 04.02.2026
04.02.2026
Эндопротезирование в лечении первичных опухолей костей
Обобщены данные отечественных и зарубежных исследований, посвящённых эндопротезной реконструкции при остеосаркоме, саркоме Юинга, хондросаркоме и гигантоклеточной опухоли
Введение.
Первичные злокачественные опухоли костей относятся к редким онкологическим заболеваниям, однако характеризуются высокой клинической значимостью вследствие агрессивного локального роста, поражения преимущественно пациентов молодого возраста и высокого риска утраты функции конечности [3,14,17]. Несмотря на относительно низкую распространённость, данная группа новообразований занимает особое место в структуре онкологической патологии опорно-двигательного аппарата, предъявляя повышенные требования к хирургической тактике и последующей реконструкции [10]. Современное лечение первичных опухолей костей основано на мультидисциплинарном подходе, включающем системную противоопухолевую терапию и хирургическое вмешательство как основной метод локального контроля заболевания [3,14].
Определяющим онкологическим принципом хирургического этапа является достижение радикальной резекции с отрицательными краями (R0), поскольку именно полнота удаления опухоли в наибольшей степени влияет на отдалённые онкологические результаты и определяет допустимость применения органосохраняющих вмешательств [3,14,31].
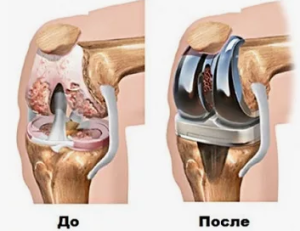
В этой связи эндопротезирование в онкоортопедии следует рассматривать не как самостоятельный метод лечения, а как реконструктивный этап, реализуемый исключительно после онкологически обоснованной резекции и направленный на восстановление опорной и двигательной функции без компромисса в отношении радикальности вмешательства [10,17,22].
Исторически хирургическое лечение опухолей костей основывалось на калечащих операциях, обеспечивавших локальный контроль ценой тяжёлой функциональной утраты [22].
Развитие химиотерапии, совершенствование методов лучевой диагностики и прогресс реконструктивной ортопедии привели к формированию концепции органосохраняющего лечения (limb salvage surgery), которое в настоящее время рассматривается как стандарт при условии соблюдения онкологической безопасности [14,17].
Эндопротезирование крупных сегментов костей и суставов стало одним из наиболее распространённых методов реконструкции после протяжённых околосуставных и сегментарных резекций, обеспечивая возможность ранней функциональной активизации пациентов
Одновременно с расширением показаний к органосохраняющим операциям и увеличением продолжительности жизни пациентов закономерно возросло абсолютное число осложнений онкологического эндопротезирования и ревизионных вмешательств [25,28,35-37,41].
Инфекционные осложнения, асептическая нестабильность, механические повреждения компонентов эндопротеза, вывихи и перипротезные переломы оказывают непосредственное влияние на функциональные исходы, эффективность реабилитации и качество жизни пациентов, а в ряде случаев приводят к утрате сохранённой конечности
Таким образом, в современной онкоортопедии сформировалось принципиальное противоречие между стремлением к максимальному сохранению функции и необходимостью минимизации риска осложнений и повторных операций.
В последние годы особое внимание уделяется персонифицированному подходу к реконструкции, включающему учёт анатомической локализации опухоли, объёма резекции, возраста пациента, состояния костномозгового канала и прогнозируемой выживаемости при выборе типа эндопротеза и способа его фиксации [6,18-21,38]. Это приобретает особое значение при сложных анатомических локализациях (таз, крестец), у пациентов детского возраста и при ожидаемой длительной эксплуатации имплантата [4,13,18-21,34].
Цель настоящего обзора — систематизировать современные данные о роли эндопротезирования в лечении первичных злокачественных опухолей костей, проанализировать принципы выбора эндопротезных конструкций, охарактеризовать основные осложнения и подходы к их лечению, а также оценить функциональные результаты, качество жизни и современные направления реабилитации пациентов после онкологического эндопротезирования.
Объектом анализа являются первичные злокачественные опухоли костей, предметом — эндопротезирование как метод реконструкции после радикальной резекции.
Данные по метастатическому поражению костей используются ограниченно и исключительно в целях дифференциального анализа показаний и исходов лечения [1,15,23].
Работа выполнена в формате нарративного обзорного исследования с аналитическим синтезом и ориентирована на клиническую интерпретацию данных; систематический анализ и метаанализ не проводились ввиду гетерогенности нозологий, локализаций и дизайна исследований.
В обзор включены публикации, посвящённые эндопротезированию при первичных злокачественных опухолях костей [3,10,14,16,17], показаниям, типам имплантатов и методам фиксации [6,16,18-21,26,38-40], результатам лечения, осложнениям, ревизиям, функциональным исходам и качеству жизни [2,5,28,30,35-37,41], а также клинической значимости анатомической локализации и детскому возрасту [4,8,9,13,18-21,33-36].Исключались работы, посвящённые исключительно паллиативному лечению метастатических поражений и единичные наблюдения, за исключением иллюстраций редких реконструктивных решений [7,24,34].
Данные по метастатическому поражению костей использовались ограниченно для разграничения целей лечения и функциональных исходов [1,15,23]. Синтез материала выполнен по направлениям: онкологические принципы хирургии и роль эндопротезирования [3,14,17,22], выбор конструкций [6,16,18-21,26,34-36,38-40], осложнения и ревизионная хирургия [25,28,30,41], функциональные результаты и реабилитация [2,5]. Выводы сформулированы с приоритетом клинической значимости и оптимизации реконструктивной тактики при сохранении онкологической радикальности [3,10,14,17,28,30,40,41].
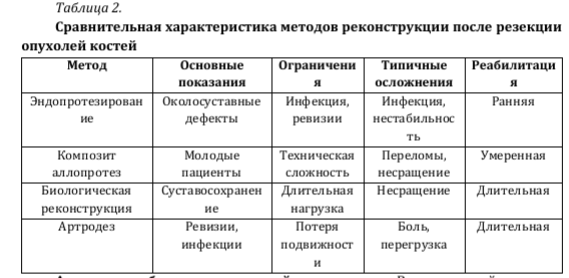
В современной онкоортопедии основными показаниями к эндопротезированию являются первичные злокачественные опухоли костей, преимущественно поражающие метаэпифизарные отделы длинных трубчатых костей и нередко вовлекающие суставные поверхности. К наиболее значимым нозологиям относятся остеосаркома, саркома Юинга и хондросаркома, что подтверждено клиническими рекомендациями и крупными сериями наблюдений [Валиев и соавт., 2022; Феденко и соавт., 2021; Blasius и соавт., 2022] [3,14,17].
Остеосаркома чаще всего локализуется в области коленного сустава, при этом поражение дистального отдела бедренной и проксимального отдела большеберцовой кости, как правило, требует околосуставной резекции с последующей эндопротезной реконструкцией [Петров и соавт., 2012; Микайлов и соавт., 2024] [10,9].
При саркоме Юинга при околосуставной локализации и адекватном ответе на неоадъювантную терапию эндопротезирование позволяет сохранить конечность без ухудшения онкологических результатов [Феденко и соавт., 2021; Abu El Afieh и соавт., 2019] [14,16]. При высокозлокачественных формах хондросаркомы и резекции суставного конца кости эндопротезирование рассматривается как метод выбора реконструкции [Валиев и соавт., 2022] [3].
Наибольшая частота онкологических эндопротезирований приходится на область коленного сустава, что обусловлено как распространённостью остеосаркомы данной локализации, так и ограниченными возможностями суставосохраняющих вмешательств [Микайлов и соавт., 2024; Микайлов и соавт., 2025; Topkar и соавт., 2021] [8,9,40]. Значимая доля реконструкций выполняется также в проксимальном отделе плечевой кости, где эндопротезирование позволяет сохранить функцию верхней конечности даже при обширных резекциях [Елхов и соавт., 2018; Петров и соавт., 2012] [5,10]. Опухоли костей таза и крестца характеризуются высокой технической сложностью вмешательств, необходимостью индивидуальных имплантатов и повышенным риском осложнений [Гафтон и соавт., 2023; Sofronov и соавт., 2015; Sushentsov и соавт., 2017] [4,33,38].
Объём резекции и выбор реконструкции определяются распространённостью опухолевого процесса, вовлечением суставной поверхности, мягкотканного компонента и сосудисто - нервных структур. Вовлечение суставного конца кости, как правило, исключает возможность сохранения нативного сустава и предопределяет необходимость эндопротезной реконструкции [Валиев и соавт., 2022; Феденко и соавт., 2021; Петров и соавт., 2012; Blasius и соавт., 2022] [3,14,10,17]. Гигантоклеточная опухоль кости рассматривается как особая нозология, при которой эндопротезирование показано лишь при массивном разрушении суставного конца, рецидивирующем течении или невозможности сохранения сустава, включая случаи после терапии деносумабом [Микайлов и соавт., 2024; Mikailov и соавт., 2024] [8,29].
Хирургическое лечение первичных опухолей костей основано на выполнении онкологически адекватной резекции с отрицательными краями, объём которой определяется исключительно распространённостью опухоли и не подлежит изменению в интересах реконструкции [Валиев и соавт., 3; Феденко и соавт., 14]. Эндопротезирование в данной концепции рассматривается как вторичный этап, направленный на восстановление дефекта после радикального удаления опухоли. Отбор пациентов для organ-preserving лечения с эндопротезированием базируется на возможности достижения R0-резекции, удовлетворительном соматическом статусе и ожидаемой функциональной пользе вмешательства [Blasius и соавт., 2022; Topkar и соавт., 2021] [17,40]. В детской практике дополнительно учитываются перспективы роста и возможность применения расширяемых эндопротезов [Dukan и соавт., 2022; El Ghoneimy и соавт., 2022] [19,20].
Предоперационное планирование основывается на данных МРТ и КТ, а при анатомически сложных локализациях включает 3D-планирование и использование индивидуальных имплантатов [Sushentsov и соавт., 2017; Гафтон и соавт., 2023] [38,4]. Эндопротезирование обеспечивает наиболее предсказуемые функциональные результаты и раннюю нагрузку, однако сопряжено с риском инфекционных и механических осложнений [10,26,40], тогда как биологические методы реконструкции применимы ограниченно и характеризуются более длительной реабилитацией и риском несращения [26,39]. Алгоритм выбора эндопротезной конструкции. В клинической практике выбор эндопротезной конструкции при первичных опухолях костей определяется совокупной оценкой онкологической радикальности резекции и ожидаемых функционально-механических результатов.
Ключевым исходным принципом является приоритет онкологически адекватного объёма резекции, который не может быть изменён в интересах реконструкции, что подчёркивается в клинических рекомендациях Валиева и соавт. [3] и Феденко и соавт. [14].
Определяющим фактором выбора конструкции остаётся анатомическая локализация опухоли.
При околосуставных резекциях в области коленного и плечевого суставов наибольшее распространение получили модульные эндопротезные системы [Петров и соавт., 2012; Topkar и соавт., 2021] [10,40]. При поражении костей таза и крестца стандартные системы, как правило, неприменимы, что требует использования индивидуальных конструкций [Гафтон и соавт., 2023; Sushentsov и соавт., 2017] [4,38]. Возраст пациента и состояние скелетного роста имеют принципиальное значение. У детей и подростков с незавершённым ростом предпочтение отдаётся раздвижным эндопротезам для профилактики выраженной разницы длины конечностей [Dukan и соавт., 2022; Ghoneimy и соавт., 2022] [19,20], тогда как у взрослых пациентов приоритет смещается в сторону механической надёжности и ревизионной доступности. Тип дефекта и протяжённость резекции также определяют выбор конструкции.
При сегментарных диафизарных резекциях с сохранением суставных поверхностей оправдано применение межкалярных эндопротезов [Sushentsov и соавт., 2014; Sokolovskii и соавт., 2025] [39,36], тогда как при разрушении суставного конца предпочтение отдают суставозамещающим системам. Выбор метода фиксации зависит от состояния костномозгового канала и качества костной ткани. Цементная фиксация обеспечивает более надёжную первичную стабильность при неблагоприятном прогнозе и сниженной плотности кости, в то время как бесцементная фиксация оправдана у пациентов с ожидаемой длительной выживаемостью [Groundland и соавт., 21; Zan и соавт., 41].
Заключительным этапом является оценка прогноза выживаемости и риска осложнений. При высокой вероятности ревизионных вмешательств предпочтение следует отдавать модульным системам, обеспечивающим техническую воспроизводимость повторных операций [Sokolovskii и соавт., 2023; Mikailov и соавт., 2025] [35,28]. Сводная характеристика типов эндопротезов с позиций клинического выбора приведена в табл. 3.
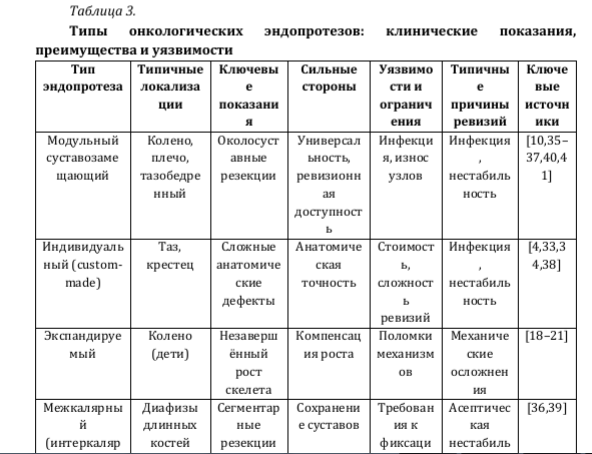
Таблица обобщает данные клинических рекомендаций и многоцентровых серий; представленные характеристики отражают наиболее типичные клинические сценарии.
Осложнения онкологического эндопротезирования: системный анализ.
Осложнения онкологического эндопротезирования следует рассматривать как совокупность клинических и онкологических факторов, определяющих долговечность реконструкции и функциональный исход лечения. В клинических исследованиях для унификации анализа осложнений широко применяются классификационные подходы, предложенные в рамках ISOLS и использующие категориальное деление причин неудач эндопротезов, что отражено в ряде современных серий наблюдений [Miwa и соавт., 2022; Zan и соавт., 2022] [30,41].
Систематизированная характеристика основных типов осложнений, клинических проявлений и лечебной тактики приведена в табл. 4.
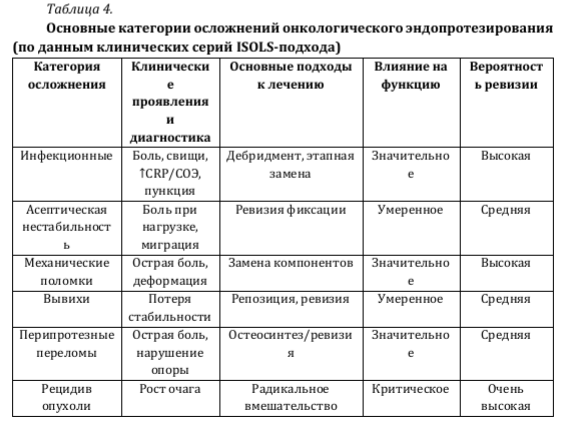
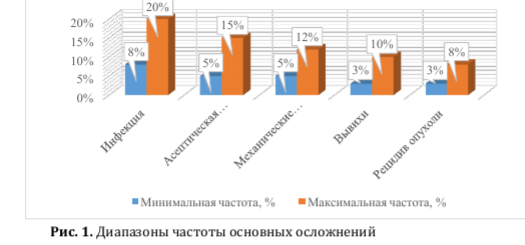
Как видно на рис. 2, по данным клинических серий реконструкции в области коленного сустава характеризуются несколько более высокой выживаемостью имплантатов по сравнению с другими локализациями, что, вероятно, связано с лучшей стандартизацией резекций и реконструктивных решений [35-37,40,41].
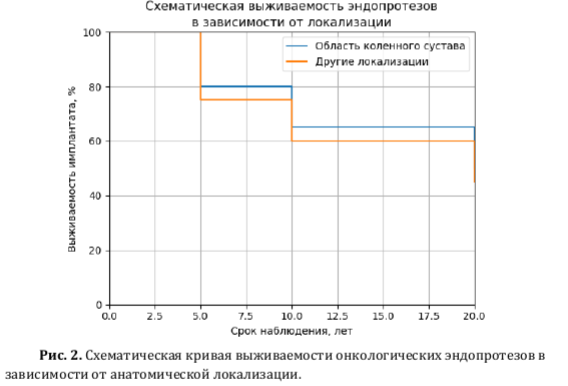
Функциональные результаты и качество жизни после онкологического эндопротезирования: роль осложнений и локализации. Функциональные результаты и показатели качества жизни после онкологического эндопротезирования в наибольшей степени определяются анатомической локализацией реконструкции и развитием послеоперационных осложнений. Даже при технически корректной резекции осложнения способны существенно ухудшать долгосрочный функциональный прогноз, что требует оценки функциональных исходов в неразрывной связи с частотой ревизионных вмешательств [Sokolovskii и соавт., 2023; Mikailov и соавт., 2025] [35,28]. Основным инструментом функциональной оценки остаётся шкала MSTS, отражающая болевой синдром, активность и способность к самообслуживанию, однако её чувствительность к параметрам качества жизни ограничена, что обусловливает дополнительное применение опросников общего профиля (SF-36 и аналогичных) при затруднённой стандартизации сопоставлений [Sergeev и соавт., 2017; Topkar и соавт., 2021; Елхов и соавт., 2024] [32,40,5]. Наиболее выраженное и стойкое снижение функции ассоциировано с инфекционными осложнениями и многоэтапными ревизиями, при которых даже после санации инфекционного очага функциональные показатели нередко не достигают исходного уровня [Mikailov и соавт., 2025; Miwa и соавт., 2022; Sokolovskii и соавт., 2023; Zan и соавт., 2022] [28,30,35,41]. Асептическая нестабильность, механические поломки и вывихи также ухудшают функциональный результат, однако при своевременной коррекции возможна частичная компенсация утраченной функции [Groundland и соавт., 2022] [21].
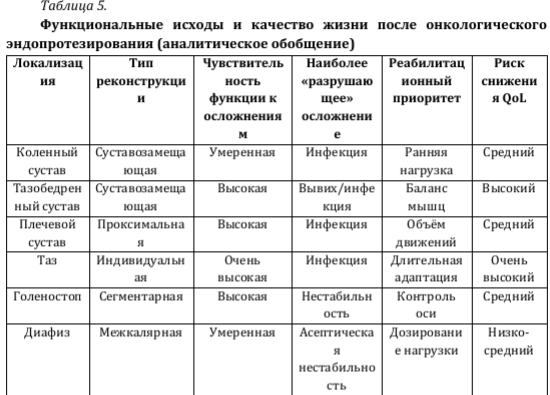
Наиболее предсказуемые функциональные исходы достигаются после эндопротезирования коленного сустава, тогда как реконструкции проксимального отдела бедренной и плечевой кости характеризуются ограничениями активности, а тазовые и сакральные вмешательства — наименее благоприятными показателями качества жизни [Микайлов и соавт., 2024; Topkar и соавт., 2021; Елхов и соавт., 2024; Гафтон и соавт., 2023; Sofronov и соавт., 2015] [8,40,5,4,33]. Исходы при диафизарных и голеностопных реконструкциях отличаются высокой вариабельностью и зависят от стабильности фиксации и отсутствия осложнений [Sokolovskii и соавт., 2023; Sokolovskii и соавт., 2025] [35,36].
Реабилитация после онкологического эндопротезирования носит этапный и нестабильный характер и наиболее эффективна при неосложнённом течении послеоперационного периода, тогда как развитие инфекции или нестабильности приводит к удлинению сроков восстановления и ухудшению функционального прогноза [Бухаров и соавт., 2022; Елхов и соавт., 2024] [2,5].
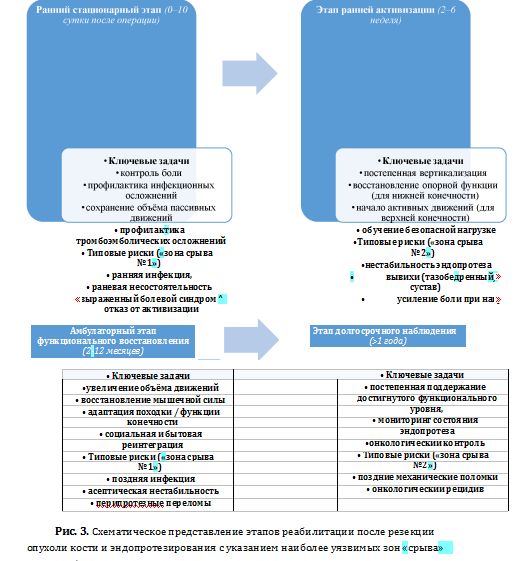
Обобщение данных литературы позволяет выделить ограниченный круг факторов, оказывающих решающее влияние на функциональный исход эндопротезирования: отсутствие инфекционных осложнений, минимальное число ревизионных вмешательств, раннее начало реабилитации и выполнение реконструкции в анатомически благоприятных зонах.
Остальные факторы, включая тип протеза и метод фиксации, играют вторичную роль и реализуют своё значение через влияние на частоту осложнений [35-37,40].
Особые клинические зоны.
Тазовые и сакральные резекции относятся к наиболее травматичным вмешательствам в онкоортопедии и сопровождаются высоким риском осложнений и стойким снижением качества жизни.
Даже при использовании индивидуальных имплантатов функциональные ограничения сохраняются, включая утрату способности к длительному сидению и нарушения тазовых функций [Гафтон и соавт., 2023; Sofronov и соавт., 2015; Sofronov и соавт., 2025] [4,33,34]. В детской практике применение расширяемых эндопротезов позволяет контролировать разницу длины конечностей, однако долгосрочный функциональный и психосоциальный исход в значительной степени определяется частотой осложнений и ревизионных вмешательств [Dukan и соавт., 2022; El Ghoneimy и соавт., 2022] [19,20]. Коленный сустав остаётся ведущей локализацией онкологического эндопротезирования, где стандартизация хирургических и реабилитационных алгоритмов обеспечивает наиболее предсказуемые функциональные результаты при отсутствии инфекционных осложнений [Микайлов и соавт., 2024; Sokolovskii и соавт., 2023] [8,35].
Современные тенденции и перспективы онкологического эндопротезирования: клинический фокус. Современное развитие онкологического эндопротезирования определяется необходимостью снижения частоты осложнений и повышения предсказуемости функциональных результатов, поскольку именно инфекционные и механические неудачи, а также ревизионные вмешательства продолжают определять качество жизни пациентов после органосохраняющих операций [28,30,35-37]. Персонализированные реконструкции и индивидуальные имплантаты повышают точность резекции и условия фиксации, прежде всего при резекциях костей таза и крестца, где стандартные системы малоэффективны [4,34,38], тогда как при типичных околосуставных резекциях длинных костей, особенно коленного сустава, их преимущества остаются ограниченными и уступают значению отсутствия осложнений и качества реабилитации [35-37]. При этом персонализация не снижает риск инфекции и может увеличивать травматичность вмешательства, что требует строгого отбора пациентов и выполнения операций в специализированных центрах.
Инфекционные осложнения остаются ведущей причиной утраты реконструкции, при этом наибольшее значение имеют организационные и хирургические меры профилактики, а не локальные антибактериальные технологии с ограниченной доказательной базой [28,30]. Механические осложнения и асептическая нестабильность сохраняют клиническую значимость у пациентов с длительной ожидаемой выживаемостью, особенно при коленных и диафизарных реконструкциях [21,35-37,41], тогда как для плечевых и тазовых эндопротезов решающую роль играют нестабильность и мышечный дисбаланс. Отсутствие национальных и международных регистров онкологического эндопротезирования ограничивает объективную оценку эффективности конструкций и тактики лечения осложнений, подчёркивая необходимость стандартизации критериев и накопления сопоставимых данных [35-37].
ЗАКЛЮЧЕНИЕ.
Эндопротезирование является основным методом реконструкции после радикальной резекции при первичных опухолях костей и ключевым инструментом реализации органосохраняющего подхода. Применение эндопротезной реконструкции возможно только при строгом соблюдении принципов онкологической радикальности, поскольку компромисс в объёме резекции неизбежно приводит к ухудшению онкологических результатов и утрате преимуществ реконструкции. Основными ограничивающими факторами метода остаются инфекционные и механические осложнения, а также необходимость ревизионных вмешательств, каждое из которых непропорционально ухудшает функциональный прогноз и качество жизни пациента. Функциональный результат после онкологического эндопротезирования определяется в первую очередь развитием осложнений и анатомической локализацией реконструкции, тогда как тип эндопротезной конструкции имеет вторичное значение. Дальнейшее улучшение результатов лечения возможно при условии концентрации сложных реконструкций в специализированных центрах, персонализированного подхода в обоснованных клинических ситуациях и развития регистровых исследований, направленных на стандартизацию оценки осложнений и функциональных исходов.
ЛитератураБухаров, А. В., Ерин, Д. А., Державин, В. А., & Ядрина, А. В. (2022). Вопросы диагностики и лечения метастазов в позвоночник и длинные кости. Сибирский онкологический журнал, 21(2), 96-108.
Бухаров, А. В., Филоненко, Е. В., Ерин, Д. А., Державин, В. А., Ядрина, А. В., Шаталов, А. М., ... & Алиев, М. Д. (2022). Особенности ранней реабилитации онкологических пациентов после резекции длинных костей нижней конечности с эндопротезированием. Сибирский онкологический журнал, 21(5), 142-148.
Валиев, А. К., Тепляков, В. В., Мусаев, Э. Р., Рогожин, Д. В., Сушенцов, Е. А., Мачак, Г. Н., ... & Федосеенко, Д. И. (2022). Практические рекомендации по лечению первичных злокачественных опухолей костей. Злокачественные опухоли, 12(3S2- 1), 307-329.
Гафтон, Г. И., Гудзь, Ю. В., Зиновьев, Г. В., Эберт, М. А., Гафтон, И. Г., & Синячкин, М. С. (2023). Эндопротезирование тазового кольца при опухолевом поражении: опыт ФГБУ «НМИЦ онкологии им. НН Петрова». Вопросы онкологии, 6 9(3S), 393394.
Елхов, Д. О., Бухаров, А. В., Ерин, Д. А., Державин, В. А., Филоненко, Е. В., Алиев, М. Д., & Каприн, А. Д. (2024). Реабилитация и качество жизни пациентов после онкологического эндопротезирования костей верхней конечности. Сибирский онкологический журнал, 23(3), 15-31.
Жеравин, А. А., Соловьев, В. Ю., Красовский, И. Б., & Панченко, А. А. (2022). Перспективы Развития Индивидуального Эндопротезирования В Онкоортопедии. Вопросы онкологии, 68(S3), 419-420.
Карпенко, В. Ю., Карасев, А. Л., Колондаев, А. Ф., Антонов, К. А., & Любезнов, Н. А. (2022). Субтотальная проксимальная резекция и замещение дефекта большеберцовой кости эндопротезом с индивидуальным коротким дистальным компонентом (клиническое наблюдение). Гений ортопедии, 28(2), 261-267.
Микайлов, И. М., Пташников, Д. А., Григорьев, П. В., & Кизина, А. А. (2024). Ретроспективный анализ хирургического лечения пациентов с ГКО костей области коленного сустава. Вестник Российского научного центра рентгенорадиологии Минздрава России, 24(3), 58-70.
Микайлов, И. М., Тихилов, Р. М., & Григорьев, П. В. (2025). Оценка эффективности первичного онкологического эндопротезирования коленного сустава при опухолевом поражении дистального отдела бедренной кости. Травматология и ортопедия России, 31(1), 5-19.
Петров В.Г., Гафтон Г.И., Семиглазов В.В., Тришкин В.А., Гудзь Ю.В., Иванова Тв., & Гафтон И.Г. (2012). Эффективность эндопротезирования при злокачественных опухолях конечностей. Вопросы онкологии, 58 (6), 727-735.
Полатова, Д. Ш., Абдусатторов, О. К., Давлетов, Р. Р., Нуржабов, А. И., Асамединов, Н. К., & Насиров, С. К. (2024). Модифицированный подход к определению опции лечения при метастатическом поражении костей.
Пысанова, Ж. У., Серикбаев, Г. А., Тулеуова, Д. А., Курманалиев, А. Ф. К., & Елекбаев, А. М. (2023). Анализ лечения опухолей костей скелета в Казахстане. Вопросы онкологии, 69(3S), 394-395.
Савлаев, К. Ф., Петриченко, А. В., Букреева, Е. А., Шавырин, И. А., Шароев, Т. А., & Иванова, Н. М. (2022). ОРГАНОСОХРАНЯЮЩЕЕ ЛЕЧЕНИЕ ОПУХОЛЕЙ КОСТЕЙ У ДЕТЕЙ. Вопросы онкологии, 68(S3), 289-290.
Феденко, А. А., Бохян, А. Ю., Горбунова, В. А., Махсон, А. Н., & Тепляков, В. В. (2021). Практические рекомендации по лечению первичных злокачественных опухолей костей (остеосаркомы, саркомы юинга) рекомендации восточноевропейской группы по изучению сарком. Злокачественные опухоли, 11(3S2-1), 264-276.
Хирургическое лечение при метастатическом поражении костей / А.В. Бухаров, М.Д. Алиев, В.А. Державин, А.В. Ядрина, Д.А. Ерин // Национальное руководство по паллиативной медицинской помощи в онкологии / Г.Р. Абузарова ; под ред. академика РАН, профессора А.Д. Каприна. — Москва : Молодая гвардия, 2022. — С. 108—136.
Abu El Afieh, J., Gray, M., Seah, M., & Khan, W. (2022). Endoprosthetic Reconstruction in Ewing's Sarcoma Patients: A Systematic Review of Postoperative Complications and Functional Outcomes. Journal of clinical medicine, 11(15)
Blasius, F., Delbruck, H., Hildebrand, F., & Hofmann, U. K. (2022). Surgical Treatment of Bone Sarcoma. Cancers, 14(11), 2694
Bolshakov N.A., Vorochay A.M., Konopleva E.I., Artyomov A.Yu., Bykova A.V., Bydanov O.I., Grachev N.S. Distal tibia resection with endoprosthetic reconstruction in pediatric and adolescent patients with bone sarcomas. Bone and soft tissue sarcomas, tumors of the skin. 2025;17(2):35-46. (In Russ.)
Dukan, R., Mascard, E., Langlais, T., Ouchrif, Y., Glorion, C., Pannier, S., & Bouthors, C. (2022). Long-term outcomes of non-invasive expandable endoprostheses for primary malignant tumors around the knee in skeletally-immature patients. Archives of orthopaedic and trauma surgery, 142(6), 927-936
El Ghoneimy, A. M., Shehab, A. M., & Farid, N. (2022). What is the Cumulative Incidence of Revision Surgery and What Are the Complications Associated With Stemmed Cementless Nonextendable Endoprostheses in Patients 18 Years or Younger With Primary Bone Sarcomas About the Knee. Clinical orthopaedics and related research, 480(7), 1329-1338
Groundland, J., Brown, J. M., Monument, M., Bernthal, N., Jones, K. B., & Randall, R. L.(2022). What Are the Long-term Surgical Outcomes of Compressive Endoprosthetic Osseointegration of the Femur with a Minimum 10-year Follow-up Period Clinical orthopaedics and related research, 480(3), 539-548.
Hwang, J.S., Mehta, A.D., Yoon, R.S. et al. From amputation to limb salvage reconstruction: evolution and role of the endoprosthesis in musculoskeletal oncology. J Orthopaed Traumatol 15, 81-86 (2014)
Kendal, J. K., Hamad, C. D., Abbott, A. G., Greig, D., Trikha, R., Christ, A. B., Wessel, L. E., Puloski, S. K. T., Monument, M. J., & Bernthal, N. M. (2023). What are the indications and survivorship of tumor endoprosthetic reconstructions for patients with extremity metastatic bone disease?. Journal of surgical oncology, 127(7), 1196-1202.
Kurilchik A.A., Starodubtsev A.L., Zubarev A.L., Ivanov V.E., Kudryavtsev D.V. Endoprosthetic replacement of the second metacarpal bone in well-differentiated chondrosarcoma. A clinical case report. Bone and soft tissue sarcomas, tumors of the skin. 2019;11(3):53-56.
Kurilchik A.A., Starodubtsev A.L., Zubarev A.L., Ivanov V.E., Kudryavtsev D.V. Endoprosthesis revision in cancer patients. MRRC experience. Bone and soft tissue sarcomas, tumors of the skin. 2019;11(3):35-41.
Li, Y., Xu, H., Shan, H., Ma, K., Liu, W., & Niu, X. (2023). A comparative study of reconstruction modalities after knee ioint-preserving tumor resection: reconstruction with a custom-made endoprosthesis versus reconstruction with a liquid nitrogen- inactivated autologous bone graft. Journal of orthopaedic surgery and research, 18(1), 908
McMahon, K. M., Eaton, V. P., Srikanth, K. K., Tupper, C. J., Merwin, M. J., Morris, M. W., Silberstein, P. J., & McKillip, K. (2023). Survey of Palliative Care Use in Primary Malignant Bone Tumors: A National Cancer Database Review. Journal of palliative medicine, 26(8), 1139-1146
Mikailov I.M., Grigoriev P.V. Experience of using neoadjuvant three- componeEvaluation of the effectiveness of revision oncological knee replacement performed for infection. Bone and soft tissue sarcomas, tumors of the skin. 2025;17(1):40-48. (In Russ.)
Mikailov I.M., Ptashnikov D.A., Grigoriev P.V., Kizina A.A., Magomedova A.A. Effectiveness of the Use of Denosumab When Performing Intralesional Surgery in Patients with Gigant Cell Tumors of the Bones of the Knee Joint. Bone and soft tissue sarcomas, tumors of the skin. 2024;16(2):39-48. (In Russ.)
Miwa, S., Yamamoto, N., Hayashi, K., Takeuchi, A., Igarashi, K., & Tsuchiya, H. (2022). Surgical Site Infection after Bone Tumor Surgery: Risk Factors and New Preventive Techniques. Cancers, 14(18), 4527
Petrochenko N.S., Sokolovsky A.V., Sokolovsky V.A., Gribkova E.I., Spirina O.G., Fedorova A.V., Valiev A.K. Role of radical surgical treatment in patients with soft tissue sarcomas invading bone. Bone and soft tissue sarcomas, tumors of the skin. 2024;16(4):80-88. (In Russ.)
Sergeev P.S., Teplyakov V.V., Shaposhnikov V.A., Lazukin A.V., Akhov A.O. Joint replacement in patients with bone tumors: a modern view. Bone and soft tissue sarcomas, tumors of the skin. 2017;(1):12-19. (In Russ.)
Sofronov D., Musaev E., Sushentsov E., Shcipakhin S. The surgical treatment pelvic bone tumors. Literature review. Bone and soft tissue sarcomas, tumors of the skin. 2015;(3):34-39.
Sofronov D.I., Magomedova K.N., Efimenko O., Borzov K.A., Fedorova A.V., Kabardaev R.M., Galustov A.M., Shin A.R., Sytov A.V., Valiev A.K. The first experience of total sacral endoprothesis with an individual implant after total sacrectomy (a rare clinical case). Bone and soft tissue sarcomas, tumors of the skin. 2025;17(1):91-98. (In Russ.)
Sokolovskii A.V., Kurilchik A.A., Ivanov V.E., Sokolovskii V.A., Zavalishina M.K. Longterm results of oncological endoprosthetics of the ankle joint: multicenter study. Bone and soft tissue sarcomas, tumors of the skin. 2023;15(4):40-51. (In Russ.)
Sokolovskii A.V., Kurilchik A.A., Zheravin A.A., Sokolovskii V.A., Khanina M.K. Longterm results of oncological endoprosthetics of the diaphyseal bone: multicenter study. Bone and soft tissue sarcomas, tumors of the skin. 2025;17(1):11-24. (In Russ.)
Sokolovskii V.A., Sokolovskii A.V., Tararykova A.A., Fedorova A.V., Bludov A.B. Longterm oncological results of patients with primary and metastatic tumors of the musculoskeletal system who underwent arthroplasty. Bone and soft tissue sarcomas, tumors of the skin. 2022;14(4):33-44. (In Russ.)
Sushentsov E.A., Musaev E.R., Sofronov D.I., Fedorova A.V., Stepanova A.M., Efimenko O.S., Dzhenzhera G.E., Aliev M.D. Custom-made endoprosthetics based on 3D-technology after resection of pelvic bones. Bone and soft tissue sarcomas, tumors of the skin. 2017;(3):14-20.
Sushentsov E.A., Sokolovsky V.A., Kabardaev R.M., Dzampaev A.Z., Kubirov M.S., Nikolaev A.P. Intercalary diaphyseal endoprosthetic reconstruction for malignant bone tumors. Bone and soft tissue sarcomas, tumors of the skin. 2014;(3-4):20-25.
Topkar, O. M., Sofulu, 0., $irin, E., & Erol, B. (2021). Limb salvage surgery of primary and metastatic bone tumors of the lower extremity: Functional outcomes and survivorship of modular endoprosthetic reconstruction. Acta orthopaedica et traumatologica turcica, 55(2), 147-153
Zan, P., Wang, H., Cai, Z., Shen, J., & Sun, W. (2022). Revision surgeries for tumor endoprostheses around the knee joint: a mid-long-term follow-up of 20 cases. World journal of surgical oncology, 20(1), 76
Теги: эндопротезирование
234567 Начало активности (дата): 04.02.2026
234567 Кем создан (ID): 989
234567 Ключевые слова: эндопротезирование, опухоли, первичные опухоли костей, онкоортопедия, органосохраняющее лечение, эндопротезная реконструкция, осложнения и ревизионные вмешательства
12354567899
Похожие статьи
Эндопротезирование в лечении первичных опухолей костейРентген на дому 8 495 22 555 6 8
Ревизионное эндопротезирование тазобедренного сустава - что нас ждет?
Первичное и ревизионное эндопротезирование тазобедренного сустава с восполнением дефектов вертлужной впадины
Эндопротезирование проксимального межфалангового сустава кисти: современное состояние проблемы



