 02.11.2024
02.11.2024
Эндопротезирование проксимального межфалангового сустава кисти: современное состояние проблемы
Основными проблемами при эндопротезировании ПМФС являются выбор имплантата и оптимального оперативного доступа с учетом сложной анатомии и биомеханики сустава
ВВЕДЕНИЕ
Проблема лечения остеоартрита проксимального межфалангового сустава (ПМФС) обусловлена низкой частотой распространения заболевания наряду с его высокой медико-социальной значимостью (существенное ограничение двигательных функций пальцев кисти, приводящее к снижению качества жизни); недостаточным уровнем освещаемости проблемы ввиду недостаточного клинического опыта и дефицита высококвалифицированных специалистов в этой области; непрерывной сменой линеек имплантатов ПМФС на медицинском рынке. Все это ограничивает возможности сравнения клинической эффективности эндопротезирования ПМФС, проведения многоцентровых исследований его результатов, в том числе на отдаленных сроках наблюдения.
Проксимальный межфаланговый сустав (ПМФС) играет важную роль в обеспечении оптимальной ловкости пальцев, силы хвата и общей функциональности кисти [1].
Остеоартрит ПМФС встречается относительно часто, с распространенностью 18 % при рентгенологической оценке [2], и поражает в основном женщин в возрасте от 60 до 79 лет, однако и мужчины, и женщины страдают одинаково часто в возрасте от 80 до 89 лет. На основании рентгенографии (R) и фотографий (P) распространенность остеоартрита проксимального межфалангового сустава кисти (R — 18 %; P — 6 %) ниже, чем в дистальном межфаланговом (DIP) суставе (R — 35 %; P — 24 %) или запястно-пястном (CMC) суставе (R — 21 %; P — 8 %) [2, 3]. Зарубежные коллеги сообщают, что межфаланговые суставы доминирующей руки демонстрируют более высокую распространенность остеоартрита, чем в недоминантной руке [4]. Дегенеративные изменения в данном суставе чаще всего являются следствием идиопатического остеоартрита (до 60 %), посттравматического артрита (последствия внутрисуставных переломов, повреждений связок) (до 25 %), системных воспалительных заболеваний (наиболее часто — ревматоидный артрит — до 15 %), а также наблюдаются при опухолевых поражениях (энхондрома, хондросаркома) [5]. Остеоартрит проксимального межфалангового сустава пальца (как первичный, так и вторичный) может вызывать боль с сопутствующим ограничением диапазона движений, что часто приводит к глобальному ухудшению функции кисти [6]. На ПМФС приходится примерно 85 % движений, необходимых для функционального хвата [7].
До сих пор не удается восстановить полный объем движений в данном суставе, несмотря на успехи коллег в эндопротезировании крупных суставов. Консервативное лечение остеоартрита ПМФС может уменьшить такие симптомы как боль, отек, скованность, а также снижение силы хвата на ранних стадиях. Однако при прогрессировании симптомов заболевания показано хирургическое вмешательство [8].
Вторичный остеоартроз чаще всего обусловлен посттравматическими изменениями, за которыми следуют хронические нестабильные воспалительные заболевания. Будучи блоковидным суставом, он чрезвычайно стабилен в сагиттальной плоскости, но имеет ограниченную толерантность к угловым, осевым и вращательным нагрузкам. Таким образом, ПМФС является одним из наиболее подверженных травмам суставом. Уязвимость ПМФС связана с его незащищенным положением в пальце и длинным моментным плечом. Из потенциальных травм руки травмы ПМФС довольно распространены среди населения в целом и особенно выражены у спортсменов [9, 10].
По данным научной литературы, основными оперативными методами лечения пациентов с деформирующим артрозом ПМФС сустава III стадии являются артродез и тотальное эндопротезирование. Идеальная цель лечения терминальной стадии остеоартроза ПМФС — безболезненное восстановление достаточной подвижности и стабильности.
Указательный и средний пальцы являются зажимающими партнерами большого пальца, а четвертому пальцу и мизинцу необходима подвижность, чтобы схватывать более крупные предметы. При выборе правильного метода лечения проблем ПМФС необходимо учитывать степень нестабильности и деформации [11, 12].
Целью всех этих методов лечения является уменьшение боли, что приводит к улучшению общей функции кисти. Артродез остается основным методом спасения при терминальной стадии артрита ПМФС и особенно полезен в случаях нестабильности, деформации или недостаточности костной ткани суставов, которые обычно не поддаются артропластике. Хотя при артродезе жертвуют подвижностью сустава ради достижения стабильности, часто это необходимый компромисс для оптимизации функции кисти [1].
Цель работы — на основе анализа зарубежной и отечественной медицинской литературы выявить основные проблемы эндопротезирования проксимального межфалангового сустава кисти.
МАТЕРИАЛЫ И МЕТОДЫ
В представленном обзоре литературы проведён анализ зарубежных и отечественных научных публикаций, посвящённых вопросам лечения заболеваний и повреждений ПМФС.
Поиск проведен в электронных базах данных Google Scholar, PubMed, e-LIBRARY на русском и английском языках по поисковым фразам: эндопротезирование проксимального межфалангового сустава, артродез проксимального межфалангового сустава, остеоартрит проксимального межфалангового сустава; arthroplasty of the proximal interphalangeal joint, arthrodesis of the proximal interphalangeal joint, osteoarthritis of the proximal interphalangeal joint. Глубина исследования — 37 лет.
В материал обзора вошли научные публикации по эндопротезированию, функциональной анатомии и биомеханике проксимального межфалангового сустава с 1988 по 2024 год включительно. Тезисы конференций и отчеты о клинических случаях исключены.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Проведенный анализ медицинской литературы по эндопротезированию ПМФС как одного из оперативных методов лечения пациентов с терминальными стадиями деформирующего артроза показал, что с момента его внедрения и по настоящее время предложено множество вариантов и способов его выполнения.
В определении хирургической тактики играет роль множество критериев: комплаентность, род деятельности и функциональные запросы пациента, анатомические особенности строения ПМФС и уникальная функция каждого пальца кисти. Так, для II и III пальцев более важна безболезненная стабильность для эффективного противопоставления I пальцу, в то время как для IV и V пальцев — максимально возможный объем сгибания, т.к. они отвечают за силу хвата кисти. Отсюда следует, что на II и III пальцах более предпочтительны артродезирующие операции, а на IV и V пальцах — эндопротезирование. Однако достоверных и полных данных исследований на данный момент недостаточно для того, чтобы подтвердить или опровергнуть данный тезис. По сравнению с эндопротезированием неоспоримыми преимуществами артродеза являются значимое снижение болевого синдрома, вплоть до полного его отсутствия, а также при адекватной фиксации ПМФС в физиологических положениях (20-30° сгибания для II и III и 40-50° для IV и V пальцев) возможность достичь удовлетворительного цилиндрического захвата кисти. Однако при этом в значительной степени пострадают прецизионные виды хвата, точные движения и мелкая моторика, что может быть важным для представителей некоторых профессий [13, 14].
Для восстановления функции ПМФС особое значение имеет понимание его анатомо-физиологических особенностей. Различная морфология ПМФС II-V пальцев, малые размеры костей, сложная биомеханика и высокая нагрузка на кисть создают ряд проблем при эндопротезировании.
Особенности анатомии и биомеханики проксимального межфалангового сустава кисти ПМФС образован головкой основной фаланги и основанием средней фаланги пальца кисти. Головка основной фаланги имеет форму трапециевидного валика с мыщелками радиальной и локтевой асимметричной формы и межмыщелковой плоской бороздкой.
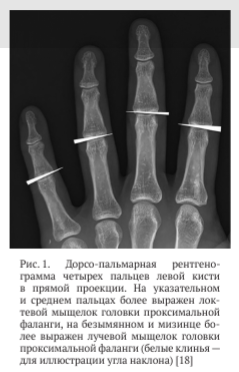
Мыщелки различаются от II к V пальцу. Во фронтальной плоскости более выражен локтевой мыщелок указательного и среднего пальцев, а на безымянном и мизинце — лучевой мыщелок (рис. 1). Соответствующая суставная лунка основания средней фаланги имеет два плоских вогнутых выступа, между которыми в тыльно-ладонном направлении проходит седловидный гребень. Основание средней фаланги несколько шире головки базальной фаланги как во фронтальной, так и в сагиттальной плоскостях [15].
Диапазон движений в ПМФС составляет 0-0-100° по нейтрально-нулевому методу. Данный сустав обеспечивает 85 % сгибательной дуги пальцев, остальные 15 % берет на себя дистальный межфаланговый сустав [16].
Долгое время ПМФС считали «простым» блоковидным соединением только с одним центром вращения в головке базового звена. Однако более точные анатомические исследования показали, что партнеры сустава — головка базальной фаланги и основание средней фаланги — не абсолютно конгруэнтны [16, 17]. Во фронтальной плоскости мыщелки головки проксимальной фаланги сочленяются с соответствующими вогнутыми выступами суставной впадины основания средней фаланги через относительно небольшие контактные поверхности, находящиеся не на вершинах мыщелков, а ближе к центру [18].
Радиус дуги суставной поверхности основания средней фаланги примерно на 30 % больше радиуса дуги мыщелка головки основной фаланги. Разница в размерах и несоответствие формы суставов-партнеров обеспечивают возможность перекатывающе-скользящих движений при сгибании и разгибании, а также боковых сгибаний и легких ротационных движений. При сжатии кулака форма суставов пальцев приводит к сложным движениям отдельных фаланг: средняя и дистальная фаланги указательного и среднего пальцев, а также средняя фаланга мизинца супинированы, средняя и дистальная фаланги безымянного пальца и дистальная фаланга мизинца пронированы [19, 20]. Выбор имплантата и используемого оперативного доступа — два наиболее часто обсуждаемых вопроса при артропластике ПМФС.
Хирургические доступы для выполнения артропластики проксимального межфалангового сустава применяются различными авторами в зависимости от возникшей клинической ситуации, или их выбор руководствуется личным опытом хирурга.
Хирургические доступы к проксимальному межфаланговому суставу
Для артропластики ПМФС описаны дорсальный, ладонный и латеральный доступы. Каждый из них обладает своими преимуществами и недостатками. Дорсальные подходы используют наиболее часто, поскольку их легче выполнить, однако при этом повреждается хрупкий разгибательный аппарат с последующим развитием отставания разгибателей [19].
Наиболее частой причиной повторных вмешательств при артропластике ПМФС является дисфункция разгибательного аппарата [21]. Это побудило хирургов изучить альтернативные ладонные и латеральные доступы к данному суставу пальца. Ладонный и латеральные доступы предлагают несколько теоретических преимуществ по сравнению с дорсальным доступом. Оба доступа дают хирургам возможность избежать разрезов на разгибательном аппарате и, следовательно, не влекут за собой длительной послеоперационной иммобилизации, что практически исключает возможность послеоперационных спаек и позволяет сразу начать реабилитацию [22].
Дорсальный хирургический доступ является наиболее широко применяемым и технически наименее требовательным по сравнению с ладонным и латеральным доступами. Он также хорош, когда необходимо одновременно исправить определенные состояния мягких тканей — такие как легкая деформация «лебединой шеи» или «бутоньерки».
Выполняют прямой или слегка изогнутый продольный разрез. Описано несколько методов доступа к суставу. A.B. Swanson et al. выступали за раскол по средней линии центрального скольжения сухожилия разгибателя [23]. Альтернативой является подход, описанный A. Chamay, при котором используют V-образный лоскут-разгибатель, обеспечивающий хороший обзор сустава и позволяющий создать длинный стабильный шов для закрытия сухожилия [24].
В своем исследовании E. Bodmer et al. сделали вывод о том, что подход с расщеплением сухожилия, как правило, приводит к лучшим результатам и связан с меньшим количеством осложнений по сравнению с подходом, описанным A. Chamay [24, 25].
В соответствии с потребностями выбранного имплантата формируют костные каналы и выполняют опилы. Для силиконовых имплантатов линию резекции планируют в соответствии с размером имплантата, при этом следует позаботиться о том, чтобы сохранить как можно большую часть коллатеральных связок. Натяжение следует выбирать так, чтобы были возможными полное сгибание и разгибание. Если есть задержка растяжения, необходим либо имплантат меньшего размера, либо большая резекция кости. При значительной деформации сустава или недостаточности коллатеральных связок необходимо наложение армирующего шва связок и/или поэтапное расслабление на сократившейся стороне. Сустав должен быть хорошо сбалансирован и при этом с возможностью полного пассивного диапазона движений. Исправить любую деформацию, не скорригированную на операционном столе, практически невозможно даже при правильном применении программы реабилитации.
Дорсальный доступ нарушает работу разгибательного аппарата, поэтому необходима иммобилизация. Это подвергает пациента высокому риску потери разгибания из-за удлинения сухожилия, если мобилизация слишком ранняя, или вероятности тугоподвижности сустава, если мобилизация продолжительная [26, 27].
Ладонный хирургический доступ имеет, по крайней мере, теоретически несколько преимуществ перед другими подходами. При этом методе сухожилия не повреждаются напрямую и, в частности, деликатный механизм разгибателей остается нетронутым. Однако ладонный доступ технически более сложен и предлагает ограниченное пространство для имплантации искусственного сустава. Кроме того, ранее существовавший дисбаланс сухожилий исправить труднее. Техника, описанная D.B. Herren et al., обеспечивает хороший доступ к суставу [28]. Формируют кожный лоскут на радиальном основании, сухожилие сгибателей обнажают и вскрывают поперечно, затем с локтевой и лучевой сторон разрез продолжают с освобождением добавочных коллатеральных связок. Доступ к суставу достигают за счет гиперразгибания. Некоторое расслабление локтевой коллатеральной связки может потребоваться, если сустав недостаточно эластичен для хорошего обнажения. Остеофиты аккуратно удаляют, поскольку это может быть потенциальным местом защемления сгибаемого имплантата. Затем резецируют головку проксимальной фаланги, при этом необходимо позаботиться о том, чтобы идентифицировать сосудисто-нервный пучок и защитить его ретракторами. Подготовку кости и имплантацию эндопротеза выполняют так же, как и при дорсальном доступе. В случаях с ранее существовавшим отклонением сухожилия сгибателя из-за латеральной деформации сухожилие может быть рецентрировано. Перед окончательным закрытием важно еще раз проверить пассивный диапазон движений. В конце процедуры латеральный край ладонной пластинки подшивают к добавочной связке. Программа реабилитации следует принципам, изложенным для дорсального подхода, но не требует никакой специальной защиты сухожилий разгибателей и разрешает даже пассивные движения [29, 30].
Трудно сделать вывод, насколько хорош ладонный подход. Однако при дорсальном доступе необходима иммобилизация, чтобы добиться процесса восстановления сухожилия. Ладонную пластинку и влагалище сухожилий сгибателей подвергают риску при ладонном или переднем доступе.
Ладонный подход используется реже, поскольку его сложнее выполнить. Его преимущество заключается в сохранении непрерывности механизмов разгибателей и сгибателей и симметричном растяжении коллатеральных связок [30-33].
Латеральный хирургический доступ — наименее распространенный подход, используемый для артропластики ПМФС. Разрез идет по средней линии на локтевой стороне пальца и изгибается дорсально на средней фаланге.
После освобождения косых и поперечных волокон ретикулярных связок разгиба- тельный аппарат приподнимается и может быть мобилизован латерально, при этом место прикрепления центральной накладки остается неповрежденным. Локтевой сосудисто-нервный пучок остается на ладонной стороне сустава. При классическом латеральном доступе локтевая коллатеральная связка должна быть полностью отделена таким образом, чтобы можно было открыть сустав с лучевой стороны. Лучше всего это сделать с помощью треугольного лоскута, который можно отогнуть проксимально. Имплантат можно установить, как описано ранее. Для закрытия необходимо повторно прикрепить локтевую коллатеральную связку таким образом, чтобы была возможна активная реабилитация. Локтевая сторона должна быть защищена наложением шины на срок до шести недель. G.I. Bain et al. описали модифицированный латеральный доступ, при котором коллатеральную связку расщепляют для установки имплантата и восстанавливают из стороны в сторону [34]. По крайней мере, теоретически опасность нестабильности уменьшается, и возможна ранняя неограниченная активная мобилизация.
Латеральный доступ используют реже, поскольку он обеспечивает ограниченное воздействие на суставы. Основным его недостатком является перерезание поперечной ретикулярной связки и одной из коллатеральных связок с риском боковой нестабильности. Некоторые авторы для решения этой проблемы выполняли восстановление связок с использованием чрескостных швов или анкеров [35, 36].
Отметим, что преимуществом дорсального доступа к ПМФС является улучшение визуализации суставной поверхности, тогда как недостатком можно считать нарушение центрального скольжения и разгибательного механизма, что требует обязательного восстановления разгибательного аппарата с последующей задержкой в диапазоне двигательных упражнений. Ладонный доступ к ПМФС может сохранить целостность сухожилия разгибателя, что позволяет осуществлять ранний диапазон движений в послеоперационном периоде.
Единое мнение отом, какой издоступов дает лучшие результатылечения, отсутствует. G.V. Tranchida et al. в исследовании на примере 66 взрослых пациентов (88 пальцев), перенесших эндопротезирование ПМФС, сравнили среднее изменение объема движений, послеоперационный объем движений и частоту послеоперационных осложнений, а также изучили связь продолжительности иммобилизации и времени до начала реабилитации с послеоперационным объемом движений. В данном исследовании не было выявлено статистических различий в среднем послеоперационном диапазоне движений, частоте осложнений или ревизионных операциях между ладонным и дорсальным доступами для артро- пластики ПМФС [37].
Вдобавок не стоит забывать, что ладонный доступ более травматичен и сложен в применении и требует от хирурга больших знаний и времени в выполнении.
Следовательно, оптимальным является дорсальный доступ, так как он наиболее прост в выполнении, однако требует адекватного восстановления разгибательного аппарата пальца, прочной фиксации и ранней реабилитации.
Именно поэтому данный доступ используют чаще.
Выбор имплантата
Помимо анатомических особенностей ПМФС и обусловленных ими трудностей выбора хирургического доступа, важной проблемой остается выбор имплантата, который должен обладать идентичной здоровому суставу морфологией суставных поверхностей, максимальной мобильностью, идентичной стабильностью и устойчивостью, наряду с небольшой потерей костной массы во время имплантации.
Кроме того, стабильная и надежная фиксация и скользящая пара без истирания — свойства, которыми также должен обладать идеальный искусственный сустав. Пути реализации всех этих возможностей эндопротеза до сих пор до конца не найдены, и не только для сустава пальца. Что касается описанной выше анатомии, можно сделать следующие наблюдения относительно имеющихся в настоящее время эндопротезов суставов пальцев. Ни одна из существующих в настоящее время модификаций имплантатов не соответствует морфологии естественного сустава пальца. Однако, анализируя литературу, можно проследить определенную тенденцию перехода к модульным компонентам и менее связанным конструкциям.
Несмотря на дальнейшее развитие материалов и конструкции, силиконовый протез, разработанный A.B. Swanson в начале 1960-х годов, остается наиболее часто имплантируемым искусственным суставом в ПМФС пальцев кисти [23]. Это не настоящий протез, а скорее гибкий заполнитель, который инкапсулирован соединительной тканью и скользит вперед и назад по костномозговому каналу. A.B. Swanson (1994) придерживался мнения, что свободное скольжение силиконового заполнителя необходимо для хорошей подвижности сустава, а также положительно влияет на его долговечность. Способность скользить позволяет уменьшить силы, действующие на кость. Автор описал это скольжение: при сгибании пальца силиконовый заполнитель в костномозговом канале скользит дистально, а при разгибании — проксимально, как «поршневой эффект» [23, 38].
Боковая устойчивость остается проблемой, особенно в отношении указательного и среднего пальцев, где стабильность важна для защемления [39, 40, 41]. Поэтому некоторые авторы по-прежнему рекомендуют артродез указательного пальца [42]. По сравнению с протезами из металла, керамики или пироуглерода, имплантаты-заполнители из силикона значительно дешевле. Несмотря на хорошие отдаленные результаты, их недостатками являются отсутствие стабильности, переломы имплантатов и фрагментация силикона, которые неоднократно наблюдают с течением времени. По данным современной литературы, имплантаты из силикона не уступают более новым имплантатам, а осложнения хорошо известны. Поэтому для улучшения результатов следует переместить акцент на оперативный подход [31, 43]. Новейшее поколение суставных имплантатов ПМФС основано на принципах замены поверхности с использованием двухкомпонентной концепции [44-49].
Проксимальный компонент заменяет двухмыщелковую головку проксимальной фаланги, а дистальный компонент имеет своего рода чашку, которая сочленяется с головкой.
Большинство этих имплантатов не представляет собой настоящей концепции восстановления поверхности, поскольку необходимо резецировать значительный объем кости, а для обеспечения адекватной фиксации необходимы длинные ножки для обоих компонентов. Доступно несколько комбинаций материалов: от классического «хром - кобальт - полиэтилен» до «керамики - керамики» и «пироуглерода - пироуглерода».
Имплантаты из пиролитического углерода с минимальными ограничениями использовали в качестве альтернативы силиконовому эндопротезированию. H.G. Tuttle et al. сообщили в общей сложности о 15 послеоперационных осложнениях, наиболее частым из которых был заметный скрип в суставе [50]. У 50 % пациентов в этой серии наблюдали неполное облегчение боли. Только два сустава показали рентгенологические признаки расшатывания. R.M. Nunley et al. показали недостаточное облегчение боли и отсутствие улучшения объема движений у пациентов после установки эндопротезов из пиролитического углерода по поводу посттравматического артрита ПМФС [51]. Хотя пироуглерод обладает превосходной биосовместимостью и идеальными характеристиками скольжения, описаны проблемы, связанные с трудностями при остеоинтеграции и скрипом в суставах. Выживаемость имплантатов из пиролитического углерода составила 85 % (83 из 97) в течение пяти лет наблюдения с высокой удовлетворенностью пациентов. Пациентов следует информировать о том, что данная процедура обеспечивает хорошее облегчение боли, но не увеличивает диапазон движений [52].
В своем исследовании B.J.W. Notermans et al. сделали вывод, что ригидность и отставание разгибателей были наиболее частыми послеоперационными осложнениями [53]. Также многие авторы наиболее частым осложнением называют ригидность [52, 54, 55]. В обзоре 76 повторных артропластик ПМФС T. Pritsch et al. обнаружили, что дисфункция разгибателей была наиболее частым (67 %) показанием к повторной операции [56].
В целом новое поколение имплантатов ПМФС, основанное на концепции шлифовки, казалось логичным развитием артропластики ПМФС, но большинство из них еще не выдержало испытания временем, и для большинства имплантатов не хватает реальных долгосрочных серий наблюдения выживаемости конструкции [11].
Колоссальные успехи применения пары трения «керамика - керамика» в хирургии крупных суставов сподвигло клиницистов к более широкому применению данной пары трения в хирургии мелких суставов [3, 57-59]. За время использования керамики в эндопротезировании тазобедренного сустава исследователи по достоинству оценили высоко конкурентные качества данного материала: износостойкость, биоинертность и биосовместимость. Имплантаты из керамики с гидроксиапатитным покрытием показали воодушевляющую комбинацию оптимальной трибологической пары и остеоинтеграции одновременно, что значительно стимулирует интерес к изучению данного материала [60].
Определенные успехи в эндопротезировании ПМФС представили в своем независимом исследовании М.И. Мурадов с соавт. и П.В. Федотов с соавт. на примере анализа результатов эндопротезирования. Авторы отмечают стойкое увеличение объёма движений и высокий процент удовлетворённости пациентов — 82 % [3, 61].
Хотя результаты в отношении расшатывания эндопротеза и боли в последние годы улучшились, некоторые проблемы остаются нерешенными. Морфология суставов, малые размеры костей, сложная биомеханика и нагрузка на кисть представляют собой особую проблему при эндопротезировании ПМФС. До сих пор не удается восстановить полный объем движений в данном суставе, несмотря на успехи коллег в эндопротезировании крупных суставов.
ЗАКЛЮЧЕНИЕ
Проведенный анализ литературы показал, что выбор имплантата и хирургической тактики — наиболее частые проблемы при эндопротезировании ПМФС, требующие решения и дальнейшего изучения. Правильное понимание различных хирургических подходов, их показаний, техники и недостатков поможет оптимизировать результаты лечения пациентов. Комфортность каждого подхода поможет хирургу свести к минимуму осложнения, улучшить функцию и индивидуализировать лечение первичного или вторичного артрита ПМФС.
Имплантируя эндопротезы ПМФС, которые выпускают в различных исполнениях, можно надежно устранить боль, сохраняя при этом определенную степень подвижности. Однако пациент должен быть проинформирован об ограниченной механической прочности и сроке службы установленных конструкций. Следует наладить взаимоотношения с пациентом, так как без его адекватного желания и работы достигнуть хорошего результата невозможно, несмотря на отличную хирургическую технику и выбор оптимального имплантата.
Faulkner H, An V, Lawson RD, Graham DJ, Sivakumar BS. Proximal Interphalangeal Joint Arthrodesis Techniques: A Systematic Review. Hand (N Y). 2023;18(1):74-79. doi: 10.1177/1558944721998019
Wilder FV, Barrett JP, Farina EJ. Joint-specific prevalence of osteoarthritis of the hand. Osteoarthritis Cartilage. 2006;14(9):953-7. doi: 10.1016/j.joca.2006.04.013
Мурадов М.И., Байтингер В.Ф., Камолов Ф.Ф. и др. Оценка отдаленных результатов эндопротезирования суставов пальцев кисти. Вопросы реконструктивной и пластической хирургии. 2016;(1):33-41. doi: 10.17223/1814147/56/5
Jonsson H. Age related prevalence of hand osteoarthritis diagnosed by photography (HOASCORE). BMCMusculoskelet Disord. 2017;18(1):508. doi: 10.1186/s12891-017-1870-0
Николаенко А.Н., Иванов В.В., Згирский Д.О. и др. Эндопротезирование проксимального межфалангового сустава. Обзор литературы. Medline.ru. 2022;23:748-766.
Srnec JJ, Wagner ER, Rizzo M. Implant Arthroplasty for Proximal Interphalangeal, Metacarpophalangeal, and Trapeziometacarpal Joint Degeneration. JHand SurgAm. 2017;42(10):817-825. doi: 10.1016/j.jhsa.2017.07.030
Forte A, Murray P. Osteoarthritis and prosthetic joints in the hand.. In: Farhadieh RD, Bulstrode NW, Mehrara BJ, Cugno S. (eds). Plastic Surgery - Principles and Practice. Elsevier Publ.; 2022:896-905. doi: 10.1016/B978-0-323-65381- 7.00057-5
Yamamoto M, Malay S, Fujihara Y, et al. A Systematic Review of Different Implants and Approaches for Proximal Interphalangeal Joint Arthroplasty. Plast Reconstr Surg.. 2017;139(5):1139e-1151e. doi: 10.1097/PRS.0000000000003260
Kamnerdnakta S, Huetteman HE, Chung KC. Complications of Proximal Interphalangeal Joint Injuries: Prevention and Treatment. Hand Clin. 2018;34(2):267-288. doi: 10.1016/j.hcl.2017.12.014
Hensler S, Behm P, Wehrli M, et al. Lateral stability in healthy proximal interphalangeal joints versus surface replacement and silicone arthroplasty: Results of a three-dimensional motion analysis study. Hand Surg Rehabil. 2020;39(4):296-301.
Mercer D, Imada AO. Arthrodesis and arthroplasty of the small joints. Oper Tech Orthop. 2020;30(4):100832. doi: 10.1016/j.oto.2020.100832
Vitale MA, Fruth KM, Rizzo M, et al. Prosthetic Arthroplasty Versus Arthrodesis for Osteoarthritis and Posttraumatic Arthritis of the Index Finger Proximal Interphalangeal Joint. J Hand Surg Am. 2015;40(10):1937-1948. doi: 10.1016/j. jhsa.2015.05.021
Richards T, Ingham L, Russell I, Newington D. The Long-term Results of Proximal Interphalangeal Joint Arthroplasty of the Osteoarthritic Index Finger. Hand (N Y). 2022;17(2):266-270. doi: 10.1177/1558944720921468
Pang EO, Yao J. Anatomy and Biomechanics of the Finger Proximal Interphalangeal Joint. Hand Clin. 2018;34(2):121-126. doi: 10.1016/j.hcl.2017.12.002
Leibovic SJ, Bowers WH. Anatomy of the proximal interphalangeal joint. Hand Clin. 1994;10(2):169-178.
Millrose M, Vonderlind HC, Thannheimer A. et al. Arthrodesis of the Proximal Interphalangeal Joint of the Finger-A Biomechanical Study of Primary Stability. JPers Med. 2023;13(3):465. doi: 10.3390/jpm13030465
Hohendorff B, Spies CK, Unglaub F, et al. Anatomy of the metacarpophalangeal and proximal interphalangeal finger joint with respect to arthroplasty. Orthopade. 2019;48(5):368-377. (In German) doi: 10.1007/s00132-019-03716-7
Le Gledic B, Hidalgo Diaz JJ, Vernet P, et al. Comparison of proximal interphalangeal arthroplasty outcomes with Swanson implant performed by volar versus dorsal approach. Hand SurgRehabil. 2018;37(2):104-109. doi: 10.1016/j. hansur.2017.11.008
Zhu AF, Rahgozar P, Chung KC. Advances in Proximal Interphalangeal Joint Arthroplasty: Biomechanics and Biomaterials. Hand Clin. 2018;34(2):185-194. doi: 10.1016/j.hcl.2017.12.008
Natera L, Moya-Gomez E, Lamas-Gomez C, et al. Proximal interphalangeal joint replacement: A comparison between the volar and dorsal approach. Rev Esp Cir Ortop Traumatol. 2014;58(5):303-8. (Im Span) doi: 10.1016/j.recot.2014.04.003
Renfree KJ. Surgical approaches for proximal interphalangeal joint arthroplasty. Bone Joint J. 2022;104-B(12):1329-1333.
Swanson AB, de Groot Swanson G. Flexible implant resection arthroplasty of the proximal interphalangeal joint. Hand Clin. 1994;10(2):261-266.
Chamay A. A distally based dorsal and triangular tendinous flap for direct access to the proximal interphalangeal joint. Ann ChirMain. 1988;7(2):179-183. doi: 10.1016/s0753-9053(88)80061-9
Bodmer E, Marks M, Hensler S, et al. Comparison of outcomes of three surgical approaches for proximal interphalangeal joint arthroplasty using a surface-replacing implant. J Hand Surg Eur Vol. 2020;45(6):608-614.
Bickel KD. The dorsal approach to silicone implant arthroplasty of the proximal interphalangeal joint. J Hand Surg Am. 2007;32(6):909-913. doi: 10.1016/j.jhsa.2007.04.013
Herren DB, Simmen BR. Palmar approach in flexible implant arthroplasty of the proximal interphalangeal joint. Clin OrthopRelatRes. 2000;(371):131-135. doi: 10.1097/00003086-200002000-00016
Shirakawa K, Shirota M. Surface replacement arthroplasty using a volar approach for osteoarthritis of proximal interphalangeal joint: results after a minimum 5-year follow-up. Hand (N Y). 2020;15(1):81-86. doi: 10.1177/1558944718787332
Bouacida S, Lazerges C, Coulet B, Chammas M. Proximal interphalangeal joint arthroplasty with Neuflex® implants: relevance of the volar approach and early rehabilitation. Chir Main. 2014;33(5):350-355. doi: 10.1016/j.main.2014.07.004
Lautenbach M, Kim S, Berndsen M, Eisenschenk A. The palmar approach for PIP-arthroplasty according to Simmen: results after 8 years follow-up. J Orthop Sci. 2014;19(5):722-728. doi: 10.1007/s00776-014-0605-4
Stoecklein HH, Garg R, Wolfe SW. Surface replacement arthroplasty of the proximal interphalangeal joint using a volar approach: case series. J Hand Surg Am. 2011;36(6):1015-1021. doi: 10.1016/j.jhsa.2011.03.003
Proubasta IR, Lamas CG, Natera L, Millan A. Silicone proximal interphalangeal joint arthroplasty for primary osteoarthritis using a volar approach. J Hand Surg Am. 2014;39(6):1075-1081. doi: 10.1016/j.jhsa.2014.03.033
Bain GI, McGuire DT, McGrath AM. A Simplified Lateral Hinge Approach to the Proximal Interphalangeal Joint. Tech Hand Up Extrem Surg. 2015;19(3):129-132. doi: 10.1097/BTH.0000000000000094
Merle M, Villani F, Lallemand B, et al. Proximal interphalangeal joint arthroplasty with silicone implants (NeuFlex) by a lateral approach: a series of 51 cases. J Hand Surg Eur Vol. 2012;37(1):50-55. doi: 10.1177/1753193411413851
Segalman KA. Lateral approach to proximal interphalangeal joint implant arthroplasty. J Hand Surg Am. 2007;32(6):905-908. doi: 10.1016/j.jhsa.2007.04.011
Tranchida GV, Allen ST, Moen SM, et al. Comparison of volar and dorsal approach for PIP arthroplasty. Hand (N Y). 2021;16(3):348-353. doi: 10.1177/1558944719861718
Srnec JJ, Wagner ER, Rizzo M. Implant Arthroplasty for Proximal Interphalangeal, Metacarpophalangeal, and Trapeziometacarpal Joint Degeneration. J Hand Surg Am. 2017;42(10):817-825. doi: 10.1016/j.jhsa.2017.07.030
Amirtharajah M, Fufa D, Lightdale N, Weiland A. Conical, radiographic, and patient-reported results of surface replacing proximal interphalangeal joint arthroplasty of the hand. Iowa Orthop J. 2011;31:140-144.
Helder O, Marks M, Schweizer A, et al. Complications after surface replacing and silicone PIP arthroplasty: an analysis of 703 implants. Arch Orthop Trauma Surg. 2021;141(1):173-181. doi: 10.1007/s00402-020-03663-5
Weistra K, Kan HJ, van Alebeek VAHJ, Ritt MJPF. Proximal Interphalangeal Joint Arthroplasty Using a Silicone Implant: A Comparison Between Integra and NeuFlex in 72 Cases. Hand (N Y). 2024;19(2):236-240. doi: 10.1177/15589447221122829
Sweets TM, Stern PJ. Proximal interphalangeal joint prosthetic arthroplasty. J Hand Surg Am. 2010;35(7):1190-1193. doi: 10.1016/j.jhsa.2010.04.005
Forster N, Schindele S, Audige L, Marks M. Complications, reoperations and revisions after proximal interphalangeal joint arthroplasty: a systematic review and meta-analysis. J Hand Surg Eur Vol. 2018;43(10):1066-1075.
Athlani L, Gaisne E, Bellemere P. Arthroplasty of the proximal interphalangeal joint with the TACTYS® prosthesis: Preliminary results after a minimum follow-up of 2 years. Hand Surg Rehabil. 2016;35(3):168-178. doi: 10.1016/j. hansur.2015.12.013
Jennings CD, Livingstone DP. Surface replacement arthroplasty of the proximal interphalangeal joint using the SR PIP implant: long-term results. J Hand Surg Am. 2015;40(3):469-473.e6.
Griffart A, Agneray H, Loubersac T, et al. Arthroplasty of the proximal interphalangeal joint with the Tactys® modular prosthesis: Results in case of index finger and clinodactyly. Hand Surg Rehabil. 2019;38(3):179-185. doi: 10.1016/j. hansur.2019.03.001
Regas I, Pluvy I, Leroy M, et al. Arthroplasty for destroyed proximal interphalangeal joint in hand trauma surgery: Silicone hinged NeuFlex® or gliding Tactys®? Hand SurgRehabil. 2022;41(6):681-687. doi: 10.1016/j.hansur.2022.09.006
Wagner ER, Weston JT, Houdek MT, et al. Medium-Term Outcomes With Pyrocarbon Proximal Interphalangeal Arthroplasty: A Study of 170 Consecutive Arthroplasties. J Hand Surg Am. 2018;43(9):797-805. doi: 10.1016/j. jhsa.2018.06.020
Tuttle HG, Stern PJ. Pyrolytic carbon proximal interphalangeal joint resurfacing arthroplasty. J Hand Surg Am. 2006;31(6):930-939. doi: 10.1016/j.jhsa.2006.02.018
Nunley RM, Boyer MI, Goldfarb CA. Pyrolytic carbon arthroplasty for posttraumatic arthritis of the proximal interphalangeal joint. J Hand Surg Am. 2006;31(9):1468-1474. doi: 10.1016/j.jhsa.2006.07.017
Watts AC, Hearnden AJ, Trail IA, et al. Pyrocarbon proximal interphalangeal joint arthroplasty: minimum two-year follow-up. J Hand Surg Am. 2012;37(5):882-888. doi: 10.1016/j.jhsa.2012.02.012
Notermans BJW, Lans J, Ponton RP, et al. Factors Associated with Reoperation after Pyrocarbon Proximal Interphalangeal Joint Arthroplasty for the Arthritic Joint: A Retrospective Cohort Study. J Hand Microsurg. 2021;13(3):132-137.
Desai A, Gould FJ, Mackay DC. Outcome of pyrocarbon proximal interphalangeal joint replacement. Hand Surg. 2014;19(1):77-83. doi: 10.1142/S0218810414500130
Pritsch T, Rizzo M. Reoperations following proximal interphalangeal joint nonconstrained arthroplasties. J Hand Surg Am. 2011;36(9):1460-1466. doi: 10.1016/j.jhsa.2011.06.002
Федотов П.В., Ковалев Д.В., Михайлов А.С. Гемиэндопротезирование плюснефаланговых суставов при остеохондропатии головки плюсневой кости (болезнь Фрайберга-Келлера II). Кафедра травматологии и ортопедии. 2022;(4):52-56. doi: 10.17238/2226-2016-2022-4-52-56
Фроленков А.В., Ульянов В.Ю., Горякин М.В. Опыт тотального эндопротезирования первого плюснефалангового сустава. Саратовский научно-медицинский журнал. 2019;15(3):633-636.
Александров Т.И., Прохоренко В.М., Чорний С.И. Эндопротезирование лучезапястного сустава: обзор литературы и анализ собственных наблюдений. Современные проблемы науки и образования. 2017;(4). URL: https:// science-education.ru/ru/article/view?id=26607 (дата обращения: 27.08.2024).
Волокитина Е.А., Антропова И.П., Тимофеев К.А., Труфаненко RA. Современное состояние и перспективы использования имплантатов из циркониевых керамических материалов в травматологии и ортопедии. Гений ортопедии. 2024;30(1):114-123. doi: 10.18019/1028-4427-2024-30-1-114-123. EDN: OBNLBM.
Федотов П.В., Ковалев Д.В., Рыбаков С.Н. Оценка отдаленных результатов эндопротезирования проксимального межфалангового сустава кисти. Гений ортопедии. 2024;30(2):191-199. doi: 10.18019/1028-4427-2024-30-2-191- 199.
. Информация об авторах: Павел Владимирович Федотов — врач травматолог-ортопед
Дмитрий Васильевич Ковалев — заведующий отделением, врач травматолог-ортопед
Анатолий Сергеевич Михайлов — врач травматолог-ортопед,
Теги: эндопротезирование суставов кисти
234567 Начало активности (дата): 02.11.2024
234567 Кем создан (ID): 989
234567 Ключевые слова: проксимальный межфаланговый сустав, эндопротезирование суставов кисти, ар- тропластика проксимального межфалангового сустава, биомеханика пальцев кисти
12354567899
Похожие статьи
Хирургическая коррекция посттравматических сгибательных контрактур суставов трехфаланговых пальцев кисти (систематический обзор литературы)Рентген на дому 8 495 22 555 6 8



