 18.07.2024
18.07.2024
Современные тенденции хирургического лечения полнослойных костно-хрящевых дефектов таранной кости
Результаты обзора показывают, что существуют возможности для совершенствования известных методов лечения путем их дополнения, а возможно, и комбинирования
Понимание сущности процессов, протекающих при развитии остеохондральных повреждений таранной кости, методы диагностики и лечения этого заболевания развивались длительное время. В зарубежной и отечественной литературе применяется различная терминология для описания данной проблемы: асептический некроз, рассекающий остеохондрит голеностопного сустава, болезнь Моше-Диаза, но в подавляющем большинстве работ фигурируют два наименования одного и того же заболевания — остеохондральные повреждения и остеохондральные дефекты таранной кости [1]. Такое обозначение, скорее, отражает анатомическую составляющую, а выбор тактики лечения основывается на площади и глубине дефекта таранной кости.
Остеохондральное повреждение таранной кости впервые описано Monro в 1856 г., который на основании обнаруженных внутрисуставных свободных тел сделал предположение о травматической этиологии остеохондральных повреждений. В 1888 г. Konig для описания свободных хрящевых внутрисуставных тел коленного сустава использовал термин «рассекающий остеохондрит». В 1922 г. M. Kappis исследовал аналогичное повреждение таранной кости, а спустя 2 года это сделал D.B. Phe- mister который первым детально описал внутрисуставные переломы таранной кости. A.L. Berndt и M. Harty изучили травматическую этиологию остеохондрального поражения таранной кости и разработали первую классификацию для данного типа повреждений.
Несмотря на богатую историю, ввиду сложности диагностики и отсутствия единого подхода в лечении пациентов данное заболевание представляет собой серьезную проблему.
Лечение остеохондральных поражений таранной кости является сложной задачей в связи с особенностями анатомии, ограниченным регенерационным потенциалом суставного хряща и постоянными нагрузками, приходящимися на таранную кость. Однако за последние 10-15 лет были достигнуты значительные успехи в понимании патофизиологии остеохондральных повреждений таранной кости и развитии хирургических методов лечения, нацеленных на хорошие и отличные долгосрочные результаты [2].
Цель исследования — представить литературный обзор состояния вопроса диагностики и лечения пациентов с остеохондральными дефектами таранной кости.
Задачи: обзор и описание методик хирургического лечения остеохондральных повреждений таранной кости и составление алгоритма хирургического лечения остеохондральных повреждений таранной кости на основании известных подходов.
МАТЕРИАЛЫ И МЕТОДЫ
Литературный поиск публикаций проводился с 1953 по 2021 год, в том числе анализ известных методик хирургического лечения — с 1999 по 2021 г. Были рассмотрены публикации в базах данных PubMed/MedLine и eLIBRARY.
Использовались ключевые слова и словосочетания на английском и русском языках: osteochondral defect, osteochondral lesions, talar necrosis, talar cartilage defects, osteochondritis dissecants of the talus, костно-хрящевые поражения таранной кости, остеохондральные поражения блока таранной кости, дефект гиалинового хряща, повреждение суставной поверхности голеностопного сустава. Из исследования исключались работы, где результаты оценивались менее чем через 12 месяцев и с возрастом пациентов моложе 18 лет.
Ряд классификаций и исторических сведений представлены со ссылками на первоисточники (табл.).
Эпидемиология
Остеохондральные повреждения таранной кости составляют 4 % от всех повреждений суставного хряща [3]. J.M. Weiss, K.G. Shea и соавт. обнаружили, что на долю всех повреждений хрящевой ткани крупных суставов приходится 3,42 % остеохондральных повреждении, при этом поражения голеностопного сустава встречались чаше, чем в других локализациях и составили 2,08 %, на втором месте по встречаемости болезнь Кёнига — 1,21 % [4].
Остеохондральные повреждения таранной кости чаще возникают у пациентов молодого трудоспособного возраста [5], средний возраст таких больных — 38 (13-58) лет [6, 7]. Прогрессирование поражения таранной кости сопровождается формированием стойкого болевого синдрома, а резистентность к консервативной терапии приводит к стойкой утрате трудоспособности и снижению качества жизни.
Этиология
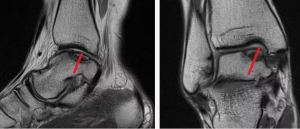
Таранная кость приблизительно на 60 % покрыта хрящом и не служит точкой прикрепления связок и мышц [8-10]. Особенности ее кровоснабжения представлены 3 артериями: передней, задней большеберцовыми артериями и прободающей ветвью малоберцовой артерии. Малый калибр внутрикостных сосудов и постоянная нагрузка на таранную кость являются предрасполагающими факторами к формированию остеохондральных дефектов [11]. S.J. Mubarak и соавт. описали несколько основных причин формирования остеохондральных дефектов таранной кости: травма в анамнезе, васкулопатии, эндокринные и метаболические нарушения, а также генетическая предрасположенность по аутосомно-доминантному типу [12]. Для более удобной идентификации повреждений Raikin и соавт., разделили поверхность купола таранной кости на 9 квадратных зон, имеющих равную площадь (рис.
1). Для каждой из них была описана глубина и частота поражения. Медиальная часть купола таранной кости поражалась значительно чаще латеральной. Частота, глубина и площадь поражения в медиальной части купола таранной кости были значительно больше, чем в латеральной. Наиболее часто поражалась зона 4, второй по частоте поражения была 6-я [13]. Примечательно, что формирование дефекта латерального отдела в 98 % сопряжено с травмой, которая при поражении медиального отдела таранной кости констатирована в 70 % случаев [10]. Также немаловажная роль в формировании остеохондрального дефекта отведена предрасполагающим факторам со стороны организма: еще в середине прошлого столетия сообщалось о генетических, метаболических или эндокринных причинах возникновения данного заболевания [14, 15].
Очевидно, что травма в анамнезе, характеризующаяся возникновением или усилением болевого синдрома, становится пусковым механизмом в проявлении клинической картины заболевания. Данный факт является причиной обращения пациента за медицинской помощью, при этом не всегда будучи первопричиной заболевания. Об этом свидетельствует давность проявления клинической картины, которая может не соответствовать стадии остеохондрального дефекта, в частности площади, глубине поражения и формированию кистозных перестроек таранной кости.
Диагностика и классификация
Клиническая картина не является специфической и представлена болью в области голеностопного сустава, часто не имеющей четкой локализации, которая может не соответствовать расположению очага поражения таранной кости. Также возможны проявления синовита и «блокады» в голеностопном суставе свободно находящимся остеохондральным фрагментом [16]. Боль усиливается при пальпации, физической нагрузке. В ряде случаев ее манифестация сопряжена с травмой в анамнезе.
При хронических поражениях клиническая картина может быть менее выражена. В анамнезе чаще всего встречается повторяющаяся травматизация, связанная с повреждением или гипермобильностью связочного аппарата стопы и голеностопного сустава [17, 18]. Неспецифическая картина заболевания, а также доминирующий характер травматической этиологии требует дифференциальной диагностики с другими повреждениями голеностопного сустава и стопы. В некоторых случаях общая картина заболевания представляет собой бессимптомное поражение, случайно обнаруженное при исследовании сопутствующей патологии голеностопного сустава [19].
Стандартные рентгенограммы голеностопного сустава (переднезадние, боковые, косые) являются исследованием первой линии при диагностике травм и заболеваний опорно-двигательного аппарата и одним из первоочередных при подозрении на остеохондральные поражения таранной кости [7]. На основании рентгенологической картины в 1959 году A.L. Berndt and M. Hardy предложили 4-стадийную классификацию остеохондральных дефектов таранной кости [20]. В 1993 году данная классификация дополнена Loomer и соавт., которые, используя преимущественно компьютерную томографию костно-хрящевых поражений, подтвердили высокую частоту (77 %) «рентгенопрозрачных поражений», или субхондральных кист. Чтобы учесть этот вывод, они добавили еще одну стадию (субхондральной кисты) к первоначальной классификации Berndt and Hardy, сохранив остальную ее часть [20].
Главным преимуществом классификации авторов является ее широкое применение и простота, к недостаткам относится низкий диагностический потенциал рентгенологического метода исследования (30-50 % остеохондральных дефектов остаются неидентифицированными), особенно это касается стадии отека костного мозга [21-24]. Согласно зарубежным гайдлайнам, при болевом синдроме неясной этиологии в голеностопном суставе следующим этапом после рентгенологического обследования является магнитно-резонансная томография (МРТ) [25]. Она имеет наибольшую информативность в отношении стабильности остеохондрального дефекта, ранних проявлений изменений в костном мозге и окружающих тканях [1]. Ранняя диагностика, хорошая визуализация и дифференцировка тканей делают МРТ-исследование золотым стандартом при диагностике остеохондропатий [7]. В 1999 году предложена МРТ-классификация Hepple и соавт., которая базируется на классификации Berndt and Hardy, подробнее останавливаясь на более ранних стадиях заболевания (повреждении суставного хряща, отеке костного мозга) [23].
Компьютерная томография
(КТ) — эффективный метод диагностики остеохондральных дефектов при вовлечении в патологический процесс субохондральной кости. Она показывает более четкие границы поражения субхондральной кости, чем МРТ-исследование, однако обладает низкой чувствительностью на ранних стадиях заболевания (например, отеке костного мозга) [26].
Основанная на КТ-картине классификация R.D. Ferkel и соавт. выделяет 4 типа повреждений и позволяет оценить состояние субхондральной кости. При этом модифицированный вариант данной классификации (Cheng-Ferkel) позволяет наряду с повреждением костных структур артроскопиче- ски оценивать состояние хрящевой ткани в месте дефекта [27]. Активное внедрение артроскопической хирургии сопряжено с развитием и становлением как самостоятельных артроскопических классификаций — International Cartilage Repair System (ICRS) [28], а так и модификаций уже имеющихся, основанных на одном или нескольких лучевых методах исследования.
Оценка дефектов таранной кости на основании одного метода исследования не может являться в полной мере руководством для выбора объема операции. Для принятия решения наряду с лучевыми методами диагностики важное значение имеет интраоперационная картина очага остеохондропатии, вовлечение в патологический процесс суставного хряща и подлежащей кости, корреляция интраоперационной картины и лучевых методов исследования [29]. В настоящее время известен ряд классификаций остеохондральных поражений таранной кости, основанных на нескольких методах исследования, таких как МРТ-классификация Anderson, базирующаяся дополнительно на рентгенологической классификации [30], и комбинированная классификация DiPaola, основанная на классификации Berndt and Hardy, дополненная данными МРТ и артроскопической картины [31]. Наиболее значимой для клинициста является классификация Mintz с корреляцией данных МРТ и артроскопической картиной [32].
В настоящее время градация классификационных систем имеет практическую направленность и подчеркивает ряд важных факторов для принятие решения в отношении тактики лечения: ин- тактность/вовлечение суставного
хряща в патологический процесс, площадь, глубину повреждения, характер субхондрального перелома, его стабильность и наличие субхондральных кист [32, 33].
Консервативное лечение
Консервативный метод лечения заключается в ограничении активности, разгрузке/иммобилизации пострадавшей нижней конечности, использовании нестероидных противовоспалительных препаратов [34]. Применение консервативной терапии при остеохондропатии таранной кости нашло рутинное применение у низкокомплаентных пациентов и пациентов с комор- бидным фоном, а также «до диагностирования» наличия остеохондрального дефекта таранной кости [7, 35]. Консервативная терапия имеет место у молодых и активных пациентов при лечении в остром периоде травмы. Выполняется иммобилизация поврежденного голеностопного сустава на 4-6 недель, с последующим расширением нагрузки до полной в течение 2-8 недель [34].
В последнее время консервативная терапия дополнилась инъекциями обогащенной тромбоцитами плазмы (PRP) с применением ги- алуроновой кислоты, после которых пациенты отмечают улучшение состояния [36]. Mei-Dan с соавт. применяли PRP и гиалуроновую кислоту при лечении пациентов с остеохондропатией таранной кости в течение 28 недель с положительной динамикой [37]. Антирезор- бтивную терапию целесообразно проводить при начальных стадиях остеонекроза, при сохранности суставной поверхности и гиалинового хряща: в ряде случаев комбинация озонотерапии с препаратами гиалу- роновой кислоты или PRP, повышает терапевтический эффект последних [38]. Оперативное лечение при сохранении болевого синдрома рекомендуется выполнять не ранее чем через 3 месяца от начала консервативного этапа [39]. Хотя консервативная терапия и может улучшить состояния пациента в короткой перспективе, в отношении долгосрочных результатах она не обладает обнадеживающими сведениями. Сообщается о положительном результатах симптоматического лечения в 20-54 % случаев [39].
Консервативная терапия может улучшить клиническое состояние пациента, купировать отек и болевой синдром, однако данный вид лечения носит симптоматический характер и на стадии необратимых изменений суставного хряща и субхондральной кости теряет свою эффективность [40].
Стимуляция хондрогенеза (микрофрактурирование)
Данный метод лечения разработан в 1994 г. J.R. Steadmann [41]. Его суть заключается в санации, дебридменте зоны остеохондрального дефекта и формировании шилом-перфоратором микропереломов в субхондральной кости.
Результатом является кровотечение из перфорантных отверстий субхондральной спонгиозной кости, разрушение внутрикостных кровеносных сосудов и высвобождение факторов роста, что приводит к образованию фибринового сгустка с последующим формированием фиброзной хрящеподобной ткани в месте дефекта. Стоит отметить, что образованная хрящевая ткань по своим биомеханическим характеристикам уступает гиалиновой хрящевой ткани [42]. Это может негативно сказываться на долгосрочных результатах [43]. К преимуществам данной методики стоит отнести артроскопическое выполнение, что сопряжено с меньшей травматичностью и более быстрой реабилитацией в послеоперационном периоде по сравнению с «открытыми» вариантами хондропластики. По данным метаанализа 25 исследований, посвященных стимуляции хондрогенеза — BMS (Bone Marrow Stimulation), успешного результата удавалось добиться в среднем в 82 % случаев (78-86 %) [44]. Данные долгосрочного исследования G. Polat и соавт. свидетельствуют о неплохих функциональных результатах, однако у 23 % пациентов отмечалось появление боли после длительной физической нагрузки [45].
О возможных ухудшениях долгосрочных результатов изолированной методики стимуляции костного мозга говориться в работе Yang и соавт., которые провели артроскопический контроль зоны микрофрактурирования пациентам с крупными остеохондральными дефектами (площадью менее 2 см2 и глубиной не более 4 мм) Повторная артроскопия выполнялась в среднем через 3,6 (2,2-8,1) года. По результатам артроскопии у 36 % пациентов отмечалось нарушение структуры хрящевой ткани в месте дефекта, что являлось поводом к проведению ревизионных операций [46]. Giannini и соавт. в обзорной статье сообщают о целесообразности изолированной стимуляции хондрогенеза при дефектах 1,5 см2 с лучшими функциональными результатами у пациентов моложе 50 лет. Также авторы предупреждают о возможном ухудшении результата в долгосрочной перспективе [47].
В целом увеличение размера поражения является наиболее объективным измерением, при этом в случае поражения более 150 мм2 изолированная методика стимуляции костного мозга малоэффективна [40, 48]. Данные результаты еще раз доказывают, что для достаточного хондрогенеза и формирования гиалиноподобной хрящевой ткани при обширных остеохондральных поражениях необходима повышенная концентрация мезенхимальных клеток в зоне дефекта в виде «суперсгустка» [49].
Методика индуцированного на коллагеновой матрице хондрогенеза (autologous matrix-induced chondrogenesis — AMIC)
Методика индуцированного на коллагеновой матрице хондрогене- за впервые описана в 2005 году и в настоящий момент является одним из перспективных и активно развивающихся методов, используемых в лечении остеохондральных дефектов таранной кости. Она включает в себя открытую или артро- скопическую санацию, дебридмент зоны остеохондрального дефекта с имплантацией коллагеновой мембраны, что стабилизирует и защищает высвобождающиеся мезенхимальные клетки [50]. Коллагеновая мембрана может быть фиксирована к дефекту с помощью фибринового геля с клеющей способностью, не требующего фиксации швами.
Также сообщалось, что в очаг поражения доставляется больше жизнеспособных клеток, что может привести к лучшим долгосрочным результатам [51].
Weigelt и соавт. провели оценку долгосрочных результатов лечения пациентов с остеохондральными дефектами таранной кости от 0,4 до 2,3 см2, которым выполнялся открытый вариант AMIC с остеотомией медиальной лодыжки. При этом средний балл AOFAS составил 93 балла, а общая удовлетворенность результатом лечения — 94 %, при этом 79 % пациентов вернулись к прежней спортивной активности [52]. D’Ambrosi и соавт. провели ретроспективную оценку 2-летних результатов артроскопи- ческого выполнения AMIC пациентам с дефектами площадью от 50 до 330 мм2. Через 2 года после операции 80,8 % пациентов вернулись к спортивной активности.
Среднее значение AOFAS через 2 года составило 87 баллов [53].
Несмотря на то, что у артроско- пического варианта хондропласти- ки есть ряд преимуществ, таких как меньшая травматичность, быстрая реабилитация, хондропластика крупных полнослойных дефектов с костной аутопластикой может быть технически трудноосуществимой. В ряде случаев артроскопический доступ не позволяет провести адекватную хирургическую обработку зоны дефекта (удаление фиброзной ткани, обработку кистозных полостей, удаление пораженной субхондральной кости), поэтому ряд комбинированных методик, совмещающих в себе костную аутопластику и AMIC-технологию, выполняются открыто [54]. В метаанализе Walther и соавт. рассмотрены 12 работ и приведены среднесрочные и долгосрочные (3-5 лет) результаты лечения пациентов с остеохондральными дефектами таранной кости площадью больше 1 см2, объемом от 768 до 7054 мм3. Показатель AOFAS в среднем улучшился на 32,47 балла, что расценивалось коллегами как значительное улучшение. Также исследователи отметили преимущество артроско- пической методики хондропластики над открытой в раннем реабилитационном периоде, однако статистически значимой разницы при оценке отдаленных результатов не прослеживалось [55].
Пересадка аутологичных хондроцитов (ACI/MACI)
Впервые эта методика опубликована коллегами из Швеции M. Brittberg и A. Lindahl и была посвящена лечению дефекта гиалинового хряща коленного сустава [56]. Существуют 3 поколения оперативных вмешательств с использованием культивированных хондро- цитов — во всех случаях операция выполняется в два этапа. Первым этапом с ненагружемого суставного хряща берутся хондроциты с последующей культивацией в течение нескольких недель; вторым этапом либо артроскопически, либо открыто производится их введение в зону остеохондрального дефекта [36]. При I поколении операций хондроциты вводились под закрытый надкостничным лоскутом дефект, при II использовалась фибриновая мембрана, при III применялось 3D-культивирование тромбоцитов на биологической матрице (MACI), которая способствует равномерному распределению хондроцитов [57]. К недостаткам стоит отнести двухэтапность лечения и экономическую составляющую методики.
Костная аллопластика
По сравнению с вышеуказанными методиками лечения пациентов с остеохондральными дефектами таранной кости аллопластика позволяет одноэтапно восстановить ее анатомию при крупных поражениях. Одним из самых важных факторов, влияющих на успех операции, является жизнеспособность хондроцитов. Сообщается, что через 14 дней снижается синтез про- теогликанов, что уменьшает вероятность остео- и хондроинтеграции. Негативное влияние на результат также могут оказывать чрезмерные манипуляции с аллотрансплантатом, большие повреждения, плотность костной ткани и многочисленные предыдущие операции [58]. Кроме этого недостатком является трудность подбора донорского материала с учетом индивидуальных особенностей размера блока таранной кости [59].
Данная методика стала весьма популярной за рубежом, так как позволяет одномоментно восстановить архитектонику и суставную поверхность таранной кости при дефектах больших размеров. Однако риски осложнений, связанные с аллотрансплантатом, и техническая сложность заготовки материала делают ее маловоспроизводимой на территории РФ.
Костная аутопластика
Данный метод предложен L. Hangody в 1996 году [60]. Операция выполнялась открыто, артротомия дополнялась остеотомией лодыжки в зависимости от доступа и расположения остеохондрального дефекта. После санации и дебридмента оценивался размер дефекта. Костный трансплантат представлял собой цилиндрические столбики и в оригинальной методике забирался костным заборщиком из ненагружаемой части ипсилатерального мыщелка бедренной кости. При установке костных стобиков в зону дефекта важно располагать аутотрансплантаты не выше суставной поверхности таранной кости. При выполнении мозаичной хондропла- стики также важно устанавливать костные столбики с пресс-фитом и не повредить при размещении нового костного аутотрансплантата уже имеющиеся [60].
Систематический обзор Seow и соавт. 9 исследований с представлением среднесрочных результатов мозаичной хондропластики дефектов таранной кости размерами 135,4 ± 56,4 мм продемонстрировал весьма высокий показатель возвращения пациентов в спорт. В течение 6 месяцев к прежнему уровню спортивной активности вернулись 81,8 % пациентов [61]. С 2008 по 2010 г. наши коллеги выполнили мозаичную хондропласти- ку 18 пациентам, у 14 из них после замещения дефекта боли полностью прекратились или значительно уменьшились, через год результат оценивался по данным опросника AOFAS и составил 88,9 ± 3,6 балла. Одной из негативных составляющих методики является болезненность «донорского места», которая возникает в 3,1 % случаев . Shimozono и соавт. провели метаанализ проблемы «донорского места» на основании 26 работ и 915 операций. Костно-хрящевой аутотрансплантат брался из медиального мыщелка бедренной кости в 19 исследованиях. Общее количество данного осложнения составило от 6,7 до 10,8 % со средним сроком наблюдения 44 месяца; важно учитывать, что пациенты со временем отмечают снижение болезненности в месте забора аутотранспантата
.
В.В. Кузнецов с соавторами предложили брать костный аутотрансплантат из ската пяточной кости и демонстрировали меньший остаточный болевой синдром «донорского места» и большую удовлетворенность пациентов по сравнению с оригинальной методикой
По результатам отечественных и зарубежных коллег очевидно, что после этой процедуры можно ожидать хороших клинических и функциональных результатов в среднесрочной перспективе при низкой частоте неудач.
Несмотря на обнадеживающие результаты и распространенность методики, полноценное восстановление суставной поверхности при мозаичной хондропластике является сложной задачей, особенно при использовании 2 и более костных столбиков. Huntley и соавт. провели микроскопическое исследование мест мозаичной костной аутопластики и отметили, что в 24 % случаев происходит гибель хондро- цитов по периферии столбика аутотрансплантата, а дополнительные 9 % приходятся на промежуток между столбиками. Таким образом, примерно одна треть поверхности мозаичной пластики не состоит из жизнеспособного гиалинового хряща [65].
Фактически от 20 до 40 % дефекта замещается фиброзным хрящом, к тому же при мозаичной хондропласти- ке воссоздание цельной суставной поверхности весьма затруднительно [66]. Использование цельного костно-хрящевого аутотрансплантата сводит к минимуму формирование фиброзно-хрящевой ткани, что является характерной особенностью техники мозаичной аутопластики. Очевидно, что методика мозаичной хондропластики является эффективным способом лечения при крупных остеохондральных дефектах, однако использование 2 и более костных столбиков не позволяет в полной мере восстановить суставную поверхность таранной кости и ее архитектонику, а также хрящевое покрытие таранной кости в долгосрочной перспективе. Повышение жизнеспособности и интеграция трансплантата с восстановлением гиалиноподобной хрящевой поверхности диктует потребность поиска новых методик и модификаций уже существующих, что должно найти свое отражение в улучшении клинических долгосрочных результатов.
При лечении крупных полнослойных дефектов таранной кости мы видим смысл в применении ко- мибинированной методики костной хрящевой аутопластики с укрыванием костных аутотрансплантатов коллагеновой мембраной.
Данная модификация воздействует на две составляющие проблемы: костная аутопластика позволяет восполнить дефект таранной кости, а применение коллагеновой мембраны — получить в месте хондропластики гиалиноподобную хрящевую ткань (рис. 2).
РЕЗУЛЬТАТЫ
Методика мозачиной аутохондро- пластики хорошо и зарекомендовала себя с точки зрения замещения костных дефектов.
Использование индуцированного на матрице хондрогенеза способствует восстановлению гиали- нопообной хрящевой ткани при остеохондральных дефектах более 150 мм2.
Атроскопическое выполнение хондропластики является менее травматичным, нежели открытая хондропластика, и ускоряет реабилитацию, однако при необходимости костной пластики дефекта трудноосуществимо.
Хорошие функциональные коротко- и среднесрочные результаты показала артроскопическая методика микрофрактурирования при дефектах малого размера, а использование культивированных хондроцитов является настоящим прорывом в лечении остеохондральных дефектов, однако двухэтапность и дороговизна делают методику малодоступной в нашей стране.
ЗАКЛЮЧЕНИЕ
Очевидно, что существуют возможности для совершенствования известных методов лечения путем их дополнения, а возможно, и комбинирования. Внедрение новых и модификация уже существующих методик хондропластики ставит перед собой задачу в повышении жизнеспособности и интеграции трансплантата с восстановлением гиалиноподобной хрящевой поверхности, что должно найти свое отражение в улучшении клинических долгосрочных результатов.
ЛИТЕРАТУРА
Zeynalov VT, Shkuro KV. Methods of treatment of osteochondral injuries of the talus (dissecting osteochondritis) at the present stage (literature review). Department of Traumatology and Orthopedics. 2018; 4(34): 24-36. Russian (Зейналов В.Т., Шкуро К.В. Методы лечения остеохондральных повреждений таранной кости (рассекающий остеохондрит) на современном этапе (обзор литературы) //Кафедра травматологии и ортопедии. 2018. № 4(34). С. 24-36.) \
Zengerink M, Szerb I, Hangody L, Dopirak RM, Ferkel RD, van Dijk CN. Current concepts: treatment of osteochondral ankle defects. Foot and Ankle Clinics. 2006; 11(2): 331-359. doi: 10.1016/j.fcl.2006.03.008
Weiss JM, Shea KG, Jacobs JC Jr, Cannamela PC, Becker I, Portman M, et al. Incidence of osteochondritis dissecans in adults. Am J Sports Med. 2018; 46(7): 1592-1595. doi: 10.1177/0363546518764676
Looze CA, Capo J, Ryan MK, Begly JP, Chapman C, Swanson D, et al. Evaluation and management of osteochondral lesions of the talus. Cartilage. 2017; 8(1): 19-30. doi: 10.1177/1947603516670708
Elias I, Jung JW, Raikin SM, Schweitzer MW, Carrino JA, Morrison WB. Osteochondral lesions of the talus: change in MRI findings over time in talar lesions without operative intervention and implications for staging systems. Foot Ankle Int. 2006; 27(3): 157-166. doi: 10.1177/107110070602700301
O'Loughlin PF, Heyworth BE, Kennedy JG. Current concepts in the diagnosis and treatment of osteochondral lesions of the ankle. Am J Sports Med. 2010; 38(2): 392-404.
Shakked RJ, Tejwani NC. Surgical treatment of talus fractures. Orthop Clin North Am. 2013; 44(4): 521-528. doi: 10.1016/j.ocl.2013.06.007
Drogin AR, Kashurnikov YuM, Bakir RA. Aseptic necrosis of the talus. Department of Traumatology and Orthopedics. 2014; 4(12): 24-28. Russian (Дрогин А.Р., Кашурников Ю.М., Бакир Р.А. Асептический некроз таранной кости //Кафедра травматологии и ортопедии. 2014. № 4(12). C. 24-28.)
Flick AB, Gould N. Osteochondritis dissecans of the talus (transchondral fractures of the talus): review of the literature and new surgical approach for medial dome lesions. Foot Ankle. 1985; 5(4): 165-185.
Lomax A, Miller RJ, Fogg QA, Jane Madeley N, Senthil Kumar C. Quantitative assessment of the subchondral vascularity of the talar dome: a cadaveric study. Foot Ankle Surg. 2014; 20(1): 57-60. doi: 10.1016/j.fas.2013.10.005
Mubarak SJ, Carroll NC. Familial osteochondritis dissecans of the knee. Clin Orthop Relat Res. 1979; 140: 131-136.
Raikin SM, Elias I, Zoga AC, Morrison WB, Besser MP, Schweitzer ME. Osteochondral lesions of the talus: localization and morphologic data from 424 patients using a novel anatomical grid scheme. Foot & Ankle International. 2007; 28(2): 154-161. doi: 10.3113/ fai.2007.0154 10.3113
Pick MP. Familial osteochondritis dissecans. J Bone Joint Surg Br. 1955; 37(1): 142-145.
Roden S, Tillegard P, Unanderscharin L. Osteochondritis dissecans and similar lesions of the talus: report of fifty-five cases with special reference to etiology and treatment. Acta OrthopScand. 1953; 23(1): 51-66.
Rungprai C, Tennant JN, Gentry RD, Phisitkul P. Management of osteochondral lesions of the talar dome. Open Orthop J. 2017; 11: 743e761. doi: 10.2174/1874325001711010743
Skoroglyadov AV, Korobushkin GV, Naumenko MV. Analysis of the results of treatment of talus injuries. Russian Medical Journal. 2012; (5): 22-24. Russian (Скороглядов А.В., Коробушкин Г.В., Науменко М.В. Анализ результатов лечения повреждений таранной кости //Российский медицинский журнал. 2012. № 5. С. 22-24.)
Prado MP, Kennedy JG, Raduan F, Nery C. Diagnosis and treatment of osteochondral lesions of the ankle: current concepts. Revista Bra- sileira de Ortopedia (English Edition). 2016; 51(5): 489-500.
McGahan PJ, Pinney SJ. Current concept review: osteochondral lesions of the talus. Foot & Ankle International. 2010; 31(1): 90-101. doi: 10.3113/fai.2010.0090
Berndt AL, Harty M. Transchondral fractures (osteochondritis dissecans) of the talus. J Bone Joint Surg Am. 1959; 41: 988-1020.
Loomer R, Fisher C, Lloyd-Smith R, Sisler J, Cooner T. Osteochondral lesions of the talus. Am J Sports Med. 1993; 21(1): 13-19.
Verhagen RW, Maas M, Dijkgraaf MGW, Tol JL, Krips R, van Dijk CN. Prospective study on diagnostic strategies in osteochondral lesions of the talus. Is MRI superior to helical CT? J Bone Joint Surg Br. 2005; 87(1): 41-46.
Hepple S, Winson IG, Glew D. Osteochondral lesions of the talus: a revised classification. Foot & Ankle International. 1999; 20(12): 789-793. doi: 10.1177/107110079902001206
Schepers T, van Schie-van der Weert EM, de Vries MR, van der Elst M. Foot and ankle fractures at the supination line. Foot (Edinb). 2011; 21(3): 124-128. doi: 10.1016/j.foot.2010.11.008
Chang EY, Tadros AS, Amini B, Bell AM, Bernard SA, Fox MG, et al. ACR Appropriateness Criteria'chronic ankle pain. J Am Coll Radiol. 2018; 15(5S): S26-S38. doi: 10.1016/j.jacr.2018.03.016
Lan T, McCarthy HS, Hulme CH, Wright KT, Makwana N. The management of talar osteochondral lesions - Current concepts. J Ar- throsc Jt Surg. 2021; 8(3): 231-237. doi: 10.1016/j.jajs.2021.04. 002
Ferkel RD, Sgaglione NA, Del Pizzo W, et al. Arthroscopic treatment of osteochondral lesions of the talus: technique and results. Orthop Trans. 1990; 14: 172.
Brittberg M, Winalski CS. Evaluation of cartilage injuries and repair. J Bone Joint Surg Am. 2003; 85e(A Suppl 2): 58e69. doi: 10.210 6/00004623-200300002-00008
Choi GW, Choi WJ, Youn HK, Park YJ, Lee JW. Osteochondral lesions of the talus. The American Journal of Sports Medicine. 2013; 41(3): 504-510. doi: 10.1177/0363546512472976
Anderson IF, Crichton KJ, Grattan-Smith T, Cooper RA, Brazier D. Osteochondral fractures of the dome of the talus. J Bone Joint Surg Am. 1989; 71(8): 1143-1152.Dipaola JD, Nelson DW, Colville MR. Characterizing osteochondral lesions by magnetic resonance imaging. Arthroscopy. 1991; 7(1): 101-104. doi: 10.1016/0749-8063(91)90087-E
Mintz DN, Tashjian GS, Connell DA, Deland JT, O'Malley M, Potter HG. Osteochondral lesions of the talus: a new magnetic resonance grading system with arthroscopic correlation. Arthroscopy. 2003; 19(4): 353-359.
Giannini S, Buda R, Faldini C, Vannini F, Bevoni R, Grandi G, et al. Surgical treatment of osteochondral lesions of the talus in young active patients. J Bone Joint Surg Am. 2005; 87 Suppl 2: 28-41. doi: 10.2106/ JBJS.E.00516
Verhagen RA, Struijs PA, Bossuyt PM, van Dijk CN. Systematic review of treatment strategies for osteochondral defects of the talar dome. Foot Ankle Clin. 2003; 8(2): 233-42, viii-ix. doi: 10.1016/ s1083-7515(02)00064-5
Bruns J, Klima H, Rosenbach B, Lussenhop S. Long-term results after glueing of osteochondral fragments and osteochondrosis dissecans. Langenbecks Arch Chir. 1993; 378(3): 160-166.
Shimozono Y, Yasui Y, Ross AW, Kennedy JG. Osteochondral lesions of the talus in the athlete: up to date review. Curr Rev Musculoskelet Med. 2017; 10(1): 131-140. doi: 10.1007/s12178-017-9393-8
Mei-Dan O, Carmont MR, Laver L, Mann G, Maffulli N, Nyska M. Platelet-rich plasma or hyaluronate in the management of osteochondral lesions of the talus. Am J Sports Med. 2012; 40(3): 534541.
Torgashin AN, Mursalov AK, Rodionova SS, Zagorodniy NV. Features of the treatment of aseptic necrosis of the talus. Clinical Guidelines Project. Genius of Orthopedics. 2021; 27(2): 153-162. Russian (Торгашин А.Н., Мурсалов А.К., Родионова С.С., Загородний Н.В. Особенности лечения асептического некроза таранной кости. Проект клинических рекомендаций //Гений ортопедии. 2021. Т. 27, № 2. C. 153-162.)
Shimozono Y, Brown AJ, Batista JP, Murawski CD, Gomaa M, Kong SW, et al. Subchondral pathology: proceedings of the International Consensus Meeting on Cartilage Repair of the Ankle. Foot Ankle Int. 2018; 39(1 suppl): 48S-53S. doi: 10.1177/1071100718781866
Steele JR, Dekker TJ, Federer AE, Liles JL, Adams SB, Easley ME. Osteochondral lesions of the talus: current concepts in diagnosis and treatment. Foot Ankle Orthopaedics. 2018; 3(3). doi: 10.1177/2473011418779559
Steadman JR, Briggs KK, Rodrigo JJ, Kocher MS, Gill TY, Rod- key WG. Outcomes of microfracture for traumatic chondral defects of the knee: average 11 year follow-up. Arthroscopy. 2006; 19(5): 477-484.
Gerasimov SA, Tenilin NA, Korytkin AA, Zykin AA. Surgical treatment of limited damage to the articular surface: the current state of the issue. Polytrauma. 2016; (1): 63-69. Russian (Герасимов С.А., Тени- лин Н.А., Корыткин А.А., Зыкин А.А. Хирургическое лечение ограниченных повреждений суставной поверхности: современное состояние вопроса //Политравма. 2016. № 1. С. 63-69.)
Ferkel RD, Zanotti RM, Komenda GA, Sgaglione NA, Cheng MS, Applegate GR, et al. Arthroscopic treatment of chronic osteochondral lesions of the talus: long-term results. Am J Sports Med. 2008; 36(9): 1750-1762.
Dahmen J, Lambers KTA, Reilingh ML, van Bergen CJA, Stufkens SAS, Kerkhoffs GMMJ. No superior treatment for primary osteochondral defects of the talus. KneeSurg Sports Traumatol Arthrosc. 2018; 26(7): 2142-2157.
Yang HY, Lee KB. Arthroscopic microfracture for osteochondral lesions of the talus: second-look arthroscopic and magnetic resonance analysis of cartilage repair tissue outcomes. J Bone Joint Surg Am. 2020; 102(1): 10-20.
Qulaghassi M, Cho YS, Khwaja M, Dhinsa B. Treatment strategies for osteochondral lesions of the talus: a review of the recent evidence. Foot (Edinb). 2021; 47: 101805. doi: 10.1016/j.foot.2021.101805
Egiazaryan KA, Lazishvili GD, Khramenkova IV, Shpak MA, Badri- ev DA. Algorithm for surgical treatment of patients with osteochondritis dissecans of the knee. Bulletin of the Russian State Medical Uni
versity. 2018; (2): 77-83. Russian ( Егиазарян К.А., Лазишвили Г.Д., Храменкова И.В., Шпак М.А., Бадриев Д.А. Алгоритм хирургического лечения больных с рассекающим остеохондритом коленного сустава //Вестник Российского государственного медицинского университета. 2018. № 2. С. 77-83.)
Ayyaswamy B, Salim M, Sidaginamale R, Elsayed M, Karpe P, Li- maye R. Early to medium term outcomes of osteochondral lesions of the talus treated by autologous matrix induced chondrogen- esis (AMIC). Foot Ankle Surg. 2021; 27(2): 207-212. doi: 10.1016/j. fas.2020.04.008
Dickschas J, Welsch G, Strecker W, Schoffl V. Matrix-associated autologous chondrocyte transplantation combined with iliac crest bone graft for reconstruction of talus necrosis due to villonodular synovitis. J Foot Ankle Surg. 2012; 51: 87-90.
Weigelt L, Hartmann R, Pfirrmann C, Espinosa N, Wirth SH. Autologous matrix-induced chondrogenesis for osteochondral lesions of the talus: a clinical and radiological 2- to 8-year follow-up study. Am J Sports Med. 2019; 47(7): 1679-1686. doi: 10.1177/0363546519841574
D’Ambrosi R, Villafane JH, Indino C, Liuni FM, Berjano P, Usuel- li FG. Return to sport after arthroscopic autologous matrix-induced chondrogenesis for patients with osteochondral lesion of the talus. Clin J Sport Med. 2019; 29(6): 470-475. doi: 10.1097/ JSM.0000000000000560
Valderrabano V, Miska M, Leumann A, Wiewiorski M. Reconstruction of osteochondral lesions of the talus with autologous spongiosa grafts and autologous matrix-induced chondrogenesis. Am J Sports Med. 2013; 41(3): 519-527. doi: 10.1177/0363546513476671
Walther M, Valderrabano V, Wiewiorski M, Usuelli FG, Richter M, Baumfeld TS, et al. Is there clinical evidence to support autologous matrix-induced chondrogenesis (AMIC) for chondral defects in the talus? A systematic review and meta-analysis.
Foot Ankle Surg. 2021; 27(3): 236-245. doi: 10.1016/j.fas.2020.07.011
Brittberg M, Lindahl A, Nilsson A, Ohlsson C, Isaksson O, Peterson L. Treatment of deep cartilage defects in the knee with autologous chondrocyte transplantation. N. Engl. J. Med. 1994; 331(14): 889-895. doi: 10.1056/NEJM199410063311401
Airapetov GA, Vorotnikov AA, Konovalov EA. Surgical methods of focal hyaline cartilage defect management in large joints (literature review). Orthopaedic Genius. 2017; 23(4): 485-491. doi: 10.18019/1028-4427-2017-23-4-485-491
Merritt G, Epstein J, Roland D, Bell D. Fresh osteochondral allograft transplantation (FOCAT) for definitive management of a 198 square millimeter osteochondral lesion of the talus (OLT): a case report. Foot (Edinb). 2021; 46: 101639.
Kuznetsov VV, Pakhomov IA. Osteochondral lesions of the talus block. Modern approaches to surgical treatment (literature review). Siberian Scientific Medical Journal. 2016; 36(2): 56-61. Russian (Кузнецов В.В., Пахомов И.А. Остеохондральные поражения блока таранной кости, современные подходы к хирургическому лечению (обзор литературы) //Сибирский научный медицинский журнал. 2016. Т. 36, № 2. С. 56-61.)
Hangody L, Kish G, Karpati Z, Szerb I, Udvarhelyi I. Arthroscopic autogenous osteochondral mosaicplasty for the treatment of femoral condylar articular defects. A preliminary report. Knee Surg Sports Traumatol Arthrosc. 1997; 5(4): 262-267.
Seow D, Shimozono Y, Gianakos AL, Chiarello E, Mercer N, Hurley ET, et al. Autologous osteochondral transplantation for osteochondral lesions of the talus: high rate of return to play in the athletic population. Knee Surg Sports Traumatol Arthrosc. 2021; 29(5): 1554-1561. doi: 10.1007/s00167-020-06216-w
Koryshkov NA, Khapilin AP, Khodzhiev AS, Voronkevich IA, Ogary- ov EV, Simonov AB, et al. Mosaic autologous osteochondroplasty in the treatment of local aseptic necrosis of the talus block. Traumatology and Orthopedics of Russia. 2014; 74(4): 90-98. Russian (Корышков Н.А., Хапилин А.П., Ходжиев А.С., Воронкевич И.А., Огарёв Е.В., Симонов А.Б. и др. Мозаичная аутологичная остео- хондропластика в лечении локального асептического некроза блока таранной кости //Травматология и ортопедия России. 2014. Т. 74, № 4. С. 90-98.)
Shimozono Y, Seow D, Yasui Y, Fields K, Kennedy JG. Knee-to-Talus Donor-Site Morbidity Following Autologous Osteochondral Transplantation: A Meta-Analysis with Best-case and Worst-case Analysis. Clin Orthop Relat Res. 2019; 477(8): 1915-1931. doi: 10.1097/ CORR.0000000000000719
Kuznetsov VV, Pakhomov IA, Korochkin SB, Repin AV, Gudi SM. A method of harvesting an osteochondral autograft from the pre-achilles region of the calcaneus. Modern Problems of Science and Education. 2017; 5; 207. Russian (Кузнецов В.В., Пахомов И.А., Короч- кин С.Б., Репин А.В., Гуди С.М. Способ забора остеохондрального аутотрансплантата из преахиллярной области пяточной кости // Современные проблемы науки и образования. 2017. № 5. С. 207.)
Huntley JS, Bush PG, McBirnie JM, Simpson AH, Hall AC. Chondrocyte death associated with human femoral oste- ochondral harvest as performed for mosaicplasty. J Bone Joint Surg Am. 2005; 87(2): 351-360.
Al Shaikh RA, Chou LB, Mann JA, Dreeben SM, Prieskorn D. Autologous osteochondral grafting for talar cartilage defects. Foot Ankle Int. 2002; 23(5): 381-389.
Сведения об авторах:
Очкуренко А.А., д.м.н., профессор, профессор кафедры травматологии и ортопедии, ФГБУ «НМИЦ ТО им. Н.Н. Приорова» Минздрава России, г. Москва, Россия.
Коробушкин Г.В., д.м.н., врач травматолог-ортопед, ФГБУ «НМИЦ ТО им. Н.Н. Приорова» Минздрава России, г. Москва, Россия.
Зейналов В.Т., к.м.н., врач травматолог-ортопед, НКЦ № 2, ФГБНУ «РНЦХ им. акад. Б.В. Петровского», г. Москва, Россия.
Ахмедов Б.Г., д.м.н., врач травматолог-ортопед, ФГБУ «НМИЦ хирургии им. А.В. Вишневского» Минздрава России, г. Москва, Россия.
Чеботарев В.В., врач травматолог-ортопед, ФГБУ «НМИЦ хирургии им. А.В. Вишневского» Минздрава России, г. Москва, Россия.
Стрелка Т.В., врач-ординатор, ФГБУ «НМИЦ ТО им. Н.Н. Приорова» Минздрава России, г. Москва, Россия.
Ельцин А.Г., к.м.н, врач травматолог-ортопед, ФГБУ «НМИЦ ТО им. Н.Н. Приорова» Минздрава России, г. Москва, Россия.
Теги: таранная кость
234567 Начало активности (дата): 18.07.2024 11:39:00
234567 Кем создан (ID): 989
234567 Ключевые слова: остеохондральное поражение; асептический некроз; таранная кость
12354567899
Похожие статьи
Сравнительное исследование погружных вариантов фиксации при артродезировании на поздних стадиях остеоартроза голеностопного суставаРентген на дому 8 495 22 555 6 8
Средне-срочные результаты лечения пациентов с костнохрящевыми дефектами таранной кости с применением костной аутопластики и amic-технологии
Ортопедические осложнения гемипаретических форм церебрального паралича: проблемы нижних конечностей (обзор литературы)
Возможности лечения методом радиочастотной денервации при коксартрозе различных стадий



