 11.07.2024
11.07.2024
Средне-срочные результаты лечения пациентов с костнохрящевыми дефектами таранной кости с применением костной аутопластики и amic-технологии
Остеохондральные дефекты таранной кости - многофакторная проблема, в основе которой лежат патологические изменения хрящевого покрытия и субхондрального слоя таранной кости, что приводит к ухудшению качества жизни и ограничению двигательной активности пациентов
Несмотря на постоянное развитие ортобиологии, лечение полнослойных костно-хрящевых дефектов продолжает оставаться актуальной проблемой для современного ортопедического сообщества. Золотым стандартом лечения дефектов суставной поверхности является стимуляция костного мозга, в частности микрофрактурирование, однако данная методика демонстрирует низкую эффективность и ухудшение результатов с течением времени, особенно при полнослойных костно-хрящевых дефектах более 150 мм2 [2]. При глубине дефекта более 3 мм целесообразно выполнение костной пластики [3].
Наиболее известными методами хондропластики дефектов таранной кости являются костно-хрящевая аллопластика, метод индуцированного на матрице хондро- генеза (Autologous Matrix-Induced Chondrogenesis — AMIC), имплантация хондроцитов [4], мозаичная костная аутопластика [5]. Однако, несмотря на широкий спектр известных методик, при крупных полнослойных повреждениях остеохондральная ауто- и аллотрансплантация являются лучшими вариантами, совмещающими в себе восстановление архитектоники таранной кости и механической прочности [6]. Однако данные подходы не лишены недостатков: так, при мозаичной костной аутопластике от 20 до 40 % дефекта замещается фиброзным хрящом, а воссоздание цельной суставной поверхности может представлять технические сложности [7]. В рамках восстановления хрящевой поверхности хорошо зарекомендовала себя методика AMIC [8].
В нашей работе представлены средне-срочные результаты лечения крупных остеохондральных дефектов таранной кости методом комбинирования костной аутопластики и AMIC-технологии.
Цель исследования — улучшить результаты лечения пациентов с остеохондральными дефектами таранной кости.
МАТЕРИАЛЫ И МЕТОДЫ
В исследование включены 16 пациентов (10 (62,5 %) женщин и 6 (37,5 %) мужчин) в возрасте 20-66 лет (средний возраст — 37 лет), проходившие лечение крупных остеохондральных дефектов таранной кости методом комбинирования костной аутопластики и AMIC-технологии в 2019-2022 годах в 15-м травматолого-ортопедическом отделении ФГБУ «НМИЦ ТО им. Н.Н. Приорова» Минздрава России.
Критерии включения в исследование: пациенты старше 18 лет, имеющие одну или несколько патологий: болезнь Моше-Диаса и другие остеохондропатии таранной кости различной этиологии, готовые соблюдать указания врача относительно назначенной терапии.
Критерии исключения из исследования:
- пациенты моложе 18 лет;
пациенты с дегенеративными изменениями суставного хряща;
соприкасающиеся повреждения суставной поверхности пилона большеберцовой кости и суставной поверхности купола таранной кости;
деформация заднего отдела стопы;
нестабильность голеностопного сустава;
кистозные поражения таранной кости при интактном суставном хряще и субхондральной кости. Средний срок наблюдения составил 15,75 месяца (12-30 месяцев). Травма голеностопного сустава в анамнезе констатирована у 14 (87,5 %) человек.
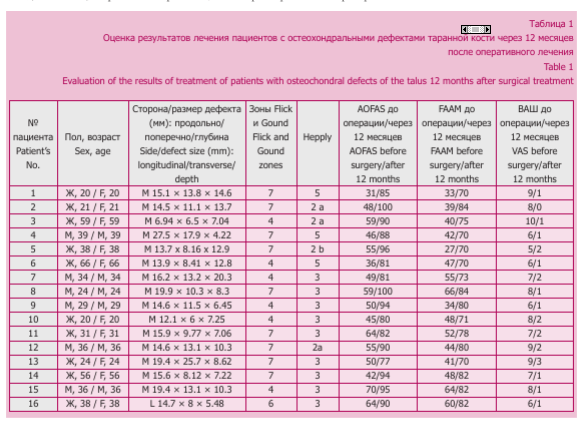
У всех пациентов имелось повреждение хрящевого покрытия таранной кости, у 1 человека глубина дефекта таранной кости составляла менее 5 мм. Всем пациентам с целью определения размеров и локализации остеохондральных дефектов выполнялось МРТ-исследование, по результатам которого размер дефекта в боковой проекции составил 15,4 (6,94-27,5) мм, в прямой проекции — 10,98 (6-25,7) мм, глубина дефекта — 8,93 (3,87-20,3) мм.
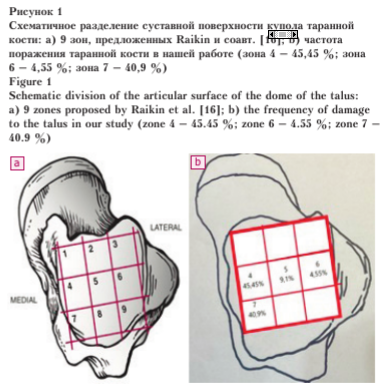
Чаще всего поражались медиальные и задне-медиальные отделы купола таранной кости (зоны 4 и 7). Для выбора доступа к остеохондральному дефекту мы определяли локализацию последнего с помощью системы 9 зон, предложенной Raikin и соавт. [9] (рис. 1).
Всем пациентам в качестве предоперационной подготовки, а также для оценки результатов операции выполнялось МРТ и рентгенологическое исследование голеностопного сустава. Рентгенография голеностопного сустава в прямой и боковой проекциях осуществлялась через 2, 6 и 12 месяцев после операции.
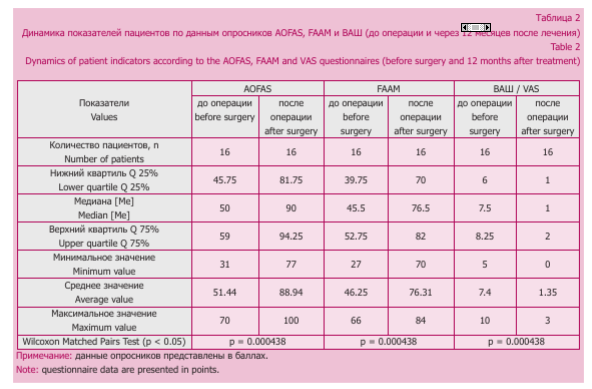
Функциональные показатели оценивались с помощью шкал с балльной оценкой: AOFAS (American Orthopaedic Foot and Ankle Society), FAAM (Foot and Ankle Ability Measure), ВАШ (визуально-аналоговой шкале) — до операции и через 12 месяцев после лечения. По данным опросников, до оперативного лечения средний результат по шкале AOFAS составил 51,44/100 баллов (диапазон — 31-70 баллов), FAAM — 46,25/84 баллов (диапазон 27-66 баллов), ВАШ — 7,4/10 баллов (диапазон 5-10 баллов) (табл. 1).
Динамику Уилкоксона (Wilcoxon Matched показателей оценивали с помо- Pairs Test).
РЕЗУЛЬТАТЫ
Имплантация коллагеновой мембраны с костной аутопластикой выполнена всем 16 пациентам, 15 их них — при глубине дефекта более 5 мм. Костный материал брался из ската пяточной кости, коллагеновая мембрана фиксировалась фибриновым гелем с клеющей способностью. В послеоперационном периоде производилась гипсовая иммобилизации на 6-8 недель, с последующей нагрузкой на оперированную нижнюю конечность.
Результаты исследования представлены в таблице 2. Послеоперационных осложнений, связанных с применяемой методикой, не отмечалось. По данным опросников определялось статистически значимое улучшение функции и качества жизни у всех пациентов (Wilcoxon Matched Pairs Test): по шкале AOFAS — 88,94/100 баллов (диапазон значений 77-100 баллов) (р = 0,000438), FAAM - 76,31/84 баллов (диапазон значений 70-84 баллов) (р = 0,000438), ВАШ — 1,35/10 баллов (диапазон значений 0-3 балла) (p = 0,000438). К прежней активности вернулись 15 (93,75 %) пациентов, у 1 человека отмечалась болезненность в месте забора донорской кости (см. № 13 в табл. 1).
Клиническое наблюдение
Пациент П. 24 лет (см. № 8 в табл. 1) в 2019 году получил перелом наружной лодыжки, осуществлялось консервативное лечение. В 2021 году больной обратился с жалобами на боли в голеностопном суставе, занимался любительским спортом (посещал тренажерный зал).
При поступлении по данным опросников: AOFAS — 59 баллов, FAAM — 66 баллов, ВАШ — 8 баллов. Пациенту было выполнено рентгенологическое и МРТ-иссле- дование голеностопного сустава (рис. 2).
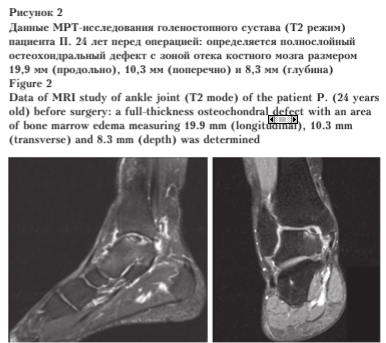
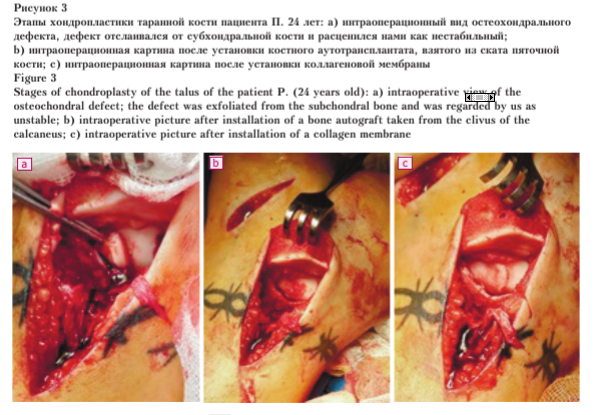
Выполнена операция: костная аутопластика дефекта таранной кости с применением AMIC-технологии (патент РФ № 2766042 «Способ хирургического замещения полнослойных костно-хрящевых дефектов суставной поверхности таранной кости с хондропатией и асептическим некрозом») (рис. 3).
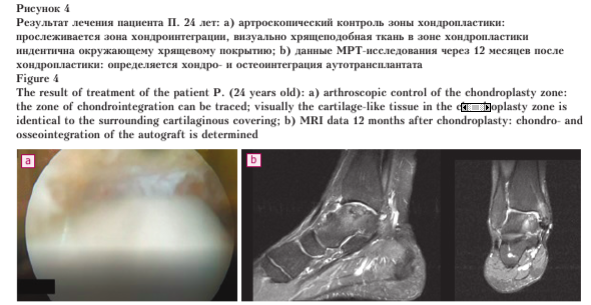
Через 6 месяцев после хондро- пластики пациенту выполнена ар- троскопическая визуализация зоны хондропластики таранной кости и удаление металлофиксаторов из медиальной лодыжки (в связи с дискомфортом в проекции металлофиксаторов) (рис. 4). По данным опросников ВАШ — 1/10 баллов, AOFAS (задний отдел стопы) — 100/100 баллов, FAAM — 84/84 баллов, пациент отмечал значительное улучшение качества жизни за последний год, вернулся к занятиям в тренажерном зале.
ОБСУЖДЕНИЕ
Доступ к таранной кости
Доступ, сопровождающийся остеотомией, получил свою популярность вместе с внедрением костно-хрящевой мозаичной пластики крупных дефектов. Методика медиальной остеотомии является самым распространенным вариантом доступа к медиальному отделу купола таранной кости. Данный метод позволяет осуществить полноценную экспозицию и костную пластику в случае крупных полнослойных остеохондральных дефектов [10]. При наличии остеохондрального дефекта в латеральном отделе суставной поверхности купола таранной кости основными подходами являются релиз ATFL (с последующим восстановлением ATFL) и остеотомия малоберцовой кости. Релиз передней таранно-малоберцовой связки позволяет визуализировать передне-латеральный отдел таранной кости.
Несмотря на большую травма- тичность, остеотомия наружной лодыжки позволяет осуществить полноценную экспозицию латеральных отделов купола таранной кости [11]. Так, G. Padiolleau и соавт. провели оценку результатов лечения 183 пациентов, из которых 86 выполнялась в рамках доступа остеотомия лодыжки при мозаичной костной аутопластике (65 остеотомий медиальной лодыжки и 21 остеотомия латеральной лодыжки). Остальным пациентам с меньшими дефектами выполнялось артроскопическое микрофрактури- рование. Существенной разницы в клинических исходах у пациентов с остеотомией и без нее не было. Коллеги отметили безопасность данной процедуры при точной репозиции и адекватной фиксации.
Несмотря на ее инвазивный характер, выполнение остеотомии не связано с увеличением числа осложнений и является методом выбора при костной аутопластике крупных дефектов таранной кости [12].
В нашем исследовании у 15 из 16 пациентов (93,75 %) выполнялся медиальный доступ с остеотомией медиальной лодыжки, у 1 (6,25 %) пациента (см. № 16 в табл. 1) — латеральный доступ с остеотомией латеральной лодыжки с сохранением передней таранно-малоберцовой связки. Осложнений, связанных с выполнением остеотомии, в исследовании не отмечалось. Важной составляющей успешного результата является восстановление анатомии голеностопного сустава посредством анатомичной репозиции остеотомии и надежной фиксациФиксация мембраны: нитки / клей Важным вопросом хондрогене- за является адекватное накопление мезенхимальных клеток, что возможно только при стабильной фиксации коллагеновой матрицы. J.E. Bekkers и соавт. провели ка- даверное исследование, в котором тестировалась прочность фиксации коллагеновой матрицы на коленном суставе, фиксация осуществлялась несколькими способами: биодиградируемыми пинами, фибриновым клеем и подшиванием мембраны. Коллеги проводили оценку фиксации после 150 циклов сгибания-разгибания в коленном суставе.
По результатам исследования наименьшее повреждение мембраны наблюдалось при фиксации мембраны фибриновым клеем. При использовании остальных способов фиксации констатированы частичные или полнослойные повреждения мембраны. В данном исследовании фибриновый клей уступал в первичной фиксации подшиванию мембраны, однако стоит отметить, что он является биологическим герметиком и его эффективность ex vivo может быть ниже. К тому же, как отметили сами исследователи, в работе использовалась более жесткая мембрана, чем в клинической практике, что, по их мнению, также может оказывать влияние на фиксацию фибриновым клеем. Таким образом, фибриновый клей обеспечивает лучшую целостность мембраны во время движения при условии хорошей фиксации. Остальные способы фиксации оказывали большее травмирующее воздействие на мембрану [13].
В нашем исследовании во всех клинических случаях коллагеновая мембрана фиксировалась с помощью фибринового геля с клеющей способностью, у 5 из 16 пациентов он изготавливался с помощью добавления в PRP глюконата кальция, в остальных случаях использовался фибриновый клей от производителя мембраны. Разницы в фиксации мембраны по данным артроскопического контроля мы не обнаружили.
Место забора трансплантата / проблема болезненности донорского места
Остеохондральная аутопластика является одним из основных методов лечения полнослойных остеохондральных дефектов таранной кости. Однако проблема болезненности донорского места негативно сказывается на общей удовлетворенности пациентов результатом лечения [14]. Y. Shimozono и со- авт. проанализировали результаты 26 работ, в которых описывается проблема «донорского места». Костно-хрящевой аутотрансплантат брался из мыщелка бедренной кости в 19 исследованиях. Общее количество данного осложнения составило от 6,7 до 10,8 % [14]. Предложенный В.В. Кузнецовым и со- авт. способ забора остеохондрального аутотрансплантата позволяет уменьшить проблему «донорского места» путем взятия костного трансплантата из предахиллярной области пяточной кости [15].
В нашем исследовании использовался костный аутотрансплантат из ската пяточной кости, у 3 из 16 пациентов отмечался дискомфорт в медиальном отделе заднего отдела стопы через 6 месяцев после хондропластики. Через 12 месяцев остаточный болевой синдром сохранился у 1 пациента, который не ограничивал повседневной двигательной активности.
Сравнение результатов лечения
F.G. Usuelli и соавт. продемонстрировали 2-годичные результаты лечения пациентов с остеохондральными дефектами таранной кости у 20 пациентов. Средний размер дефекта составил 111,1 ± 43,2 мм2, AOFAS до операции — 57,1 ± 14,9 балла, после — 86,6 ± 10,9 балла, ВАШ до — 8,1 ± 1,4, после — 2,2 ± 2,2 балла, 16 из 19 пациентов вернулись к своей спортивной активности, как до операции [16].
В нашем исследовании получен аналогичный результат: по опроснику AOFAS - 88,94/100 (77-100) баллов, FAAM - 76,31/84 (70-84) баллов, ВАШ — 1,35/10 (0-3) баллов.
ЗАКЛЮЧЕНИЕ
Предложенная комбинированная модифицированная методика AMIC является многообещающим новым методом оперативного лечения пациентов с остеохондральными дефектами таранной кости. Совершенствование хирургической техники и понимания анатомии повреждения таранной кости ведут к поиску и новых подходов к лечению, которые по своей сути направлены на снижение травма- тичности операции и сокращению сроков реабилитации.
Хорошие клинические результаты, данные рентгенограмм, МРТ, артроскопическая картина были получены через 12 месяцев после проведения операции. В большинстве своем пациенты вернулись к прежней двигательной активности, в том числе и спортивной.
Данная методика является доступной, воспроизводимой и экономически эффективной. Однако отсутствие долгосрочных групповых исследований и литературных обзоров не дает однозначного ответа на вопрос о большей клинической эффективности новых методов по сравнению с традиционными. Проведение дальнейших исследований с большим количеством пациентов и более долгим сроком наблюдения позволит сравнить эффективность предложенной методики хондро- пластики с традиционно используемыми методами оперативного лечения пациентов с остеохондральными дефектами таранной кости.
ЛИТЕРАТУРА
Looze CA, Capo J, Ryan MK, Begly JP, Chapman C, Swanson D, et al. Evaluation and management of osteochondral lesions of the talus. Cartilage. 2017; 8(1): 19-30.
Cunningham DJ, Adams SB. Arthroscopic treatment of osteochondral lesions of the talus with microfracture and platelet-rich plasma-infused micronized cartilage allograft. Arthroscopy Techniq. 2020; 9(5): e627ee637.
Rothrauff BB, Murawski CD, Angthong C, Becher C, Nehrer S, Niemey- er P, et al. Scaffold-based therapies: proceedings of the international consensus meeting on cartilage repair of the ankle. Foot Ankle Int. 2018; 39(1suppl): 41S-47S.
Steele JR, Dekker TJ, Federer AE, Liles JL, Adams SB, Easley ME. Osteochondral lesions of the talus: current concepts in diagnosis and treatment. Foot Ankle Orthopaedics. 2018; 3(3)
Hangody L, Kish G, Modis L, Szerb I, Gaspar L, Dioszegi Z, Kendik Z. Mosaicplasty for the treatment of osteochondritis dissecans of the talus: two to seven year results in 36 patients. Foot Ankle Int. 2001; 22(7): 552-558.
Wang CC, Yang KC, Chen IH. Current treatment concepts for osteochondral lesions of the talus. Tzu Chi Med J. 2020; 33(3): 243-249.
Al Shaikh RA, Chou LB, Mann JA, Dreeben SM, Prieskorn D. Autologous osteochondral grafting for talar cartilage defects. Foot Ankle Int. 2002; 23(5): 381-389.
Walther M, Valderrabano V, Wiewiorski M, Usuelli FG, Richter M, Baumfeld TS, et al. Is there clinical evidence to support autologous matrix-induced chondrogenesis (AMIC) for chondral defects in the talus? A systematic review and meta-analysis. Foot Ankle Surg. 2021; 27(3): 236-245.
Elias I, Zoga AC, Morrison WB, Besser MP, Schweitzer ME, Raikin SM. Osteochondral lesions of the talus: localization and morphologic data from 424 patients using a novel anatomical grid scheme. Foot Ankle Int. 2007; 28(2): 154-161. doi: 10.3113/FAI.2007.0154
Sadlik B, Kolodziej L, Puszkarz M, Laprus H, Mojzesz M, Whyte GP. Surgical repair of osteochondral lesions of the talus using biologic inlay osteochondral reconstruction: clinical outcomes after treatment using a medial malleolar osteotomy approach compared to an arthroscopically-assisted approach. Foot and Ankle Surgery. 2019; 25(4): 449-456. doi: 10.1016/j.fas.2018.02.010
Mayne AIW, Lawton R, Reidy MJ, Harrold F, Chami G. A comparison of surgical exposures for posterolateral osteochondral lesions of the talar dome. Foot and Ankle Surgery. 2018; 24(2): 107-109. doi: 10.1016/j.fas.2016.11.012
Padiolleau G, Amouyel T, Barbier O, De L'Escalopier N, Cordier G, Baudrier N, et al. Safety of malleolar osteotomies in surgery for osteochondral lesions of the talus. Orthop TraumatolSurg Res. 2021; 107(8S): 103070. doi: 10.1016/j.otsr.2021.103070
Bekkers JE, Tsuchida AI, Malda J, Creemers LB, Castelein RJ, Saris DB, et al. Quality of scaffold fixation in a human cadaver knee model. Osteoarthritis Cartilage. 2010; 18(2): 266-272. doi: 10.1016/j.joca.2009.09.001
Shimozono Y, Seow D, Yasui Y, Fields K, Kennedy JG. Knee-to-talus donor-site morbidity following autologous osteochondral transplantation: a meta-analysis with best-case and worst-case analysis. Clin Orthop Relat Res. 2019; 477(8): 1915-1931.
Kuznetsov VV, Pakhomov IA, Korochkin SB, Repin AV, Gudi SM. The method of taking osteochondral autograft from the preahil- lar region of the calcaneus. Modern of science and education. 2017; (5): 207. Russian (Кузнецов В.В., Пахомов И.А., Корочкин С.Б., Репин А.В., Гуди С.М. Способ забора остеохондрального аутотрансплантата из предахиллярной области пяточной кости //Современные проблемы науки и образования. 2017. № 5. С. 207.)
Информация об авторах:
Очкуренко А.А., д.м.н., профессор, профессор кафедры травматологии и ортопедии ФГБУ «НМИЦ ТО им. Н.Н. Приорова» Минздрава России; вице-президент Ассоциации травматологов-ортопедов России, г. Москва, Россия. ORCID: 0000-0002-1078-9725. eLibrary SPIN: 8324-2383
Коробушкин Г.В., д.м.н., врач-травматолог-ортопед, заведующий 15-м травматолого-ортопедическим отделением ФГБУ «НМИЦ ТО им. Н.Н. Приорова» Минздрава России, г. Москва, Россия. ORCID: 0000-0002-9960-2911. eLibrary SPIN: 9715-1063
Ахмедов Б.Г., д.м.н., врач-травматолог-ортопед, заведующий отделением ортопедии и артрологии ФГБУ «НМИЦ хирургии им. А.В. Вишневского» Минздрава России, г. Москва, Россия. ORCID: 0000-0002-9041-9539. eLibrary SPIN: 4582-5685.
Чеботарев В.В., врач-травматолог-ортопед отделения ортопедии и артрологии ФГБУ «НМИЦ хирургии им. А.В. Вишневского» Минздрава России. ORCID: 0009-0001-6483-3162
Милица И.М., врач-травматолог-ортопед 14-го отделения, аспирант кафедры травматологии и ортопедии ФГБУ «НМИЦ ТО им. Н.Н. Приорова» Минздрава России. ORCID 00909-0005-9832-316Х. eLibrary SPIN: 4015-8113
Теги: таранная кость
234567 Начало активности (дата): 11.07.2024 19:46:00
234567 Кем создан (ID): 989
234567 Ключевые слова: остеохондральный дефект таранной кости; хондропла- стика таранной кости; коллагеновая мембрана; мозаичная хондропластика
12354567899
Похожие статьи
Ортопедические осложнения гемипаретических форм церебрального паралича: проблемы нижних конечностей (обзор литературы)Рентген на дому 8 495 22 555 6 8
Оценка эффективности вариантов артродезирования голеностопного сустава
Возможности лечения методом радиочастотной денервации при коксартрозе различных стадий
Ревизионные оперативные вмешательства после артродезирования голеностопного сустава с фиксацией ретроградным интрамедуллярным стержнем на фоне осложнений механического происхождения



