 12.01.2024
12.01.2024
Замещение костного дефекта таранной кости аутотрансплантатом, взятым из пяточной кости, с применением AMIC-технологии: клинический случай
Вопрос выбора тактики лечения полнослойных остеохондральных дефектов таранной кости до сих пор является актуальным
Введение
Остеохондральные дефекты таранной кости составляют 4% от всех повреждений суставного хряща [1]. В 75% случаев причиной возникновения остеохондральных дефектов таранной кости является травма, как правило, рецидивирующий подвывих в голеностопном суставе [2]. Чаще всего за помощью обращаются люди молодого трудоспособного возраста и пациенты, повседневная деятельность которых сопряжена с повышенной двигательной активностью и спортом [3, 4, 5]. Лечение данной патологии обусловлено сложностью диагностики: неспецифическая клиническая картина, проявляющаяся болью в голеностопном суставе, малоинформативность рентгенографии на ранних стадиях заболевания. Около 30-43% повреждений на рентгенограммах не идентифицируются, а длительная симптоматическая терапия, не дополненная этиотропной, приводит к прогрессированию заболевания и формированию полнослойного остеохондрального дефекта [6, 7].
При хирургическом лечении остеохондральных дефектов широко используются артроскопи- ческие остеоперфоративные методики, которые минимизируют повреждения мягких тканей и костных структур [8, 9, 10]. Результат данного воздействия — образование в области дефекта хрящевого регенерата, напоминающего фиброзный хрящ, который по своим биомеханическим характеристикам уступает гиалиновому хрящу [10, 11, 12]. Решением проблемы восстановления хрящевого покрытия может быть применение методики культивирования аутологичных хондроцитов и AMIC-технологии [13].
В 2006 г. P. Behrens с соавторами впервые применили для лечения остеохондральных дефектов коленного сустава коллагеновые мембраны [14]. M. Wiewiorski с соавторами описали модифицированную методику AMIC (autologous matrix-induced chondrogenesis, в русскоязычной литературе — хондрогенез, индуцированный аутологической матрицей) для лечения пациентов с остеохондральными дефектами таранной кости. Для восстановления архитектоники таранной кости зарубежные коллеги использовали спонгиозный костный аутотрансплантат, костная пластика дополнялась коллагеновой мембраной [15].
Мы адаптировали и модифицировали методику, предложенную К.А. Егиазаряном с соавторами для лечения болезни Кёнига, которая заключалась в выполнении мозаичной костной аутохондропластики с применением технологии AMIC и последующим артроскопическим контролем [16]. Нами разработан способ замещения полнослойных костно-хрящевых дефектов суставной поверхности таранной кости, заключающийся в применении комбинированной костной аутопластики с использованием AMIC-технологии (патент РФ № 2766042).
Цель исследования — на клиническом примере продемонстрировать возможности костной аутопластики в сочетании с технологией AMIC при лечении полнослойного костно-хрящевого дефекта таранной кости.
Описание клинического случая
Пациент 34 лет без сопутствующей патологии в 2011 г. получил травму голеностопного сустава во время занятий спортом в тренажерном зале, после чего его начали беспокоить постоянные боли ноющего характера и отечность в области голеностопного сустава. Консервативная терапия (НПВП и хондропротекторы) не дала положительного эффекта.
Боли усиливались при физической нагрузке, что делало невозможной прежнюю физическую активность.
Болевой синдром усилился в 2020 г. Пациент обратился в НМИЦ ТО им. Н.Н. Приорова. Состояние пациента при поступлении в клинику: ВАШ — 6 баллов, AOFAS-AHS (American Orthopedic Foot and Ankle Society scale — Ankle Hindfoot Scale) [17] — 49 баллов, FAAM (Foot and Ankle Ability Measure) [18] — 55 баллов.
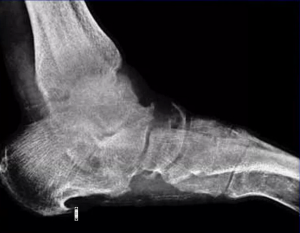
Было выполнено МРТ левого голеностопного сустава: прослеживался гетерогенный сигнал в медиальном отделе купола таранной кости, выявлены хондромаляция суставной поверхности, перестройка костной ткани медиального отдела таранной кости. В области медиального купола таранной кости определялся остеохондральный дефект размерами 16,4x9,4x20,8 мм (рис. 1).
Хирургическое вмешательство. В условиях проводниковой анестезии, в положении пациента на левом боку с турникетом на нижней трети бедра, выполнен доступ к медиальной лодыжке. С применением шевронной остеотомии медиальной лодыжки осуществлен доступ к остеохондральному дефекту медиального отдела купола таранной кости. При ревизии определялся измененный хрящ, который легко отделился от подлежащей кости с формированием остеохондрального дефекта 16,4x9,4 мм. Объем удаленного материала определялся по результатам предоперационного планирования, основанного на данных МР
Измененная костно-хрящевая ткань удалена (рис. 2).
Далее из ската пяточной кости (дорзальная поверхность пяточной кости между задней суставной фасеткой пяточной кости и предахиллярной областью пяточной кости) забирался структурный костный аутотрансплантат, объем которого соответствовал объему удаленной костной ткани из таранной кости. Методом press-fit костный аутотрансплантат установлен в сформированное ложе таранной кости. Для получения макета дефекта использовался шаблон из стерильной алюминиевой фольги. Модель из фольги соответствовала площади дефекта таранной кости и полностью покрывала костный аутотрансплантат, после чего подготовленная коллагеновая мембрана (Ортософт, Россия), предварительно увлажненная фибриновым гелем с клеющей способностью (Криофит, Россия) устанавливалась на костный аутотрансплантат. Остеотомированный фрагмент медиальной лодыжки фиксирован двумя винтами, раны послойно ушиты.
Для придания покоя оперированной конечности и профилактики развития эквинусного положения стопы выполнена ее иммобилизация гипсовой повязкой. Рекомендации: ходьба на костылях без нагрузки на оперированную нижнюю конечность в течение 8 нед. с последующим переходом на ортез и началом дозированной нагрузки, активная разработка движений в голеностопном суставе. Переход на полную нагрузку через 8 нед. после операции.
На осмотре через 6 мес. отмечена положительная динамика: уровень боли по ВАШ снизился до 2 баллов, оценка по AOFAS-AHS — 90 баллов, по FAAM — 84 балла.
Проведена артроскопия голеностопного сустава с целью контроля результата костно-хрящевой аутохондропластики с применением AMIC-технологии. Артроскопия осуществлялась через стандартные переднелатеральный и переднемедиальный порты. В связи с наличием дискомфорта в проекции металлофиксаторов выполнено их удаление. Выявлены рубцовые ткани в передних отделах голеностопного сустава, которые были удалены. При визуализации места хондропласти- ки определялось формирование гиалиноподобной хрящевой ткани, архитектоника суставной поверхности таранной кости сохранена (рис. 4).
Через 12 мес. выполнено контрольное МРТ- исследование: определяются консолидация зоны остеотомии, перестройка аутотрансплантата в зоне дефекта таранной кости и формирование хрящевого покрытия (рис. 5).
Через 12 мес. после хондропластики объем движений в голеностопном суставе восстановлен в полном объеме. Пациент вернулся к занятиям любительским спортом. После удаления металлофиксаторов пациент отметил снижение болевого синдрома. Состояние по данным опросников через 12 мес.: ВАШ — 1 балл, AOFAS-AHS — 94 балла, FAAM — 83 балла.
Возможности лечения полнослойных остеохондральных дефектов таранной кости ограничены — единственным способом восстановления архитектоники таранной кости является костная пластика [19, 20]. При крупных дефектах (более 1,5 см2) для восстановления архитектоники таранной кости широко применяется костная ауто- и аллопластика [5, 15].
Несмотря на хорошие клинические результаты при
лечении крупных дефектов, при мозаичной костной аутопластике от 20 до 40% дефекта
замещается фиброзным хрящом. . Changи E. Lencznerотметили, что при мозаичной хондро-
пластике (нескольких костных столбиков) восстановление однородного хрящевого
покрытия таранной кости весьма затруднительно [21]. По данными N. Kodamaс
соавторами, суставная поверхность при выполнении мозаичной хондропластики, в
частности пространство между костными столбиками, преимущественно представлено
фиброзной тканью [22].
Использование цельного аллотрансплантата позволяет восстановить архитектонику таранной кости, минимизируя развитие фиброзной ткани [23]. Наиболее частым осложнением является костная резорбция, сопровождающаяся замедленной консолидацией или ее отсутствием и проседанием трансплантата, а в редких случаях — трансплан- тат-ассоциированная инфекция [24]. По данным послеоперационных МРТ-исследований, чаще наблюдается костная резорбция на границе «аллотрансплантат — здоровая кость», нежели «аутотрансплантат — здоровая кость» [15].
Создание костного «каркаса» с помощью аутотрансплантатов является одной из приоритетных задач в лечении пациентов с полнослойными остеохондральными дефектами, однако восстановление хрящевого покрытия играет немаловажную роль в долгосрочной перспективе. Использование коллагеновой мембраны для покрытия костного аутотрансплантата позволяет концентрировать большое количество мезенхимальных клеток и воссоздать цельное хрящевое покрытие, состоящее из гиалиноподобной хрящевой ткани [25]. Фиксация мембраны с помощью фибринового геля с клеющей способностью может способствовать хондрогенной дифферен- цировке мезенхимальных стволовых клеток [26], чем мы и руководствовались при выборе метода фиксации мембраны.
F. Migliorini с соавторами склоняются к возрастному ограничению имплантации аутологичных культивированных хондроцитов для восстановления хрящевого покрытия, так как пациенты в возрасте 30-33 лет демонстрируют лучшие результаты по сравнению с более старшей возрастной группой. При использовании технологии AMIC данная тенденция не прослеживалась. Поэтому авторы пришли к выводу о том, что эта методика может применяться в старших возрастных группах пациентов с дефектами таранной кости. К тому же одноэтапность и стоимость данной процедуры в отличие от методики культивирования хондро- цитов (забор и культивирование хондроцитов в лабораторных условиях с последующей имплантацией) являются немаловажными преимуществами как для пациентов, так и для хирургов [13, 27].
В клиническом наблюдении, представленном M. Wiewiorski с соавторами, описана комбинированная методика лечения крупного дефекта таранной кости, которая состоит из замещения дефекта аутотрансплантатом, взятым из гребня подвздошной кости, с применением коллагеновой мембраны. Крупный нестабильный остеохондральный дефект площадью около 3 см2 был удален в пределах здоровых тканей, выполнена стимуляция костного мозга с использованием ретроградного микро- дриллинга, затем в зону дефекта уложена костная крошка, взятая из гребня подвздошной кости [15]. Как и в нашем случае, коллагеновую мембрану фиксировали к костному аутотрансплантату фибриновым клеем.
В экспериментальной работе Г.Д. Лазишвили с соавторами провели сравнение эффективности коллагеновых мембран Ортософт (Россия) и Chondro-Gide (Германия). Мембрана Ортософт сформирована методом электроспиннинга из нановолокон диаметром 300-500 нм, состоящих из смеси полилактида и бычьего коллагена I типа. Мембрана Chondro-Gide изготовлена из свиного коллагена I и III типов. В случае применения композитной мембраны Ортософт весьма показательны следующие моменты. Во-первых, образование хрящевой ткани в процентном соотношении заметно выше; во-вторых, ярко выражены островки хрящевой ткани в центре дефекта по всей его толщине, скорость репарации клеток выше, что и является причиной большего объема хрящевой ткани, в отличие от зоны имплантации мембраны Chondro-Gide, где выявлялся только «краевой» неохондрогенез. Во всех случаях хрящевая ткань при неохондрогенезе была представлена гиалиновым хрящом. Таким образом, проведенное исследование подтвердило эффективность применения коллагеновых мембран для регенерации хрящевой ткани. Эксперимент показал, что композитная мембрана Ортософт не уступает, а в ряде случаев и превосходит эффективность мембраны Chondro- Gide [25].
Для профилактики формирования субхондральных кист предпочтительнее использовать структурный аутотрансплантат с прочной посадкой, нежели спонгиозную крошку [28]. В нашей работе аутотрансплантат мы брали в виде костных столбиков и имплантировали в место дефекта методом press-fit по аналогии с техникой хондро-пластики по Hangody.
В оригинальной методике L. Hangody было предложено выполнение «мозаичной» аутохондропластики, где костный трансплантат брался из ненагружаемой области мыщелка бедренной кости [29]. К преимуществам забора трансплантата из данной области относится возможность восполнения крупных дефектов костным аутотрансплантатом, покрытым хрящевой тканью. Отрицательной стороной способа является возникновение болевого синдрома в донорском месте [30]. В.В. Кузнецов с соавторами предложили брать костный аутотрансплантат из предахил- лярной области пяточной кости, что обеспечивает меньший остаточный болевой синдром «донорского места» и большую удовлетворенность пациентов по сравнению с оригинальной методикой [31]. В нашем клиническом случае мы брали костный аутотрансплантат из ската пяточной кости, и болевого синдрома через 12 мес. после операции не наблюдалось. Однако методика AMICс остеотомией лодыжки при доступе к остеохондральному дефекту таранной кости не лишена недостатков. Так, зарубежные коллеги сообщают об основном осложнении, связанном не столько с самой методикой, сколько с фиксацией остеотомированной лодыжки винтами — это жалобы пациентов на наличие дискомфорта в проекции металлофиксаторов [32]. Именно поэтому мы считаем целесообразным удалять металлофиксаторы, но не ранее чем через полгода после операции. Артроскопическая санация с обзором места хондропластики в совокупности с МРТ-исследованием позволяют визуально оценить хрящеподобное покрытие зоны хондропластики и его идентичность с окружающим хрящевым покрытием таранной кости.
Заключение
При полнослойном остеохондральном дефекте таранной кости оптимальным методом лечения является замещение остеохондрального дефекта костным аутотрансплантатом.
Данный способ является одним из самых доступных, воспрозводимых, а «мозаичная» имплантация костных аутотрансплантатов позволяет замещать дефекты различных размеров и формы.
В представленном клиническом наблюдении применение костного аутотрансплантата позволило восполнить дефект таранной кости, а укрытие аутотрансплантата коллагеновой мембраной способствовало формированию в зоне дефекта гиалиноподобной хрящевой ткани, визуально идентичной окружающему хрящевому покрытию таранной кости. Несмотря на положительный результат лечения, невозможно сделать вывод о преимуществе метода лечения на основании одного клинического наблюдения. Необходимы более масштабные исследования нового метода лечения и его сравнение с уже существующими.
1. DeBerardino T.M., Arciero R.A., Taylor D.C. Arthroscopic treatment of soft tissue impingement of the ankle in athletes. Arthroscopy. 1997;13(4):492-498. doi: 10.1016/s0749-8063(97)90129-8.
2. Rikken O.G.H., Kerkhoffs G.M.M.J. Osteochondral Lesions of the Talus: An Individualized Treatment Paradigm from the Amsterdam Perspective. Foot Ankle Clin. 2021;26(1):121-136. doi: 10.1016/j.fcl.2020.10.002
3. Shimozono Y., Yasui Y., Ross A.W., Kennedy J.G. Osteochondral lesions of the talus in the athlete: up to date review. CurrRevMusculoskeletMed. 2017;10(1):131- 140. doi: 10.1007/s12178-017-9393-8.
4. Lan T., McCarthy H.S., Hulme C.H., Wright K.T., Makwana N. The management of talar osteochondral lesions — Current concepts. J Arthrosc Jt Surg. 2021;8(3):231-237. doi: 10.1016/j.jajs.2021.04.002.
5. Giannini S., Buda R., Faldini C., Vannini F., Bevoni R., Grandi G. et al. Surgical treatment of osteochondral lesions of the talus in young active patients. J Bone Joint Surg Am. 2005;87 Suppl 2:28-41. doi: 10.2106/JBJS.E.00516.
6. Verhagen R.A., Maas M., Dijkgraaf M.G.W., Tol J.L., Krips R., van Dijk C.N. Prospective study on diagnostic strategies in osteochondral lesions of the talus. Is MRI superior to helical CT? J Bone Joint Surg Br. 2005;87(1):41-46.
7. Hepple S., Winson I.G., Glew D. Osteochondral Lesions of the Talus: A Revised Classification. Foot Ankle Int 1999;20(12):789-793.
8. Зейналов В.Т., Шкуро К.В. Методы лечения остеохондральных повреждений таранной кости (рассекающий остеохондрит) на современном этапе (обзор литературы). Кафедра травматологии и ортопедии. 2018;4(34):24-36. doi: 17238/issn2226-2016.2018.4.24-36.
9. Айрапетов Г., Воротников А., Коновалов Е. Методы хирургического лечения локальных дефектов гиалинового хряща крупных суставов (обзор литературы). Гений ортопедии. 2017;23(4):485-491. doi: 10.18019/1028-4427-2017-23-4-485-491.
10. Choi W.J., Park K.K., Kim B.S., Lee J.W. Osteochondral Lesion of the Talus. Am J Sports Med. 2009;37(10): 1974-1980. doi: 10.1177/0363546509335765.
11. Yang H.Y., Lee K.B. Arthroscopic Microfracture for Osteochondral Lesions of the Talus: Second-Look Arthroscopic and Magnetic Resonance Analysis of Cartilage Repair Tissue Outcomes. J Bone Joint Surg Am. 2020;102(1):10-20. doi: 10.2106/JBJS.19.00208.
12. Герасимов С.А., Тенилин Н.А., Корыткин А.А., Зыкин А.А. Хирургическое лечение ограниченных повреждений суставной поверхности: современное состояние вопроса. Политравма. 2016;(1):63-69. Gerasimov S.A., Tenilin N.A., Korytkin A.A., Zykin A.A. Surgical treatment of localized injuries to articular surface: the current state of the issue. Polytrauma. 2016;(1):63-69. (In Russian).
13. Migliorini
F., Maffulli N., Eschweiler J., Gotze C., Hildebrand F., Betsch M. Prognostic
factors for the management of chondral defects of the knee and ankle joint: a
systematic review. Eur J Trauma Emerg Surg. 2023;49(2):723-745.
14. Behrens P., Bitter T., Kurz B., Russlies M. Matrix- associated autologous chondrocyte transplantation/ implantation (MACT/MACI) — 5-year follow-up. Knee. 2006;13(3):194-202. doi: 10.1016/j.knee.2006.02.012.
15. Wiewiorski M., Barg A., Valderrabano V. Autologous matrix-induced chondrogenesis in osteochondral lesions of the talus. Foot and Ankle Clinics. 2013;18(1): 151-158. doi: 10.1016/j.fcl.2012.12.009.
16. Егиазарян К.А., Лазишвили Г.Д., Ратьев А.П., Сиротин И.В., Бут-Гусаим А.Б., Данилов М.А. и др. Современные тенденции в лечении локальных хрящевых дефектов коленного сустава. Хирургическая практика. 2020;(3):65-72.
17. De Boer A.S., Tjioe R.J.C., Van Der Sijde F., Meuffels D.E., den Hoed P.T., Van der Vlies C.H. et al. The American Orthopaedic Foot and Ankle Society AnkleHindfoot Scale; Translation and validation of the Dutch language version for ankle fractures. BMJ Open. 2017;7(8): e017040. doi: 10.1136/bmjopen-2017-017040.
18. Martin R.L., Irrgang J.J., Burdett R.G., Conti S.F., Van Swearingen J.M. Evidence of validity for the Foot and Ankle Ability Measure (FAAM). Foot Ankle Int. 2005;26(11):968-983.doi:10.1177/107110070502601113.
19. Тимофеев К.А. Дефекты таранной кости и возможности их замещения. Уральский медицинский журнал. 2022;21(2):55-58.
20. Корышков Н.А., Хапилин А.П., Ходжиев А.С., Воронкевич И.А., Огарёв Е.В., Симонов А.Б. и др. Мозаичная аутологичная остеохондропластика в лечении локального асептического некроза блока таранной кости. Травматология и ортопедия России. 2014; 20(4):90-98. doi: 10.21823/2311-2905-2014-0-4-90-98. Koryshkov N.A., Khapilin A.P., Khodzhiyev A.S., Voronkevich I.A., Ogarev E.V., Simonov A.B. et al. Treatment of local talus osteochondral defects using mosaic autogenous osteochondral plasty. Traumatology and Orthopedics of Russia. 2014;20(4):90-98.
21. Chang E., Lenczner E. Osteochondritis dissecans of the talar dome treated with an osteochondral autograft. Can J Surg. 2000;43(3):217-221.
22. Kodama N., Honjo M., Maki J., Hukuda S. Osteochondritis dissecans of the talus treated with the mosaicplasty technique: a case report. J Foot Ankle Surg. 2004;43(3): 195-198. doi: 10.1053/j.jfas.2004.03.003.
23. Bisicchia S., Rosso F., Amendola A. Osteochondral allograft of the talus. Iowa Orthop J. 2014;34:30-37.
24. Merritt
G., Epstein J., Roland D., Bell D. Fresh osteochondral allograft
transplantation (FOCAT) for definitive management of a 198 square millimeter
osteochondral lesion of the talus (OLT): A case report. Foot (Edinb).
2021;46:101639.
25. Лазишвили Г.Д., Егиазарян К.А., Никишин Д.В., Воронцов А.А., Шпак М.А., Клинов Д.В. и др. Экспериментальное обоснование применения коллагеновых мембран для реконструкции полнослойных дефектов гиалинового хряща. Хирургическая практика. 2020;(1):45-52. doi: 10.38181/2223-2427-2020-1-45-52. Lazishvili G.D., Egiazaryan K.A., Nikishin D.V., Vorontsov A.A., Shpak M.A., Klinov D.V. et al. Experimental substantiation ofthe use of collagen membranes for the reconstruction of full-thickness defects in hyaline cartilage. Surgical Practice. 2020;1(41):45-52. (In Russian). doi: 10.38181/2223-2427-2020-1-45-52.
26. Malahias M.A., Kostretzis L., Megaloikonomos P.D., Cantiller E.B., Chytas D., Thermann H. et al. Autologous matrix-induced chondrogenesis for the treatment of osteochondral lesions of the talus: A systematic review. Orthop Rev (Pavia). 2021;12(4):8872. doi: 10.4081/or.2020.8872.
27. Migliorini F., Maffulli N., Baroncini A., Knobe M., Tingart M., Eschweiler J. Matrix-induced autologous chondrocyte implantation versus autologous matrix- induced chondrogenesis for chondral defects of the talus: a systematic review. Br Med Bull. 2021;138(1):144- 154. doi: 10.1093/bmb/ldab008.
28. Hurley E.T., Murawski C.D., Paul J., Marangon A., Prado M.P., Xu X. et al. Osteochondral Autograft: Proceedings of the International Consensus Meeting on Cartilage Repair of the Ankle. Foot Ankle Int. 2018;39 (1 suppl):28S-34S. doi: 10.1177/1071100718781098.
29. Hangody L., Fules P. Autologous osteochondral mosaicplasty for the treatment of full- thickness defects of weight-bearing joints: ten years of experimental and clinical experience. J Bone Joint Surg Am. 2003;85-A Suppl 2:25-32.doi: 10.2106/00004623-200300002-00004.
30. Пашкова Е., Сорокин Е., Коновальчук Н., Фомичев В., Шулепов Д., Демьянова К. Ретроспективный анализ результатов оперативного лечения пациентов с остеохондральными повреждениями блока таранной кости. Гений ортопедии. 2022;28(5):643-651. doi: 10.18019/1028-4427-2022-28-5-643-651.
31. Кузнецов В.В., Пахомов И.А., Корочкин С.Б., Репин А.В., Гуди С.М. Способ забора остеохондрального аутотрансплантата из преахиллярной области пяточной кости. Современные проблемы науки и образования. 2017;(5). Режим доступа:
32. Waltenspul M., Meisterhans M., Ackermann J., Wirth S. Typical Complications After Cartilage Repair of the Ankle Using Autologous Matrix-Induced Chondrogenesis (AMIC). Foot Ankle Orthop. 2023;8(1): 24730114231164150. doi: 10.1177/24730114231164150.
Сведения об авторах
Чеботарев Виталий Витальевич
Коробушкин Глеб Владимирович — д-р мед. наук
Ахмедов Багавдин Гаджиевич — д-р мед. наук
Гайдаров Арип Рашидови
Теги: таранная кость
234567 Начало активности (дата): 12.01.2024 20:11:00
234567 Кем создан (ID): 989
234567 Ключевые слова: таранная кость, остеохондральный дефект, хондропластика, коллагеновая мембрана, AMIC
12354567899
Похожие статьи
Результаты открытого вправления врожденного вывиха бедра, варизирующеи деротационнои остеотомии и ацетабулопластики по Dega у детей с дисплазией тазобедренного сустава: ретроспективный анализРентген на дому 8 495 22 555 6 8
Эндопротезирование коленного сустава у пациентов, находящихся на хроническом гемодиализе: стандартная операция или сложный случаи?
Результаты лечения пациентов с переломами лодыжек и заднего края большеберцовой кости с использованием различных вариантов хирургической техники
Остеонекроз головки бедренной кости — еще одно наследие COVID-19?



