 25.12.2023
25.12.2023
Сравнительная оценка использования индивидуальных ЗЭ-компонентов и стандартных имплантатов для реконструкции вертлужной впадины при ревизионном эндопротезировании
Использование индивидуальных вертлужных 3D-компонентов является одним из перспективных методов реконструкции вертлужной впадины при ее значительных дефектах, в том числе сопровождающихся диссоциацией костей таза, позволяет добиться стабильной фиксации и восстановить биомеханику тазобедренного сустава
Введение
В течение последних двух десятилетий отмечается значительное увеличение числа операций первичной артропластики крупных суставов, в связи с чем возрастает потребность в ревизионном оперативном лечении [1, 2, 3, 4].
Реконструкция вертлужной впадины при дефектах IIC, IIIA, ШВ по классификации W.G. Paprosky, особенно при нарушении целостности тазового кольца, является сложной задачей [5, 6]. Для восстановления вертлужной области с большими костными дефектами необходим широкий спектр стандартных имплантатов [7]. На сегодняшний день существует множество хирургических опций и техник для использования стандартных ревизионных имплантатов, однако добиться длительного их выживания не всегда удается [8].
Использование индивидуально изготовленных вертлужных компонентов является одним из наиболее эффективных вариантов реконструкции вертлужной впадины при ее значительных дефектах [9, 10, 11]. Применение SD-компонентов при значительных костных дефектах, сопровождающихся диссоциацией костей таза, позволяет не только добиться стабильной фиксации, но и восстановить биомеханику тазобедренного сустава [12, 13].
Цель исследования — сравнить результаты применения индивидуально изготовленных 3D-компонентов, опорных антипротрузионных колец, аугментов и/или гемисферических компонентов в ревизионном эндопротезировании тазобедренного сустава при костных дефектах типа IIIB по классификации W.G. Paprosky.
МАТЕРИАЛ И МЕТОДЫ
Дизайн исследования
Проведено проспективное когортное исследование в период с 2017 по 2022 г. Проанализированы результаты лечения 90 пациентов с костными дефектами типа IIIB, которым выполнялось ревизионное эндопротезирование тазобедренного сустава.
Критерии включения:
- расшатывание вертлужного компонента эндопротеза тазобедренного сустава с костным дефектом типа IIIB по классификации W.G. Paprosky;
- выполнение второго этапа лечения перипро- тезной инфекции (ППИ) (удаление спейсера, установка компонентов эндопротеза).
Критерии невключения:
- ВИЧ, наркомания, психическая неадекватность;
- глубокая ППИ тазобедренного сустава;
- тяжелая соматическая патология, требующая активной коррекции и являющаяся противопоказанием к оперативному вмешательству или существенно увеличивающая операционный риск.
Критерии исключения:
- свищевая форма ППИ;
- декомпенсация соматической патологии перед оперативным лечением.
Всех пациентов разделили на три группы. В первую группу вошли 30 (33,3%) человек, которым имплантировали индивидуально изготовленные вертлужные 3D-компоненты; во вторую группу — 30 (33,3%) пациентов, у которых дефекты компенсировали аугментами и/или гемисферическим компонентом; третья группа представлена 30 (33,3%) пациентами, которым устанавливали антипротрузионные опорные кольца.
Показанием к ревизионному эндопротезированию было асептическое расшатывание компонентов эндопротеза или выполнение второго этапа ревизионного эндопротезирования тазобедренного сустава при лечении ППИ.
Перед оперативным вмешательством проводилось комплексное обследование всех пациентов с целью исключения ППИ, по рекомендациям II Согласительной конференции включающее:
- клинический осмотр;
- оценку рентгенограмм таза и тазобедренного сустава;
- оценку показателей крови: СОЭ и С-реактив- ного белка;
- пункцию пораженного сустава с целью микробиологического и цитологического исследований [4].
Изготовление индивидуальных вертлужных компонентов
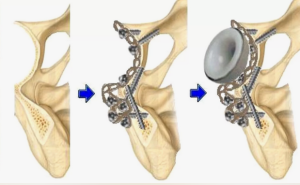
Для 3D-реконсгрукции таза и его дефектов использовалась трехмерная КТ со срезами не более 0,6 мм и давностью не позднее двух недель. Затем КТ отправляли инженеру-конструктору, который формировал 3D-модель дефекта таза и изготавливал модель примерочного компонента с помощью программного обеспечения PME Planner («МЕДТЭК», Россия) (рис. 1 a, b).
Затем совместно с хирургом создавали 3D-модель компонента для оценки возможного контакта имплантата с оставшейся костью пациента, определения вариантов направления фиксирующих винтов, выявления центра ротации бедра. Угол антеверсии мы выбрали 25°, угол инклинации — 45° (рис. 1 c).
С целью лучшего пространственного понимания имеющихся дефектов костей вертлужной области использовали изготовленные тактильные 3D-модели таза в масштабе 1:1, которые позволяют анализировать уже имеющуюся у пациента патологическую анатомию вертлужной области, правильно классифицировать костные дефекты и более точно позиционировать имплантат (рис. 2).
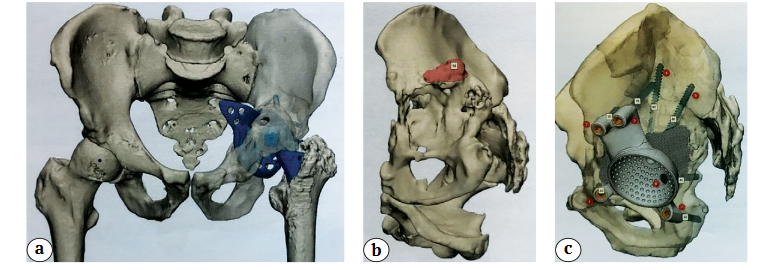
Рис. 1. Цифровое предоперационное планирование на основании SD-визуализации: а — оценка костного дефицита
вертлужной впадины до удаления компонентов; b — оценка костного дефицита после
удаления компонентов эндопротеза (красным цветом выделен участок, который
необходимо удалить перед имплантацией компонента для его точного
позиционирования); c — фиксация SD-компонента в вертлужной области винтами

Рис. 2. Тактильная 3D-модель таза в масштабе 1:1
Для лучшей остеоинтеграции мы применяли пористую структуру на границе «имплантат - кость» с толщиной балок 0,45-0,50 мм. По внутренней поверхности вертлужного компонента создавались дополнительные углубления под шляпку спонгиозных костных винтов диаметром 6,5 мм с глубиной не более 0,2 мм. С целью контроля за нижним краем вертлужной впадины и ориентирования при позиционировании в ране примерочной модели и самого компонента мы просили производителей делать выемку диаметром до 1,5 см на «6 часах» (рис. 3). Внутренняя часть компонента предназначена для имплантации в него вертлужного компонента цементной фиксации. Нами использовались персонифицированные имплантаты, изготовленные компанией ООО «ТИОС» (Россия).
Хирургическая техника
После предварительной подготовки проводилось оперативное лечение. У пациентов, которым имплантировали индивидуально изготовленные конструкции, мы использовали переднелатеральный доступ к тазобедренному суставу, однако при отсутствии проксимального отдела бедренной кости доступ становился латеральным. Вслед за удалением компонентов эндопротеза проводилась санация операционной раны растворами антисептика — 5 л через систему Pulsavac (ZimmerBiomet). Затем проводились обработка вертлужной области, формирование ложа для персонифицированного компонента и примерка SD-модели на тестовом компоненте и в ране, оценивались ее конгруэнтность и стабильность (рис. 4).

Рис. 3. Индивидуально изготовленные фрагмент таза, компонент и примерочная модель вертлужной впадины. Дополнительная выемка на «6 часах» для ориентирования при позиционировании имплантата в ране
Затем выполняли имплантацию самого индивидуального вертлужного компонента (рис. 5). SD-имплантат фиксировали винтами диаметром 6,5 мм и длиной от 30 до 80 мм согласно результатам предоперационного планирования.
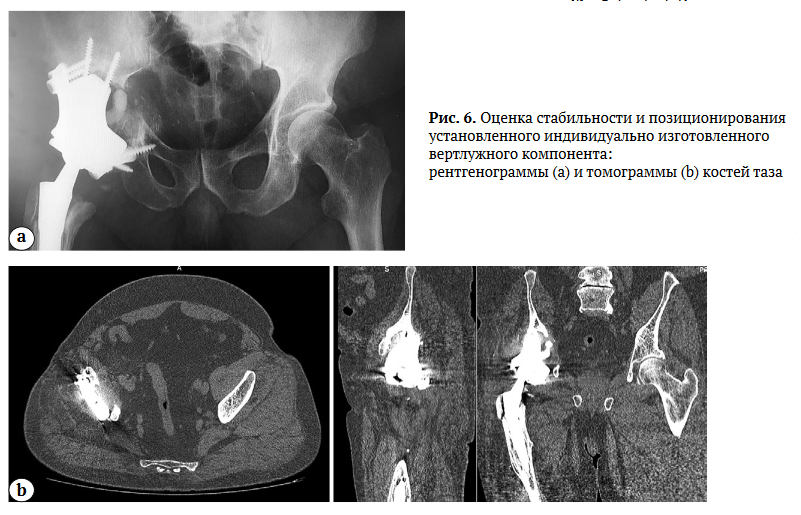
Следует отметить, что конструкторы при формировании модели оценивают только наличие костной ткани. Однако зачастую мягкие ткани являются интерпонентом, который создает дополнительные трудности при позиционировании и установке SD-модели. Для этого необходимо тщательно подготовить ложе с целью точной имплантации компонента. В послеоперационном периоде всем пациентам выполнялись контрольные рентгенограммы, а через 3 мес. — КТ с целью оценки стабильности и позиционирования установленных имплантатов (рис. 6).
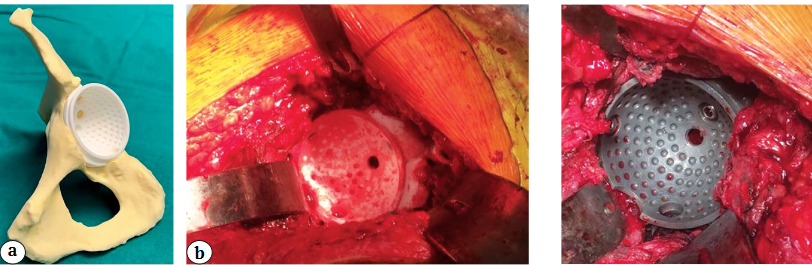
Рис. 4. Примерка тестового компонента: a — на модели таза; b — в ране Рис. 5. Имплантация
На сроках 3, 6 и 12 мес. после операции с целью оценки стабильности и возможного расшатывания имплантатов проводилась оценка рентгенограмм в трех зонах вертлужной впадины по DeLee - Charnley по линиям рентгенологического просветления [14].
Расшатывание вертлужного компонента выявлялось по следующим критериям:
- отрицательная динамика в расширении границ рентгенологического просветления;
- поломка винтов, фиксирующих вертлужные компоненты или их миграция;
- миграция вертлужного компонента более чем на 2 мм и изменение угла его наклона более чем на 4° [15];
- сдвиг центра ротации в сравнении с ранее выполненными рентгенограммами [16].
Оценка результатов
Для проведения статистического анализа были выбраны следующие параметры: пол, возраст, индекс массы тела пациентов, причина ревизионного вмешательства, количество предыдущих оперативных вмешательств, продолжительность операции, интраоперационная кровопотеря, парциальное или полное ревизионное вмешательство, применение систем двойной мобильности. Оценку болевого синдрома и клинико-функционального результата мы проводили до оперативного лечения и через 3, 6, 12 мес., далее один раз в год с помощью шкал WOMAC, Harris Hip Score, ВАШ.
После оперативного лечения анализировали частоту и структуру осложнений: асептическое расшатывание, нестабильность эндопротеза, развитие ППИ и нейропатия седалищного нерва.
Статистический анализ
Статистическую обработку полученных данных выполняли в программе IBM SPSS Statistics Base 22.0 for Windows. Для проверки на нормальность распределения использовался критерий Колмогорова - Смирнова. Показатели шкал Harris Hip Score, WOMAC и ВАШ имели ненормальное распределение при проверке с помощью критерия Колмогорова - Смирнова. Остальные показатели были расценены как показатели с нормальным распределением.
Для дальнейшего анализа использовались следующие непараметрические критерии: ранговый критерий знаков Вилкоксона (исследование параметров до и после операции) и ранговый критерий Манна- Уитни (сравнительный анализ первой и второй групп). Для описания качественных признаков использовались относительные (%) и абсолютные частоты. Для сравнения двух независимых групп качественных признаков использовался х2 Пирсона. Значения непрерывных величин с нормальным распределением представлены либо как M±SD, где M — выборочное среднее, SD — стандартное отклонение, либо как медиана (Me) [Q1, Q3] для ненормально распределенных данных в обеих группах.
Статистически значимыми считались различия с критерием р<0,05.
Результаты
Проведенный нами анализ показал, что исследуемые группы были сопоставимы по полу, индексу массы тела, типам костных дефектов вертлужной впадины. Однако в первой группе отмечалось больше случаев костных дефектов типа IIIB, сочетающихся с диссоциацией костей таза. Средний срок наблюдения в первой группе (с применением 3D-компонентов) составил 37 мес. (от 26 до 56), во второй группе (с применением аугментов и/или гемисферических компонентов) — 42 мес. (от 30 до 59), в третьей группе (с использованием опорных колец) — 40 мес. (от 27 до 58). Необходимо отметить, что первая группа пациентов превосходила пациентов второй и третьей групп по количеству ревизионных вмешательств в анамнезе (р<0,05) (табл. 1).
Характеристика пациентов трех групп исследования
Таблица 1
|
Показатель |
Первая группа n = 30 |
Вторая группа n = 30 |
Третья группа n = 30 |
Всего n = 90 |
|
|
Средний возраст, лет |
58,6 |
62,1 |
72,4 |
|
|
|
ИМТ |
|
29,3 |
28,7 |
27,6 |
|
|
Пол |
М |
11 |
9 |
8 |
28 |
|
|
Ж |
19 |
21 |
22 |
62 |
|
Количество операций в анамнезе |
3,8 |
2,36 |
2,1 |
|
|
Окончание таблицы 1
|
Показатель |
Первая группа n = 30 |
Вторая группа n = 30 |
Третья группа n = 30 |
Всего n = 90 |
|
Тип дефекта |
|
|
|
|
|
IIIB |
30 |
30 |
30 |
90 |
|
в т.ч. диссоциация костей таза |
15 |
3 |
4 |
22 |
|
Причина ревизии |
|
|
|
|
|
Асептическое расшатывание |
24 |
24 |
19 |
67 |
|
Второй этап лечения ППИ |
6 |
6 |
11 |
23 |
Несмотря на большую продолжительность и объем оперативного вмешательства в первой группе, средняя интраоперационная кровопотеря была больше во второй группе на 23,3 мл, чем в первой, и на 98 мл больше, чем в третьей. Из 22 случаев диссоциации костей таза в 15 случаях имплантировали индивидуальные 3D- конструкции, в 3 случаях использовали аугмент и/ или гемисферу, в оставшихся 4 случаях применяли антипротрузионные кольца. Полные данные об интраоперационных показателях представлены в таблице 2.
Интраоперационные показатели
Таблица 2
|
Показатель |
Первая группа n = 30 |
Вторая группа n = 30 |
Третья группа n = 30 |
Всего n = 90 |
|
|
Выполнение импакционной костной |
Да |
0 |
2 |
3 |
5 |
|
пластики |
|
|
|
|
|
|
|
Нет |
30 |
28 |
27 |
85 |
|
Время операции, мин. |
|
168,4 (±24,2) |
129,2 (±23,1) |
134,4 (±12,1) |
|
|
Интраоперационная кровопотеря, мл |
|
696,7 (±127,1) |
720 (±172,2) |
622 (±152,3) |
|
|
Среднее количество используемых винтов, шт. |
|
5,1 (±1,2) |
4,6 (±2,1) |
4,3 (±2,2) |
|
|
Использование компонентов двойной |
|
21 |
0 |
8 |
29 |
|
мобильности, шт. |
|
|
|
|
|
|
Объем ревизионного вмешательства |
Парциальное |
6 |
14 |
9 |
29 |
|
|
Полное |
24 |
16 |
21 |
61 |
Осложнения
После ревизионных вмешательств было выявлено 27 (30%) осложнений, причем их количество было больше во второй и третьей группах пациентов (табл. 3).
У пациентов первой группы с 3D-конструк- циями в 2 (6,6%) случаях была диагностирована глубокая ППИ, которая в одном случае закончилась летальным исходом. Во втором случае мы провели санацию с хорошим результатом, подразумевающим купирование инфекции, избавление пациента от болевого синдрома и хороший клинический исход.
В 2 (6,6%) случаях произошел вывих эндопротеза: в одном случае у пациентки с системой двойной мобильности, в другом — со стандартными компонентами (рис. 7). У пациентки с системой двойной мобильности вывих произошел через 4 мес. после операции, а у пациентки со стандартным компонентов — через 3 нед. после операции. В обоих случаях нам пришлось выполнить открытое вправление с увеличением длины головки. Еще одно осложнение было получено через 23 мес. после парциального ревизионного эндопротезирования правого тазобедренного сустава. Оно было диагностировано только на контрольных рентгенограммах и проявлялось в виде поломки одного фланца, но на стабильность компонента и клинико-функциональный результат это никак не повлияло (рис. 8).
Для оценки исходов ревизионного эндопротезирования тазобедренного сустава важными показателями являются клинический результат и интенсивность болевого синдрома. Оценка результатов по шкалам представлена в таблице 4.
Таблица 3
Осложнения после ревизии в трех группах пациентов
|
Осложнение |
Первая группа n = 30 |
Вторая группа n = 30 |
Третья группа n = 30 |
Всего n = 90 |
|
Нестабильность в суставе |
2 (6,6%) |
4 (13,2%) |
4 (13,2%) |
10 (11,1%) |
|
Перипротезная инфекция |
2 (6,6%) |
3 (10%) |
3 (10%) |
8 (8,8%) |
|
Расшатывание компонентов |
1 (3,3%) |
2 (6,6%) |
1 (3,3%) |
4 (4,4%) |
|
Нейропатия |
1 (3,3%) |
2 (6,6%) |
2 (6,6%) |
5 (5,5%) |
|
Всего |
6 (20%) |
11 (36,6%) |
10 (33,3%) |
27 (30%) |
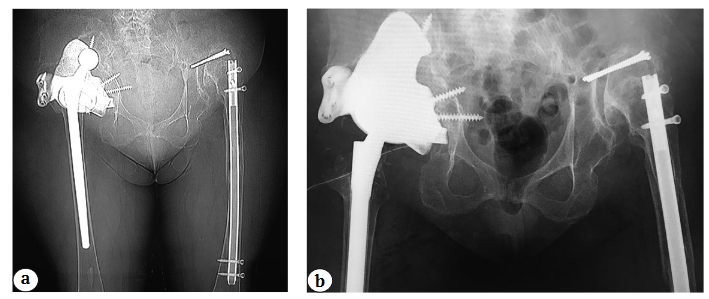
Рис. 7. Рентгенограммы костей таза после ревизионного эндопротезирования правого тазобедренного сустава: a — вывих головки эндопротеза (система двойной мобильности); b — после открытого вправления и увеличения длины головки эндопротеза (система двойной мобильности)
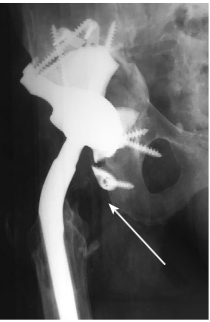
Рис. 8. Рентгенограмма правого тазобедренного сустава через 2 года после парциального ревизионного эндопротезирования — поломка одного из фланцев 3D-компонента (обозначена стрелкой)
Оценка результатов по шкалам
Таблица 4
|
Группа |
Harris Hip Score |
WOMAC |
ВАШ |
|||
|
до операции |
после операции |
до операции |
после операции |
до операции |
после операции |
|
|
Первая |
27 [25,5;29,2] |
78 [36,9;90,1] |
76 [34,7;92,2] |
7 [2,9;15,1] |
9 [8,7;10] |
0,5 [0,3;1,2] |
|
Вторая |
32 [24,3;38,2] |
72 [38,2;91,7] |
68 [31,9;82,1] |
14 [7,7;28,5] |
8 [7,9;9,8] |
1,1 [0,8;2,5] |
|
Третья |
34 [29,2;39,5] |
70 [32,5;85,9] |
71 [32,8;85,4] |
17 [9,9;32,9] |
7 [6,7;8,9] |
1,5 [0,7;3,1] |
p<0,05.
Обсуждение
По мере увеличения числа выполняемых операций первичного эндопротезирования тазобедренного сустава у молодых пациентов неуклонно растет частота ревизионных вмешательств [17]. Так, по данным регистра Великобритании, в 2017 г. было выполнено более 8 тыс. ревизионных операций на тазобедренном суставе [18].
Каждая ревизионная операция — это сложная задача для хирурга, особенно при наличии массивного костного дефекта вертлужной впадины. Перед хирургом стоят такие задачи, как надежная фиксации компонента и обеспечение стабильности сустава. Для их решения необходимо грамотное предоперационное планирование, т.к. правильно интерпретированный костный дефект позволяет минимизировать риск ошибки и облегчить выполнение оперативного лечения [19].
Классификация костных дефектов вертлужной впадины, предложенная W.G. Paprosky в 1993 г. и основанная на рентгенологических признаках, удобна для использования при предоперационном планировании [13]. Однако она является несовершенной для углубленной диагностики, поскольку не позволяет определить ограниченность или неограниченность костного дефекта, а также не учитывает наличия диссоциации костей таза [20]. Поэтому для детальной оценки каждого дефекта вертлужной впадины необходимо выполнение КТ с последующей 3D-визуализацией.
M.S. Ibrahim с соавторами продемонстрировали хорошие результаты ревизионного эндопротезирования при одновременном использовании импакционной костной пластики и бесцементных компонентов с пористым покрытием. Однако авторы подчеркивают, что данный метод не может обеспечить длительную выживаемость имплантатов при обширных дефектах вертлужной впадины, таких как IIIA и IIIB [21]. Другие авторы сообщают о высоком уровне осложнений при использовании импакционной костной пластики или аллотрансплантатов для замещения массивных дефектов вертлужной впадины [22, 23]. Основным преимуществом импакционной пластики является восстановление костной массы, особенно у молодых пациентов, которым со временем может потребоваться повторная ревизия [24, 25].
В ревизионной хирургии все чаще стали использовать металлические аугменты с танталовым покрытием. Однако для их хорошей фиксации с последующей остеоинтеграцией необходимо наличие достаточного количества костной ткани. M. Whitehouse с соавторами продемонстрировали достаточно высокую выживаемость (92%) через 10 лет после ревизионного эндопротезирования с использованием аугментов [26]. Благодаря своей универсальности аугменты позволяют хирургам в большинстве случаев выполнить реконструкцию вертлужной впадины. Но при их использовании требуется дополнительная обработка кости фрезами, что уменьшает запас костной ткани. Кроме того, ориентация винтов в аугментах параллельна, что не позволяет менять направление винтов для лучшей фиксации. Поэтому в некоторых случаях ревизионного эндопротезирования использование аугментов не позволяет полноценно восполнить костный дефект [8]. В нашем исследовании мы наблюдали 6,6% случаев асептического расшатывания компонентов при использовании аугментов.
Еще одним вариантом лечения пациентов со значительными костными дефектами вертлужной впадины являются опорные антипротрузионные кольца. Основным преимуществом данного метода является его низкая стоимость. Однако невозможность биологической фиксации не дает надежды на долговременную стабильность конструкции [27]. Поэтому использовать данный метод не рекомендуется у активных и молодых пациентов. В нашем исследовании средний возраст больных, которым имплантировали антипротрузионные кольца, составлял 72,4 года, что по классификации ВОЗ является пожилым возрастом.
При комбинированном дефиците передней и задней колонн вертлужной впадины ни один из стандартных ревизионных имплантатов не позволяет восстановить истинный центр ротациит головки бедренной кости.
Единственным методом реконструкции обширного костного дефекта вертлужной впадины являются трехфланцевые индивидуально изготовленные S-конструкции, которые позволяют осуществить персонифицированный подход к каждому случаю. Хотя этот метод более дорогостоящим по сравнению с использованием стандартных имплантатов [28], он часто бывает единственным возможным вариантом лечения [29]. Кроме того, наличие пористой поверхности имплантата в области его контакта с костным ложем способствует биологической фиксации и остеоинтеграции, что напрямую влияет на долговременную стабильность [30]. M.J. Tauntonс соавторами продемонстрировали, что стоимость трехфланцевого индивидуально изготовленного компонента сопоставима со стоимостью бесцементной чашки с аугментами [31]. Р.М. Тихилов с соавторами считают, что при обширных дефектах использование индивидуальных вертлужных конструкций с экономической точки зрения является более эффективной стратегией лечения, чем имплантация серийных вертлужных компонентов [32].
A.A. Корыткин c соавторами выявили прямую корреляционную взаимосвязь между отклонением центра ротации после операции и последующей ревизией вертлужного компонента, что подтверждает важность восстановления анатомии тазобедренного сустава [33]. Имплантированный 3D-компонент позволяет восстановить предварительно спланированный центр анатомически правильной ротации.
Основными недостатками индивидуального изготовления вертлужных компонентов являются сложность предоперационного планирования и длительное изготовление конструкции [33]. С другой стороны, этот метод упрощает выполнение операции: нет необходимости имплантировать аллотрасплантаты, моделировать опорное кольцо, подбирать аугменты, кейджи и гемисферы для достижения адекватной фиксации [8, 34]. Однако в нашем исследовании на имплантацию персонифицированного компонента было затрачено на 39,2 мин. больше, чем на установку аугмента с гемисферой, и на 34,0 мин. больше, чем на установку антипротрузионного кольца и чашки.
Частота осложнений после ревизионного эндопротезирования с применением индивидуальных конструкций достигает 26% [35]. A.C. Kawalkar с соавторами продемонстрировали, что при использовании индивидуальных трехфланцевых конструкций количество вывихов, по разным данным, варьируется от 0% до 30%. В нашем исследовании частота вывихов составила 6,6% (2 из 30 пациентов) [36].
Многие авторы указывают на улучшение результатов по шкале Harris Hip Score с 25 баллов до операции до 75 и более после оперативного вмешательства при использовании персонифицированных имплантатов [6, 9, 38, 39]. В нашем исследовании средний балл по Harris Hip Score увеличился с 27 [25,5; 29,2] до 78 [36,9; 90,1], что сопоставимо с данными литературы. Относительно невысокие показатели оценочных шкал после оперативного лечения свидетельствуют об изначально тяжелом состоянии пациентов, а также об объеме и сложности проведенного ревизионного эндопротезирования [6].
В нашем исследовании результаты в группе пациентов, которым имплантировали персонифицированные конструкции, были в 1,08 раза выше по Harris Hip Score, чем в группе с аугментами, и в 1,10 раза выше, чем в группе с антипротрузи- онными кольцами. Аналогичные результаты мы получили по шкале WOMAC: результат был лучше в 1,95 раза, чем у пациентов с аугментами, и в 2,32 раза лучше, чем у пациентов с антипро- трузионными кольцами. Количество осложнений в послеоперационном периоде у пациентов с индивидуальными конструкциями было в 1,83 раза меньше, чем у пациентов второй группы, и в 1,66 раза меньше, чем в третьей группе.
Заключение
Изготовленные с использованием 3D-технологий индивидуальные конструкции являются приоритетным вариантом при выполнении ревизионного эндопротезирования у пациентов с дефектами типа IIIB по классификации W.G. Paprosky, особенно сопровождающихся диссоциацией костей таза. Однако при использовании персонифицированных компонентов не стоит рассчитывать на снижение продолжительности самой операции.
Заявленный вклад авторов
Мурылев В.Ю. — дизайн исследования, обзор публикаций по теме статьи, анализ полученных данных, написание и редактирование текста статьи.
Куковенко Г.А. — дизайн исследования, обзор публикаций по теме статьи, анализ полученных данных, написание текста статьи.Елизаров П.М. — дизайн исследования, обзор публикаций по теме статьи, сбор и анализ данных.
Рукин Я.А. — сбор и анализ данных, написание и редактирование текста статьи.
Музыченков А.В. — сбор и анализ данных, написание и редактирование текста.
Руднев А.И. — сбор и анализ данных, редактирование текста статьи.
Жучков А.Г. — сбор и анализ данных, редактирование текста статьи.
Алексеев С.С. — сбор и анализ данных, редактирование текста статьи.
Бобров Д.С. — сбор и анализ данных, редактирование текста статьи.
Германов В.Г. — сбор и анализ данных, редактирование текста статьи.
Все авторы прочли и одобрили финальную версию рукописи статьи. Все авторы согласны нести ответственность за все аспекты работы, чтобы обеспечить надлежащее рассмотрение и решение всех возможных вопросов, связанных с корректностью и надежностью любой части работы.
Источник финансирования. Авторы заявляют об отсутствии внешнего финансирования при проведении исследования.
Возможный конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Этическая экспертиза. Не применима.
Информированное согласие на публикацию. Авторы получили письменное согласие пациентов на участие в исследовании и публикацию результатов.
Литература
1. Yoon P.W., Lee Y.K., Ahn J., Jang E.J., Kim Y., Kwak H.S. et al. Epidemiology of hip replacements in Korea from 2007 to 2011. J Korean Med Sci. 2014;29(6):852-858. doi: 10.3346/jkms.2014.29.6.852.
2. Telleria J.J., Gee A.O. Classifications in brief: Paprosky classification ofacetabular bone loss. Clin Orthop Relat Res. 2013;471(11):3725-3730. doi: 10.1007/s11999-013-3264-4.
3. Тихилов Р.М., Шубняков И.И., Денисов А.О. Классификации дефектов вертлужной впадины: дают ли они объективную картину сложности ревизионного эндопротезирования тазобедренного сустава? (критический обзор литературы и собственных наблюдений). Травматология и ортопедия России. 2019;25(1):122-141. doi: 10.21823/2311-2905-2019-25-1-122-141.
4. Parvizi
J., Tan T.L., Goswami K., Higuera C., Della Valle C., Chen A.F. et al. The 2018
Definition of Periprosthetic Hip and Knee Infection: An Evidence- Based and
Validated Criteria. J Arthroplasty. 2018;33(5): 1309-1314.e2.
5. DallAva L., Hothi H., Henckel J., Di Laura A., Shearing P., Hart A. Comparative analysis of current 3D printed acetabular titanium implants. 3D Print Med. 2019;5(1):15. doi: 10.1186/s41205-019-0052-0.
6. Корыткин А.А., Новикова Я.С., Морозова Е.А., Герасимов С.А., Ковалдов К.А., Эль Мудни Ю.М. Индивидуальные трехфланцевые вертлужные компоненты при ревизионном эндопротезировании тазобедренного сустава у пациентов со значительными дефектами вертлужной впадины: планирование, хирургическая техника, результаты. Травматология и ортопедия России. 2020;26(2):20-30. doi: 10.21823/2311-2905-2020-26-2-20-30.
7. Bozic
K.J., Kamath A.F., Ong K., Lau E., Kurtz S., Chan V. et al. Comparative
Epidemiology of Revision Arthroplasty: Failed THA Poses Greater Clinical and
Economic Burdens Than Failed TKA. Clin Orthop Relat Res. 2015;473(6):2131-2138.
8. Tikhilov R.M., Dzhavadov A.A., Kovalenko A.N., Bilyk S.S., Denisov A.O., Shubnyakov 1.1. Standard Versus Custom-Made Acetabular Implants in Revision Total Hip Arthroplasty. J Arthroplasty. 2022;37(1):119-125. doi: 10.1016/j.arth.2021.09.003.
9. Berend M.E., Berend K.R., Lombardi A.V., Cates H., Faris P. The patient-specific triflange acetabular implant for revision total hip athroplasty in patients with severe acetabular defects: planning, implantation, and results. Bone Joint J. 2018;100-B (1 Supple A):50-54. doi: 10.1302/0301-620X.100B1.BJJ-2017-0362.R1.
10. Zampelis V., Flivik G. Custom-made 3D-printed cup- cage implants for complex acetabular revisions: evaluation of pre-planned versus achieved positioning and 1-year migration data in 10 patients. Observational Study. Acta Orthop. 2021;92(1):23-28. doi: 10.1080/17453674.2020.1819729.
11. Yao A., George D.M., Ranawat V., Wilson C.J. 3D Printed Acetabular Components for Complex Revision Arthroplasty. Indian J Orthop. 2021;55(3):786-792. doi: 10.1007/s43465-020-00317-x.
12. Wyatt M.C. Custom 3D-printed acetabular implants in hip surgery - innovative breakthrough or expensive bespoke upgrade? Hip Int. 2015. 25(4):375-379. doi: 10.5301/hipint.5000294. .
13. Aprato A., Giachino M., Bedino P., Mellano D., Piana R., Masse A. Management of Paprosky type three B acetabular defects by custom-made components: early results. Int Orthop. 2019;43(1):117-122. doi: 10.1007/s00264-018-4203-5.
14. DeLee J.G. Charnley J. Radiological demarcation of cemented sockets in total hip replacement. Clin Orthop Relat Res. 1976;(121):20-32. doi: 10.1097/00003086-197611000-00003.
15. Jeong
M., Kim H.J., Lim S.J., Moon Y.W., Park Y.S. Revision total hip arthroplasty
using tantalum augmentin patients with Paprosky III or IV acetabular bonedefects:
a minimum 2-year follow up study. Hip Pelvis. 2016;28(2):98-103.
16. Shi H.F., Xiong J., Chen Y.X., Wang J.f., Wang Y.H. Radiographic analysis of the restoration of hip joint center following open reduction and internal fixation of acetabular fractures: a retrospective cohort study. BMC Musculoskelet Disord. 2014;15(1):277. doi: 10.1186/1471-2474-15-277.
17. Weber M., Renkawitz T., Voellner F., Craiovan B., Greimel F., Worlicek M. et al. Revision Surgery in Total Joint Replacement Is Cost-Intensive. Biomed Res Int. 2018;2018:8987104. doi: 10.1155/2018/8987104.
18. The National Joint Register. 15th Annual report; 2018.
19. Durand-Hil M., Henckel J., Di Laura A., Hart A. Can custom 3D printed implants successfully reconstruct massive acetabular defects? A 3D-CT assessment. J Orthop Res. 2020;38(12):2640-2648. doi: 10.1002/jor.24752.
20. Тихилов Р.М., Джавадов А.А., Коваленко А.Н., Денисов А.О., Демин А.С., Ваграмян А.Г. и др. Какие особенности дефекта вертлужной впадины влияют на выбор ацетабулярного компонента при ревизионном эндопротезировании тазобедренного сустава
21. Ibrahim M.S., Raja S., Haddad F.S. Acetabular impaction bone grafting in total hip replacement. Bone Joint J. 2013;95-B (11 Suppl A):98-102.
22. Lee P.T., Raz G., Safir O.A., Backstein D.J., Gross A.E. Long-term results for minor column allografts in revision hip arthroplasty. Clin Orthop Relat Res. 2010;468(12):3295-3303. doi: 10.1007/s11999-010-1591-2.
23. Buttaro M.A., Comba F., Pusso R., Piccaluga F. Acetabular revision with metal mesh, impaction bone grafting, and a cemented cup. Clin Orthop Relat Res. 2008;466(10):2482-2490. doi: 10.1007/s11999-008-0442-x.
24. Lakstein D., Backstein D., Safir O., Kosashvili Y., Gross A.E. Trabecular Metal cups for acetabular defects with 50% or less host bone contact. Clin Orthop Relat Res. 2009;467(9):2318-2324. doi: 10.1007/s11999-009-0772-3.
25. Mancino
F., Cacciola G., Di Matteo V., De Marco D., Greenberg A., Perisano C. et al.
Reconstruction options and outcomes for acetabular bone loss in revision hip
arthroplasty. Orthop Rev (Pavia). 2020;12(Suppl 1):8655.
26. Whitehouse
M.R., Masri B.A., Duncan C.P., Garbuz D.S. Continued good results with modular
trabecular metal augments for acetabular defects in hip arthroplasty at 7 to 11
years. Clin Orthop Relat Res. 2015;473(2):521-527.
27. Hansen E., Shearer D., Ries M.D. Does a cemented cage improve revision THA for severe acetabular defects? Clin Orthop Relat Res. 2011;469(2):494-502. doi: 10.1007/s11999-010-1546-7.
28. Eltorai A.E., Nguyen E., Daniels A.H. Three-Dimensional Printing in Orthopedic Surgery. Orthopedics. 2015;38(11):684-687. doi: 10.3928/01477447-20151016-05.
29. Gruber M.S., Jesenko M., Burghuber J., Hochreiter J., Ritschl P., Ortmaier R. Functional and radiological outcomes after treatment with custom-made acetabular components in patients with Paprosky type 3 acetabular defects: short-term results. Clinical Trial. BMC Musculoskelet Disord. 2020;21(1):835.
30. Berasi
C.C. 4th, Berend K.R., Adams J.B., Ruh E.L., Lombardi A.V. Jr. Are custom
triflange acetabular components effective for reconstruction of catastrophic
bone loss? Clin Orthop Relat Res. 2015;473(2):528-535.
31. Taunton M.J., Fehring T.K., Edwards P., Bernasek T., Holt G.E., Christie M.J. Pelvic discontinuity treated with custom triflange component: a reliable option. Clin Orthop Relat Res. 2012;470(2):428-434. doi: 10.1007/s11999-011-2126-1.
32. Тихилов Р.М., Джавадов А.А., Денисов А.О., Чилилов А.М., Черкасов М.А., Билык С.С. и др. Анализ экономической эффективности использования индивидуальных и серийных вертлужных конструкций при ревизионном эндопротезировании тазобедренного сустава. Гений ортопедии. 2022;28(2): 234-240. doi: 10.18019/1028-4427-2022-28-2-234-240.
33. Корыткин А.А., Захарова Д.В., Новикова Я.С., Горбатов Р.О., Ковалдов К.А., Эль Мудни Ю.М. Опыт применения индивидуальных трехфланцевых вертлужных компонентов при ревизионном эндопротезировании тазобедренного сустава. Травматология и ортопедия России. 2017;23(4): 101-111
34. Goodman G.P., Engh C.A.Jr. The custom triflange cup: build it and they will come. Bone Joint J. 2016;98-B (1 Suppl A):68-72. doi: 10.1302/0301-620X.98B.36354.
35. Van Eemeren A.,
Vanlommel J., Vandekerckhove M. Acetabular reconstruction with a custom-made
triflange acetabular component through direct anterior approach - A case
report. J Clin Orthop Trauma. 2020;11(Suppl 2): S211-S213.
36. Kawalkar A.C., Kalanie A., Neil M.J. Excellent Midterm Results of Triflange Patient Matched Implants for Extensive Acetabular Bone Defect. Hip Pelvis. 2021;33(2):87-95.doi: 10.5371/hp.2021.33.2.87.
37. Berasi
C.C. 4th., Berend K.R., Adams J.B., Ruh E.L., Lombardi A.V. Jr. Are custom
triflange acetabular components effective for reconstruction of catastrophic
bone loss? Clin Orthop Relat Res. 2015;473(2):528-535.
38. Citak M., Kochsiek L., Gehrke T., Haasper C., Suero E.M., Mau H. Preliminary results of a 3D-printed acetabular component in the manage ment of extensive defects. Hip Int. 2018;28(3):266-271. doi: 10.5301/hipint.5000561.
Сведения об авторах
Мурылев Валерий Юрьевич — д-р мед. наук, профессор , ГБУЗ «Городская клиническая больница им. С.П. Боткина» Департамента здравоохранения г. Москвы, г. Москва, Россия
Елизаров Павел Михайлович — канд. мед. наук, ГБУЗ «Городская клиническая больница им. С.П. Боткина» Департамента здравоохранения г. Москвы, г. Москва, Россия
Рукин Ярослав Алексеевич — канд. мед. наук, ФГАОУ ВО «Первый Московский государственный медицинский университет им. И.М. Сеченова (Сеченовский Университет)» Минздрава России, г. Москва, Россия
Музыченков Алексей Владимирович — канд. мед. наук, ФГАОУ ВО «Первый Московский государственный медицинский университет им. И.М. Сеченова (Сеченовский Университет)» Минздрава России, г. Москва, Россия
Руднев Александр Игоревич - ФГАОУ ВО «Первый Московский государственный медицинский университет им. И.М. Сеченова (Сеченовский Университет)» Минздрава России, г. Москва, Россия
Жучков Александр Геннадьевич — канд. мед. наук, ГБУЗ «Городская клиническая больница им. С.П. Боткина» Департамента здравоохранения г. Москвы, г. Москва, Россия
Алексеев Семен Сергеевич - ГБУЗ «Городская клиническая больница им. С.П. Боткина» Департамента здравоохранения г. Москвы, г. Москва, Россия
Бобров Дмитрий Сергеевич — канд. мед. наук, ГБУЗ «Городская клиническая больница им. С.П. Боткина» Департамента здравоохранения г. Москвы, г. Москва, Россия
Германов Валерий Григорьевич — канд. мед. наук, ФГАОУ ВО «Первый Московский государственный медицинский университет им. И.М. Сеченова (Сеченовский Университет)» Минздрава России, г. Москва, Россия
Теги: эндопротезирование тазобедренного сустава
234567 Начало активности (дата): 25.12.2023 11:36:00
234567 Кем создан (ID): 989
234567 Ключевые слова: ревизионное эндопротезирование тазобедренного сустава, дефекты вертлужной впадины, нарушение целостности тазового кольца, индивидуальные вертлужные компоненты, 3D-печать
12354567899
Похожие статьи
Злокачественные новообразования костей и суставных хрящей: остеосаркома, саркома ЮингаРентген на дому 8 495 22 555 6 8
Дифференцированный подход к лечению пациентов с дегенеративной патологией комплекса "поясничный отдел позвоночника - таз - тазобедренные суставы"с позиции оценки сагиттального баланса туловища
Возможности использования бесцементных компонентов при ревизионном эндопротезировании вертлужной впадины
Хондропластика в лечении больных с остеоартритом первого плюснефалангового сустава



