 15.12.2023
15.12.2023
Злокачественные новообразования костей и суставных хрящей: остеосаркома, саркома Юинга
Саркома Юинга - это новообразование из мелких голубых круглых клеток, характеризующееся высокой степенью злокачественности и поражающая кости и мягкие ткани, главной характеристикой которого является обнаружение перестройки EWSR1 с генами-партнёрами семейства ETS
Термины и определения
Генерализованная форма заболевания - заболевание, при котором выявлены метастатические очаги в органах или тканях.
Локализованная форма заболевания - заболевание, при котором метастатические очаги не выявлены.
Общая выживаемость (ОВ) - выживаемость, которая рассчитывается от начала лечения до окончания исследования или смерти пациента.
Остеосаркома - первично злокачественная опухоль костей, которая развивается из примитивных мезенхимальных стволовых клеток, способных дифференцироваться в костную, хрящевую или фиброзную ткани.
Полный эффект (ПЭ) - полная регрессия мягкотканного компонента опухоли, отсутствие или исчезновение отдаленных метастазов, положительная динамика в виде исчезновения периостальной реакции, уменьшение остеолитических очагов по данным рентгенологического, КТ и МРТ исследований.
Прогрессия заболевания (ПЗ) — прогрессия более 25% от первоначального объема поражения или появление новых метастазов.
Стабилизация заболевания (СЗ) — сокращение менее 50% или прогрессия менее 25% от первоначального объема опухолевого поражения.
Частичный эффект (ЧЭ) — редукция более 50% опухолевой массы по сравнению с первоначально диагностированным объемом.
Хороший ответ (GR) — лечебный патоморфоз IV степени.
Плохой ответ (PR) — лечебный патоморфоз I - III степени.
Skip-метастазы - очаги опухоли, расположенные в одном анатомическом сегменте с опухоль, но не связанные с нею.
1. Краткая информация
1.1. Определение заболевания или состояния (группы заболеваний или состояний)
Остеосаркома - первично злокачественная опухоль костей, которая развивается из примитивных мезенхимальных стволовых клеток, способных дифференцироваться в костную, хрящевую или фиброзную ткани [1].
Саркома Юинга - это новообразование из мелких голубых круглых клеток, характеризующееся высокой степенью злокачественности и поражающая кости и мягкие ткани, главной характеристикой которого является обнаружение перестройки EWSR1 с генами-партнёрами семейства ETS [1,2].
Точная этиология злокачественных новообразований костей и суставных хрящей в настоящее время неизвестна. Эти заболевания являются мультифакторными и не имеют четко определённых драйверных мутаций. Известно, что для остеосаркомы предрасполагающими факторами являются полученная пациентом доза ионизирующего излучения, а также наличие дефекта гена Р53. Для возникновения саркомы Юинга роль внешних факторов остаётся неизвестной.
Патогенез сарком костей основан на неконтролируемом делении опухолевых клеток,. В дальнейшем опухолевые клетки приобретают возможность к метастазированию, инвазии и неоангиогенезу, что выражается в метастатическом поражении других органов и систем преимущественно гематогенным путем [1,2]. При этом для остеосаркомы неконтролируемое деление опухолевых клеток сопровождается продукцией большого количества патологического остеоида, что ведет к разрушению здоровой костной ткани и формированию опухоли
1.2 Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
В отдельно группу относятся вторичные остеогенные саркомы после перенесенных в прошлом злокачественных образований, в развитии которых имеет значение полученная в прошлом химиолучевая терапия либо наличие патологического гена ретинобластомы RB.
1.3 Эпидемиология заболевания или состояния (группы заболеваний или состояний)
Остеогенная саркома является самой распространенной первичной опухолью костей у детей и подростков. Первый пик заболеваемости приходится на препубертатный и пубертатный возраст, второй пик - на возраст старше 65 лет. Среди всех онкологических заболеваний детей и подростков остеосаркома находится на 8 месте и составляет примерно 2,4% - 2,6% от всех злокачественных новообразований у детей. Гендерное соотношение (мальчик/девочки) составляет 1,3-1,6:1. Общая заболеваемость составляет около 4 случаев на 1 миллион детского населения.
Как правило, опухоль поражает длинные кости конечностей (около 80% всех случаев). Чаще всего первичный очаг локализуется в бедренной кости (около 45% случаев), большеберцовой кости (18-20%) и плечевой кости (10%).
Остальные случаи приходятся на редкие локализации: кости черепа (8%), кости таза (8%). Экстраоссальная локализация первичного очага встречается казуистически редко [1-4].
Пик заболеваемости саркомой Юинга приходится на популяцию, возраст которой составляет от 10 до 25 лет. Около 90% больных находятся во второй и третьей декадах жизни. Однако в литературе описаны клинические наблюдения развития саркомы Юинга у младенцев и лиц старческого возраста (75-90 лет). Саркома Юинга составляет 10-15% от всех опухолей костей. Заболеваемость составляет 3,4 случая на 1 миллион населения в год по данным, полученным онкологическими службами Европы и США. Точная российская статистика отсутствует. Мальчики болеют чаще девочек, в соотношении примерно 2:1. 5-летняя выживаемость значительно различается в зависимости от стадии процесса и его локализации [1,2,5-7].
1.4 Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
С40.0 - длинные кости верхних конечностей, лопатка
С40.1 - короткие кости верхней конечности С40.2 - длинные кости нижней конечности
С40.3 - короткие кости нижней конечности
С40.8 - поражение костей и суставных хрящей конечностей, выходящее за пределы одной и более вышеуказанных локализаций
С41.0- кости черепа и лица
С41.1 - нижняя челюсть
С41.2 - позвоночный столб
С41.3 - ребра, грудина, ключицы
С41.4 - кости таза, крестец, копчик
С41.8 - поражение костей и суставных хрящей, выходящее за пределы одной и более вышеуказанных локализаций
1.5 Классификация заболевания или состояния (группы заболеваний или состояний)
Согласно классификации ВОЗ опухолей мягких тканей и костей 2013 года (четвертый пересмотр), выделяют локализованный (местнораспространенный) вариант остеосаркомы (80% случаев) и генерализованный (метастатический) вариант (20% случаев) [1,2].
Центральная;
• Высокой степени злокачественности:
Классическая: хондробластическая, фибробластическая, остеобластичеекая;
Атипичные гистологические формы: остеобластическая остеосаркома - склерозирующий тип: эпите лиойдная; остеобластома-подобная; хондробластома-подобная; подобная хондромиксойдной фиброме; подобная злокачественной фиброзной гистиоцитоме; гигантоклеточная.
Телеангиэктатическая остеосаркома;
Мелкоклеточная остеосаркома;
• Низкой степени злокачественности: низкозлокачественная центральная; подобная фиброзной дисплазии; подобная десмопластической фиброме.
Поверхностная;
• Низкой степени злокачественности: паростальная;
• Промежуточной степени злокачественности: периостальная;
• Высокой степени злокачественности: дифференцированная паростальная.
Интракортикальная
Гнотическая
Внескелетная: высокой и низкой степени злокачественности
Вторичная (ассоциированная с болезнью Педжета, радио индуцированная): как правило высокой степени злокачественности
Классификация саркомы Юинга более простая и говорят о локализованной форме саркомы Юинга, о саркоме Юинга с метастазами в лёгкие (стадия IVa) и о генерализованной форме саркомы Юинга с метастазами в кости и/или в лёгкие и/или в костный мозг
TNM классификация 2010 [8]:
Т - первичная опухоль
• Тх - первичная опухоль не может быть определена
• То - нет признаков первичной опухоли
• Т1 - наибольший размер опухоли < 8 см.
• Т2 - наибольший размер опухоли > 8 см.
• Т3 - несколько несвязанных опухолей в первичной зоне поражения кости.
N - регионарные лимфоузлы
• Nx - наличие метастатического поражения в регионарных лимфатических узлах не может быть определено
• No - нет регионарных метастазов в лимфатические узлы
• N1 - регионарные метастазы в лимфатические узлы
М - отдаленные метастазы
• Мх- наличие отдаленных метастазов не может быть определено или исследование не проводилось
• Мо - отдалённые метастазы отсутствуют
• Mi - имеют место отдалённые метастазы:
• Mia' в легких
• М,ь - другой локализации.
G: степень дифференцировки
• Gx - степень дифференцировки не может быть определена или исследование не проводилось.
• Gi - высокодифференцированная
• G2 - умеренно дифференцированная
• G3 - низкодифференцированная
• G4 - недифференцированная.
• Gi_2 - низкая степень злокачественности;
• G3.4 - высокая степень злокачественности
Стадирование
|
Стадия |
TNM |
Степень злокачественности |
|
IA |
Т1 N0 МО |
Низкая |
|
IB |
Т2 N0 МО |
Низкая |
|
ПА |
Т1 N0 МО |
Высокая |
|
ПВ |
Т2 N0 МО |
Высокая |
|
III |
ТЗ N0 МО |
Любая |
|
IVA |
Любое Т N0 М1а |
Любая |
|
IVB |
Любое Т N1 любое М |
Любая |
|
|
Любое Т любое N М1Ь |
Любая |
1.6 Клиническая картина заболевания или состояния (группы
заболеваний или состояний)
Остеогенная саркома и саркома Юинга могут длительное время развиваться бессимптомно. Клинически первым признаком этих заболеваний является боль в области локализации первичной опухоли. По мере развития заболевания к ней может присоединяться припухлость в области опухоли, нарушение функции, неврологические нарушения при сдавливании периферических нервных окончаний, а также патологические переломы в связи с разрушением структуры кости, в случае локализации в области грудной клетки могут возникать нарушения дыхания, явления плеврита. Для саркомы Юинга характерным бывает уже с самого начала заболевания появление общих симптомов интоксикации, лихорадка, снижение массы тела (так называемые В-симптомы), что, как правило, свидетельствует о распространенном процессе.
2. Диагностика
Критерии установления диагноза/состояния: диагноз остеосаркомы ставится на основании совокупности анамнестических данных, физикалъного обследования, а также результатов лабораторных и инструментальных исследований. Основным критерием подтверждения диагноза является гистологическое исследование биоптата опухоли [5].
1) анамнестические данные — длительный болевой синдром, наличие патологического перелома, наличие ретинобластомы в анамнезе
2) физикалъное обследование - припухлость, объемное образование, нарушение функции конечности, патологический перелом
3) лабораторные исследования — гистологическое и иммуногистохимическое исследование, при саркоме Юинга — молекулярно-генетическое исследование с обязательным определением перестройки генов EWSR1 с генами партнёрами семействыа ETS
4) инструментальное обследование - рентгенография пораженной области, МСКТ и МРТ пораженной области с контрастным усилением, МСКТ грудной клетки с контрастным усилением, сцинтиграфия костей всего тела, при саркоме Юинга - ПЭТ-КТ с фтордезоксиглюкозой
2.1. Жалобы и аамнез
• У всех пациентов с подозрением на остеосаркому или саркому Юинга рекомендуется сбор жалоб и анамнеза [3,5].
Комментарии: Рекомендовано обратить внимание на:
• болевой синдром в области конечностей и других частях опорно-двигательного аппарата, особенно сохраняющийся более 2 недель, вне зависимости от наличия или отсутствия травмы в анамнезе;
• появление опухолевого образования в области костей скелета с тенденцией к увеличению;
• сохраняющаяся лихорадка неясного генеза;
• переломы без признаков консолидации;
• переломы без предшествующей травмы или с травмой, которая не должна была по силе воздействия вызвать типичный перелом (например, перелом костей голени при ударе ногой по футбольному мячу);
• неврологические нарушения (нарушение тазовых фунщий при поражении костей таза, крестца и копчика, онемение в нижних конечностях при поражении седалищных нервов и т.о.);
• затруднение дыхания без видимых причин, чувство сдавления в грудной клетке
Необходимо уточнить:
• наличие в анамнезе ретинобластомы;
• наличие в анамнезе любых других перенесенных онкологических заболеваний;
• наличие онкологических заболеваний у сиблингов;
• наличие онкологических заболеваний у других членов семьи;
• наличие в анамнезе травм, оперативных вмешательств, лучевой терапии, контакта с радиоактивным излучением, хронических заболеваний, перенесенных инфекций.
2.2 Физикальное обследование
• У всех пациентов с подозрением на остеосаркому или саркому Юинга рекомендуется провести общий физикальный осмотр [3,5].
Уровень убедительности рекомендации С (уровень достоверности доказательств 5)
Комментарии: необходимо обратить внимание на состояние сердечно-сосудистой, нервной, дыхательной, пищеварительной и лимфатической систем, опорно-двигательного аппарата, кожи, слизистых и подкожно-жировой клетчатки. При выявлении объемного образования одной из конечностей необходимо провести сравнительный осмотр обеих конечностей, измерить максимальный объем образования сантиметровой лентой.
2.3 Лабораторные диагностические исследования
• Всем пациентам с подозрением на остеосаркому или саркому Юинга рекомендовано проведение следующих лабораторных исследований для уточнения общего состояния пациента, возможности проведения специфического лечения и необходимости назначения сопутствующей и сопроводительной терапии [3,5,9,10]:
о общий (клинический) анализ крови с определением скорости оседания эритроцитов (СОЭ);
о биохимический анализ крови общетерапевтический (б/х) с определением содержания белка, билирубина, мочевины, креатинина, аспартатаминотрансферазы (ACT), аланинаминотрансферазы (АЛТ), лактатдегидрогеназы (ЛДГ), щелочной фосфатазы (ЩФ), Na+, К+, Са+, СГ в сыворотке крови для исключения тяжелых дисфункций; о общий (клинический) анализ мочи, исследование функции нефронов по клиренсу креатинина (проба Реберга), а также анализ мочи мочи методом Нечипоренко; о коагулограмма (ориентировочное исследование системы гемостаза).
2.4 Инструментальные диагностические исследования
Комментарии: для остеогенной саркомы и саркомы Юинга не существует специфического маркера в общем, биохимическом анализе крови и общем анализе мочи.
• Всем пациентам с подозрением на остеосаркому или саркому Юинга рекомендовано проведение рентгенографии области первичного поражения в двух проекциях с масштабной разметкой для первичной диагностики опухолевого образования, а также оценки наличия мягкотканного компонента и периостальной реакции [5,9,11].
Комментарий: Характерные симптомы остеосаркомы — очаг деструкции, игольчатый периостит, «козырек» Кодмана [11], характерный симптом саркомы Юинга - луковичный периостит [6].
• Всем пациентам с подозрением на остеосаркому или саркому Юинга рекомендовано проведение компьютерной томографии (КТ) пораженной области с контрастным усилением [5,9,11].
Комментарий: КТ обязательно должна захватывать всю анатомическую область поражения целиком. В случае КТ таза должен быть снят весь таз, а не его пораженная половина, в случае КТ конечностей, обязательно должны быть захвачены два смежных сустава (для бедренной кости коленный и тазобедренный сустав, для большеберцовой кости - голеностопный и коленный и т.д.). При наличии противопоказаний к введению контрастного вещества КТ может быть выполнена без контраста.
• Всем пациентам с подозрением на остеосаркому или саркому Юинга рекомендовано проведение магнитно-резонансной томографии пораженной области с внутривенным болюсным контрастированием (МРТ) [5,9,11].
Комментарий: Правила выполнения такие же, как при КТ (см. выше). МРТ должна выполняться обязательно для оценки мягкотканного компонента, степени инвазии опухоли в окружающие ткани, распространенность по костно-мозговому каналу, наличия/отсутствия skip-mts и для планирования оптимального места биопсии.
При оценке распространения объемного процесса по блиннику конечности МРТ необходимо выполнять с захватом двух прилегающих суставов для исключения распространения вне первичного очага в пределах пораженной кости и планирования в дальнейшем локального контроля.
Исследование выполняется в 3-х плоскостях с проведением контрастного усиления.
Основные импульсные последовательности —режим с подавлением жировой ткани, Т1 ВИ, Т2 ВИ u DWI.
После введения парамагнетика помимо Т1 ВИ серии проводится Т1 с режимом подавления сигнала от жировой ткани в аксиальной плоскости.
Оценивается объем опухоли, распространенность как по костной ткани с вовлечением прилежащего сустава, так и экстраоссалъный компонент, реакция надкостницы и ее протяженность, изменение прилегающих мягких тканей, сосудисто-нервный пучок, возможное наличие и изменение лимфатических узлов.
При поражении других локализаций нужно учитывать особенности данной анатомической области: например, поражение позвонков и крестца может сопровождаться распространением экстраоссалъного компонента в позвоночный или крестцовый канал с компрессией невральных структур. При поражении позвоночного столба сканирование должно включать режимы и для оценки паравертебральных мягких тканей.
• Всем пациентам с подозрением на остеосаркому или саркому Юинга рекомендовано проведение сцинтиграфии костей всего тела с технецием 99 [5,9].
Комментарий: обязательный метод диагностики для анодирования и поиска метастатических поражений в других отделах опорно-двигательного аппарата.
• Всем пациентам с подозрением на остеосаркому или саркому Юинга рекомендовано проведение КТ органов грудной клетки с контрастным усилением для оценки наличия метастазов в легкие [3,5].
Комментарии: стандартом первичной диагностики метастазов опухолей костей в легких является КТ органов грудной клетки высокого разрешения с внутривенным контрастным усилением и проведением 3-х фаз контрастирования (нативной, артериальной и венозной), с толщиной срезов не более 2,5 мм, с последующим проведением мулътипланарной реконструкции с толщиной срезов 0,625 мм и просмотром в режиме MIP (maximum intensity projections, проекции максимальной интенсивности). При последующей оценке очагового поражения легких в динамике с целью уменьшения лучевой нагрузки целесообразно проведение КТ без контрастного усиления или только венозной фазы контрастирования.
• Всем пациентам с подозрением на саркому Юинга или с верифицированной саркомой Юинга до начала лечения рекомендовано проведение позитронной эмиссионной томографии, совмещенной с компьютерной томографией с туморотропными РФП (флудезоксиглюкозой [ 18F]) для оценки распространенности опухолевого процесса, включая метастатическое поражение не только костной системы и дыхательного аппарата, но и других органов и систем [5,9].
• Всем пациентам с подозрением на саркому Юинга или с верифицированной саркомой Юинга до начала лечения рекомендовано получение цитологического препарата костного мозга путем пункции, цитологическое исследование мазка костного мозга (миелограмма) для оценки распространенности опухолевого процесса, включая метастатическое поражение не только костной системы, но и поражения костного мозга [10].
• Всем пациентам с подозрением на саркому Юинга или с верифицированной саркомой Юинга до начала лечения рекомендовано проведение МРТ головного мозга с контрастным усилением (при наличии противопоказаний к введению контрастного препарата можно без контраста) для оценки возможного метастатического поражения головного мозга, субарахноидального пространства, мягких тканей головы и костей лицевого и мозгового черепа [12].
• Всем пациентам с подозрением на саркому Юинга или с верифицированной саркомой Юинга до начала лечения рекомендовано проведение УЗИ органов брюшной полости, малого таза и периферических лимфоузлов для оценки наличия сопутствующей патологии, которая может помешать дальнейшему лечению, а также с целью поиска очагов в других органов и системах и в периферических лимфоузлах [13].
• Всем пациентам с подозрением на саркому Юинга или с верифицированной саркомой Юинга до начала лечения рекомендовано проведение регистрации электрокардиограммы и эхокардиографии для оценки функции миокарда, в том числе сократимости миокарда и фракции выброса левого желудочка с целью предупредить возможную кардиотоксичность специфического лечения [14].
2.5 Иные диагностические исследования
• Всем пациентам с подозрением на злокачественное новообразование кости по данным клинического осмотра и инструментальным методам исследования рекомендованы биопсия кости и патолого-анатомическое исследование биопсийного (операционного) материала костной ткани, в том числе с применением иммуногистохимических методов, для верификации диагноза [3,5].
Комментарии: биопсия - важнейшая и решающая процедура при диагностировании опухоли кости ши мягких тканей. Как правило, это финальный этап обследования [11,15]. Весь необходимый спектр исследований проводится до биопсии. В соответствии с ними принимается решение о ее проведении или, наоборот, отказе от нее. В первую очередь, это касается МРТ первичного очага с контрастом. Данное исследование помогает определить наиболее репрезентативную область в опухолевом очаге, которую необходимо сбиопсироватъ, найти наиболее короткий и безопасный путь к данной области. В-третьих, проведение биопсии до МРТ не только может привести к серьезным ошибкам и осложнениям, но и изменит инициальную картину опухоли, что затруднит оценку последующей динамики лечения.
Стандарты выполнения биопсии:
1. Планирование места биопсии, по возможности, должно проводиться на междисциплинарном совещании при участии врача-онколога (детского онколога), врача- травмапюлога-орпюпеда, врача-патологоанатома и врача-радиотерапевта или врача- радиолога. Это необходимо для выбора наиболее репрезентативного очага [11,15-17].
2. Биопсия должна выполняться в специализированном онкологическом стационаре, при возможности, в операционной, оснащенной С-дугой (ЭОП), под общей анестезией [15,16].
3. При выполнении биопсии должен учитываться будущий операционный доступ (операция по удалению опухоли), на конечностях разрез должен быть продольный, при постановке Рэдон-дренажа его точка выхода должна быть на одной линии с разрезом. По возможности, разрез должен быть не более 4-5 см [11,18].
4. Техника проведения должна быть максимально аккуратной и щадящей. Необходимо исключить работу инструментом за пределами биопсийного тракта, в целях предотвращения контаминации опухолевыми клетками окружающих тканей. Не допускать повреждения анатомических грант] между компартментами [11,15,19].
5. Забор материала лучше делать скальпелем, чтобы избежать его повреждения [15].
6. При необходимости забора костной ткани - выполняется остеотомия в виде овала или прямоугольника с закругленными краями. Форма квадрата, прямоугольника, круг — должны быть исключены. При необходимости увеличения костного окна, в целях сохранения опороспособности кости, окно увеличивается в продольном направлении, ни в коем случае не в поперечном [11,20].
7. Количество забранного материала должно быть достаточным для проведения всех видов гистологического исследования (при необходимости в операционную приглашается врач- патологоанатом для визуальной оценки материала), проведения цитогенетического исследования, для его консервации в био-банке, а также для архива и на случай необходимости пересмотра вреференс-центрах [15,16,18,20].
8. При дифференциальном диагнозе с остеомиелитом необходимо дополнительно часть материала отправлять на бактериологическое исследование [11].
9. Как правило, биопсии проводят без наложения жгута, так как это может помешать проведению адекватного гемостаза. Если жгут все же используется, то его категорически нельзя накладывать на область, пораженную опухолью. Снимать его необходимо до ушивания раны, с целью проведения гемостаза [11,15,16].
10. Необходим тщательный гемостаз с целью предотвращения развития гематомы (потенциально контаминированной опухолевыми клетками), при необходимости проводится дренирование [15,21].
11. Тщательное ушивание раны, при необходимости маркировка биопсийного тракта титановыми хирургическими скрепками [11].
12. Морфологическая верификация полученного биопсийного материала должна проводиться в крупных учреждениях онкологического профиля (референс-центрах) при наличии врача- папюлогоанапюма с соответствующей подготовкой [15].
Неправильный выбор места биопсии или нарушения техники её выполнения ставят под угрозу проведение адекватного локального контроля, ограничивают выбор способа мышечной пластики, значительно повышают риск рецидива после выполнения последующей органосохранной операции, а в некоторых случаях могут сделать ее проведение невозможным [11].
3. Лечение
Во всех случаях верифицированной злокачественной опухоли кости у пациентов младше 2 лет целесообразно обсуждение лечебной тактики в рамках консилиума, желательно с привлечением медицинского учреждения федерального уровня [5].
• Всем пациентам с остеосаркомой, начиная с ПА стадии, и всем пациентам с саркомой Юинга рекомендована комплексная терапия, включающая неоадъювантную химиотерапию, хирургическое лечение, адъювантную химиотерапию, а также при саркоме Юинга лучевую терапию [3,5,9,22-24].
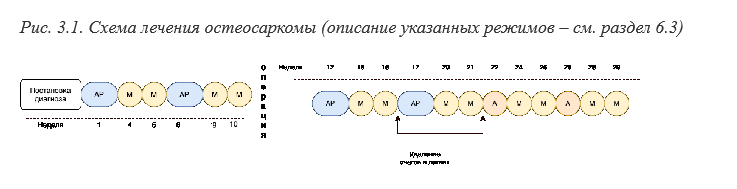
• Всем пациентам с остеосаркомой, начиная с ПА стадии, рекомендована неоадьювантная и адъювантная химиотерапия (см. раздел 6.3) [3,25].
Выбор схемы адъювантной терапии зависит от ответа на неоадъювантную терапию (степени терапевтического патоморфоза) (см. рис. 3.1)
Первый курс адъювантного АР проводится через 1-2 недели после оперативного вмешательства, в зависимости от состояния пациента. Также целесообразно на первом курсе снизить гидратацию до 2500 мл/м2 и внимательно следить за диурезом.
• Всем пациентам с локализованной формой периостальной или параостальной (юкстакортикальной) остеосаркомы не рекомендуется проведение ПХТ [5,11,26,27]
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 4)
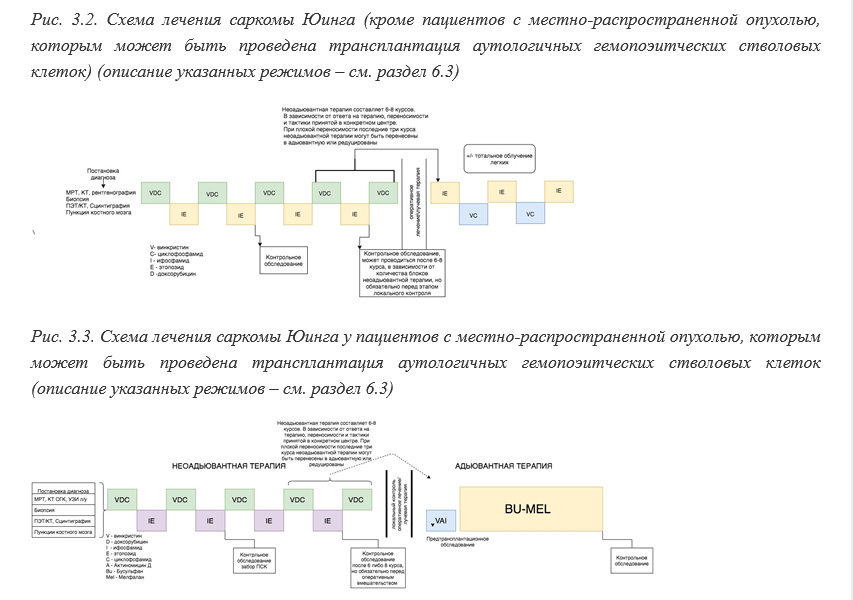
• Всем пациентам с саркомой Юинга рекомендована неоадьювантная и адъювантная химиотерапия (см. раздел 7.3) [6,9,28].
Уровень убедительности рекомендации C (уровень достоверности доказательств 5)Комментарии: неоадьювантная терапия включает в себя чередование курсов VDC (винкристин**, доксорубицин**, циклофосфамид**) и IE (ифосфамид**, этопозид**) с интервалом 14 дней (схемы представлены в разделе 7.3.2). Должно быть проведено минимум 6 курсов неоадьювантного лечения [28,29]. В случае если у пациента отмечается выраженная токсичность и плохая переносимость, оставшиеся курсы могут быть перенесены в постоперационный период или редуцированы.
Адъювантная химиотерапия состоит из курсов IE и VC - суммарно до 14 курсов.
Максимальная кумулятивная доза доксорубицина** не должна превышать 375мг/лг [28]).
• Всем пациентам с локально распространенной саркомой Юинга (объем более 200 мл) при наличии возможности рекомендована высокодозная химиотерапия с последующей трансплантацией аутологичных гемопоэтических стволовых клеток [22,30].
Уровень убедительности рекомендации В (уровень достоверности доказательств 3)
Комментарии: заготовка стволовых клеток производится исходя из принципов, принятых в том или ином центре.
Кондиционирование перед аутологичной трансплантацией периферических стволовых клеток проводится в рамках схемы, принятой в том или ином учреждении, имеющим опыт проведения подобных манипуляций. Как правило, кондиционирование включает в себя бусулъфан• ** или треосулъфан**, а также мелфалан**. Также кондиционирование и сопроводительная терапия в период перед ТГСК зависит от клинического статуса пациента и индивидуальной переносимости тех или иных препаратов.
Рис. 3.4. Схема показаний к рекомендации у пациентов с саркомой Юинга

Стационар, проводящий лечение, должен быть хорошо оснащен технически: иметь возможность интраоперационной рентгенографии (С-дуга), иметь многофункциональные установки для коагуляции. При проведении операции важен междисциплинарный подход - участие абдоминальной хирургической бригады при операциях на костях таза, участие нейрохирургической бригады при операциях на позвоночнике.
• Всем пациентам с верифицированной злокачественной опухолью кости, за исключением признанных инкурабельными решением междисциплинарного консилиума, рекомендуется органоуносящая операция (ампутация или экзартикуляция) согласно срокам протокола лечения при наличии хотя бы одного из следующих показаний [11,31-33]: о гигантские размеры опухоли, поражающей все окружающие ткани вплоть до кожных покровов [11,31]
о вовлечение в опухолевый процесс магистрального сосудисто-нервного пучка, технически исключающее проведение реконструктивно-пластического этапа операции [11,31] о прогрессирование на фоне предоперационной ПХТ [11]
о отказ пациента от органосохраняющей операции [11,33]
о жизненные показания к экстренному хирургическому вмешательству в связи с изъязвлением, распадом опухоли и/или кровотечением [11,31]
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
• Всем пациентам с верифицированной злокачественной опухолью кости, за исключением признанных инкурабельными решением междисциплинарного консилиума, при отсутствии показаний к выполнению органоуносящей операции рекомендуется органосохраняющая операция (резекция сегментарная с эндопротезированием, резекция сегментарная с реконструктивно-пластическим компонентом) [33,34].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
• У всех пациентов при удалении злокачественных опухолей костей, согласно классификации Enneking, рекомендовано следовать следующим базовым принципам резекций [11,31]:
о широкая резекция (en-block) - подразумевает удаление опухоли без повреждения псевдокапсулы и в муфте из визуально неизмененных окружающих тканей; о радикальная резекция - удаление опухоли с целым анатомическим компартментом, в котором она расположена.
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
• Всем пациентам с периостальной или параостальной (юкстакортикальной) остеосаркомой рекомендуется радикальное хирургическое лечение вне зависимости от степени распространения опухоли [5,11,26,27]
Уровень убедительности рекомендаций С (уровень достоверности доказательств —4) Комментарии: хирургически предпочтительно выполнение широкой резекции
Уровень убедительности рекомендаций C (уровень достоверности доказательств –4)
• Всем пациентам с саркомой Юинга рекомендуется проведение лучевой терапии [5,6,9]
Комментарии: Лучевая терапия у пациентов с саркомой Юинга, как правило, применяется в комбинации с операцией, но может проводиться в самостоятельном плане у неоперабельных пациентов. Также может проводиться облучение метастатических очагов и тотальное облучение легких. Особенности лучевой терапии при саркоме Юинга - см. раздел 7.4
3.3 Лучевая терапия
• Всем пациентам, получающим лечение в стационаре, при поступлении в стационар и далее от 1 до 4 раз в месяц рекомендуется проводить нутритивный скрининг с целью выявления белково-энергетической недостаточности либо риска ее развития [35].
Комментарии: критерии белково-энергетической недостаточности и факторы нутритивного рска — см. приложение Г1. Первичный скрининг проводится либо с помощью оценки антропометрических показателей и выявления риска, либо с использованием стандартных шкал/утилит для проведения нутритивного скрининга [36,37]. Основными антропометрическими параметрами для оценки нутритивного статуса являются: масса тела, рост, индекс массы тела, окружность плеча (ОП), толщина кожно-жировой складки над трицепсом (КЖСТ), окружность мышц плеча (ОМП) [38,39].
Нутритивный скрининг заключается в первичной и затем регулярной оценке нутритивного статуса и риска развития белково-энергетической недостаточности, в том числе скрытой, у каждого пациента, с момента поступления в стационар. Частота проведения нутритивного скрининга может варьировать от 1 до 4 раз в месяц и должна определяться конкретной клинической ситуацией и особенностями проводимого лечения [40,41].
• Пациентам с выявленными нутритивными нарушениями при поверхностном скрининге с помощью специальных шкал, либо в результате антропометрии рекомендуется более детальное обследование нутритивного статуса: анализ питания, оценка тканевого состава тела, оценка лабораторных показателей, а также детальный физикальный осмотр на предмет выявления нутритивно-метаболических нарушений и их предикторов [42].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
• Всем пациентам с белково-энергетической недостаточностью или высоким риском ее развития (независимо от нутритивного статуса) рекомендуется проведение нутритивной поддержки (НП) [43].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: первой формой НП должно являться диетологическое консультирование с последующей коррекцией основного рациона и возможным назначением дополнительно лечебных питательных смесей.
Расчет тотального расхода энергии (ТРЭ) проводится по формуле: ТРЭ = ЭОО х КК, где ЭОО - энергия основного обмена, КК — конверсионный коэффициент. Золотым стандартом для определения ЭОО является непрямая калориметрия. При невозможности проведения непрямой калориметрии, ЭОО возможно вычислять по формуле (например, Schofield) [44]. Во избежание гипералиментации на начальных этапах нутритивной поддержки детям с хронической белково-энергетической недостаточностью и/или с предполагаемым дефицитом поступления нутриентов 3 и более месяцев подряд в анамнезе для вычисления ТРЭ используется КК=0,85-
1,4. Точный объем нутритивного вмешательства определяется в зависимости от конкретной клинической ситуации.
При выборе формы, метода, вида и объема НП необходимо руководствоваться, в первую очередь, принципом индивидуального подхода - сообразно клинической ситуации и логике.
Энтеральное питание (ЭП) является приоритетным при выборе метода нутритивной поддержки [45]: оно является наиболее физиологичным, обеспечивая внутрипросветную трофику слизистой оболочки ЖКТ, препятствует микробной транслокации из просвета кишечника в кровь, является экономически более выгодным, чем парентеральное питание.
Выбор метода ЭП определяется сохранностью глотательной функции, а также функциональным состоянием ЖКТ: отсутствие аппетита, нежелание принимать пищу и смеси для ЭП, нарушение глотательной функции, невозможность перорального восполнения потребности в нутриентах и энергии - показания для проведения ЭП через назогастральный зонд. Наличие патологических состояний, при которых пациент не должен принимать пищу естественным путем (острый панкреатит, стеноз выходного отдела желудка, высокие проксимальные свищи) — в этих случаях показана реализация ЭП через назоеюнальный зонд. Выбор режима введения энтерального питания определяется конкретной клинической ситуацией, состоянием гастроинтестинального тракта: в зависимости от клинического состояния используется болюсный или капельный (непрерывное или сеансовое введение) режим введения питательной смеси.
Начинать энтеральное питание истощенным пациентам целесообразно с изокалорической полимерной смеси с последующим переходом на гиперкалорийную (под контролем переносимости). При наличии явлений малъабсорбции следует рассмотреть вопрос о назначении полуэлементной/олигомерной смеси.
При необходимости проведения зондового питания продолжительностью более б недель, а также при невозможности адекватной алиментации другими методами энтерального пистания и при отсутствии противопоказаний для проведения ЭП и самой гастростомии показано наложение гастростомы. В случае, когда на начальных этапах нутритивной поддержки выявляется необходимость длительного проведения энтерального питания и прогнозируется риск развития нутритивной недостаточности (в т.ч. при проведении химиолучевого лечения), либо при наличии у ребенка тяжелой хронической белковоэнергетической недостаточности с высоким риском ее усугубления в дальнейшем возможно превентивное наложение гастростомы, минуя этап зондового питания. Преимущественным и, желательно, единственным питательным субстратом, вводимым в гастростому должны являться специализированные питательные смеси.
Всем пациентам, получающим НП, необходимо проводить нутритивный мониторинг, который должен включать антропометрию, анализ тканевого состава тела, лабораторные показатели (биохимическое исследование крови, копрограмма)
• Всем пациентам, которым невозможно обеспечить расчетную нутритивную потребность энтеральным путем, рекомендуется назначение парентерального питания [46].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5)
Комментарии: ключевым (и единственным) показанием для назначения парентерального питания (ПП) является невозможность обеспечить расчетную нутритивную потребность пациента энтеральным путем — текущая или потенциально возможная в краткосрочной перспективе. Потребность в парентеральном введении аминокислот рассчитывается индивидуально и зависит от возраста пациента, клинического статуса, количества поступающего белка энтеральным путем (см. приложение Г1). Парентеральное поступление жиров должно быть ограничено до максимум 4 г кг суш у доношенных и недоношенных детей и 3 г кг суш у детей старшего возраста. Введение жиров нужно начинать с меньших доз, за 3- 4 дня наращивая объем до расчетных значений, следя за переносимостью по лабораторным показателям [46]. В процессе ПП необходим постоянный мониторинг уровня триглицеридов в плазме крови и уменьшение введения липидов при необходимости. Отсутствуют точные данные о том, какой уровень триглицеридов у детей может приводить к неблагоприятным последствиям — предположительно, их максимальная концентрация не должна превышать 250 мг/дл (2,8 ммоль/л) для новорожденных и 400 мг/дл (4,5 ммоль/л) для детей более старшего возраста [46]. Потребность в парентеральном введении глюкозы рассчитывается индивидуально и зависит от возраста пациента, клинического статуса, количества поступающих углеводов энтеральным путем. Введение глюкозы нужно начинать с меньших объемов, за 3-4 дня наращивая объем до расчетных значений — следя за уровнем гликемии.
• Всем пациентам, получающим НП, рекомендуется нутритивный мониторинг, который может включать антропометрию, анализ тканевого состава тела, лабораторные показатели (биохимическое исследование крови, копрограмма) [45,47]
• Пациентам при возникновении острого или хронического болевого синдрома рекомендуется провести диагностику причины болевого синдрома и последующую патогенетическую или сипмтоматическую терапию болевого синдрома в соответствии с существующими профильными рекомендациями [48].
• Всем пациентам после хирургического лечения в объеме эндопротезирования суставов рекомендовано проведение реабилитационных мероприятий [49].
Комментарии: основные принципы реабилитационной терапии:
1. Постепенное увеличение интенсивности упражнений на область оперативного вмешательства;
2. Регулярность;
3. Следует выполнять лечебную физкультуру, направленную на весь организм.
Комплекс реабилитационных мероприятий следует разделить на несколько периодов:
Ранний период начинается сразу после операции, после удаления дренажной системы. Как правило, это происходит на 2-3 сутки. Упражнения направлены на минимальную нагрузку в области оперативного вмешательства и осуществляются с помощью аппаратов для пассивной разработки функции суставов. Основная задача состоит в том, чтобы добиться максимального объема движений в суставе без нагрузки на мышечные и костные структуры. При этом необходимо постепенно увеличивать угол сгибания и разгибания конечности.
Второй период предполагает постепенное увеличение мышечной активности.
Третий период направлен на увеличение мышечной массы.
При оперативных вмешательствах на нижних конечностях все этапы реабилитационных мероприятий должны чередоваться с регулярными занятиями ходьбой. Первые шаги должны происходить поэтапно: с помощью ходунков, на костылях, с палкой и, наконец, без опоры.
• Всем пациентам с остеосаркомой или саркомой Юинга после окончания лечения в течение 5 лет рекомендовано катамнестическое наблюдение по следующей схеме [50]:
1-2 год - каждые 3 месяца, 3-5 годы - каждые 6 месяцев: консультация врача- детского онколога, КТ органов грудной клетки с контрастным усилением, рентгенография зоны установки эндопротеза, УЗИ области послеоперационного рубца.
Организация оказания медицинской помощи
Показания для госпитализации в медицинскую организацию:
1. Необходимость проведения биопсии, оперативного лечения, лучевой терапии, химиотерапии;
2. Коррекция посткурсовой анемии, тромбоцитопении, нейтропении, фебрильной нейтропении;
3. Коррекция эндопротеза или другой замещающей имплантируемой конструкции
4. Инфицирование эндопротеза или другой замещающей имплантируемой конструкции
5. Необходимость проведения манипуляции под общей анестезией
6. Необходимость постановки или уточнения диагноза
Показания к выписке пациента из медицинской организации
1. Окончание этапа терапии, при условии, что пациент находится в стабильном удовлетворительном соматическом статусе
2. Окончания всего лечения, достижение ремиссии при условии, что пациент находится в стабильном удовлетворительном соматическом статусе
3. Инкурабельность пациента с возможностью его перевода под наблюдение паллиативной службы либо в хоспис
6. Дополнительная информация, влияющая на течение и исход заболевания
6.1. Особенности биопсии опухолевых образований костей у детей
6.1.1. Планирование биопсии:
При планировании биопсии необходимо учитывать биологические особенности сарком костей и мягких тканей. Саркомы растут центростремительно, таким образом, что самая незрелая часть расположена по растущему краю. Между опухолью и сдавливаемыми ее окружающими нормальными тканями формируется реактивная зона. Реактивная зона состоит из индуцированной пролиферации мезенхимальных клеток, неоангиогенеза и воспалительного процесса. Данная зона может быть поражена опухолевыми клетками, скопления которых называется сателлитами, они не являются метастазами. Тип мезенхимальной пролиферации определяется анатомической локализацией опухоли: мягкотканные опухоли стимулируют фиброзную реакцию, а внутрикостные очаги стимулируют костеобразующую реакцию. То есть, один и тот же патологический очаг в разных анатомических областях будет стимулировать разные мезенхимальные реакции. В отличие от сарком, карциномы обычно инфильтрируют окружающие ткани, а не оттесняют их, и обычно не индуцируют формирование реактивной зоны. Таким образом, очаг саркомы более гетерогенный, в то время как очаг карциномы более гомогенный [11]. Для постановки диагноза в случае карциномы, часто достаточно проведения трепан-биопсии. При саркоме это может вести к диагностической ошибке, так как материал будет взят не из репрезентативного очага. В международной литературе это называется “sampling error” - ошибка выборки [11].
Так как в процессе проведения биопсии происходит загрязнение операционной области опухолевыми клетками, что может увеличивать риск локального рецидива. Это обуславливается размером хирургического доступа, грубыми манипуляциями инструментом, неадекватностью гемостаза, отсутствием маркировки биопсийного тракта. Независимо от того, проводилась ли открытая биопсия или трепан-биопсия, в последствии, необходимо исходить из того, что область биопсии загрязнена опухолевыми клетками и следовательно должна быть иссечена с соблюдением всех онкологических правил (широкий отступ, оставление тракта и на опухоли, иссечение места стояния дренажа) [16]. Поэтому кожный разрез и биопсийный тракт должны быть расположены строго е соответствии с будущим операционным доступом [11]. Путь к опухоли должен быть, по возможности максимально коротким, проходить не более чем через один мышечный компартмент, и находится на безопасном расстоянии от магистрального сосудисто-нервного пучка [11,15].
6.1.2 Операционные доступы при проведении биопсии
Для каждого сегмента конечностей существуют классические операционные доступы для проведения локального контроля. Эти доступы необходимо учитывать при проведении биопсии. [7,8,9]
Пояс верхней конечности

Рис. 6.1 Проекция для биопсии лопатки [11]
При проведении биопсии на верхней конечности необходимо учитывать стандартный доступ для операции Тихова-Линберга. В зависимости от локализации и распространенности опухоли используется либо весь доступ, либо его часть.
На Рис. 6.1 изображена задняя часть доступа, которая может быть использована для удаления опухоли лопатки. Эта же линия и является проекцией для выбора места биопсии лопатки.
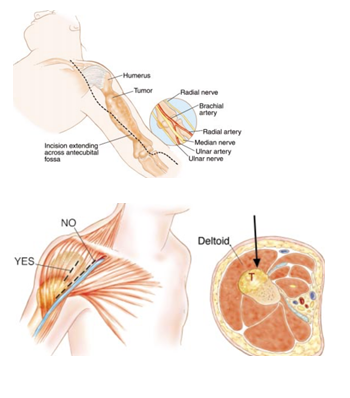
Рис. 6.2 Проекция для биопсии опухоли плеча [11]
На Рис. 6.2 часть доступа, используемая для проведения операции по удалению опухоли плечевой кости, как в проксимальной, так и в дистальной частях.
Линия доступа, используемая для биопсии на предплечье и кисти, как правило выбирается индивидуально, в зависимости от локализации, размеров и планируемой операцией. Так как эти локализации довольно редкие, классических рекомендаций нет.
Пояс нижних конечностей
Биопсия опухолей костей таза сложная процедура ввиду анатомии данной области. Открытая биопсия должна проводиться после тщательного предоперационного планирования и междисциплинарного обсуждения. Если выбрано проведение трепан-биопсии, то последняя должна выполняться под контролем КТ [51].
Для удаления опухолей таза существует унифицированный тазовый доступ (Рис 6.3 и 6.4), также как и на верхнем плечевом поясе, в зависимости от локализации и размеров опухоли, он может использоваться полностью, либо могут быть использованы какие-либо его части. Однако, ряд специализированных центров иногда используют его модификации.

Рис 6.3. Задняя часть унифицированного тазового доступа, при необходимости может быть продлена дистальнее по линии крестцово-подвздошного сочленения [11].
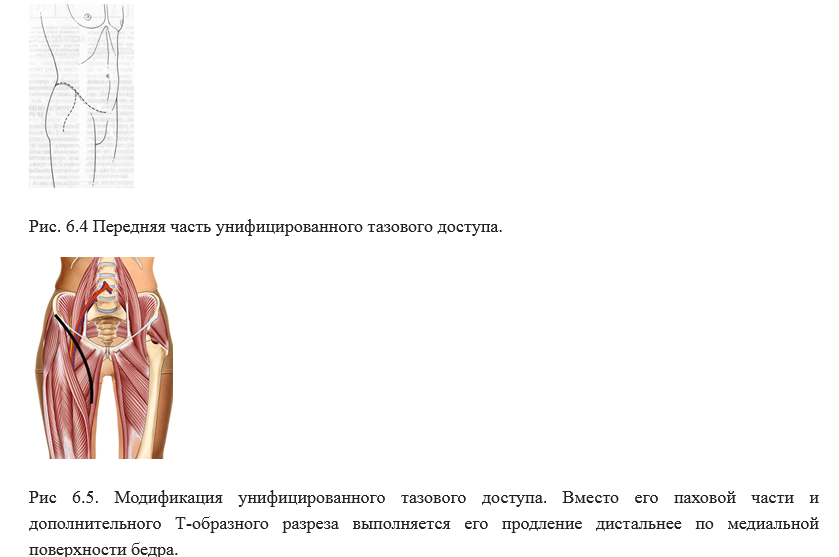
Проведение биопсии (открытой или трепан-биопсии) должно проводится только в проекции унифицированного тазового доступа [51]. Выполнение биопсии в проекции модификаций доступа возможно только в тех центрах, где в дальнейшем будет выполняться операция по удалению опухоли.
При локализации очага на бедре в верхних двух третях предпочтительна биопсия с латеральной стороны (Рис. 6.6). Как правило, с этим не возникает сложностей, так как мышечный массив с латеральной стороны меньше по объему. В нижней трети возможна биопсия как с медиальной, так и с латеральной стороны, в зависимости от локализации мягкотканного компонента

На голени, из-за дефицита мягких тканей и особенностей кровоснабжения, корректное выполнение биопсии крайне важно. Ошибка выбора доступа, изъязвление места биопсии, не бережное отношение к мягким тканям - могут привести к невозможности проведения органосохраняющей операции.
Предпочтительное место проведения биопсии - передне-медиальный доступ. В редких случая возможно выполнение биопсии через передний доступ Рис. 6.8. При опухоли м/берцовой кости выполняется латеральный доступ, при котором крайне важно знать топографию малоберцового нерва Рис. 6.9.
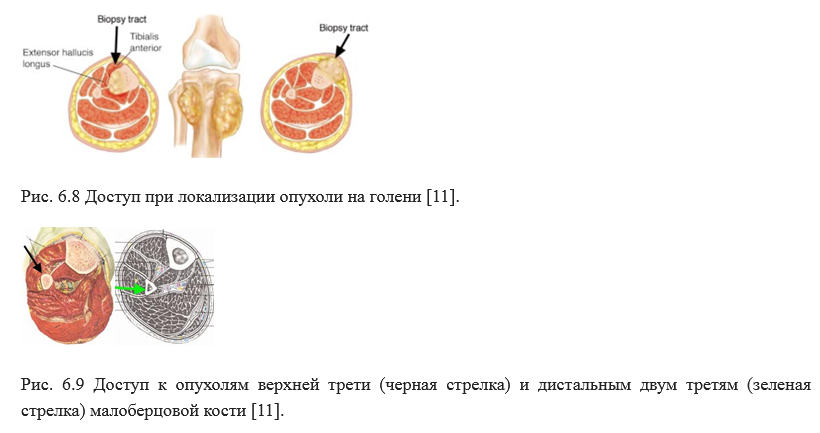
Дистальный отдел голени и стопа крайне редкая локализация опухолей. Поэтому в отличие от таких локализация как плечо, или область коленного сустава, в этой области нет таких же широко распространенных методик.
Локализация опухоли в дистальном и среднем отделах стопы, как правило, требует проведения ампутации, поэтому доступ для биопсии выбирается индивидуально. Для биопсии пяточной кости предпочтителен медиальный доступ. Однако, при необходимости может быть выбран и латеральный доступ. Таранная кость биопсируется из переднего доступа. Также при необходимости может быть использован медиальный. В связи с появлением новых методик, стало возможным проведение эндопротезирования голеностопного сустава, поэтому тут также важно учитывать будущий доступ для операции. В данной области предпочтителен передне-латеральный доступ. Рис. 6.10. В связи с выраженным дефицитом мягких тканей, крайне важно избегать их контаминации опухолевыми клетками.

Отдельно стоит сказать о такой сложной локализации как позвонки. Учитывая, что как правило опухоли данной локализации манифестируют с неврологической симптоматики и болевого синдрома, в большинстве случаев пациентам требуется декомпресионная ламинэктомия по жизненным показаниям. Если данная процедура выполняется не в онкологическом, а как часто бывает, в нейрохирургическом стационаре, крайне необходимо, чтобы оперирующий хирург отдал удаляемые, компримирующие, ткани на гистологическое исследование и провел тщательный гемостаз перед ушиванием раны. При наличии дефекта в позвонке, закрыл его гемостатиком, воском или костным цементом [11].
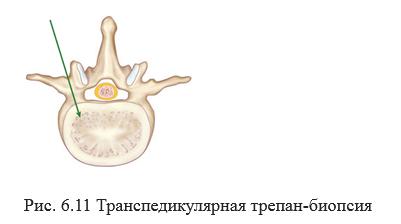
При выявлении опухоли позвонка без распространения в спинномозговой канал, без неврологической симптоматики, выполняется транспедикулярная трепан-биопсия под контролем компьютерной томографии [51] (Рис. 6.11).
Главная цель хирургического лечения - радикальное удаление опухоли, что должно гарантировать отсутствие развития локального рецидива [11,32,52].
6.2.1 Базовые принципы резекции злокачественных опухолей
На сегодняшний день существует 4 базовых принципа резекций злокачественных опухолей [11,31,52]:
1. Внутриочаговая резекция - заключается в удалении опухоли по частям, с повреждением псевдокапсулы, с большим риском обсеменения области операции опухолевыми клетками.
2. Краевая резекция - удаление по краю или через псевдокапсулу опухоли. Подобный тип операции может вести к тому, что микроскопически край резекции может проходит по опухолевой ткани.
3. Широкая резекция (en-block) - подразумевает удаление опухоли без повреждения псевдокапсулы и в муфте из визуально неизмененных окружающих тканей.
4. Радикальная резекция - удаление опухоли с целым анатомическим компартментом, в котором она расположена.
Современная онкоортопедия рекомендует использование широкой резекции или радикальной резекции при удалении злокачественных опухолей костей. Однако ширина муфты из неизмененных тканей и отступ по кости до сих пор дискутабельны. Ряд источников рекомендует отступ от 3 до 7 см, что проблематично применять у пациентов детского возраста, ввиду их антропометрических данных. Ряд современных источников, в том числе рекомендации ESMO, советуют безопасную границу резекции 2 см на «свежем» удаленном препарате и 1 см после его фиксации [53-55].
Радикальная резекция также применима, особенно в случаях, когда у пациента выявлены skip- mts [11,52].
На сегодняшний день появились исследования, допускающие краевую резекцию при злокачественных опухолях костей, особенно при остеосаркоме, но не при саркоме Юинга. Однако, ввиду малого числа исследований, большинство из которых ретроспективные и имеют период наблюдения менее 5 лет, применять данный тип хирургического лечения не целесообразно [53-55].
Внутриочаговая резекция противопоказана при злокачественных опухолях костей.
Исключением может быть гиганто-клеточная опухоль. До сих пор нет единого мнения о злокачественности данной нозологии. Согласно МКБ-10, данная опухоль относится к доброкачественным, но ряд зарубежных специалистов относит ее к потенциальнозлокачественным.
6.2.2 Органоуносящие операции
Принятие решения о проведении органоуносящей операции должно проводиться коллегиально, с участием онколога, онкоортопеда, лучевого терапевта, специалиста лучевой диагностики, патолога, психолога. Родители должны быть подробнейшим образм оповещены о причинах принятого решения [32].
Виды органоуносящих операций:
1. Ампутация на уровне кисти
2. Ампутация на уровне средней трети предплечья
3. Ампутация на уровне средней трети плеча
4. Экзартикуляция в плечевом суставе
5. Межлопаточно-грудная ампутация
6. Ампутация на уровне стопы
7. Ампутация на уровне средней трети голени
8. Ампутация на уровне средней трети бедра
9. Экзартикуляция в т/бедренном суставе
10. Межподвздошно-брюшная ампутация (гемипельвэктомия)
6.2.3 Органосохраняющие лечения
При отсутствии показаний к органоуносящей операции возможно выполнение органосохраняющей операции, разновидностями которых являются:
1. Эндопротезирование
2. Биологическая реконструкция (использование аутотрансплантата малоберцовой кости на сосудистой ножке, аллографта)
6.2.3.1 Эндопротезирование
В современной онкоортопедии среди различных способов восстановления дефекта и функции конечности после удаления опухолевого очага ведущее место занимают высокотехнологичные операции с использованием эндопротезов. Использование модульных систем эндопротезирования является предпочтительным способом реконструкции костных дефектов при злокачественных опухолях костей у пациентов подросткового возраста, достигших костной зрелости. Современные технологии позволяют выполнить эндопротезирование практически любой локализации. Для пациентов детского возраста с незрелым скелетом существуют индивидуально изготовленные, раздвижные эндопротезы, удлиняемые по мере роста пациента [34,52,56].
Выделяют следующие виды реконструктивных операций в объёме эндопротезирования:
• стандартные первичные операции у пациентов подросткового возраста с применением модульных систем эндопротезирования;
• стандартные первичные операции у пациентов детского возраста с применением индивидуально изготовленных раздвижных имплантов;
• эндопротезирование редких анатомических зон конечностей: лучезапястный сустав, локтевой сустав, голеностопный сустав;
• ревизионное эндопротезирование (ввиду асептической нестабильности, инфекционных осложнений, поломки элементов эндопротеза, полной выработки механизма удлинения импланта);
• эндопротезирование после резекции костей таза с применением имплантов изготовленных на 3D-np интере;
• эндопротезиование позвонков.
Особенности при первичном эндопротезировании у детей и подростков [34,52,56,57]:
• изготовления индивидуального импланта для пациентов с незрелым скелетом, без возможности варьирования использования интрамедуллярных ножек и методов фиксации;
• строгое следование предоперационной планировке у пациентов с раздвижными эндопротезами;
• раздвижной механизм эндопротеза (инвазивный и неинвазивный);
• сохранение условий для реэндопротезирования и коррекции дефицита длины конечностей.
Рост количества случаев первичного эндопротезирования и успехи XT костных сарком приводят к ежегодному увеличению количества пациентов, нуждающихся в повторных ортопедических операциях в связи с развитием таких осложнений как асептическая нестабильность, поломка элементов эндопротеза, полная выработка механизма удлинения импланта, появление блокировки зоны роста или появление деформации оси конечности. Проведение ревизионных операций вне зависимости от их причины требует подготовленной команды онкоортопедов и соответствующего оборудования. Ревизионный эндопротез для пациентов с незрелым скелетом изготавливается индивидуально, что позволяет, не удаляя весь эндопротез, заменить его часть. Применение модульной системы эндопротезирования у пациентов со зрелым скелетом упрощает выполнение последующих ревизионных операций и увеличивает биологический резерв кости, за счет возможности замены отдельных элементов и установки специальных интрамедуллярных ножек [34,56-58].
Особенности хирургической техники [11,56-58]:
1. оставление биопсийного тракта ad mass с опухолью;
2. соблюдение ортопедических правил фиксации интрамедуллярных ножек эндопротеза;
3. соблюдение физиологической оси конечности и восстановление ее дооперационной длины;
4. наличие хирургических навыков для выполнения мышечной пластики при необходимости;
5. адекватная реконструкция мышечного компонента для укрытия импланта и восстановления функции.
При локализации опухолевого очага в диафизе сегмента конечности, по возможности, необходимо сохранить суставы пациента. Для этого проводится удаление только диафиза - интеркалярная резекция [59,60]. Замещение пострезекционного дефекта в этом случае может быть проведено при помощи эндопротеза, а также при помощи биологической реконструкции - использования аутотрансплантата малоберцовой кости на сосудистой ножке, при необходимости аллографта, а также остеосинтеза одной или двумя пластинами с угловой стабильностью [61-63].
Для возможности проведения данной операции должны быть соблюдены следующие условия [59,61,62]:
1. Возможность соблюдения всех онкологических правил резекции
2. Наличие у пациента возможности забора аутотрансплантата малоберцовой кости
3. Наличие в стационаре микрохирургической бригады и микрохирургического оборудования
4. Владение навыками остеосинтеза
6.2.3 Хирургическое лечение метастатического поражения легких
Хирургическое лечение является основным методом локального контроля метастазов ОС, в первую очередь метастазов в легких. Излечение пациента от метастатической формы ОС возможно только в случае достижения полной хирургической ремиссии (ПХР) в легких. ПХР значительно улучшает прогноз после рецидива и общую выживаемость пациентов, недостижение ремиссии не обеспечивает длительного выживания [64-69]. 5-летняя общая выживаемость после полной резекции метастатических очагов легких варьирует от 32 до 39%, при невозможности проведения полной резекции - от 0 до 2% [66,67]. Попытка проведения полного удаления метастазов должна предприниматься всякий раз, но при соблюдении двух важных условий: полного контроля над первичной опухолью и сохранения достаточного для жизнедеятельности объема легочной ткани после резекции [70]
В протоколе EURAMOS метастатическая болезнь легких имеет следующее определение: 3 или более очагов максимальным диаметром > 5 мм или единичный очаг > 1 см, выявленные на
МСКТ, трактуются как очевидные метастазы; меньшее количество очагов или очаги меньшего диаметра трактуются как возможные метастазы. Если пациент с первичными метастазами проходит лечение с куративной целью, все очаги должны быть полностью удалены, вне зависимости от их количества и расположения. Удаление очагов абсолютно показано пациентам, у которых при инициальной диагностике выявлены очевидные или возможные метастазы в легких.
«Золотым» стандартом лечения метастатического поражения легких при ОС остается торакотомия, позволяющая провести мануальную пальпацию легкого и обнаружить маленькие и глубоко расположенные метастазы, не выявленные на предоперационной МСКТ [71,72]. Для торакоскопии и видеоассистированной торакотомии отведена роль биопсии с целью постановки диагноза и стадирования, куративные возможности минимально инвазивной хирургии ограничены [68,70,73].
В настоящее время при унилатеральном поражении легких при ОС большей частью исследователей признан следующий подход: проведение унилатеральной торакотомии с резекцией всех выявленных очагов и тщательное наблюдение после операции. Проведение эксплоративной торакотомии с контрлатеральной стороны при унилатеральном поражении признано нецелесообразным.
При билатеральном поражении легких хирургические опции включают в себя симультанные билатеральные торакотомии (синхронные), этапные билатеральные торакотомии, разделенные во времени (метахронные), и срединную стернотомию. Каждый вариант имеет как преимущества, так и недостатки. Преимуществом симультанных билатеральных торакотомий является возможность адекватно осмотреть каждый гемиторакс и провести две операций за одно анестезиологическое пособие. Недостатком является длительность анестезиологического пособия, включающая в себя необходимость обеспечения восстановления адекватной сердечно- легочной деятельности при переходе с однолегочной вентиляции с одной стороны на однолегочную вентиляцию с противоположной стороны. Фактором, ограничивающим проведение синхронных торакотомий, является множественное поражение легких, а именно наличие 10-ти и более очагов в одном/обоих легких по данным предоперационной КТ ОГК. Наиболее общепринятым и рекомендуемым является проведение этапных билатеральных торакотомий, которые обеспечивают возможность адекватно осмотреть каждый гемиторакс и не сопровождаются таким длительным анестезиологическим пособием, как при симультанных торакотомиях. Кроме того, такой вид оперативного вмешательства показан при множественном поражении легких. Недостатком этапных операций является вероятность задержки проведения следующей торакотомии из-за медленного восстановления и послеоперационных осложнений, что может привести к прогрессии заболевания и к увеличению объема последующей резекции. Некоторые хирурги предпочитают проводить срединную стернотомию [74-76]. Для этого операционного доступа есть ряд противопоказаний, а именно: преимущественная локализация метастазов в задних отделах легких, большие и/или множественные метастазы в нижней доле левого легкого, предшествующие операции на грудной клетке. Кроме того, этот доступ требует большего взаимодействия между хирургом и анестезиологом на протяжении всего оперативного вмешательства. Также следует отметить большую травматичность повторной стернотомии, если
таковая потребуется [70]. Преимуществами стернотомии считаются проведение одного доступа для двусторонней экспозиции и резекции и менее выраженный по сравнению с торакотомией болевой синдром в послеоперационном периоде. В исследовании Abbo О описывается проведение билатеральной передней стерноторакотомии (разреза по типу «раковины моллюска») у детей с метастазами ОС в легкие [68].
Множественность (> 5) очагов не должна являться противопоказанием к проведению хирургического вмешательства. Операция должна проводиться строго на коллабированнном легкого в условиях однолегочной вентиляции. При наличии субплеврально расположенных очагов показано проведение атипичных клиновидных резекций легкого для сохранения большего объема паренхимы, при локализации очагов в прикорневых отделах показано проведение анатомических резекций (лобэктомии/билобэктомии/пульмонэктомии) [77].
6.3 Особенности проведения курсов химиотерапии
6.3.1 Химиотерапия остеосарком
Курс АР [25]
Доксорубицин** - 37,5 мг/м /сут, 48-часовая непрерывная инфузия, 1-2 сутки (суммарно 75 мг/ м2)
#Цисплатин** 40 мг/м /сут, 72-часовая непрерывная инфузия , 1-3 сутки (суммарно 120 мг/м ) Гидратация - 3000 мл/м за 24 часа
Перед началом каждого курса необходимо выполнить исследования:
• Рст, вес и площадь поверхности тела
• Клинический осмотр
• Общий анализ крови и лейкоцитарная формула
• Биохимический анализ крови (креатинин, мочевина, натрий, калий, кальций, магний, фосфат, щелочная фосфатаза, белок, бикарбонат, печеночная трансаминаза, билирубин)
• После накопленной дозы доксорубицина 300 мг/м : фракция выброса левого желудочка
Минимальные критерии для начала химиотерапии
• Нейтрофилы > 0,75 х109/л
• или лейкоциты > 2,0 х109/л
• Тромбоциты >75 х109/л
• Билирубин < 1,25 х верхняя граница нормы
• СКФ > 70 мл/мин/1.73 м2
• Сердечная деятельность ФВ левого желудочка > 50%
Курс М [24.25]
Метотрексат** 12000 мг/м2 в/в кап за 4 часа
Гидратация - 3000 мл/м за 24 часа, с достаточным количеством натрия гирокарбоната** (150 ммоль на 3 литра физ. р-ра или декстрозы 5%). Гидратация корригируется на фоне измерения pH мочи, которое проводится каждые 4-6 часов.
Перед началом каждого курса необходимо выполнить исследования:
• Рост, вес и площадь поверхности тела
• Клинический осмотр
• Общий анализ крови и лейкоцитарная формула
• Биохимический анализ крови (креатинин, мочевина, натрий, калий, кальций, магний, фосфат, щелочная фосфатаза, белок, бикарбонат, печеночные трансаминазы, билирубин)
• Значение pH мочи
• Коагулограмма
• Общий (клинический) анализ мочи (если есть изменения, выполнить анализ мочи по Нечипоренко)
Минимальные критерии для начала химиотерапии
• Нейтрофилы > 0,25 х109/л
• или лейкоциты > 1,0 х109/л
• Тромбоциты >75 х109/л
• Билирубин < 1,25 х верхняя граница нормы
• СКФ > 70 мл/мин/1.73 м2
• Значение pH мочи > 7,0
• Трансаминазы <5 N
Перед началом курса необходимо убедиться в отсутствии скопления больших объемов жидкости в «третьем пространстве», то есть в плевральных полостях, в области таза и брюшной полости, так как метотрексат** может задерживаться в них и вызывать ожоги слизистой.
В связи с тем, что метотрексат** вводится в очень высокой дозе, необходимо убедиться в том, что в клинике есть возможность проводить мониторинг концентрации метотрексата в крови.
Сопроводительная терапия
• Антиэметическая - в соответствии с принятыми рекомендациями по ведению пациентов на высоко эметогенной терапии [78]
• Кальция фолинат** вводится в дозе 15 мг/м каждые 6 часов, начиная с 24 часа от введения метотрексата** [79,80]
Концентрация метотрексата** и его выведение
|
Время забора |
Значение |
|
24 час |
10 ммоль/л |
|
42 час |
1 ммоль/л |
|
48 час |
0.25 ммоль/л |
|
72 час |
Менее 0,1 ммоль/л |
|
При задержке метотрексата** показано увеличение дозы кальция фолината**, объема гидратации до 4000 мл/м2, проведение форсированного диуреза. При задержке метотрексата** более 50 ммоль/л, доза кальция фолината** увеличивается до 50мг/м2 и вводится каждые 3 часа При задержке метотрексата** более 100 ммоль/л, доза кальция фолината** увеличивается до 100 мг/м2 и вводится каждые 3 часа |
|
С прогностической точки зрения важно также определять так называемую пиковую концентрацию метотрексата в конце 4-го часа инфузии.
КурсА [24]
#Доксорубицин* * - 37,5 мг/м /сут, 48-часовая непрерывная инфузия (1-2 сутки)
Гидратация - 3000 мл/м за 24 часа
Перед началом каждого курса необходимо выполнить исследования:
• Рост, вес и площадь поверхности тела
• Клинический осмотр
• Общий анализ крови и лейкоцитарная формула
• Биохимический анализ крови (креатинин, мочевина, натрий, калий, кальций, магний, фосфат, щелочная фосфатаза, белок, бикарбонат, печеночная трансаминаза, билирубин)
• После накопленной дозы доксорубицина** 300 мг/м : фракция выброса левого желудочка
Минимальные критерии для начала химиотерапии:
• Нейтрофилы
• или лейкоциты
• Тромбоциты
• Билирубин
• СКФ
• Сердечная деятельность
> 0,75 х109/л
> 2,0 х109/л >75x10%
< 1,25 х верхняя граница нормы
> 70 мл/мин/1.73м2
ФВ левого желудочка > 50%
Сопроводительная терапия:
• Антиэметики - в соответствии с принятыми рекомендациями по ведению пациентов на высоко эметогенной терапии [78]
• Диуретики - каждые 6 часов необходимо измерять соотношение между введенной жидкостью и выделенной, при задержке жидкости на фоне большого объема инфузии, показано проведение форсированного диуреза
• Колонне стимулирующие факторы (далее - Г-КСФ) -должны назначаться при снижении уровня нейтрофилов менее 0,5 тыс/мкл, либо при появлении в посткурсовом периоде фебрильной нейтропении. Пациенты, имевшие на прошлом курсе АР осложнения в виде
фебрильной нейтропении, сепсиса могут получать препараты Г-КСФ уже спустя 24-48 часов после окончания курса
• Обработка полости рта растворами антисептиков, полоскание полости рта
6.3.2 Химиотерапия саркомы Юинга Блок VDC [23.28.29.81]
Винкристин** - 2 мг/м (не более 2 мг; 0,05 мг/кг для детей от 1 до 3 лет и 0,025 мг/кг для детей младше 1 года) в/в струйно медленно - день 1
Доксорубицин** - 37,5 мг/м2/сут (для детей <1 года 1,25 мг/кг в день) в/в кап продленной
инфузией за 48 часов - день 1,2 (суммарно 75 мг/м )
Циклофосфамид** - 1200 мг/м (для детей младше 3 лет 40 мг/кг х 1 в день) в/в кап за 1 час - день 1
Месна** - 1200 мг/м - 600 мг/м дается перед введением циклофосфамида**, 600 мг/м - после.
Г-КСФ 5 мкг/кг 4-13 дни (при интервале 14 дней стимуляция плановая через 24 часа после окончания ПХТ, прекратить за 24 часа до начала ПХТ, либо при восстановлении показателей) ежедневно до достижения абсолютного числа нейтрофилов больше 0,75 х 109/л и количества тромбоцитов больше 75 х 109/л. Продолжать следующий курс химиотерапии через 24 часа после последней дозы Г-КСФ.
Не допускается введение в один просвет доксорубицина** и месны**, поэтому необходима установка двухпросветного катетера, либо вводить месну** каждые 4 часа, перекрывая инфузию доксорубицина**.
Кумулятивная доза доксорубицина** не должна превышать 375 мг/м2, после достижения этой дозы (после 5 курсов) режим вводится без доксорубицина** (режим VC)
Блок IE [28]
Ифосфамид** - 1800 мг/м (для детей <1 года используют 50% от рассчитанной дозы на м ) в/в капельно за 4-5 часов - 1, 2, 3, 4, 5 дни
Этопозид** - 100 мг/м (для детей <1 года используют 50% от рассчитанной дозы на м ) в/в кап за 2 часа - 1,2,3,4,5 дни
Ифосфамид** вводится на фоне суточной инфузии месны** (100-150% от дозы ифосфамида**) за 24 часа, начать введение месны** за 3-4 часа до ифосфамида**. Ифосфамид** и месна** должны идти по разным инфузионным системам.
Между курсами возможна стимуляция Г-КСФ.
Минимальные критерии для начала курса: нейтрофилы > 0,75 х 109/л, тромбоциты > 75 х 109/ л.
6.4. Особенности лучевой терапии при саркоме Юинга
6.4.1 Технические требования к оборудованию для ДЛТ
Линейный ускоритель электронов с энергией фотонов 6-10 МэВ, оснащенный многолепестковым коллиматором и, крайне желательно, системой/системами визуального контроля укладки: компьютерной томографией в коническом пучке (СВСТ), портальной визуализацией.
Фиксирующие приспособления для головы и тела (термопластические маски, вакуумные матрасы и др.).
Рентгеновский компьютерный томограф для топометрии, имеющий плоскую деку с возможностью крепления и индексацией систем фиксации.
Система 3-D планирования облучения и, крайне желательно, с возможностью расчета облучения с применением методик модулированной по интенсивности лучевой терапии в статическом и динамическом режимах (IMRT/VMAT).
Выполнение КТ-топометрии должно проводиться на рентгеновском компьютерном томографе, приспособленном для нужд радиотерапии.
Разметка проводится с использованием индивидуальных средств фиксации:
• при локализации в области головы и шеи - термопластических масок и вакуумного матраса,
• при локализации в области средостения, брюшной полости и полости малого таза - вакуумного матраса и др.
Послеоперационные, постбиопсийные рубцы должны быть помечены рентгенконтрастными метками.
Сканирование проводится с толщиной среза:
• в области головы и шеи - 1-3 мм,
• в области средостения, брюшной полости и малого таза - 2-5 мм.
Величина поля изображения (Field Of View, FOV) должна быть максимальной для включения всех частей тела и систем фиксации.
Необходимо предусмотреть, что при топометрии и лучевой терапии пациентов младше 5 лет может потребоваться общая анестезия.
Планирование проводится на нативной серии КТ-топометрии.
Макроскопический объем опухоли (GTV) определяется как максимальное распространение опухоли - до начала терапии или прогресса на фоне лечения.
Для его уточнения необходимо совмещение разметочных КТ-грамм и диагностических КТ или MPT-изображений, данных ПЭТ/КТ, проведенных перед началом всего курса лечения или на фоне прогресса заболевания.
Клинический объем мишени (CTV) включает GTV с отступом 2 см с учетом анатомических барьеров распространения опухоли. Область послеоперационного рубца от биопсии или резекции должна быть включена в объем облучения [82].
Исключение: см раздел «Лучевая терапия отдельных локализаций опухоли».
Планируемый объем мишени (PTV) включает CTV с дополнительным отступом 3-10 мм в соответствии с внутренними стандартами клиники и должен составлять:
• для головы и шеи - 3-7 мм
• для средостения, забрюшинного пространства и малом тазу - 5-10 мм
• для конечностей - 10 мм
Допустимо уменьшение отступов на PTV при выполнении ежедневного контроля укладки с помощью компьютерной томографии в коническом пучке (СВСТ) перед сеансом облучения.
Обычное фракционирование (одна фракция в сутки, пять фракций в неделю, с разовой дозой 1,8-2,0 Гр) является приоритетным режимом фракционирования.
Только нормальное фракционирование допустимо при вовлечении большого объема кишечника в поле облучения. Также оно является строго обязательным, если в поле облучения входят структуры ЦНС (например, для опухолей позвоночника), так как для восстановления тканей ЦНС требуются более длительные интервалы между фракциями.
Пактиномшшн должен быть исключен из схемы лечения на время проведения лучевой терапии.
Поксорубииин **: при возникновении сильной кожной или кишечной реакции, доза доксорубицина должна быть снижена или полностью исключена при последующих курсах во время лучевой терапии.
Бусулъфан * *: облучение легких как до, так и после применения бусульфана** может вызвать тяжелый фиброз легкого. Тотальное облучение легких должно быть исключено. Локальное облучение возможно при незначительном вовлечении легочной ткани в объем облучения. При расположении первичной опухоли в области грудной стенки, стойким злокачественным плевральным выпотом или после нерадикальной резекции опухоли возможность применения лучевой терапии в сочетании с бусульфаном• ** требует дополнительного обсуждения. Стоит избегать включения больших объемов кишечника в зону. Если это необходимо, лучевая терапия должна проводиться не ранее 8-10 недель после введения бусульфана** [82]. При вовлечении структур ЦНС в объем облучения, доза на них не должна превышать 30 Гр [83].
Показания:
• прогрессирование на фоне неоадъювантной химиотерапии
• невозможность проведения оперативного лечения в объеме R0
• наличие патологических состояний требующих срочной коррекции, таких как компрессия спинного мозга (при условии невозможности коррекции с помощью других лечебных опций).
Проводится совместно с 3-4 или 5-6 курсом индукционной химиотерапии.
При обычном фракционировании суммарная очаговая доза составляет 54,0 Гр [82].
Показания:
• плохой гистологический ответ на неоадьювантную химотерапию (10% или более жизнеспособных опухолевых клеток) [84,85].
• позитивные края резекции после операции (R1 или R2 резекция)
• оперативное лечение на этапе диагностики, если в последующем не была выполнена «second look» операция.
• расположение опухоли в паравертебральной области или области таза [86,87].
Пациентам, которым показан послеоперационный курс лучевой терапии, сначала продолжают курсы послеоперационной (консолидирующей) химиотерапии.
Лучевая терапия должна быть начата после заживления послеоперационных ран, обычно после 2-4 цикла консолидирующей терапии.
У пациентов с макроскопическим или микроскопическим остатком, лучевая терапия может быть начата ранее.
При послеоперационной лучевой терапии дозы зависят от края резекции и ответа опухоли на проводимую индукционную (неоадьювантную) химиотерапию:
• R2 резекция - 45-54 Гр (с возможностью эскалации дозы до 60,0 Гр на остаточную опухоль, в
зависимости от размера и локализации первичной опухоли, а также возраста пациента)
• R1 резекция с плохим гистологическим ответом (10% или более жизнеспособных опухолевых клеток) - 54 Гр
• R1 резекция с хорошим гистологический ответом (менее 10% жизнеспособных опухолевых клеток) - 45 Гр
• R0 резекция с плохим гистологическим ответом (10% или более жизнеспособных опухолевых клеток) - 45 Гр [82]
6.4.8 Радикальная лучевая терапия
Радикальная лучевая терапия применяется только для неоперабельных больных.
Лучевая терапия начинается после окончания неоадьювантной химиотерапии.
Суммарные дозы составляют 54-60 Гр. После достижения дозы 45 Гр следует сократить объем облучения (CTVboost=GTV).
У детей младше 10 лет, с благоприятными прогностическими факторами (маленький размер опухоли <100 мл, полный ответ на химиотерапию по данным МРТ или биопсии «second look»), доза может быть редуцирована.
6.4.9 Лучевая терапия отдельных локализаций опухоли.
Опухоли конечностей.
Безопасные отступы на CTV в проксимальном и дистальном направлении должны быть не менее 3-5 см, и не менее 2 см в боковых направлениях.
В случае наличия признаков обширного интрамедуллярного поражения целесообразно облучение всей кости.
Область операции и послеоперационный рубец должны входить в поле облучения.
При облучении после эндопротезирования, протез должен быть включен в область облучения с безопасным краем 2 см.
Если возможно, следует редуцировать дозу облучения на область метаэпифизарных пластинок (зон роста кости) до 20 Гр.
Чтобы избежать развития фиброза, следует снижать дозу на участок кожи и подкожной клетчатки со стороны максимально удаленной от места первичной опухоли на всем протяжении мишени.
При облучении областей рядом с суставом, доза на последний не должна превышать 45 Гр.
При облучении в высоких дозах, после достижения 45 Гр следует уменьшить поля до объема максимального распространение опухоли - до начала терапии или прогресса на фоне лечения
(GTV) с безопасным краем в проксимальном и дистальном направлении 2 см, и не менее 1-2 см в боковых направлениях (CTV).
Опухоли туловища. головы и шеи/черепа.
Безопасный край во всех направления должен составлять не менее 2-х см с учетом анатомических барьеров. Меньшие отступы допускаются, если в объем входят критические структуры без инвазии в них опухоли.
Опухоли таза и грудной стенки.
Опухоли данной локализации часто имеют большую внутрибрюшную или внутригрудную распространённость, которые хорошо сокращаются на химиотерапии.
Клинический объем мишени (CTV) должен включать объем распространения опухоли в мягких тканях и костях на момент начала терапии (GTV) с отступом 2 см во все стороны и корректироваться в отношении возможного распространения в брюшную и плевральную полость.
Если опухоль инфильтрирует плевральную полость показано облучение всего легкого с пораженной стороны:
• у пациентов младше 14 лет с РОД 1,5 Гр до СОД 15 Гр;
• у пациентов старше 14 лет с РОД 1,8 Гр до СОД 19,8 Гр
Зона первичной опухоли должна облучаться до суммарной дозы 45 Гр. Возможна эскалация дозы до 54 Гр в области максимального риска рецидива опухоли.
Важно! У пациентов с опухолями грудной стенки, которые получают химиотерапию, содержащую бусульфан, следует избегать облучения больших объемов легочной ткани и требует дополнительного обсуждения.
Позвоночник
Объем облучения (CTV) должен включать в себя по одному здоровому позвонку выше и ниже опухоли, а также паравертебральный мягкотканый компонент с безопасным краем 2 см.
Приоритетными способами облучения являются: конформное облучение в динамической арке, или многопольное облучение (IMRT).
Лопатка
При опухолях в верхней части лопатки, включение плечевого сустава и головки плечевой кости обязательно.
Тотальное облучение обоих легких.
Облучение легких показано пациентам с метастазами в легкие на этапе постановки диагноза [87].
Оба легких должны быть облучены:
• у пациентов младше 14 лет с РОД 1,5 Гр в СОД 15 Гр
• у пациентов младше 14 лет с РОД 1,5 Гр в СОД 18 Гр.
Возможно дополнительное облучение отдельных метастатических очагов до эквивалентных доз
45 Гр.
Важно! Исключить тотальное облучения легких у пациентов в схемах, содержащих бусульфан!
Облучение костных метастазов
Облучение костных метастазов требует дополнительного обсуждения. Показаны эквивалентные дозы не менее 45 Гр без использования широких отступов.
У пациентов, получавших бусульфан, лучевая терапия должна проводиться через 8-10 недель после окончания высокодозной химиотерапии [82,88].
Метастазы в головной мозг:
Тотальное облучение головного мозга в дозе в режиме классического фракционирования с РОД 2 Гр до СОД 30 Гр.
Возможен буст на отдельные очаги до дозы 50 Гр, если имеется не более 2-х очагов и размер их не превышает 2-3 см.
Толерантные дозы на здоровые ткани
• Спинной мозг: максимальная доза не более 40 Гр (Dmax < 40 Гр). Исключением являются опухоли позвоночника где максимальная допустимая доза составляет 50-54 Гр. При использовании Бусульфана доза на спинной и головной мозг не должна превышать 30 Гр.
• Сердце: Dmean < 30 Гр.
• Печень: объем ткани пече
Список литературы
1. Fletcher C.D.M. et al. WHO Classification of Tumours of Soft Tissue and Bone. Fourth Edition. 2013. 468 p.
2. Doyle L.A. Sarcoma classification: An update based on the 2013 World Health Organization Classification of Tumors of Soft Tissue and Bone // Cancer. John Wiley and Sons Inc., 2014. Vol. 120, № 12. P. 1763-1774.
3. Ritter J., Bielack S.S. Osteosarcoma // Ann. Oncol. 2010. Vol. 21. P. 320-325.
4. Ottaviani G., Jaffe N. The epidemiology of osteosarcoma // Cancer Treatment and Research. Kluwer Academic Publishers, 2009. Vol. 152. P. 3-13.
5. Sybil Biennann J. et al. Bone Cancer. NCCN Guidelines Version 1.2020. 2019.
6. Van Den Berg H. et al. Ewing tumors in infants // Pediatr. Blood Cancer. 2008. Vol. 50, № 4. P. 761-764.
7. Shi Z. et al. Renewed interest in the role of consolidative radiotherapy in advanced stage diffuse large В-cell lymphoma // Leukemia and Lymphoma. 2013. Vol. 54, № 10. P. 2122-2130.
8. Sobin L.H., Gospodarowicz M.K., Wittekind C. TNM Classification of Malignant Tumours. Wiley, 2011. 201 p.
9. Potratz J. et al. Ewing sarcoma: Clinical state-of-the-art // Pediatric Hematology and Oncology. 2012. Vol. 29, № 1. P. 1-11.
10. Детская онкология. Национальное руководство. Под ред. М.Д. Алиева, В.Е. Полякова, ЕЛ. Менткевича, С.А. Маяковой. М.: Издательская группа РОНЦ. Практическая медицина, 2012. 684 р.
11. Malawer М.М., Sugarbaker PH. Musculoskeletal Cancer Surgery - Treatment of Sarcomas and Allied Diseases. Springer, 2001. 626 p.
12. Bekiesinska-Figatowska M. et al. CNS Metastases from Bone and Soft Tissue Sarcomas in Children, Adolescents, and Young Adults: Are They Really So Rare? 2017.
13. Bundscherer F., Deeg K.H., Seiler A. [Sonographic diagnosis of solid space-occupying abdominal lesions in childhood], //Monatsschr. Kinderheilkd. 1987. Vol. 135, № 1. P. 30-35.
14. Youssef G., Links M. The prevention and management of cardiovascular complications of chemotherapy in patients with cancer // American Journal of Cardiovascular Drugs. 2005. Vol. 5, № 4. P. 233-243.
15. Traina F. et al. Current concepts in the biopsy of musculoskeletal tumors: AAOS exhibit selection // J. Bone Jt. Surg. - Am. Vol. Journal of Bone and Joint Surgery Inc., 2015. Vol. 97, № 2. P. е7(1).
16. Kubo Т. et al. A meta-analysis supports core needle biopsy by radiologists for better histological diagnosis in soft tissue and bone sarcomas // Medicine (United States). Lippincott Williams and Wilkins, 2018. Vol. 97, № 29. P. el 1567.
17. Мацко Д.Е. Саркомы костей: классификация, гистологическое строение, особенности морфологической диагностики//Практическая онкология. 2010. Vol. 11, № 1. Р. 1-10.
18. Pohlig F. et al. Percutaneous core needle biopsy versus open biopsy in diagnostics of bone and soft tissue sarcoma: a retrospective study. // Eur. J. Med. Res. 2012. Vol. 17. P. 29.
19. Mankin H.J., Mankin C.J., Simon M.A. The hazards of the biopsy, revisited: For the members of the musculoskeletal tumor society // J. Bone Jt. Surg. - Ser. A. 1996. Vol. 78, № 5. P. 656-663.
20. Clark C.R. et al. The effect of biopsy-hole shape and size on bone strength. // J. Bone Joint Surg. Am. 1977. Vol. 59, № 2. P. 213-217.
21. Егоренков В.В., Бит-Сава Е.М., Молчанов М.С. Правила забора материала для морфологического исследования // Практическая онкология. 2017. Vol. 18, № 4. Р. 336-342.
22. Ladenstein R. et al. Primary disseminated multifocal Ewing sarcoma: Results of the Euro- EWING 99 trial // J. Clin. Oncol. 2010. Vol. 28, № 20. P. 3284-3291.
23. Biswas B. et al. Developing a prognostic model for localized Ewing sarcoma family of tumors: A single institutional experience of 224 cases treated with uniform chemotherapy protocol // Journal of Surgical Oncology. John Wiley and Sons Inc., 2015. Vol. Ill, № 6. P. 683-689.
24. Whelan J.S. et al. EURAMOS-1, an international randomised study for osteosarcoma: results from pre-randomisation treatment f on behalf of the EURAMOS collaborators // Ann. Oncol. 2015. Vol. 26. P. 407-414.
25. Smeland S. et al. Survival and prognosis with osteosarcoma: outcomes in more than 2000 patients in the EURAMOS-1 (European and American Osteosarcoma Study) cohort // Eur. J. Cancer. Elsevier Ltd, 2019. Vol. 109. P. 36-50.
26. Laitinen M. et al. The prognostic and therapeutic factors which influence the oncological outcome of parosteal osteosarcoma // Bone Jt. J. British Editorial Society of Bone and Joint Surgery, 2015. Vol. 97B, № 12. P. 1698-1703.
27. Cesari M. et al. Periosteal osteosarcoma // Cancer. 2011. Vol. 117, № 8. P. 1731-1735.
28. Womer R.B. et al. Randomized controlled trial of interval-compressed chemotherapy for the treatment of localized ewing sarcoma: A report from the children’s oncology group // J. Clin. Oncol. American Society of Clinical Oncology, 2012. Vol. 30, № 33. P. 4148-4154.
29. Miser J.S. et al. Treatment of metastatic Ewing’s sarcoma or primitive neuroectodermal tumor of bone: evaluation of combination ifosfamide and etoposide—a Children’s Cancer Group and Pediatric Oncology Group study // J. Clin. Oncol. 2004. Vol. 22, № 14. P. 2873-2876.
30. Tenneti P. et al. Role of High-Dose Chemotherapy and Autologous Hematopoietic Cell Transplantation for Children and Young Adults with Relapsed Ewing’s Sarcoma: A Systematic Review // Sarcoma. Hindawi Limited, 2018. Vol. 2018.
31. Heck R.K. General principles of tumors // Campbells Operative Orthopaedics. 10th edition. 2004. P. 733-792.
32. Rougraff B.T. et al. Limb salvage compared with amputation for osteosarcoma of the distal end of the femur: A long-term oncological functional, and quality-of-life study // J. Bone Jt. Surg. - Ser. A. Journal of Bone and Joint Surgery Inc., 1994. Vol. 76, № 5. P. 649-656.
33. Gitelis S. et al. Principles of limb salvage surgery // Chapman's Orthopaedic Surgery, 3rd edition. 2001. P. 3309-3381.
34. Marulanda G.A. et al. Use of extendable prostheses: A limb-salvaging alternative for patients with malignant bone tumors // Expert Review of Medical Devices. 2008. Vol. 5, № 4. P. 467-474.
35. Joffe L. et al. Nutritional status and clinical outcomes in pediatric patients with solid tumors: A systematic review of the literature // Seminars in Oncology. W.B. Saunders, 2019. Vol. 46, № 1. P. 48- 56.
36. Isenring E., Elia M. Which screening method is appropriate for older cancer patients at risk for malnutrition? // Nutrition. Elsevier Inc., 2015. Vol. 31, № 4. P. 594-597.
37. Martin L. et al. Diagnostic criteria for the classification of cancer-associated weight loss // J. Clin. Oncol. American Society of Clinical Oncology, 2015. Vol. 33, № 1. P. 90-99.
38. Manary M.J., Sandige H.L. Management of acute moderate and severe childhood malnutrition // BMJ. BMJ, 2008. Vol. 337, № 7680. P. 1227-1230.
39. van den Broeck J., Eeckels R., Massa G. Validity of Single-Weight Measurements to Predict Current Malnutrition and Mortality in Children // J. Nutr. 1996. Vol. 126, № 1. P. 113-120.
40. Meijers J.M.M. et al. Nutritional care; do process and structure indicators influence malnutrition prevalence over time? // Clin. Nutr. Churchill Livingstone, 2014. Vol. 33, № 3. P. 459- 465.
41. Muscaritoli M. et al. Consensus definition of sarcopenia, cachexia and pre-cachexia: Joint document elaborated by Special Interest Groups (SIG) “ cachexia-anorexia in chronic wasting diseases” and “ nutrition in geriatrics” // Clin. Nutr. Clin Nutr, 2010. Vol. 29, № 2. P. 154-159.
42. Kondrup J. et al. ESPEN guidelines for nutrition screening 2002 // Clin. Nutr. Churchill Livingstone, 2003. Vol. 22, № 4. P. 415-421.
43. Rickard К. A. et al. Reversal of protein-energy malnutrition in children during treatment of advanced neoplastic disease // Ann. Surg. Lippincott, Williams, and Wilkins, 1979. Vol. 190, № 6. R 771-781.
44. Joosten K.F.M., Kerklaan D., Verbruggen S.C.A.T. Nutritional support and the role of the stress response in critically ill children // Current Opinion in Clinical Nutrition and Metabolic Care. Lippincott Williams and Wilkins, 2016. Vol. 19, № 3. P. 226-233.
45. Arends J. et al. ESPEN guidelines on nutrition in cancer patients // Clin. Nutr. Churchill Livingstone, 2017. Vol. 36, № 1. P. 11-48.
46. Koletzko B. et al. Guidelines on Paediatric Parenteral Nutrition of the European Society of Paediatric Gastroenterology, Hepatology and Nutrition (ESPGHAN) and the European Society for Clinical Nutrition and Metabolism (ESPEN), Supported by the European Society of Paediatri // Journal of Pediatric Gastroenterology and Nutrition. J Pediatr Gastroenterol Nutr, 2005. Vol. 41, № SUPPL. 2. 87 p.
47. August D.A., Huhmann M.B. A.S.P.E.N. Clinical guidelines: Nutrition support therapy during adult anticancer treatment and in hematopoietic cell transplantation // Journal of Parenteral and Enteral Nutrition. JPEN J Parenter Enteral Nutr, 2009. Vol. 33, № 5. P. 472-500.
48. Абузарова E.P et al. Обезболивание взрослых и детей при оказании медицинской помощи. Методические рекомендации. ФЕБОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России., 2016. 94 р.
49. Punzalan М., Ну den G. The role of physical therapy and occupational therapy in the rehabilitation of pediatric and adolescent patients with osteosarcoma // Cancer Treatment and Research. 2009. Vol. 152. P. 367-384.
50. Феденко A.A. et al. Практические рекомендации по лечению первичных злокачественных опухолей костей (остеосаркомы, саркомы Юинга) // Злокачественные опухоли: Практические рекомендации RUSSCO. 2019. Vol. 9. Р. 259-271.
51. Mavrogenis A.F. et al. How should musculoskeletal biopsies be performed? // Orthopedics. Slack Incorporated, 2014. Vol. 37, № 9. P. 585-588.
52. Ruggieri P. et al. Outcome of expandable prostheses in children // J. Pediatr. Orthop. 2013. Vol. 33, № 3. P. 244-253.
53. Andreou D. et al. The influence of tumor- and treatment-related factors on the development of local recurrence in osteosarcoma after adequate surgery. An analysis of 1355 patients treated on neoadjuvant Cooperative Osteosarcoma Study Group protocols. // Ann. Oncol. Off. J. Eur. Soc. Med. Oncol. 2011. Vol. 22, № 5. P. 1228-1235.
54. Kandel R. et al. Surgical margins and handling of soft-tissue sarcoma in extremities: A clinical practice guideline // Curr. Oncol. Multimed Inc., 2013. Vol. 20, № 3. P. e247.
55. Casali P.G., Blay J.-Y. Soft tissue sarcomas: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up // Ann. Oncol. 2010. Vol. 21. P. 198-203.
56. Kotz R.I. Progress in musculoskeletal oncology from 1922 - 2012 // Int. Orthop. Springer Verlag, 2014. Vol. 38, № 5. P. 1113-1122.
57. Hosalkar H.S., Dormans J.P Limb Sparing Surgery for Pediatric Musculoskeletal Tumors // Pediatric Blood and Cancer. 2004. Vol. 42, № 4. P. 295-310.
58. Groundland J.S., Binitie O. Reconstruction After Tumor Resection in the Growing Child // Orthopedic Clinics of North America. W.B. Saunders, 2016. Vol. 47, № 1. P. 265-281.
59. Gur E. et al. The Use of Free Vascularized Fibular Grafts for Reconstruction of Segmental Bone Defects // Musculoskeletal surgery, part 4, Oncology. 2009. P. Chapter 28.
60. Capanna R. et al. A New Reconstructive Technique for Intercalary Defects of Long Bones: The Association of Massive Allograft with Vascularized Fibular Autograft. Long-Term Results and Comparison with Alternative Techniques // Orthopedic Clinics of North America. 2007. Vol. 38, № 1. P. 51-60.
61. Zaretski A. et al. Biological reconstruction of bone defects: The role of the free fibula flap // Journal of Children’s Orthopaedics. British Editorial Society of Bone and Joint Surgery, 2011. Vol. 5, №4. P. 241-249.
62. Manfrini M. et al. Imaging of Vascularized Fibula Autograft Placed Inside a Massive Allograft in Reconstruction of Lower Limb Bone Tumors // Am. J. Roentgenol. American Roentgen Ray Society, 2004. Vol. 182, № 4. P. 963-970.
63. Hilven PH. et al. The vascularised fibular graft for limb salvage after bone tumour surgery: A multicentre study // Bone Jt. J. British Editorial Society of Bone and Joint Surgery, 2015. Vol. 97-B, № 6. P. 853-861.
64. Goorin A.M. et al. Prognostic significance of complete surgical resection of pulmonary metastases in patients with osteogenic sarcoma: Analysis of 32 patients // J. Clin. Oncol. 1984. Vol. 2, № 5. P. 425-431.
65. Tabone M.D. et al. Osteosarcoma recurrences in pediatric patients previously treated with intensive chemotherapy // J. Clin. Oncol. American Society of Clinical Oncology, 1994. Vol. 12, № 12. P. 2614-2620.
66. Ferrari S. et al. Postrelapse survival in osteosarcoma of the extremities: Prognostic factors for long-term survival // Journal of Clinical Oncology. American Society of Clinical Oncology, 2003. Vol. 21, №4. P. 710-715.
67. Bielack S. et al. Osteosarcoma: The COSS experience // Cancer Treatment and Research. 2009. Vol. 152. P. 289-308.
68. Abbo О. et al. Bilateral anterior stemothoracotomy (clamshell incision): A suitable alternative for bilateral lung sarcoma metastasis in children // World J. Surg. Oncol. BioMed Central Ltd., 2014. Vol. 12, № 1. P. 233.
69. Kager L. et al. Primary metastatic osteosarcoma: Presentation and outcome of patients treated on neoadjuvant Cooperative Osteosarcoma Study Group protocols // J. Clin. Oncol. 2003. Vol. 21, № 10. P. 2011-2018.
70. Harting M.T., Blakely M.L. Management of osteosarcoma pulmonary metastases // Semin. Pediatr. Surg. W.B. Saunders, 2006. Vol. 15, № 1. P. 25-29.
71. Castagnetti M., Delame A., Gentet J.C.
Optimizing the surgical management of lung nodules in children with
osteosarcoma: Thoracoscopy for biopsies, thoracotomy for resections // Surg. Endosc. Other Interv. Tech. 2004. Vol. 18, № 11.
72. Kayton M.L. Pulmonary Metastasectomy in Pediatric Patients // Thoracic Surgery Clinics. 2006. Vol. 16, № 2. P. 167-183.
73. Femandez-Pineda I. et al. Patients with osteosarcoma with a single pulmonary nodule on computed tomography: A single-institution experience // Journal of Pediatric Surgery. 2012. Vol. 47, № 6. P. 1250-1254.
74. Goncalves de Oliveira-Filho A., Sbragia Neto L., Epehnan S. Median sternotomy for the resection of bilateral pulmonary metastases in children // Pediatr. Surg. Int. 1998. Vol. 13. P. 560-563.
75. Fuchs J. et al. Analysis of sternotomy as treatment option for the resection of bilateral pulmonary metastases in pediatric solid tumors // Surgical Oncology. 2008. Vol. 17, № 4. P. 323-330.
76. Tsai J., Mattei P. Median sternotomy for bilateral pulmonary metastasectomy in children // J. Pediatr. Surg. W.B. Saunders, 2012. Vol. 47, № 7. P. 1345-1348.
77. Heaton T.E., Davidoff A.M. Surgical treatment of pulmonary metastases in pediatric solid tumors // Semin. Pediatr. Surg. W.B. Saunders, 2016. Vol. 25, № 5. P. 311-317.
78. Jordan K. et al. Antiemetics in children receiving chemotherapy. MASCC/ESMO guideline update 2009 // Supportive Care in Cancer. 2011. Vol. 19, № SUPPL. 1. P. S37-42.
79. High-Dose Methotrexate, Leucovorin and Glucarpidase Dosing, Administration, and Monitoring-Adult/Pediatric-Inpatient Clinical Practice Guideline.
80. Howard S.C. et al. Preventing and Managing Toxicities of High-Dose Methotrexate // Oncologist. Alphamed Press, 2016. Vol. 21, № 12. P. 1471-1482.
81. Grier H.E. et al. Addition of ifosfamide and etoposide to standard chemotherapy for Ewing’s sarcoma and primitive neuroectodermal tumor of bone // N. Engl. J. Med. N Engl J Med, 2003. Vol. 348, №8. P. 694-701.
82. Dirksen U. Ewing 2008. 2018. P. 163.
83. Seddon B.M. et al. Fatal radiation myelopathy after high-dose Busulfan and Melphalan chemotherapy and radiotherapy for Ewing’s sarcoma: A review of the literature and implications for practice // Clin. Oncol. 2005. Vol. 17, № 5. P. 385-390.
84. Lin P.P. et al. Chemotherapy response is an important predictor of local recurrence in Ewing sarcoma// Cancer. 2007. Vol. 109, № 3. P. 603-611.
85. Ahmed S.K. et al. Pelvis Ewing sarcoma: Local control and survival in the modem era // Pediatr. Blood Cancer. John Wiley and Sons Inc., 2017. Vol. 64, № 9.
86. Pan H.Y. et al. Prognostic factors and patterns of relapse in ewing sarcoma patients treated with chemotherapy and R0 resection // Int. J. Radiat. Oncol. Biol. Phys. Elsevier Inc., 2015. Vol. 92, № 2. P. 349-357.
87. Dirksen U. et al. High-dose chemotherapy compared with standard chemotherapy and lung radiation in ewing sarcoma with pulmonary metastases: Results of the european ewing tumour working initiative of national groups, 99 trial and ewing 2008 // Journal of Clinical Oncology. American Society of Clinical Oncology, 2019. Vol. 37, № 34. P. 3192-3202.
88. Paulino A.C., Mai W.Y., Teh B.S. Radiotherapy in metastatic ewing sarcoma // Am. J. Clin. Oncol. Cancer Clin. Trials. 2013. Vol. 36, № 3. P. 283-286.
Приложение А1. Состав рабочей группы
1. Карачунский А.И. - д.м.н., профессор, зам. генерального директора - директор Института онкологии, радиологии и ядерной медицины НМИЦ ДГОИ им. Дмитрия Рогачева Минздрава России, член правления Национального общества детских гематологов и онкологов
2. Дзампаев А.З. - к.м.н., зав. отделением опухолей опорно-двигательного аппарата отдела общей онкологии НИИ ДОГ НМИЦ онкологии им. И.И. Блохина Минздрава России, член Российского общества детских онкологов, член Восточно-Европейской группы по изучению сарком
3. Тихонова М.В. - врач-онколог консультативного отделения, научный сотрудник отдела научного проектирования и контролируемых клинических исследований НМИЦ ДГОИ им. Дмитрия Рогачева Минздрава России
4. Нечеснюк А.В. - к.м.н., зав. отделением лучевой терапии НМИЦ ДГОИ им. Дмитрия Рогачева Минздрава России
5. Большаков И.А. - врач травматолог-ортопед консультативного отделения, отделения онкологии и детской хирургии НМИЦ ДГОИ им. Дмитрия Рогачева Минздрава России
6. Сенжапова Э.Р - научный сотрудник отделения опухолей опорно-двигательного аппарата отдела общей онкологии НИИ ДОГ РОНЦ им. И.И. Блохина Минздрава России, член Российского общества детских онкологов
7. Романцова О.А. - врач-онколог НИИ ДОГ РОНЦ им. И.И. Блохина Минздрава России
8. Ускова И.Г. - врач-детский хирург, научный сотрудник отделения онкологии и детской хирургии НМИЦ ДГОИ им. Дмитрия Рогачева Минздрава России
9. Нисиченко Д.В. - к.м.н., старший научный сотрудник отделения опухолей опорнодвигательного аппарата отдела общей онкологии НИИ ДОГ РОНЦ им. И.И. Блохина Минздрава России, член Российского общества детских онкологов, член Восточно- Европейской группы по изучению сарком
10. Ремизов А.И. - врач-рентгенолог рентгенологического отделения НМИЦ ДГОИ им. Дмитрия Рогачева Минздрава России
Приложение А2. Методология разработки клинических рекомендаций
1. Врачи-детские онкологи;
2. Врачи-онкологи;
2. Студенты медицинских ВУЗов
Таблица 1. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
|
УДД |
Расшифровка |
|
1 |
Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением мета-анализа |
|
2 |
Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением мета-анализа |
|
3 |
Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода или нерандомизированные сравнительные исследования, в том числе когортные исследования |
|
4 |
Несравнительные исследования, описание клинического случая |
|
5 |
Имеется лишь обоснование механизма действия или мнение экспертов |
Таблица 2. Шкала оценки уровней достоверности доказательств (УДД) для методов
профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)
|
УДД |
Расшифровка |
|
1 |
Систематический обзор РКИ с применением мета-анализа |
|
2 |
Отдельные РКИ и систематические обзоры исследований любого дизайна, за исключением РКИ, с применением мета-анализа |
|
3 |
Нерандомизированные сравнительные исследования, в т.ч. когортные исследования |
|
4 |
Несравнительные исследования, описание клинического случая или серии случаев, исследования «случай- контроль» |
|
5 |
Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов |
Таблица 3. Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств)
|
УУР |
Расшифровка |
|
А |
Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными) |
|
В |
Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными) |
с
Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными)
Порядок обновления клинических рекомендаций.
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию - не реже чем один раз в три года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, наличии обоснованных дополнений/замечаний к ранее утверждённым КР, но не чаще 1 раза в 6 месяцев.
Приложение АЗ. Связанные документы
Нет
Приложение Б. Алгоритмы ведения пациента
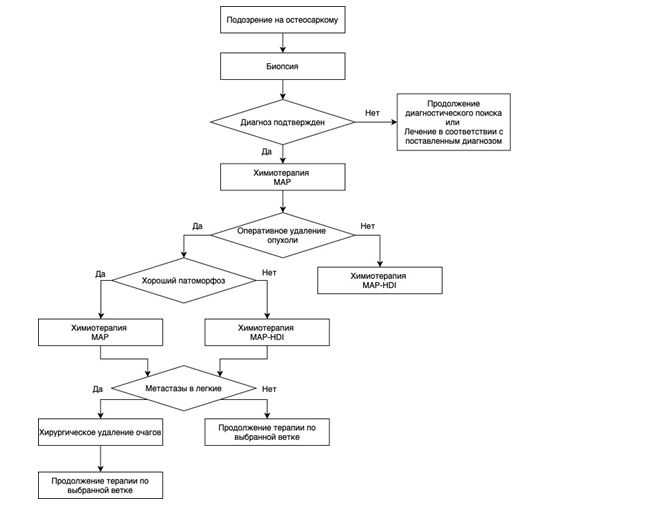

Остеосаркома, остеогенная саркома - агрессивная злокачественная опухоль, клетки которой происходят из костной ткани. Это наиболее часто встречающаяся первичная злокачественная опухоль костей (первичные опухоли - то есть опухоли, возникающие в самих костях, - следует отличать от костных метастазов других опухолей).
Чаще всего остеосаркома поражает длинные трубчатые кости рук и ног. В большинстве случаев опухоль возникает вблизи коленного сустава - в верхней части большеберцовой кости или в нижней части бедренной кости. Могут также поражаться верхняя часть бедренной кости, плечевая кость, кости таза, локтевая и малоберцовая кости, кости черепа. При этом в костях чаще всего наблюдается поражение метафиза - участка, «ответственного» за рост костей у детей и расположенного между центральной частью трубчатой кости и ее расширенным концевым отделом.
Остеосаркома
может прорастать в окружающие кость мягкие ткани - мышцы, жир, сухожилия. С
кровотоком опухолевые клетки могут распространяться в отдаленные участки
организма, давая метастазы. Наиболее типично метастазирование в легкие, однако
метастазы иногда возникают и в других органах, включая головной мозг; возможно
также поражение других костей.
Соответственно, при остеосарко различают локализованную и метастатическую формы опухолевого процесса, то есть формы без отдаленных метастазов (поражена только кость и прилежащие ткани) и с метастазами. Также иногда выделяют три стадии заболевания: стадии I и II отвечают остеосаркоме соответственно низкой и высокой степени злокачественности, но без метастазов, а стадия III - метастазировавшей опухоли.
В зависимости от гистологических характеристик опухоли различают остеобластическую, хондробластическую и фибробластическую остеосаркому, а также некоторые редкие разновидности.
Остеогенная саркома может встречаться в любом возрасте, однако наиболее характерна для молодого взрослого и особенно для подросткового возраста. Большинство заболевших - от 10 до 30 лет. В среднем возрасте эта опухоль встречается очень редко. Около 10% заболевших - пожилые люди старше 60 лет; считается, что у них развитие опухоли может быть спровоцировано другими костными заболеваниями, возникшими к этому возрасту, или связано с перенесенным облучением. Мужчины болеют несколько чаще женщин.
Частота возникновения остеосаркомы составляет около 3-4 случаев на 1 миллион детей и молодых людей в возрасте до 20 лет.
Остеосаркома чаще всего возникает в период быстрого роста костей, и поэтому риск этой опухоли несколько больше у высоких подростков, особенно у мальчиков. Кроме того, повышенный риск остеосаркомы наблюдается при некоторых генетических аномалиях.
Например, эта опухоль чаще встречается у детей с наследственной ретинобластомой (опухолью сетчатки), синдром Ли-Фраумени, некоторыми заболеваниями костей. Возможно также развитие остеосаркомы у людей, перенесших облучение, - например, в ходе лечения другой опухоли. Однако в большинстве случаев болезнь возникает у детей и молодых людей, у которых нет ни одного из перечисленных факторов риска.
Иногда остео саркома возникает после травмы, и пациент или его родители считают, что именно травма спровоцировала опухоль. Но промежуток времени между травмой и обнаружением опухоли может сильно различаться, и трудно надежно доказать связь между возникновением остео саркомы и предшествующими ушибами и переломами.
Признаки и симптомы
При остеогенной саркоме типичны жалобы на боль, обычно вблизи сустава, которая становится заметнее по ночам или при физической нагрузке - так, при поражении костей ноги может возникнуть хромота. Как правило, больные первоначально принимают эти явления за последствия мышечного перенапряжения или травмы, однако при остеосаркоме боли с течением времени не ослабевают, а усиливаются. К сожалению, на ранних стадиях опухолевого процесса нередко ставится ошибочный диагноз (миозит, невралгия, последствия травмы и т.п.), что ведет к потере времени и ухудшению прогноза. Поэтому при непонятных и долго сохраняющихся болях в костях следует посетить врача-онколога (детского онколога), чтобы в случае обнаружения опухоли своевременно начать лечение.
По мере развития опухолевого процесса и вовлечения соседних тканей, иногда через несколько недель после появления боли, возникает припухлость над участком опухоли. Затем зона припухлости увеличивается, возникает отечность, на коже видна венозная сеть. Движения в ближайшем суставе затруднены из-за боли. Иногда происходит патологический (то есть обусловленный болезнью) перелом кости, хотя это не очень частое явление.
При распространенной опухоли могут возникнуть симптомы общего характера, такие как утомляемость, нарушения сна, потеря веса, анемия, повышение температуры и т.д.
Диагностика
Как правило, первым шагом в диагностике остеосаркомы является рентгеновское исследование. На снимке виден очаг деструкции кости; нередко наблюдается так называемый козырек Кодмана (на участках, где надкостница приподнята опухолью и прерывается).
При обнаружении опухоли производится ее биопсия с последующим микроскопическим исследованием.
Компьютерная томография (КТ) позволяет точнее изучить опухоль, причем как внутрикостный компонент, так и распространение в окружающие мышечную и жировую ткани (внекостный компонент). Магнитно-резонансная томография (МРТ) дает дополнительную информацию: так, она полезна для изучения состояния костномозговой полости пораженной кости, а также для обнаружения метастазов саркомы в центральную нервную систему
Возможно также использование позитронно-эмиссионной томографии (ПЭТ). Рентгенография или компьютерная томография грудной клетки важны для обнаружения метастазов в легких. Остеосцинтиграфия используется для обнаружения метастазов в другие кости и/или многоочаговой формы болезни.
Определенное значение для прогноза имеет биохимический анализ крови, так как повышенные уровни лактатдегидрогеназы (ЛДГ, LDH) и щелочной фосфатазы чаще наблюдаются при более агрессивном течении болезни.
Необходимым этапом лечения остеосаркомы является хирургическое удаление опухоли. В случае его невозможности (например, опухоль поражает основание черепа или позвоночник) прогноз существенно ухудшается.
Несколько десятилетий назад операции по поводу остеогенной саркомы костей ног или рук практически всегда сводились к ампутации. Однако сейчас в большинстве случаев есть возможность провести щадящую операцию, то есть операцию, сохраняющую конечность. В этих случаях пораженный участок кости с окружающими тканями удаляется и заменяется либо искусственным эндопротезом, либо костным имплантантом. Для детей целесообразно использовать раздвижные эндопротезы, длину которых можно увеличивать по мере роста ребенка. К сожалению, при обширном опухолевом процессе, в который вовлечены сосуды и/или нервы, ампутация все равно может быть неизбежной.
Может применяться также хирургическое удаление крупных метастазов, прежде всего в легких.
Так как остеосаркома быстро распространяется, то удалить первичный очаг опухоли недостаточно: даже если макроскопически заметных метастазов нет, необходима химиотерапия, так как без нее выживаемость очень низка. При остеосаркоме химиотерапия используется как до удаления опухоли, так и после ее хирургического удаления, для уничтожения оставшихся опухолевых клеток. При этом после удаления опухоли производится ее исследование для оценки ответа на предшествующую химиотерапию и выбора стратегии последующего лечения.
Среди химиотерапевтических препаратов при остеосаркоме эффективны высокодозный метотрексат (в сочетании с лейковорином для минимизации побочных эффектов), доксорубицин, препараты платины, ифосфамид, этопозид. Применяется также комбинация BCD (блеомицин, циклофосфамид, актиномицин D) и т.п.
Лучевая терапия применяется очень редко, так как клетки остеосаркомы малочувствительны к облучению. Иногда облучение используют при невозможности полного удаления опухоли.
Прогноз
Результаты лечения остеогенной саркомы существенно улучшились за последние десятилетия. В различных исследованиях указываются разные цифры, но в целом доля выздоравливающих детей и молодых пациентов после комбинированного лечения по поводу остеосаркомы составляет около 70%. Особенно эффективно излечиваются локализованные формы, а также опухоли, хорошо отвечающие на химиотерапию. Прогноз зависит также от местонахождения опухоли и возможности ее полного хирургического удаления.
Среди отдаленных последствий лечения остеосаркомы обычно наиболее существенны последствия операции. Так, если была произведена ампутация руки или ноги, то необходимо ее протезирование и долгий процесс реабилитации. Кроме того, многим больным, особенно подросткам, в этой ситуации может потребоваться помощь психолога.
При операциях, сохраняющих конечность, также необходимы реабилитационные мероприятия. Возможные проблемы включают в себя износ эндопротеза и его инфицирование.
Саркома Юинга - злокачественная опухоль, обычно поражающая кости. Среди злокачественных опухолей костей у детей она по частоте встречаемости занимает второе место после остеосаркомы. Чаще всего она возникает в длинных трубчатых костях (таких как бедренная, большеберцовая, малоберцовая, плечевая), а также в костях таза, ребрах, позвонках, лопатках и т.п. Поражение плоских костей, таких как кости таза, ребра или лопатки, при саркоме Юинга встречается намного чаще, чем при остеосаркоме. Из первичного костного очага опухоль быстро распространяется в окружающие мягкие ткани, включая мышцы и сухожилия.
Иногда первичная опухоль при саркоме Юинга возникает не в кости, а в мягких тканях. В этих случаях говорят о внекостной (экстраоссальной) саркоме Юинга.
Существует целое семейство сходных агрессивных злокачественных опухолей, родственных саркоме Юинга. Поэтому говорят об «опухолях семейства саркомы Юинга». Кроме костной и внекостной саркомы Юинга, к нему относятся также периферические примитивные нейроэктодермальные опухоли - ПНЭО (необходимо отличать их от ПНЭО головного мозга, которые имеют другую природу!). Особой формой ПНЭО является так называемая опухоль Аскина.
Клетки саркомы Юинга и ПНЭО не полностью идентичны друг другу, но имеют сходные молекулярно-биологические и цитогенетические характеристики - так, в подавляющем большинстве случаев в опухолевых клетках присутствует транслокация t(ll;22). Стратегии лечения этих опухолей также сходны.
Для саркомы Юинга различают локализованную и метастатическую стадии болезни. Это важно для планирования лечения и для оценки прогноза заболевания. При локализованной стадии опухоль может распространяться из первичного очага на окружающие мягкие ткани, но при этом обычные методы исследования не обнаруживают отдаленных метастазов. О метастатической стадии говорят, когда опухоль уже распространилась в другие части тела. Типичны метастазы в легкие, кости и костный мозг; возможно также метастазирование в лимфоузлы, центральную нервную систему, печень и т.п.
Саркома Юинга - вторая по частоте встречаемости (после остеосаркомы) опухоль костей у детей. В европейских странах общая заболеваемость опухолями семейства саркомы Юинга составляет около 2-3 случаев на 1 миллион населения в возрасте до 20 лет. При этом большинство случаев относится к костной саркоме Юинга, и лишь около 15% приходится на внекостную саркому Юинга и ПНЭО.
Саркома Юинга редко встречается у детей младше 5 лет и у взрослых старше 30 лет. Чаще всего она возникает у подростков 10-15 лет. Мальчики болеют несколько чаще девочек. Среди европейцев эта опухоль встречается в несколько раз чаще, чем среди выходцев из стран Азии и Африки.
Есть данные, что риск саркомы Юинга несколько повышен при наличии некоторых доброкачестенных костных опухолей (таких как энхондрома) и определенных аномалий мочеполовой системы. Саркома Юинга не является генетически обусловленным заболеванием, но в редких случаях можно говорить о наследственной предрасположенности - например, известны случаи возникновения ПНЭО у детей в одной и той же семье. Образ жизни детей и их родителей, по-видимому, не играет роли в возникновении саркомы Юинга.
Распространено мнение, что развитие костных сарком, включая саркому Юинга, часто провоцируется травмой. Однако промежутки времени между травмой и обнаружением опухоли могут быть очень разными, и трудно надежно доказать связь между возникновением саркомы и предшествующими ушибами и переломами. Не исключено, что часто травма просто заставляет обратить внимание на этот участок тела, и в результате обнаруживается опухоль, которая на самом деле существовала и раньше.
Признаки и симптомы
Характерный симптом костной саркомы Юинга - боли в пораженном участке кости. В отличие от болей, обусловленных травмой, они не стихают при фиксации конечности, а с течением времени не ослабевают, а усиливаются. Иногда эти боли принимают за признак воспаления, но прием антибиотиков не приводит к их прекращению.
У большинства больных костной саркомой Юинга и практически у всех больных с внекостной саркомой постепенно возникает припухлость на месте опухоли. Отечность может распространиться на ближайший сустав, нарушая его функции. Зона припухлости обычно болезненна при ощупывании (пальпации) и быстро увеличивается в размерах с течением времени. Примерно в 1/3 случаев наблюдается местное повышение температуры, то есть можно почувствовать, что зона опухоли теплее окружающих тканей. Кожа над пораженным участком может быть покрасневшей, с проступающими расширенными венами.
При значительном опухолевом поражении кости может возникнуть патологический (то есть вызванный болезнью) перелом этой кости.
Если опухоль поражает позвоночник или окружающие его ткани, то возможны двигательные нарушения и/или нарушения функций тазовых органов.
По мере распространения опухоли в организме (метастазирования) возникают симптомы «общего» характера: слабость, утомляемость, потеря веса, повышение температуры тела.
Часто саркому Юинга удается диагностировать довольно поздно, лишь через несколько месяцев после появления первых симптомов. Это связано с тем, что первоначально боль и припухлость считают результатом травмы или воспаления. Поэтому при долго сохраняющихся необъяснимых костных болях целесообразна консультация врача-онколога или детского- онколога.
Диагностика
Рентгенография пораженного участка кости обычно является первым исследованием, позволяющим обнаружить саркому Юинга. Эта опухоль имеет характерный вид на рентгенограммах, что позволяет поставить предварительный диагноз. Ультразвуковое исследование (УЗИ) этой же области применяется для оценки размеров и характера мягкотканного компонента опухоли.
Более подробную информацию о распространении опухоли можно получить с помощью других визуализирующих методов, таких как рентгеновская компьютерная томография (КТ) и магнитно-резонансная томография (МРТ). Эти методы позволяют уточнить локализацию и размеры опухоли, выявить степень поражения мягких тканей вокруг пораженной кости, оценить состояние костномозгового канала, обнаружить метастазы. Может производиться также позитронно-эмиссионная томография (ПЭТ).
Для уточнения природы обнаруженной опухоли необходима биопсия мягкотканного компонента или самого пораженного участка кости. Производятся различные исследования клеток, включая иммуногистохимическое, а также цитогенетический анализ на присутствие транслокации t( 11 ;22) и других хромосомных изменений.
Так как саркома Юинга часто дает метастазы в легкие, для их обнаружения целесообразно проведение рентгенографии и компьютерной томографии грудной клетки. Саркома Юинга также может давать множественные метастазы в кости, для обнаружения которых используется о стео сцинтиграфия.
При саркоме Юинга нередко встречается поражение костного мозга. Для его выявления используется костномозговая пункция или трепанобиопсия с последующим анализом полученных образцов костного мозга на присутствие опухолевых клеток.
Проводятся и обычные лабораторные исследования. Могут наблюдаться изменения в клиническом анализе крови: лейкоцитоз, анемия, повышение СОЭ. В биохимическом анализе крови важен уровень лактатдегидрогеназы (ЛДГ, LDH), так как его повышение чаще наблюдается при более агрессивном течении болезни.
К сожалению, в 20-30% всех случаев саркома Юинга диагностируется тогда, когда она уже успела дать метастазы, обнаруживаемые обычными методами исследования.
Саркома Юинга - высокоагрессивная опухоль, быстро дающая микрометастазы. Поэтому ее лечение обязательно включает в себя системное воздействие на весь организм, для чего используется полихимиотерапия - иначе рецидивы практически неизбежны. Кроме того, необходимы хирургическое лечение и/или лучевая терапия.
Во многих случаях при саркоме Юинга возможно хирургическое удаление опухоли - например, если она поражает кости нижних или верхних конечностей, ребра, лопатки и т.п. Удаляется как пораженный участок кости, так и мягкотканный компонент опухоли, причем удаленный участок кости заменяется эндопротезом. Иногда, к сожалению, бывает необходима ампутация руки или ноги, но часто современные методы лечения позволяют ее избежать. После удаления опухоли может проводиться лучевая терапия участка, где она была расположена, для уничтожения оставшихся опухолевых клеток.
Если полное хирургическое удаление опухоли невозможно, то врачи пытаются контролировать ее при помощи лучевой терапии, так как клетки саркомы Юинга чувствительны к этому виду лечения. Однако в этих случаях повышается риск рецидива болезни.
Химиотерапия в современных протоколах лечения саркомы Юинга применяется как до, так и после операции. После удаления опухоли производится ее исследование для оценки ответа на предшествующую химиотерапию и выбора стратегии последующего лечения.
В составе чередующихся курсов химиотерапии используются винкристин, доксорубицин, циклофосфан, дактиномицин, ифосфамид и этопозид. Общая продолжительность химиотерапевтического лечения саркомы Юинга обычно составляет 7-10 месяцев.
При метастатической форме болезни больным может быть рекомендована высокодозная химиотерапия с аутологичной трансплантацией костного мозга или периферических стволовых клеток.
Общая выживаемость больных локализованной саркомой Юинга при современном комбинированном лечении составляет около 70%. К сожалению, прогноз резко ухудшается при метастатической стадии болезни, особенно при метастазах в кости и костный мозг; в этих случаях даже использование высокодозной химиотерапии в сочетании с трансплантацией костного мозга позволяет достигнуть не более 20-30% выживаемости. Прогноз зависит также от локализации опухоли и от ее чувствительности к химиотерапии.
После излечения необходимы регулярные осмотры для контроля побочных эффектов и максимально раннего обнаружения рецидива, если он случится.
После эндопротезирования пациентам может потребоваться длительная реабилитация для восстановления нормального объема движений. Если была произведена ампутация руки или ноги, то необходимо ее протезирование и также серьезная реабилитация.
Возможно возникновение отдаленных побочных эффектов химиотерапии и лучевой терапии. Так, могут наблюдаться кардиомиопатия (поражение сердечной мышцы), бесплодие, нарушения роста костей и т.п. Кроме того, несколько повышается риск возникновения вторичных злокачественных опухолей. Однако многие больные могут после успешного окончания лечения вести полноценную жизнь.
Приложение Г.
Приложение Г1. Оценка нутритивного статуса
Таб. Г1.1. Критерии оценки белково-энергетической недостаточности.
|
Антропометрические показатели |
Нутритивный статус |
||
|
Тяжелая нутритивная недостаточность |
Умеренная нутритивная недостаточность |
Нормальный нутритивный статус |
|
|
Вес (на возраст), перцентиль |
<5 |
5-15 |
16-84 |
|
Рост (на возраст), перцентиль |
<5 |
5-15 |
16-84 |
|
ИМТ, перцентиль |
<5 |
5-15 |
16-84 |
|
ОМП, перцентиль |
<5 |
5-10 |
>10 |
Примечания. ИМТ - индекс массы тела, ОМП - окружность мышц плеча.
ИМТ и ОМП являются ключевыми антропометрическими показателями, в случае низких значений одного из них нутритивный статус оценивается как нутритивная недостаточность. При значении одного из них менее 5 перцентиля, а другого более 15 нутритивный статус обозначается как умеренная нутритивная недостаточность, в остальных случаях - как тяжелая нутритивная недостаточность.
Таб. Г1.2. Определение наличия клинических факторов нутритивного риска
|
Нутритивный риск |
Критерии |
|
Высокий |
1. Нарушения аппетита (снижение, инверсия вкуса) - текущие или потенциально возможные в течение 1 недели на фоне проводимой терапии основного заболевания 2. Потребление менее половины от необходимого рациона 3. Нарушения функции ЖКТ - текущие или потенциально возможные в течение 1 недели на фоне проводимой терапии основного заболевания 4. Потеря более 2% массы тела за неделю или более 5% за месяц. 5. Опухоли, локализованные забрюшинно, в брюшной полости, области малого таза 6. Возраст до 2 лет |
|
Низкий |
Все, кроме критериев высокого риска |
Таб. Г1.3. Потребность в аминокислотах у стабильных пациентов при проведении ПП
|
Недоношенные младенцы Доношенные младенцы 2 мес - 3 г 3 - 18 |
1.5- 4 г/кг/сут 1.5- 3 г/кг/сут 1.5- 2,5 г/кг/сут 1,5 -2 г/кг/сут |
|
Таб. Г1.4. Энергетические потребности у стабильных пациентов при парентеральном питании |
|
|
Диапазон возраста |
Ккал/кг веса тела/день |
|
Недоношенные |
110-120 |
|
Младенцы 0-1 год |
90-100 |
|
Дети 1-7 лет |
75-90 |
|
Дети 7-12 лет |
60-75 |
|
Дети 12-18 лет |
30-60 |
Теги: саркома Юинга
234567 Начало активности (дата): 15.12.2023 17:57:00
234567 Кем создан (ID): 989
234567 Ключевые слова: полихимиотерапия, саркома Юинга, новообразования костей, суставные хрящи
12354567899
Похожие статьи
Анализ биомеханики проксимального межфалангового сустава после эндопротезированияПерспективы использования низкомодульных сплавов системы TI-(15-20)NB-(5-10)TA для создания имплантатов в травматологии и ортопедии. Доклиническое исследование
Цифровое моделирование критических состояний эндопротезирования пястно-фалангового сустава
Рентген на дому 8 495 22 555 6 8
Курс медицинской рентгенологии. Рентгенодиагностика. Туберкулез костей и суставов. Часть 2. Глава 6



