 15.08.2023
15.08.2023
Цифровое моделирование критических состояний эндопротезирования пястно-фалангового сустава
ВВЕДЕНИЕ
Медицина сегодняшних дней и, в частности, хирургия, ортопедия и травматология развиваются ежедневно с огромной скоростью, представляя казавшиеся немыслимыми каких-то десять лет назад открытия и результаты диагностики и лечения. В настоящее время хирургия суставов шагнула далеко вперёд, став основным и повсеместным способом хирургического лечения пациентов с остеоартритами различной этиологии [1].
Ежегодно в нашей стране выполняется более 80000 операций по замене суставов, причём современные технологии позволяют врачу выполнить эндопротезирование практически любого сустава [2]. Огромных успехов в виде отличных функциональных результатов достигла хирургия крупных суставов - тазобедренного, плечевого, с чем связано и подавляющее количество ежегодно выполняемых эндопротезирова-
ний данных суставов (до 90 %) [2, 3]. Совсем иная картина наблюдается с мелкими суставами кисти - доля операций по их замене составляет менее 1 % от общего числа операций данного типа [4]. Несмотря на широкий спектр органосохраняющих операций на пястнофаланговом суставе, существует определённое число клинических ситуаций, оптимальным решением которых является эндопротезирование пястно-фалангового сустава [4-7].Мировая статистика и собственные клинические наблюдения отмечают значительное отставание данного направления от хирургии крупных суставов. Анализ зарубежной и отечественной литературы показал потребность медицинского и научного сообщества в поиске новых конструктивных решений и материалов для изготовления мелких имплантов для кисти и стопы [8].
Кисть человека представляет собой сложноустроенный и многокомпонентный орган, имеющий наибольшее представительство в центральной нервной системе. Это связано с огромными требованиями, предъявляемыми современным человеком к собственным рукам: необходимость точных, строго дозированных движений означает огромный вызов для лечащего хирурга, реабилитолога и, конечно, медицинских изделий, используемых в восстановлении функции кисти [10-12]. Исходя из этого, неоспоримым является факт необходимости создания анатомически адаптированных имплантов, в результате чего их комплексная разработка является актуальной задачей [12].
Эндопротезирование ПФС исторически прошло тернистый путь своего развития с 60-х годов прошлого века до своего актуального статуса. Было создано и апробировано значительное количество видов эндопротезов с использованием различных материалов для их изготовления. В настоящее время отмечена тенденция к созданию анатомически адаптированных несвязанных эндопротезов, а также связанных силиконовых имплантов для пациентов с ревматоидным артритом и выраженными дегенеративными изменениями капсульно-связочного аппарата и костной ткани ПФС [13].
На данный момент не существует идеального материала для изготовления имплантов мелких суставов кисти и стопы. Все материалы, представленные на современном этапе и используемые в практике, отличаются своими достоинствами и недостатками, в связи с чем функциональные результаты эндопротезирования ПФС отличаются противоречивостью. Однако в последние годы использование циркониевой керамики в качестве материала для изготовления имплантов суставов стало развиваться наиболее активно. Это связано с развитием технологий аддитивного производства, а также ценными качествами данного материала: износостойкость, биоинертность и биосовместимость, высокая коррозионная устойчивость [14, 15]. Не обошли вниманием керамику и кистевые хирурги, и уже стали появляться публикации об опыте использования цельнокерамических эндопротезов суставов кисти. Однако проблема поиска оптимального дизайна изделий всё ещё остра и требует детальной проектировочной, доклинической и апробационной работы [16, 17].
Современная медицинская наука идёт в мощном тандеме с инженерией, цифровыми технологиями, проектированием. В помощь врачу-исследователю работают специалисты различных специальностей, позволяющие получать высокоточные результаты доклинических исследований, что необходимо на сегодняшний день при внедрении новых технологий и медицинских изделий в клиническую практику [18].
Неотъемлемой частью лечения заболеваний и повреждений кисти является реабилитация, в связи с чем стали появляться специалисты по терапии кисти, а также профильные реабилитационные отделения и центры.
Внедрение новой технологии в клиническую практику на сегодняшний день сопровождается широким рядом доклинических исследований и тестов. Прежде чем попасть в лечебное учреждение, изделие медицинского назначения проходит технические испытания в сертифицированной лаборатории, токсикологические исследования на стандартных культурах клеток, тестирование образцов на лабораторных животных и кадаверные эксперименты [19].
Принимая во внимание высокие требования, возлагаемые на кистевого хирурга, нами было разработано и проведено данное цифровое исследование, позволяющее провести испытания созданного эндопротеза ex vivo, оградив пациента от дополнительных физических и психологических травм и замкнув цикл доклинических испытаний, требуемых для сертификации новой технологии.
Анализ современной зарубежной и отечественной литературы выявил наиболее частые осложнения эндопротезирования пястно-фалангового сустава несвязанными имплантами:
1) вывих компонентов эндопротеза;
2) перелом ножки эндопроеза;
3) перипротезный перелом фаланги или пястной кости.
Цель - провести анализ цифровых моделей критических состояний эндопротезирования пястно-фалангового сустава с механической и клинической точки зрения.
Таким образом, проведение объективных исследований основных стереотипов движений в пястно-фаланговом суставе позволит кистевому терапевту достичь оптимальных функциональных результатов, а пациенту - избежать вышеназванных осложнений [20].
МАТЕРИАЛЫ И МЕТОДЫ
В период с 2017 по 2021 год были проанализированы данные 34 пациентов, обратившихся за помощью в Клиники Самарского государственного медицинского университета по поводу остеоартроза фалангового сустава. Средний возраст пациентов составил 47 ± 2,65 года, из них 15 женщин (44,2 %) и 19 мужчин (55,8 %). Пациенты обращались за помощью с основными жалобами на боль и ограничение движений в ПФС.
У всех пациентов проведен сбор жалоб и клинический осмотр, проведение рентгенографии кисти в двух проекциях и компьютерная томография (КТ).
Для анализа биомеханики здоровых и поражённых суставов выполнялась SD-визуализация сканов КТ: оценивалась конгруэнтность суставных поверхностей, радиус кривизны, девиация пальцев при различных нозологических формах. Также в период исследования выполнена диссекция 36 кадаверных ПФС с целью детального изучения анатомии капсульно-связочного аппарата.
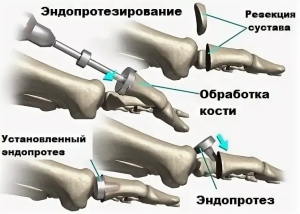
На основании собственных исследований, а также анализа опыта зарубежных коллег и соотечественников, с учетом тенденций движения к персонифицированной медицине нами был разработан конструктив цельнокерамического двухкомпонентного анатомически адаптированного эндопротеза пястно-фалангового сустава [21] (рис. 1).
Разработанный эндопротез относится к имплантам несвязанного типа и полностью выполнен из инертной циркониевой керамики. Суставная поверхность пястного компонента выполнена таким образом, чтобы обеспечивать минимальную резекцию нативной кости в двух плоскостях, а суставная поверхность дистального компонента практически полностью повторяет структуру суставной поверхности основания проксимальной фаланги. Ножки компонентов имеют коническую форму со скруглениями на верхушках, что обеспечивает простоту установки press-fit, а имеющиеся на них продольные канавки - шесть на проксимальной и четыре на дистальной ножках - обеспечивают дополнительную ротационную стабильность и создают условия для остеоинтеграции. Данный эндопротез спроектирован в четырёх размерах и планируется к использованию со специально разработанным для него инструментарием [21]. Новое изделие медицинского назначения прошло полный цикл технических и токсикологических испытаний. Технические испытания проведены на базе АНО «Центр качества, эффективности и безопасности медицинских назначений», г. Москва (акт № 11/022.Р-2021 от 10 ноября 2021 г.). Токсикологическое исследование выполнено на базе физико-химической лаборатории «Дельма», г. Пущино (программа токсикологических исследований медицинского изделия № МИ21-0208/02 от 2 августа 2021 г.).
Для исследования анатомии и биомеханики здоровых и повреждённых ПФС использовали массив КТ-сканов в формате DICOM и выполняли SD-моделирование с использованием полигонального моделирования, SD-скульптинга, а также систем автоматизированного моделирования, разработанных в Институте инновационного развития СамГМУ. В процессе данного этапа исследования мы использовали программные комплексы ZBrush, Autodesk 3dsMax, в результате чего получали трёхмерные модели пястно-фаланговых суставов для дальнейшего проектирования эндопротеза нового конструктивного дизайна [22].
Для моделирования критических ситуаций использования разработанного эндопротеза мы применили метод конечных элементов. Метод конечных элементов (МКЭ) - основной способ определения напряжённо-деформированного состояния различных конструкций. Практическое применение МКЭ нашёл и в медицине, в частности в травматологии и ортопедии: метод позволяет определить действующие нагрузки на имплант (эндопротез, пластину, винт и т.д.) и на опорно-двигательную систему. Применение данного метода позволяет оптимизировать форму импланта, параметры его установки, а также спрогнозировать оптимальный срок службы при заданных нагрузках. Работа МКЭ в данном исследовании проводилась с помощью программного комплекса Ansys - надёжного программного обеспечения по реализации МКЭ в машиностроении, инженерии, медицине [23]. Из многообразия движений кисти мы выбрали основные стереотипы и загрузили в программный комплекс в виде 3D-моделей.
При этом использовались следующие свойства материалов (керамики), представленные в таблице 1.
Таблица 1
Механические свойства керамики
|
Свойства |
Значение |
|
Плотность, г/см3 |
6 |
|
Средний размер частиц, мкм |
< 1 |
|
Прочность на изгиб, МПа |
900 |
|
Модуль Юнга, ГПа |
210 |
|
Твёрдость по Виккерсу, HV 0.1 |
1200 |
Механические свойства кортикальной кости, использованные при разработке цифровой модели:
- модуль Юнга 1,8 * 1010 Па;
- предел прочности 146 МПа;
- удельный вес 1800 кг/м3.
В специально разработанной цифровой модели ПФС, предназначенной для программного комплекса Ansys, применялись данные кортикальной кости, так как моделирование предполагает упрощение и абстрагирование от реальной клинической картины ввиду сложности воссоздания физиологических и биомеханических процессов в нативной кости, что было достаточно для проведения данного исследования.
Трехмерная модель импланта интегрировалась в костную ткань. Особый интерес в данном исследовании представляет не только напряжённо-деформированное состояние элементов импланта, но и напряжения в костных тканях, которые также могут быть подвержены разрушениям вследствие превышения допускаемых нагрузок.
Для разработки цифровой модели были взяты основные стереотипы движений, заключающиеся в шаровом захвате предметов с углом сгибания в МСР 0, 30, 60 и 90 градусов со сжатием предмета. После построения трехмерных моделей проводился расчёт напряжённо-деформированного состояния элементов импланта и костных тканей с целью определения максимальной допустимых и рабочих нагрузок для каждого из названных стереотипов движений.
Анализ проводился с применением метода конечных элементов. Трехмерная модель импланта подвергалась разбиению на конечные элементы, после чего прикладывались граничные условия: фаланговая костная ткань подвергалась заделке - закреплению от перемещения по торцевой области модели во всех направлениях, а к пястной кости прикладывались осевые нагрузки с усилием в эквиваленте от 0 до 50 кг. Конечно-элементная модель имплантированного эндопротеза МСР показана на рисунке 2.
Модель приведена при усилии нагрузки 50 кг. Угол сгибания в МСР 60°.
После построения всех необходимых моделей и их разбиения на конечные элементы выполнялась серия расчётов, по результатам которых проводился анализ предельно допускаемых нагрузок и соответствующих запасов по прочности элементов импланта и костных тканей.
Расчёты проводились при нагружении «шаровой захват с углом сгибания в МСР 0, 30, 60, 90 градусов, сжатие предмета». Нагрузки прилагались в диапазоне 1,0-50,0 кг.
Напряжённо-деформированное состояние элементов модели представлено на рисунках 3 и 4.
РЕЗУЛЬТАТЫ
На всех приведённых рисунках показаны напряжения в модели импланта, интегрированного в костную ткань. По результатам расчётов видно, что наибольшие напряжения в модели воспринимают элементы импланта, а именно суставная поверхность фалангового компонента. Исключение составляет угол сгибания в МСР 0°, при котором нагрузка распределяется равномерно по впадине фалангового компонента импланта, в результате чего напряжения в конструкции значительно ниже, чем при других углах сгибания в МСР.
Однако, учитывая механические свойства элементов модели, наиболее нагруженным и подверженным разрушению элементом во всех расчетах является костная ткань. Зависимость напряжений в костной ткани от прилагаемых нагрузок показана на рисунке 5.
В результате расчётов получены зависимости, из которых следует:
1) при нагрузке свыше 20 килограммов наступает потеря прочности костной ткани при всех положениях сгибания (30°, 60°, 90°), кроме 0°. При 0° нагрузка распределяется на костную ткань таким образом, что она способна выдержать усилие до 50 кг и более. При положении сустава 90° прочность теряется уже после 10 килограммов осевой нагрузки;
2) устойчивость конструкции при углах 30-60° имеет крайне малый разброс по прочности, резко воз
растает при положениях угла, близких к 0°, и резко снижается при приближении к углу сгибания 90°;
3) прочность элементов импланта значительно превышает прочность костной ткани в соединении сустава и костной ткани.
ОБСУЖДЕНИЕ
С каждым годом требования к научным исследованиям, а, следовательно, и к разрабатываемым изделиям и устройствам становятся всё выше, при этом преследуется единственная задача - улучшение качества жизни и оказываемой медицинской помощи. В арсенале врача и исследователя сегодня имеются не только экспериментальные лаборатории, но также и технологии из смежных специальностей. Все новые изделия и импланты должны подвергаться тщательному доклиническому исследованию, прежде чем поступят на клинические испытания [24]. Настоящее исследование показывает возможность междисциплинарного научного исследования как результата объективных данных, полученных на основании математического моделирования. Разработка режима двигательной активности у пациентов после эндопротезирования пястно-фалангового сустава на основании объективных технических данных позволит избежать риска возникновения грозных осложнений - вывиха компонентов эндопротеза, перелома ножки эндопротеза и перипротезного перелома.
Предложенная нами цифровая модель не идеальна, в ней имеются погрешности, допустимые для экспериментального исследования и в целом для процесса моделирования [25]. Программный комплекс Ansys визуализирует эндопротез в виде заранее упрощённой модели, что, с одной стороны, позволяет провести математические расчеты, но, с другой стороны, абстрагирует процесс от реальной клинической ситуации. В целом данный принцип возможен, так как речь идет о комплексных доклинических исследованиях, и на данном этапе реальные клинические условия не воссоздавались. Тем не менее, данное исследование выявило граничные условия для режима двигательной активности в раннем послеоперационном периоде и наметило оптимальный диапазон движений после эндопротезирования МСР. Полученная концепция может быть дополнена и получить развитие в дальнейших клинических испытаниях разработанного импланта с учётом полученных результатов, что позволит свести к минимуму дополнительные физические и психоэмоциональные травмы для пациента.
Для того, чтобы ярче подчеркнуть необходимость и актуальность биоинженерных исследований, мы применили комплексную оценку результатов при формировании выводов как с инженерной точки зрения, так и с клинической.
ВЫВОДЫ
1. Технический результат: элементы импланта, изготовленные из керамики, способны выдерживать значительно большие нагрузки, чем костная ткань в зоне интеграции фалангового компонента импланта.
Клиническая интерпретация: дистальный компонент пястно-фалангового сустава подвержен перипро- тезному перелому.
2. Технический результат: механические свойства костной ткани в зоне интеграции фалангового компонента являются определяющими при достижении оптимальных условий эксплуатации пястно-фалангового импланта. При этом в процессе проектирования импланта, а также при разработке рекомендаций по двигательной активности и прилагаемым усилиям, необходимо учитывать индивидуальные особенности костных тканей пациента (пористость, хрупкость, прочие факторы).
Клиническая интерпретация: при установке фалангового компонента эндопротеза следует учитывать возраст пациентов и сопутствующую патологию, а также соблюдать максимальную прецизионность при формировании канала ввиду малого объёма периимплант- ной костной ткани фаланги.
3. Технический результат: при нагрузке свыше 20 килограммов наступает потеря прочности костной ткани при всех положениях сгиба (30°, 60°, 90°), кроме 0°. При 0° нагрузка распределяется на костную ткань таким образом, что она способна выдержать усилие до 50 кг и более. При положении сустава 90° прочность теряется уже после 10 кг осевой нагрузки.
Клиническая интерпретация: в раннем послеоперационном периоде следует избегать нагрузки свыше 20 кг при движениях до 60°. При движениях от 60° до 90° нагрузка не должна превышать 10 кг.
4. Технический результат: устойчивость конструкции при углах 30-60° имеет крайне малый разброс по прочности, резко возрастает при положениях угла, близких к 0°, и резко снижается при приближении к углу сгибания 90°.
Клиническая интерпретация: разработанный эндопротез позволяет достичь функционального объема движения в МСР после эндопротезирования, который составляет 30-60°, без значимых рисков развития описанных осложнений.
СПИСОК ИСТОЧНИКОВ
1. Pabian PS, Kolber MJ, McCarthy JP. Postrehabilitation strength and conditioning of the shoulder: an interdisciplinary approach. Strength and Conditioning Journal. 2011;33(3):42-55. doi: 10.1519/SSC.0b013e318213af6e
2. Вороков А.А., Бортулев П.И., Хайдаров В.М., Линник С.А., Ткаченко А.Н. Эндопротезирование тазобедренного и коленного суставов: показания к операции. Ортопедия, травматология и восстановительная хирургия детского возраста. 2020;8(3):355-364. doi: 10.17816/ PTORS34164
3. Батыгин Г.Г., Редько И.А. Регистры по эндопротезированию тазобедренных суставов. М. : Литтерра, 2016. 208 с. EDN XWFNGP.
4. Vakalopoulos K, Arner M, Denissen G, Rodrigues J, Schadel-Hopfner M, Krukhaug Y, Page R, Lubbeke A. Current national hand surgery registries worldwide. J Hand Surg Eur Vol. 2021;46(1):103-106. doi: 10.1177/1753193420970155
5. Mulkoglu C, Ayhan FF. A case with Behcet's disease involving erosive Metacarpophalangeal joint arthritis: the value of ultrasonography in the diagnosis of an Erosion. BMC Med Imaging. 2020;20(1):60. doi: 10.1186/s12880-020-00461-8
6. Родоманова л.А., Афанасьев А.О. Сравнительный анализ эффективности эндопротезирования пястно-фаланговых суставов у больных с ревматоидным поражением кисти. Травматология и ортопедия России. 2015;(1):42-50.
7. Adkinson JM, Chung KC. Advances in small joint arthroplasty of the hand. Plast Reconstr Surg. 2014;134(6):1260-1268. doi: 10.1097/ PRS.0000000000000733
8. Herren DB, Ishikawa H, Rizzo M, Ross M, Solomons M. Arthroplasty in the hand: what works and what doesn't? J Hand Surg Eur Vol. 2022;47(1):4- 11. doi: 10.1177/17531934211017703
9. Swann J. The world at your finger tips: how the hand functions. Nursing and Residential Care. 2015;17(8):444-448. doi: 10.12968/nrec.2015.17.8.444
10. Conson M, Di Rosa A, Polito F, Zappullo I, Baiano C, Trojano L. "Mind the thumb”: Judging hand laterality is anchored on the thumb position. Acta Psychol (Amst). 2021 Sep;219:103388. doi: 10.1016/j.actpsy.2021.103388
11. Young RW. Evolution of the human hand: the role of throwing and clubbing. J Anat. 2003;202(1):165-74. doi: 10.1046/j.1469-7580.2003.00144.x
12. Qiu S, Kermani MR. Inverse kinematics of high dimensional robotic arm-hand systems for precision grasping. J Intell Robot Syst. 2021;(70). doi: 10.1007/s10846-021-01349-7
13. Aujla RS, Sheikh N, Divall P, Bhowal B, Dias JJ. Unconstrained metacarpophalangeal joint arthroplasties: a systematic review. Bone Joint J. 2017;99-B(1):100-106. doi: 10.1302/0301-620X.99B1.37237
14. Castagnini F, Cosentino M, Bracci G, Masetti C, Faldini C, Traina F. Ceramic-on-Ceramic Total Hip Arthroplasty with Large Diameter Heads: A Systematic Review. Med Princ Pract. 2021;30(1):29-36. doi: 10.1159/000508982
15. Lakhdar Y, Tuck C, Binner J, Terry A, Goodridge R. Additive manufacturing of advanced ceramic materials. Progress in Materials Science. 2021;116:100736. doi: 10.1016/j.pmatsci.2020.100736
16. Горякин М.В., Ульянов В.Ю. Опыт тотального эндопротезирования при внутрисуставном оскольчатом переломе пястно-фалангового сустава (клинический случай). Саратовский научно-медицинский журнал. 2020;16(2):485-487.
17. Мурадов М.И., Байтингер В.Ф., Камолов Ф.Ф., Сайк П.Ю., Курочкина О.С. Оценка отдаленных результатов эндопротезирования суставов пальцев кисти. Вопросы реконструктивной и пластической хирургии. 2016;(1):33-39.
18. Chien S, Bashir R, Nerem RM, Pettigrew R. Engineering as a new frontier for translational medicine. Sci Transl Med. 2015;7(281):281fs13. doi: 10.1126/scitranslmed.aaa4325
19. Shegokar R. Preclinical testing - understanding the basics first. In book: Drug Delivery Aspects. 2020. pp. 19-32. doi: 10.1016/b978-0-12-821222- 6.00002-6
20. Hooijmans CR, de Vries RBM, Ritskes-Hoitinga M, Rovers MM, Leeflang MM, IntHout J, Wever KE, Hooft L, de Beer H, Kuijpers T, Macleod MR, Sena ES, Ter Riet G, Morgan RL, Thayer KA, Rooney AA, Guyatt GH, Schunemann HJ, Langendam MW; GRADE Working Group. Facilitating healthcare decisions by assessing the certainty in the evidence from preclinical animal studies. PLoS One. 2018;13(1):e0187271. doi: 10.1371/ journal.pone.0187271
21. Эндопротез пястно-фалангового сустава кисти : пат. 202475 Рос. Федерация ; МПК A61F 2/42 / Колсанов А.В., Николаенко А.Н., Ушаков А.А., Дороганов С.О., Гранкин И.О., Исайкин П.Ю., Згирский Д.О. ; патентообладатель Общество с ограниченной ответственностью «НЕ- ОТЕХ». № 2020138501 ; заявл. 24.11.2020 ; опубл. 19.02.2021, Бюл. 5. EDN YGMLVG.
22. Шкрум А.С., Катасонова Г.Р. Тенденции применения аддитивных технологий в различных предметных областях и в медицинской сфере. Уральский медицинский журнал. 2020;(5):216-220. doi: 10.25694/URMJ.2020.05.38. EDN NVQJGY
23. Науменко Л.Ю., Маметьев А.А., Погребной О.В. Математическое моделирование геометрической оси костномозгового канала длинных костей кисти. Травма. 2013;14(5):74-76.
24. Taberna M, Gil Moncayo F, Jane-Salas E, Antonio M, Arribas L, Vilajosana E, Peralvez Torres E, Mesfa R. The Multidisciplinary Team (MDT) Approach and Quality of Care. Front Oncol. 2020;10:85. doi: 10.3389/fonc.2020.00085
25. Groenwold RHH, Dekkers OM. Measurement error in clinical research, yes it matters. Eur J Endocrinol. 2020;183(3):E3-E5. doi: 10.1530/EJE- 20-0550
Статья поступила в редакцию 06.05.2022; одобрена после рецензирования 14.09.2022; принята к публикации 20.02.2023. The article was submitted 06.05.2022; approved after reviewing 14.09.2022; accepted for publication 20.02.2023.
Информация об авторах:
1. Андрей Николаевич Николаенко - кандидат медицинских наук, директор НИИ бионики и персонифицированной медицины
2. Виктор Вячеславович Иванов - кандидат медицинских наук, врач травматолог-ортопед
3. Святослав Олегович Дороганов - врач травматолог-ортопед
4. Алексей Станиславович Букатый - доктор технических наук, профессор, руководитель отдела
5. Денис Олегович Згирский - врач травматолог-ортопед
6. Павел Юрьевич Исайкин - врач травматолог-ортопед
1. Andrey N. Nikolaenko - Candidate of Medical Sciences
2. Viktor V. Ivanov - Candidate of Medical Sciences,
3. Svyatoslav O. Doroganov - M.D
4. Alexey S. Bukaty - Doctor of Technical Sciences, Professor
5. Denis O. Zgirsky - M.D
6. Pavel Yu. Isaykin - M.D
Вклад авторов:
Николаенко А.Н. - концептуализация; валидация; контроль; управление проектом.
Иванов В.В. - формальный анализ; обработка данных.
Дороганов С.О. - исследование; написание первоначального варианта; редактирование; визуализация.
Букатый А.С. - исследование, обработка данных, написание первоначального варианта.
Згирский Д.О. - визуализация, написание, редактирование.
Исайкин П.Ю. - визуализация, написание, редактирование.
Теги: эндопротезирование
234567 Описание для анонса:
234567 Начало активности (дата): 15.08.2023 12:26:00
234567 Кем создан (ID): 989
234567 Ключевые слова: эндопротезирование пястно-фалангового сустава, метод конечных элементов, эндопротезирование суставов кисти, цифровое моделирование
12354567899
Похожие статьи
Результаты хирургического лечения пациентов с переломами вертлужной впадины и квадрилатеральной поверхностиРентген на дому 8 495 22 555 6 8
Определение конгруэнтности стандартного полусферического вертлужного компонента и посттравматически деформированной вертлужной впадины при первичном эндопротезировании тазобедренного сустава (экспериментальное исследование)
Среднесрочные результаты применения метода аутопластики медиального дефекта большеберцовой кости при первичном эндопротезировании коленного сустава
Ложные суставы шейки бедренной кости: применение новой классификации при эндопротезировании у пациентов пожилого возраста



