 01.08.2023
01.08.2023
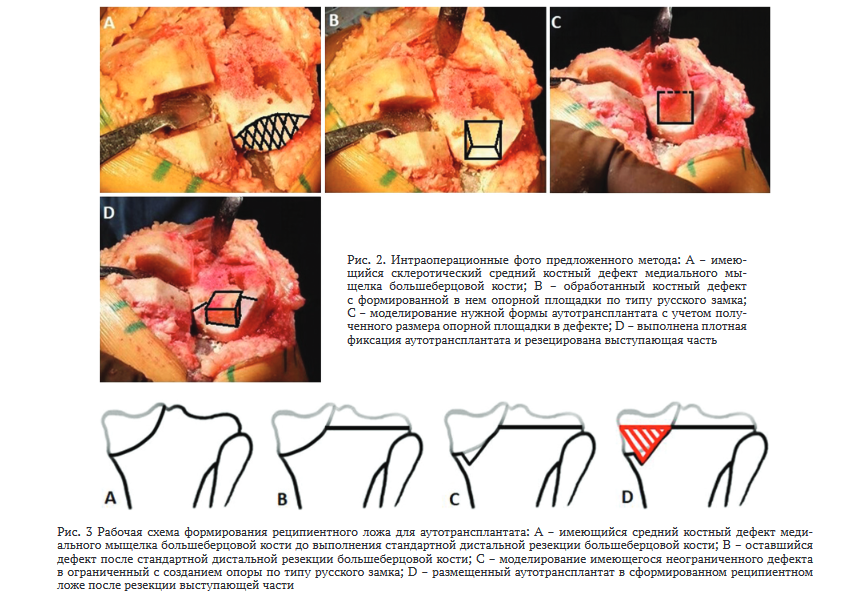
Среднесрочные результаты применения метода аутопластики медиального дефекта большеберцовой кости при первичном эндопротезировании коленного сустава
Замещение костного дефекта при первичном эндопротезировании коленного сустава остается одной из распространенных задач, которую необходимо решать интраоперационно
ВВЕДЕНИЕ
В настоящее время не осталось сомнений, что операция эндопротезирования коленного сустава занимает первое место в финальном лечении его дегенеративно-дистрофических заболеваний [1]. Для достижения хорошего результата при первичном эндопротезировании коленного сустава приходится решать ряд задач:
дефицит костной ткани костей, образующих коленный сустав, является одной из них. Костные дефекты могут встречаться как в латеральной, так и в медиальной области, но чаще всего встречаются в задневнутреннем отделе большеберцовой кости. Это обусловлено преобладанием варусной деформации коленного сустава по частоте встречаемости [2, 3]. Восстановление мыщелков большеберцовой кости при имеющихся костных дефектах с созданием надежной и прочной опоры для тибиального компонента является обязательным условием для получения хорошего клинического результата.
В дальнейшем в статье нами будет использоваться модифицированная ФГБУ НМИЦ ТО им. Р.Р. Вредена классификация Insall J.N. [4], где сформировано три замера дефекта.
Малые дефекты - площадь дефекта не больше 1/3 поверхности мыщелка и глубина не больше 5 мм. Средние дефекты - площадь дефекта не больше 1/2 поверхности мыщелка, а глубина от 5 до 10 мм. Большие дефекты - площадь дефекта составляет 2/3 от поверхности мыщелка и глубина более 10 мм. В настоящие время в арсенале хирурга имеется несколько вариантов восполнения костного дефицита медиального мыщелка большеберцовой кости при первичном эндопротезировании коленного сустава. Пластику малых костных дефектов можно выполнять как аутотрансплантатами [5, 6], так и костным цементом [7-9]. Со средними дефектами хорошо справляются методы с использованием металлических блоков [10-12], метод костной аллопластики [13] и метод аутопластики [14-16]. С большими дефектами способны справиться два варианта пластики: металлические блоки [17-19] и костные аллотрансплантаты [20].
Существующие варианты замещения костного дефекта при первичном эндопротезировании коленного сустава имеют свои преимущества и недостатки [21]. Метод цементной пластики совместно с армированием расширяет возможность его применения при обширных дефектах, а также является экономически выгодным и простым способом [22, 23]. Но цемент не является биологической основой и при полимеризации может вызывать ожог окружающих тканей, а также цемент может уменьшаться в объеме на 2 % от исходного [7]. Надежную первичную опору для компонентов эндопротеза при больших дефектах дает метод применения металлических блоков [10, 11].
Но при обработке костного ложа под аугмент, как правило, резецируется и здоровая кость, что практически сводит к нулю вариант в последующем выполнить консервативную ревизию, и поэтому этот метод не должен быть рекомендован молодым пациентам [24-26].
К преимуществам метода применения аллотрансплантата относится его биологическая совместимость и значительный объем материала, что, в свою очередь, позволяет хирургу сформировать трансплантат в соответствии с геометрией и объемом имеющегося костного дефекта и избежать ненужного удаления кости пациента [13, 20]. В то же время, применение аллокости несет в себе риск передачи инфекционных заболеваний [27, 28], и не у всех медицинских учреждений есть возможность использовать костный банк. Литературных данных по использованию этого метода при первичном эндопротезировании коленного сустава крайне мало.
Метод аутопластики несет в себе «стратегию плюс костная ткань», а не минус - как в методах цементной и металлической пластики, вследствие того, что аутопластика позволяет заместить и сохранить костную ткань мыщелка. А это, в свою очередь, увеличивает шансы при возникшей необходимости выполнить не прогрессивную, а консервативную ревизию. Принципы консервативной ревизии состоят в неиспользовании ревизионных конструкций эндопротеза и в сведении до минимума агрессивных воздействий на интактные прилежащие ткани и костные структуры, что особенно важно у более молодых пациентов [5, 29, 30]. Следует указать, что недостатком аутопластики может стать ограничение по объему самого аутотрансплантата и имеющийся риск отсутствие его перестройки с последующим несращением с костью реципиента [3].
В научной литературе работ со среднесрочными результатами, посвящённых методу использования аутотрансплантата, который не нуждается в дополнительной фиксации, ограниченное количество [6].
Нашей целью стало проведение анализа результатов использования метода аутопластики медиального дефекта большеберцовой кости при первичном эндопротезировании коленного сустава и выполнение сравнения полученных клинических и рентгенологических результатов с группой пациентов, которым проводилось стандартное эндопротезирование коленного сустава без восстановления костных дефектов.
Для пластики имеющихся дефектов использовали разработанный метод аутопластики, где аутотрансплантат не нуждается в дополнительной фиксации металлоконструкциями (патент RU 2 607 189 C1).
Проведенный анализ содержит в себе сравнение рентгенологических и клинических данных обеих групп пациентов. Все полученные результаты прошли статистическую оценку.
Гипотеза заключается в том, что мы получим при сравнении двух групп существенное предоперационное различие в исходной варусной деформации, но при этом в проведенных предоперационных клинических опросниках разницы в данных, вероятно, не будет. А в последующем, в послеоперационном периоде, в двух группах разницы в осях конечностей уже не будет, и в среднесрочных наблюдениях по клиническим опросникам результаты в группах также будут аналогичны.
МАТЕРИАЛЫ И МЕТОДЫ
Мы проанализировали истории болезни пациентов, которые проходили оперативное лечение гонар- троза 3 стадии методом первичного эндопротезирования в ФГБУ ННИИТО с 2014 по 2016 год. Критерием включения в анализ стали все случаи выполнения имплантации трехкомпонентного эндопротеза одной фирмы-производителя (DePuy Sigma PS), а саму операцию выполняла только одна хирургическая бригада. В этот же анализ вошли все пациенты, которым выполнялась костная аутопластика по разработанной методике.
С учетом критериев включения за указанный период было отобрано 276 операций. Критерием исключения стало наличие у пациентов в анамнезе перенесенного гонита (6 случаев), наличие системного заболевания (30 случаев), вальгусная деформация нижней конечности (15 случаев) и имеющийся консолидированный перелом в порочном положении бедренной и/или большеберцовой кости (10 случаев). Также из анализа были исключены пациенты, которым выполнялась пластика костного дефекта большеберцовой кости цементом (13 случаев). Учитывая критерии исключения, получили 202 случая. Из них для проведения сравнения мы выделили 2 группы. Первая группа составила 31 случай, где мы использовали костную аутопластику для замещения дефекта. Вторая группа составила 171 случай, где выполнялось первичное стандартное эндопротезирование коленного сустава. У пациентов сформированных групп определили исходные данные: пол, возраст, индекс массы тела (ИМТ), время операции, кровопотеря, сторона операции, дооперационная контрактура сустава и объем активного движения в нем. В исходных данных выявлены неоднородные показатели: время операции, дооперационная контрактура и сторона операции, по которым выполнили выравнивание контрольной и исследуемой группы при помощи метода PSM (Propensity Score Matching) [31]. И, таким образом, количество случаев, включенных в исследование, составило 31 в исследуемой группе и 31 в контрольной группе. Дизайн исследования представлен на рисунке 1.

Используемые клинические и рентгенологические методы оценки
В дооперационном и послеоперационном периоде всем пациентам проводилось клиническое и рентгенологическое исследование. Клиническая оценка проводилась в соответствии с опросниками KSS [32], WOMAC [33], а инструментальное исследование включало в себя рентгенографию коленного сустава в двух проекциях и осевой снимок нижних конечностей (от головки бедренной кости до голеностопного сустава).
Диапазон объема активного движения и имеющуюся дооперационную контрактуру измеряли в положении лежа на спине при помощи гониометра по проходящей ноль системе [34].
Опросник KSS состоял из двух частей: общей оценки коленного сустава (KSS knee score) и оценки функции сустава (KSS function score), а опросник WOMAC состоял из трех частей: боль, скованность, функция.
При помощи рентгенограмм проводили оценку таких критериев как ось нижней конечности, наличие рентгенопрозрачных линий и перестройка костного трансплантата. В этом исследовании, по соглашению всех авторов, варусной деформации было присвоено отрицательное (-) значение, вальгусной деформации - положительное (+), и для оценки деформации оси нижней конечности и ее исправления использовали анатомический феморо-тиби- альный угол (аФТУ/aFTA) и бедренно-коленно-лодыжечный угол (БКЛУ/HKA) [35] (табл. 1).
Рентгенопрозрачные линии (RLLs), линии, проходящие на границе кости и цемента, оценивались с использованием метода системы зональной рентгенологической оценки RKES (roentgenographic knee evaluation system, 1989 г.) [36, 37].
Костная перестройка трансплантата оценивалась сначала по появлению мостовидной трабекуляции на границе соприкосновения трансплантата и кости, а в конечном итоге, по исчезновению этой границы [38, 39]. Первой послеоперационной точкой исследования служили данные при выписке пациента из стационара, а последующие промежуточные точки были в срок 6, 12, 24, 36 месяцев. Конечной точкой был срок 60 месяцев после операции.
Иногородние пациенты, не имеющие возможности осуществить очную консультацию, рентгеновские снимки высылали по почте, а заполнение шкал опросников выполнялось дистанционно при помощи телефонной связи.
Хирургическая техника
В положении пациента на спине, под пневматическим жгутом, выполняется артротомия коленного сустава с использованием переднемедиального доступа. После освобождения плато большеберцовой кости на латеральном мыщелке устанавливается экстрамедуллярный тибиальный направитель , глубина резекции 8 мм с переднезадним наклоном 0-3°. После выполнения резекции суставной поверхности остаточный костный дефект оценивается метрической линейкой по модифицированной классификации Insall J.N. [4], при выявлении малых и средних дефектов выполняется пластика. Забор губчатого трансплантата производится из костного фрагмента, полученного при формировании паза для межмыщелкового бокса бедренного компонента. Затем производится качественная обработка дефектной склеротичной кости, которая включает в себя моделирование имеющегося неограниченного дефекта в ограниченный с созданием опоры по типу русского замка и достижение «кровяной россы» на всех стенках реципиентного ложа. Далее, с учетом полученного размера опорной площадки, в дефекте изготавливают нужный размер аутотрансплантата. В последующем путем мягкой импакции производится плотная фиксация трансплантата в полученном ранее реципиентном ложе. Важность этого этапа заключается в сведении до минимума травматических воздействий на трансплантат, так как это может приводить к разрушению структуры костной ткани и нарушению пространственной ориентации костных балок. Затем выступающий трансплантат над проксимальным опилом большеберцовой кости аккуратно резецируется осциллирующей пилой. При необходимости, при выполнении этого этапа трансплантат можно фиксировать тупфером. Интраоперационные фото и рабочая схема предложенного метода представлены на рисунках 2, 3. При данной методике использовался эндопротез фирмы DePuy Sigma PS с цементной фиксацией без удлиняющей ножки. На вторые сутки после операции у всех пациентов производится удаление дренажа, и они начинают выполнять укрепляющие упражнения для мышц нижних конечностей. На третьи сутки пациенты активизированы и обучаются ходьбе при помощи костылей, а также проводится активная работа с инструкторами ЛФК. Выписка производится на 5-6 сутки после операции с ортопедическими рекомендациями по использованию костылей при ходьбе в течение 6 недель.
Распределения непрерывных показателей испытывались на согласие с законом нормального распределения критерием Шапиро-Уилка. Ввиду ненормального распределения данных для сравнения непрерывных показателей использованы ранговые критерии: U-критерий Манна-Уитни для сравнения групп в одной временной точке и критерий Вилкоксона для сравнения динамики аФТУ/aFTA, БКЛУ/HKA и баллов качества жизни по опросникам KSS, FSKSS, WOMAC внутри групп. Для описательной статистики рассчитывались медиана [первый квартиль; третий квартиль] (МЕД [Q1; Q3]) и среднее ± стандартное отклонение (СРЕД ± СО) у непрерывных данных; количество (процент) у категориальных и бинарных данных, у бинарных данных вычислялся 95 % доверительный интервал (95 % ДИ) по формуле Вильсона. Для сравнения категориальных и бинарных показателей применялся точный двусторонний критерий Фишера. Устранение ошибок множественного сравнения категорий проводилось путем коррекции достигнутых уровней p методом Бенджамини-Хохберга [31].
Устранение выявленных неоднородностей показателей времени операции, стороны и контрактуры между контрольной и экспериментальной группами проводилось PSM (Propensity Score Matching) методом ближайшего соседа (Nearest Neighbor Matching) с величиной калибра 0,25 (сaliper), без предварительного отсева неподходящих пациентов в группах (discarding), с заданным соотношением искомых групп 1:1. В результате было отобрано по 31 пациенту в каждую группу [31].
Проверка статистических гипотез проводилась при критическом уровне значимости р = 0,05, т.е. различие считалось статистически значимым, если p < 0,05.
РЕЗУЛЬТАТЫ
Средний срок наблюдения составил 72 месяца (диапазон 60-84 месяца). Исходные данные пациентов из двух групп не показали существенной разницы при статистическом анализе, за исключением времени операции (р = 0,001), предоперационной сгибательной контрактуры (р = 0,007) и стороны операции (р = 0.078). Показатели исходных данных между группами до выравнивания и после выравнивания по неоднородным показателям с помощью метода PSM [31] представлены в таблице 2.
Так как в этом исследовании, по соглашению всех авторов, варусной деформации было присвоено отрицательное значение (-) при измерении аФТУ/aFTA и БКЛУ/HKA, а критерием исключения стала вальгус- ная деформация (+), то в дооперационных измерениях градусов у всех пациентов было отрицательное значение либо нулевое. Данные по количеству пациентов с предоперационной варусной деформацией по отношению к диапазону градусов феморо-тибиального угла аФТУ/aFTA и бедренно-колено-лодыжечного угла БКЛУ/HKA представлены в таблицах 3 и 4.
Исходя из полученных данных измерения феморо- тибиального (аФТУ/aFTA) и бедренно-колено-лодыжечного (БКЛУ/HKA) угла, можно выявить значительное различие между группами в исходной варусной деформации (оба угла, р < 0,001), а именно, в исследовательской группе, где выполняли аутопластику, ва- русная деформация была грубее. Но уже в послеоперационных измерениях существенных статистических различий не наблюдалось (р = 0,257; 0,075), и в обеих группах было нейтральное исправление оси нижней конечности (табл. 5).
Перестройка аутотрансплантата вначале сопровождалась рентгенологическими признаками склерозирования, и отмечались гетерогенные зоны частичной резорбции на границе «трансплантат - кость», затем в течение 6-18 месяцев появлялись признаки мостовидной трабекуляции в зоне соприкосновения, и, в конечном итоге, в течение 24 месяцев (диапазон 12-36 месяцев) граница соприкосновения «трансплантат-кость» полностью исчезала (рис. 4).
Не прогрессирующие рентгенопрозрачные линии < 2 мм в группе, где выполнялась аутопластика, наблюдались в 6 случаях и в 8 случаях в группе, где пластика не выполнялась. Рентгенопрозрачные линии, превышающие 2 мм, ни в одной группе не встречались.
Нежелательные явления в виде расшатывания ти- биального компонента отмечены в трех случаях. В исследуемой группе, где применялась аутопластика, выполнено одно одноэтапное ревизионное оперативное вмешательство по поводу асептического расшатывания компонентов эндопротеза через 4 месяца после операции. В контрольной группе выполнено два ревизионных оперативных вмешательства. Одно двухэтапное ревизионное оперативное вмешательство было выполнено по поводу септического расшатывания компонента через 19 месяцев после операции, другое одноэтапное ревизионное оперативное лечение было выполнено по поводу асептического расшатывания компонентов через 45 месяцев после операции. Таким образом, ревизионному оперативному лечению в сумме двух групп подверглись 4,83 % пациентов за весь период наблюдения.
Предоперационные и послеоперационные клинические результаты
Таблица 6
|
Клинические опросники |
До операции |
Значение р |
После операции |
Значение р |
||
|
исследуемая группа |
контрольная группа |
исследуемая группа |
контрольная группа |
|||
|
KSS* |
50,58 ± 9,06 |
52,61 ± 8,92 |
0,334 |
78 ± 6,06 |
79,06 ± 6,02 |
0,432 |
|
KSSfs** |
61,58 ± 5,03 |
63,06 ± 5,12 |
0,283 |
80,65 ± 4,67 |
81,1 ± 4,77 |
0,656 |
|
WOMAC, боль |
16,81 ± 2,68 |
15,87 ± 2,09 |
0,138 |
5,32 ± 1,72 |
5,48 ± 1,63 |
0,688 |
|
WOMAC, скованность |
4,45 ± 1,65 |
4,32 ± 1,51 |
0,769 |
1,81 ± 0,91 |
1,81 ± 0,79 |
0,389 |
|
WOMAC, функция |
43,26 ± 8,17 |
42,16 ± 7,79 |
0,568 |
8,55 ± 1,29 |
8,52 ± 1,55 |
0,873 |
* - KSS - общая оценка коленного сустава (KSS knee score), ** - KSSfs - оценка функции сустава (KSS function score).
ОБСУЖДЕНИЕ
Применение модульных металлических блоков или цемента для восполнения костного дефицита при первичном эндопротезировании коленного сустава создает условия для возникновения существенного костного дефекта при последующих ревизионных операциях. Это, прежде всего, связано с тем, что ни аугмент, ни цемент не перестраиваются в костную ткань, а, тем более, при установке металлического блока необходимо резецировать здоровую кость, и, тем самым, шансы выполнения последующей консервативной ревизии при этих двух методах очень малы.
Предложенный вариант пластики дефекта медиального мыщелка большеберцовой кости позволяет достичь хороших результатов первичного эндопротезирования при малых и средних дефектах по Insall без каких-либо дополнительных способов фиксации аутотрансплантата. В научной литературе описаны методы, где аутотрансплантат дополнительно фиксируется при помощи различных металлоконструкций при первичном эндопротезировании коленного сустава [14, 40-44]. Дополнительная фиксация аутотрансплантата разрушает губчатую кость как скафолд, нарушая пространственное расположение костных балок. В отличие от этого, в предложенной методе костный аутотрансплантат не подвергается дополнительному разрушению костных балок металлоконструкциями, и, тем самым, создаются наиболее благоприятные условия для миграции клеточных элементов (мостовидной миграции) с последующим преобразованием в единую трабекулярную архитектуру, которую можно косвенно оценивать рентгенологическим исследованием. Это стало возможно при выполнении трех условий: первое - создание костного замка для прочной и плотной фиксации трансплантата, второе - максимальное сохранение пространственной ориентации костных балок трансплантата, третье - наличие «кровяной росы» в реципиентном ложе. При применении разработанного метода не требуется донорское ложе в других анатомических областях костного скелета, так как материал для пластики дефекта берется из костной структуры, которая образуется при выполнении стандартной резекции бедренной кости при подготовке межмыщелкового паза под феморальный компонент. Реабилитационные рекомендации пациентам, которым была выполнена аутопластика медиального дефекта большеберцовой кости при первичном эндопротезировании коленного сустава, были идентичны рекомендациям пациентам, которым не выполнялась аутопластика.
К недостаткам применения аутотрансплантата можно отнести ограничение по возможному использованию объема самого трансплантата и наличие имеющегося, как и у аллотрансплантата, риска несращения с костью реципиента [3, 14].
Сроки исчезновения границы соприкосновения «трансплантат-кость», по всей видимости, зависят от характеристики дефекта и имеющегося регенерационного потенциала пациента, то есть, чем больше объем дефекта и старше пациент, тем сроки полной перестройки трансплантата дольше.
Наличие выявленных рентгенопрозрачных линий больше 2 мм априори является предиктором раннего расшатывания компонентов эндопротеза [45]. Непрогрессивные рентгенопрозрачные линии, не превышающие 2 мм в проведенном исследовании, нами наблюдались в обеих группах, так как их было практически одинаковое количество. Это подтверждает, что нет особого различия риска развития расшатывания компонентов в обеих группах.
У одного пациента в группе, где выполнялась костная аутопластика, диагностирована асептическая медиальная дислокация тибиального компонента через 4 месяца после операции. По этому поводу пациенту выполнено одноэтапное ревизионное оперативное лечение. Первичное эндопротезирование у данного пациента выполнялось в 2014 году, то есть на начальных этапах применения разработанной методики. Причиной смещения трансплантата стала ранняя полноценная осевая нагрузка на нижнюю конечность. Для предупреждения впоследствии таких случаев мы начали более тщательно разъяснять пациентам важность соблюдения ортопедического режима и последствия, которые могут возникнуть, если этого не делать.
В исследуемой группе было выполнено одно ревизионное оперативное лечение (0,31 %), а в контрольной группе выполнено два ревизионных вмешательства (0,62 %), поэтому существенного статистического раз
Основываясь на среднесрочных 72-недельных результатах наблюдения, мы выявили, что разработанная нами методика замещения медиального дефекта большеберцовой кости показала хороший результат, подтвержденный клиническими и рентгенологическими исследованиями.
Из неоднородных критериев, по которым в последующем делали сопоставление по методу PSM для формирования контрольной группы, интересны время операции и имеющаяся контрактура коленного сустава. Объяснить разницу в группах затраченного времени на операцию не сложно, в группе, где выполнялась аутопластика, дополнительно тратились минуты на обработку реципиентного ложа и на моделирование аутотрансплантата до нужной формы. Сложней объяснить, почему такой критерий, как имеющаяся контрактура коленного сустава, стал неоднородным в исходном сравнении групп, в то время как критерий объема активного движения получился однородным.
Это несоответствие объясняется наличием костного дефекта большеберцовой кости в задневнутреннем отделе. Увеличение размера сгибательной щели в коленном суставе в исследуемой группе происходит за счёт двух факторов: первый - это наличие заднемедиального дефекта большеберцовой кости; второй - это биомеханический задний откат медиального мыщелка бедренной кости при сгибании. Таким образом, получается, что медиальный мыщелок бедра смещается в дефект при сгибании, и, тем самым, увеличивается угол сгибания в коленном суставе. Но, так как дефект расположен в заднемедиальном отделе, то при разгибании коленного сустава медиальный мыщелок бедра упирается в передней край дефекта большеберцовой кости и, тем самым, ограничивается разгибание в суставе. Поэтому в исследуемой группе имеется более выраженная сгибательная контрактура и одинаковый объем активного движения по сравнению с контрольной группой.
Используемый метод сопоставления неоднородных данных PSM (Propensity Score Matching) в двух группах позволил выполнить более корректное статистическое послеоперационное сравнение.
Проведенное исследование подтвердило нашу гипотезу, так как в рассматриваемых группах в исходных данных была существенная разница в варусной деформации, а в клинических предоперационных опросниках различий между группами не было. Но уже после выполнения оперативного лечения нами не выявлено различий в полученных осях нижних конечностей между группами, а данные клинических опросников также остались без статистических различий.
Следовательно, применение аутологичного костного трансплантата является безопасным, доступным, дешёвым и эффективным методом при малых и средних медиальных дефектах большеберцовой кости при первичном эндопротезировании коленного сустава.
СПИСОК ИСТОЧНИКОВ
1. The Swedish Knee Arthroplasty Register 1975-1997: an update with special emphasis on 41, 223 knees operated on in 1988-1997 / O. Robertsson, K. Knutson, S. Lewold, L. Lidgren // Acta Orthop. Scand. 2001. Vol. 72, No 5. P. 503-513.
2. Vail T.P., Lang J.E., Van Sikes C. III. Surgical techniques and instrumentation in total knee arthroplasty. Chapter 105 // Scott W.N., editor. Insall & Scott Surgery of the Knee. 5th Ed. Philadelphia: Elsevier - Churchill Livingstone. 2012. P. 1042-1099. DOI: 10.1016/B978-1-4377-1503-3.00105-0.
3. Cuckler J.M. Bone loss in total knee arthroplasty: graft augment and options // J. Arthroplasty. 2004. Vol. 19, No 4 Suppl. 1. P. 56-58. DOI: 10.1016/j.arth.2004.03.002.
4. Джигкаев А.Х., Каземирский А.В., Преображенский П.М. Опыт применения модульных блоков для замещения костных дефектов медиального мыщелка большеберцовой кости при первичном эндопротезировании коленного сустава // Травматология и ортопедия России. 2012. № 1 (63). С. 22-29.
5. Autologous morselised bone grafting for medial tibial defects in total knee arthroplasty / T. Sugita, T. Aizawa, A. Sasaki, N. Miyatake, H. Fujisawa, M. Kamimura // J. Orthop. Surg. (Hong Kong). 2015. Vol. 23, No 2. P.185-189. DOI: 10.1177/230949901502300214.
6. Autologous Impaction Bone Grafting for Bone Defects of the Medial Tibia Plateau during Primary Total Knee Arthroplasty: Propensity Score Matched Analysis with a minimum of 7-year follow-up / J.M. Sohn, Y. In, S.H. Jeon, J.Y. Nho, M.S. Kim // J. Arthroplasty. 2018. Vol. 33, No 8. P. 2465-2470. DOI: 10.1016/j.arth.2018.02.082.
7. Bilgen M.S., Eken G., Guney N. Short-term results of the management of severe bone defects in primary TKA with cement and K-wires // Acta Orthop. Traumatol. Turc. 2017. Vol. 51, No 5. P. 388-392. DOI: 10.1016/j.aott.2017.02.002.
8. Relationship between screw numbers and severity of tibial bone defect in primary total knee arthroplasty / C. Zheng, Y.G. Zhou, H.Y. Ma, Z. Zhang, H.H. Fu, W.M. Wu, S. Piao, Y.Q. Du, S. Wang // Zhongguo Gu Shang. 2016. Vol. 29, No 5. P. 415-420.
9. Замещение костных дефектов при первичном эндопротезировании коленного сустава / Н.Н. Корнилов, Т.А. Куляба, Р.М. Тихилов, А.В. Каземирский, А.В. Селин, А.И. Печинский, А.И. Петухов, И.И. Кроитору, А.В. Сараев // Травматология и ортопедия России. 2008. № 1 (47). С. 76-81.
10. Defektrekonstruktion in der Knieendoprothetik mit Wedges und Blocken / R. Hube, T. Pfitzner, P. von Roth, H.O. Mayr // Oper. Orthop. Traumatol. 2015. Vol. 27, No 1. P. 6-16. DOI: 10.1007/s00064-014-0331-2.
11. Lee J.K., Choi C.H. Management of tibial bone defects with metal augmentation in primary total knee replacement: a minimum five-year review // J. Bone Joint Surg. Br. 2011. Vol. 93, No 11. P. 1493-1496. DOI: 10.1302/0301-620x.93b10.27136.
12. Отдаленные результаты первичного эндопротезирование коленного сустава с применением модульных блоков для замещения костных дефектов медиального мыщелка большеберцовой кости / Н.В. Загородний, А.Н. Ивашкин, Ф.С. Ауде, Н.Г. Захарян, Р.В. Степанян, С.В. Безверхий, Р.Н. Алиев // Современная наука: Актуальные проблемы теории и практики. Серия: Естественные и технические науки. 2017. № 1. С. 69-74.
13. Femoral bone grafting in primary and revision total knee arthroplasty / C.J. van Loon, M.M. Wijers, M.C. de Waal Malefijt, P. Buma, R.P. Veth // Acta Orthop. Belg. 1999. Vol. 65, No 3. P. 357-363.
14. Mid-term results of impaction bone grafting in tibial bone defects in complex primary knee arthroplasty for severe varus deformity / Y.S. Tanwar, Y. Kharbanda, H. Bhargava, K. Attri, A. Bandil // SICOT J. 2019. Vol. 5. P. 2. DOI: 10.1051/sicotj/2018056.
15. Union, Knee Alignment, and Clinical Outcomes of Patients Treated with Autologous Bone Grafting for Medial Tibial Defects in Primary Total Knee Arthroplasty / K. Hosaka, S. Saito, T. Oyama, H. Fujimaki, E. Cho, K. Ishigaki, Y. Tokuhashi // Orthopedics. 2017. Vol. 40, No 4. P. e604-e608. DOI: 10.3928/01477447-20170418-01.
16. Отдаленные результаты применения костной аутопластики при эндопротезировании коленного сустава / Р.М. Тихилов, А.В. Каземирский, П.М. Преображенский, И.И. Кроитору, Т.А. Куляба, Н.Н. Корнилов, А.Х. Джигкаев, В.Л. Игнатенко // Травматология и ортопедия России. 2010. № 3(57). С. 21-27.
17. Tsukada S., Wakui M., Matsueda M. Metal block augmentation for bone defects of the medial tibia during primary total knee arthroplasty // J. Orthop. Surg. Res. 2013. Vol. 8. P. 36. DOI: 10.1186/1749-799X-8-36.
18. Metaphyseal sleeves as the primary implant for the management of bone defects in total knee arthroplasty after post-traumatic knee arthritis /C. Martin-Hernandez, L.J. Florfa-Arnal, A. Gomez-Blasco, A. Hernandez-Fernandez, C. Pinilla-Gracia, L. Rodriguez-Nogue, M. Lizcano- Palomares, E.M. Lasheras // Knee. 2018. Vol. 25, No 4. P. 669-675. DOI: 10.1016/j.knee.2018.05.009.
19. Addressing large tibial osseous defects in primary total knee arthroplasty using porous tantalum cones / J.S. You, A.R. Wright, I. Hasegawa, B. Kobayashi, M. Kawahara, J. Wang, C.K. Nakasone // Knee. 2019. Vol. 26, No 1. P. 228-239. DOI: 10.1016/j.knee.2018.11.001.
20. Total knee arthroplasty for post-traumatic proximal tibial bone defect: three cases report / D. Tigani, D. Dallari, C. Coppola, R. Ben Ayad, G. Sabbioni, M. Fosco // Open Orthop. J. 2011. Vol. 5. P. 143-150. DOI: 10.2174/1874325001105010143.
21. Методы замещения костного дефицита большеберцовой кости при первичном эндопротезировании коленного сустава: систематический обзор литературы / М.Б Гуражев, В.С. Баитов, А.Н. Гаврилов, В.В. Павлов, А.А. Корыткин // Травматология и ортопедия России. 2021. Т. 27, № 3. С. 173-188. DOI: 10.21823/2311-2905-2021-27-3-173-188.
22. Finite Element Assessment of the Screw and Cement Technique in Total Knee Arthroplasty / C. Zheng, H.Y. Ma, Y.Q. Du, J.Y. Sun, J.W. Luo, D. B. Qu, Y.G. Zhou // Biomed. Res. Int. 2020. Vol. 2020. 3718705. DOI: 10.1155/2020/3718705.
23. Use of screws and cement in primary TKA with up to 20 years follow-up / M.E. Berend, M.A. Ritter, E.M. Keating, M.D. Jackson, K.E. Davis // J. Arthroplasty. 2014. Vol. 29, No 6. P.1207-1210. DOI: 10.1016/j.arth.2013.12.023.
24. Aggarwal A.K., Baburaj V. Managing bone defects in primary total knee arthroplasty: options and current trends // Musculoskelet. Surg. 2021. Vol. 105, No 1. P. 31-38. DOI: 10.1007/s12306-020-00683-7.
25. Review article: bone defect classifications in revision total knee arthroplasty / Y.Y. Qiu, C.H. Yan, K.Y. Chiu, F.Y. Ng // J. Orthop. Surg. (Hong Kong). 2011. Vol 19, No 2. P. 238-243. DOI: 10.1177/230949901101900223.
26. Metaphyseal cones and sleeves in revision total knee arthroplasty: Two sides of the same coin? Complications, clinical and radiological results - a systematic review of the literature / A. Zanirato, M. Formica, L. Cavagnaro, S. Divano, G. Burastero, L. Felli // Musculoskelet. Surg. 2020. Vol. 104, No 1. P. 25-35. DOI: 10.1007/s12306-019-00598-y.
27. Buck B.E., Malinin T.I., Brown M.D. Bone transplantation and human immunodeficiency virus. An estimate of risk of acquired immunodeficiency syndrome (AIDS) // Clin. Orthop. Relat. Res. 1989. No 240. P. 129-136. PMID: 2645073.
28. Yoon J.R., Seo I.W., Shin Y.S. Use of autogenous onlay bone graft for uncontained tibial bone defects in primary total knee arthroplasty // BMC Musculoskelet. Disord. 2017. Vol. 18, No 1. P. 502. DOI: 10.1186/s12891-017-1826-4.
29. Yamanaka H., Goto K., Suzuki M. Total knee arthroplasty for rheumatoid arthritis patients with large tibial condyle defects // J. Orthop. Surg. (Hong Kong). 2012. Vol. 20, No 2. P. 148-152. DOI: 10.1177/230949901202000202. PMID: 22933668.
30. Kharbanda Y., Sharma M. Autograft reconstructions for bone defects in primary total knee replacement in severe varus knees // Indian J. Orthop. 2014. Vol. 48, No 3. P. 313-318. DOI: 10.4103/0019-5413.132525.
31. MatchIt: Nonparametric Preprocessing for Parametric Causal Inference / D. Ho, K. Imai, G. King, E.A. Stuart // Journal of Statistical Software. 2011. Vol. 42, No 8. DOI: 10.18637/jss.v042.i08.
32. Rationale of the Knee Society clinical rating system / J.N. Insall, L.D. Dorr, R.D. Scott, W.N. Scott // Clin. Orthop. Relat. Res. 1989. No 248. P. 1314.
33. Validation study of WOMAC: a health status instrument for measuring clinically important patient relevant outcomes to antirheumatic drug therapy in patients with osteoarthritis of the hip or knee / N. Bellamy, W.W. Buchanan, C.H. Goldsmith, J. Campbell, L.W. Stitt // J. Rheumatol. 1988. Vol. 15, No 12. P. 1833-1840.
34. Маркс В.О. Ортопедическая диагностика (руководство-справочник). Минск: Наука и техника, 1978, С. 440-441.
35. The Inadequacy of Short Knee Radiographs in Evaluating Coronal Alignment after Total Knee Arthroplasty / A. Park, J.B. Stambough, R.M. Nunley, R. L. Barrack, D. Nam // J. Arthroplasty. 2016. Vol. 31, No 4. P. 878-882. DOI: 10.1016/j.arth.2015.08.015.
36. Radiolucency at the bone-cement interface in total knee replacement. The effects of bone-surface preparation and cement technique / M.A. Ritter, S. A. Herbst, E.M. Keating, P.M. Faris.// J. Bone Joint Surg. Am. 1994. Vol. 76, No 1. P. 60-65. DOI: 10.2106/00004623-199401000-00008.
37. Ewald F.C. The Knee Society total knee arthroplasty roentgenographic evaluation and scoring system // Clin. Orthop. Relat. Res. 1989. No 248. P. 9-12.
38. De Waal Malefijt M.C., Van Kampen A., Slooff T.J. Bone grafting in cemented knee replacement. 45 primary and secondary cases followed for 2-5 years // Acta Orthop. Scand. 1995. Vol. 66, No 4. P. 325-328. DOI: 10.3109/17453679508995554.
39. Total hip arthroplasty with bulk femoral head autograft for acetabular reconstruction in developmental dysplasia of the hip / F.C. Pizarro, S.W. Young, J.H. Blacutt, R. Mojica, J.C. Cruz // ISRN Orthop. 2013. Vol. 2013. 794218. DOI: 10.1155/2013/794218.
40. Aglietti P., Buzzi R., Scrobe F. Autologous bone grafting for medial tibial defects in total knee arthroplasty // J. Arthroplasty. 1991. Vol. 6, No 4. P. 287-94. DOI: 10.1016/s0883-5403(06)80178-6.
41. Autogenous bone grafting of uncontained bony defects of tibia during total knee arthroplasty: a 10-year follow up / I. Ahmed, M. Logan, F. Alipour, H. Dashti, W.A. Hadden // J. Arthroplasty. 2008. Vol. 23, No 5. P. 744-750. DOI: 10.1016/j.arth.2007.08.021.
42. Bone graft for tibial defects in total knee arthroplasty. 1986 / L.D. Dorr, C.S. Ranawat, T.A. Sculco, B. McKaskill, B.S. Orisek // Clin. Orthop. Relat. Res. 2006. Vol. 446. P. 4-9. DOI: 10.1097/01.blo.0000214430.19033.b3.
43. Windsor R.E., Insall J.N., Sculco T.P. Bone grafting of tibial defects in primary and revision total knee arthroplasty // Clin. Orthop. Relat. Res. 1986. No 205. P. 132-137.
44. Laskin R.S. Total knee arthroplasty in the presence of large bony defects of the tibia and marked knee instability // Clin. Orthop. Relat. Res. 1989. No 248. P. 66-70.
45. Guha A.R., Debnath U.K., Graham N.M. Radiolucent lines below the tibial component of a total knee replacement (TKR) - a comparison between single- and two-stage cementation techniques // Int. Orthop. 2008. Vol. 32, No 4. P. 453-457.
Информация об авторах:
1. Михаил Борисович Гуражев
2. Владислав Сергеевич Баитов - кандидат медицинских наук
3. Андрей Николаевич Гаврилов
4. Виталий Леонидович Лукинов - кандидат физико-математических наук
5. Андрей Александрович Корыткин - кандидат медицинских наук
6. Виталий Викторович Павлов - доктор медицинских наук
Вклад авторов:
Гуражев М.Б. - написание текста рукописи, анализ полученных данных.
Баитов В.С. - разработка дизайна статьи, редактирование рукописи.
Гаврилов А.Н. - поиск литературных источников по теме статьи.
Лукинов В.Л. - статистический дизайн и сопровождение.
Корыткин А.А. - общее руководство, утверждение окончательного варианта статьи.
Павлов В.В. - анализ литературных данных, идеологическое сопровождение.
Теги: эндопротезирование коленного сустава
234567 Начало активности (дата): 01.08.2023 09:41:00
234567 Кем создан (ID): 989
234567 Ключевые слова: эндопротезирование коленного сустава, костный дефект, аутологичный костный транспланта
12354567899
Похожие статьи
Ретроспективный анализ результатов оперативного лечения пациентов с остеохондральными повреждениями блока таранной костиРентген на дому 8 495 22 555 6 8
Доклиническая оценка эффективности и безопасности нового костнопластического материала ксеногенного происхождения, содержащего в своем объеме ванкомицин и меропенем
Разработка шаблона мгновенных центров вращения коленного сустава (экспериментальное исследование)
Медицинские аспекты протезирования пациентов после ампутации на уровне голени с использованием цифровых технологий



