 26.07.2023
26.07.2023
Доклиническая оценка эффективности и безопасности нового костнопластического материала ксеногенного происхождения, содержащего в своем объеме ванкомицин и меропенем
Костный ксеноматрикс является доступным материалом для пластики в связи с его доступностью и возможностью существенной модификации
ВВЕДЕНИЕ
Возрастающая необходимость в костно-пластических материалах для практики травматологии и ортопедии в настоящее время приводит к тому, что материалы ксеногенного происхождения все чаще используются в клинике [1, 2]. Клинический опыт применения таких материалов указывает на то, что их эффективность и безопасность вполне сопоставимы с материалами аллогенного происхождения [3-5]. Среди основных обнаруживаемых недостатков применения ксеноматериалов можно выделить их недостаточную остеогенную активность и инфекционные осложнения, возникающие в постимплантационном периоде [6]. Частота последних, по ряду данных, может достигать 10-16 % [7-9]
Устранение указанных недостатков осуществляется путем модификации данного материала. Основные направления такой модификации - использование ксеноматрикса как носителя для различных стимуляторов [10, 11].
Существуют следующие направления модификации: 1) импрегнация ксеноматрикса биологически активными веществами [12, 13]; 2) создание на основе ксеноматрикса тканеинженерных конструкций [14-16]; 3) химическая модификация минерального и органических компонентов ксеноматрикса [17, 18]. Среди вариантов первого направления наиболее востребованной является модификация ксеноматери- ала веществами, препятствующими его инфицированию [19]. В этом направлении нами получен ксеногенный костнопластический материал, содержащий в своем объеме антибиотики ванкомицин и меропенем.
Цель исследования - сравнительная оценка эффективности и безопасности применения ксеногенного костнопластического материала, содержащего в своем объеме антибиотики ванкомицин и меропенем, в эксперименте на модели заживления дефекта длинных костей у кроликов.
МАТЕРИАЛЫ И МЕТОДЫ
Дизайн исследования. Исследование выполнено на 28 кроликах-самцах в возрасте от 8 месяцев до 1,2 года, массой тела от 3 до 4,5 кг. Всем животным моделировали полостной дефект правого и левого дистального метафиза бедренной кости размером 4 х 4 х 6 мм. В полость дефекта имплантировали тестируемые блоки костного матрикса аналогичного размера. Материал получали из костной ткани быков по технологии, описанной авторами в патентах (полезная модель № 191700, изобретения № 2708639, № 2712701), для очистки материала и импрегнации антибиотиков использовали технологию сверхкритической флюидной экстракции.
Животным группы 1 (n = 8, контроль) имплантировали свободный «чистый» костный блок (использован ксеногенный материал Матрикс остеопластический "Bio-Ost", РЗН 2015/3086). Животным группы 2 (n = 10) - костный блок, насыщенный ванкомицином. Животным группы 3 (n = 10) - костный блок, насыщенный меропенемом.
Срок плановой эвтаназии - 84-е и 182-е сутки после имплантации (эвтаназировали на каждом сроке половину животных в каждой группе).
Моделирование дефекта. В условиях операционной, под общим наркозом, у животных моделировали полостной дефект дистального метафиза бедренной кости. Для премедикации использовали растворы димедрола 1 % (0,02 мг/кг), атропина сульфата 0,1 % (0,02 мг/кг), медитина 1 % (0,35 мг/кг), для наркоза - эмульсию пропофола 1 % (4 мг/кг/мин). Оперативный доступ к дистальному метафизу бедренной кости осуществляли с латеральной поверхности. Выполняли продольный разрез кожи и подкожной клетчатки на латеральной поверхности дистального метафиза бедренной кости длиной от 2,5 до 3,0 см. Разъединяли мышцы, скелетировали поверхность метафиза. Далее, стоматологическим бором формировали несквозной полостной дефект в виде четырехугольной призмы размером 4 х 4 х 6 мм. После этого в дефект помещали имплантат.
Имплантат устанавливали плотно при помощи легкого вколачивания. Далее послойно наглухо ушивали операционную рану. После операции для достижения обезболивающего эффекта выполняли однократное введение раствора кетопрофена 10 % в дозе 0,02 мл/кг.
Для профилактики осложнений послеоперационной гипотермии наркозного сна осуществляли обогрев кроликов под инфракрасной лампой в течение 1-3 часов при температуре 25-28 °С на поверхности тела, до полного пробуждения животного. Животные в постимплантационном периоде содержались в индивидуальных клетках. Кормление кроликов осуществлялось 1 раз в сутки по стандартному рациону, вода - без ограничений.
Прижизненные исследования. В динамике оценивали общее состояние животных, особенность их поведения, интенсивность и характер двигательной активности, состояние волосяного и кожного покрова, окраску слизистых оболочек, потребление корма и воды. Оценивали локальные изменения мягких тканей, заживление послеоперационной раны, изменения функционального состояния оперированного сегмента.
Рентгенологические исследования. Выполняли рентгенографию зон имплантации в прямой и боковой проекции до операции, на 14, 28, 56, 84, 112, 140 и 182 сутки опыта.
Исследование проводили на рентгенологическом аппарате Toshiba (Rotanode) Model E7239.N:10G749 (Япония). Сила тока составляла 2,53,2 mA, напряжение 43-44 kV, фокусное расстояние 90 см, выдержка выставлялась автоматически.
Патоморфологические исследования. Плановую эвтаназию кроликов осуществляли после премедикации раствором димедрола 1 % (0,02 мг/кг) и рометара 2 % (5 мг/кг) с последующим введением летальной дозы барбитуратов.
После эвтаназии выполняли вскрытие трупа животного, макроскопическое описание картины органов и тканей, места введения имплантатов, определяли относительную массу внутренних органов. Осуществляли взятие материала для гистологического исследования.
Гистологические исследования. Проксимальные метаэпифизы бедренных костей экспериментальных животных забирали через 84 и 182 суток имплантации. Костные фрагменты фиксировали в нейтральном 10 % формалине, декальцинировали, обезвоживали и заливали в целлоидин-парафин. Гистологические срезы полученных блоков толщиной 5-7 мкм окрашивали гематоксилином и эозином. Автоматизированную оцифровку гистологических препаратов выполняли в сканирующем микроскопе для лабораторных исследований Pannoramic Midi II BF (3DHISTECH Ltd., Hungary) по технологии «Whole-slide imaging». Исследование цифровых гистологических препаратов, полуколичественную и количественную оценку тканевых и клеточных компонентов в области заполнения дефектов остеопластическими материалами производили с использованием программного продукта Pannoramic Viewer, версия 2.4. (3DHISTECH Ltd., Hungary). На цифровых изображениях гистологических срезов в области имплантации гистоморфометрически оценивали соотношение площадей остеопластического материала, новообразованных костной и соединительной тканей, костного мозга.
Для оценки биологического действия материалов определяли степень их раздражающего воздействия и ответной реакции клеток и тканей в соответствии с методикой, рекомендованной стандартом ГОСТ ISO 10993-6-2011. Все измерения были выполнены в средней части дефектов.
Лабораторные исследования включали гематологические и биохимические исследования, которые проводили до операции, на 14, 30, 84, 182 сутки после имплантации. Гематологические показатели определяли на анализаторе ABX Pentra 60 (Horiba ABX, Япония). Лейкоцитарную формулу подсчитывали в мазках крови, окрашенных по Романовскому-Гимзе, под иммерсией при увеличении х 100. Биохимическое исследование включало определение в сыворотке крови концентрации общего белка, мочевины, С-реактивного белка, глюкозы, активности аспартатаминотрансферазы и аланинаминотрансферазы. Активность ферментов, а также концентрацию общего белка, мочевины, глюкозы, С-реактивного белка в сыворотке крови определяли на автоматическом биохимическом анализаторе Hitachi/BM 902 (Япония), используя наборы реагентов фирмы Vital Diagnostic (СПб).
Статистическая оценка. Результаты количественных признаков представлены в таблицах виде медианы, 1-3 квартиля (Me; Q1-Q3). Нормальность распределения в выборках определяли с помощью критерия Шапиро- Уилка.
Процедуру статистической оценки значимости отличий показателей на сроках эксперимента с дооперационными значениями проводили с использованием W-критерия Вилкоксона. Достоверность межгрупповых различий оценивали с помощью непараметрического H-критерия Крускала-Уоллиса. Минимальный уровень значимости (р) принимали, равным 0,05.
Регулирующие стандарты. Исследование выполнено в соответствии со следующими документами:
- ГОСТ Р ИСО 10993-1-2011. Национальный стандарт Российской Федерации. Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 1. Оценка и исследования;
- ГОСТ Р ИСО 10993-6-2011. Национальный стандарт Российской Федерации. Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 6. Исследования местного действия после имплантации;
- ГОСТ 33215-2014 Руководство по содержанию и уходу за лабораторными животными. Правила оборудования помещений и организации процедур;
- ГОСТ 33216-2014 Руководство по содержанию и уходу за лабораторными животными. Правила содержания и ухода за лабораторными грызунами и кроликами.
Этические принципы. Исследование выполнено при соблюдении принципов гуманного обращения с лабораторными животными в соответствии с требованиями Европейской конвенции по защите позвоночных животных, используемых для экспериментов и других научных целей, и Директивой 2010/63/EU Европейского парламента и Совета Европейского союза от 22 сентября 2010 года по охране животных, используемых в научных целях. На проведение исследования получено одобрение комитета по этике при ФГБУ «НМИЦ ТО имена академика Г.А. Илизарова».
РЕЗУЛЬТАТЫ
Клинико-рентгенологические наблюдения. У животных всех экспериментальных групп заживление операционных ран проходило первичным натяжением, без септических осложнений. В послеоперационном периоде общее состояние животных всех групп было удовлетворительным. В течение первых 5-7 суток в зоне оперативных вмешательств наблюдалась гиперемия кожи и небольшой отек мягких тканей. В дальнейшем признаков воспаления мягких тканей не наблюдали. В течение первых трех суток у животных фиксировалась субфебрильная температура тела в пределах 39,5 °С, в последующие дни температура тела находилась в пределах средних значений. У всех животных функция конечностей сохранялась в полном объеме на протяжении всего периода наблюдений.
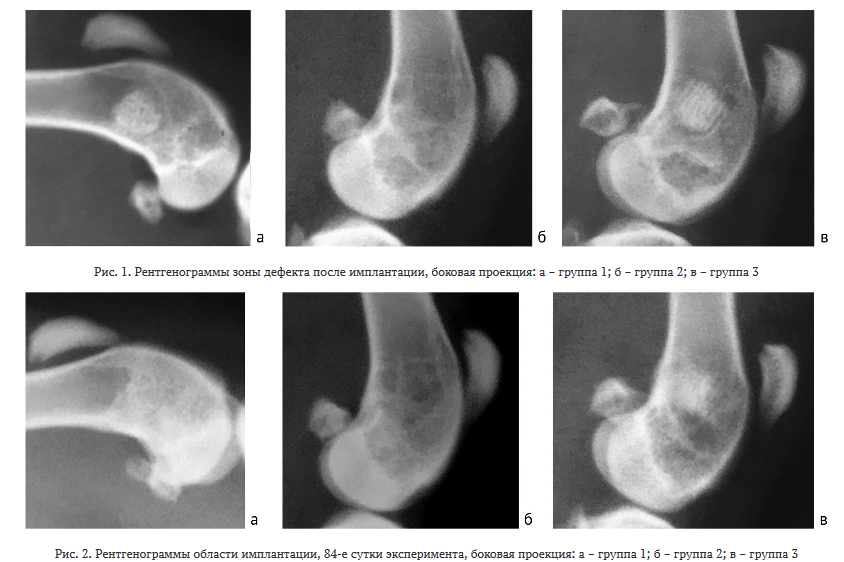
На рентгенограммах в день операции у животных групп 1 и 3 имплантируемый ксеноматрикс хорошо визуализировался. Его рентгенологическая плотность была схожа с плотностью корковой пластинки материнской кости, губчатая структура хорошо просматривалась (рис. 1, а, в). В группе 2 плотность имплантируемого материала была низкой и соответствовала плотности окружающей губчатой костной ткани, в связи с этим дефект кости, заполненный ксе- номатериалом, просматривался с трудом (рис. 1, б).
На 84-е сутки эксперимента у 4-х (50 %) животных группы 1 границы между имплантируемым материалом и материнской костью была сглажена (рис. 2, а). В группе 2 к этому сроку в 100 % случаев ксеноматрикс не визуализировался (рис. 2, б). В группе 3 границы между имплантируемым материалом и материнской костью стирались, имплантат в большинстве случаев (60 %) имел вид облаковидной тени высокой интенсивности (рис. 2, в).
На 182-е сутки эксперимента в группе 1 имплантируемый материал имел вид слабозаметной облаковидной тени (рис. 3, а). В группе 2 к этому сроку материал не визуализировался в 100 % случаев (рис. 3, б). В группе 3 у 5 (50 %) животных ксеноматрикс определялся в виде округлого размытого пятна повышенной рентгенологической плотности (рис. 3, в).
Патоморфологическое исследование. Все животные были эвтаназированы планово, гибели животных вне плана не зафиксировано. Осмотр внутренних органов при патологоанатомическом исследовании не выявил патологических изменений у всех экспериментальных животных. Относительная масса органов у животных групп 2-3 статистически значимо относительно животных группы 1 не отличалась. Осмотр зон имплантации обнаружил плотное срастание имплантата с материнской костью, свищевые ходы отсутствовали. Однако у одного животного из каждой группы отмечали наличие хрящевых наростов, что было интерпретировано как разившийся артроз коленного сустава.
Это наблюдение говорит о том, что ксеноматериал целесообразно с осторожностью применять для замещения костных дефектов, расположенных рядом с суставными полостями.
Сводные данные о скорости деградации материала и клинических нежелательных явлениях, отмеченных в ходе эксперимента, представлены в таблице 1. Можно отметить, что более раннее замещение материала отмечалось у животных группы 2. В группе 3 полного замещения материала к последнему сроку наблюдения не отмечалось.
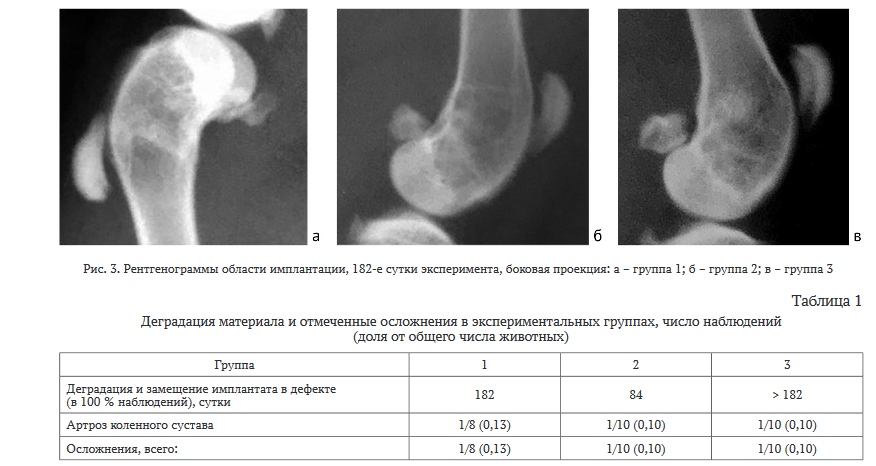
Таким образом, клиническо-рентгенологические и патологоанатомические наблюдения говорят о том, что во всех группах имплантационный материал имел приемлемую биосовместимость. Случаев отторжения и токсических проявлений (локальных и системных) не было выявлено ни у одного животного. Во всех группах имплантация остеопластического матрикса (как немодифицированного, так и модифицированного) в костную ткань метафизов трубчатых костей не вызывала у животных явных признаков воспаления, сепсиса, развития серьезных нежелательных реакций, что в целом говорило о приемлемой безопасности тестируемых материалов. Однако разная длительность деградации материалов и наличие отдельных осложнений приводят к необходимости уточнения показаний их применения в зависимости от локализации дефекта.
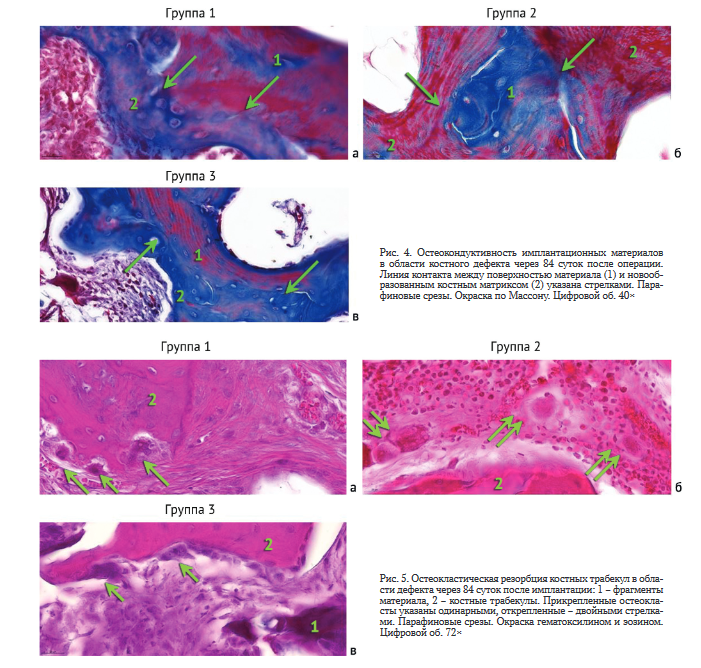
Гистологические исследования. На 84-е сутки эксперимента у животных всех групп регистрировали феномен остеокондукции, заключающийся в тесном контакте новообразованного грубоволокнистого костного матрикса с поверхностью фрагментов костного ксеноматрикса (рис. 4). В то же время сцепление новообразованных трабекул с имплантационными материалами не было прочным, что приводило к возникновению локальных артефактов в виде их разделения и образования пустот на гистологических срезах.
В данном экспериментальном периоде также отмечалась активная резорбция новообразованных костных трабекул. Обнаруживали как прикрепленные (рис. 5, а, в), так и открепленные (рис. 5, б) остеокласты с 2-10 ядрами.
Прикрепленные остеокласты имели хорошо развитую гофрированную каемку, открепленные - сглаженный овальный контур.
Количество остеокластов составляло около 1-2, редко 3-5 в поле зрения.
Через 182 суток после имплантации у животных всех экспериментальных групп наблюдали восстановление органотипического строения метафизов трубчатых костей в области моделирования дефектов (рис. 6, а-в). В группе 1 имплантационный материал подвергался биодеградации, замещаясь новообразованной сетью массивных костных трабекул (рис. 6, а). Межтрабекулярные пространства заполнял кроветворный костный мозг, включающий адипоциты и очажки соединительной ткани. В группах 2 и 3 на этом сроке эксперимента отмечали практически полную элиминацию ксеноматериала и заполнение дефекта губчатым костным веществом с гипопластической трабекулярной сетью и обширными полями красного и желтого костного мозга (рис. 6, б, в).
Анализ количественного соотношения тканевых компонентов в области средней части дефекта обнаружил, что на 84-е сутки эксперимента в группах 2 и 3 относительная площадь фрагментов ксеноматрикса и соединительной ткани на гистологических срезах была значимо ниже в сравнении с контролем. Площади костной ткани в
составе новообразованных костных трабекул и костного мозга в межтрабекулярных промежутках, напротив, достоверно превышали контрольные значения (табл. 2).
На 182-е сутки после операции в группе 1 отмечено трехкратное снижение площади имплантационного материала и четырехкратное - соединительной ткани. Суммарная площадь трабекулярной костной ткани несколько увеличивалась в сравнении с предыдущим сроком эксперимента. В группах 2 и 3 отмечали практически полную элиминацию ксеноматериала в средней части дефекта и замещение его трабекулярной костью с костным мозгом.
Анализ оценки раздражающего действия изученных материалов показал, что на 84-е сутки после имплантации показатели клеточной и тканевой реакции, а также результирующий суммарный показатель в группах 2 и 3, не отличались от таковых группы 1 (табл. 3). На 182-е сутки эксперимента показатель клеточной реакции в области дефекта у животных групп 2, 3 был снижен в сравнении с контролем, что определило значимое снижение степени раздражающего действия материалов.
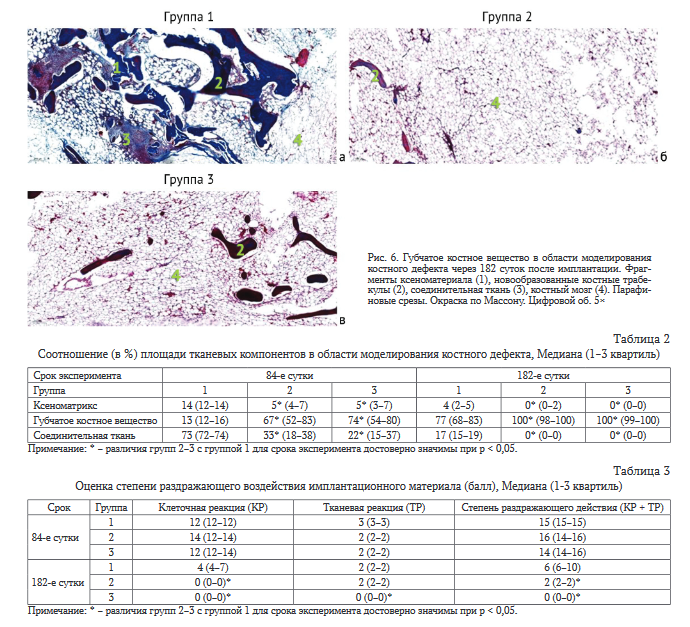
Анализ данных гистологического исследования показал, что имплантация ксеногенного костного матрикса и его модификаций, импрегнированных ванко- мицином и меропенемом, не препятствует заполнению костных дефектов губчатым костным веществом с развитой трабекулярной структурой. Изученные материалы проявляют свойства биорезорбируемости и остеокондуктивности. Остеопластические материалы с ванкомицином и меропенемом обладают лучшими характеристиками биосовместимости в сравнении с контролем. При этом на 182-е сутки после имплантации материалы, импрегнированные ванкомицином и меропенемом, являются менее раздражающими относительно контрольного материала. Выраженность признаков тканевой и клеточной реакции снижается пропорционально элиминации остеопластического материала.
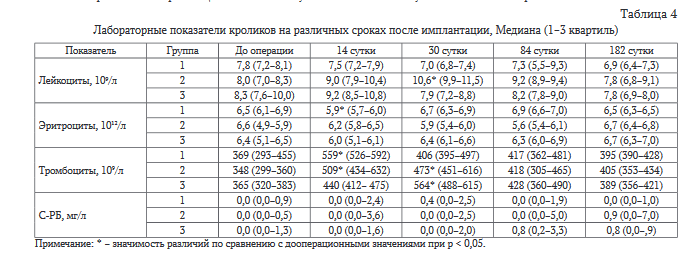
Лабораторные исследования. Статистически значимое повышение средних значений уровня лейкоцитов отмечалось на 30-е сутки эксперимента у животных группы 2 (табл. 4), снижение уровня эритроцитов отмечалось у животных группы 1. У животных всех групп отмечался рост числа тромбоцитов на 14-30 сутки после имплантации. Средние значения С-реактивного белка в сыворотке крови животных всех групп статистически значимо не отличались. Уровень общего белка, глюкозы и мочевины, а также активность трансами- наз в сыворотке крови животных всех групп на сроках эксперимента статистически значимо не отличались.
Оценка индивидуальных отклонений лабораторных показателей показала, что у одного животного (частота 0,13) группы 1 на сроках эксперимента обнаруживались признаки воспалительной реакции: рост уровня С-реактивного белка на 30-е сутки и лейкоцитопения с тромбоцитозом на 84-е сутки после имплантации. Клинически у данного животного был обнаружен дерматит на обеих задних лапах. Взаимосвязь этого события с имплантацией изделия была оценена как маловероятная, т.к. причиной дерматита, вероятно, являлись натоптыши на лапах от решётки поддона вследствие большого веса данного животного. В группе 2 и 3 у двух животных в каждой группе (частота 0,20) отмечали разовый рост уровня С-реактивного белка. Таким образом, результаты лабораторного исследования также демонстрируют приемлемую безопасность применения изученных ксеноматериалов.
ДИСКУССИЯ
Для костной пластики ксеноматериалы представляются перспективной альтернативой ауто- и аллотрансплантатам [20, 21]. Однако неоднозначность данных по доказательности эффективности ксеноматериалов в настоящее время приводит к необходимости улучшения и расширения биологических характеристик ксе- номатрикса, в том числе и придания материалу антимикробной активности [22-24].
В этом направлении ранее было показано, что костный ксеноматрикс является оптимальным материалом для загрузки антибиотиков, как с позиции доступности сырья, так и в качестве материала, обладающего остеоиндуктивными и биоразлагаемыми свойствами [25].
По результатам данного исследования нами были показаны приемлемые характеристики оригинальных костных ксеноматериалов, содержащих в своем объеме антибиотики.
Отмечено, что данные материалы обладали достаточной биосовместимостью. Скорость деградации и замещения полости дефектов для материала, содержащего ванкомицин, даже превышала эти характеристики чистого ксеноматериала. В рамках дизайна выполненного исследования можно лишь ориентировочно говорить об антимикробной активности материала (случаев инфицирования отмечено не было). Тем не менее, ранее нами в опытах in vitro были продемонстрированы антибактериальные характеристики данного материала по отношению к S. aureus [26].
Анализируя эффективность тестируемых ксено- матриксов, важно отметить, что большинство из его эксплуатационных характеристик (биосовместимость, скорость резорбции, остеокондукция и остеоиндукция), по-видимому, зависит от совместимости костной основы и антибиотика, а также от технологии импрегнации последних. Согласно проведенному исследованию, очевидно, что эти условия в нашем опыте, скорее всего, не влияли на показатели эффективности и безопасности материала с антибиотиками в сравнении с чистым материалом. В пользу этого говорят и литературные данные. Так, показано, что использованная нами технология импрегнации не сказывается совместимости костного материала [27], а добавление ванкомицина не оказывает существенного влияния на структуру костного каркаса [28].
Однако литературные данные достаточно неоднозначны в части оценки скорости ремоделирования ксе- номатериалов, насыщенных антибиотиками. По некоторым данным, наблюдается как увеличение скорости ремоделирования, так и его снижение относительно чистого материала [29, 30]. В этом плане нужно согласиться с авторами работы [31], в которой отмечается, что локальное воздействие антибиотиков на репарацию кости - слабо изученный процесс, зависящий от вида антибиотиков, их сочетания и концентрации.
Это согласуется и с нашими данными рентгенологических исследований, когда скорость ремоделирования кости в области имплантации материала с ванкомицином была выше, а материала с меропенемом ниже относительно скорости ремоделирования чистого материала. Хотя данные гистологических исследований свидетельствуют об ускоренной деградации модифицированного антибиотиками ксеноматрикса в обеих опытных сериях.
Наши опыты также свидетельствуют о достаточно приемлемой безопасности исследованного материала с антибиотиками (отсутствие воспаления, инфицирования, серьезных нежелательных явлений и т.д.) относительно контрольных образцов. В целом достаточная безопасность ксеноматериала отмечена и в других работах [32, 33].
Таким образом, полученные нами данные по эффективности и безопасности костных ксеноматериалов, импрегнированных ванкомицином и меропенемом, говорят о возможности их применения в клинической практике. В пользу этого имеются данные о положительном опыте клинического применения ксенома- териалов с антибиотиками, в частности у пациентов с посттравматической костной инфекцией длинных костей нижних конечностей [34].
Очевидно, что некоторые характеристики исследуемого материала, а именно, возможность предупреждения инфекционных осложнений, могут быть с высоким уровнем доказательности изучены только в клинической практике.
Тем не менее, сопоставимая скорость замещения материала нативной костью, его безопасность относительно чистого ксеноматериала позволят использовать материал с антибиотиками по показаниям, применимым для использования чистого материала. Тем более, что применение ксеноматрикса как средства локальной доставки антибиотиков, по мнению некоторых исследователей, вполне перспективно не только с целью профилактики инфицирования, но и для пластики дефектов при лечении остеомиелита [35]. В дополнение стоит отметить, что для целей профилактики инфицирования ксенома- териала перспективным выглядит использование его ступенчатой (многократной) стерилизации, однако эти процедуры могут существенно снижать его эксплуатационные характеристики [36].
ЗАКЛЮЧЕНИЕ
Разработанные костнопластические материалы на основе ксеноматрикса костей крупного рогатого скота, насыщенные ванкомицином и меропенемом, обладают приемлемыми характеристиками безопасности и эффективности как в части замещения дефекта, так и профилактики инфицирования при костной пластике. Это делает возможным их дальнейшую апробацию в клинической практике.
СПИСОК ИСТОЧНИКОВ
1. Стогов М.В., Смоленцев Д.В., Киреева Е.А. Костные ксеноматериалы в травматологии и ортопедии (аналитический обзор литературы) // Травматология и ортопедия России. 2020. Т. 26, № 1. С. 181-189. DOI: 10.21823/2311-2905-2020-26-1-181-189.
2. Bone xenotransplantation: A review of the history, orthopedic clinical literature, and a single-center case series / D.N. Bracey, N.E. Cignetti, A.H. Jinnah, A.V. Stone, B.M. Gyr, P.W. Whitlock, А.Т. Scott // Xenotransplantation. 2020. Vol. 27, No 5. Р. e12600. DOI: 10.1111/xen.12600.
3. Acetabular revision in total hip arthroplasty with tantalum augmentation and lyophilized bovine xenograft / C.V. Diesel, T.A. Ribeiro, M.R. Guimaraes, C.A.S. Macedo, C.R. Galia // Rev. Bras. Ortop. 2017. Vol. 52, No Suppl. 1. P. 46-51. DOI: 10.1016/j.rboe.2017.08.009.
4. Improved osseointegration using porcine xenograft compared to demineralized bone matrix for the treatment of critical defects in a small animal model / A.H. Jinnah, P. Whitlock, J.S. Willey, K. Danelson, B.A. Kerr, O.A. Hassan, C.L. Emory, T.L. Smith, D.N. Bracey // Xenotransplantation. 2021. Vol. 28, No 2. P. e12662. DOI: 10.1111/xen.12662.
5. Comparison of Allograft and Bovine Xenograft in Calcaneal Lengthening Osteotomy for Flatfoot Deformity in Cerebral Palsy / J. Rhodes, A. Mansour, A. Frickman, B. Pritchard, K. Flynn, Z. Pan, F. Chang, N. Miller // J. Pediatr. Orthop. 2017. Vol. 37, No 3. P. e202-e208. DOI: 10.1097/ BPO.0000000000000822.
6. Recent Trends in the Development of Bone Regenerative Biomaterials / G. Tang, Z. Liu, Y. Liu, J. Yu, X. Wang, Z. Tan, X. Ye // Front. Cell Dev. Biol. 2021. Vol. 9. P. 665813. DOI: 10.3389/fcell.2021.665813.
7. Аугментация костных дефектов дистального отдела большеберцовой кости синтетическим b-трикальций фосфатом и ксенопластическим материалом "Остеоматрикс" при хирургическом лечении внутрисуставных импрессионных переломов / С.М. Кутепов, Е.А. Волокитина, М.В. Гилев, Ю.В. Антониади, Е.В. Помогаева // Гений ортопедии. 2016. № 3. С. 14-20.
8. Биодеградируемые импланты. Становление и развитие. Преимущества и недостатки. (Обзор литературы) / Л.А. Якимов, Л.Ю. Слиняков, Д.С. Бобров, Е.Б. Калинский, Е.В. Ляхов, А.Л. Лосик // Кафедра травматологии и ортопедии. 2017. № 1 (21). С. 47-52.
9. Clinical trial and in-vitro study comparing the efficacy of treating bony lesions with allografts versus synthetic or highly-processed xenogeneic bone grafts / E.J. Kubosch, A. Bernstein, L. Wolf, T. Fretwurst, K. Nelson, H. Schmal // BMC Musculoskelet. Disord. 2016. Vol. 17. P. 118. DOI: 10.1186/ s12891-016-0930-1.
10. Investigating the Osteoinductive Potential of a Decellularized Xenograft Bone Substitute / D.N. Bracey, A.H. Jinnah, J.S. Willey, T.M. Seyler, I. D. Hutchinson, P.W. Whitlock, T.L. Smith, K.A. Danelson, C.L. Emory, B.A. Kerr // Cells Tissues Organs. 2019. Vol. 207, No 2. P. 97-113. DOI: 10.1159/000503280.
11. Comparison of demineralized bone matrix and hydroxyapatite as carriers of Escherichia coli recombinant human BMP-2 / Y.Z. Jin, G.B. Zheng, J. H. Lee, S.H. Han // Biomater. Res. 2021. Vol. 25, No 1. DOI: 10.1186/s40824-021-00225-7.
12. Interaction between living bone particles and rhBMP-2 in large segmental defect healing in the rat femur / F. Liu, J.W. Wells, R.M. Porter, V. Glatt, Z. Shen, M. Schinhan, A. Ivkovic, M.S. Vrahas, C.H. Evans, E. Ferreira // J. Orthop. Res. 2016. Vol. 34, No 12. P. 2137-2145. DOI: 10.1002/jor.23255.
13. Xeno-Hybrid Bone Graft Releasing Biomimetic Proteins Promotes Osteogenic Differentiation of hMSCs / H. Zhu, V.H. Blahnova, G. Perale, J. Xiao, F. Betge, F. Boniolo, E. Filova, S.P. Lyngstadaas, H.J. Haugen // Front. Cell Dev. Biol. 2020. Vol. 8. P. 619111. DOI: 10.3389/fcell.2020.619111.
14. Mesenchymal stem cell sheets: a new cell-based strategy for bone repair and regeneration / M. Chen, Y. Xu, T. Zhang, Y. Ma, J. Liu, B. Yuan, X. Chen, P. Zhou, X. Zhao, F. Pang, W. Liang // Biotechnol. Lett. 2019. Vol. 41, No 3. P. 305-318. DOI: 10.1007/s10529-019-02649-7.15. The construction of a novel xenograft bovine bone scaffold, (DSS)6-liposome/CKIP-1 siRNA/calcine bone and its osteogenesis evaluation on skull defect in rats / G. Xu, X. Hu, L. Han, Y. Zhao, Z. Li // J. Orthop. Translat. 2021. Vol. 28. P. 74-82. DOI: 10.1016/j.jot.2021.02.001.
16. Stem Cell-Friendly Scaffold Biomaterials: Applications for Bone Tissue Engineering and Regenerative Medicine / Y. Zhang, D. Wu, X. Zhao, M. Pakvasa, A.B. Tucker, H. Luo, K.H. Qin, D.A. Hu, E.J. Wang, A.J. Li, M. Zhang, Y. Mao, M. Sabharwal, F. He, C. Niu, H. Wang, L. Huang, D. Shi, Q. Liu, N. Ni, K. Fu, C. Chen, W. Wagstaff, R.R. Reid, A. Athiviraham, S. Ho, M.J. Lee, K. Hynes, J. Strelzow, T.-C. He, M. El Dafrawy // Front. B?oeng. Biotechnol. 2020. Vol. 8. 598607. DOI: 10.3389/fbioe.2020.598607.
17. Fabrication and characterization of bovine hydroxyapatite-gelatin-alendronate scaffold cross-linked by glutaraldehyde for bone regeneration / Samirah, A.S. Budiatin, F. Mahyudin, J. Khotib // J. Basic Clin. Physiol. Pharmacol. 2021. Vol. 32, No 4. P. 555-560. DOI: 10.1515/jbcpp-2020-0422.
18. Contribution of the in situ release of endogenous cations from xenograft bone driven by fluoride incorporation toward enhanced bone regeneration / W. Qiao, R. Liu, Z. Li, X. Luo, B. Huang, Q. Liu, Z. Chen, J.K.H. Tsoi, Y.X. Su, K.M.C. Cheung, J.P. Matinlinna, K.W.K. Yeung, Z. Chen // Biomater. Sci. 2018. Vol. 6, No 11. P. 2951-2964. DOI: 10.1039/c8bm00910d.
19. Local antibiotic delivery with bovine cancellous chips / C.S. Lewis, J. Katz, M.I. Baker, P.R. Supronowicz, E. Gill, R.R. Cobb // J. Biomater. Appl.
2011. Vol. 26, No 4. P. 491-506. DOI: 10.1177/0885328210375729.
20. Comparative study of impact of animal source on physical, structural, and biological properties of bone xenograft / F. Gashtasbi, S. Hasannia, S. Hasannia, M. Mahdi Dehghan, F. Sarkarat, A. Shali // Xenotransplantation. 2020. Vol. 27, No 6. e12628. DOI: 10.1111/xen.12628.
21. Bone grafts: which is the ideal biomaterial? / H.J. Haugen, S.P. Lyngstadaas, F. Rossi, G. Perale // J. Clin. Periodontol. 2019. Vol. 46, No Suppl. 21. P. 92-102. DOI: 10.1111/jcpe.13058.
22. Накоскин А.Н., Дюрягина О.В., Ковинька М.А. Ксеноимплантация матрикса костной ткани при замещении дефектов кости у кроликов // Ветеринария Кубани. 2016. № 6. С. 19-21.
23. Маркеры костного ремоделирования при замещении дефекта трабекулярной костной ткани резорбируемыми и нерезорбируемыми остеопластическими материалами в эксперименте / М.В. Гилев, Е.А. Волокитина, И.П. Антропова, В.В. Базарный, С.М. Кутепов // Гений ортопедии. 2020. Т. 26, № 2. С. 222-227.
24. Evaluation and comparison of synthesised hydroxyapatite in bone regeneration: As an in vivo study / A. Rahimnia, H. Hesarikia, A. Rahimi, S. Karami, K. Kaviani // J. Taibah Univ. Med. Sci. 2021. Vol. 16, No 6. P. 878-886. DOI: 10.1016/j.jtumed.2021.06.006.
25. Local antibiotic delivery with demineralized bone matrix / C.S. Lewis, P.R. Supronowicz, R.M. Zhukauskas, E. Gill, R.R. Cobb // Cell Tissue Bank. 2012. Vol. 13, No 1. P. 119-127. DOI: 10.1007/s10561-010-9236-y.
26. In vitro оценка антимикробной активности модифицированных костных ксеноматериалов / М.В. Стогов, Д.В. Смоленцев, З.С. Науменко, Н.В. Годовых, М.В. Гурин, Е.А. Киреева, А.Е. Лукьянов, О.В. Дюрягина, Н.В. Тушина // Гений ортопедии. 2019. Т. 25, № 2. С. 226-231. DOI: 10.18019/1028-4427-2019-25-2-226-231.
27. Получение ксеногенной костной крошки для имплантаций с помощью сверхкритической флюидной экстракции / Д.В. Смоленцев, М.В. Гурин, А.А. Венедиктов, С.В. Евдокимов, Р.С. Фадеев // Медицинская техника. 2019. № 4 (316). С. 8-10.
28. Evaluation of a bone filler scaffold for local antibiotic delivery to prevent Staphylococcus aureus infection in a contaminated bone defect / K.E. Beenken, M.J. Campbell, A.M. Ramirez, K. Alghazali, C.M. Walker, B. Jackson, C. Griffin, W. King, S.E. Bourdo, R. Rifkin, S. Hecht, D.G. Meeker, D.E. Anderson, A.S. Biris, M.S. Smeltzer // Sci. Rep. 2021. Vol. 11, No 1. P. 10254. DOI: 10.1038/s41598-021-89830-z.
29. A biodegradable antibiotic-eluting PLGA nanofiber-loaded deproteinized bone for treatment of infected rabbit bone defects / J. Gao, G. Huang, G. Liu, Y. Liu, Q. Chen, L. Ren, C. Chen, Z. Ding // J. Biomater. Appl. 2016. Vol. 31, No 2. P. 241-249. DOI: 10.1177/0885328216654424.
30. Antibiotic-loaded bone graft for reduction of surgical site infection in spinal fusion / S.M. Shiels, V.P. Raut, P.B. Patterson, B.R. Barnes, J.C. Wenke // Spine J. 2017. Vol. 17, No 12. P. 1917-1925. DOI: 10.1016/j.spinee.2017.06.039.
31. Effect of Local Delivery of Vancomycin and Tobramycin on Bone Regeneration / W. Han, L. Zhang, L.J. Yu, J.Q. Wang // Orthop. Surg. 2021. Vol. 13, No 5. P. 1654-1661. DOI: 10.1111/os.13020.
32. Биохимические маркеры остеогенеза и воспаления в сыворотке крови при ксеноимплантации / А.Н. Накоскин, М.А. Ковинька, И.А. Тала- шова, Н.В. Тушина, С.Н. Лунева // Медицинский вестник Северного Кавказа. 2018. Т. 13, № 1-1. С. 82-85.
33. Репаративные процессы при алло- и ксеноимплантации внеклеточного матрикса кости / А.Н. Накоскин, Т.А. Силантьева, Н.В. Накоскина, И.А. Талашова, Н.В. Тушина // Патологическая физиология и экспериментальная терапия. 2018. Т. 62, № 3. С. 60-66. DOI: 10.25557/0031- 2991.2018.03.60-66.
34. Effect of Anti-infective reconstituted bone xenograft combined with external fixator on serum CRP and PCT levels and prognosis of patients with bone infection after lower extremity long bone trauma / F. Wang, Y. Liu, X. Qiu, H. Fei, W. Liu, K. Yuan // Evid. Based Complement. Alternat. Med. 2021. Vol. 2021. P. 5979514. DOI: 10.1155/2021/5979514.
35. Recent advances in the local antibiotics delivery systems for management of osteomyelitis / R.K. Wassif, M. Elkayal, R.N. Shamma, S.A. Elkheshen // Drug Deliv. 2021. Vol. 28, No 1. P. 2392-2414. DOI: 10.1080/10717544.2021.1998246.
36. Изменения морфомеханических характеристик костных имплантатов при радиационной стерилизации / В.В. Розанов, И.В. Матвейчук, А.П. Черняев, Н.А. Николаева // Известия Российской академии наук. Серия физическая. 2019. Т. 83, № 10. С. 1435-1440.
Информация об авторах:
1. Максим Валерьевич Стогов - доктор биологических наук, доцент
2. Ольга Владимировна Дюрягина - кандидат ветеринарных наук
3. Тамара Алексеевна Силантьева - кандидат биологических наук
4. Елена Анатольевна Киреева - кандидат биологических наук;
5. Ирина Владимировна Шипицына - кандидат биологических наук
6. Михаил Александрович Степанов - кандидат ветеринарных наук
Теги: дефект длинных костей
234567 Начало активности (дата): 26.07.2023 12:06:00
234567 Кем создан (ID): 989
234567 Ключевые слова: костный ксеноматериал, ванкомицин, меропенем, дефект длинных костей
12354567899
Похожие статьи
Рентген на дому 8 495 22 555 6 8Разработка шаблона мгновенных центров вращения коленного сустава (экспериментальное исследование)
Оценка синовита голеностопного сустава при диабетической нейроостеоартропатии в зависимости от воспалительной фазы хронического остеомиелита
Медицинские аспекты протезирования пациентов после ампутации на уровне голени с использованием цифровых технологий



