 14.11.2023
14.11.2023
Сравнительная оценка остеоинтеграции новых чрескожных имплантатов из ультрамелкозернистого сплава Ti Grade 4
Показано, что титановые имплантаты из материалов со структурированной поверхностью обеспечивают повышенную скорость остеоинтеграции, что делает их применение достаточно перспективным
ВВЕДЕНИЕ
Применение
титановых сплавов в наноструктурном и ультрамелкозернистом (УМЗ) состояниях, а
также модификация поверхности в настоящее время представляют собой
универсальную стратегию для повышения механических свойств и биосовместимости
медицинских изделий [1, 2].
Для
практики ортопедии в этой части актуальными являются исследования
остеоинтеграции чрескожных имплантатов из титановых сплавов с различным
химическим составом, структурой и покрытием [3-6]. Показано, что остео-
интегрируемые титановые имплантаты из материалов со структурированной
поверхностью обеспечивают повышенную
скорость остеоинтеграции [7, 8]. В большей степени это изучено для изделий,
используемых в стоматологии и челюстно-лицевой хирургии [9-11]. Тем не менее,
эти исследования делают перспективным направлением улучшение характеристик приживаемости
чрескожных имплантатов, внедряемых в настоящее время для решения задач
остеоинтеграционного протезирования [12-14].
Цель
- провести сравнительную оценку эффективности остеоинтеграции новых чрескожных
имплантатов для протезирования, изготовленных из ультрамелкозернистого сплава
TiGrade4.
МАТЕРИАЛЫ
И МЕТОДЫ
Исследование
выполнено на 12 кроликах-самцах породы Советская шиншилла, возраст - 6-10
месяцев, средний вес - 3,2 ± 0,3 кг. Премедикацию для операции осуществляли
путем внутримышечного введения димедрола 1 % 10 мг/кг, атропина 0,01 % 0,05
мг/кг, медитина 0,1 % 1 мг/кг, золетила 100 0,025 мг/кг, наркоз производили
внутривенно препаратом пропофол 1 % 10 мг/кг. Всем кроликам производили
остеотомию большеберцовой кости на границе верхней и средней трети. Далее
рассверливали костномозговой канал до 4,5 мм и вкручивали в культю
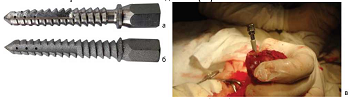
большеберцовой кости имплантат (патент № 152558) диаметром 5 мм. Животным опытной
группы (n = 6) устанавливали титановые
имплантаты из ультрамелкозернистого сплава Ti Grade 4
(рис. 1, а), животным контрольной группы (n =
6) устанавливали титановые имплантаты из стандартного сплава Ti6Al4V (рис.
1, б). Установка имплантатов представлена на рисунке 1, в. Культю голени
формировали миопластическим способом с использованием одного
кожно-фасциального лоскута.
Далее
на кость устанавливалось компрессионное устройство (патент № 2631631) с
протезом из фторопласта (рис. 2). Кость подвергалась компрессионной нагрузке
3,5 Н в течение 5 недель после имплантации. Выбор величины компрессионной
нагрузки обоснован нами в ранее выполненном исследовании [15].
Рис. 1.
Имплантаты из ультрамелкозернистого сплава Ti Grade 4
после механической обработки (а) и сплава Ti6Al4V после
селективного лазерного сплавления (б); установка имплантатов в культю
большеберцовой кости кролика (в)
Рис. 2.
Рентгенограмма культи большеберцовой кости кролика после операции (а) и фото
кролика с установленным имплантатом в устройстве внешней фиксации с
компрессионным нагружением (б)
Экспериментальные
исследования
Имплантаты
для группы контроля изготавливались из порошка Ti6Al4V производства
фирмы Advanced Powders&Coatings Inc. (Канада) со средним размером
частиц 23,5 мкм, изготовленных методом селективного лазерного сплавления (СЛС)
на 30-принтере EOS EOSINT M 280
(Германия) в Уральском федеральном университете [16]. Имплантаты для опытной
группы изготавливались из прутка ультрамелкозернистого титана Ti Grade 4
диаметром 10 мм, полученного методом равноканального углового прессования на
предприятии ООО «Нанотех» (Уфа), производились на автомате продольного
точения MANURHIN K’MX 432.
Механические свойства материалов и среднее арифметическое отклонение
микропрофиля резьбовой поверхности имплантатов представлены в таблице 1. Эти
данные по свойствам материала СЛС-имплантатов со- гласуютя с результатами
исследований, приведенных в работе Каплана М.А. с соавт. [17].
Таблица
1
Механические
свойства и среднее арифметическое отклонение микропрофиля резьбовой поверхности
имплантатов
|
Тип
имплантата
|
СЛС Ti6Al4V (контроль)
|
Механическая
обработка УМЗ сплава Ti Grade
4 (опыт)
|
|
МПа
|
1045
|
1071
|
|
ов,
МПа
|
1200
|
1240
|
|
5, %
|
8
|
11
|
|
Ra,
мкм
|
5,59
|
0,95
|
Дополнительно
для оценки структурных изменений, происходящих в процессе токарной обработки
опытного имплантата, нами на сканирующем электронном микроскопе Zeiss CrossBeam AURIGA в
режиме анализа дифракции обратно рассеянных электронов (EBSD) выполнено
исследование микроструктуры материала имплантатов после механической
обработки. На рисунке 3 представлены микрошлифы резьбовой части имплантата,
результаты EBSD-анализа растровой электронной
микроскопии и гистограмма распределения размеров зерен микроструктуры,
построенная с использованием программного пакета SIAMS 700.
Результат
EBSD-анализа показал, что исследуемая
микроструктура является смешанной ультрамелкозернистой и нанокристаллической с
отдельными крупными зернами размером до 2 мкм. Превалируют зерна размером от
100 до 300 нм, их количество составляет порядка 28 %. Присутствует также
большое количество нанокристаллитов с размерами менее 100 нм, содержание
которых достигает 32 %. Наличие таких нанокристаллитов в материале резьбовой
поверхности имплантата
предполагает существенное повышение эффективности остеоинтеграции.
Содержание
животных. В ходе исследования животные содержались в клетках по одному
животному с емкостями для корма и воды. Влажную уборку клеток проводили
ежедневно.
Корм раздавался животным один раз в день, чистая питьевая вода - без
ограничений. Перед поступлением в эксперимент животные проходили карантин в
течение 21 суток.
Наблюдение животных в ходе эксперимента осуществляли ежедневно,
оценивали общее состояние, дыхание, функцию оперированной конечности, а также
состояние послеоперационных ран. Длительность наблюдения всех животных
составила 26 недель после имплантации. Эвтаназию животных осуществляли путем
введения летальных доз барбитуратов.
Рентгенологические
исследования. Для рентгенографии использовался рентгеновский аппарат «Compact», (Милан,
Италия). Сила тока составляла 60 мА, напряжение 57-69 кУ, время
экспозиции - 0,4-0,6 сек. Конкретные параметры работы аппарата зависели от
конституции животного. Рентгенографию конечности кролика выполняли в прямой и
боковой проекции. Рентгенографию проводили до и после оперативного вмешательства,
на 21, 42, 84, 105 180 сутки после операции.
Морфологическое
исследование. Большеберцовую кость с интегрированным в нее имплантатом помещали
в 10-процентный раствор нейтрального формалина. Через 7 суток фиксации кость
распиливали в продольном направлении, оставляя имплантированную конструкцию в
одной из половин распила, обнажая лишь поверхность имплантата, а затем
продолжали фиксацию в формалине еще 3-5 суток. Далее половину культи
большеберцовой кости, где оставался имплантат, обезвоживали в этиловом спирте
(по 2 смены 70, 80, 96 и 100 градусной крепости), заливали в
2,2-диметил-3-метиленбицикло[2,2,1]гептан и сушили в открытой емкости до
полного его испарения.
Высушенные распилы напыляли токопроводным слоем Pt и
Pd и
исследовали методом сканирующей микроскопии при помощи электронного микроскопа
Zeiss EVO MA18 (Carl Zeiss Group, Германия).
Распределение Са и Р в тканях, адгезированных на поверхности интегрированных
имплантатов, выполняли с использованием энергодисперсионного спектрометра BRUKER OUANTAX 200 - XFlash 6/10
(Bruker Nano GmbH, Германия). Работа осуществлялась
в режиме построения элементных карт, спектров и получения цифровых данных о
содержании каждого остеотропного элемента.
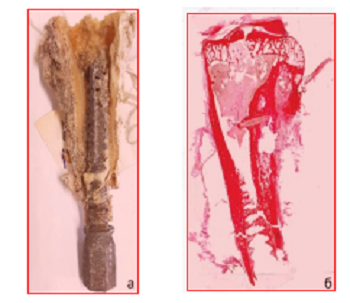
Рис. 3.
Фото микрошлифов резьбовой части имплантата (а); фазово-контрастный EBSD снимок
a-фазы поверхностного слоя резьбы
(б); гистограммы распределения размеров зерен материала имплантата после
токарной обработки (в)
Фрагменты
культи большеберцовой кости без имплантата декальцинировали в смеси соляной и
муравьиной кислот, дегидратировали и заливали в парафинсодержащие смеси,
способные к затвердеванию. На микротоме санного типа Reichard (Германия)
изготавливали парафиновые срезы толщиной 6 мкм, которые после депарафинирования
окрашивали гематоксилином и эозином. Далее их исследовали с помощью
стереомикроскопа AxioScope A1 (Carl Zeiss MicroImaging GmbH, Германия).
Лабораторные
исследования. В динамике эксперимента выполняли забор крови на сроках до операции,
через 3, 5, 12 и 26 недель после имплантации. Выполняли комплекс биохимических
и гематологических исследований, включавших определение концентрации общего
белка, С-реактивного белка (СРБ), креатинина, мочевины, общего кальция,
неорганического фосфата, оценку активности фосфатаз (щелочная фосфатаза - ЩФ;
костный изофермент кислой фосфатазы - ТрКФ) и трансаминаз (АЛТ, АСТ),
определение содержания лейкоцитов, эритроцитов и тромбоцитов.
Гематологические
исследования выполнены на автоматическом анализаторе ProCyte Dx (IDEXX Lab., Нидерланды), биохимические - на
автоматическом анализаторе Hitachi/BM 902 (F. Hoffmann-La Roche Ltd., Италия)
с использованием наборов реагентов Вектор-Бест (Россия).
Регулирующие
стандарты. Исследование выполнено в соответствии с ГОСТом ISO 10993-1-2021.
Изделия
медицинские. Оценка биологического действия медицинских изделий. Часть 1.
Оценка и исследования в процессе менеджмента риска; ГОСТом ISO 10993-6-2021.
Изделия медицинские. Оценка биологического действия медицинских изделий. Часть
6. Исследования местного действия после имплантации.
Этические
принципы. До начала исследования было получено одобрение локального этического
комитета, прокол № 1(71) от 28.04.2022. Исследование проведено при соблюдении
принципов гуманного обращения с лабораторными животными в соответствии с
требованиями Европейской конвенции по защите позвоночных животных,
используемых для экспериментов и других научных целей, и Директивой 2010/63/EU Европейского парламента и Совета
Европейского союза от 22 сентября 2010 года по охране животных, используемых в
научных целях.
Статистические
методы. Результаты в таблицах 2 и 3 представлены в виде медианы, 1-3 квартиля (Me; Q1-Q3). Нормальность
выборок определяли с помощью критерия Шапиро - Уилка. Процедуру статистической
оценки значимости отличий показателей на сроках эксперимента с дооперационными
значениями проводили с использованием W-критерия
Вилкоксона. Достоверность различий между группами оценивали с помощью T-критерия Манна-Уитни. Минимальный
уровень значимости (р) принимали равным 0,05.
РЕЗУЛЬТАТЫ
В
постимплантационном периоде отмечено, что общее состояние кроликов обеих групп
было удовлетворительным. Опорная функция конечности восстанавливалась на 4-5-е
сутки после операции и в дальнейшем присутствовала у животных опытной и
контрольной группы на всем протяжении наблюдения. Во всех экспериментах не
было выявлено воспаления и гнойных процессов кожи в месте выхода имплантата.
Выпадения имплантатов к моменту эвтаназии (26 недель) у экспериментальных
животных обеих групп не отмечено. Каких-либо серьезных нежелательных событий в
ходе наблюдения не обнаружено, нагноения в области культи и периимплантном
пространстве не выявлено. При патоморфологическом исследовании животных после
эвтаназии каких- либо патологических изменений внутренних органов не
обнаружено.
Во
всех случаях у животных опытной группы через 26 недель после имплантации
рентгенологически отмечалась полная органотипичежая перестройка кости (рис. 4,
а). У кроликов группы контроля также во всех случаях отмечалось отсутствие
нестабильности имплантата, однако в двух случаях определяли незначительную
резорбцию на интерфейсе «имплантат-кость» (рис. 4, б).
Гистологически
через 26 недель эксперимента у животных опытной группы на всем протяжении
культи большеберцовой кости в компактной пластинке не выявлено её порозных
изменений, расширения гаверсовых каналов, выраженной остеокластической
резорбции (рис. 5). В проксимальной части культи метафизарная кость была
практически не изменена и
представлена крупно- и среднеячеистой губчатой костью с жировым костным мозгом
в межтрабекулярных промежутках (рис. 5, б, д). Вокруг имплантата формировался
повторяющий его форму костный футляр, представленный пластинчатой костной
тканью (рис. 5, в). Костная ткань вплотную без зазоров и без
соединительнотканной прослойки прилегала к структурам имплантата (рис. 5, а).
В проксимальной части костно-имплантационного блока в новообразованной на
поверхности имплантата кости обнаруживались немногочисленные резорбционные
полости (рис. 5, г). Костная ткань, врастающая в межрезьбовые промежутки
имплантата, была высоко минерализована и ва- скуляризована (рис. 5, е).
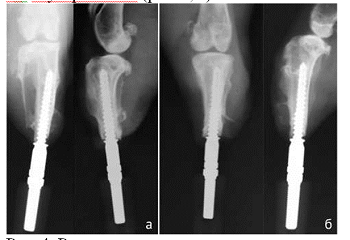
Рис. 4.
Рентгенограммы голени кроликов через 26 недель после имплантации: а - опытная
группа; б - группа контроля
Рис. 5.
Проксимальный участок культи большеберцовой кости животных опытной группы: а -
распил большеберцовой кости кролика с установленным имплантатом; б -
гистотопограмма распила большеберцовой кости кролика после извлечения
имплантата. Ув. 1,5
х; в - формирование костного футляра на
поверхности интегрированного имплантата. Ув. 50х; г - резорбционные полости на
поверхности костного футляра. Ув. 200х; д - метафизарная кость. Ув. 200х; е -
костная ткань в межрезьбовых пространствах. Ув. 200х. Окраска: б - по
Ван-Гизону; в-д - гематоксилином и эозином; е - по Массону
Гистологически
в группе контроля через 26 недель эксперимента между поверхностью
СЛС-имплантата и костной тканью наблюдался плотный контакт, что обеспечивало
прочное удержание имплантата в ложе кости. К данному периоду сформировался
единый костно-имплантационный блок. На всем протяжении культи кости сохранялась
непрерывная компактная пластинка. Выраженных периостальных напластований не
обнаруживалось. В дистальной и средней частях культи большеберцовой кости
отмечали врастание костной ткани в резьбовые межреберные углубления
имплантата (рис. 6, а, б).
Исследования,
выполненные методом сканирующей электронной микроскопии, показали полную интеграцию
костной ткани в структурные поверхности имплантата (межрезьбовые углубления,
отверстия структурах имплантата) на всем протяжении контакта кость-имплантат у
животных опытной группы (рис. 7).
В
контрольной группе плотный контакт костной ткани и ее интеграцию в
поверхностные структуры имплантата также подтверждают данные энергодисперсионного
анализа в виде электронных карт распределения остеотропных элементов в
структурах распила костно-имплантационного блока (рис. 8).
Методом
рентгеновского электронно-зондового микроанализа обнаружено, что в субстрате
формирующегося на поверхности имплантата у кроликов опытной группы кальция
было достоверно больше во всех областях имплантата относительно животных группы
контроля (табл. 2). Содержание фосфора на поверхности имплантата у животных
опытной группы также было статистически значимо выше относительно контроля в
проксимальной и срединной области имплантата.
В
динамике эксперимента отмечены различия в активности фосфатаз в сыворотке крови
экспериментальных животных (табл. 3). Так, у кроликов опытной группы
отмечалось повышение активности ЩФ через 12 недель после имплантации
относительно дооперационных значений. У животных группы контроля активность
ЩФ, наоборот, снижалась на 3 неделе, а на 3-й и 5-й повышалась активность
костного изофермента кислой фосфатазы. Также у животных группы контроля
относительно опытной группы дольше удерживался повышенный уровень СРБ
сыворотки крови.
Рис. 6.
Формирование блока «кость-имплантат» у животных группы контроля через 26 недель
эксперимента: а - распил большеберцовой кости кролика с установленным имплантатом;
б - гистотопограмма распила большеберцовой кости кролика после извлечения
имплантата. Окраска по Ван- Гизону Ув. 1,5х
Рис. 7.
Карты распределения остеотропных элементов в различных участках костно-имплантационного
блока через 26 недель эксперимента, опытная группа: а - проксимальная область,
б - срединная область, в - дистальная область. Рентгеновский электронно-
зондовый микроанализ. Ув. 68 х
Рис. 8.
Карты распределения остеотропных элементов в различных участках
костно-имплантаионного блока через 26 недель эксперимента, контрольная группа:
а - проксимальная область, б - срединная область, в - дистальная область.
Рентгеновский электронно- зондовый микроанализ. Ув. 68х
Таблица
2
Содержание
кальция и фосфора (вес %) на поверхности имплантата в различных участках культи
большеберцовой кости кролика через 26 недель эксперимента, Ме (Q1-Q3)
|
Область
исследования
|
Кальций,вес
%
|
Фосфор,
вес %
|
|
опыт
|
контроль
|
опыт
|
контроль
|
|
Проксимальная
|
13,6
(13,0-14,1)*
|
7,3
(6,9-7,6)
|
4,1
(3,9-4,3)*
|
3,6
(3,5-3,6)
|
|
Срединная
|
15,8
(15,2-16,3)*
|
9,1
(8,9-9,4)
|
5,5
(5,1-5,8)*
|
4,6
(4,4-4,7)
|
|
Дистальная
|
12,2 (11,7-12,6)*
|
10,3
(10,0-10,5)
|
3,9
(3,7-4,2)
|
4,5
(4,2-4,8)
|
Примечания:
* - достоверные отличия относительно группы контроля при р < 0,05.
Таблица
3
Изменения
некоторых биохимических показателей сыворотки крови кроликов экспериментальных
групп на
сроках наблюдения (недели), Ме (Q1-Q3)
|
Показатель
|
Группа
|
0
|
3
|
5
|
12
|
26
|
|
ЩФ,
Е/л
|
О
|
51(50-59)
|
45
(38-49)
|
59
(54-61)
|
67#(62-73)
|
60
(52-62)
|
|
К
|
53
(48-63)
|
42#(38-46)
|
51
(49-56)
|
58
(45-66)
|
61
(56-66)
|
|
ТрКФ,
Е/л
|
О
|
28
(24-30)
|
30
(28-36)
|
33
(28-40)
|
25
(21-29)
|
19 (18-29)
|
|
К
|
26
(22-26)
|
41#(35-42)
|
34#(29-38)
|
20
(16-28)
|
20
(16-29)
|
|
С-РБ,
мг/мл
|
О
|
0
(0-1)
|
14#(4-30)
|
12
(2-20)
|
5
(0-7)
|
2
(0-2)
|
|
К
|
0
(0-1)
|
13#(6-22)
|
10#(4-17)
|
2
(0-3)
|
4#(2-21)
|
Примечание:
# - достоверные отличия с дооперационными значениями при р < 0,05. О -
опытная группа; К - контрольная группа.
Другие
изученные лабораторные показатели (общий белок, креатинин, мочевина,
трансаминазы, общий кальций, неорганический фосфат, лейкоциты, эритроциты,
тромбоциты) статистически значимо относительно дооперационных значений в обеих группах в динамике наблюдения не изменялись (данные не представлены). Не отмечено и существенных отклонений лабораторных показателей при анализе индивидуальной динамики по каждому животному
ОБСУЖДЕНИЕ
Полученные
нами данные свидетельствуют в пользу того, что процесс остеоинтеграции чрескожного
имплантата со смешанной ультрамелкозернистой и нанокристаллической структурой
был лучше относительно изделия сравнения. На это указывают данные
количественных показателей рентгеновского электронно-зондового
микроанализа, которые показали более высокое содержание кальция в новообразованной
костной ткани на поверхности имплантата на всем протяжении
костно-имплантационного блока у животных основной группы. На активацию
остеогенеза в зоне имплантации указывает и динамика
активности щелочной фосфатазы у кроликов опытной группы.
Изменения лабораторных
показателей позволяют говорить также о том, что биосовместимость имплантата
из материала с ультрамелкозернистой и нанокристаллической структурой была выше
относительно СЛС-имплантата.
Во-первых, у животных группы контроля отмечалась
остеолитическая реакция, о чем свидетельствовал рост активности ТрКФ и
зафиксированные у двух животных рентгенологические признаки в обеих
группах в динамике наблюдения не изменялись (данные не представлены). Не
отмечено и существенных отклонений лабораторных показателей при анализе
индивидуальной динамики по каждому животному.
Во-вторых, острофазная
реакция на имплантацию у животных группы контроля, исходя из динамики СРБ, была
более длительной относительно животных опытной группы. Стоит отметить, что
отсутствие выраженных осложнений и значительных клинико-лабораторных отклонений
у животных обеих групп в ходе всего эксперимента также говорит и о приемлемой
безопасности тестированных изделий.
Полученные
нами данные согласуются с многочисленными результатами других экспериментальных
исследований, в которых однозначно отмечено, что титановые имплантаты со
структурированной поверхностью в сравнительных исследованиях показывают
повышенные характеристики остеоинтеграции относительно имплантатов без
модификации структуры материала резьбовой поверхности [18-24]. Однако
используемые экспериментальные модели в этих работах существенно отличаются от
нашей модели. Так, в ряде работ [18, 21, 22] устанавливали дентальный имплантат
в объем кости сегментов задних конечностей экспериментальных животных. В
других работах дентальные имплантаты со структурированной поверхностью
имплантировали по месту применения - в челюсть [19, 23, 24]. В статье Nan-Jue Cao и др. [19] с помощью SMAT-технологии титановому имплантату
смогли придать градиентно наноструктурированную поверхность (GNS Ti). Установлено, что по сравнению с
крупнозернистым титаном CG поверхность
GNS Ti стимулирует адгезию, пролиферацию
и дифференцирование клеток и улучшает остеогенез и остеоинтеграцию.
В
одной из работ [20] рассмотрены преимущества остеоинтеграции титанового
имплантата, поверхность которого модифицирована путем покрытия остеогенными
нановолокнами, в состав которых входит поли- капролактон, желатин,
гидроксиапатит, дексаметазон, бета-глицерофосфат и аскорбиновая кислота. В
эксперименте на кроликах титановые имплантаты с остеогенным нановолоконным
покрытием показали лучшие результаты, чем контрольные образцы без покрытия.
Кроме того, в регенерированной ткани вокруг имплантата отсутствовали
патологические изменения.
Отдельно
стоит выделить работу C.F. Jones с
соавт., в которой показана эффективность остеоинтеграции
Таким
образом, результаты исследований на кроликах показали, что применение
чрескожных имплантатов, изготовленных из сплава Ti Grade 4
со смешанной нанокристаллической и ультрамелкозернистой структурой имплантатов
с наноструктурированной поверхностью как в губчатую кость, так и в кортикальную
[27].
Нами
встречены единичные работы, в которых отмечаются преимущества в части
интеграции именно чрескожных имплантатов с модифицированной поверхностью,
причем авторы этих работ указывают на улучшение интеграции этих имплантатов с
мягкими тканями [25, 26].
В
целом, экспериментальные работы по исследованию остеоинтеграции
модифицированных имплантатов продолжаются. Показано, например, что в основе
эффективности биоинтеграции таких имплантатов могут быть задействованы
генетические механизмы [28]. Отмечается, что внедрение поверхностных модификаций
биосовместимых металлов является лучшим решением для повышения характеристик
коррозионной стойкости таких изделий [29]. Перспективное направление -
включение в модифицированную поверхность ионов отдельных металлов [30, 31].
Несмотря
на достаточно большой объем экспериментальных исследований, клинический опыт
применения титановых имплантатов с объемной или поверхностной
ультрамелкозернистой наноструктурой ограничен. Причиной этому может явиться то,
что некоторые аспекты применения данных изделий в экспериментальных
исследованиях до сих пор изучены мало. В этом плане стоит выделить работу [32],
в которой отмечается, что в исследованиях влияния модификации структуры
титановых имплантатов практически не изучаются топографические и химические
изменения поверхностей после остеоинтеграции, не описаны осложнения их
применения, не освещается выживаемость изделий в долгосрочном периоде,
особенно с учетом условий постоянной нагрузки на кость. А. Jayasree с
соавт. отдельно отмечают, что выявленные в большинстве экспериментальных работ
положительные эффекты остеоинтеграции могут быть связаны с тем, что имплантат у
животных, как правило, не несет механических нагрузок, поэтому для преодоления
такого разрыва в долгосрочной перспективе необходимы исследования in vivo на
крупных моделях животных с механической нагрузкой [33].
Оценивая
в целом текущее состояние тематики можно отметить, что преимущество
проведенного нами исследования заключается в том, что титановые имплантаты со
смешанной ультрамелкозернистой и нанокристаллической структурой были изучены
на модели, приближенной к модели клинического применения, с достаточно
длительным сроком наблюдения. Это делает перспективным применение таких
имплантатов для решения клинических задач протезирования. Очевидно, что
ограничения данного исследования касаются объемов выборок экспериментальных
животных.
Источники
финансирования. Исследование выполнено в рамках темы «Управляемая одноэтапная
остеоинтеграция чрескожных имплантатов с механобиологическим стимулированием
костеобразования в условиях системы внешней фиксации» государственного задания
на осуществление научных исследований и разработок ФГБУ «НМИЦ ТО им. акад. Г.А.
Илизарова» Минздрава России, а также при финансовой поддержке Министерства
науки и высшего образования Российской Федерации в рамках Программы развития
Уральского федерального университета имени первого Президента России Б.Н.
Ельцина в соответствии с программой стратегического академического лидерства «Приоритет-2030».
Этическая
экспертиза. До начала исследования было получено одобрение локального
этического комитета, протокол № 1(71) от 28.04.2022.
СПИСОК
ИСТОЧНИКОВ
1. Sanchez-Bodon J, Andrade Del Olmo J, Alonso JM, et al. Bioactive
Coatings on Titanium: A Review on Hydroxylation, Self-Assembled Monolayers
(SAMs) and Surface Modification Strategies. Polymers (Basel). 2021;14(1):165
2. Xu J, Zhang J, Shi Y, et al. Surface
Modification of Biomedical Ti and Ti Alloys: A Review on Current Advances.
Materials (Basel). 2022;15(5):1749. doi: 10.3390/mal505l749
3. Jain S, Parashar V. Analytical review on the
biocompatibility of surface-treated Ti-alloys for joint replacement
applications. Expert Rev Med Devices. 2022;19(9):699-719. doi: 10.1080/17434440.2022.2132146
4. Kaur M, Singh K. Review on titanium and
titanium based alloys as biomaterials for orthopaedic applications. Mater Sci
Eng C Mater Biol Appl. 2019;102:844-862. doi: 10.1016/j.msec.2019.04.064
5. Su EP, Justin DF, Pratt CR, et al. Effects of
titanium nanotubes on the osseointegration, cell differentiation,
mineralisation and antibacterial properties of orthopaedic implant surfaces.
Bone Joint J. 2018;100-B(1 Supple A):9-16.
6. Zhan X, Li S, Cui Y, et al. Comparison of the
osteoblastic activity of low elastic modulus Ti-24Nb-4Zr-8Sn alloy and pure
titanium modified by physical and chemical methods. Mater Sci Eng C Mater Biol
Appl. 2020;113:111018. doi: 10.1016/j.msec.2020.111018
7. Чекишева Т.Н. Наноматериалы и их
роль в регенерации костной ткани. Клиническая и экспериментальная морфология.
2019;8(4):19-24. doi: 10.31088/CEM2019.8.4.19-24
8. Souza JCM, Sordi MB, Kanazawa M, et al. Nano-scale
modification of titanium implant surfaces to enhance osseointegration. Acta
Biomater. 2019;94:112-131. doi: 10.1016/j.actbio.2019.05.045
9. Шулятникова О.А., Рогожников Г.И., Порозова С.Е. и др. Функциональные
наноструктурированные материалы на основе диоксида титана для использования в
ортопедической стоматологии. Проблемы стоматологии. 2020;16(1):171-177. doi: 10.18481/2077-7566-20-16-1-171-177
10. Wang C, Gao S, Lu R, et al. In Vitro and In Vivo
Studies of Hydrogenated Titanium Dioxide Nanotubes with Superhydrophilic
Surfaces during Early Osseointegration. Cells. 2022;11(21):3417. doi:
10.3390/cells11213417
11. Zhang Y, Gulati K, Li Z, et al. Dental Implant
Nano-Engineering: Advances, Limitations and Future Directions. Nanomaterials
(Basel). 2021;11(10):2489. doi: 10.3390/nano11102489
12. Darter BJ, Syrett ED, Foreman KB, et al.
Changes in frontal plane kinematics over 12-months in individuals with the
Percutaneous Osseointegrated Prosthesis (POP). PLoS One. 2023;18(2):e0281339.
doi: 10.1371/journal.pone.0281339
13. Hagberg K, Ghasemi Jahani SA, Omar O, Thomsen
P. Osseointegrated prostheses for the rehabilitation of patients with
transfemoral amputations: A prospective ten-year cohort study of
patient-reported outcomes and complications. J Orthop Translat. 2022;38:56-64.
doi:
10.1016/j.jot.2022.09.004
14. Sinclair S, Beck JP, Webster J, et al. The
First FDA Approved Early Feasibility Study of a Novel Percutaneous Bone
Anchored Prosthesis for Transfemoral Amputees: A Prospective 1-year Follow-up Cohort
Study. Arch Phys Med Rehabil. 2022;103(11):2092-2104. doi: 10.1016/j.
apmr.2022.06.008
15. Еманов А.А., Горбач Е.Н., Стогов М.В. и др. Выживаемость чрескожных
имплантатов в условиях различной механической нагрузки на кость. Гений
ортопедии. 2018;24(4):500-506. doi: 10.3390/10.18019/1028-4427-2018-24-4-500-506
16. Кузнецов В.П., Горгоц В.Г., Аникеев А.В.,
Еманов А.А. Производство новых внутрикостных остеоинтегрируемых имплантатов
методом аддитивных технологий. Вестник Курганского государственного университета.
Серия «Технические науки». 2017;(2):120-125.
17. Каплан М.А., Смирнов М.А., Кирсанкин А.А.,
Севостьянов М.А. Свойства изделий из титанового сплава Ti6-Al4-V, полученных
методом селективного лазерного плавления. Физика и химия обработки материалов.
2019;(3):46-57.
18. Almeida D, Sartoretto SC, Calasans-Maia JA, et al. In
vivo osseointegration evaluation of implants coated with nanostructured
hydroxyapatite in low density bone. PLoS One. 2023;18(2):e0282067. doi:
10.1371/journal.pone.0282067
19. Cao NJ, Zhu YH, Gao F, et al. Gradient
nanostructured titanium stimulates cell responses in vitro and enhances
osseointegration in vivo. Ann Transl Med. 2021;9(7):531. doi:
10.21037/atm-20-7588
20. Das S, Dholam K, Gurav S, et al. Accentuated
osseointegration in osteogenic nanofibrous coated titanium implants. Sci Rep.
2019;9(1):17638. doi: 10.1038/s41598-019-53884-x
21. Hasegawa M, Saruta J, Hirota M, et al. A Newly
Created Meso-, Micro-, and Nano-Scale Rough Titanium Surface Promotes
Bone-Implant Integration. Int J Mol Sci. 2020;21(3):783. doi:
10.3390/ijms21030783
22. He W, Yin X, Xie L, et al. Enhancing
osseointegration of titanium implants through large-grit sandblasting combined
with micro-arc oxidation surface modification. J Mater Sci Mater Med.
2019;30(6):73. doi: 10.1007/s10856-019-6276-0
23. Hoornaert A, Vidal L, Besnier R, et al.
Biocompatibility and osseointegration of nanostructured titanium dental
implants in minipigs. Clin Oral Implants Res. 2020;31(6):526-535. doi:
10.1111/clr.13589
24. Salou L, Hoornaert A, Stanovici J, et al.
Comparative bone tissue integration of nanostructured and microroughened dental
implants. Nanomedicine (Lond). 2015;10(5):741-51. doi: 10.2217/nnm.14.223
25. Farrell BJ, Prilutsky BI, Ritter JM, et al.
Effects of pore size, implantation time, and nano-surface properties on rat
skin ingrowth into percutaneous porous titanium implants. J Biomed Mater Res A.
2014;102(5):1305-15.
26. Van den Borre CE, Zigterman BGR, Mommaerts MY,
Braem A. How surface coatings on titanium implants affect keratinized tissue: A
systematic review. J Biomed Mater Res B Appl Biomater. 2022;110(7):1713-1723.
doi: 10.1002/jbm.b.35025
27. Jones CF, Quarrington RD, Tsangari H, et al. A
Novel Nanostructured Surface on Titanium Implants Increases Osseointegration in
a Sheep Model. Clin Orthop Relat Res. 2022;480(11):2232-2250. doi:
10.1097/CORR.0000000000002327
28. Morandini Rodrigues L, Lima Zutin EA, Sartori
EM, et al. Nanoscale hybrid implant surfaces and Osterix-mediated
osseointegration. J Biomed Mater Res A. 2022;110(3):696-707. doi:
10.1002/jbm.a.37323
29. Asri RIM, Harun WSW, Samykano M, et al.
Corrosion and surface modification on biocompatible metals: A review. Mater Sci
Eng CMater Biol Appl. 2017;77:1261-1274. doi: 10.1016/j.msec.2017.04.102
30. Ding M, Shi J, Wang W, et al. Early
osseointegration of micro-arc oxidation coated titanium alloy implants
containing Ag: a histomorphometric study. BMC Oral Health. 2022;22(1):628. doi: 10.1186/s12903-022-02673-6
31. Li X, Wang M, Zhang W, et al. A
Magnesium-Incorporated Nanoporous Titanium Coating for Rapid Osseointegration.
Int J Nanomedicine. 2020;15:6593-6603. doi: 10.2147/IJN.S255486
32. Gulati K, Scimeca JC, Ivanovski S, Verron E.
Double-edged sword: Therapeutic efficacy versus toxicity evaluations of doped
titanium implants. DrugDiscov Today. 2021;26(11):2734-2742. doi:
10.1016/j.drudis.2021.07.004
33. Jayasree A, Ivanovski S, Gulati K. ON or OFF:
Triggered therapies from anodized nano-engineered titanium implants. J Control Release. 2021;333:521-535. doi: 10.1016/j.jconrel.2021.03.020
Информация
об авторах:
1. Максим Валерьевич Стогов - доктор биологических
наук, доцент, руководитель отдела
2. Андрей Александрович Еманов - кандидат
ветеринарных наук, ведущий научный сотрудник
3. Виктор Павлович Кузнецов - доктор технических
наук, профессор, заведующий лабораторией, профессор кафедры
4. Елена Николаевна Горбач - кандидат
биологических наук, ведущий научный сотрудник
5. Елена Анатольевна Киреева - кандидат
биологических наук, старший научный сотрудник
6. Андрей Викторович Корелин - кандидат
технических наук, доцент, начальник управления, УрФУ,
Вклад
авторов:
Стогов
М.В. - разработка методологии, создание мета-данных, написание первоначального
проекта работы.
Еманов
А.А. - проведение экспериментов, подготовка работы к публикации, визуализация
данных.
Кузнецов
В.П. - идея, создание моделей, подготовка работы к публикации.
Горбач
Е.Н. - сбор данных, подготовка работы к публикации, визуализация данных.
Киреева
Е.А. - сбор данных, статистическая оценка.
Корелин
А.В. - создание моделей, подготовка работы к публикации.
Теги: протезирование
234567
Начало активности (дата): 14.11.2023 20:07:00
234567
Кем создан (ID): 989
234567
Ключевые слова:
протезирование, остеоинтеграция, титановый имплантат, нанокристаллическая структура, селективное лазерное сплавле¬ние, эксперимент, кролики, безопасность изделия
12354567899
 14.11.2023
14.11.2023