 18.09.2023
18.09.2023
Хирургические методы стабилизации грудной клетки при множественных переломах ребер
Закрытая травма груди занимает одно из лидирующих мест среди всех повреждений
актуальность
Большинство пациентов с переломами ребер получают консервативную терапию с хорошими результатами. В случае множественных переломов ребер и (или) флотирующей грудной клетки смертность может достигать 22% и с каждым дополнительным сломанным ребром этот показатель растет [7]. В этом случае пациенты нуждаются в стабилизации реберного каркаса для осуществления адекватного дыхания. Начиная с 50-х годов широкое применение приобрел способ пневматической стабилизации — искусственная вентиляция легких (ИВЛ) с использованием положительного давления в конце выдоха (ПДКВ) [3]. Параллельно с начала ХХ века развивались стабилизации грудной клетки [8], которые в последние десятилетия стали более популярными.
В этой статье представлен литературный обзор различных методик фиксации ребер у пациентов с множественными переломами.
ПАТОФИЗИОЛОГИЧЕСКИЕ АСПЕКТЫ ПЕРЕЛОМОВ РЕБЕР И НЕСТАБИЛЬНОЙ ГРУДНОЙ КЛЕТКИ
При закрытой травме кинетическая энергия воздействует преимущественно на костный каркас груди, одной из главных ролей которого является защита внутренних органов. С количеством сломанных ребер растет вероятность неблагоприятного исхода. Так, при наличии переломов от 1 до 5 ребер смертность достигает 5,8-10%, а при 6 и более — до 15% [9]. Причина такого прогноза многофакторная. Развитие дыхательной дисфункции возникает вследствие болевого синдрома, парадоксального дыхания, вторичного повреждения внутренних органов отломками ребер, ушиба легких. Первым фактором, провоцирующим развитие патофизиологического каскада дыхательной дисфункции у пациентов с переломами ребер, является болевой синдром, генез развития которого связан с активацией ноцицептивной системы. При воздействии травмирующего фактора на периферические окончания ноцицепторов, расположенных в зоне удара и местах переломов ребер, формируется болевой импульс, который передается по миелинези- рованным А-дельта волокнам и немиелинизирован- ным С-афферентам в дорзальные рога спинного мозга. Ноцицептивные нейроны дорзальных рогов спинного мозга формируют восходящие тракты, осуществляющие проведение ноцицептивных сигналов к различным подкорковым отделам головного мозга и к ядрам таламуса. Возникает ощущение боли [10].
В ответ на боль организм «изолирует» область повреждения путем сокращения мышц грудной стенки и ограничения движения в зоне переломов, что приводит к нарушению экскурсии грудной клетки и, как следствие, к нарушению вентиляции в прилегающей легочной паренхиме [11]. При отсутствии адекватного кашля и нарушении мукоцилиарного транспорта возможно формирование слизистых пробок, ателектаза и развитие пневмонии при бактериальной колонизации [12].
Помимо болевого синдрома переломы ребер могут приводить к формированию флотирующих фрагментов грудной стенки — «реберному клапану». При изолированной травме подобное осложнение может развиваться до 20% случаев, при сочетанной — до 70% [13]. При этом создаются условия, при которых свободный участок грудной стенки движется в противоположном направлении движению грудной стенки, что снижает эффективность дыхания и может приводить к газообменным нарушениям [14]. Нестабильность грудной клетки практически в 50% приводит к дыхательной недостаточности и необходимости пневматической стабилизации — проведению искусственной вентиляции с положительным давлением в дыхательных путях на выдохе [15]. При патологоанатомическом исследовании умерших от ЗТГ в более чем 50% случаев выявлялась флотирующая грудная клетка с гемо- и пневмотораксом [16], при этом у подавляющего большинства погибших выявлялись пластинчатые ателектазы, про- екционно совпадающие с зонами флотации [17].
Нестабильность грудной стенки неразрывно связана с ушибом легкого, как одним из факторов развития дыхательной недостаточности. Механизм возникновения ушиба легкого до конца не ясен. Основываясь на физических законах, предполагается, что ускорение и замедление тела человека может вызвать повреждение легочной ткани даже без существенного столкновения, наподобие сильного сжатия [18]. Весь процесс можно разделить на три составные части. Иннерционный эффект — альвеолярная ткань повреждается в результате сдвигающей силы структур корня легкого, так как ткани разной плотности по-разному ускоряются и замедляются [19]. Эффект расслоения — мелкие разрывы в местах, где ударная волна встречается с различными граничащими поверхностями [20]. Эффект имплозии — ударная волна сжимает газ в тканях легкого. Вслед за этим газ расширяется и приводит к возникновению микровзрывов воздушной части легкого [21]. При таких смещениях легких возникает деформация и повреждение альвеол с отрывом их от бронхиол, тем самым уменьшается дыхательная поверхность [22].
В зоне удара в альвеолах накапливается кровь и интерстициальная жидкость [23]. Практически незамедлительно в ответ на повреждение в области ушиба концентрируются воспалительные белки, что дополнительно ухудшает вентиляцию [24]. Происходит уменьшение количества сурфактанта, и альвеолы в конечном итоге разрушаются, а легочная ткань теряет свою эластичность за счет скопления патологической жидкости в ней [25]. Ушибы легких при закрытой травме встречаются в диапазоне 17-75%. Учитывая вышеописанные механизмы, может присоединиться бактериальная пневмония, частота которой при ушибах легких достигает 20% [18]. Острый респираторный дистресс-синдром также может быть осложнением ушиба легкого в 17% случаев, а при повреждении более чем 20% легочной ткани достигает 82% [26].
Отломки ребер могут повреждать различные структуры груди с формированием гемо- или пневмоторакса. Пневмоторакс наблюдается практически в половине случаев травмы груди [27], а гемоторакс — в 1/3 [28]. При множественных и флотирующих переломах такие интраплевральные осложнения определяются в 80-90% случаев [14].
Пневмоторакс возникает вследствие повреждения легочной ткани или воздухоносных путей. Наличие воздуха в плевральной полости приводит к компрессии легкого как на стороне повреждения, так и контрлатерального легкого в связи со смещением средостения в здоровую сторону, что нарушает адекватный газообмен.
Попадание крови в плевральную полость может быть связано как с повреждением легкого, так и с повреждением сосудов грудной стенки (наиболее часто межреберных) и сосудов средостения. Функциональные нарушения дыхания при гемотораксе практически не отличаются от таковых при пневмотораксе, за исключением геморрагической анемии [29]. Кроме этого, гемоторакс может развиваться при повреждении диафрагмы, которое встречается в 3% наблюдений ЗТГ [30]. Помимо гемоторакса, разрыв диафрагмы может привести к развитию диафрагмальной грыжи [31] с ущемлением и некрозом различных органов живота [32].
Таким образом, важным направлением лечения пациента с тяжелой травмой груди является восстановление адекватной экскурсии грудной клетки, предотвращение повреждения легкого отломками ребер и купирование последствия контузии легких.
ОСНОВНЫЕ МЕТОДЫ ЛЕЧЕНИЯ
В лечении переломов ребер, осложненных флотирующей грудной клеткой, выделяют два принципиально разных подхода: консервативный и хирургический [33].
Консервативный метод заключается в стабилизации отломков ребер путем создания повышенного внутригрудного давления за счет ПДКВ. Респираторная поддержка в данном случае может осуществляться с помощью инвазивной искусственной вентиляции или неинвазивной с постоянным позитивным давлением в дыхательных путях (СРАР) [34]. По результатам исследований СРАР позволяет сократить время пребывания пациентов в отделении реанимации и интенсивной терапии (ОРИТ), общую длительность госпитализации, а также способствует уменьшению вероятности развития нозокомиальной инфекции и снижает необходимость интубации пациента [35]. Также в 70-е годы в исследовании продемонстрированы методика ИВЛ с перемежающейся вентиляцией и ПДКВ, которая позволила сократить длительность ИВЛ и пребывания в отделении реанимации [36].
Несмотря на положительные результаты консервативного лечения с использованием «положительной пнематизации», пациентам приходилось длительное время находиться на ИВЛ. Это приводило к развитию ряда ИВЛ-ассоциированных осложнений. Стремление минимизировать вероятность развития осложнений, снизить длительность госпитализации привело к поиску более совершенных и эффективных методов лечения. В том числе хирургических.
При сравнении с хирургическими методиками, консервативное лечение связано с длительной ИВЛ, риском развития пневмонии, продолжительным пребыванием в отделении интенсивной терапии [37]. Хирургическое же лечение позволяет значительно уменьшить болевой синдром, ускорить восстановление респираторной функции. Что в свою очередь уменьшает частоту развития пневмонии, снижает потребность в ИВЛ и трахеостомии, сокращает период нахождения в ОРИТ и в стационаре в целом [38].
Решение о выборе того или иного способа лечения основывается на двух показателях: эффективности и безопасности метода. Эффективность метода лечения можно оценить по уменьшению или увеличению длительности госпитализации, длительности ИВЛ. Безопасность оценивается количеством осложнений и летальных исходов.
Различают четыре основные хирургические методики лечения: 1) использование методов тракции грудной клетки; 2) использование аппаратов внешней фиксации; 3) использование способов постоянной внутренней фиксации; 4) использование накостного остеосинтеза пластинами [39]. Также отдельно выделена группа методики, осуществляемой через торакоскопический доступ и группа методики с использованием биоразлагаемых материалов.
СТАБИЛИЗАЦИЯ С ИСПОЛЬЗОВАНИЕМ МЕТОДОВ ТРАКЦИИ ГРУДНОЙ КЛЕТКИ
История метода берет свое начало с 1928 года, когда Jones T. впервые опубликовал методику лечения множественных переломов ребер у ребенка. Метод заключался в тракции реберного клапана при помощи пулевых щипцов, что позволяло уменьшить компрессию легочной ткани и риск развития ателектазов и воспалительных изменений [40]. Надо отметить, что эта методика появилась ранее, чем методика стабилизации грудной клетки посредствам ИВЛ. В 1946 г. Jaslow I. описал методику вытяжения грудины при формировании переднего грудино-реберного клапана. Он использовал крючок от обычной вешалки, который через небольшой доступ под местной анестезией вкручивал в грудину не более чем на 5 оборотов, что позволяло не пройти за задний кортикальный слой грудины. Затем подвешивал груз к крючку через блок. Пациент должен был находиться в таком положении в течение 8 суток [41]. Вешалка стала прототипом винтов Шанца. В начале 50-х годов XX столетия американский хирург Heroy W. при рулевых переломах ребер вкручивал 2 металлических винта в грудину, за которые выполнял вытяжение в положении Фавлера. Обычно в течение 24 часов винты выламывались из грудины и тракция продолжалась посредством редукционных щипцов через отверстия, оставшиеся от винтов (рис. 1) [42].
Методика тракции грудной клетки приобретала различные модификации; так, венгерский хирург Constantinescu О. смоделировал крючок, который при разворачивании в тканях превращался в Г-образный и фиксировался к металлической пластине над кожей, за счет чего и осуществлялось вытяжение (рис. 2) [43]. Существовали работы хирургов по использованию бельевых цапок, штопоров, но суть их заключалась в создании условий, при которых уменьшалась компрессия легочной ткани, увеличивалась жизненная емкость легких, уменьшался риск развития ателектазов [39].
Грязнухин Э.Г. в 2004 г. предложил
вводить 4 спицы под местной анестезией при помощи дрели в тело и рукоятку
грудины через межреберья с разных сторон (в плоскости грудины). Выстоящие
хвостовые концы спиц изгибали у выхода из кости к центру грудины и фиксировали
к одной пластинке, за которую осуществляли тракцию [44]. В 2004 г. BalciA. et al. продемонстрировал
и сравнительные результаты лечения пациентов, которым проводилось скелетное
вытяжение и лечение посредством создания ПДКВ. Было отмечено уменьшение
длительности потребности в ИВЛ в 2 раза и снижение летальности в группе
хирургического лечения более чем на 10% [45]. Н.Г. Ушаков (2010) также добился положительных результатов, используя данный метод.
Отметил уменьшение длительности вентиляции на 9 суток и снижение летальности на
14,7% [46].
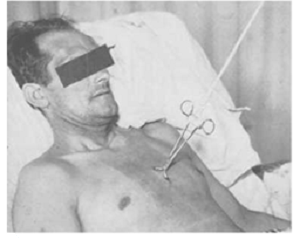
Рис. 1. Тракция за грудину после
наложения редукционных щипцов. (Фотография заимствована из статьи Heroy W.W.)
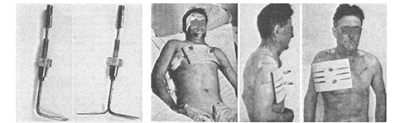
Рис. 2. Оригинальная методика фиксации ребер Константинеску. (Фотографии зимствована из статьи Constantinescu O.)
СТАБИЛИЗАЦИЯ С ИСПОЛЬЗОВАНИЕМ АППАРАТОВ ВНЕШНЕЙ ФИКСАЦИИ
Методика использования аппаратов внешней фиксации развивалась одновременно с методами тракции грудной клетки. В 1967 г. Н.К. Голобородько предложил методику подшивания отломков ребер к фиксирующей шине, расположенной на коже пациента и выступающей за линию переломов более чем на 5 см. Но этот способ не представлялось возможным применить у пациентов с двусторонними переломами ребер и переломом грудины [47].
В 1977 г. А.П. Паниотов предложил методику остеосинтеза при помощи введения в плевральную полость через центр флотирующего участка грудной клетки специального троакара, имеющего на конце складывающийся шарнирный четырехзвенник. После заведения троакара в плевральную полость плечики раскрывались, упираясь во внутреннюю поверхность пораженных ребер. Снаружи троакар фиксировался к пластмассовой панели дугообразной формы гайками, а концы панели должны были выступать за пределы флотирующего участка [48].
В 2001 г. хорватский хирург М. Glavas предложил фиксировать флотирующий фрагмент с помощью протеза из костного цемента Pallacos. Протез располагался над флотирующим сегментом грудной стенки по касательной с уровня от верхнего до неповрежденных ребер. Ребра крепились к протезу посредством швов или проволоки [49]. По эффективности хорошо зарекомендовал себя внеочаговый экстраплевральный остеосинтез. Аппарат наружной фиксации включает в себя заклепочные элементы или реберные крючки, несущую штангу, кронштейны и стабилизирующую штангу. Стабилизирующая штанга прикрепляется к грудине, а флотирующий фрагмент к несущей штанге. Система скрепляется при помощи кранштейнов и гаек [50].
В НИИ СП им. Н.В. Склифосовского в 2016 г. был запатентован аппарат для наружной фиксации множественных и флотирующих переломов ребер, ключицы и грудины.
Конструкция представляла собой стержни, которые на внутреннем конце имели резьбу, посредством которой ввинчивались в наружный кортикальный слой кости ребра, а наружные концы прикреплялись к пластинчатой штанге гайками (патент № RU 02637834 C2 20171207, автор Шарипов И.А., Хубутия М.Ш., Тарабрин Е.А., Шахшаев М.К.).
В 2018 г. В.Д. Шатохин и соавт. опубликовали статью, в которой также представлены результаты использования аппарата наружной фиксации, который фиксировали при помощи анкеров к стабильным участкам ребер, ключиц, таза [51]. Таким образом, имеющиеся способы внешней фиксации при множественных и флотирующих переломах ребер доказали свою эффективность и могут рассматриваться в качестве методов временной или окончательной стабилизации.
стабилизация с использованием способов постоянной внутренней фиксации
Эта методика подразумевает расположение стабилизирующих устройств внутри организма без наружных фиксирующих основ. Одной из первых публикаций, посвященных этому виду стабилизации грудной клетки, принадлежит французскому хирургу V. Dor (1967). Стабилизация производилась через торако- томный доступ при помощи спиц Киршнера [52]. Guemelli N. et al. (1979) описали подобный метод, при котором стабилизация флотирующих переломов достигалась путем введения двух длинных спиц Киршнера под зоны реберного клапана по завершению торакотомии. Спицы удалялись через 30 дней. Авторы отметили хорошие результаты [53].
В 1991 г. Landreneau R. et al. описали методику с использованием металлических стержней для внешней фиксации системой Lunque. Стержни вводили в ребра через торакотомический доступ в область флотирующего участка и фиксировали с помощью наружного механизма, располагающегося в мягких тканях грудной стенки [54] (рис. 3).
Отечественный хирург Ю.Б. Шапот с коллегами (1985) предложили свою модификацию фиксаци имножественных переломов ребер, используя спицы Киршнера. Спицы изгибались по форме ребра и устанавливались над ним и фиксировались с помощью танталовых скобок, удаление производилось через 10 месяцев [55].
Рис. 3. Удаленный из организма фиксатор Lunque. (Фотография заимствована из статьи Landreneau R.S.)
Спицы Киршнера также легли в основу интрамедуллярного остеосинтеза ребер. Металлическая спица вводилась через кортикальный слой отломка ребра в мозговой канал и проводилась через зону перелома во второй отломок. Спицы Киршнера используются для интрамедуллярного остеосинтеза более 50 лет, однако с их использованием связаны такие осложнения, как прорезывание имплантата через костную ткань, его миграция, ротационная нестабильность [8, 55].
По результатам одного из биомеханических исследований было показано, что при нагрузке спица может дислоцироваться из ткани ребра ввиду своей прочности и сниженной эластичности, что ведет к возможному повреждению мягких тканей и потере каркасной прочности [56]. С целью уменьшения описанных осложнений были разработаны интрамедуллярные фиксаторы (ribs splints). Согласно биомеханическим исследованиям Bottlang M. et al. (2010) данные фиксаторы стабилизируют место перелома в 2 раза лучше, чем спицы [57]. Кроме того, очень редко наблюдается дислокация импланта при данном методе фиксации. Описаны единичные случаи миграции имплантов, которые могут вызвать болезненные ощущения [58]. Основным преимуществом интрамедуллярного остеосинтеза перед другими методиками является простота постановки устройства и минимальная инвазивность, которая обеспечивается небольшими кожными доступами, что снижает вероятность послеоперационных осложнений [59].
Также немаловажным является значительное уменьшение болевого синдрома, что продемонстрировал Ali Akil (2019), выполняя интрамедулярный остеосинтез под видеоторакоскопической ассистенцией (2,6±0,3 после операции против 8±1,15 до операции, p<0,0001 по визуальной аналоговой шкале — VAS) [60]. Аналогичные результаты получил Redwan B. (2015) [61]. Другим преимуществом интрамедуллярного фиксатора является возможность стабилизации переломов в труднодоступных участках грудной клетки, например, под лопаткой [62], на заднем отрезке ребер или при переломах первых ребер [56]. Однако, согласно наблюдениям Marasco S. et al., несмотря на вышеуказанные преимущества, лишь у 9% пациентов наблюдалась полная консолидация костных структур спустя 3 месяца после операции [63].
СТАБИЛИЗАЦИЯ С ИСПОЛЬЗОВАНИЕМ НАКОСТНОГО ОСТЕОСИНТЕЗА ПЛАСТИНАМИ
Наиболее популярной системой для накостного остеосинтеза является MatrixRIB. Она представляет собой титановые пластины, механически устойчивые на сгиб, четко повторяющие реберную анатомию. Толщина пластин составляет 1,5 мм, длина вариабельна и зависит от количества отверстий фиксации (от 15 до 18), предназначенных для крепления пластин к ребру с помощью 2,9 мм фиксирующих винтов [64].
При сравнении спиц Киршнера с системой накостной фиксации в биомеханическом эксперименте было установлено, что динамическая нагрузка вызвала в среднем в 3 раза больше деформации спиц (1,2±1,4 мм, р=0,09), чем накостных конструкций (0,4±0,2 мм,
Рис. 4. Остеосинтез ребер пластиной MatrixRIB. (Фотография заимствована из статьи Беняна А.С.)
Винтовой накостный остеосинтез широко применяется и в зарубежной, и в российской практике у пациентов с множественными переломами ребер и нестабильной грудной клеткой [65] (рис. 4).
Основными показателями эффективности проведения накостного остеосинтеза является восстановление удовлетворительных значений функции внешнего дыхания. Так, Пушкин С.Ю. и соавт. (2014) показали, что нарастание объема форсированного выдоха за 1 секунду (ОФВ1) к моменту выписки пациента составляет более 25% [66]. Данные результаты были сделаны на основании наблюдения за 5 пациентами с ЗТГ. Согласно Bottlang M. et al. (2013), спустя 3 месяца после оперативного вмешательства у 84% пациентов отмечалось восстановление должных значений ОФВ1 [67].
Немаловажным аспектом использования остеосинтеза ребер является уменьшение болевого синдрома, что подтвердило исследование Wu W.-M. (2015), где балльная оценка боли уменьшилась с 5,8 до 3,3 (p<0,05) по VAS [68]. Этот анальгетический эффект подтвержден в ситематическом обзоре de Jong M.B. (2014) [62]. Улучшение показателей внешнего дыхания и адекватная анальгезия способствуют снижению потребности в ИВЛ [69]. Так, в статье Pieracci F.M. (2016) продемонстрировал статистически значимое уменьшение продолжительности ИВЛ с 5 (0-18) до 0 (0-8) дней (p<0,01), более того, — это привело к снижению количества трахеостомий с 45,7% до 14,3 % (p=0,01) [70]. Jing-Oing Xu (2015) отметил, что использование хирургической стабилизации ребер посредством накостного остеосинтеза не только уменьшает потребность в ИВЛ, но и снижает частоту развития пневмонии на 20-45% (p<0,05) [71].
В совокупности: лучшая анальгетическая способность, отсутствие потребности в длительной ИВЛ, снижение частоты инфекционных легочных осложнений приводит к сокращению койко-дня в отделении реанимации в среднем на 3-4 сут (p<0,016) и общей длительности госпитализации на 8-9 сут [72]. Однако стоит отметить, что есть литературные источники, демонстрирующие отсутствие положительного эффекта от применения хирургической стабилизации ребер [73]. Возникновение осложнений в раннем послеоперационном периоде описано у 8,9 пациентов (11,8%) [74], по некоторым результатам — у 7,4 (37%) [75]. Среди возможных осложнений различные авторы описывают развитие сепсиса, эмпиемы плевры, нагноение послеоперационной раны [74]. Кроме этого, возможны осложнения, связанные с техническими неисправностями имплантата — перелом пластины фиксатора, его смещение, в связи с чем возникает необходимость повторной операции [75]. Несмотря на это, есть публикации, в которых авторы описывают неосложненное течение раннего послеоперационного периода, а также оптимальное купирование болевого синдрома [67, 69].
Еще одна винтовая система, завоевавшая свое место в клинической практике, носит название RibLoc и представляет собой [/-образный фиксатор, меньшей длины по сравнению с другими имплантатами, скрепляющий ребро по верхнему краю посредством винтов, прикрепляемых к поверхности ребра в переднезаднем направлении.
Система RibLoc позволяет уменьшить размеры операционного доступа за счет своих малых размеров по сравнению с другими имплантами [76] (рис. 5). В одном из биомеханических исследований при сравнении данных фиксаторов с накостным остеосинтезом пластинами было показано, что при симулировании нагрузки, возникающей при дыхательных движениях, [/-образный фиксатор потерял 0,12±0,03 Н/мм (1,9%) своей жесткости, тогда как пластинчатый — 0,72±0,13 Н/мм (9,9%) (р=0,001), что позволяет делать вывод о большей износоустойчивости системы RibLoc, по сравнению с накостными пластинами [77]. При применении у пациентов с переломами ребер данная система показала удовлетворительные результаты фиксации, купирования болевого синдрома, а также неосложненное течение послеоперационного периода [78]. Также, согласно SaidS., после применения описанной фиксационной методики отмечаются положительные изменения ОФВ1 по сравнению с предоперационным значением и дальнейшим улучшением в течение последующих 3 месяцев [79].
Среди возможных осложнений описаны: образование гематомы, поломка фиксатора, выраженный болевой синдром, которые могут являться показанием к удалению фиксатора [80].
Таким образом, основным преимуществом системы [/-образного фиксатора является возможность его установления из мини-инвазивного доступа. При этом данный фиксатор не уступает по своим биомеханическим характеристикам пластинам накостной системе и может эффективно использоваться у пациентов с переломами ребер.
Помимо винтовых накостных конструкций существуют и безвинтовые. Одной из первых таких систем стала пластина Judet, которая представляет собой накостный фиксатор из крепежных клипс, соединенный планкой между ними. Клипсы загибаются и таким образом обжимают ребро по обе стороны от перелома, фиксируя отломки друг к другу [81]. Способ стал прародителем системы реберной фиксации Stracos, которая успешно используется для фиксации ребер в настоящее время [82] (рис. 6).
Безвинтовые накостные фиксаторы также демонстрируют эффективные показатели. Так, в исследовании, проведенном французскими специалистами, отмечается простота выполнения хирургического вмешательства, гибкость конструкции, что позволяет предотвратить излом пластины. Также отмечается значительное уменьшение времени ИВЛ в сравнении с контрольной группой, которую лечили консервативно (142±224 против 74±125 часов, p=0,026). Аналогичный положительный результат достигнут и в отношении длительности госпитализации (32,3±19,3 против 21,7±7,8 сут, р=0,024) [82]. Сопоставимые результаты получил японский хирург Tanaka, использовавший пластины Judet для фиксации переломов ребер. Он отметил уменьшение длительности ИВЛ (10,8±3,4 сут против 18,3±7,4 сут, р<0,05), уменьшения частоты развития пневмонии (24% против 77%; р<0,05) [83]. Поломка аппарата фиксации наблюдалась в 20% наблюдений [84].
Рис. 5. Система RibLoc. (Фотография заимствована из статьи De Palma 4.)
Рис. 6. Остеосинтез с использованием пластин Stracos Fig. 6. Osteosynthesis with Stracos plates
РОЛЬ ВИДЕОТОРАКОСКОПИИ В СТАБИЛИЗАЦИИ РЕБЕРНОГО КАРКАСА
С начала 2000 гг. для снижения травматичности остеосинтеза ребер разрабатываются методики с использованием видеоторакоскопии. Жестков К.Г. (2006) предложил методику фиксации ребер при помощи спиц под видеоторакоскопическим контролем. Для фиксации перелома им накладывались перикос- тальные швы на стабильные и флотирующий участки ребер. После репозиции субфасциально проводились спицы. Затягивание перикостальных швов приводило к фиксации отломков ребер к спице и предотвращало флотацию [85].
Sunkui K. (2013) выполнил 3 торакоскопические операции пациентам с флотирующей грудной клеткой. Он использовал пластину Насса, которую располагал так, что концы ее выходили за пределы флотирующего участка и фиксировались к стабильной части грудной клетки, таким образом не возникало парадоксального движения грудной клетки. Была отмечена безопасность и эффективность этой методики [86].
Накостный остеосинтез, также выполненный под контролем видеоторакоскопа, позволяет более четко локализовать переломы ребер, при репозиции и фиксации избежать повреждения межреберных сосудов и внутренних органов [87]. Кроме того, видеоторакоскопическая поддержка остеосинтеза позволила ускорить реабилитацию и улучшить показатели функции внешнего дыхания, уменьшить частоту раневой инфекции с 18 до 2,9 % (p=0,044) и ускорить выписку из стационара (5,64±1,11 против 7,58±1,15 сут, p<0,001) [88]. Pieracci F. (2019) выполнил несколько операций, в которых использовалась полностью торакоскопическая фиксация ребер пластинами MatrixRIB. Пластины фиксировались с внутренней стороны ребер при помощи винтов, вкручиваемых специально разработанными эндоскопическими шуруповертами (рис. 7). Автор сообщает о хороших результатах и отсутствии инфекционных осложнений, однако сравнительного анализа в настоящий момент не проводилось [89]. В 2021 г. Zachary M. Bauman et al. продемонстрировали результаты лечения пациента с множественными переломами ребер. Отломки ребер были фиксированы специально разработанной металлоконструкцией для интраплевральной фиксации под видеоторакоскопическим контролем [90].
ФИКСАЦИЯ РЕБЕР ПОСРЕДСТВОМ БИОРАЗЛАГАЕМЫХ СИСТЕМ
Особенностью описанных систем остеосинтеза является их изготовление из нерезорбируемых материалов. Пациент пожизненно носит конструкцию в своем организме, либо требуется повторная операция по ее удалению. Однако существуют конструкции, разработанные из материалов, подвергающихся резорбции. Так, Mayberry J.C. (2003) использовал пластины и винты из биоразлагаемого материала — poly (L-lactide- co-D, L-lactide). Было отмечено минимальное количество хирургических осложнений (в одном случае из десяти отмечено нагноение операционной раны, потребовавшее дренирования) и удовлетворительная консолидация переломов [91].
Эти импланты могут фиксироваться как к наружной, так и к внутренней поверхности ребер при помощи рассасывающихся нитей (рис. 8). Они сохраняют достаточную жесткость в течение времени, необходимого для консолидации переломов. Кроме того, медленное рассасывание конструкции приводит к постепенному повышению механической нагрузки на кость, что предотвращает “stress-shielding” (локальный остеопороз) — снижение плотности кости и повышение ломкости в связи с отсутствием нагрузки [92]. Подобные осложнения могут возникать после удаления металлоконструкций [93].
ВЫВОД
Представленный обзор демонстрирует разнообразность хирургических методов стабилизации грудной клетки. Универсального способа, который можно было бы использовать при всех видах переломов и осложнений, в настоящий момент не разработано. Таким образом, хирургические возможности в лечении пациентов с множественными переломами ребер не исчерпаны и, вероятно, будут совершенствоваться по мере достижений в технологической сфере.
СПИСОК ИСТОЧНИКОВ
1. LoCicero J, Mattox KL. Epidemiology of chest
trauma. Surg Clin. 1989;69:15-19. PMID: 2911786
2. Harrison M.
Traumatic pneumothorax: a review of current practices. BrJ HospMed.
2014;75:132-135. PMID: 24621627
3. Vana PG,
Neubauer DC, Luchette FA. Contemporary management of flail chest. Am Surg.
2014;80:527-535. PMID: 24887787
4. Martin TJ,
Eltorai AS, Dunn R, Varone А, Joyce MF, Kheirbeket T, al.
Clinical management of rib fractures and methods for prevention of pulmonary
complications: a review. Injury. 2019;50:1159-1165.
5. He WW, Yang
Y, Wu WM, Zhao T, Guo X, Li Y, et al. Chest wall stabilization (CWS) in China:
current situation and prospect. J Thorac Dis. 2019;11(Suppl 8):S1104-S1148.
6. Познанский С.В. Евтихов Р.М., Кутырев Е.А., Колбашова Ю.Н., Кукушкин А.В. Видеоторакоскопическая стабилизация каркаса грудной клетки. Современные технологии в медицине. 2010;(1- 2):72-73.
7. Bulger EM, Arneson MA, Mock CN, Jurkovich GJ. Rib fractures in the
elderly. J Trauma. 2000;48:1040-1047.
8. Bemelman M, Poeze M, Blokhuis TJ, Leenen LPH. Historic overview of treatment techniques for rib fractures and flail chest. Eur J Trauma Emerg Surg. 2010;36:407-415.
9. Flagel BT, Luchette FA, Reed RL, Esposito TJ, Davis KA, Santaniello JM, et al. Half-a-dozen ribs: the breakpoint for mortality. Surgery. 2005;138:717-725.
10. Кукушкин М.Л., Табеева Г.Р., Подчуфарова Е.В. Болевой синдром: патофизиология, клиника, лечение. Москва: ИМАпресс; 2011.
11. May L, Hillermann C, Patil S. Rib fracture management. BJA Educ. 2016;16:26-32
12. Van Lieshout EMM, Verhofstad MHJ, Van Silfhout DJT, Dubois EA. Diagnostic approach for myocardial contusion: a retrospective evaluation of patient data and review of the literature. Eur J Trauma Emerg Surg. 2021;47(4):1259-1272. PMID: 31982920
13. Багненко С.Ф., Тулупов А.Н. Актуальные проблемы диагностики и лечения тяжелой закрытой травмы груди. Скорая медицинская помощь. 2009;10(2):4-10.
14. Вагнер Е.А., Рогацкий В.А., Черешнев В.А. Патологическая физиология травмы груди. Пермь; 1990.
15. Velmahos GC, Vassiliu P, Chan LS, Murray JA, Berne TV, Demetriades D. Influence of flail chest on outcome among patients with severe thoracic cage trauma. IntSurg. 2002;87(4):240-244. PMID: 12575808
16. Dehghan N, De Mestral C, McKee MD, Schemitsch EH, Nathens A. Flail chest injuries: a review of outcomes and treatment practices from the National Trauma Data Bank. J Trauma Acute Care Surg. 2014;76(2):462- 468. PMID: 24458051
17. Moreno De La Santa, Magdalena P, Polo Otero MD, Delgado C, Leal S, Trinidad C, et al. Rib fractures: mortality risk factors. Interact Cardiovasc Thorac Surg. 2013;17(Is suppl 1):19-20, abs 0-074. https:// doi.org/10.1093/icvts/ivt288.74
18. Rendeki
S, Molnar TF. Pulmonary contusion. J Thorac Dis.
19. Boyd AD. Lung injuries. In: Hood RM, Boyd AD, Culliford AT. (ed.) Thoracic Trauma. Philadelphia: Saunders; 1989. p. 153-155.
20. Allen GS, Coates NE. Pulmonary contusion: A collective review. Am Surg. 1996;62:895-900. PMID: 8895709
21. Allen GS, Cox CS. Pulmonary contusion in children: Diagnosis and management. South Med J. 1998;91:1099-1106. PMID: 9853720
22. Ganie FA, Lone H, Lone GN, Wani ML, Singh S, Dar AM, et al. Lung Contusion: A Clinico-Pathological Entity with Unpredictable Clinical Course. Bull Emerg Trauma. 2013;1:7-16. PMID: 27162815
23. Cohn SM. Pulmonary contusion: Review of the clinical entity. J Trauma. 1997;42:973-979. PMID: 9191684
24. Livingston DH, Hauser CJ. Trauma to the chest wall and lung. McGraw- Hill Professional, 2003. In: Moore EE, Feliciano DV, Mattox KL. (eds.) Trauma. 5th ed. New York, McGraw-Hill Professional; 2004. p. 507538.
25. Bader A, Rahman U, Morris M, McCormack JE, Huang EC, Zawin M, et al. Pulmonary contusions in the elderly after blunt trauma: incidence and outcomes. J Surg Res. 2018;230:110-116. PMID: 30100025
26. Haynes D, Baumann M. Management of pneumothorax. Semin Respir Crit Care Med. 2010;31:769-780. PMID: 21213209
27. Ramanathan R, Wolfe LG, Duane TM. Initial suction evacuation of traumatic hemothoraces: a novel approach to decreasing chest tube duration and complications. Am Surg. 2012;78:883-887. PMID: 22856496
28. Athanassiadi K, Gerazounis M, Theakos N. Management of 150 flail chest injuries: analysis of risk factors affecting outcome. Eur J Cardiothorac Surg. 2004;26:373-376. PMID: 15296899
29. Karmy-Jones
R, Jurkovich G. Management of Blunt Chest and Diaphragm Injuries. In: Patterson
GA, Pearson FG, Cooper JD, Deslauriers J, Luketich JD, Lerut AEMR. (eds.)
Pearson’s Thoracic and Esophageal
30. Liu O, Luan L, Zhang G, Li B. Treatment of Chronic Traumatic Diaphragmatic Hernia Based on Laparoscopic Repair: Experiences From 23 Cases. Front Surg. 2021;8:706824. PMID: 34336921
31. Tessely H, Journe S, Therasse A, Hossey D., Lemaitre J. A case of colon necrosis resulting from a delayed traumatic diaphragmatic hernia. J Surg Case Rep. 2020;2020:rjaa101. PMID: 32582428
32. Granetzny A, Abd El-Aal M, Emam E, Shalaby A, Boseila A. Surgical versus conservative treatment of flail chest. Evaluation of the pulmonary status. Interact Cardiovasc Thorac Surg. 2005;4(6):583-587. PMID: 17670487
33. Richter T, Ragaller M. Ventilation in chest trauma. J Emerg Trauma. Shock. 2011;4(2):251-259. PMID: 21769213
34. Duggal A, Perez P, Golan E, Tremblay L, Sinuff T. Safety and efficacy of noninvasive ventilation in patients with blunt chest trauma: a systematic review. Crit Care. 2013;17(4):R142. PMID: 23876230 https:// doi.org/10.1186/cc12821
35. Бенян А.С. Внутренняя пневматическая стабилизация в лечении переднего реберного клапана. Вестник анестезиологии и реаниматологии. 2014;(6):66-68.
36. Cullen P, Modell JH, Kirby RR, Klein Jr EF, Long W. Treatment of flail chest. Arch Surg. 1975;110:1099-1103. PMID: 1098616
37. Fowler TT, Taylor BC, Bellino MJ, Althausen PL. Surgical Treatment of Flail Chest and Rib Fractures. J Am Acad Orthop Surg. 2014;22(12):751- 760. PMID: 25425610
38. Leinicke
JA, Elmore L, Freeman BD, Colditz GA. Operative Management of Rib Fractures in
the Setting of Flail Chest: A Systematic Review and Meta-Analysis. Ann Surg. 2013; 258(6):914-921. PMID: 23511840
39. Бенян А.С. Хирургическая стабилизация грудной клетки при множественных и флотирующих переломах ребер. Вестник травматологии и ортопедии им.Н.Н. Приорова. 2015;(3):86-92.
40. Jones T, Richardson E. Traction on the sternum in the treatment of multiple fractured ribs. Surg Gynec Obstet. 1926;42:283.
41. Jasloiv I. Skeletal traction in the treatment of multiple fractures of the thoracic cage. Am J Surg. 1946;72(5):753-755. PMID: 21003141 https:// doi.org/10.1016/0002-9610(46)90358-3
42. Heroy WW, Eggleston FC. A method of skeletal traction applied through the sternum in «steering wheel» injury of the chest. Ann Surg. 1951;133(1): 135-138. PMID: 14800268
43. Constantinescu O. A new method of treating the flaii chest wall. Am J Surg. 1965;109:604-610. PMID: 14281884
44. Корнилов Н.В., Грязнухин Э.Г. Травматология и ортопедия. Санкт- Петербург; 2004.
45. Balci AE, Eren S, Cakir О, Eren MN. Open fixation in flail chest: review of 64 patients. Asian Cardiovasc Thorac Ann. 2004;12(1):11-15. PMID: 14977734
46. Ушаков Н.Г. Алгоритм диагностики и тактики лечения пострадавших с множественными клапанными переломами ребер при закрытой травме груди. Аспирантский вестник Поволжья. 2010;(3- 4):116-119.
47. Голобородько H.K., Булага В.В. Общие принципы работы специализированного центра политравмы и шока. Вестник хирургии им. И.И. Грекова. 1989;(6):139-141.
48. Греджев А.Ф., Паниотов А.П. Панельная фиксация при множественных переломах ребер. Клиническая хирургия. 1977;(8):69-78.
49. Glavas M, Altarac S, Vukas D, Ivancic A, Drazinic I, Gusic N, et al. Flail chest stabilization with palacos prosthesis. Acta Med Croatica. 2001;55(2):91-95. PMID: 11505635
50. Вишневский Д.А., Рудаков C.C., Миланов H.O. Хирургия грудной стенки. Москва: Видар-М; 2005.
51. Шатохин В.Д., Пушкин С.Ю., Дьячкова Г.В., Губа А.Д., Шатохин Д.В., Камеев И.Р. Результаты оперативного лечения флотирующих переломов грудинно-реберного комплекса. Гений ортопедии. 2018;24(3):290-295.
52. Dor V, Paoli J, Noirclerc M, Malmejac C, Chauvin G, Pons R. Lysteosynthese des volets thoraciques technique, resultants et indications apropos de 19 observations. Ann Chir. 1967;2(15):983-996. PMID: 5619289
53. Guernelli N, Bragaglia RB, Briccoli A, Mastrorilli M, Vecchi R. Technique for the management of anterior flail chest. Thorax. 1979;34(2):247-248. PMID: 483193
54. Landreneau RS, Hinson JM, Hazerlrigg SR, Johnson JA, Boley TB, Curtis JJ. Strut fixation of an extensive flail chest. Ann Thorac Surg. 1991;51(3):473-475. PMID: 1998429
55. Шaпoт Ю.Б., Бесаев Г.М., Кашанский Ю.Б., Зайцев E.H. Техника остеосинтеза при переломах ребер, грудины и ключицы. Вестник хирургии им. И.И. Грекова. 1985;(11):83-87.
56. Forward DP, Ollivere BJ, Ng JWG, Coughlin TA, Rollins KE. Current concepts in rib fracture fixation. Bone Jt. 360. 2016;5(5):2-7
57. Bottlang M, Helzel I, Long W, Fitzpatrick D, Madey S. Less-Invasive Stabilization of Rib Fractures by Intramedullary Fixation: A Biomechanical Evaluation. J Trauma. 2010;68(5):1218-1224. PMID: 20068479
58. Bottlang M, Walleser S, Noll M, Honold S, Madey SM, Fitzpatrick D, et al. Biomechanical rationale and evaluation of an implant system for rib fracture fixation. Eur J Trauma Emerg Surg. 2010;36(5):417-426. PMID: 21841953
59. Zaidenberg EE, Rossi LA, Bongiovanni SL, Tanoira I, Maignon G, Ranalletta M. Snapping scapular syndrome secondary to rib intramedullary fixation device. Int J Surg Case Rep. 2015;17:158-160. PMID: 26629853
60. Akil A, Ziegeler S, Reichelt J, Semik M, Muller MC, Fischer S. Rib osteosynthesis is a safe and effective treatment and leads to a significant reduction of trauma associated pain. Eur J Trauma Emerg Surg. PMID: 30989244
61. Redwan B,
Reichelt J, Freermann S, Semik M, Fischer S. Video-assisted minimally invasive
rib osteosynthesis using intramedullary titanium splints in patients with
unstable rib fractures: treatment algorithm and first clinical results.
Interact Cardiovasc Thorac Surg. 2015;21(Suppl 1): S60.
ИНФОРМАЦИЯ ОБ АВТОРАХ
Тарабрин Евгений Александрович - доктор медицинских наук, заведующий кафедрой госпитальной хирургии № 2, ФГАОУ ВО «Первый Московский государственный медицинский университет им. И.М. Сеченова» М3 РФ; главный научный сотрудник отделения неотложной хирургии, эндоскопии и интенсивной терапии, ГБУ3 «НИИ СП им. Н.В. Склифосовского Д3М»;
Котанджян Вазген Гагикович - заведующий хирургическим торакальным отделением, ГБУ3 «НИИ СП им. Н.В. Склифосовского Д3М»;
Офицеров Андрей Аркадьевич- научный сотрудник отделения биотехнологий и трансфузиологии, ГБУ3 «НИИ СП им. Н.В. СклиФосовского Д3М»;
Теги: переломы ребер
234567 Начало активности (дата): 18.09.2023 16:30:00
234567 Кем создан (ID): 989
234567 Ключевые слова: остеосинтез ребер, закрытая травма груди, переломы ребер
12354567899
Похожие статьи
Рентгеноанатомические основы исследования легких. Глава 5Паравертебральная блокада при лечении пациентов с закрытой травмой груди
Рентген на дому 8 495 22 555 6 8
Рентгеноанатомические основы исследования легких. Глава 2
Рентгеноанатомические основы исследования легких. Глава 1
Хронический лимфоцитарный лейкоз / лимфома из малых лимфоцитов



