 07.06.2023
07.06.2023
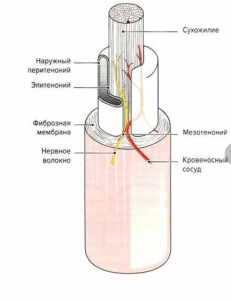
Моделирование шва сухожилия с его изоляцией для демонстрации первичной регенерации
Регенерация зоны шва при субтотальной изоляции замедляется и происходит за счет клеток самого сухожилия
Введение.
Восстановление функции сухожилий сгибателей пальцев кисти после оперативного лечения представляет проблему из-за неизбежного образования блокирующих спаек. Для профилактики адгезий предложено механическое разобщение скользящих поверхностей сухожилия и стенки костно-фиброзного канала рассеченной полимерной трубкой. При этом, несмотря на хорошие клинические результаты, морфологически подтвердить срастание зоны шва после такого вмешательства у пациентов не представляется возможным.
Цель. Представить экспериментальную модель и технику хирургического вмешательства с изоляцией и блокированием продольно рассеченной полимерной трубкой на пяточном сухожилии лабораторных животных для получения и исследования регенерата в зоне шва.
Материалы и методы. В эксперименте под ингаляционной анестезией Изофлураном на задних лапах у 10 лабораторных крыс линии Wistar выполнено моделирование шва сухожилия с блокированием и изоляцией (n = 14) и контрольная операция шва сухожилия без изоляции (n = 6). Прооперированные сухожилия иссекали через 3 недели, изучали внешний вид и гистологическую картину регенератов в зоне шва.
Результаты. Модель операции с изоляцией зоны шва на пяточных сухожилиях крыс хорошо воспроизводится и адекватно имитирует операцию на сухожилиях кисти пациентов.
Морфология полученных регенератов демонстрирует восстановление непрерывности с формированием сухожилиеподобной ткани в месте соединения. В эксперименте субтотальная изоляция не привела к некрозу сухожилия, но замедлила срастание зоны шва. Трубка препятствовала образованию адгезий и сохраняла питание сухожилия через рассеченное щелевидное пространство. Выводы.
Моделирование операции шва сухожилия с изоляцией на пяточном сухожилии крысы позволяет получить материал для демонстрации первичной регенерации сухожилия in vivo. Регенерация зоны шва при субтотальной изоляции замедляется и происходит за счет клеток самого сухожилия.
Наибольшую сложность представляет реконструкция сгибательного аппарата в зоне костно-фиброзных каналов. При этом неудовлетворительные исходы операций в виде теногенных контрактур главным образом обусловлены невозможностью идеального восстановления скользящих структур и образованием блокирующих спаек между сухожилием и стенкой канала. Единственным положительным следствием формирования спаек вокруг сухожилия можно считать врастание сосудов и неоваскуляризацию зоны шва [2].
Для профилактики рубцовых и теногенных контрактур хирурги соблюдают требования, предъявляемые к «идеальному шву» [3]. С той же целью после операции проводят мобилизацию сухожилий - их ежедневное перемещение в канале [1,4]. При этом механически непрочный шов или неконтролируемая реабилитация могут привести к разрыву зоны шва и повторной более травматичной операции.
Поскольку предложенные многочисленные способы профилактики спаек противовоспалительными лекарственными средствами [5-7], ирригацией в полость каналов цитостатических лекарственных средств [8] и препаратов гиалуроновой кислоты [9, 10], разобщением барьерами биологического происхождения [11-14] и мембранами из биодеградируемых синтетических полимеров [15] не получили широкого распространения, главным средством профилактики спаек после операции остается мобилизация сухожилий с первых дней после операции [1, 16].
В одной из работ [17] для защиты зоны шва от врастания рубцов и формирования стенки канала применяют продольно рассеченную полимерную трубку, временно фиксированную к сухожилию. Новая технология представляет альтернативу двухэтапной тендопластике в тех случаях, когда костно-фиброзный канал рубцово изменен, а концы сухожилия глубокого сгибателя могут быть сближены и сшиты с незначительным натяжением.
Однако, несмотря на хорошие клинико-функциональные результаты применения новой технологии, исследовать процесс срастания сухожилий у прооперированных пациентов не представляется возможным. Ранее выполненный эксперимент по тенотомии и шву на пяточных сухожилиях мелких лабораторных животных [18] продемонстрировал возможность создания относительно простой экспериментальной модели для воспроизведения операций, проводимых на сухожилиях кисти пациентов, и получения ткани восстановленного сухожилия для морфологических исследований.
.
МАТЕРИАЛЫ И МЕТОДЫ
Экспериментальные животные, их сухожилия и этика эксперимента. Для отработки техники вмешательства были взяты 10 крыс линии Wistar обоего пола весом 250-300 граммов. У данных животных при пассивном тыльном сгибании стопы хорошо кон-турировалось и пальпировалось пяточное (ахиллово) сухожилие.
Моделирование шва сухожилия с его изоляцией выполнено у 4-х животных на обеих задних лапах и у 6 - на правой задней лапе (n = 14, опыт). Последним животным на левой задней лапе была сделана теното-мия и шов сухожилия без изоляции (n = 6, контроль).
Методика эксперимента и работа с лабораторными животными были одобрены локальным комитетом по биомедицинской этике учреждения образования «Гомельский государственный медицинский университет».
Представленная в статье экспериментальная модель разработана и апробирована в соответствии с современными этическими и регламентирующими документами [19-21]. Все операции животным проводили стерильными инструментами в асептических условиях операционной научно-исследовательской лаборатории медицинского университета.
Способ обезболивания. Для обезболивания животных применяли ингаляционную анестезию Изофлураном. После извлечения из клетки животное помещали в эксикатор, на дно которого предварительно клали ткань, пропитанную анестетиком. В отсутствии дозатора релаксирующую концентрацию Изофлурана в эксикаторе объемом 1 л создавали испарением нанесенного на ткань препарата, не превышая дозу 2 мл. После снижения двигательной активности животного его извлекали, укладывали и фиксировали на операционном столе спиной вверх. Для поддержания анестезии у носа и рта животного размещали пластиковую тубу, заполненную смоченной анестетиком ватой. О достаточном и безопасном уровне наркоза на протяжении операции судили по спонтанному регулярному дыханию животного и отсутствию реакций на болевое раздражение.
Гистологическое исследование регенерата. Сразу по окончании операции блокирующие швы с трубки снимали и из просвета трубки извлекали мягкотканный тяж. Нити из зоны шва всех сухожилий аккуратно удаляли. Сухожилия помещали в раствор нейтрального формалина. Гистологическую проводку тканей выполняли на автоматическом аппарате с принадлежностями STP 120 «Thermo Scientific» (компания Thermo Fisher Scientific Inc., США).
Продольные срезы толщиной 5 мкм получали на санном микротоме HM 450 «Thermo Scientific». Препараты окрашивали гематоксилином и эозином и по Ван Гизону. Изучение морфологии сухожилий и фотодокументирование проводили с использованием оптического микроскопа «Levenhuk MED 10T» (компания Levenhuk LLC, США) с цифровым видеоокуляром ToupCam 10.0 MP.
РЕЗУЛЬТАТЫ
Проведение эксперимента требовало предварительной подготовки: 1) комплектования набора хирургических инструментов для операций на мелких структурах; 2) подготовки условий, средств и оборудования для анестезии; 3) планирования способа шва сухожилия, техники тенотомии и определения их последовательности; 4) подбора атравматичного шовного материала и трубки, подходящей для изоляции пяточного сухожилия крысы.
Наиболее подходящими для экспериментальных вмешательств оказались инструменты из набора для операций на кисти - пинцеты, иглодержатель, зажим «москит», ножницы, пиковидный скальпель № 11.
Ингаляционная анестезия предпринята как наиболее эффективная и безопасная для проведения оперативных вмешательств у грызунов [22]. При этом анестетиком выбора стал Изофлуран, поскольку он имеет самый низкий коэффициент растворения в крови и, следовательно, минимальную токсичность. Препарат обеспечивал максимально быстрое вхождение животного в наркоз, а также достаточно быструю реверсию. Наркоз и мониторинг двигательных реакций во время операции осуществлял подготовленный помощник. Вхождение крыс в наркоз сопровождалось последовательным исчезновением рефлексов. Первым пропадал рефлекс переворачивания.
Выпадение педального рефлекса свидетельствовало о достаточном уровне седации и моменте, когда животное можно фиксировать на операционном столе. Наступление хирургической стадии наркоза отмечали по отсутствию пальпебрального и лингвального рефлексов. При отрицательном рефлексе «сдавливания запястий» отмечали исчезновение болевой чувствительности и приступали к операции. В случае нарушения ритма дыхания или появления мышечного тонуса во время наркоза эксперимент ограничивался изоляцией сшитого сухожилия только на правой задней лапе. Таким образом, шов с изоляцией выполнен на 14 пяточных сухожилиях (у 6 крыс на правой задней лапе, у 4 - на обеих лапах). Шесть сшитых неизолированных сухожилий на левых лапах послужили материалом для контроля.
Находившимся под наркозом животным сбривали шерсть по периметру голеней обеих задних лап, после чего голени и стопы обрабатывали раствором «Септо-цид Синерджи» (производитель ЗАО «БелАсептика», Беларусь).
Техника операции с изоляцией сухожилия. Разрез кожи длиной 1,5-2 см выполняли в проекции сухожилия по задней поверхности голени. Рассекая брыжейку, мобилизовали ахиллово сухожилие от пяточного бугра до сухожильно-мышечного перехода. Для удобства последующего соединения концов до тенотомии ствол сухожилия прошивали двумя нитями (рис. 1). В качестве шовного материала использовали длительно рассасывающиеся нити из полигликолида калибра 3/0 на атравматичной колющей игле. Отводя нити и натягивая сухожилие визуализировали уровень тенотомии. Последнюю выполняли острым скальпелем перпендикулярно ходу волокон так, чтобы не пересечь нити. Затем концы сухожилия адаптировали конец-в-конец и связывали нити.
Для изоляции сухожилий брали фрагменты эластичных прозрачных инфузионных проводников из нетоксичного поливинилхлорида (производитель УП «Фре-Бор», Беларусь) длиной 1 см с внутренним диаметром 1.5 мм и толщиной стенки 0,3 мм. Трубку рассекали вдоль, накладывали на сшитое сухожилие и подшивали к нему П-образными швами выше и ниже зоны соединения. Для удержания от смещения во время прошивания трубку временно фиксировали к сухожилию тонкими инъекционными иглами. После наложения трубки в зоне ее рассечения оставался щелевидный зазор 0,3 мм для врастания брыжейки и питания зоны шва. Кожу лап животных ушивали непрерывным обвивным швом и обрабатывали бриллиантовым зеленым.
Длина пяточного сухожилия крыс составляла 1.5 см, толщина достигала 1,8-2 мм, что было достаточно для выполнения экспериментальной операции без использования микроскопа.
На рисунке 1 видно, что пяточное сухожилие крысы сначала прошито двумя нитями (а), а затем выполнена поперечная тенотомия (б). Такая последовательность технически упростила и ускорила оперативное вмешательство. В случае традиционной последовательности - тенотомии и последующего шва сухожилия - возникают сложности с одинаково точным прошиванием ствола и сопоставлением подвижных концов тонкого сухожилия. Подобные манипуляции существенно удлиняют операцию и приводят к деформации зоны шва.
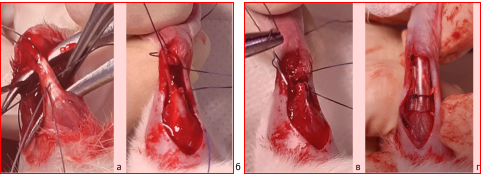
Рис. 1. Этапы операции на пяточном сухожилии крысы: прошивание (а), тенотомия (б), соединение концов сухожилия (в) и укрытие сухожилия рассеченной трубкой (г)
При подборе трубки для изоляции достаточно тонкого сухожилия крысы учитывались следующие требования: трубка должна была быть эластичной, апиро-генной, стерильной и прозрачной. Внутренний диаметр импланта должен был быть таким, чтобы продольно рассеченная и уложенная на сухожилие трубка укрывала не менее 2/3 его диаметра и образовывала щелевидный зазор для врастания соединительной ткани и сосудов. Стенка трубки также должна была быть достаточно тонкой, чтобы она могла обратимо деформироваться при движениях животного и не создавала натяжения окружающих мягких тканей. Выбранная нами трубка оптимально отвечала заданным требованиям за исключением эластичности. Тогда как целый инфузионный проводник был мягким и легко деформировался при сжатии пальцами, его фрагменты длиной 1 см оказались недостаточно эластичными, что затрудняло удержание рассеченной трубки на сухожилии крысы во время наложения блокирующих швов. Для фиксации трубки во время прошивания ее прикалывали к сухожилию тонкой инъекционной иглой. Внешний вид сухожилия, блокированного в трубке, представлен на рисунке 1 (г).
Техника операции на контрольных сухожилиях была аналогичной вышеописанной, но исключала изоляцию сухожилия полимерной трубкой.
Послеоперационный период. После операции животных помещали в клетку, где через 1-3 минуты они становились активными. Далее животных содержали и наблюдали в привычных условиях вивария. С учетом сложности создания внешней иммобилизации миниатюрных лап крыс, а также наличия внутренней фиксации сухожилий полимерными трубками, животных вели в режиме ранней мобилизации.
Иссечение сухожилий. Второе вмешательство у крыс выполняли через 3 недели после первой операции также под ингаляционной анестезией. Доступ осуществляли по послеоперационному рубцу.
После рассечения кожи трубки с заключенными в них сухожилиями легко обнаруживались и выделялись из окружающих тканей, шов сухожилий выглядел состоятельным (рис. 2).
Трубки были окружены бледнорозовой тканью с гладкой скользящей поверхностью, через щелевидное пространство в сухожилие врастала рыхлая кровоточащая соединительная ткань. Иммобилизированное в трубке пяточное сухожилие пересекали вровень с краями трубки и единым блоком удаляли из раны. Кожу лапы животного ушивали непрерывным обвивным швом и обрабатывали раствором антисептика. Крысу возвращали в клетку.
Извлеченные из трубок сухожилия имели вид соединительнотканных тяжей с гладкой поверхностью. Их диаметр на всем протяжении составлял 1,3-1,5 мм, что меньше, чем поперечный размер самой узкой части здорового пяточного сухожилия крысы (1,8-2 мм). Таким образом, лежащая на сухожилии полимерная трубка придавала форму и формировала скользящую поверхность сухожилия и его оболочку. Очевидно, что использование более эластичной трубки сохранило бы естественную анатомическую конфигурацию сухожильно-мышечного перехода. Целостность зоны шва при легком растяжении образцов после удаления шовного материала свидетельствовала о срастании всех сухожилий.
Забор сшитых без изоляции сухожилий на левых лапах животных вызывал трудности из-за изменения тканей в виде утраты скользящей оболочки сухожилия, срастания его с окружающими тканями и деформации. Для получения материала выполняли выделение сухожилия из рубцов с его иссечением. В средней части сухожилия определялось веретенообразное утолщение диаметром 2,5-3 мм с заключенным в него шовным материалом.
Наблюдение животных. После завершения эксперимента животных наблюдали в течение 5-7 дней до нормализации состояния, о чем свидетельствовало их активное перемещение в клетке и появление отталкивания задними лапами от жесткой поверхности.
Рис. 2. Внешний вид трубки и окружающих тканей через
3 недели после тенотомии и шва с изоляцией сухожилия
Морфология регенерата при изоляции сухожилия рассеченной полимерной трубкой. На микрофотоснимках продольных срезов опытных сухожилий сшитые концы по всей зоне контакта соединяет рыхлый незрелый регенерат (рис. 3, а). Его структура представлена богато васкуляризованной тканью (рис. 3, б), характерной для пика фазы репарации. О метаболической активности формирующегося регенерата свидетельствует пролиферация фибробластов, наличие их молодых и более зрелых форм, присутствие гистиоцитов, макрофагов, плазматических и лимфоидных клеток (рис. 3, в), а также новообразование молодых незрелых капилляров вблизи контактирующих в плоскости соединения сухожильных волокон и сухожильных пучков (рис. 3, г). Эти клетки и микрососуды образуют незрелую грануляционную ткань, которая заполняет травматический микродефект и в последствии перестраивается в сухожилиеподобную ткань. Прилежавшая к трубке поверхность сухожилия представлена гладким слоем нежной мягковолокнистой соединительной ткани, нарастающей на регенерат (рис. 3, д). В срезах, окрашенных по Ван Гизону, отмечены признаки синтеза коллагена и его отложение в виде разнонаправленных волокон и пучков ярко-оранжевого цвета по ходу сосудов равномерно по всей толщине регенерата сухожилия (рис. 3, е).
Подобная морфология трехнедельного регенерата пяточного сухожилия животного демонстрирует наличие и реализацию клеточной формы регенерации, присущей соединительной ткани. Макроскопически отмеченное восстановление целости сухожилия и микроскопически видимое замещение травматического дефекта тканью, идентичной погибшей, свидетельствует о протекании реституции сухожилия в отсутствии внешних источников регенерации.
Морфология регенерата сухожилия в контроле. В области заживления определяется утолщение сухожилия (рис. 4, а). На парафиновых срезах оно представляет собой зрелый структурно организованный регенерат из плотной волокнистой соединительной ткани. Клетки регенерата представлены преимущественно теноцитами веретенообразной формы с округлыми, реже - с вытянутыми ядрами без видимой цитоплазмы, единичными фибробластами и редкими макрофагами и лейкоцитами (рис. 4, б).
В центральной части регенерата короткие плотно прилежащие друг к другу пучки коллагеновых волокон 1-го и 2-го порядков структурированы, располагаются под углом или перпендикулярно к основной оси сухожилия. Ближе к поверхности сухожилия и в переходных зонах волокна вытянуты и ориентированы продольно, по направлению тянущих сил.
Кровоснабжение регенерата скудное, наблюдается между пучками в прослойках рыхлой соединительной ткани в виде 1-2 капилляров в поле зрения при большом увеличении (рис. 4, б). Поверхность сухожилия покрывают поврежденные в ходе выделения соединительнотканные спайки (рис. 4, в). Представленная гистологическая картина демонстрирует завершение фазы репарации сухожилия.
Рис 3. Микрофотоснимки зоны соединения в эксперименте по моделированию шва с изоляцией сухожилия на пяточном сухожилии крысы. Концы сухожилия соединяет соединительнотканный регенерат (а) с обилием незрелых кровеносных капилляров (б), крупными фибробластами и лимфоцитарно-макрофагальной инфильтрацией (в). Вдоль контактирующих в зоне соединения сухожильных волокон и пучков идет новообразование капилляров (г).
Поверхность сухожилия покрывает гладкий слой рыхлой соединительной ткани (д). В толще регенерата и у его поверхности определяется накопление коллагена в виде волокон ярко-оранжевого цвета (е). Парафиновые срезы.
Окраска гематоксилином и эозином - а, б, г, д; окраска по Ван Гизону - в, е. Ув. 40 х (а); 400х (б, г, д, е); 1000хс иммерсией (в)
Рис 4. Микрофотоснимки регенерата, сформировавшегося после тенотомии и шва без изоляции сухожилия. Зрелый регенерат утолщен (а), образован пучками разнонаправленных зрелых коллагеновых волокон, между которыми проникают единичные капилляры (б). Поверхность сухожилия покрыта соединительнотканными спайками (в).
Парафиновые срезы. Окраска гематоксилином и эозином. Ув. 40х (а); 100х (в); 400х (б)
Длительность эксперимента 3 недели была обоснована достижением срастания пяточного сухожилия у крыс после тенотомии и шва без изоляции в этот срок [18], а также результатами эксперимента, в котором первичная регенерация сухожилия кролика в аваскулярной среде наступала через 3 недели после шва [23, 24]. У человека в это же время со 2-ой по 6-ю неделю протекает фаза репарации (фибропластическая), когда прочность зоны шва прогрессивно возрастает настолько, что можно приступать к более активной реабилитации пациента [1, 16, 25].
В обычных условиях у лабораторных животных зона шва реваскуляризуется приблизительно через 17 дней после шва, когда вновь формирующиеся сосуды прорастают через спайки из окружающих тканей вдоль поверхности сухожилия и проникают в зону шва через аваскулярные в норме области [26]. В представленной экспериментальной модели при изоляции срастание сухожилия замедлилось на половину фазы, поскольку было возможно только благодаря синтетической активности теноцитов и тенобластов самого сухожилия. Пик фазы репарации в виде активации колла-гено- и ангиогенеза пришелся на конец третьей недели.
На протяжении 3-х недель трубка являлась механическим барьером для врастания рубцовой ткани и исключала влияние внешних источников регенерации. Врастание сосудов в зону шва шло лишь на ограниченном участке со стороны щелевидного пространства в рассеченной трубке из предсуществующих в окружающих тканях капилляров. При этом стимуляция репаративной регенерации и дифференцировка ткани происходили благодаря сохранению доминирующего регуляторного механизма регенерации сухожилия -функционального механизма [27, 28]. Положительным эффектом от имплантации трубки стало формирование скользящих поверхностей сухожилия и его оболочки, необходимых в клинической практике для свободной экскурсии сухожилия и восстановления нормального объема движений в пальцах кисти.
ВЫВОДЫ
В статье представлена экспериментальная модель томии, шва и изоляции пяточного сухожилия на лабораторных крысах, имитирующая операцию реконструкции с временной изоляцией зоны шва продольно рассеченной полимерной трубкой у пациентов с застарелыми повреждениями сухожилий глубоких сгибателей пальцев кисти. Операция на пяточном сухожилии крыс хорошо воспроизводится. С ее помощью можно исследовать процесс срастания сухожилия в эксперименте in vivo, а также изучать влияние разных факторов на формирование регенерата.
Субтотальная изоляция полимерными трубками в эксперименте не вызвала некроза сухожилия и зоны шва. Гистологическое исследование продемонстрировало жизнеспособность сухожилия и его первичную репаративную регенерацию за счет клеток самого сухожилия. Замедление регенерации при изоляции сухожилий следует учитывать при ведении пациентов после операций и назначении активной реабилитации.
Достоинством и гуманным аспектом представленной модели является то, что она не предусматривает выведение животных из эксперимента, они продолжают жить и могут быть использованы в других исследованиях.
СПИСОК ИСТОЧНИКОВ
1. Зенченко А.В., Чернякова Ю.М. Биология срастания, изменения биомеханики и реабилитация после шва сухожилий сгибателей пальцев кисти // Медицинские новости. 2020. № 10. С. 13-19.
2. Ломая М.П., Шихзагиров З.Т. Причины формирования теногенных сгибательных контрактур пальцев кисти и их устранение с помощью тенолиза (обзор литературы) // Травматология и ортопедия России. 2005. № 1 (34). С. 60-67.
3. Strickland J.W. Flexor tendons - acute injuries // Green’s operative hand surgery. Ed. by D.P. Green, R.N. Hotchkiss, W.C. Pederson. New York: Churchill Livingstone. 1999. P. 1851-1897.
4. Strickland J.W. Biologic rationale, clinical application, and results of early motion following flexor tendon repair // J. Hand Ther. 1989. Vol. 2, No 2. P. 71-83. DOI:10.1016/S0894-1130(89)80045-6.
5. Kulick M.I., Smith S., Hadler K. Oral ibuprofen: evaluation of its effect on peritendinous adhesions and the breaking strength of a tenorrhaphy // J. Hand Surg. Am. 1986. Vol. 11, No 1. P. 110-120. DOI: 10.1016/s0363-5023(86)80116-2.
6. Carlstedt C.A., Madsen K., Wredmark T. The influence of indomethacin on biomechanical and biochemical properties of the plantaris longus tendon in the rabbit // Arch. Orthop. Trauma Surg. 1987. Vol. 106, No 3. P. 157-160.
7. Szabo R.M., Younger E. Effect of indomethacin on adhesion formation after repair of zone II tendon lacerations in the rabbit // J. Hand Surg. Am. 1990. Vol. 15, No 3. P. 480-483. DOI: 10.1016/0363-5023(90)90066-z.
8. Голубев И.О., Львов С.Е. Местное применение адрибластина для профилактики образования повторных спаек после тенолиза сухожилий сгибателей // Травматология и ортопедия России. 1998. № 1. С. 37-39.
9. Ozgenel G.Y., Etoz A. Effects of repetitive injections of hyaluronic acid on peritendinous adhesions after flexor tendon repair: a preliminary randomized, placebo-controlled clinical trial // Ulus. Travma Acil. Cerrahi. Derg. 2012. Vol. 18, No 1. P. 11-17. DOI: 10.5505/tjtes.2011.95530.
10. Патрикеев Д.В. Использование оригинального сухожильного шва и эндопротеза синовиальной жидкости «Noltrex» в лечении больных с повреждением сухожилий сгибателей пальцев кисти в зоне фиброзно-синовиальных влагалищ // Травматология и ортопедия России. 2006.
№ 4 (42). С. 64-68.11. Способ лечения поврежденного сухожилия в зоне синовиального влагалища / Э.Р. Мулдашев, Н.Н. Аслямов, Н.Д. Кульбаев, Р.Т. Нигматуллин, Д.А. Щербаков // Вестник ОГУ 2010. № 12. С. 253-255.
12. Склянчук Е.Д. Реконструкция скользящего аппарата сухожильного трансплантата васкуляризованным фасциальным лоскутом в эксперименте // Вестник травматологии и ортопедии им. Н.Н. Приорова. 2000. № 2. С. 26-32.
13. Prevention of peritendinious adhesions in zone II primary flexor tendon repair using a vein patch graft: A comparative study / A.M. Khazbak, A.A. Shaker, N.I. El Shishtawy, B.M. Zaki, N.A.S. Mahmoud // Eur. J. Plast. Surg. 2019. Vol. 42. P. 359-364. DOI: 10.1007/s00238-018-1494-0.
14. Ozgenel G.Y. The effects of a combination of hyaluronic and amniotic membrane on the formation of peritendinous adhesions after flexor tendon surgery in chickens // J. Bone Joint Surg. Br. 2004. Vol. 86, No 2. P. 301-307.
15. Применение современных противоспаечных препаратов в хирургии / О.А. Мешкова, Д.Ю. Богданов, Н.Л. Матвеев, И.А. Курганов // Эндоскопическая хирургия. 2015. Т. 21, № 3. С. 37-42. DOI: 10.17116/endoskop20l521337-42.
16. Овсянникова А.Д. Реабилитация и тактика ведения пациентов после хирургического восстановления сухожилий сгибателей пальцев кисти // Вопросы реконструктивной и пластической хирургии. 2018. Т. 2, № 2 (65). С. 62-73.
18. Зенченко А.В., Чернякова Ю.М. Сравнение трехнедельных регенератов пяточного сухожилия после тенотомии и шва в эксперименте in vivo // Журнал Гродненского государственного медицинского университета. 2021. Т. 19, № 1. С. 77-84. DOI: 10.25298/2221-8785-2021-19-1-77-84.
19. Руководство по работе с лабораторными животными для сотрудников ГБОУ ВПО РНИМУ им. Н.И. Пирогова Минздрава России, занятых проведением доклинических испытаний. М., 2015. 42 с.
20. Institutional Animal Care and Use Committee Guidebook. 2nd edition. ARENA (Applied Research Ethics National Association / OLAW (Office of Laboratory Animal Welfare). National Institutes of Health. 2002. 210 p.
21. Guide for the Care and Use of Laboratory Animals. 8th edition. Washington, National Research Council, DC: The National Academy Press. 2011. 220 p. DOI: 10.17226/12910.
22. Макарова М.Н. Применение ингаляционной анестезии в доклинических исследованиях // Лабораторные животные для научных исследований. 2020. № 4. С. 13-28. DOI:10.29296/2618723X-2020-04-02.
23. Lundborg G. Experimental flexor tendon healing without adhesion formation - a new concept of tendon nutrition and intrinsic healing mechanisms. A preliminary report // Hand. 1976. Vol. 8, No 3. P. 235-238. DOI: 10.1016/0072-968x(76)90007-3.
24. Lundborg G., Rank F. Experimental intrinsic healing of flexor tendons based upon synovial fluid nutrition // J. Hand Surg. Am. 1978. Vol. 3, No 1. P. 21-31. DOI: 10.1016/s0363-5023(78)80114-2.
25. Seiler J.G. Flexor tendon repair // J. Am. Soc. Surg. Hand. 2001. Vol. 1. P. 177-191. DOI: 10.1053/jssh.2001.26283.
26. Gelberman R.H., Khabie V., Cahill C.J. The revascularization of healing flexor tendons in the digital sheath. A vascular injection study in dogs // J. Bone Joint Surg. Am. 1991. Vol. 73, No 6. P. 868-881.
27. The excursion and deformation of repaired flexor tendons treated with protected early motion / R.H. Gelberman, M.J. Botte, J.J. Spiegelman, W.H. Akeson // J. Hand Surg. Am. 1986. Vol. 11, No 1. P. 106-110. DOI: 10.1016/s0363-5023(86)80115-0.
28. Струков А.И., Серов В.В. Патологическая анатомия : учебник. 6-е изд., перераб. и доп. / под ред. В.С. Паукова. М. : ГЭОТАР-Медиа, 2015. 880 с.
Информация об авторах:
1. Александр Викторович Зенченко
2. Сергей Васильевич Тарасенко
Теги: шов
234567 Начало активности (дата): 07.06.2023 17:11:00
234567 Кем создан (ID): 989
234567 Ключевые слова: сухожилие, тенотомия, шов сухожилия, изоляция зоны шва, регенерат сухожилия, лабораторные животные
12354567899
Похожие статьи
Реализация общебиологических законов, открытых Г.А. Илизаровым, в лечении раненых и пострадавших с дефектами диафизов длинных костей нижних конечностейРентген на дому 8 495 22 555 6 8
Способ пластики сухожилия длинного разгибателя первого пальца кисти
Вывихи плеча
А.П. Быстров "Прошлое, настоящее, будущее человека". Часть 3 Глава 1



