 04.01.2026
04.01.2026
Влияние расширенного предоперационного обследования на выбор тактики лечения перед вторым этапом ревизионного эндопротезирования тазобедренного сустава
Показатели реинфекции или рецидива перипротезной инфекции при выполнении второго этапа ревизионного эндопротезирования тазобедренного сустава (РЭТС) остаются достаточно высокими
ВВЕДЕНИЕ
По данным национальных регистров эндопротезирования, количество операций артропластик тазобедренного сустава (ТБС) неуклонно растет, как следствие, растет и число осложнений. Перипротезная инфекция (ППИ) ТБС является лидирующим по разрушительности для организма человека и частоте встречаемости осложнением после эндопротезирования ТБС [1, 2, 3].
Прогрессирующий дефицит костной ткани, а также необходимость продолжительного стационарного лечения и неоднократных оперативных вмешательств способствуют повышению риска фатальных осложнений, снижению качества жизни пациентов, нередко приводя к инвалиди- зации и летальным исходам [4, 5, 6]. По данным K.M. Natsuhara с соавторами, летальность после выполнения двухэтапного ревизионного вмешательства по поводу ППИ в течение года составляет 4,22%, а в течение 5 лет — уже более 21,00% [7]. Более того, существует вероятность реинфицирования и рецидива инфекционного процесса в области оперированного ТБС. Есть данные о частоте рецидивов инфекции после ревизионных операций в 10% через год, 14% — через 5 лет и 15% — через 15 лет с момента операции [8]. Существует несколько подходов к лечению ППИ ТБС. Для определения дальнейшей тактики лечения необходимо правильно установить диагноз.
С. Li с соавторами разработали классификацию ППИ, основанную на зрелости микробной биопленки на поверхности компонентов эндопротеза, разделив ППИ на острую и хроническую [9]. В более ранней работе и D.T. Tsukayama с соавторами предложили классификацию ППИ, основанную на сроках манифестации клинических признаков и пути проникновения инфекции в организм [10].
Не представляет трудностей установить диагноз в случаях, когда локальные признаки воспаления, а также наличие свища с обильным отделяемым в области ТБС явно указывают на наличие ППИ. Гораздо сложнее отличить хроническую ППИ, вызванную низковирулентными штаммами микроорганизмов, от явлений асептического расшатывания компонентов эндопротеза. С этой целью специалистами во всем мире используются различные протоколы диагностики ППИ, среди которых наиболее востребованы EBJIS [11], ICM [12], WAIOT [13]. Так или иначе золотым стандартом диагностики ППИ остается стандартное микробиологическое исследование синовиальной жидкости и образцов перипротезных тканей [14].
В случаях выявления ППИ специалистами используются такие варианты оперативного лечения, как одно- и двухэтапное ревизионное эндопротезирование тазобедренного сустава (РЭТС) [15].
При одноэтапном РЭТС выполняются удаление всех компонентов эндопротеза, санация и установка ревизионных компонентов с последующей пролонгированной антибактериальной терапией [16].
При лечении поздней глубокой ППИ ТБС предпочтение отдается двухэтапному РЭТС [17, 18]. Преимуществом данного метода является локальное воздействие антибактериальных препаратов непосредственно в очаге инфекции [19]. На первом этапе проводятся удаление компонентов эндопротеза, санация, установка различного вида импрегнированных антибиотиками спейсеров. На втором этапе, после исключения реинфицирования, выполняются удаление спейсера, санация, установка ревизионных компонентов эндопротеза [16, 20].
Так называемыми операциями отчаяния при лечении хронической ППИ являются операция Гирдлестоуна или ампутация конечности [21].
Цели исследования: 1) сравнить диагностическую точность, специфичность и чувствительность используемых маркеров инфекции в рамках предоперационных диагностических протоколов с целью исключения реинфекции у пациентов с установленным спейсером тазобедренного сустава перед вторым этапом РЭТС; 2) проанализировать и сравнить микробиологический пейзаж, полученный на этапах РЭТС.
На сегодняшний день остро стоит вопрос о необходимости выполнения диагностической аспирации синовиальной жидкости ТБС перед вторым этапом ревизионного эндопротезирования. Из-за особенностей, связанных с установленным спейсером, некоторые специалисты предлагают переходить к выполнению второго этапа РЭТС, минуя выполнение диагностических процедур и тем более аспирации синовиальной жидкости. При этом частота реинфицирования, по разным данным, составляет от 8,4% до 33% [22, 23]. Q. Wang с соавторами в своей работе приводят данные о частоте реинфицирования 22,5% уже после первого этапа РЭТС [24].
МАТЕРИАЛ И МЕТОДЫ
Дизайн исследования
Тип исследования — проспективное одноцентровое с ретроспективным анализом.
Исследование проводилось в 2018-2023 гг. на базе ортопедического отделения ГКБ им. С.П. Боткина. В нем приняло участие 107 пациентов.
Критерии включения:
наличие впервые установленного спейсера ТБС по поводу ППИ;
отсутствие клинических признаков инфекционного процесса в области планируемой операции (свища, локальной гиперемии, гипертермии);
согласие на выполнение второго этапа ревизионного эндопротезирования;
письменное информированное согласие пациента на участие в исследовании.Критерии невключения:
активный инфекционный процесс с наличием свищевого хода в области ТБС, локальной гиперемии, гипертермии;
ранее выполненная операция Гирдлестоуна по поводу ППИ;
объективные противопоказания к ревизионной операции в силу соматического или психического статуса;
ВИЧ-инфекция;
повторно выполненная имплантация спейсера.
Критерии исключения:
появление у пациента свищевого хода в области исследуемого ТБС;
отказ пациента от оперативного вмешательства и дальнейшее нежелание участвовать в исследовании;
выявление реинфекции при проведении предоперационной диагностики;
смерть пациента до выполнения второго этапа РЭТС.
Схема отбора пациентов представлена на рисунке 1.
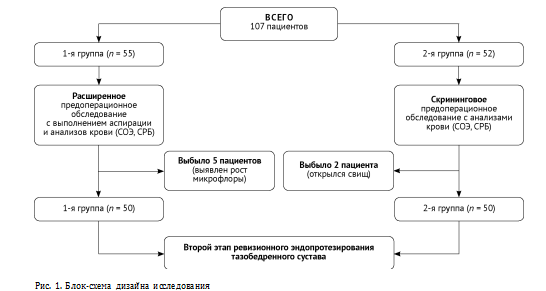
Пациенты были разделены на две группы, исходя из ретроспективного или проспективного характера полученных данных и объема выполняемых диагностических мероприятий.
Характеристика пациентов, включенных в исследование, представлена в таблице 1.
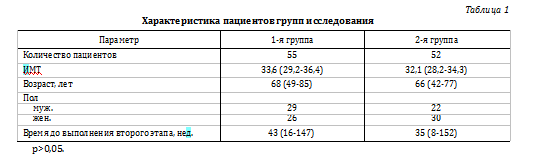
В 1-й (проспективной) группе пациентов в рамках расширенного диагностического протокола на дооперационном этапе выполнялись анализы крови на СОЭ, СРБ, а также проводилась диагностическая аспирация синовиальной жидкости ТБС с последующим микробиологическим исследованием и определением чувствительности к антибактериальным препаратам. Полученный биоматериал в течение 30 мин. доставлялся в лабораторию для микробиологического анализа. Обязательным условием являлись отказ от местной анестезии, а также строгое соблюдение пациентами «антибактериальных каникул» не менее чем за 14 дней до даты планируемой аспирации.
При получении материала производился высев на питательные среды (BD BACTEC Peds Plus, Becton Dickinson, США) с обязательным культивированием до 14 дней и определением чувствительности к антибактериальным препаратам.
При отсутствии аспирата («сухом суставе») решение вопроса о дальнейшей тактике лечения принималось, исходя из результатов анализов сывороточных биомаркеров СОЭ и СРБ. При получении значений, не выходящих за пределы референсного диапазона, согласно «малым критериям» Второй международной согласительной конференции по скелетно-мышечной инфекции (ICM 2018) [25], ситуация расценивалась как купирование инфекции, и пациент направлялся на выполнение второго этапа.
Во 2-й (ретроспективной) группе обследование осуществлялось согласно скрининговому предоперационному диагностическому протоколу с целью исключения реинфицирования. Скрининговый протокол включал ретроспективный анализ результатов сывороточных показателей биомаркеров воспаления СОЭ и СРБ. Согласно результатам анализа медицинской документации, у этих пациентов отсутствовали признаки воспалительного процесса в области операции: локальная гиперемия, гипертермия, свищ в области исследуемого ТБС. Пороговые значения сывороточных показателей СОЭ и СРБ у пациентов обеих групп соответствовали пороговым значениям «малых критериев» ICM 2018 [25].
Выполнение второго этапа РЭТС было рекомендовано пациентам, у которых по результатам используемых протоколов предоперационной диагностики реинфекция ТБС была исключена. В рамках второго этапа ревизионного эндопротезирования выполняли удаление спейсера, санацию, установку ревизионных компонентов эндопротеза.
У всех пациентов на этапе доступа осуществлялся забор тканей из-под удаленных компонентов спейсера (от 3 до 6 образцов) с последующим микробиологическим исследованием и опре делением чувствительности к антибактериальным препаратам. Результат интраоперационного микробиологического исследования образцов пе- риимплантных тканей во время выполнения второго этапа РЭТС являлся эталонным, исходя из чего оценивались и анализировались результаты проведенной предоперационной диагностики у пациентов 1-й и 2-й групп.
Статистический анализ
Сбор, обработка и систематизация информации осуществлялись при помощи электронных таблиц Microsoft Office Excel 2016. Сравнительный анализ частот в 1-й и 2-й группах проводился с помощью углового преобразования (критерия) Фишера и t-критерия Стьюдента. Статистически значимыми признавались различия на уровне р<0,05.
Статистические данные анализировали с помощью компьютерной программы MedCalc 13.2.2 (MedCalc Software, Бельгия). Проведен ROC-анализ для всех исследуемых биомаркеров с целью определения чувствительности, AUC и специфичности используемых маркеров реинфекции (использовался индекс Юдена).
РЕЗУЛЬТАТЫ
Из 55 пациентов 1-й группы синовиальная жидкость при выполнении предоперационной диагностической аспирации была получена у 47 (85%). В 8 (15%) случаях синовиальную жидкость получить не удалось («сухой сустав»). Показатели сывороточных маркеров (СОЭ, СРБ) у всех пациентов
1-й группы с «сухим суставом» не превышали пороговых значений, указанных в рекомендациях ICM 2018 [25]. Поэтому им было рекомендовано выполнение второго этапа РЭТС.
У 5 (9%) пациентов 1-й группы согласно результатам дооперационного микробиологического исследования синовиальной жидкости был выявлен рост микрофлоры. Эти пациенты были исключены из исследования и направлены на выполнение ревизионного эндопротезирования в объеме: удаление спейсера, санация, повторная установка спейсера.
При проведении предоперационной диагностики из исследования были исключены два (4%) пациента 2-й группы: у них было выявлено открытие свищевого хода с серозно-геморрагическим отделяемым в области исследуемого сустава. Эти пациенты были направлены на дальнейшее лечение (санацию, повторную установку спейсера) в отделение гнойной хирургии.
По результатам интраоперационного микробиологического исследования при выполнении 2-го этапа РЭТС реинфекция была выявлена у 40 (40%) из 100 пациентов в обеих группах. В 1-й группе количество пациентов с выявленной инфекцией по результатам интраоперационного микробиологического исследования при выполнении второго этапа РЭТС оказалось ниже: 9 (18%) против 31 (62%) в группе пациентов, которым диагностическая аспирация не выполнялась (р<0,05). В 4 (45%) случаях у пациентов 1-й группы были выявлены микробные ассоциации по результатам интраоперационного микробиологического исследования при выполнении второго этапа РЭТС. Были также обнаружены 4 (45%) представителя грамположительных микроорганизмов (S. haemoliticus, MRSE, MSSE) и 1 (10%) представитель грамотрицательной микрофлоры (E. coli).
Среди пациентов 2-й группы по результатам интраоперационного микробиологического исследования при выполнении второго этапа РЭТС в 19 (62%) случаях выявленная микрофлора представлена различными граположительными микроорганизмами: MRSE — 7 (36%), E. faecalis — 3 (16%), MSSE — 2 (10%), C. acnes — 2 (10%), другие виды — 5 (28%), а также микробными ассоциациями — 10 (32%). Спектр выявленных микроорганизмов также включал представителей грамотрицательной флоры: K. pneumoniae — 1 (3%), и рост дрожжеподобных грибов — C. auris — 1 (3%).
По результатам ROC-анализа были определены показатели диагностической точности, чувствительности, AUC и специфичности используемых методов диагностики у пациентов 1-й и 2-й групп (табл. 2, 3).
Благодаря выявлению роста микрофлоры по результатам дооперационной аспирации у 5 пациентов 1-й группы удалось своевременно диагностировать инфекцию и изменить тактику дальнейшего лечения, направив больных на повторную установку спейсера.
Несмотря на невысокие показатели чувствительности СОЭ, СРБ и аспирации, показатели специфичности продемонстрировали высокие значения для СРБ и аспирации. Различия в полученных результатах диагностических показателей биомаркеров СОЭ и СРБ в обеих группах статистически не значимы (р>0,05).
Мы также анализировали и сравнивали результаты микробиологического исследования у пациентов с выявленной инфекцией после выполнения первого и второго этапов РЭТС с целью оценки вероятного рецидива/реинфицирова- ния. Были получены следующие результаты: из 40 пациентов с выявленной инфекцией (в обеих группах) по результатам интраоперационного микробиологического исследования образцов периимплантных тканей при выполнении второго этапа РЭТС рецидив инфекции (верифицирован хотя бы один микроорганизм, полученный на первом этапе) был выявлен в 10 (10%) случаях, реинфекция (выявленный при выполнении второго этапа РЭТС микроорганизм отличается от полученного при выполнении первого этапа РЭТС) диагностирована в 30 (30%) случаях. Отсутствие роста микрофлоры (ситуация трактуется как купирование инфекции) по результатам микробиологического исследования образцов периимплант- ных тканей при выполнении второго этапа РЭТС отмечено в 60 (60%) случаях.
В 1-й группе был выявлен один (2%) случай рецидива (метициллин-чувствительный эпидермальный стафилококк) в составе микробной ассоциации. Во 2-й группе было выявлено 9 (18%) случаев рецидива инфекции. Преобладающая флора была представлена метициллин-резистентным грамположительным коагулазо-негативным стафилококком (MRSE — 25%), другими представителями грамположительной микрофлоры (20%), микробными ассоциациями (55%).
При анализе микрофлоры у пациентов с рецидивом инфекции было обнаружено, что наиболее часто рецидив инфекции отмечался при выявлении MRSE (40%) и различных других грам- положительных микроорганизмов: S. warneri (10%),
S. capitis (20%), MSSE (10%), E. faecalis (10%), MRSA (10%), в том числе в составе микробных ассоциаций. Стоит отметить, что у 4 из 10 пациентов (40%) с рецидивом инфекции был выявлен рост как минимум одного из нескольких возбудителей, полученных при выполнении первого этапа РЭТС. У двух пациентов из 10 (20%) выявлен полный рецидив микроорганизма/ов, как и на первом этапе РЭТС (при установке спейсера).
Важно отметить, что большинство случаев (9 из 10) рецидива ППИ приходится на пациентов из 2-й группы. Количество пациентов с выявленным рецидивом инфекции в 1-й группе оказалось статистически значимо ниже, чем во 2-й группе: один случай в 1-й группе против 9 случаев во 2-й группе (р<0,05).
Реинфицирование с впервые выявленным микроорганизмом по результатам интраоперационного микробиологического исследования образцов периимплантных тканей во время выполнения второго этапа РЭТС среди пациентов обеих групп выявлено в 30 случаях (30%). В 1-й группе пациентов выявлено 8 (16%) случаев реинфекции. В структуре выявленной микрофлоры преобладали: грамположительный коагулазонегативный стафилококк (MSSE) — 2 (25%), S. haemoliticus — 2 (25%), микробные ассоциации — 3 (38%). Во 2-й группе выявлено 22 (44%) случая роста микрофлоры по результатам интраоперационного микробиологического исследования при выполнении второгого этапа РЭТС. Доминирующей флорой оказались: грамположительный коагула- зонегативный стафилококк — 15 (65%), в том числе S. epidermidis (20%) и другие представители грамположительной флоры (45%); грамотрицательная флора (K. pneumoniae — 5%), различные микробные ассоциации — 25%, дрожжеподобные грибы — 5%. Случаи выявленной реинфекции в 1-й группе встречались статистически значимо реже, чем во 2-й группе: 8 случаев в 1-й группе против 22 случаев во 2-й группе (p<0,05).
Из 40 пациентов с выявленной инфекцией по результатам интраоперационного микробиологического исследования образцов периимплант- ных тканей при выполнении второго этапа РЭТС в обеих группах получено 13 (32,5%) различных микробных ассоциаций. В составе микробных ассоциаций преобладал грамположительный стафилококк — 23 (82%): преимущественно MRSE (21%),
S. capitis (17%) и другие виды (62%). Также присутствовали представители грамотрицательной флоры — 4 (14%), дрожжеподобных грибов — 1 (2%).
ОБСУЖДЕНИЕ
Несмотря на высокие показатели реинфекции у пациентов с установленным спейсером ТБС, ее предоперационное исключение является достаточно дискутабельным вопросом.
M. Sukeik с соавторами принимали решение о выполнении второго этапа РЭТС по результатам микробиологического исследования синовиальной жидкости, полученной при предоперационной аспирации тазобедренного сустава. Авторы также опирались на результаты сывороточных показателей СОЭ (менее 30 мм/час) и СРБ (менее 10 мг/л). Дооперационная аспирация выполнялась не менее чем через 4 нед. после окончания приема антибактериальных препаратов [26].
Своевременная и точная диагностика ППИ крайне важна и позволяет уже на ранних этапах верифицировать возбудителя и выбрать наилучшую тактику лечения. Для этих целей разработаны различные алгоритмы. Однако допустимо ли использование этих же алгоритмов у пациентов с установленным спейсером ТБС перед выполнением второго этапа РЭТС?
Диагностика реинфекции у пациентов со спей- сером ТБС является крайне сложной задачей. Даже в таких протоколах диагностики и лечения ППИ, как MSIS [27] и ICM [25], отсутствуют рекомендации по выполнению диагностической аспирации после выполнения первого этапа РЭТС по поводу ППИ.
В исследовании, посвященном особенностям воздействия артикулирующих спейсеров на пери- протезные ткани, было выявлено, что спейсеры, изготовленные из полиметилметакрилата, способствуют иммуномодулирующему воздействию на синовиальную оболочку и периимплантные ткани. Образующаяся на месте контакта спейсер-кость мембрана индуцирована различными иммунными клетками за счет истирания цемента, образования цементного дебриса и миграции компонентов клеточного иммунитета [28]. Также при выполнении диагностической аспирации важно понимать, что антибактериальные препараты, входящие в состав спейсера, высвобождаясь в синовиальную жидкость, способствуют получению ложноотрицательных результатов микробиологического исследования при выполнении диагностической аспирации синовиальной жидкости ТБС [29]. Вопрос продолжительности выделения антибактериальных препаратов из спейсера вполне диску- табельный, в связи с чем точность синовиальных биомаркеров при аспирации синовиальной жидкости у пациентов с установленным спейсером в разные сроки может отличаться. Так, S.P. Boelch с соавторами продемонстрировали данные, согласно которым локальная концентрации антибактериальных препаратов может сохраняться повышенной более 6 нед. с момента операции. Авторы отмечают, что указанные данные были получены в эксперименте in vitro, а в ситуациях in vivo продолжительность выделения антибиотика может отличаться [30]. Таким образом, наличие в полости сустава повышенной концентрации иммунных клеток и антибактериальных препаратов может способствовать ложным результатам диагностики реинфекции при выполнении исследований синовиальной жидкости.
В доступной литературе не так много публикаций, в которых авторы приводят результаты анализа показателей диагностической точности различных маркеров инфекции с целью исключения реинфекции у пациентов перед выполнением 2-го этапа РЭТС. Некоторые специалисты, например S. Hoell с соавторами, не рекомендуют выполнять аспирацию перед выполнением ревизионного эндопротезирования и предлагают искать новые биомаркеры для диагностики реинфекции у пациентов с установленным спейсером ТБС [31].
H.M.L. Muhlhofer с соавторами в своем исследовании оценили диагностические показатели сывороточных (СОЭ, СРБ) и синовиальных (показатель полиморфноядерных нейтрофилов) маркеров инфекции у пациентов после первого этапа РЭТС. Исходя из полученных авторами данных, ни один из используемых биомаркеров не позволяет верифицировать длительно персистирующую инфекцию. С другой стороны, авторы также отмечают, что выполнение микробиологического исследования синовиальной жидкости в рамках предоперационной диагностики ППИ зачастую демонстрирует ложноположительные результаты (контаминация), что приводит к неправильному выбору тактики лечения. H.M.L. Muhlhofer с соавторами рекомендуют использовать междисциплинарный подход к лечению ППИ и предлагают переходить к выполнению второго этапа РЭТС, не прерывая курс антибактериальной терапии между этапами [32].
S.P. Boelch с соавторами также считают, что выполнение диагностической аспирации ТБС с микробиологическим исследованием синовиальной жидкости и подсчетом лейкоцитов синовиальной жидкости у пациентов с установленным спейсером не является надежным стандартом диагностики, позволяющим верифицировать пер- систирующую инфекцию [33]. H.M.L. Muhlhofer с соавторами также предлагают переходить к выполнению второго этапа РЭТС, не прекращая антибактериальную терапию, а повышенные показатели сывороточного СРБ считать лишь дополнительным фактором риска развития инфекционных осложнений [32].
Стоит обсудить вопрос: когда же стоит приступать к выполнению второго этапа РЭТС? На сегодняшний день этот вопрос остается открытым. Несмотря на многочисленные исследования, общепринятого протокола в отношении сроков выполнения ревизионной операции второго этапа РЭТС в настоящее время нет [34]. В свою очередь, мы считаем, что оптимальным временем выполнения второго этапа РЭТС является период компенсации и восстановления общего состояния пациента после выполнения первого этапа РЭТС с учетом высокотравматичного вмешательства, а также после исключения реинфекции по результатам применения комплексного предоперационного алгоритма диагностики с выполнением диагностической аспирации сустава.
Некоторые авторы предлагают выполнять второй этап РЭТС в сроки 4-11 нед. после установки спейсера, так как операции, проведенные в этот период, по их мнению, имеют самую выокую эффективность. По данным тех же авторов, в случаях выполнения РЭТС до 4 нед. после установки спей- сера риск реинфекции составлял 100%, позднее 11 нед. — 47,8%. Авторы также сообщили о 30% частоте рецидива инфекции, вызванной одним и тем же инфекционным агентом [35].
Рецидивы инфекции после выполнения второго этапа ревизионного эндопротезирования, к сожалению, не так уж и редки. По некоторым данным, частота рецидива инфекции в течение 15 лет после ревизии составляет 17% [36]. E. Kozaily с соавторами получили 49% реинфицирования после выполнения двухэтапного РЭТС при наблюдении до 2 лет. Решение о выполнении второго этапа принималось с учетом состояния послеоперационной раны, а также тенденции к снижению провоспалительных сывороточных биомаркеров на 80%. Предоперационная диагностическая аспирация авторами не выполнялась [37]. С другой стороны, остается неизвестным тот факт, что выявленный микроорганизм является именно рецидивом инфекции, которую не удалось вылечить после установки спейсера или уже новым возбудителем? В нашем исследовании доля рецидива инфекции составила 10%. В 30% случаев был выявлен абсолютно другой микроорганизм или микробная ассоциация (реинфекция).
При проведении исследования мы также столкнулись с проблемой «сухого сустава»: синовиальная жидкость отсутствовала в 15% случаев при выполнении предоперационной аспирации у пациентов с установленным спейсером ТБС. С.А. Божкова с соавторами в своем исследовании, выполняя дооперационные аспирации у пациентов перед ревизионным вмешательством, столкнулись с «сухим суставом» в 21,4% случаев. Авторы также считают, что выполнение предоперационной аспирации сустава не является достаточным для диагностики ППИ, однако выявление положительной культуры микроорганизмов является одним из факторов выбора дальнейшей тактики лечения [38]. К сожалению, авторы не отмечают, проводились ли аспирации у пациентов со спейсе- ром, в связи с чем анализ данных может быть затруднен. S. Huguet с соавторами проанализировали эффективность дооперационной аспирации 20 ТБС. Согласно полученным результатам, чувствительность метода составила 0% [39].
Примечательно, что в доступной литературе удалось найти не так много публикаций, в которых проводится анализ большого количества аспираций у пациентов с установленным спейсером ТБС [29, 31, 32, 33, 39].
Согласно нашим представлениям о детальной предоперационной диагностике, перед выполнением второго этапа ревизионного эндопротезирования тазобедренного сустава необходимо выполнять диагностическую аспирацию синовиальной жидкости тазобедренного сустава всем пациентам с установленным спейсером, так как аспирация при получении синовиальной жидкости позволяет значительно снизить риск интраоперационного выявления инфекции при выполнении второго этапа ревизионного эндопротезирования тазобедренного сустава.
Несмотря на рутинное использование сывороточных биомаркеров СОЭ и СРБ, наилучший показатель диагностической точности среди используемых тестов был продемонстрирован при выполнении предоперационной диагностической аспирации.
В структуре выявленных возбудителей при рецидиве и реинфекции наиболее часто встречались представители грамположительной коагулазоне- гативной флоры.
ЗАКЛЮЧЕНИЕ
Использование расширенного предоперационного диагностического протокола позволило нам уже на дооперационном этапе выявить реинфекцию, что повлияло на изменение тактики дальнейшего лечения.
ЛИТЕРАТУРА
Annual report 2021 Norwegian National Advisory Unit on Arthroplasty and Hip Fractures. doi:10.13140/RG.2.2.34266.26566.
Swedish Arthroplasty Register Annual Report 2021.
The Danish Hip Arthroplasty Register (DHR), 2021 National Annual Report.
Kapadia B.H., Berg R.A., Daley J.A., Fritz J., Bhave A., Mont M.A. Periprosthetic joint infection.
Rietbergen L., Kuiper J.W., Walgrave S., Hak L., Colen S. Quality of life after staged revision for infected total hip arthroplasty: a systematic review. Hip Int 2016;26(4):311-318.
Hipfl C., Leopold V., Becker L., Pumberger M., Perka C., Hardt S. Two-stage revision for periprosthetic joint infection in cemented total hip arthroplasty: an increased risk for failure? Arch Orthop Trauma Surg. 2023;143(7):4481-4490
Natsuhara K.M., Shelton T.J., Meehan J.P., Lum Z.C. Mortality During Total Hip Periprosthetic Joint Infection. J Arthroplasty.
Petis S.M., Abdel M.P., Perry K.I., Mabry T.M., Hanssen A.D., Berry D.J. Long-Term Results of a 2-Stage Exchange Protocol for Periprosthetic Joint Infection Following Total Hip Arthroplasty in 164 Hips. J Bone Joint Surg Am. 2019;101(1):74-84.
Li C., Renz N., Trampuz A. Management of Periprosthetic Joint Infection. Hip Pelvis. 2018;30(3):138-146.
Tsukayama D.T., Estrada R., Gustilo R.B. Infection after total hip arthroplasty. A study of the treatment of one hundred and six infections. J Bone Joint Surg Am. 1996;78(4):512-523.
Papalini C., Pucci G., Cenci G., Mencacci A., Francisci D., Caraffa A. et al. Prosthetic joint infection diagnosis applying the three-level European Bone and Joint Infection Society (EBJIS) approach. Eur J Clin Microbiol Infect Dis. 2022;41(5):771-778. doi: 10.1007/s10096-022-04410-x.Schwarz E.M., Parvizi J., Gehrke T., Aiyer A., BattenbergA., Brown S.A. et al. 2018 International Consensus Meeting on Musculoskeletal Infection: Research Priorities from the General Assembly Questions. J Orthop Res. 2019;37(5):997-1006.
Bozhkova S., Suardi V., Sharma H.K., Tsuchiya H., Del Sel H., Hafez M.A. et al. The W.A.I.O.T. Definition of Peri-Prosthetic Joint Infection: A Multicenter, Retrospective Validation Study. J Clin Med. 2020;9(6):1965. doi: 10.3390/jcm9061965.
Tarabichi S., Goh G.S., Zanna L., Oadiri O.S., Baker C.M., Gehrke T. et al. Time to Positivity of Cultures Obtained for Periprosthetic Joint Infection. J Bone Joint Surg Am. 2023;105(2):107-112. doi: 10.2106/JBJS.22.00766.
Ahmed S.S., Begum F., Kayani B., Haddad F.S. Risk factors, diagnosis and management of prosthetic joint infection after total hip arthroplasty. Expert Rev Med Devices. 2019;16(12):1063-1070. doi: 10.1080/17434440.2019.1696673.
Pannu T.S., Villa J.M., Higuera C.A. Diagnosis and management of infected arthroplasty. SICOTJ. 2021;7:54. doi: 10.1051/sicotj/2021054.
Renner L., Perka C., Trampuz A., Renz N. Treatment of periprosthetic infections. Chirurg. 2016;87(10):831-838. (In German). doi: 10.1007/s00104-016-0255-5.
Li C., Renz N., Trampuz A., Ojeda-Thies C. Twenty common errors in the diagnosis and treatment of periprosthetic joint infection. Int Orthop. 2020;44(1):
Webb J.C., Gbejuade H., Lovering A., Spencer R. Characterisation of in vivo release of gentamicin from polymethyl methacrylate cement using a novel method. Int Orthop. 2013;37(10):2031-2036. doi: 10.1007/s00264-013-1914-5.
Мурылев В., Куковенко Г., Елизаров П., Рукин Я., Цыгин Н. Перипротезная инфекция при эндопротезировании тазобедренного сустава. Врач. 2018;(3): 17-22. doi: 10.29296/25877305-2018-03-04.
Murylev V., Kukovenko G., Elizarov P., Rukin Ya, Tsigin N. Periprosthetic infection during hip arthroplasty. Vrach. 2018;29(3):17-22. (In Russian). doi: 10.29296/25877305-2018-03-04.
Girdlestone G.R. Arthrodesis and other operations for tuberculosis of the hip. In: Milford H., ed. The Robert Jones birthday volume. London: Oxford University Press; 1928. p. 347-74.
Ibrahim M.S., Raja S., Khan M.A., Haddad F.S. A multidisciplinary team approach to two-stage revision for the infected hip replacement: a minimum five-year follow-up study. Bone Joint J. 2014;96-B(10):1312-1318. doi: 10.1302/0301-620X.96B10.32875.
Goud A.L., Harlianto N.I., Ezzafzafi S., Veltman E.S., Bekkers J.E.J., van der Wal B.C.H. Reinfection rates after one- and two-stage revision surgery for hip and knee arthroplasty: a systematic review and meta-analysis. Arch Orthop Trauma Surg. 2023;143(2):829-838. doi: 10.1007/s00402-021-04190-7.
Wang O., Huang J., Chen X., Jin Y. Risk factors of reinfection after prosthesis removal and antibiotic bone cement spacer implantation for the treatment of periprosthetic joint infection. BMC Infect Dis. 2022;22(1):905. doi: 10.1186/s12879-022-07908-z.
Parvizi J., Tan T.L., Goswami K., Higuera C., Della Valle C., Chen A.F. et al. The 2018 Definition of Periprosthetic Hip and Knee Infection: An Evidence- Based and Validated Criteria. J Arthroplasty. 2018;33(5): 1309-1314.e2.
Sukeik M., Haddad F.S. Two-stage procedure in the treatment of late chronic hip infections - spacer implantation. Int J Med Sci. 2009;6(5):253-257.
Parvizi J., Zmistowski B., Berbari E.F., Bauer T.W., Springer B.D., Della Valle C.J. et al. New definition for periprosthetic joint infection: from the Workgroup of the Musculoskeletal Infection Society. Clin Orthop Relat Res. 2011;469(11):2992-2994.
Singh G., Deutloff N., Maertens N., Meyer H., Awiszus F., Feuerstein B. et al. Articulating polymethylmethacrylate (PMMA) spacers may have an immunomodulating effect on synovial tissue. Bone Joint J. 2016;98-B(8): 1062-1068. doi: 10.1302/0301-620X.98B8.36663.
Newman J.M., George J., Klika A.K., Hatem S.F., Barsoum W.K., Trevor North W. et al. What is the Diagnostic Accuracy of Aspirations Performed on Hips With Antibiotic Cement Spacers? Clin Orthop Relat Res. 2017;475(1):204-211.
Boelch S.P., Jordan M.C., Arnholdt J., Rudert M., Luedemann M., Steinert A.F. Loading with vancomycin does not decrease gentamicin elution in gentamicin premixed bone cement. J Mater Sci Mater Med. 2017;28(7):104. doi: 10.1007/s10856-017-5915-6.
Hoell S., Moeller A., Gosheger G., Hardes J., Dieckmann R., Schulz D. Two-stage revision arthroplasty for periprosthetic joint infections: What is the value of cultures and white cell count in synovial fluid and CRP in serum before second stage reimplantation? Arch Orthop Trauma Surg. 2016;136(4):447-452. doi: 10.1007/s00402-015-2404-6.
Muhlhofer H.M.L., Knebel C., Pohlig F., Feihl S., Harrasser N., Schauwecker J. et al. Synovial aspiration and serological testing in two-stage revision arthroplasty for prosthetic joint infection: evaluation before reconstruction with a mean follow-up of twenty seven months. Int Orthop. 2018;42(2):265-271. doi: 10.1007/s00264-017-3700-2.
Boelch S.P., Weissenberger M., Spohn F., Rudert M., Luedemann M. Insufficient sensitivity of joint aspiration during the two-stage exchange of the hip with spacers. J Orthop Surg Res. 2018;13(1):7. doi: 10.1186/s13018-017-0703-z.
Puetzler J., Schulze M., Gosheger G., Schwarze J., Moellenbeck B., Theil C. Is long time to reimplantation a risk factor for reinfection in two-stage revision for periprosthetic infection? A systematic review of the literature. Front Surg. 2023;10:1113006. doi: 10.3389/fsurg.2023.1113006.
Vielgut I., Sadoghi P., Wolf M., Holzer L., Leithner A., Schwantzer G. et al. Two-stage revision of prosthetic hip joint infections using antibiotic-loaded cement spacers: When is the best time to perform the second stage? Int Orthop. 2015;39(9):1731-1736. doi: 10.1007/s00264-015-2751-5.
Carender C.N., DeMik D.E., Otero J.E., Noiseux N.O., Brown T.S., Bedard N.A. What is the Clinical Utility of Synovial Alpha Defensin Testing of Antibiotic Spacers Before Reimplantation? J Arthroplasty. 2021;36(6): 2150-2157. doi: 10.1016/j.arth.2021.02.001.
Kozaily E., Tan T.L., Yacovelli S., Anis H., Higuera C., Piuzzi N.S. et al. Interim Spacer Exchange for Treatment of Periprosthetic Joint Infection: Almost Half the Patients Subsequently Fail. J Arthroplasty. 2022;37(1): 150-155. doi: 10.1016/j.arth.2021.08.028.
Божкова С.А., Тихилов Р.М., Шубняков И.И., Борисов А.М., Мидаев А.И. Роль рутинного дооперационного обследования в выявлении перипро- тезной инфекции и ее рецидива при ревизионном эндопротезировании тазобедренного сустава. Хирургия. Журнал им. Н.И. Пирогова. 2022;(5):68-74. doi: 10.17116/hirurgia202205168.
Сведения об авторах
И Мурылев Валерий Юрьевич — д-р мед. наук, профессор
Парвизи Джавад — д-р мед. наук, профессор
Руднев Александр Игоревич
Куковенко Григорий Андреевич — канд. мед. наук
Елизаров Павел Михайлович — канд. мед. наук
Музыченков Алексей Владимирович — канд. мед. наук
Алексеев Семен Сергеевич — канд. мед. наук
Ерохин Николай Евгеньевич
Яковлев Константин Гарриевич
Теги: инфекции тазобедренного сустава
234567 Начало активности (дата): 04.01.2026
234567 Кем создан (ID): 989
234567 Ключевые слова: диагностика периимплантной инфекции тазобедренного сустава, рецидив инфекции, аспирация синовиальной жидкости, лабораторная диагностика периимплантной инфекции тазобедренного сустава, спейсер тазобедренного сустава, ревизионное эндопротезирование тазобедренного сустава
12354567899
Похожие статьи
Диагностика глубокой перипротезной инфекции тазобедренного суставаРентген на дому 8 495 22 555 6 8
Гематологические маркеры перипротезной инфекции при ревизионном эндопротезировании тазобедренного сустава
Анализ экономической и клинической эффективности одно- и двухэтапных ревизий при лечении перипротезной инфекции тазобедренного сустава (обзор литературы)
Лечение ранней глубокой парапротезной инфекции при эндопротезировании тазобедренного сустава



