 12.07.2025
12.07.2025
Анализ микробного пейзажа у пациентов с перипротезной инфекцией тазобедренного сустава
Концепция патогенеза перипротезной инфекции (ППИ) заключается в способности патогенных микроорганизмов колонизировать поверхности имплантатов, инфицирование которых осуществляется во время операции или гематогенной диссеминации бактерий
ВВЕДЕНИЕ
Концепция патогенеза перипротезной инфекции (ППИ) строится на динамическом равновесии взаимодействия импланта и иммунной системы человека [1]. Засев имплантов патогенными микроорганизмами осуществляется либо во время операции, либо при гематогенной диссеминации бактерий [2-6]. Многие бактерии формируют биопленки на металлических и полиэтиленовых поверхностях компонентов эндопротезов [2, 7-9]. Эта способность микроорганизмов (так называемых сесильных форм) обеспечивает их персистенцию и выживаемость в госпитальной среде. Кроме того, бактерии, устойчивые к противомикробным препаратам, оказываются устойчивы к ним и в форме биопленок, и в этом виде они становятся наименее уязвимыми для действия антибиотиков. [10, 11]. Длительное заживление послеоперационных костных ран зачастую связано с проникновением патогенов и возникновением в костной ткани микроабсцессов, колонизацией остеобластов [12-14]. Вместе с тем, существуют трудноизлечимые виды возбудителей ППИ, такие как штаммы стафилококков, резистентные к антибактериальным препаратам трех и более классов, фторхинолон-резистентные и карбапенем-резистентные грамотрицательные микроорганизмы, грибковая микрофлора [2, 15, 16]. Все вышеперечисленные факторы раскрывают причину неудовлетворительных результатов лечения ППИ и подчеркивают необходимость определения этиологии патологического процесса.
Цель работы — определить характер микробиологического пейзажа у пациентов c инфекцией, ассоциированной с ортопедическими имплантами тазобедренного сустава
Микробиологическая диагностика осуществляется методом выделения и идентификации возбудителя после забора материала из нескольких наиболее контаминированных пораженных тканей [17]. Для деструкции биопленки осуществляют обработку ультразвуком удаленных компонентов эндопротеза, с этой же целью возможно применение раствора дитиотреитола [18-21]. Время инкубации биопленочных бактерий составляет 14-21 день, что ведет к их более высокой выживаемости, в сравнении с моноинфекциями, у которых инкубационный период составляет 5-14 суток [22].
.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование проведено на материале, полученном от 147 пациентов (56 % мужчин и 44 % женщин) после ревизионных операций по поводу перипротезной инфекции тазобедренного сустава. Возраст пациентов составил (54,7 ± 12,7) г. Число образцов исследования — 294. У 105 (71 %) пациентов наблюдали свищевую форму ППИ сустава, у 29 (20 %) отмечали гиперемию, отек в области послеоперационного шва, в 13 (9 %) случаях имелись открытые раны. У 28 (19 %) пациентов наблюдали острое течение инфекционного процесса (продолжительность инфекции в среднем 21,8 дн., Me — 22; 95 % ДИ от 19,7 до 24,0) и у 119 (81 %) — хроническое (продолжительность инфекции в среднем 26,3 мес., Me — 13; 95 % ДИ от 20,5 до 32,3).
В 114 (78 %) случаях гнойно-воспалительное осложнение развилось после первичного эндопротезирования и лишь в 33 (22 %) случаях — после ревизионного вмешательства. Лечебный процесс в значительной степени усложняло тяжелое коморбидное состояние пациентов по шкале ASA (англ.: American Society of Anesthesiology), выявленное у 82 (56 %) больных.
Объектом исследования служили образцы костных и мягких тканей, полученных при иссечении инфицированного сустава, а также удаленные элементы эндопротеза пациентов с ППИ тазобедренного сустава. На основе рекомендованных методов, посев производили на плотные питательные среды (желчно-солевой агар, агар Сабуро, среда Левина, колумбийский агар и питательный агар с 5 % бараньей крови). Образцы помещали в термостат и инкубировали при 37 °С в течение 24-48 ч. Подсчитывали количество колоний в чашках Петри, полученный результат переводили в десятичный логарифм, выражая в КОЕ/мл. Для создания анаэробных условий использовали газогенераторные пакеты «Анаэ- рогаз», выращивая грибковую флору в течение 5 сут. при температуре 30 °С.
Изучая бактериальные культуры, их идентифицировали общепринятыми методами, а также используя бактериологические анализаторы TB Expression (BioMerieux, Франция) и Walk Away 40 (США).
Статистическая обработка данных выполнена с помощью пакета программ Statistica for Windows, v. 13.0 (Stat Soft Inc., США) и Microsoft Excel (Microsoft, США). Для характеристики микробиологического спектра выполнены процентные расчеты. Описательные статистические результаты представляли собой среднее значение ± стандартная ошибка ^Е) для количественных данных. Распределение данных анализировали с помощью тестов нормальности Шапиро - Уилка и Колмогорова - Смирнова. Сравнение между несвязанными выборками проводили с использованием критерия Манна - Уитни. Различия считали значимыми при p < 0,05.
РЕЗУЛЬТАТЫ
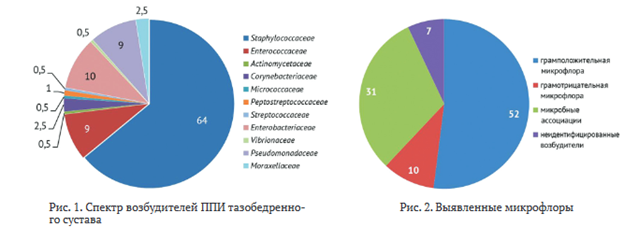
В интраоперационном биологическом материале выделено 196 штаммов патогенных микроорганизмов, спектр которых представлен на рис. 1. Доминирование семейства Staphylococcaceae было отмечено в 64 % случаев, значительную часть выделенных штаммов составляли также Enterobacteriaceae (10 %), Enterococcaceae (9 %) и Pseudomonadaceae (9 %).
В 39 наблюдениях (20 %) выявлены MRSA и MRSE, в 17 (9 %) — Р. aeruginosa (рис. 1).
Идентификация микроорганизмов для верификации таксономической принадлежности патогенных бактерий показала, что среди выделенных и идентифицированных бактерий основную часть микрофлоры составило семейство Staphylococcaceae с преобладанием штаммов Staphylococcus aureus, Staphylococcus epidermidis и Staphylococcus saprophyticus.
У 137 пациентов (93 %) микрофлора идентифицирована, однако у 10 пациентов идентифицировать возбудителей не удалось. У 76 пациентов (52 %) определяли изоляты грамположительной микрофлоры, у 15 пациентов (10 %) — грамотрицательная микрофлора в монокультуре. У 46 пациентов (31 %) наблюдали наличие микробных ассоциаций (рис. 2).
Следует отметить, что в 22 % случаев, т.е. у 17 из 76 пациентов с изолированной грамположительной микрофлорой (доминирующим штаммом золотистого, а также эпидермальным стафилококком) произошел рецидив гнойно-воспалительного процесса. Повторное нагноение у 15 пациентов с грамо- трицательной микрофлорой (представленной преимущественно штаммами Pseudomonas aeruginosa) отмечено только в двух случаях (13 %). Наиболее часто в составе полимикробной инфекции выделялись семейства Staphylococcaceae (78 %), Enterobacteriaceae (28 %), Enterowccaceae (26 %), Pseudomоnadaceae (15 %) и Moraxellaceae (6,5 %).
Очевидно в результате предшествующей терапии антибактериальными препаратами, у пациентов с ППИ достаточно распространены и занимают второе место после грампозитивной микрофлоры полимикробные ассоциации. Микробная ассоциация из двух агентов выявлена у 34 пациентов (74 %), из трех агентов — у 11 (24 %). Рост четырех микроорганизмов выявлен у одного больного.
Общее количество пациентов с рецидивом инфекционного процесса при наличии микробных ассоциаций составило 19 человек (41 % наблюдений), что было самым высоким числом осложнений. С целью купирования воспалительного процесса шести пациентам с рецидивированием инфекции проводили повторную хирургическую обработку, восьми пациентам осуществили замену спейсера, остальным — резекционную артропластику.
При не идентифицированном составе микрофлоры у двух из 10 пациентов произошло повторное нагноение в период нахождения в стационаре. Этим пациентам проведено двухэтапное ревизионное вмешательство.
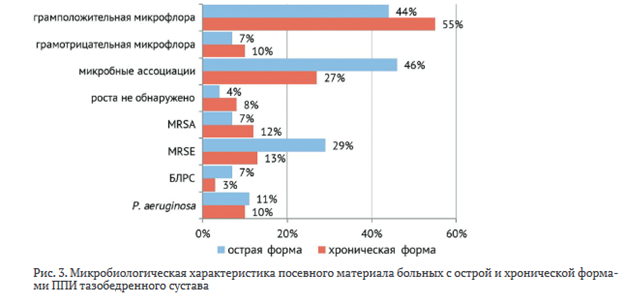
Сравнительная оценка результатов интраоперационного исследования микробиологического спектра возбудителей у пациентов с острой и хронической формами имплант-ассоциированной инфекции представлена на рис. 3.
В структуре оперативных вмешательств по поводу ППИ у 28 (19 %) пациентов манифестация инфекции составила 22 дн. (МКИ-17 — 27,5 дн.), а у 119 пациентов продолжительность гнойного процесса составила 26 мес. (8-35 мес.).
В структуре микробного пейзажа пациентов с острой и хронической формами инфекционного процесса вклад изолированной грамположительной (44 % и 55 %) и грамотрицательной (7 % и 10 %) микрофлоры был сопоставим (рис. 3). Однако отмечено, что микробные ассоциации и MRSE штаммы статистически значимо (р < 0,05) чаще встречались у пациентов с острой формой инфекционного процесса. Метициллин-резистентные штаммы эпидермального стафилококка являлись причиной развития острого инфекционного процесса практически в каждом третьем случае (29 %). В целом, рецидив случился у 7 (25 %) пациентов с острым и у 39 (33 %) пациентов с хроническим вариантом течения инфекционного процесса ППИ. грамположительная микрофлора грамотрицательная микрофлора микробные ассоциации роста не обнаружено MRSA MRSE Б/1РС Р. aeruginosa
ОБСУЖДЕНИЕ
Оценивая микробный пейзаж пациентов с имплант-ассоциированной инфекцией, следует заметить, что клетки микроорганизмов, особенно в условиях биопленок, приобретают все более выраженную резистентность к противомикробным препаратам. Это, в свою очередь, требует новых подходов к оценке рисков и лечению инфекционного процесса, развившегося после эндопротезирования тазобедренных суставов. В течение всего срока нахождения в организме ортопедического импланта сохраняется риск развития ППИ, основными возбудителями которой являются грамположительные бактерии (чаще всего золотистый и эпидермальный стафилококки), характеризующиеся ростом резистентных штаммов [23-26]. Отсутствие мишеней для проявления действия антимикробной терапии у многих грамположительных микроорганизмов приводит к отсутствию контроля над резистентными штаммами, вызывая закономерную тревогу лечащих врачей, что нашло свое отражение, как в отечественных, так и в зарубежных публикациях [27-30].
Второй по значимости этиологической причиной нагноения эндопротезов является полимикробная инфекция. Частота встречаемости полимикробной инфекции имеет тенденцию к росту, мы наблюдали ее в 31 % случаев.
Полимикробная инфекция у наших пациентов представлена предсказуемым спектром: Staphylococcaceae — 78 %, Enterobacteriaceae — 28 %, Enterococcaceae — 26 %, Pseudomonadaceae — 15 % и Moraxellaceae — 6,5 %. Такая клиническая ситуация усложняет выбор адекватного режима антибиотикотерапии и, зачастую, приводит к худшим исходам в сравнении с ППИ с мономикробной микрофлорой, что отмечалось и в литературных источниках [31, 32].
Ряд исследователей указывают на необходимость учитывать экспрессию патогенности микроорганизмов, а также их способность к биопленкообразованию [33-37], в связи с чем определение спектра возбудителей ППИ приобретает большое значение.
У больных в нашем исследовании не выявлена грибковая микрофлора, но в зарубежных публикациях уделяется внимание грибковым инфекциям, которые встречаются в 1-4 % случаев, подавляющую их часть (80 %) составляют грибы рода Candida [38, 39]. Данная проблема характерна для иммуноком- проментированных больных [40, 41].
Проведенное микробиологическое исследование перипротезных тканей выявило этиологию инфекционного процесса в подавляющем большинстве (93 %) исследованных случаев. Наиболее частой причиной неидентификации возбудителя, очевидно, являлся прием антибактериальных препаратов до обнаружения патогена.
ЗАКЛЮЧЕНИЕ
Преимущественной причиной развития ППИ являются грампозитивная микрофлора и микробные ассоциации. Достоверные различия у больных с острым и хроническим типом ППИ отмечались по уровню микробных ассоциаций и присутствию штаммов MRSE c трендом на доминирование в группе с острым характером воспаления.
СПИСОК ИСТОЧНИКОВ
Zimmerli W. Infection and musculoskeletal conditions: Prosthetic-joint-associated infections. Best Pract Res Clin Rheumatol. 2006;20(6):1045-1063. doi: 10.1016/j.berh.2006.08.003.
Шералиев Т.У., Федоров Е.А., Гольник В.Н., Павлов В.В. Перипротезная инфекция при эндопротезировании тазобедренного сустава: особенности современной этиологии, проблемы и перспективы диагностики: монография. Красноярск: Научно-инновационный центр; 2021:230. doi: 10.12731/978-5-907208-50-6.
Bertani A, Drouin C, Demortiere E, et al. A prosthetic joint infection caused by Streptococcus pneumoniae: a case report and review of the literature. Rev Chir Orthop Reparatrice Appar Mot. 2006 Oct;92(6):610-614. (In French) doi: 10.1016/s0035-1040(06)75921-9.
Zeller V, Lavigne M, Leclerc P, et al. Group B streptococcal prosthetic joint infections: a retrospective study of 30 cases. Presse Med. 2009;38(11):1577-1484. doi: 10.1016/j.lpm.2009.02.026.
Винклер Т., Трампуш А., Ренц Н. и др. Классификация и алгоритм диагностики и лечения перипротезной инфекции тазобедренного сустава. Травматология и ортопедия России. 2016;22(1):33-45. doi: 10.21823/2311-2905-2016-0-1-33-45.
Renaud A, Lavigne M, Vendittoli PA. Periprosthetic joint infections at a teaching hospital in 1990-2007. Can JSurg. 2012;55(6):394-400. doi: 10.1503/cjs.033610.
Афиногенова А.Г. Даровская Е.Н. Микробные биопленки ран: состояние вопроса. Травматология и ортопедия России. 2011;17(3):119-125. doi: 10.21823/2311-2905-2011-0-3-119-125.
Божкова С.А. Современные принципы диагностики и антибактериальной терапии инфекции протезированных суставов (обзор литературы). Травматология и ортопедия России. 2011;17(3):126-136. doi: 10.21823/2311-2905-2011-0-3-126-136.
Gristina AG, Naylor P, Myrvik Q. Infections from biomaterials and implants: a race for the surface. Med Prog Technol. 1988-1989;14(3-4):205-224.
Gonzalez Moreno M, Trampuz A, Di Luca M. Synergistic antibiotic activity against planktonic and biofilm-embedded Streptococcus agalactiae, Streptococcus pyogenes and Streptococcus oralis. J Antimicrob Chemother. 2017;72(11):3085-3092. doi: 10.1093/jac/ dkx265.
Molina-Manso D, del Prado G, Ortiz-Perez A, et al. In vitro susceptibility to antibiotics of staphylococci in biofilms isolated from orthopaedic infections. Int J Antimicrob Agents. 2013;41(6):521-523. doi: 10.1016/j.ijantimicag.2013.02.018.
Masters EA, Trombetta RP, de Mesy Bentley KL, et al. Evolving concepts in bone infection: redefining "biofilm", "acute vs. chronic osteomyelitis", "the immune proteome" and "local antibiotic therapy". Bone Res. 2019;7:20. doi: 10.1038/s41413-019-0061-z.
Garzoni C, Kelley WL. Return of the Trojan horse: intracellular phenotype switching and immune evasion by Staphylococcus aureus. EMBO Mol Med. 2011;3(3):115-7. doi: 10.1002/emmm.201100123.
Nelson CL, McLaren AC, McLaren SG, et al. Is aseptic loosening truly aseptic? Clin Orthop RelatRes. 2005;(437):25-30. doi: 10.1097/01. blo.0000175715.68624.3d.
Тихилов Р.М., Божкова С.А., Артюх В.А. Перипротезная инфекция в области крупных суставов конечностей. Клинические рекомендации. В кн.: Ортопедия: клинические рекомендации. Под ред. С.П. Миронова. М.: ГЭОТАР-Медиа; 2018:719-746.
Ливенцов В.Н., Божкова, А.Ю., Кочиш В.Н. и др. Трудноизлечимая перипротезная инфекция тазобедренного сустава: результаты санирующих операций. Травматология и ортопедия России. 2019;25(4):88-97. doi: 10.21823/2311-2905-2019-25-4-88-97.
Gelalis ID, Arnaoutoglou CM, Politis AN, et al. Bacterial wound contamination during simple and complex spinal procedures. A prospective clinical study. Spine J. 2011;11(11):1042-1048. doi: 10.1016/j.spinee.2011.10.015.
Corvec S, Portillo ME, Pasticci BM, et al. Epidemiology and new developments in the diagnosis of prosthetic joint infection. Int J Artif Organs. 2012;35(10):923-934. doi: 10.5301/ijao.5000168.
Schmolders J, Hischebeth GT, Friedrich MJ, et al. Evidence of MRSE on a gentamicin and vancomycin impregnated polymethylmethacrylate (PMMA) bone cement spacer after two-stage exchange arthroplasty due to periprosthetic joint infection of the knee. BMC Infect Dis. 2014;14:144. doi: 10.1186/1471-2334-14-144.
Holinka J, Bauer L, Hirschl AM, et al. Sonication cultures of explanted components as an add-on test to routinely conducted microbiological diagnostics improve pathogen detection. J Orthop Res. 2011;29(4):617-522. doi: 10.1002/jor.21286.
Dudareva M, Barrett L, Figtree M, et al. Sonication versus Tissue Sampling for Diagnosis of Prosthetic Joint and Other Orthopedic Device-Related Infections. J Clin Microbiol. 2018;56(12):e00688-18. doi: 10.1128/JCM.00688-18.
Ji B, Xu E, Cao L, et al. The method and result analyses of pathogenic bacteria culture on chronic periprosthetic joint infection after total knee arthroplasty and total hip arthroplasty. Zhonghua Wai Ke Za Zhi. 2015;53(2):130-134. (In Chin).
Божкова С.А., Касимова А.Р., Тихилов Р.М. и др. Неблагоприятные тенденции в этиологии ортопедической инфекции: результаты 6-летнего мониторинга структуры и резистентности ведущих возбудителей. Травматология и ортопедия России. 2018;24(4):20-31. doi: 10.21823/2311-2905-2018-24-4-20-31.
Божкова С.А., Краснова М.В., Полякова Е.М. и др. Способность к формированию биопленок у клинических штаммов S. aureus и S. epidermidis - ведущих возбудителей ортопедической имплант-ассоциированной инфекции. Клиническая микробиология, антимикробная химиотерапия. 2014;16(2):149-156.
Font-Vizcarra L, Tornero E, Bori G, et al. Relationship between intraoperative cultures during hip arthroplasty, obesity, and the risk of early prosthetic joint infection: a prospective study of428 patients. Int J Artif Organs. 2011;34(9):870-875. doi: 10.5301/ijao.5000026.
Crowe B, Payne A, Evangelista PJ, et al. Risk Factors for Infection Following Total Knee Arthroplasty: A Series of 3836 Cases from One Institution. J Arthroplasty. 2015;30(12):2275-2278. doi: 10.1016/j.arth.2015.06.058.
Salgado CD, Dash S, Cantey JR, Marculescu CE. Higher risk of failure of methicillin-resistant Staphylococcus aureus prosthetic joint infections. Clin Orthop Relat Res. 2007;461:48-53. doi: 10.1097/BLG.0b013e318n23d4e.
Spiegl U, Patzold R, Friederichs J, et al. Risk factors for failed cleansing following periprosthetic delayed hip prosthesis infection. Orthopade. 2012 Jun;41(6):459-466. (In German) doi: 10.1007/s00132-012-1936-5.
Kurd MF, Ghanem E, Steinbrecher J, Parvizi J. Two-stage exchange knee arthroplasty: does resistance of the infecting organism influence the outcome? Clin Orthop Relat Res. 2010;468(8):2060-2066. doi: 10.1007/s11999-010-1296-6.
Dieckmann R, Schulz D, Gosheger G, et al. Two-stage hip revision arthroplasty with a hexagonal modular cementless stem in cases of periprosthetic infection. BMC MusculoskeletDisord. 2014;15:398. doi: 10.1186/1471-2474-15-398.
Marculescu CE, Cantey JR. Polymicrobial prosthetic joint infections: risk factors and outcome. Clin Orthop Relat Res. 2008;466(6):1397-1404. doi: 10.1007/s11999-008-0230-7.
Tsaras G, Maduka-Ezeh A, Inwards CY, et al. Utility of intraoperative frozen section histopathology in the diagnosis of periprosthetic joint infection: a systematic review and meta-analysis. J Bone Joint Surg Am. 2012;94(18):1700-1711. doi: 10.2106/JBJS.J.00756.
Garrido-Gomez J, Arrabal-Polo MA, Giron-Prieto MS, et al. Descriptive analysis of the economic costs of periprosthetic joint infection of the knee for the public health system of Andalusia. J Arthroplasty. 2013;28(7):1057-1060. doi: 10.1016/j.arth.2013.02.012.
Padegimas EM, Maltenfort M, Ramsey ML, et al. Periprosthetic shoulder infection in the United States: incidence and economic burden. J Shoulder Elbow Surg. 2015;24(5):741-746. doi: 10.1016/j.jse.2014.11.044.
Schwarz EM, Parvizi J, Gehrke T, et al. 2018 International Consensus Meeting on Musculoskeletal Infection: Research Priorities from the General Assembly Questions. J Orthop Res. 2019;37(5):997-1006. doi: 10.1002/jor.24293.
Niska JA, Meganck JA, Pribaz JR, et al. Monitoring bacterial burden, inflammation and bone damage longitudinally using optical and pCT imaging in an orthopaedic implant infection in mice. PLoS One. 2012;7(10):e47397. doi: 10.1371/journal.pone.0047397.
Шипицына И., Осипова Е. Анализ качественного и количественного состава ассоциаций микроорганизмов, выделенных из гнойного очага, у пациентов с хроническим остеомиелитом за трехлетний период. Гений ортопедии. 2022;28(6):788-793. doi: 10.18019/1028-4427-2022-28-6-788-793.
Bori G, McNally MA, Athanasou N. Histopathology in Periprosthetic Joint Infection: When Will the Morphomolecular Diagnosis Be a Reality? BiomedRes Int. 2018;2018:1412701. doi: 10.1155/2018/1412701.
Wiwattanawarang N. Fungal periprosthetic joint infection after total knee arthroplasty. J Med Assoc Thai. 2014 Dec;97(12):1358-1363.
Jakobs O, Schoof B, Klatte TO, et al. Fungal periprosthetic joint infection in total knee arthroplasty: a systematic review. Orthop Rev (Pavia). 2015;7(1):5623. doi: 10.4081/or.2015.5623.
Информация об авторах:
Артем Михайлович Ермаков — доктор медицинских наук, руководитель Клиники, научный сотрудник
Наталья Александровна Богданова — заведующая лабораторией
Елена Леонидовна Матвеева — доктор биологических наук, ведущий научный сотрудник
Теги: инфекция
234567 Начало активности (дата): 12.07.2025
234567 Кем создан (ID): 989
234567 Ключевые слова: перипротезная инфекция, микрофлора, воспаление, эндопротезирование
12354567899
Похожие статьи
Пульмонолог заявила о важности очищения легкихРентген на дому 8 495 22 555 6 8
Эффективное сочетание методов артроскопической и малоинвазивной хирургии при хронической заднелатеральной нестабильности локтевого сустава
Результаты реконструктивной хирургии конечностей с использованием телескопического титанового стержня
Высвобождение антибиотиков из материалов для замещения постостеомиелитических дефектов кости



