 28.09.2024
28.09.2024
Безопасность применения продленной седации севофлураном у пациентов с тяжелой черепно-мозговой травмой
На основании полученных данных можно сделать вывод о безопасности применения ингаляционной седации у данной категории пациентов, а также об отсутствии значимого влияния севофлурана на уровень внутричерепного давления и показатели центральной гемодинамики
Введение
Черепно-мозговая травма (ЧМТ) — одна из важнейших проблем современного здравоохранения, относящаяся к трем ведущим причинам смертности в мире [1]. Для анестезиологии и реаниматологии особую актуальность имеет вопрос интенсивной терапии пациентов с травматическими повреждениями, в том числе головного мозга [2]. В России ежегодно регистрируется около 600 000 случаев ЧМТ. В случае повреждений легкой и средней степени тяжести летальность может составлять от 1,5 до 3,5%, при тяжелых формах — 1525%, а при крайне тяжелых и вовсе достигает 60% [3]. Высокая степень инвалидизации (около 100-150 человек на 100 000 населения) [4], а также высокая летальность преимущественно среди людей трудоспособного возраста является важной социально-экономической проблемой, требующей поиска актуальных и современных решений [5].
Цель. На примере клинических наблюдений продемонстрировать безопасность применения ингаляци
Зачастую течение ЧМТ осложняется развитием дыхательной недостаточности. Поврежденная ткань головного мозга крайне чувствительна к гипоксии и гиперкапнии [6], что может привести ко вторичному гипоксическому повреждению. С целью профилактики данного осложнения рекомендуется незамедлительно выполнить протезирование функции дыхания [7]. Проведение искусственной вентиляции легких (ИВЛ) подразумевает начало седативной терапии для обеспечения комфорта самого пострадавшего. Также важными моментами является сокращение использования опиоидных анальгетиков, купирование психомоторного возбуждения, снижение метаболических потребностей головного мозга и безопасное проведение процедур. Доказано, что соблюдение данных условий позволяет уменьшить влияние повреждающих факторов и улучшить исходы травматической болезни у пострадавших в отделении реанимации и интенсивной терапии (ОРИТ) [8].
Традиционными внутривенными седативными препаратами являются пропофол и мидазолам [9, 10], однако продолжительное их использование сопряжено с рядом проблем, которые могут отрицательно повлиять на лечение пациентов [11-13]. Способность пропофола негативно влиять на нервную ткань уже доказана с 2016 года [14], однако отсутствие четких указаний по поводу метода проведения седации в рекомендациях МЗ РФ оставляет открытым вопрос выбора препарата [15, 16]. Из современных препаратов также можно отметить дексмедетомидин, применяемый для умеренной седации при широком спектре патологий [17, 18]. Тем не менее, когда речь идет о необходимости тотальной миоплегии и поддержании более глубоких уровней седации (BIS<60), эффективность Дексдора значительно уступает более ранним препаратам [19]. Отдельно стоит отметить, что применение седативных препаратов для коррекции внутричерепной гипертензии (ВЧГ) является методом с весьма слабой доказательной базой, а уровень седации оказывает на показатели ВЧД большее значение, чем эффект того или иного препарата [20, 21].
С начала 2000-х годов в Европе, а позднее и в Российской Федерации, прошло сертификацию устройство для ингаляционной седации AnaConDa (The Anaesthetic Conserving Device), позволяющее комфортно и безопасно использовать ингаляционные анестетики в условиях ОРИТ [22]. Однако результаты использования галогенсодержащих препаратов в нейрореаниматологии на данном этапе не однозначны. Так, у пациентов с массивным субарахноидальным кровоизлиянием (САК) вследствие разрыва церебральной аневризмы (Fisher IV) на фоне продленной седации изофлураном в послеоперационном периоде не отмечалось значимого повышения ВЧД.
Напротив, улучшение регионального мозгового кровотока и снижение потребности мозга в кислороде в остром периоде благотворно влияло на течение заболевания с развитием церебрального ангиоспазма [23, 24]. В своей работе, опубликованной в 2015 году, J.C. Purrucker et al. небезосновательно обращают внимание на сложность в интерпретации повышения ВЧД у пациентов с внутричерепными кровоизлияниями из-за наличия различных факторов, влияющих на показатели жизнедеятельности человека [25].
Отличительная особенность ингаляционных анестетиков — это реализация органопротективных свойств за счет фосфорилирования активного фермента гликоген-синтазы-киназы 3р (ГСК-3Р) [26, 27]. Исследования на экспериментальных животных доказывают снижение зоны повреждения головного мозга благодаря использованию летучих анестетиков при индуцированном церебральном повреждении [28, 29]. Безусловно, применение ингаляционных анестетиков не является полной альтернативой классическим внутривенным препаратам, однако как метод безопасной продленной седации ингаляционные анестетики безусловно заслуживают права на рассмотрение.
Клиническое наблюдение № 1
Пациент Б., 41 год. Был найден на улице в бессознательном состоянии и доставлен в стационар бригадой скорой медицинской помощи. На момент поступления обращают на себя внимание выраженная церебральная недостаточность с угнетением уровня сознания до 8 баллов по шкале комы Глазго (ШКГ), а также респираторные нарушения. С целью протекции дыхательной системы и предотвращения возможного вторичного повреждения головного мозга и аспирации пациенту была выполнена оротрахеальная интубация трахеи с переводом на ИВЛ. Проводилась комплексная интенсивная терапия, направленная на стабилизацию витальных функций организма и коррекцию нарастающей ВЧГ.
Несмотря на это, отмечено развитие триады Кушинга: системная гемодинамика с тенденцией к гипертензии до 170/100 мм рт.ст., частота сердечных сокращений (ЧСС) со склонностью к брадикардии от 50 до 60 в минуту, развитие тахипноэ и асинхронии с респиратором.
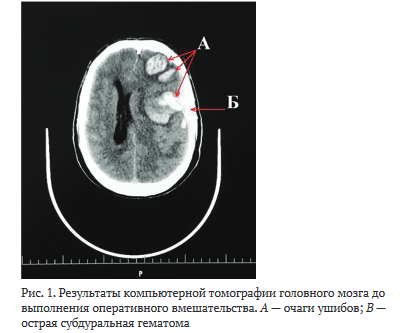
По результатам инструментальной диагностики, включавшей компьютерную томографию (КТ) головного мозга (рис. 1), рентгенологические и ультразвуковые исследования, выставлен диагноз: «Закрытая ЧМТ. Перелом костей свода и основания черепа. Ушиб головного мозга тяжелой степени. Травматическое субарахноидальное кровоизлияние, острая субдуральная гематома в левой лобно-височной области 3 см3 с ушибами левых лобной, теменной и височной долей (65 см3), перелом свода и основания черепа, травматический САК, острая субдуральная гематома (СДГ) в левой лобно-височной области 3 см3». При расчете интегративных шкал: SOFA - 6 баллов, APACHE II - 18 баллов (прогнозируемая летальность 25%).
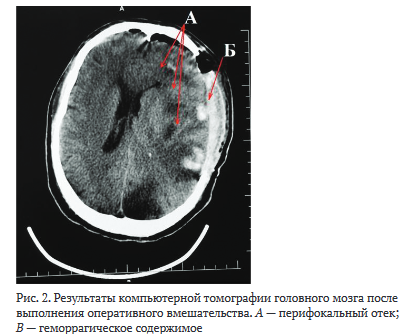
Учитывая характер повреждения, пациенту с целью предотвращения развития жизнеугрожающей дислокации и отека головного мозга было выставлено показание к экстренному оперативному вмешательству в объеме декомпрессивной трепанации черепа, удаления очагов ушиба и свободной пластики твердой мозговой оболочки (рис. 2). Интраоперационно выполнена установка вентрикулярного датчика ВЧД "Spiegelberg" (ВЧД на конец операции составило 9 мм рт.ст.)
При поступлении в ОРИТ для нейрохирургических больных общее состояние пациента оценивалось как тяжелое, проводилась ИВЛ с минутной вентиляцией 8,5 л/мин,
FiO2 50 % (SpO2 100%). Гемодинамика с тенденцией к гипотензии, сопровождающаяся умеренной синусовой тахикардией до 100-110 в минуту. Минимальные значения артериального давления (АД) 100/50 мм рт.ст., что было расценено как дополнительный фактор риска прогрессирования отека головного мозга, ввиду чего была начата инфузия раствора норадреналина с расчетной скоростью 0,2 мкг/кг/мин. На фоне проводимой терапии отмечалась относительная стабилизация гемодинамики, а средний уровень АД достиг целевых значений 80-100 мм рт.ст.
Интраоперационная анестезия проводилась с использованием севофлурана, с внутривенным болюсным введением пропофола с целью обеспечения адекватной седации на момент транспортировки. В отделении реанимации, уже в первые часы с момента поступления, было зафиксировано выраженное повышение ВЧД (25-26 мм рт.ст.), в связи с чем начата противоотечная терапия (15% раствор Маннитола 0,5 г/кг и умеренное углубление ингаляционной седации), а также позиционные методы коррекции. На фоне проводимых мероприятий удалось добиться стабилизации ВЧД на уровне 15-17 мм рт.ст. Использование севофлурана с концентрацией в конце выдоха 0,8—1,3 об.% (0,4-0,6 МАК) и пробуждением каждые 4-6 часов не приводило к значимому повышению ВЧД. Учитывая действующие рекомендации [20], эффективная консервативная коррекция и стойкое снижение ВЧД ниже 20 мм рт.ст. позволила не прибегать к более агрессивным методам. Еще одним мониторируемым показателем эффективности проводимой седации был коэффициент экстракции кислорода головным мозгом. Расчет данного показателя выполнялся по формуле:
K = SpO2 (а) - SpO2 (v),
где К - коэффициент экстракции, SpO2 (а) - сатурация артериальной крови, SpO2 (v) - сатурация крови из луковицы яремной вены.
Нормальные значения коэффициента экстракции кислорода для головного мозга составляют 25-45% (при условии адекватной SpO2 в луковицы яремной вены). Однако важно понимать, что данные отклонения SpO2 в «ретро-вене», а, соответственно, и значения коэффициента экстракции кислорода допустимы при наличии массивного очага ушиба и развившегося отека-ишемии головного мозга (табл. 1).
На 2-е сутки с момента поступления в ОРИТ отмечалась отрицательная динамика вследствие развития менингита с развитием инфекционно-токсических осложнений. В лабораторных показателях отмечался выраженный лейкоцитоз. Также отмечалось значительное повышение уровней С- реактивного белка (СРБ) и прокальцитонина (рис. 3), что в полной мере соответствовало присоединению бактериальных осложнений. Пациенту продолжено проведение ингаляционной седации севофлураном, а также назначена эмпирическая антибактериальная терапия широкого спектра действия согласно программе СКАТ (стратегия контроля антимикробной терапии).
Подтверждение вторичного менингита при контроле лабораторно-иструментальных исследований и посевов сред (pan-culture): воспалительные изменения клинического анализа ликвора и рост микроорганизмов в спинномозговой жидкости. Стоит отметить, что применение ингаляционной седации не приводило к неконтролируемой нестабильности гемодинамики, а также не влияло на показатели церебральной перфузии.
На фоне проводимой специфической и неспецифической терапии к 3-м суткам отмечается регресс лихорадки и снижение маркеров воспаления, отсутствие значимого повышения ВЧД, что, согласно временным промежуткам и клинической картине, позволило инициировать отказ от дальнейшей седации и прекратить использование севоф- лурана. Также на фоне регрессирования ВЧГ отмечалась стабилизация гемодинамики с постепенным снижением доз вазопрессорной поддержки, полный отказ от которой, из-за присоединения септических осложнений, стал возможен только к 7-м суткам (рис. 4). Однако ввиду тяжести церебральной дисфункции (уровень бодрствования 9 баллов по ШКГ и 9 баллов по FOUR) было принято решение о проведении продленной ИВЛ с выполнением временной трахеостомы. К 10-м суткам, на фоне регрессирования церебральной дисфункции, снижения интенсивности воспаления и стабилизации витальных функций и показателей газового состава крови (рис. 5) было начато плановое отлучение пациента от ИВЛ. На 20-е сутки, после выполнения необходимых
методов оценки функции глотания и дыхания, была выполнена успешная
деканюляция и продолжена активизация. Пациент переведен в профильное
отделение для прохождения дальнейшего этапа реабилитации спустя 21 сутки
пребывания в ОРИТ. Уровень сознания на момент перевода оценивается как
ясное, с элементами сенсомоторной афазии и правосторонней гемиплегией
(ШКГ - 3 балла, расширенная ШКГ - 4 балла).
Примечания: ИВЛ - искусственная вентиляция легких; МОД - минутный объем дыхания; а. - показатели в артериальной крови; Lac - лактат крови; MAP - среднее артериальное давление; P/F - респираторный индекс; рН - водородный показатель (показатель кислотности); рСО2 - напряжение углекислого газа крови; pO2 - напряжение кислорода крови; retro-v. - показатели в луковице яремной вены; SpO2 - сатурация (насыщение гемоглобина кислородом)
Пациентка К., 42 года. Доставлена в отделение реанимации и интенсивной терапии в крайне тяжелом, нестабильном состоянии с диагнозом «Закрытая ЧМТ с ушибом головного мозга, мягких тканей головы и параорбитальной гематомой слева». Тяжесть состояния обусловлена выраженной церебральной недостаточностью с угнетением уровня сознания до комы (ШКГ 6 баллов) и дыхательной недостаточностью (сатурация 78%, акроцианоз, частота дыхательных движений - ЧДД до 8 в минуту). Учитывая тяжесть состояния, было принято решение о переводе пострадавшей на ИВЛ. Параметры респиратора настроены с минутной объемной вентиляцией 8,7 л/мин и FiO2 50% (SpO2 100%). Исходная гемодинамика с тенденцией к гипертензии с максимальными значениями АД 145/110 мм рт.ст. и синусовой тахикардией до 130 в минуту. При проведении нейровизуализации выявлено наличие проникающей ЧМТ с острой СДГ в правой лобно-теменно-височной области, очагом ушиба и размозжения правой височной доли, переломом костей свода и основания черепа, лицевого скелета, микропневмоцефалии, осложнившихся жизнеугрожающей дислокацией головного мозга (рис. 6). Проведено экстренное оперативное вмешательство - декомпрессивная трепанация черепа, удаление острой СДГ 100 см3 и установка датчика ВЧД "Spiegelberg".
После выполнения оперативного вмешательства пациентка была доставлена в ОРИТ, где была продолжена ИВЛ с минутной вентиляцией 8,5 л/мин, FiO2 50% (SpO2 100%) (рис. 7). За время оперативного вмешательства, а также в раннем послеоперационном периоде отмечалась нестабильность гемодинамики, потребовавшая начала вазопрессорной терапии норадреналином с расчетной скоростью 0,3-0,45 мкг/кг/мин. Учитывая состояние пациентки, было принято решение о продленной медикаментозной седации с применением севофлурана. Интраоперационная анестезия также выполнялась с применением данного препарата, а ВЧД не превышало 8-9 мм рт.ст. После стабилизации показателей гемодинамики и достижения адекватной глубины седации в отделении интенсивной терапии, значение ВЧД составляло 7 мм рт.ст. На фоне проводимой терапии состояние пациентки было оценено как стабильно тяжелое, параметры респираторной поддержки корректировались согласно газовому составу крови, а вазопрессорной терапии - согласно показателям гемодинамики. При оценке тяжести состояния по данным интегративных шкал: SOFA 8 баллов, APACHE II - 19 баллов (прогнозируемая летальность 25%).
Тогда же ретроградно в луковицу яремной вены установлен катетер для динамической оценки церебральной оксигенации. Ингаляционная седация проводилась с концентрацией анестетика в конце выдоха 0,6-1,25 об.% (0,3-0,6 МАК). Учитывая тяжесть полученных повреждений, а также с целью лучшего ухода и дальнейшей активизации пациентки, было принято решение о раннем выполнении трахеостомы. Для обеспечения стабильного состояния пациентки, включая аналгезию, было продолжено применение севофлурана в комбинации с нестероидными противовоспалительными средствами (НПВС) и опиоидными анальгетиками по
необходимости. Спустя 36 часов ингаляционная седация отключена, а за
время ее проведения отмечена стабильность ВЧД и церебрального
метаболизма кислорода (табл. 2).
Уже после прекращения ингаляционной седации (рис. 8), к 3-м суткам, течение травмы осложнилось развитием посттравматического церебрального ангиоспазма, что потребовало изменения тактики контроля и поддержания церебрального перфузионного давления. Разнонаправленная динамика показателей экстракции кислорода в 1-м и во 2-м клинических наблюдениях связана с нарушениями ауторегуляции и с преобладанием ангиоспастического компонента в первые сутки у пациента № 1, в то время как у пациентки № 2 снижение потребления О2 к 36 часам было связано с «выключением» из метаболизма очага с необратимыми повреждениями (рис. 9). Также на 5-е сутки отмечалось повышение температуры тела до 39,3°С и маркеров воспаления (СРБ 215 мг/л). С целью исключения инфекции ЦНС выполнена диагностическая люмбальная пункция, по результатам которой был выставлен диагноз «Менингит» (цитоз - 853 кл. в 1 мкл, лактат - 5,6 ммоль/л, глюкоза 2,3 ммоль/л). Антибактериальная терапия скорректирована согласно программе СКАТ. На фоне проводимой консервативной терапии состояние пациентки с положительной динамикой, и уже к 13-м суткам данных за менингит не было. На 18-е сутки пациентка была переведена на самостоятельное дыхание через тра- хеостомическую трубку. На фоне восстановления уровня бодрствования до ясного сознания, частичного регресса левостороннего гемипареза и стабилизации витальных функций организма после оценки функции глотания произведена деканюляция трахеи, и на следующий день пациентка переведена в профильное отделение. Общее время пребывания в отделении реанимации составило 31 койкодень (ШКГ - 3 балла, расширенная ШКГ - 6 баллов).
ОБСУЖДЕНИЕ
На примере двух пациентов с тяжелой ЧМТ показаны результаты применения севофлурана в качестве продленной седативной терапии. Для динамического мониторинга рассматривались такие важные показатели, как ВДЧ, системная гемодинамика и церебральный метаболизм кислорода. В первом клиническом наблюдении даже при наличии исходной ВЧГ, потребовавшей медикаментозной коррекции, использование ингаляционного анестетика в течение 72 часов не привело к значимому повышению ВЧД. У пациентки второго клинического наблюдения на фоне проводимой ингаляции севофлураном в течение 36 часов исходно низкое ВЧД оставалось в пределах референсных значений. Не было выявлено и отрицательного влияния ингаляционной седации у пациентов в раннем послеоперационном периоде с присоединением вторичного инфекционного повреждения ЦНС на системную гемодинамику. Показатели газообмена нервной ткани в обоих случаях хоть и не находились в пределах физиологической нормы, однако соответствовали изменениям, характерным для течения данных заболеваний. Пациенты переведены из ОРИТ на дальнейшие этапы реабилитации в стабильном состоянии с выраженным регрессом неврологических нарушений.
ЗАКЛЮЧЕНИЕ
На основании полученных данных можно сделать вывод о возможности применения ингаляционной седации у данной категории пациентов, а также отметить отсутствие отрицательного влияния севофлурана на уровень внутричерепного давления и показатели центральной гемодинамики. Однако вторичные осложнения, развившиеся у пациентов, не позволяют сделать однозначный вывод о влиянии данного метода седации на
длительность искусственной вентиляции легких и их пребывание в отделении
реанимации и интенсивной терапии. Только накопление достаточного объема
клинического материала позволит выявить все преимущества и недостатки
данного метода.
СПИСОК ИСТОЧНИКОВ
Васильева Е.Б., Талыпов А.Э., Синкин М.В., Петриков С.С. Особенности клинического течения и прогноз исходов тяжелой черепно-мозговой травмы. Журнал им. Н.В. Склифосовского «Неотложная медицинская помощь». 2019;8(4):423-429.
Шабанов А.К., Картавенко В.И., Петриков С.С., Марутян З.Г., Розум- ный П.А., Черненькая Т.В. и др. Тяжелая сочетанная черепномозговая травма: особенности клинического течения и исходы. Журнал им. Н.В. Склифосовского «Неотложная медицинская помощь». 2017;6(4):324-330.
Крылов В.В., Иоффе Ю.С., Талыпов А.Э. 50 лет отделению неотложной нейрохирургии НИИ скорой помощи им. Н.В. Склифосовского. Нейрохирургия. 2010;(4):3-14.
Jiang JY, Gao GY, Feng JF, Mao Q, Chen LG, Yang XF, et al. Traumatic brain injury in China. Lancet Neurol. 2019;18(3):286-295. PMID: 30784557
Deng RM, Liu YC, Li JQ, Xu JG, Chen G. The role of carbon dioxide in acute brain injury. Med Gas Res. 2020;10(2)81-84. PMID: 32541133
Ошоров А.В., Савин И.А., Горячев А.С. Внутричерепная гипертензия: патофизиология, мониторинг, лечение: руководство для врачей. Москва: Волков А.А.; 2021.
Лихванцев В.В., Гребенчиков О.А., Скрипкин Ю.В., Улиткина О.Н., Бершадский Ф.Ф., Строителева Е.М. Ингаляционная седация у кардиохирургических больных в отделении интенсивной терапии. Вестник анестезиологии и реаниматологии. 2018;15(5):46-53.
Celis-Rodrfguez E, Diaz Cortes JC, Cardenas Bolivar YR, Carrizosa Gonzalez JA, Pinilla DI, Ferrer Zaccaro LE, et al. Evidence-based clinical practice guidelines for the management of sedoanalgesia and delirium in critically ill adult patients. Med Intensiva (Engl Ed). 2020;44(3):171- 184. PMID: 31492476
Russo G, Harrois A, Anstey J, Van Der Jagt M, Taccone F, Udy A, et al.; TBI Collaborative Investigators. Early sedation in traumatic brain injury: a multicentre international observational study. Crit Care Resusc. 2023;24(4):319-329. PMID: 38047010
Schlapfer M, Piegeler T, Dull RO, Schwartz DE, Mao M, Bonini MG, et al. Propofol increases morbidity and mortality in a rat model of sepsis. Crit Care. 2019;19(1):45.
Roberts RJ, Barletta JF, Fong JJ, Schumaker G, Kuper PJ, Papadopoulos S, at al. Incidence of propofol-related infusion syndrome in critically ill adults: a prospective, multicenter study. Crit Care. 2009;13(5):R169.
Schlapfer M, Piegeler T, Dull RO, Schwartz DE, Mao M, Bonini MG, at al. Propofol increases morbidity and mortality in a rat model of sepsis. Crit Care. 2015;19(1):45.
Woldegerima N, Rosenblatt K, Mintz CD. Neurotoxic Properties of Propofol Sedation Following Traumatic Brain Injury. Crit Care Med. 2016;44(2):455-456. PMID: 26771796
Cioccari L, Luethi N, Bailey M, Shehabi Y, Howe B, Messmer AS, et al; ANZICS Clinical Trials Group and the SPICE III Investigators. The effect of dexmedetomidine on vasopressor requirements in patients with septic shock: a subgroup analysis of the Sedation Practice in Intensive Care Evaluation [SPICE III] Trial. Crit Care. 2020;24(1):441. PMID: 32678054
Likhvantsev VV, Landoni G, Levikov DI, Grebenchikov OA, Skripkin YV, Cherpakov RA. Sevoflurane Versus Total Intravenous Anesthesia for Isolated Coronary Artery Bypass Surgery with Cardiopulmonary Bypass: A Randomized Trial. J
Cardiothorac Vasc Anesth. 2016;30(5):1221-1227. PMID: 27431595
Abou El Fadl MH, O’Phelan KH. Management of Traumatic Brain Injury: An Update. Neurosurg Clin N Am. 2018;29(2):213-221.
Ассоциации нейрохирургов России. Очаговая травма головного мозга. Клинические рекомендации. Москва; 2022.
Froese L, Dian J, Gomez A, Zeiler FA. Sedation and cerebrovascular reactivity in traumatic brain injury: another potential avenue for personalized approaches in neurocritical care? Acta Neurochir (Wien). 2021;163(5):1383-1389.
Гребенчиков О.А., Кулабухов В.В., Шабанов А.К., Игнатенко О.В., Антонова В.В., Черпаков Р.А. и др. Перспективы применения ингаляционной седации в интенсивной терапии. Анестезиология и реаниматология. 2022;(3):84-94.
Villa F, Iacca C, Molinari AF, Giussani C, Aletti G, Pesenti A., at al. Inhalation versus endovenous sedation in subarachnoid hemorrhage patients: effects on regional cerebral blood flow. Crit Care Med. 2012;40(10):2797-2804. PMID: 22824929
Bosel J, Purrucker JC, Nowak F, Renzland J, Schiller P, Perez EB, et al. Volatile isoflurane sedation in cerebrovascular intensive care patients using AnaConDa®: effects on cerebral oxygenation, circulation, and pressure. Intensive Care Med. 2012;38(12):1955-1964. PMID: 23096426
Purrucker JC, Renzland J, Uhlmann L, Bruckner T, Hacke W, Steiner T., at al. Volatile sedation with sevoflurane in intensive care patients with acute stroke or subarachnoid haemorrhage using AnaConDa®: an observational study. Br J Anaesth. 2015;114(6):934-943. PMID: 25823541
Zheng S, Zuo Z. Isoflurane preconditioning induces neuroprotection against ischemia via activation of p38 mitogen-activated protein kinases. Mol Pharmacol. 2004;65(5):1172-1180. PMID: 15102945
Chi OZ, Hunter C, Liu X, Weiss HR. The effects of isoflurane pretreatment on cerebral blood flow, capillary permeability, and oxygen consumption in focal cerebral ischemia in rats. Anesth Analg. 2010;110(5):1412-1418. PMID: 20304986
Kitano H, Kirsch JR, Hurn PD, Murphy SJ. Inhalational anesthetics as neuroprotectants or chemical preconditioning agents in ischemic brain. J Cereb Blood Flow Metab. 2007;27(6):1108-1128.
Wang Z, Li J, Wang A, Wang Z, Wang J, Yuan J, et al. Sevoflurane Inhibits Traumatic Brain Injury-Induced Neuron Apoptosis via EZH2- Downregulated KLF4/p38 Axis. Front Cell Dev Biol. 2021;4(9):658720.
Journal Emergency Medical Care. 2017;6(4):324-330. (In Russ.) https:// doi.org/10.23934/2223-9022-2017-6-4-324-330
Korolev VM, Poshatayev KE. Efficiency of Implementation of the Program for Traffic Safety in Khabarovsk Territory. Bulletin of Neurology, Psychiatry and Neurosurgery. 2014;(11):62-65 (In Russ.)
Jiang JY, Gao GY, Feng JF, Mao Q, Chen LG, Yang XF, et al. Traumatic brain injury in China. Lancet Neurol. 2019;18(3):286-295.
Deng RM, Liu YC, Li JQ, Xu JG, Chen G. The role of carbon dioxide in acute brain injury. Med Gas Res. 2020;10(2)81-84.
Oshorov AV, Savin IA, Goryachev AS. Vnutricherepnaya gipertenziya: patofiziologiya, monitoring, lechenie. Moscow: Volkov AA; 2021. (In Russ.)
Celis-Rodrfguez E, Diaz Cortes JC, Cardenas Bolivar YR, Carrizosa Gonzalez JA, Pinilla DI, Ferrer Zaccaro LE, et al. Evidence-based clinical practice guidelines for the management of sedoanalgesia and delirium in critically ill adult patients. Med Intensiva (Engl Ed). 2020;44(3):171- 184
Russo G, Harrois A, Anstey J, Van Der Jagt M, Taccone F, Udy A, et al.; TBI Collaborative Investigators. Early sedation in traumatic brain injury: a multicentre international observational study. Crit Care Resusc. 2023;24(4):319-329. PMID: 38047010
Schlapfer M, Piegeler T, Dull RO, Schwartz DE, Mao M, Bonini MG, et al. Propofol increases morbidity and mortality in a rat model of sepsis. Crit Care. 2019;19(1):45.
Roberts RJ, Barletta JF, Fong JJ, Schumaker G, Kuper PJ, Papadopoulos S, at al. Incidence of propofol-related infusion syndrome in critically ill adults: a prospective, multicenter study. Crit Care. 2009;13(5):R169.
Schlapfer M, Piegeler T, Dull RO, Schwartz DE, Mao M, Bonini MG, at al. Propofol increases morbidity and mortality in a rat model of sepsis. Crit Care. 2015;19(1):45.
Woldegerima N, Rosenblatt K, Mintz CD. Neurotoxic Properties of Propofol Sedation Following Traumatic Brain Injury. Crit Care Med. 2016;44(2):455-456.
Potapov AA, Krylov VV, Gavrilov AG, Kravchuk AD, Likhterman LB, Petrikov SS, et al. Guidelines for the diagnosis and treatment of severe traumatic brain injury. Part 2. Intensive care and neuromonitoring. Burdenko’s Journal of Neurosurgery. 2016;80(1):98-106.
Cioccari L, Luethi N, Bailey M, Shehabi Y, Howe B, Messmer AS, et al; ANZICS Clinical Trials Group and the SPICE III Investigators. The effect of dexmedetomidine on vasopressor requirements in patients with septic shock: a subgroup analysis of the Sedation Practice in Intensive Care Evaluation [SPICE III] Trial. Crit Care. 2020;24(1):441. PMID: 32678054
Likhvantsev VV, Landoni G, Levikov DI, Grebenchikov OA, Skripkin YV, Cherpakov RA. Sevoflurane Versus Total Intravenous Anesthesia for Isolated Coronary Artery Bypass Surgery with Cardiopulmonary Bypass: A Randomized Trial. J Cardiothorac Vasc Anesth. 2016;30(5):1221-1227.
Assotsiatsii neyrokhirurgov Rossii. Ochagovaya travmagolovnogo mozga. Klinicheskie rekomendatsii. Moscow; 2022 (In Russ.)
Froese L, Dian J, Gomez A, Zeiler FA. Sedation and cerebrovascular reactivity in traumatic brain injury: another potential avenue for personalized approaches in neurocritical care? Acta Neurochir (Wien). 2021;163(5):1383-1389. PMID: 33404872
Grebenchikov OA, Kulabukhov VV, Shabanov AK, Ignatenko OV, Antonova VV, Cherpakov RA, et al. Prospects of inhalation sedation in intensive care. Russian Journal of Anesthesiology and Reanimatology. 2022;(3):84-94. (In Russ.)
Villa F, Iacca C, Molinari AF, Giussani C, Aletti G, Pesenti A., at al. Inhalation versus endovenous sedation in subarachnoid hemorrhage patients: effects on regional cerebral blood flow. Crit Care Med. 2012;40(10):2797-2804. PMID: 22824929
Bosel J, Purrucker JC, Nowak F, Renzland J, Schiller P, Perez EB, et al. Volatile isoflurane sedation in cerebrovascular intensive care patients using AnaConDa®: effects on cerebral oxygenation, circulation, and pressure. Intensive Care Med. 2012;38(12):1955-1964. PMID: 23096426
Purrucker JC, Renzland J, Uhlmann L, Bruckner T, Hacke W, Steiner T., at al. Volatile sedation with sevoflurane in intensive care patients with acute stroke or subarachnoid haemorrhage using AnaConDa®: an observational study. Br J Anaesth. 2015;114(6):934-943. PMID: 25823541
Zheng S, Zuo Z. Isoflurane preconditioning induces neuroprotection against ischemia via activation of p38 mitogen-activated protein kinases. Mol Pharmacol. 2004;65(5):1172-1180. PMID: 15102945
Chi OZ, Hunter C, Liu X, Weiss HR. The effects of isoflurane pretreatment on cerebral blood flow, capillary permeability, and oxygen consumption in focal cerebral ischemia in rats. Anesth Analg. 2010;110(5):1412-1418. PMID: 20304986
Kitano H, Kirsch JR, Hurn PD, Murphy SJ. Inhalational anesthetics as neuroprotectants or chemical preconditioning agents in ischemic brain. J Cereb Blood Flow Metab. 2007;27(6):1108-1128.
Wang Z, Li J, Wang A, Wang Z, Wang J, Yuan J, et al. Sevoflurane Inhibits Traumatic Brain Injury-Induced Neuron Apoptosis via EZH2- Downregulated KLF4/p38 Axis. Front Cell Dev Biol. 2021;4(9):658720.
Сафиуллин Данила Раильевич - врач анестезиолог-реаниматолог отделения реанимации и интенсивной
терапии для нейрохирургических больных ГБУЗ «НИИ СП им. Н.В.
Склифосовского ДЗМ»; аспирант ФГБНУ ФНКЦ Р
Шабанов Аслан Курбанович - доктор медицинских наук, заместитель главного врача ГБУЗ «НИИ СП им.
Н.В. Склифосовского ДЗМ» по анестезиологии и реанимации; ведущий научный
сотрудник ФГБНУ ФНКЦ РР
Гринь Андрей Анатольевич- доктор медицинских наук, член-корреспондент РАН, заведующий научным отделением неотложной нейрохирургии ГБУЗ «НИИ СП им. Н.В. Склифосовского ДЗМ»
Евсеев Анатолий Константинович доктор химических наук, ведущий научный сотрудник отделения общей реанимации ГБУЗ «НИИ СП им. Н.В. Склифосовского ДЗМ»;
Евдокимов Артем Игоревич заведующий ОРИТ для нейрохирургических больных ГБУЗ «НИИ СП им. Н.В. Склифосовского ДЗМ»;
Петриков Сергей Сергеевич член-корреспондент РАН, профессор, доктор медицинских наук, директор ГБУЗ «НИИ СП им. Н.В. Склифосовского ДЗМ»;
Гребенчиков Олег Александрович доктор медицинских наук, заведующий лабораторией органопротекции при критических состояниях ФГБНУ ФНКЦ РР;
Теги: черепно-мозговая травма
234567 Начало активности (дата): 28.09.2024 14:53:00
234567 Кем создан (ID): 989
234567
Похожие статьи
Мышечная дистрофия при деменцииРентген на дому 8 495 22 555 6 8
Атлас укладок при рентгенологических исследованиях (Кишковский А.Н.) - Глава 4. Часть 6
Приказ Министерства здравоохранения Российской Федерации от 15 ноября2012 г. № 927н ”Об утверждении Порядка оказания медицинской помощи пострадавшим с сочетанными, множественными и изолированными травмами,сопровождающимися шоком”
ПОВРЕЖДЕНИЯ ПОЗВОНОЧНИКА У ДЕТЕЙ



