 21.09.2024
21.09.2024
Особенности регенерации пяточного сухожилия после его поперечной тенотомии с сохранением перитенона и его структур в эксперименте
Техника лечения врожденной косолапости по методу Ponseti является методом выбора, однако возможности репарации ахиллова сухожилия после поперечной тенотомии у пациентов детского возраста практически не изучены.
ВВЕДЕНИЕ
Лечение врожденной косолапости имеет долгую историю: от консервативной техники J.H. Kite (1972) [1] и разнообразных оперативных вмешательств до техники I. Ponseti [2-6]. Методика устранения деформации по Ponseti является «золотым стандартом» при лечении врожденной косолапости и сводится к одновременному устранению основных компонентов деформации стопы, наложению гипсовых повязок, тенотомии укороченного ахиллова сухожилия и длительного ношения корригирующих отводящих шин [7-14]. При этом в 70-85 % случаев коррекция эквинуса стопы достигается за счет чрескожной поперечной тенотомии ахиллова сухожилия [15-19].
Несмотря на то, что в литературе достаточно широко отражены вопросы регенерации сухожильных структур [20-22], научный интерес к данной проблеме не утрачен до настоящего времени. Так, регенерация сухожилий может происходить за счет внутренних ресурсов путем пролиферации и миграции теноцитов из эпитенона и эндотенона в место повреждения или внешних путем проникновения клеток из окружающего влагалища сухожилия и синовиума [23-24]. В настоящее время считается, что регенерация сухожилия включает как внутренние, так и внешние механизмы, причем последние преобладают на ранних этапах, а внутренние — в более поздние сроки [25].
Оба источника регенерации важны в синтезе внеклеточного матрикса (ECM) и в создании внутренней неоваскулярной сети [26]. По данным некоторых авторов, ультраструктурные характеристики остаются измененными даже через 12 мес. после травмы [27]. Регенерат сухожилия имеет рубцовоподобный характер и никогда полностью не восстанавливает биомеханические свойства, которые у него были до повреждения [28]. Так, по данным C. Frank, D. McDonald, N. Shrive [29], ремоделирование сухожильной ткани может продолжаться в течение нескольких лет, при этом сухожилия, как правило, демонстрируют значительное снижение структурных и механических свойств сразу после травмы с последующим медленным, но неполным восстановлением до первоначальных параметров.
Таким образом, хотя ахиллопластика входит в стандарт лечения детей с врожденной косолапостью по методике Ponseti, практически отсутствуют данные о репаративных процессах пяточного сухожилия после его пересечения с сохранением перитенона у растущих организмов. При оперативном вмешательстве практикующий детский ортопед стремится получить результат, при котором любая структура (костная, сухожильная ткань), подвергшаяся хирургическому воздействию, была бы в итоге максимально приближенной к нормальной анатомии детского организма. В связи с этим, изучение изменений, происходящих в ахилловом сухожилии после его пересечения при лечении врожденной косолапости, имеет большое практическое значение. От того, насколько качественно происходит восстановление пяточного сухожилия и в какие временные сроки, напрямую зависит эффективность процесса реабилитации этой группы пациентов: длительность иммобилизации, безопасность механической нагрузки, активность занятия ЛФК. Для изучения изменений, происходящих в сухожилии при выполнении поперечной ахиллотомии без повреждения перитенона и структур в нем расположенных (сосуды, нервы), нами выполнена экспериментальная работа на растущих животных.
Цель работы — выявить особенности процессов репарации пяточного сухожилия при его поперечном пересечении с сохранением перитенона и его структур (сосудов, нервов) в эксперименте на растущих кроликах.
МАТЕРИАЛЫ И МЕТОДЫ
Особенности репарации ахиллова сухожилия после его поперечной тенотомии без пересечения соединительнотканного влагалища — перитенона изучены в эксперименте у растущих животных. В экспериментальное исследование в качестве биомодели включены 20 кроликов породы Шиншилла обоего пола в возрасте 1-1,5 месяцев с массой (1476,0 ± 114,3) г. Содержание конвенциональных животных осуществляли в стандартных условиях вивария университетской клиники согласно правилам «Европейской конвенции о защите позвоночных животных, используемых для экспериментов или в иных научных целях» (Страсбург, 18.05.2014). Экспериментальная часть работы выполнена с учетом требований, изложенных в приказе Минздравсоцразвития РФ № 708н от 23.08.2010 «Об утверждении правил лабораторной практики».
Кроликов выводили из эксперимента по пять особей путем воздушной эмболии под местной анестезией на 15, 30, 60 и 90-е сут. после тенотомии ахиллова сухожилия. Сроки изучения репаративной регенерации сухожильной ткани выбраны на основе литературных данных [30]. Во всех сериях эксперимента препарат ахиллова сухожилия интактной конечности кролика исследован для определения параметров возрастной нормы. Гистологическому исследованию подвергли зону регенерата ахиллова сухожилия, также осуществляли подсчет коллагеновых волокон I и II порядка.
В эксперименте воспроизведена ситуация, когда при выполнении подкожного поперечного пересечения ахиллова сухожилия не повреждается перитенон и структуры в нем расположенные (сосуды,нервы). Под общей анестезией скальпелем по задней поверхности голени с отступом 1 см от места прикрепления ахиллова сухожилия к бугру пяточной кости продольно на протяжении 0,3-0,5 см рассекали кожу, подкожную клетчатку. После производили продольное рассечение сухожильного влагалища — перитенона с пересечением всех его слоев (паратенон и эпитенон) на длину кожного разреза. Субперитенониально выделяли пяточное сухожилие, которое пересекали скальпелем № 11 в поперечном направлении без нанесения дополнительного повреждения соединительнотканному влагалищу — перитенону. Затем лапе животного придавали положение тыльной флексии с расхождением концов пересеченного сухожилия на 0,5-0,7 см внутри соединительнотканного влагалища. Кожную рану не ушивали. Осуществляли фиксацию оперированной конечности кролика гипсовой лонгетной повязкой от верхней трети бедра со стопой в течение 2 нед. После снятия гипсовой повязки нагрузку оперированной конечности кролика искусственно не ограничивали.
Полученные образцы тканей фиксировали в 10 % растворе забуференного нейтрального формалина с последующей их декальцинацией в среде Bwdec-R (Bio-Optica). Гистологическую проводку препаратов проводили по общепринятой методике на аппарате Excelsior ES (Thermo Scientific). При помощи станции для заливки образцов тканей в парафин HistoStar (Thermo Scientific) изготавливали парафиновые блоки. На микротоме Microm HM 325 (Thermo Scientific) с парафиновых блоков изготавливали гистологические срезы толщиной 4-6 мкм, которые окрашивали гематоксилином и эозином и заключали в монтирующую среду. Микроскопию и фотофиксацию гистологических препаратов проводили при помощи морфометрического комплекса Leica DMR.
Статистическую обработку результатов исследования проводили с использованием пакета прикладных программ Statistika 12.0. Статистическая проверка нормальности распределения выполнена с помощью критерия W Шапиро - Уилка. Учитывая, что часть выборок не отвечала нормальному закону распределения и имела малый объем, то для дальнейшей работы с выборками использован непараметрический метод — W-критерий Вилкоксона.
РЕЗУЛЬТАТЫ
Результаты межгруппового сравнения толщины коллагеновых волокон I и II порядка в норме и в зоне регенерата в разные сроки вывода животных представлены в таблице 1.
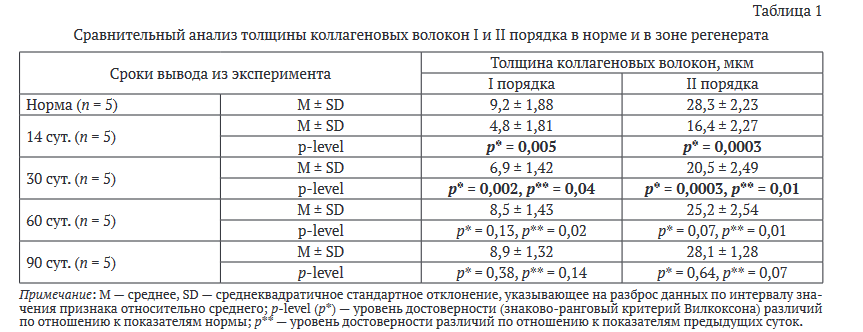
Через 15 сут. после хирургического вмешательства область травматического повреждения была представлена бесклеточными участками и лизированными коллагеновыми волокнами. На этом фоне значительную площадь препарата занимали тонкие коллагеновые волокна, формирующие войлокоподобную сеть, перемежающуюся с небольшими очагами некроза. Вместе с тем, жировая ткань имела небольшую площадь. Большое количество клеток фибробластического ряда, отличающихся по форме и размерам, располагалось вдоль пучков коллагеновых волокон или формировало пролифераты.
В ряде участков зоны дефекта определяли молодую, частью созревающую грануляционную ткань с преобладанием в клеточном составе гистиоцитов и фибробластов с большим содержанием тонкостенных сосудов. В участках сухожилия, непосредственно прилегающих к зоне повреждения, на небольшом протяжении сохранялась аксиальная направленность коллагеновых волокон, однако наличие «вставочных» пучков приводило к нарушению ориентации большинства волокон, в результате чего истонченные и фрагментированные пучки коллагеновых волокон приобретали извилистые контуры. В данной зоне определяли очаги деструкции или обширной пролиферации клеток (рис. 1).
На этом сроке эксперимента в зоне дефекта сформирован более тонкий регенерат с упорядоченной структурой, не содержащий избыточных коллагеновых структур. В рубцовой ткани определяли преобладание клеток фиброцитарного ряда, располагавшихся между параллельно расположенными пучками коллагеновых волокон. Данное строение рубцовой ткани было максимально приближено к исходной сухожильной ткани, что подтверждено наличием пучков коллагеновых волокон I и II порядка, плотно прилегающих друг к другу, между которыми располагались участки рыхлой соединительной ткани с небольшим количеством кровеносных сосудов.
К 15 сут. толщина коллагеновых волокон I порядка достигала (4,80 ± 1,81) мкм, что статистически значимо меньше по отношению к показателю нормы — (9,20 ± 1,88) мкм, p = 0,005. Толщина коллагеновых волокон II порядка к этому сроку была равна (16,40 ± 2,27) мкм и по сравнению с показателем нормы — (28,30 ± 2,23) мкм — определена статистически значимая разница, p = 0,001.
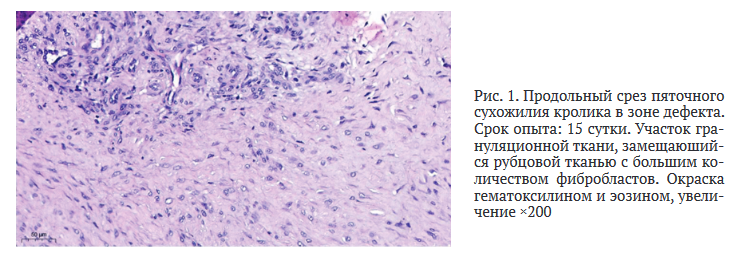
На 30 сут. от начала эксперимента в перифокальной зоне сухожилия определены достаточно протяжённые участки взаимно параллельно ориентированных пучков сухожильных волокон с хорошо различимыми ядрами теноцитов, разделенных эндотендинием. В этот срок эксперимента отмечено увеличение толщины пучков коллагеновых волокон, которые приобрели волнистую конфигурацию, свойственную структурной организации сухожилия в норме.
Однако сохранялась часть коллагеновых конструкций с меньшей степенью структурированности и отсутствием волнистости. Представительство жировой ткани по сравнению с предыдущим сроком исследования по занимаемой площади было более распространённым и имело вид очаговых разрастаний. Однако на некотором протяжении в зоне дефекта отмечено разрастание плотной волокнистой соединительной ткани рубцового характера с небольшим содержанием сосудов капиллярного типа, клеточных элементов фибробласто-гистио- цитарного ряда. Отсутствовали однонаправленность и упорядоченность расположения коллагеновых волокон в структуре регенерата с нахождением участков невысокой плотности фибробластов, различающихся формой и размерами ядра (рис. 2).
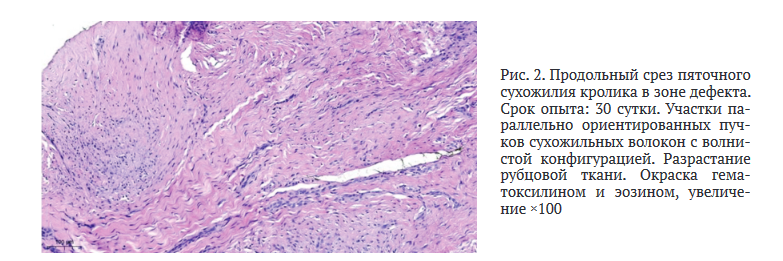
К 30 сут. толщина коллагеновых волокон I порядка увеличилась до (6,90 ± 1,42) мкм, по сравнению со значением 15 сут. — (4,80 ± 1,81) мкм — разница статистически значима, p = 0,04. При сравнении с показателем нормы — (9,20 ± 1,88) мкм — сохранялась выраженная разница, p = 0,002. Толщина коллагеновых волокон II порядка к 30 сут. статистически значимо увеличивалась до (20,50 ± 2,49) мкм по отношению к показателю предыдущих суток — (16,40 ± 2,27) мкм, p = 0,01. Однако значение толщины коллагеновых волокон II порядка было статистически значимо меньше по отношению к нормативному показателю, р = 0,001.
На сроке 60 сут. в зоне травматического повреждения выявлены обширные пласты сохранной сухожильной ткани с плотными пучками коллагеновых волокон. На небольшой площади срезов обнаружены небольшие участки богатоклеточной соединительной ткани, местами рубцового характера (рис. 3). Образованная рубцовая ткань характеризовалась типичным расположением коллагеновых волокон, частью с разнонаправленными областями с уплотнённой упаковкой, частью — с рыхлой упаковкой пучков, местами с признаками дистрофических изменений. В рубцовой ткани отмечено уменьшение количества кровеносных капилляров и обнаружены сосуды с расширенным пустым просветом.
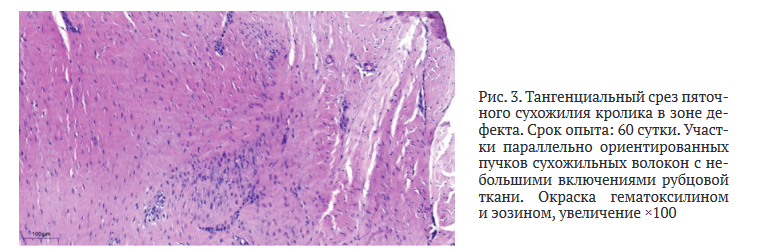
В гистопрепарате на фоне участков плотной волокнистой ткани встречались мелкие очаги рыхлой волокнистой ткани и незначительное количество жировой ткани, которая имела вид небольших очаговых скоплений групп липоцитов. Таким образом, спустя 60 сут. в зоне заживления на большей площади среза сформирована сухожильноподобная ткань с более плотным расположением волокон тёмно-эозинофильного цвета с включением непротяжённых участков жировой и рубцовой ткани. Пучки коллагеновых волокон имели однонаправленность и упорядоченность их расположения, а толщина волокон соответствовала показателям здорового сухожилия.
К 60 сут. толщина коллагеновых волокон I порядка увеличивалась до (8,50 ± 1,43) мкм по отношению к значению 30 сут. — (6,90 ± 1,42) мкм, определена статистически достоверная разница (p = 0,02). К этому сроку происходило статистически значимое увеличение толщины коллагеновых волокон II порядка до (25,20 ± 2,54) мкм по отношению к предыдущему показателю (p = 0,07). Толщина коллагеновых волокон I и II порядка стала не отличимой от показателей их нормы (p = 0,13 и p = 0,07 соответственно).
К исходу 90 сут. в перифокальной зоне сухожилия определены протяжённые поля сухожильной ткани с волнообразными светло-эозинофильными волокнами обычного строения с несколько утолщённым перитенонием, а также небольшие участки рыхлой волокнистой соединительной ткани с сетью сосудов и небольших очагов жировой ткани (рис. 4).
В зоне дефекта к этому сроку среди пластов соединительной ткани обнаружены волокна сухожилия обычной архитектоники с взаимно параллельным волнистым расположением. Однако в участках, сопряжённых с зоной дефекта, по периферии выявлены фокусы более рыхлой соединительной ткани с небольшим количеством мелкокалиберных сосудов.
К 90 сут. толщина коллагеновых волокон I порядка увеличивалась до (8,9 ± 1,32) мкм по сравнению с показателем 60 сут. (р = 0,14), однако без наблюдаемой статистической значимости, при сравнении с показателем нормы — (9,2 ± 1,88) мкм — также статистически значимой разницы не отмечено (р = 0,38). Толщина коллагеновых волокон II порядка к этому сроку увеличивалась до (28,1 ± 1,28) мкм и по отношению к предыдущему — (25,2 ± 2,54) мкм и нормативному показателю — (28,3 ± 2,23) мкм — статистически значимой разницы не определялось (р = 0,07 и p = 0,64 соответственно).
ОБСУЖДЕНИЕ
По данным литературы, в процессе старения сухожилия подвергаются многочисленным биохимическим, клеточным и механическим изменениям, которые вызывают общее снижение способности сухожилия восстанавливаться после травмы. Так, отмечается снижение объемной плотности тенобластов, а также уменьшение количества тенобластов на единицу поверхности площади сухожилия [31, 32]. В целом, с возрастом способность тенобласта синтезировать структурные белки и регуляторные биомолекулы после травмы снижается.
Поскольку синтез коллагена и коллагенолитическая активность уменьшаются с возрастом, происходит снижение в обновлении коллагеновых волокон [33, 34]. Это уменьшение приводит к увеличению диаметра коллагеновых волокон и выраженной изменчивости в толщине. При отсутствии эффективного количества теногенных клеток-предшественников у взрослых, которые опосредованно влияют на выработку клеток, пролиферирующие фибробласты приводят к фиброзному восстановлению сухожилия и формированию постоянного рубца [35, 36].
Выполненное нами экспериментальное исследование на растущих кроликах показало, что к исходу 15 сут. после тенотомии с сохранением перитенониальной оболочки в зоне дефекта был сформирован более тонкий регенерат, с упорядоченной структурой и не содержащий избыточных коллагеновых структур. В рубцовой ткани определяли преобладание клеток фиброцитарного ряда, располагавшихся между параллельно расположенными пучками коллагеновых волокон. Данное строение рубцовой ткани максимально приближено к исходной сухожильной ткани, что подтверждалось наличием пучков коллагеновых волокон I и II порядка, плотно прилегающих друг к другу, между которыми располагались участки рыхлой соединительной ткани с небольшим количеством кровеносных сосудов. К 30 и 60 сут. эксперимента происходило восстановление органотипической структуры сухожилия в зоне его пересечения. Так, уже через 60 сут. область повреждения заполнена сухожильноподобной тканью с более плотным расположением волокон тёмно-эозинофильного цвета с включением непротяжённых участков жировой и рубцовой ткани. При этом пучки коллагеновых волокон имели однонаправленность и упорядоченность их расположения, а толщина волокон соответствовала показателям здорового сухожилия. К исходу 90 сут. зона дефекта представлена небольшими участками плотной волокнистой руб- цово изменённой ткани с небольшим количеством клеточных элементов фибробластов. Среди пластов соединительной ткани обнаружены волокна сухожилия обычной архитектоники с взаимно параллельным расположением пучков коллагеновых волокон, толщина которых была максимально приближена к нормативным показателям.
Исходя из вышеописанного, можно предположить, что при пересечении пяточного сухожилия неповрежденное соединительнотканное влагалище (перитенон) препятствует расхождению концов пересеченного сухожилия на значительное расстояние. При этом неповрежденное соединительнотканное влагалище (перитенон) фактически поддерживает сухожилие в состоянии функционального натяжения. В этом случае репаративные процессы в зоне дефекта, происходящие в условиях сохранившегося функционального натяжения поврежденного сухожилия, протекают в кротчайшие сроки. Кроме того, неповрежденное сухожильное влагалище (перитенон) с сохраненными сосудами и нервами оказывает благоприятное влияние на репаративные процессы в зоне тенотомии ахиллова сухожилия. Все это приводит к тому, что к исходу 90 сут. зона дефекта пяточного сухожилия на большем протяжении представлена сухожильноподобной тканью, в которой обнаружены волокна сухожилия обычной архитектоники с взаимно параллельным расположением пучков коллагеновых волокон, а их толщина максимально приближена к нормативным показателям.
Основываясь на результатах экспериментальной работы, можно полагать, что пациент с врожденной косолапостью после тенотомии ахиллова сухожилия, выполненной максимально щадяще (без повреждения перитенона и его структур), уже через 3 мес. будет иметь пяточное сухожилие, полностью восстановившее свою целостность и морфологическую структуру.ЗАКЛЮЧЕНИЕ
Экспериментальное исследование показало, что через 3 мес. после пересечения ахиллова сухожилия в изучаемой зоне формируется сухожильноподобная ткань с коллагеновыми волокнами адекватной толщины, с включением мелких островков волокнистой рубцово изменённой ткани с небольшим количеством клеточных элементов — фибробластов. То есть, при рассечении ахиллова сухожилия с сохранением перитенона и его сосудов и нервов образуется сухожильная ткань, максимально напоминающая первоначальную. Таким образом, при лечении пациентов по методу Ponseti выполнение ахиллотомии с сохранением соединительнотканного влагалища (перитенона) и его сосудов и нервов является непременным условием получения положительного результата выполненного оперативного вмешательства.
.
СПИСОК ИСТОЧНИКОВKite JH. Nonoperative treatment of congenital clubfoot. Clin OrthopRelatRes. 1972;84:29-38. doi: 10.1097/00003086- 197205000-00007
Dobbs MB, Gurnett CA. Update on clubfoot: etiology and treatment. Clin Orthop Relat Res. 2009;467(5):1146-П53. doi: 10.1007/s11999-009-0734-9
Rijal R, Shrestha BP, Singh GK, et al. Comparison of Ponseti and Kite's method of treatment for idiopathic clubfoot. Indian J Orthop. 2010;44(2):202-207. doi: 10.4103/0019-5413.61941
Kaseke F, Mudawarima T. Comparison of Ponseti and Kite's method of treatment for congenital Talipes Equino using the Pirani scoring system. Cent Afr J Med. 2013;59(1-4):14-18.
Garcia LC, de Jesus LR, Trindade MO, et al. Evaluation of kite and ponseti methods in the treatment of idiopathic congenital clubfoot. Acta Ortop Bras. 2018;26(6):366-369. doi: 10.1590/1413-785220182606183925
Bina S, Pacey V, Barnes EH, et al. Interventions for congenital talipes equinovarus (clubfoot). Cochrane Database Syst Rev. 2020;5(5):CD008602. doi: 10.1002/14651858.CD008602.pub4
Кожевников О.В., Косов И.С., Грибова И.В. и др. Новая технология коррекции тяжелых форм косолапости у детей. Вестник травматологии и ортопедии им. Н.Н. Приорова. 2009;(1):58-64.
Кенис В.М., Степанова Ю.А. Анализ причин неоптимального консервативного лечения врожденной косолапости у детей. Травматология и ортопедия России. 2017;23(3):80-85. doi: 10.21823/2311-2905-2017-23-3-80-85
Morcuende JA. Congenital idiopathic clubfoot: prevention of late deformity and disability by conservative treatment with the Ponseti technique. PediatrAnn. 2006;35(2):128-136. doi: 10.3928/0090-4481-20060201-13
Pirani S, Naddumba E, Mathias R, et al. Towards effective Ponseti clubfoot care: the Uganda Sustainable Clubfoot Care Project. Clin Orthop Relat Res. 2009;467(5):1154-1163. doi: 10.1007/s11999-009-0759-0
Owen RM, Penny JN, Mayo A, et al. A collaborative public health approach to clubfoot intervention in 10 low-income and middle-income countries: 2-year outcomes and lessons learnt. J Pediatr Orthop B. 2012;21(4):361-365. doi: 10.1097/ BPB.0b013e3283504006
Radler C. The Treatment of Recurrent Congenital Clubfoot. Foot Ankle Clin. 2021;26(4):619-637. doi: 10.1016/j. fcl.2021.07.001
Rieger MA, Dobbs MB. Clubfoot. ClinPodiatrMedSurg. 2022;39(1):1-14. doi: 10.1016/j.cpm.2021.08.006
Jain AK, Kohli N, Bansal N, et al. Evaluation of Results of Ponseti Technique in Idiopathic Clubfoot using Clinical Evaluation and Radiological Assessment. Int J Appl Basic Med Res. 2022;12(1):43-46. doi: 10.4103/ijabmr. ijabmr_281_21
Бландинский В.Ф., Вавилов М.А., Торно Т.Э., Донской А.В. Лечение атипичной врожденной косолапости методом Понсети. Травматология и ортопедия России. 2010;16(1):75-79. doi: 10.21823/2311-2905-2010-0-1-75-79
Morcuende JA, Abbasi D, Dolan LA, Ponseti IV. Results of an accelerated Ponseti protocol for clubfoot. J Pediatr Orthop. 2005;25(5):623-6. doi: 10.1097/01.bpo.0000162015.44865.5e
Terrazas-Lafargue G, Morcuende JA. Effect of cast removal timing in the correction of idiopathic clubfoot by the Ponseti method. Iowa Orthop J. 2007;27:24-27.
Cohen E, Katz T, Rozen U, et al. The Influence of Achilles Tenotomy and Compliance with Foot Abduction Orthosis on the Relapse Rate of Ponseti Treatment for Idiopathic Clubfoot: A Regional Study. J Foot Ankle Surg. 2020;59(4):784- 787. doi: 10.1053/j.jfas.2019.12.007
Rademan J. Ruptured pseudoanuerysm of the posterial tibial artery after percutaneous Achilles tenotomy. BMJ Case Rep. 2022;15(3):e232847. doi: 10.1136/bcr-2019-232847
Демичев Н.П., Путилин А.А. Криоконсервирование и аллотрансплантация сухожильной ткани. Ортопедия, травматология и протезирование. 1990;(4):22-27.
Conway AM, Dorner RW, Zuckner J. Regeneration of resected calcaneal tendon of the rabbit. Anat Rec. 1967;158(1):43- 49. doi: 10.1002/ar.1091580106
Enwemeka CS, Spielholz NI, Nelson AJ. The effect of early functional activities on experimentally tenotomized Achilles tendons in rats. Am JPhys MedRehabil. 1988;67(6):264-269.
Gelberman RH, Manske PR, Vande Berg JS, et al. Flexor tendon repair in vitro: a comparative histologic study of the rabbit, chicken, dog, and monkey. J Orthop Res. 1984;2(1):39-48. doi: 10.1002/jor.1100020107
Manske PR, Lesker PA. Biochemical evidence of flexor tendon participation in the repair process--an in vitro study. J Hand Surg Br. 1984;9(2):117-120.
Voleti PB, Buckley MR, Soslowsky LJ. Tendon healing: repair and regeneration. Annu Rev BiomedEng. 2012;14:47-71. doi: 10.1146/annurev-bioeng-071811-150122
James R, Kesturu G, Balian G, Chhabra AB. Tendon: biology, biomechanics, repair, growth factors, and evolving treatment options. JHandSurgAm. 2008;33(1):102-112. doi: 10.1016/j.jhsa.2007.09.007
Miyashita H, Ochi M, Ikuta Y. Histological and biomechanical observations of the rabbit patellar tendon after removal of its central one-third. Arch Orthop Trauma Surg. 1997;116(8):454-462. doi: 10.1007/BF00387577
Leadbetter W.B. Cell-matrix response in tendon injury. Clin Sports Med. 1992;11(3):533-578.
Frank C, McDonald D, Shrive N. Collagen fibril diameters in the rabbit medial collateral ligament scar: a longer term assessment. Connect Tissue Res. 1997;36(3):261-269. doi: 10.3109/03008209709160226
Лаврищева Г.И., Оноприенко Г.А. Морфологические и клинические аспекты репаративной регенерации опорных органов и тканей. М.: Медицина; 1996:208.
Nagy IZ, Von Hahn HP, Verzar F. Age-related alterations in the cell nuclei and the DNA content of rat tail tendon. Gerontologia. 1969;15(4):258-264. doi: 10.1159/000211694
Moore MJ, De Beaux A. A quantitative ultrastructural study of rat tendon from birth to maturity. J Anat. 1987;153:163- 169.
Neuberger A., Slack H.G. The metabolism of collagen from liver, bone, skin and tendon in the normal rat. Biochem J. 1953;53(1):47-52. doi: 10.1042/bj0530047
Kannus P., Jozsa L. Histopathological changes preceding spontaneous rupture of a tendon. A controlled study of 891 patients. J Bone Joint Surg Am. 1991;73(10):1507-1525.
Godwin J.W., Pinto A.R., Rosenthal N.A. Macrophages are required for adult salamander limb regeneration. Proc Natl AcadSci USA. 2013;110(23):9415-9420. doi: 10.1073/pnas.1300290110
Godwin J, Kuraitis D, Rosenthal N. Extracellular matrix considerations for scar-free repair and regeneration: insights from regenerative diversity among vertebrates. Int J Biochem Cell Biol. 2014;56:47-55. doi: 10.1016/j.biocel.2014.10.011
Максим Валерьевич Власов — кандидат медицинских наук, заведующий отделением, Footdoc@mail.ru;
Наталья Юрьевна Широкова — кандидат биологических наук, старший научный сотрудник, nush 63@mail.ru;
Ирина Владимировна Мусихина — кандидат медицинских наук, врач травматолог-ортопед, i_musihina@mail.ru.
Теги: врожденная косолапость
234567 Начало активности (дата): 21.09.2024 11:37:00
234567 Кем создан (ID): 989
234567 Ключевые слова: врожденная косолапость, метод Ponseti, регенерация пяточного сухожилия, микроморфометрия, эксперимент, кролики
12354567899
Похожие статьи
Измерение длины нижних конечностей: обзор литературыРентген на дому 8 495 22 555 6 8
Сравнение отдаленных результатов лечения детей с косолапостью
Рост и развитие врожденно укороченной голени после удлинения по Г.А. Илизарову



