 24.08.2024
24.08.2024
Сравнительная оценка эффективности эмболизации ветвей подколенной артерии и комплексного консервативного лечения при остеоартрите коленного сустава
Остеоартрит (ОА) коленного сустава — распространённое заболевание, которое часто приводит к боли и нарушению функции сустава
Введение.
Остеоартрит (ОА) коленного сустава — патология, которая занимает 17% от всех заболеваний костно-мышечной системы. Её распространённость расширяется с каждым годом и вызвана увеличением продолжительности жизни и повышением индекса массы тела (ИМТ) [1-3].
Лечение ОА начинают с консервативных методов, однако, как показала практика, добиться стойкого результата удаётся не всегда [4]. Также нередко применяют хирургические вмешательства, которые являются инвазивными, вплоть до тотального эндопротезирования суставов. Данные методы рассматривают после неэффективности консервативного лечения, но существуют пациенты с некупируемым болевым синдромом на ранних стадиях заболевания, а также больные, имеющие противопоказания к масштабным операциям либо попросту не готовые к ним [5, 6].
По результатам исследований, проведённых в 2010-х годах, выдвинута гипотеза о том, что причиной ОА может быть воспаление в суставе [7-9]. С учётом данной теории открывается новая ветвь поиска альтернативных методов лечения ОА [10].
В 2015 году на основании теории о неоваскуляризации Y. Okuno и соавт., а также ряд других учёных представили эффективную технологию лечения некупируемого болевого синдрома при ОА коленного сустава путём эмболизации ветвей подколенной артерии (ЭВПА) [11]. Авторы отмечали уменьшение болевого синдрома у пациентов по ВАШ, а также улучшение функции сустава по опроснику WOMAC (Western Ontario and McMaster University Osteoarthritis Index). Методика применялась пациентам с анамнезом неэффективности консервативного лечения не менее 3 месяцев.
Цель исследования.
Оценить и сравнить ближайшие, среднесрочные и отдалённые результаты ЭВПА и комплексного консервативного лечения у больных ОА коленного сустава III стадии.
Материал и методы.
В исследование были включены больные ОА коленного сустава, которым по объективным и субъективным причинам было невозможно осуществить хирургическое вмешательство. Им проводилось консервативное лечение различными курсами, включающими нестероидные противовоспалительные препараты (НПВП), лечебную физкультуру (ЛФК), физиотерапию, инъекции гиалуроновой кислоты, глюкокортикоидов (ГКС), PRP-терапию. Однако план лечения нередко составлялся эмпирически и не носил комплексного характера. При неэффективности одних методов и препаратов внесистемно назначались другие и т. д. У данных пациентов эффекта от проводимой терапии не отмечалось более 3 месяцев, поэтому они обратились в нашу клинику.

Пациенты, не включённые в исследование в связи с тяжестью и нестабильностью заболеваний, направлялись к профильным специалистам с рекомендациями по применению определенных методик лечения, не обостряющих течение основного заболевания.
Больные обеих групп проходили плановое обследование в условиях поликлиники, включающее в себя: анализы крови (клинический и биохимический), ревмопробы, рентгенографию коленного сустава в прямой и боковой проекциях. Для проведения ЭВПА пациентам 1-й группы проводили дополнительные обследования: коагулограмму, RW, HBsAg, HCV, ВИЧ, группу крови, Rh, общий анализ мочи, флюро- графию, электрокардиограмму, ультразвуковое исследование вен и артерий нижних конечностей.
Степень поражения суставов определялась по шкале Kellgren-Lawrence (K-L) [13] и соответствовала III стадии в обеих группах.
Выбраны следующие временные точки изучения результатов лечения: через 7 дней, 1, 6, 12 и 24 месяца после операции/начала консервативного лечения, при этом болевой синдром оценивали по шкале ВАШ, функцию сустава — по опроснику WOMAC (3 категории, включающие в себя 24 вопроса, каждый из вопросов оценивался по шкале от 0 до 100 мм). Оценку результатов инструментальных методов проводили по данным МРТ в соответствии с протоколами WORMS (Whole-ORgan Magnetic resonance imaging Score) [14] на всех этапах наблюдения. Для этого из каждой группы были определены по 10 человек, схожих по возрасту, ИМТ и полу.
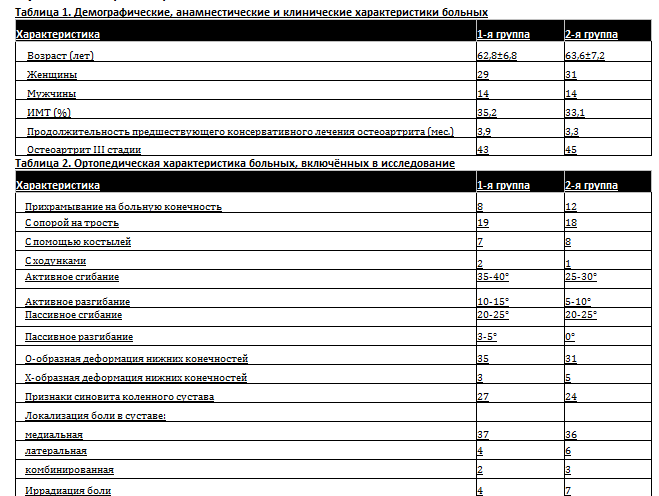
Демографические, анамнестические, клинические характеристики и ортопедический статус больных при первичном обращении представлены в таблицах 1 и 2.
Ввиду мультиморбидного состояния больных для проведения комплексной консервативной терапии мы разделили их дополнительно на 2 подгруппы: подгруппу А и Б.
В подгруппу А вошёл 21 пациент с тяжёлыми сопутствующими заболеваниями: ожирение 3 степени, гипертоническая болезнь (ГБ) 3 стадии, ЯБЖ или двенадцатиперстной кишки в анамнезе, сахарный диабет (СД) 1 и 2 типа, ХПН 1-3 стадии, хроническая печёночная недостаточность 1-2 стадии, ХСН (1 ФК по NYHA), онкологические заболевания. Больные данной подгруппы имели высокие средние показатели боли по шкалам ВАШ (73,3±15,4 мм) и WOMAC (боль 50,2±6,1 мм, скованность 60,7±9,3 мм, затруднение повседневного самообслуживания 54,2±6,7 мм), что отрицательно отражалось на качестве жизни. Ходьба на дистанции более 200 м вызывала проблемы.
Преобладающее число (22 человека) пациентов использовало дополнительные средства опоры при передвижениях в виде трости, костылей или ходунков. Основу данной подгруппы составили больные пожилого и преклонного возраста.
В подгруппу Б вошли 24 пациента с менее тяжёлыми хроническими заболеваниями: ожирение 1-2 степени, ГБ 1-2 стадии, гастрит, СД 2 типа без применения инсулина. Эти пациенты имели менее выраженные показатели боли по ВАШ (61,8±11,4 мм) и WOMAC (боль 41,4±5,6 мм, скованность 48,9±8,6 мм, затруднение повседневной жизни 43,0±11,06 мм). У большинства больных при ходьбе отмечалось нарушение походки в виде хромоты.
Использование средств дополнительной опоры имело место только в 6 случаях (5 — с помощью трости, 1 — с помощью костылей). Пациенты данной подгруппы имели более молодой возраст (трудоспособный возраст) по сравнению с подгруппой А.
Нами был проведён сравнительный анализ показателей групп на всех этапах исследования с использованием методов параметрической статистики. Независимые выборки демонстрировали различия, которые рассчитывались с использованием t-критерия и дисперсионного анализа (ANOVA/MANOVA). Определялись соотношения межгрупповой и внутригрупповой дисперсий в измеряемых данных. Показателем изменчивости служила сумма квадратов отклонения полученных значений от среднего. Общая сумма квадратов SSTotal раскладывалась на межгрупповую сумму квадратов SSBG и внутригрупповую сумму квадратов SSWG с использованием формулы:
SSTotal=SSBG+SSWG.
Межгрупповая и внутригрупповая дисперсии служили оценкой одной и той же дисперсии и были равны.
Межгрупповое число степеней свободы находят по формуле:
vBG=m - 1,
где m — число групп.
Внутригрупповое число степеней свободы — по формуле:
vWG=n-m,
где n — количество наблюдений в каждой из групп.
Степень образовавшейся связи между двумя заданными переменными устанавливали, применяя коэффициент корреляции Пирсона и Спирмена. Методы непараметрической статистики также были использованы в работе.
Сопоставляли каждый из признаков ранг по возрастанию или убыванию. Определяли разности рангов каждой пары сопоставляемых значений (d).
Возводили в квадрат каждую разность и суммировали полученные результаты. Вычисляли коэффициент корреляции рангов по формуле Ргде d — разность между рангами по двум переменным; n — количество ранжируемых наблюдений.
Затем определяли статистическую значимость коэффициента с помощью t-критерия, рассчитанного по формуле:
где г — коэффициент корреляции, п — число коррелирующих признаков.
Лечение больных 1-й группы. В стационаре проводился клинический и физикальный осмотр для определения триггерных зон сустава.
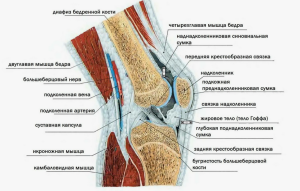
В начальный период внедрения технологии применяли метод, разработанный и описанный Okuno Y. и соавт. [16], заключавшийся в следующем: в условиях рентгенооперационной, в положении больного лёжа на спине, под местной анестезией осуществляли пункцию бедренной артерии в паховой области с установлением интродьюсера. Интраартериально вводили стандартную дозу гепарина 5000 ЕД. Через проводник перемещали катетер до уровня средней и нижней трети бедра, после чего выполняли ангиографию конечности в прямой проекции в целях определения расположения всех ветвей подколенной артерии (рис. 1).
Путём пальпации коленного сустава уточняли локализацию болезненных участков и, соответственно, на ангиограмме определяли актуальные (целевые) ветви, их кровоснабжающие. По выбранным ветвям смещали катетер дистальнее уровня кожных ответвлений и проводили ангиографию в целевых ветвях для выявления патологически новообразованной сосудистой сети, визуализируемой в виде «туманного облака» (рис. 2А). После обнаружения патологических сосудов проводили их эмболизацию. В качестве эмболизирующего агента использовали препарат имипинем+циластатин, в котором содержатся нерастворимые частицы диаметром 10—70 микрон. У больных с аллергическими реакциями на антибиотик использовали эмбосферы Embozen размером 75 микрон. Выбранные сферы смешивали с неионным низкоосмолярным мономерным йодированным рентгеноконтрастным средством и вводили в просвет сосуда до окклюзии (рис. 2В). Далее катетер удаляли и проводили гемостаз путём ручного сдавливания артерии в области прокола в течение 20 минут с последующей установкой давящей повязки либо использовали устройство закрытия артериального доступа.
При анализе первых проведённых миниинвазивных операций (технического исполнения и результатов) у некоторых больных наблюдали нецелевую эмболизацию и, вследствие этого, — ишемию кожных покровов в области коленного сустава и дистальнее (рис. 3). Мы пришли к мнению, что причиной такого состояния оказалось использование более мобильных эмбосфер диаметром менее 0,25 диаметра соответствующей ветви сосуда на выбранном ранее уровне эмболизации.
Усовершенствованная и применённая технология позволила более точно осуществить локальную эмболизацию, использовать меньшее количество сфер и снизить риск их рефлюкса из просвета сосуда в кожные ветви за счёт отсутствия просвета между катетером и стенками сосуда.
При выписке пациентам даны консультации относительно их заболевания и рекомендации по изменению образа жизни и питания, разъяснены факторы, влияющие на прогрессирование патологического процесса и рецидив болевого синдрома. Назначены симптом-модифицирующие препараты медленного действия курсами 2 раза в год, а также произведён индивидуальный подбор упражнений ЛФК для ежедневного применения с учётом хронических заболеваний и конституционных особенностей пациента в целях укрепления мышечного каркаса нижних конечностей и увеличения мобильности суставов.
Лечение больных 2-й группы. Применённая программа консервативного лечения включала 3 раздела [1].
Базовым курсом терапии симптоматических лекарственных средств быстрого действия НПВП в инъекционной и пероральной форме назначали высокоселективные ингибиторы циклооксигеназы-2 в невысоких дозировках, чтобы не спровоцировать обострения хронических заболеваний ЖКТ и сердечно-сосудистой системы: лорноксикам внутривенно капельно 8 мг + 200 мл 0,9% ЫаС1 1 раз в день 5 дней и целекоксиб 100 мг, 1 капсула 2 раза в день, 7 дней. При незначительном уменьшении показателей боли не менее 50 мм по ВАШ курс инъекционного препарата продлевался на 5 дней, а пероральная форма — на 14 дней. По уменьшении выраженности болевого синдрома отменялась инъекционная форма НПВП и понижалась дозировка перорального препарата до 100 мг 1 раз в день — препарат применялся до купи
рования болевого синдрома либо снижения показателей боли до 20-30 по ВАШ, но не более 4 недель. На фоне приёма препарата НЯ пациенты не отмечали. На весь курс приёма НПВП назначался ингибитор протонной помпы в полной суточной дозировке (омепразол 40 мг, 1 капсула 1 раз в день).
Применялись трансдермальные формы НПВП: аце- клофенак в виде геля на поражённый сустав. Для усиления проводимости препарата использовался 25% раствор димексида: пропитанная им марлевая салфетка прикладывалась поверх нанесённого геля и создавала герметичные условия. Данный компресс применялся по 1 ч 2 раза в день, курсом в 21 день.
В первые дни лечения в целях купирования остро выраженного болевого синдрома (ВАШ 60 мм и выше) или синовита проводили внутрисуставные инъекции ГКС: дипромета, не более 2 инъекций в год, учитывая препараты ГКС, вводившиеся в ранее проводимых лечениях. Пациентам с СД, почечной и печёночной недостаточностью инъекции ГКС не проводили в связи с риском ухудшения их состояния, а назначали слабые пероральные опиоиды: трамадол 1 таблетка по 100 мг 2 раза в день, не более 10 дней; при снижении болевого синдрома дозировка препарата понижалась либо производилась его отмена.
Из симптомомодифицирующих препаратов медленного действия применяли инъекционную форму препарата Амбене Био. В его состав помимо хондроитина сульфата входят 15 аминокислот, пептиды, микро- и макроэлементы.
Производится он путём биоэкстракции, что позволяет вместить 100 мг действующего вещества в 1 мл, а технологии нано- и ультрафильтрации позволяют добиться высокой чистоты действующих веществ и повысить синергию их симптоматического и патогенетического действия. Амбене Био в рамках исследования вводили внутримышечно 1 мл, 1 раз в день, курсом в 20 дней. Однако стоит отметить, что у данного препарата имеется режим дозирования по 2 мл через день, курсом 10 инъекций, что может быть фактором, повышающим приверженность пациентов к лечению. Последний момент особенно важен, учитывая фактически «пожизненный» режим терапии пациентов с ОА ввиду хронического прогрессирующего характера заболевания. В год проводили 2 курса препаратом Амбене Био, либо препарат мог быть заменен на 2 курса пероральных форм хондроитина сульфата (Амбене Хондро).
При снижении болевого синдрома и купировании явлений синовита для сохранения достигнутого результата всем больным проводили инъекции препарата гиалуроновой кислоты: 1% гиалуронат натрия 20 мг/2 мл, с длительным курсом введения (1 инъекция 1 раз в 7 дней № 5).
При определении реабилитационных мероприятий комплекса учитывали, что гиподинамия, избыточная иммобилизация и тем более полная обездвиженность вредны для пациентов данной подгруппы.
Учитывая мультиморбидное состояние, воз - раст больных и клинические проявления ОА занятия лечебной гимнастикой (ЛГ) в данной группе преимущественно проводили индивидуально. Упражнения были адаптированы к потребностям, толерантности к физической нагрузке и предпочтениям каждого пациента. Исключалась ударная нагрузка и большие перерывы в занятиях, обеспечивалась максимальная приверженность для мотивации пациента. Больным применяли лёгкую физическую активность, которая помимо механических и функциональных улучшений способствовала снижению риска дальнейшего прогрессирования и обострения сопутствующих заболеваний (диабета, сердечно-сосудистых и т. д.), а также улучшению настроения и социальной самооценки.
Включены следующие мероприятия:
ЛФК — индивидуально, занятия начинались в палате, исходное положение — лёжа на спине или на боку; назначались динамические и статические упражнения для мелких и средних мышечных групп нижних и верхних конечностей в соотношении 3:1. Количество повторов 3-5 раз. Проводилась дыхательная гимнастика, назначались статические и динамические дыхательные упражнения. Занятия ЛГ проводились под контролем измерения пульса и артериального давления (АД) до и после занятий. Время проведения 10-15 минут. Затем после улучшения состояния (уменьшение болевого синдрома, снижение отёка в области коленного сустава, улучшение мобильности пациента в пределах палаты и т. д.) пациент переводился для проведения индивидуальной ЛГ в зал ЛФК. Добавлялись специальные корригирующие упражнения для поражённого сустава, увеличивалось количество повторов и подходов. Время занятия ЛГ составляло 20-30 минут с учётом специальных укладок.
В данный период назначали физиотерапевтическое лечение: переменное магнитное поле на область поражённого сустава, время процедуры составляло 15-20 минут; фонофорез с гидрокортизоном, курс — 3-5 процедур, в дальнейшем с переходом на мазь с содержанием НПВП, курс — до 10-15 процедур; лазеротерапия — в период ремиссии, курс — 10-12 процедур.
Классический лечебный массаж у данной категории больных не назначался, учитывая сопутствующую патологию.
При использовании больным средств опоры проводилось обучение ходьбе с помощью трости или
костылей, распределяя правильно нагрузку тела на дополнительную опору, формируя навык правильной ходьбы.
У данной категории больных активно применялась эрготерапия на специальных установках и стендах в целях формирования навыка самообслуживания и адаптации в повседневной жизни.
Лечение подгруппы Б. Комплекс применённых медикаментозных мероприятий включал те же вышеописанные пункты. В то же время, в отличие от подгруппы А, НПВП назначались в более высоких дозировках, что позволило снизить выраженность болевого синдрома, не прибегая к блокадам ГКС или опиоидным анальгетикам. Назначался лорноксикам внутривенно капельно 8 мг + 200 мл 0,9% ЫаС1 2 раза в день, 5 дней, целекоксиб в пероральной форме, 200 мг, 1 капсула 2 раза в день, 14 дней. Затем дозировка лорноксикама понижалась до 8 мг в сутки, а целекоксиба — до 200 мг в сутки, до купирования болевого синдрома либо понижения боли до целевых значений шкалы ВАШ 20-30 мм, но не более 4 недель. Также назначался омепразол 40 мг, 1 капсула 1 раз в день, на весь период применения НПВП.
Применение более высоких дозировок на раннем этапе избавило от проявлений синовита у 18 больных, что позволило провести курс инъекций гиалу- роновой кислоты на раннем этапе лечения. И только в 6 наблюдениях (синовит не купировался) пришлось предварительно прибегнуть к внутрисуставному введению ГКС.
Реабилитационные мероприятия включали более динамичные занятия ЛГ, инвазивное физиолечение, а также классический массаж.
ЛФК проводили в зале малогрупповым методом или индивидуально. В занятия включались общеразвивающие и специальные упражнения для мелких, средних и крупных мышц нижних и верхних конечностей, туловища. Из специальных упражнений выполняли специальные укладки для пораженного сустава с экспозицией 10-15 минут. В комплекс ЛГ входили динамические и статические упражнения для поражённой нижней конечности в соотношении 3:1. Количество повторов каждого упражнения варьировалось от 5 до 8 раз, количество подходов — 1-3. Время проведения ЛГ 15-20-35 минут, без учёта специальной укладки для поражённого коленного сустава.
Процедура ЛГ проводилась под контролем измерения пульса и АД до и после процедуры. Больные проходили от 5-6 занятий на петлевом комплексе, представляющем собой многофункциональную систему. Метод работы на нём основан на принципе антигравитации, что способствует уменьшению болевого синдрома и улучшению функции сустава.
• Физиотерапия была представлена одним-двумя физическими факторами, сочетающимися между собой. В разных схемах назначалось переменное магнитное поле, фонофорез с НПВП, лазеротерапия на область поражённого коленного сустава, ударно-волновая терапия, нейростимуляция. Классический лечебный массаж назначался всем пациентам по щадящей методике — 10-12 процедур ежедневно или через день.
Больным при наступлении рецидива болевого синдрома проводили повторный курс консервативного лечения в обеих подгруппах.
Результаты.
В таблице 3 представлены средние значения полученных результатов лечения больных из обеих групп.
При анализе полученных результатов можно отметить, что пациенты 1-й группы изначально имели более высокие значения боли, скованности сустава и затруднённости в повседневной жизни. В раннем периоде наблюдения (7 дней с момента начала лечения) имело место выраженное снижение показателей.
Так, боль в 1-й группе понизилась до средней отметки 18,28 мм, а во 2-й — до 28,92 мм, скованность сустава в 1-й группе составила 17,25 мм, во 2-й — 26,2 мм, затруднение повседневной жизни в 1-й группе — 22,51 мм, во 2-й — 32,78 мм. Однако уже через месяц с начала лечения данные в обеих группах практически сравнялись, при этом тенденция снижения значений по всем показателям у больных 1-й группы
продолжалась. Аналогичная динамика наблюдалась при обследовании и через 6 месяцев.К 12 месяцам наблюдения у всех пациентов во 2-й группе отмечалось выраженное повышение средних цифровых значений боли с 15,34 до 32,24 мм, скованности — с 17,2 до 35,95 мм, затруднённости в повседневной жизни — с 20,27 до 35,2 мм, что потребовало повторного курса лечения, в то же время у больных 1-й группы эффективность лечения сохранялась, при этом боль соответствовала 10,4 мм, скованность — 12,3 мм, затруднённость в повседневной жизни — 14,99. На 24-й месяц наблюдения у больных 1-й группы количественное значение болевого синдрома несколько увеличилось: боль (средние значения) — 12,64, скованность сустава — 15,65, затруднения в повседневной жизни — 16,16. У пациентов 2-й группы на фоне проведённого повторного курса лечения и с учётом периода замеров данных (год с момента повторного лечения) показатели были незначительно ниже показателей наблюдения в период 12 месяцев.
Таким образом, у больных 1-й группы удалось добиться качественного улучшения состояния сразу после осуществления ЭВПА в раннем периоде наблюдения, в отличие от 2-й группы. Более того, сохранение стабильного эффекта в период наблюдения позволило избежать дополнительных лечебных мероприятий. У 2-й группы снижение показателей боли протекало медленней и постепенно, что привело к значимому облегчению состояния пациентов на более поздних сроках.
Отмечалось значительное снижение средних показателей ВАШ на всех этапах наблюдения: в 1-й группе с 69,4 до 25,2; 19,6; 15,38; 18,4; 22,17 по сравнению с умеренной аналогичной динамикой во 2-й группе — от 67,7 до 46,6; 33,2; 26,53; 48,2; 37,4 (см. табл. 4).
Как видно из таблицы 5, на фоне значительного снижения болевого синдрома и улучшения качества жизни больных оценка WORMS показала, что за 2 года наблюдения состояние как коленного сустава в целом, так и отдельных хондральных и костных структур практически осталось на прежнем уровне во всех группах, то есть прогрессирования патологического процесса не наблюдалось. Отмечались незначительная градационная деградация гиалинового хряща сустава, умеренное уменьшение трабекулярного отёка, образование единичных субхондральных кист. Значимой разницы в исследовании состояния кортикальной кости не выявлено. Однако выявлен умеренный рост остеофитов сустава. В тканях менисков произошла незначительная дегенерация хряща, состояние связочного аппарата не изменилось, при этом наблюдалось уменьшение воспаления периартикулярных тканей сустава. Отметим, что у больных 1-й группы по сравнению со 2-й на ранних сроках исследования отмечалось более значительное уменьшение явлений воспаления мягких тканей и снижение трабекулярного отёка.
На фоне значительного снижения болевого синдрома и улучшения качества жизни больных оценка WORMS показала, что за 2 года наблюдения состояние как коленного сустава в целом, так и отдельных хондральных и костных структур практически осталось на прежнем уровне во всех группах, то есть прогрессирования патологического процесса ненаблюдалось
Осложнения.
За время наблюдения за пациентами 1-й группы встречались следующие осложнения, хотя было бы правильнее их назвать нежелательными явлениями.
На начальном этапе исследования, до внедрения усовершенствованной оригинальной методики проведения ЭВПА, отмечалась ишемическая пигментация кожи на целевой конечности у 12 пациентов, однако в дальнейшем она проявилась лишь у 1 больного из-за сложности доступа в целевую ветвь артерии во время операции. Также в этот период в 1 случае выявилось чувство онемения по медиальной поверхности коленного сустава, связанное с неселективной эмболизацией при применении эмбосфер мелкого диаметра, 7 человек отмечали образование подкожных гематом в области артериального доступа поверхностной бедренной артерии. Данные больные отличались наличием выраженной прослойки подкожно-жировой клетчатки, что затрудняло определение анатомической области прохождения поверхностной бедренной артерии. Все эти осложнения купировались самостоятельно в течение 1 месяца.
Осложнений у пациентов 2-й группы при проведении консервативных курсов лечения не наблюдалось.
Обсуждение. Лечение больных с запущенными стадиями ОА коленного сустава — достаточно сложная задача. У пациентов с III стадией поражения сустава по K-L применением консервативных тактик лечения зачастую не удаётся добиться желаемого результата в уменьшении болевого синдрома. Хирургические методы показаны не всем пациентам по ряду причин, связанных с физическим состоянием организма пациента, а некоторые больные эмоционально не готовы к операции. Также тяжело купируемый болевой синдром при III стадии ОА сильно снижает качество жизни и эмоциональный фон пациента. Выполненное исследование показало, что ЭВПА и рационально проведённое комплексное консервативное лечение согласно клиническим рекомендациям позволяет достигнуть положительных клинических результатов в виде уменьшения болевого синдрома, улучшения ортопедического статуса пациента и в целом качества жизни. Однако, несмотря на достаточную эффективность комплексной терапии в соответствии с новейшими рекомендациями в лечении ОА и использование современных медикаментов, по данным ВАШ и WOMAC, после ЭВПА удаётся добиться снижения болевого синдрома, улучшения и стабилизации функции сустава на более ранних сроках, чем у пациентов при консервативном лечении, при этом и длительность достигнутого эффекта значительно больше. Более того, положительный результат от консервативного лечения снизился к концу первого года наблюдения, и у всех пациентов произошел рецидив боли, что потребовало повторного курса лечения, в то время как в 1-й группе у большинства больных эффект от процедуры сохранялся на протяжении всего исследования, и только в 4 наблюдениях произошёл рецидив боли, а в 7 случаях отмечалось незначительное её повышение. Причиной рецидива болевого синдрома и его усиления у пациентов 1-й группы могли быть такие факторы как небольшие травмы, полученные в быту, ненормированная физическая активность при ИМТ более 40, повлекшая возобновление воспаления.
Эмболизация ветвей подколенной артерии — миниинвазивная операция, которая может качественно купировать болевой синдром, улучшить качество жизни и активность пациента и стать выходом из сложившейся ситуации для пациентов с данной проблемой.
По данным WORMS, за 2 года у всех пролеченных больных отмечалась незначительная градационная дегенерация тканей коленного сустава. Однако при сравнительной оценке парных выборок после ЭВПА процесс дегенерации тканей сустава прогрессировал менее выраженно, чем при консервативной терапии. По-видимому, это связано с более значимым уменьшением трабекулярного отёка и синовита сустава у пациентов основной группы. Эти данные подтверждают мнение, что воспаление в суставе может приводить к дегенерации тканей сустава [3, 4], стимулирует неоангиогенез, а вместе с ним и рост нервов. Предполагается, что дегенеративно изменённые структуры сустава продуцируют поступление провоспалительных цитокинов, таких как IL-1p, IL-6 и фактор некроза опухоли (TNF-a). Цитокины вызывают боль и генерируют вновь новообразование провоспалительных цитокинов. Хроническое воспаление стимулирует неоангиогенез, а вместе с ним и рост немиелинизиро- ванных сенсорных нервных волокон по ходу новообразованных сосудов [15-17]. Повышенное количество нервных окончаний приводит к увеличенному поступлению ноцицептивных нейронов, что сказывается на чувствительности тканей, тем самым усиливая болевые ощущения, а выраженная боль приводит к ещё большему образованию провоспалительных цитокинов и далее к неоангиогенезу, что приводит к порочному кругу развития болевого синдрома.
Сравнительный анализ результатов нашего исследования с данными Okuno Y. и соавт [11, 18] показал, что по опроснику WOMAC и шкале ВАШ были получены схожие исходы: значимое снижение показателей боли и общих показателей WOMAC в ближайшие сроки после проведения ЭВПА, а также сохранение эффекта на всем протяжении наблюдения, однако показатели
WORMS до ЭВПА и спустя 2 года несколько отличались. За период наблюдения общая оценка средних значений увеличилась с 42,0 до 43,1 [11, 18], в то время как, по нашим данным, она составила 67,2 и 69,3 соответственно.
Вероятно, разница обусловлена более высоким ИМТ и степенью поражения суставов у больных в проведённом нами исследовании.
Осложнения, возникшие в результате проведения ЭВПА, малочисленны и не подразумевают риск ухудшения качества жизни пациента или его здоровья,
Разработанный оригинальный способ ЭВПА— перспективная технология, которая позволяет минимизировать число нежелательных явлений. При наличии противопоказаний к её осуществлению для получения положительного эффекта от лечения необходимо применить рациональный комплекс консервативных мероприятий, включающий помимо немедикаментозных средств базисную терапию лекарственными препаратами симптом- и структурномодифицирующей терапии, которые обладают подтверждёнными данными клинической эффективности и могут повышать приверженность пациентов к лечению за счёт коротких курсов применения
также они купируются самостоятельно, без дополнительных вмешательств.Выводы.
Основываясь на двухлетних наблюдениях за пациентами с выраженным некупируемым болевым синдромом, вызванным остеоартритом коленного сустава III стадии по K-L, эмболизация ветвей подколенной артерии являлась более эффективным методом его устранения, улучшения качества жизни и социальной активности по сравнению с консервативным комплексом, при педантичном и контролируемом применении которого тоже достигаются положительные результаты.
Разработанный оригинальный способ ЭВПА — перспективная технология, которая позволяет минимизировать число нежелательных явлений.
При наличии противопоказаний к её осуществлению для получения положительного эффекта от лечения необходимо применить рациональный комплекс консервативных мероприятий, включающий помимо немедикаментозных средств базисную терапию лекарственными препаратами симптом- и струк- турно-модифицирующей терапии, которые обладают подтверждёнными данными клинической эффективности и могут повышать приверженность пациентов к лечению за счёт коротких курсов применения.
Литература
Kulkarni K, Karssiens T, Kumar V, Pandit H. Obesity and osteoarthritis. Maturitas. 2016; 89:22-28.
Ugeskr Laeger. 2020; 182(42):V06200477. Danish. PMID: 33046193
Conaghan PG, Cook AD, Hamilton JA, Tak PP. Therapeutic options for targeting inflammatory osteoarthritis pain. Nat Rev Rheumatol. 2019; 15(6) :355-363. https: //doi.org/10.1038/s41584-019-0221-y
Scott CEH, MacDonald DJ, Howie CR. 'Worse than death' and waiting for a joint arthroplasty. Bone Joint J. 2019; 101-B(8):941-950. https: //doi.org/10.1302/0301-620X.101B8.BJJ-2019-0116.R1
Мурылев В.Ю., Цыгин Н.А., Шутов Е.В., Жучков А.Г., Рукин Я.А. Тотальное эндопротезирование тазобедренных и коленных суставов у пациентов с хронической болезнью почек (обзор литературы). Травматология и ортопедия России. 2018; 24(2):138-145. [Murylev VYu, Tsygin NA, Shutov EV, Zhuchkov AG, Rukin YaA. Total Hip and Knee Arthroplasty in Patients with Chronic Kidney Disease (Review). Traumatology and orthopedics of Russia. 2018; 24(2):38-145. (In Russ.)]. https:// d
Pelletier JP, Raynauld JP, Abram F, Haraoui B, Choquette D, Martel-Pelletier J. A new non-invasive method to assess synovitis severity in relation to symptoms and cartilage volume loss in knee osteoarthritis patients using MRI. Osteoarthritis Cartilage. 2008; 16 Suppl 3:S8-13.
Angiogenesis in the synovium and at the osteochondraljunction in osteoarthritis. Osteoarthritis Cartilage. 2007; 15(7):743-51. https: //doi.org/10.1016 /j.joca.2007.01.020
Меджидов К.М., Паршиков М.В., Гинзбург Л.М., Соловьёв Ю.С.,
Ужахов И.М. Эмболизация артерий в купировании суставной и околосуставной боли: как, когда и у кого? Обзор литературы. Вестник травматологии и ортопедии им. Н.Н. Приорова. 2022; 29(3) :307-316. [MedjidovKM, Parshikov MV,
Ginzburg LM, Solov'yev YuS, Uzhakhov IM. Embolization of the arteries in the relief ofjoint and nearjoint pain: how, when and in whom? A review. N.N. Priorov Journal of Traumatology and Orthopedics. 2022; 29(3):307—316. (In Russ.)].
Okuno Y, Korchi AM, Shinjo T, Kato S. Transcatheter arterial emboli zation as a treatment for medial knee pain in patients with mild to moderate osteoarthritis. Cardiovasc Intervent Radiol. 2015; 38(2) :336-343
Клинические рекомендации, утвержденные АРР в 2013 г.
Федеральные клинические рекомендации по ревматологии с дополнениями от 2016 г. по диагностике и лечению остеоартрита.
Паршиков Михаил Викторович — д. м. н., профессор кафедры травматологии, ортопедии и медицины катастроф Российского университета медицины, Москва, Россия — ответственный за контакты
Меджидов Камал Магомедалиевич — врач травматолог-ортопед ГБУЗ МО «Домодедовская больница», Московская обл., Домодедово, Россия / Kamal M. Medjidov — MD, orthopedic traumatologist of a SBHI MR «Domodedovo Hospital», Moscow region, Domodedovo city, Russia.
Говоров Михаил Викторович — к. м. н., доцент кафедры травматологии, ортопедии и медицины катастроф Российского университета медицины, Москва, Россия / Mikhail V. Govorov — MD, PhD, Associate Professor of the Department of Traumatology, Orthopedics and Disaster Medicine of the Russian University of Medicine, Moscow, Russia.
Кузбашева Татьяна Георгиевна — к. м. н., врач лечебной физкультуры, временно не работает / Tatyana G. Kuzbasheva — MD, PhD, doctor of physical therapy.
Шерматов Кымбатбек Рустамбекович — к. м. н., врач травматолог- ортопед ГБУЗ МО «Домодедовская больница», Московская обл., Домодедово, Россия / Kymbatbek R. Shermatov — MD, PhD, orthopedic traumatologist of a SBHI MR «Domodedovo Hospital», Moscow region, Domodedovo city, Russia.
Теги: остеоартрит коленного сустава
234567 Начало активности (дата): 24.08.2024 14:45:00
234567 Кем создан (ID): 989
234567 Ключевые слова: остеоартрит коленного сустава, эмболизация ветвей подколенной артерии, миниинвазивная операция, некупируемый болевой синдром, комплексное консервативное лечение.
12354567899
Похожие статьи
Рентген на дому 8 495 22 555 6 8Механизм наследования идиопатического сколиоза
Результаты применения внутритканевой электростимуляции при лечении начальных стадий гонартроза у лиц пожилого и зрелого возраста
Анализ причин ревизионных артропластик коленного сустава
30.07.2024 15:04:33



