 19.04.2024
19.04.2024
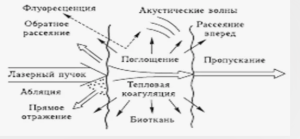
Поглащение и рассеяние лазерного излучения в суставном хряще при обработке очага
Артроскопическая лазерная обработка суставного хряща является эффективным и перспективным методом лечения остеоартроза
Остеоартроз - одно из наиболее распространённых заболеваний, приводящих к потере трудоспособности. Артроскопическая лазерная обработка суставного хряща является эффективным и перспективным методом лечения остеоартроза, однако её методика может быть улучшена за счёт результатов данного исследования.Цель исследования: экспериментальная оценка коэффициентов поглощения и рассеяния лазерных излучений с длинами волн Х=1.55 мкм и Х=0.97 мкм в тканях суставного хряща и установления роли этих излучений в механизме лазерного воздействия при лечении хондропатии.
Введение
Остеоартроз - болезнь, проявляющееся повреждением суставного хряща, является одним из наиболее распространённых заболеваний, поражающая до 50 % взрослого трудоспособного населения старше 50 лет. Он выражается в появлении на поверхности хряща очагов хондропатии - зон локальной деструкции суставного хряща [1, 2, 3]. Во время артроскопических операций у пациентов с артрозом может выполняться лазерная обработка
очагов хондропатии. Лазерная обработка имеет ряд преимуществ по сравнению с другими типами воздействия, такими как хоолодноплазменная абляция и механическое воздействие [4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21]. В первую очередь такими преимуществами являются: дозированность и высокая точность воздействия, позволяющие свести вероятность повреждений хряща вне обрабатываемой области к минимуму;стимуляция регенерации хрящевой ткани в очаге хондромаляции по механизмам механобиологии.
Авторами был проведен ряд экспериментов по изучению воздействия сочетанного двухволнового излучения 1=0,97 мкм + 1=1,55 мкм на хрящ [22]. Оказалось, что при таком сочетанном двухволновом воздействии необходимый эффект («сглаживание» поверхности хряща) достигается при меньшей суммарной мощности. Было установлено, что в среде 0,9% раствора NaCl эффективное «сглаживание» поверхности хряща при минимальном термическом воздействии на окружающие ткани происходит при использовании двухволнового излучения 1,55 мкм / 5 Вт и 0,97 мкм /3 Вт в импульсно-периодическом режиме (импульс/пауза=100 мс/50 мс) с расстояния 2 мм в течении 2 с [22]. Также было показано, что наибольший вклад в нагрев хрящевой ткани вносит излучение 1=1.55 мкм, по- глощающееся в поверхностных областях, тогда как излучение 1=0.97 мкм поглощается слабее и проникает в более глубокие слои [22].
Для отработки этой и подобных лазерных технологий, для уточнения механизма действия лазерного излучения на биоткани, а также для проведения моделирования необходимы данные об оптических характеристиках суставного хряща в используемых спектральных диапазонах. Целью данной работы являются экспериментальная оценка коэффициентов поглощения и рассеяния лазерных излучений с длинами волн 1=1.55 мкм и 1=0.97 мкм в тканях суставного хряща и установления роли этих излучений в механизме лазерного воздействия при лечении хондропатии.
Материалы и методы
В качестве объектов воздействия использовались образцы суставного хряща свиньи.
При помощи криомикротома из образцов хрящевой ткани свиньи были изготовлены тонкие срезы толщиной 100 мкм и 200 мкм. Срезы были помещены между 2 предметными стёклами, смоченными изотоническим 0,9 % раствором Nad
Для измерения оптических свойств образов был использован «метод подвижных интегрирующих сфер» [25]. По сравнению с классическим методом при котором сферы фиксируются вплотную к образцу [27, 28], данный метод
позволяет значительно повысить точность определения оптических свойств, что обусловлено увеличением количества экспериментальных данных при различных положениях образца [29].Фотография и блок-схема установки представлены на Рисунке 1.
Основу установки составляют лазерный источник 1 FiberLase CR (НТО «ИРЭ-Полюс», Россия) и две интегрирующие сферы (2 и 3) Thorlabs IS200-4 диаметром 8 см с входными портами 12.5 мм. Излучение от источника 1
попадало на клин 4, который отводил часть излучения на измеритель мощности 13, необходимый для контроля мощности лазера. Проходящее через клин излучение диафрагмируется до диаметра 1-2 мм на диафрагмах 5, а также модулировалось чоппером (Thorlabs MC2000B-EC) 6 на частоте 130 Гц. После чоппера излучение с помощью зеркало 7 перенаправлялось во входной порт нижней интегрирующей сферы 2. Пройдя через образец 8, часть излучения, попадало в верхнюю сферу 3. Каждая сфера была оснащена фотодетектором Thorlabs PDA10CS2 (9 и 10), сигнал с которых регистрировался с помощью синхронного детектора, выделяющего сигнал на частоте модуляции излучения (12).Применения метода синхронного детектирования при измерении сигналов с фотодетекторов способствует значительному увеличению точности ввиду исключения влияния электрических и оптических шумов, возникающих вне
частоты модуляции. Поочередное считывания показаний детекторов осуществлялось с помощью мультиплексора 11.В процессе измерения образец располагался на подвижной платформе 16 и с помощью шагового двигателя 15 обеспечивалось его передвижение в пространстве между сферами.
Управление ходом эксперимента осуществлялось с помощью компьютера (PC).
В ходе эксперимента измерялись зависимости PT(LT) и PR(LR), где - PTи P - мощности регистрируемые детекторами верхней и нижней интегрирующих сфер соответственно, LT и LR - расстояния от образца до ближнего порта верхней и нижней сфере соответственно [25].
Полученные значения мощностей нормировались на значения мощности, регистрируемой в отсутствие образца каждой сферой в отдельности. Измеренные нормированные зависимости PT(LT) и Pr(Lr) являются монотонно убывающими функциями.
На больших расстояниях функция PT(LT) стремится к некоторому ненулевому значению, которое соответствует значению коллимированного пропускания.
Оптические свойства биологических тканей определялись при совмещении этих результатов с результатами математического моделирования с использованием численного метода Монте-Карло, подробно описанного в работе [26].
Метод подвижных интегрирующих сфер, представленный в работе, позволяет значительно повысить точность определения оптических свойств. По сравнению с классическим методом, при котором сферы фиксируются вплотную к образцу [27, 28], в данном методе повышение точности обусловлено увеличением количества экспериментальных данных при различных положениях образца [29].
Теоретическая часть:
Описание процессов взаимодействия биологических тканей с лазерным излучением требует знания их оптических свойств. К основным оптическим параметрам биологических материалов следует отнести показатель преломления n(s,X) коэффициенты поглощения р (s,X) и рассеяния р (s,X), фазовую функцию рассеяния p(s, s', X, X'), а также параметр анизотропии рассеяния g(s,X) (средний косинус угла между направлением распространения до и после рассеяния cosd) которые зависят от длины волны X и направления распространения s.
Распространение света в изотропной среде в отсутствие неупругого рассеяния может быть описано уравнением переноса [23]:
13/(f, s, t) с dt = -(sVI(r, s, t)) - -О + [1 s)I(r, s, t) + J p(s, s')I(r, s, t)du’ + s(r, s, t) (1)
где I)r , s, t) - лучевая интенсивност1> [Вт м-2 ср-1] в точке, соответствующей радиус-вектору г, р - коэффициент поглощения, р - коэффициент рассеяния, p(s, Ж ') - фазовая функция рассеяния, Л? S, t) - функция сеисывающая распределение источников св(ста, doc' - т-лесный угол в направлении s . Фазовая функция p(S, В'] описывает рассеивающие свойства среды и прстутавляе- собой функцию плот ности вероятвости для рассеяния в направлении s' фотона, изначально движущегос- в направл-нии Ж, т.е. хса;раьстеризует э лемеутарный акт рассеяния. Если ц-сс еяние си мметрично относительно направления распространения паднющей волны, тогда фазовая функция зависит тнлько от угла в между направлениями В и В', т.е. р(н, ?')= р(в).
Предположение о случайном распределение 'ус-еиваселей в среде означсет отсутствие в структуре биоткани пространственной корреляции,что вриводит к нормировке:
лJ p(e)2nsindde = 1 (2)
Во многих случаях фазовая функция хорошо аппроксимируется функцией Хеньи-Гринштейна [27]:
Р(в) = 7Z1-д24 п ()+g2-2gcos9)3/2'
д =< cosO >= j р(в) ¦ о (3)
д изменяотся от О до 1: соответствует случаю изотропного пропускания ., диффузного оттажения и коаффиционта коллимированного проптскания Т13. Верхний индекс m (измеренный) указывает на эмпирическое происхождение использулмасх сначений. Пеовые два измерения проводятся при помощи установки содержащей одну или две интегуизующие сферы. Конфигурация устанонки схематично покозанаяа нис. 1а.
Измеренные значения Ту Ы?т|преоб]:1а^яД)тся в действительные значения полного пропускания Tt и диффузного отражения Rd с учетом itолученных для интегрирующей сферы корреьций [24].
После п ол учения экспериментальных данных и их коррекции решается система уравнений [24]:Тсс (с, д, т) - Тст = 0
Ttc(c, д, т)
Tt = 0 (4)
Rcd{c,д,т= - Rd = 0
где щит Т это оптическая толщина образца, d, ( гтометричесоая толщина оброзца, с=р/ptн альбедо (исроктериотива диффузной отражательной способности поверхности), и pt=pa+ps -полный (интвгральный) коэффицие т ослабления.
Индекс с (вычисленный, прогнозируемый, аналитический) указывает на то, что значения вычисляются в соответствии с моделью распространения света в среде. Эта система нелинейна относительно оптических свойств т, с и д. Обозначим левую часть системы (4) за F=(F, F2, FJ. Если вклада рассеянного света в измеряемое коллимированное пропускание нет, оптическая толщина т может быть оценена в соответствии с законом Бера и система уравнений (4) уменьшится до двух уравнений для с ид. Если, однако, этот вклад значителен, все 3 уравнения решаются совместно.
С целью исключения случайных и инструментальных погрешностей и повышения точности моделирования использовался комбинированный подход, включавший в себя как стандартные измерения при помощи интегрирующих
сфер, так и гониометрические измерения [25].
Измерения для излучения с А=0,97 мкм проводились на 3 образцах толщиной 100 мкм и одного образца толщиной 200 мкм.
Измерения для излучения с А=1,55 мкм проводились на 2 образцах толщиной 100 мкм и 200 мкм соответственно.
Результаты
Измерения оптических параметров с источником 0,97 мкм
Графики зависимостей нормированных мощностей, регистрируемых верхней (пропускание) и нижней (отражение) сферами от положения образцов представлены на рис. 2 и 3.
На графике коэффициента пропускания для образцов 100 мкм наблюдается разброс ~10% , который, как мы полагаем, связан с неоднородностью свойств образцов, и наличием в препарате пузырей.
Из рис. 2 видно, что для образцов ткани толщиной 100 мкм зависимости коэффициента полного пропускания от положения образца между сферами близки к линейным.
На графике коэффициента пропускания для образцов 100 мкм наблюдается разброс ~10% , который, как мы полагаем, связан с неоднородностью свойств образцов, и наличием в
препарате пузырей.
Из рис. 2 видно, что для образцов ткани толщиной 100 мкм зависимости коэффициента полного пропускания от положения образца между сферами близки к линейным.
Измерения оптических параметров с источником 1,55 мкм
Данные зависимостей нормированных мощностей, реги-стрируемых верхней (пропускание) и нижней (отражение) сферами от положения образца представлены на рис. 3.
Для зависимостей коэффициента полного пропускания наблюдается хорошая повторяемость, что свидетельствует о корректности получаемых данных. Для зависимостей коэффициента диффузного отражения (обратного рассеяния) ошибки измерения становятся довольно значительными, т.к. уровень обратного рассеяния довольно низкий. Следует отметить, что в регистрируемый сигнал вклад вносит также засветка и шум
фотодетектора.
Обсуждение
Ниже, на рисунке 4, приведены графики зависимостей для излучения с 1=0,97 мкм, рассчитанных методом Монте-Карло, с использованием оптических параметров, приведенных в табл. 1 для образца толщиной 200 мкм. Расчет параметров проводился обратным методом Монте-Карло, в качестве функции, описывающей акт рассеяния, использовалась функция Хеньи-Гринштейна.
Подобная закономерность наблюдается также и в работах других авторов [32, 33, 34, 35], хотя числовые значения р и р расходятся в отдельных работах, что можно объяснить различиями в условиях экспериментов, качестве образцов, а также методах измерения.
Выводы
Данный эксперимент позволил нам ответить на воз-никшие ранее в рамках более крупного исследования [22] вопросы. Были определены коэффициенты поглощения и рассеяния лазерных излучений с длинами волн Я=1.55 мкм
и Я=0.97 мкм и на основании полученных данных сделаны следующие выводы:
При прохождении через толщу суставного хряща коэффициент поглощения (р ) у лазерного излучения с Я=0,97 мкм значительно ниже чем у лазерного излучения с Я=1,55 мкм.
При прохождении через толщу суставного хряща коэффициент рассеяния (р) у лазерного излучения с Я=0,97 мкм значительно выше чем у лазерного излучения с Я=1,55 мкм.
При лазерной обработке очага хондропатии сочетанным излучением Я=0,97 мкм + Я=1,55 мкм, излучение Я=1,55 мкм «сглаживает» поверхность суставного хряща в очаге хондромаляции позволяя достигать восстановления структурности суставной поверхности, а параметры излучения Я=0,97 мкм в толще суставного хряща позволяют запустить механизмы фотобиомодуляции в суставном хряще и подлежащей суб- хондральной кости.
Список литературы
1.Glyn-Jones S., Palmer A. J. R. Agricola, AJ Price, TL Vincent,H. Weinans . AJ Carr, Osteoarthritis. Lance., 2015; 386(9991): 376-87 Doi: 10.1016/S0140-6736(14)60802-3
2. Madry H., Kon E., Condello V, Peretti G.M., Steinwachs M., Seil R., Berruto M., Engebretsen L., Filardo G., Angele P (2016) Early osteoarthritis of the knee. Knee Surg Sports Traumatol Arthrosc, 2016;24:1753-1762 Doi: 10.1007/s00167-016-4068-3
3. Корнилов Н. Н., Денисов А. А. Парадигма раннего гонартроза: обзор современных возможностей диагностики и лечения (часть 1) //Терапевтический архив // 2017; 12-2(89):238-243. [Kornilov N. N., Denisov A. A. Paradigma rannego gonartroza: obzor sovremennyh voz-mozhnostej diagnostiki i lecheniya (chast’ 1) Terapevticheskij arhiv 2017;
12-2(89):238-243]4. Иванников С. В Лазерная артроскопическая хирургия (Дегенеративно-дистрофические поражения коленного сустава). Москва, 2001; 19 с. [Ivannikov S. V Lazernaya artroskopicheskaya hirurgiya (Degenerativno-distroficheskie porazheniya kolennogo sustava) Moscow, 2001; pp. 19] Перспективы лечения дискогенных компрессионных форм пояснично-крестцовых радикулитов с помощью пункционных неэндоскопических лазерных операций // Сандлер Б. И. [и др.]. Владивосток. 2004. 181 с.[ Sandler B. I. et al. Perspektivy lecheniya diskogennyh kompressionnyh form poyasnichno-krestcovyh radikulitov s pomoshch’yu punkcionnyh neendoskopicheskih lazernyh operacij Vladivostok
5. Лазерная инженерия хрящей / Баграташвили В. Н. [и др.]. Москва. 2006. 448 с. [Bagratashvili V N. et al. Lazernaya inzheneriya hryashchej Moscow, 2006. 448 p. ]
6.Sobol E. etal. Laser regeneration of spine discs cartilage: mechanism, in-vivo study and clinical applications. Proceedings of Light-Activated Tissue Regeneration and Therapy Conference. Springer, Boston, MA, 2008. Pp. 259-266.
7. Holden P. K. et al. The effects of laser irradiation of cartilage on chondrocyte gene expression and the collagen matrix. Lasers in Surgery and Medicine: The Official Journal of the American Society for Laser Medicine and Surgery, 2009; 7(41):487
8. Yusupov V I., Chudnovskii V M., Bagratashvili V N. Laser-induced hydrodynamics in water-saturated biotissues: 2. Effect on delivery fiber. Laser Physics, 2011; 7(21): 1230-1234 Doi:10.1134/S1054660X11140015
9. Yusupov V. I. et al. Laser-induced hydrodynamics in water-saturated tissue: III. Optoacoustic effects. Laser Physics, 2013; 1(24): 015601
10. Yusupov V I. et al. Generation of acoustic waves by cw laser radiation at the tip of an optical fiber in water. Acoustical Physics, 2016; 5(62): 537-544. Doi:10.1134/S1063771016050183
11. O’Conor C. J., Case N., Guilak F. Mechanical regulation of chondrogenesis. Stem cell research & therapy, 2013; 4(4): 1-13 Doi:10.1186/ scrt211 Fahy N., Alini M., Stoddart M. J. Mechanical stimulation of mesen-chymal stem cells: Implications for cartilage tissue engineering. Journal of Orthopaedic Research, 2018; 1(36): 52-63 Doi :10.1002/jor.23670 Juang Y. M. et al. Proteomic analysis of chondrocytes exposed to pressure. Biomedical Chromatography, 2010:12(24): 1273-1282
12. Mizuno S., Ogawa R. Using changes in hydrostatic and osmotic pressure to manipulate metabolic function in chondrocytes. American Journal of Physiology-Cell Physiology, 2011;6(300): 1234-1245 Doi:10.1152/ ajpcell.00309.2010
13 .Karamesinis K. et al. Continuous hydrostatic pressure induces differentiation phenomena in chondrocytes mediated by changes in polycystins, SOX9, and RUNX2. Journal of Orofacial Orthopedics/Fortschritte der Kieferorthopadie, 2017;1(78):21-31 Doi:10.1007/s00056- 016-0061-1
14. Sobol E. N. et al. Laser-induced regeneration of cartilage. Journal of Biomedical Optics, 2011; 8(6): 080902. Doi:10.1117/1.3614565
15. Alexandrovskaya Y. M. et al. Mechanisms of laser activation of chondrocytes in osteoarthritis healing. Laser Physics Letters, 2018;8(15): 085601 Doi:10.1088/1612-202X/aac746
16. Баум О. И. Механизмы модификации хрящевой ткани и тканей глаза под действием лазерного излучения. Москва. 2016. 22 с.
Информация об авторах:
Лычагин Алексей Владимирович - доктор медицинских наук, заведующий кафедрой травматологии, ортопедии и хирургии катастроф ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет)
Юсупов Владимир Исаакович - кандидат технических наук, старший научный сотрудник Института фотонных технологий Федерального научно-исследовательского центра “Кристаллография и фотоника”, Россия
Сурин Владимир Владимирович - аспирант кафедры травматологии, ортопедии и хирургии катастроф ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет), Россия
Иванников Сергей Викторович - доктор медицинских наук, профессор, профессор кафедры травматологии, ортопедии и хирургии катастроф первого ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет), Россия
Петров Павел Игоревич - ассистент кафедры травматологии, ортопедии и хирургии катастроф ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет), Россия
Коваленко Никита Валерьевич - научный сотрудник НТО ИРЭ Полюс , Россиия
Шевелкина Екатерина Дмитриевна - научный сотрудник НТО ИРЭ, Россия
Заров Алексей Юрьевич - ассистент кафедры травматологии, ортопедии и хирургии катастроф ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет)
Теги: остеоартроз
234567 Начало активности (дата): 19.04.2024 10:40:00
234567 Кем создан (ID): 989
234567 Ключевые слова: остеоартроз. лазерное излучение, хрящ
12354567899
Похожие статьи
Реконструкция тазобедренного сустава у молодых пациентов с диспластическим коксартрозомРентген на дому 8 495 22 555 6 8
Изометрия как предиктор результата остеосинтеза при переломах задних отделов вертлужной впадины
Результаты ревизионного эндопротезирования коленного сустава с применением индивидуальных имплантатов
Среднесрочные результаты лечения перипротезной инфекции с применением спейсеров с углеродным покрытием, импрегнированных серебром



