 05.01.2024
05.01.2024
Среднесрочные результаты лечения перипротезной инфекции с применением спейсеров с углеродным покрытием, импрегнированных серебром
Поверхность имплантатов — идеальное место для бактериальной адгезии, способствующей об-разованию зрелой биопленки
Введение
Эндопротезирование суставов в настоящее время признано золотым стандартом лечения пациентов с остеоартрозом III—IV стадий. Преимуществами эндопротезирования являются быстрое купирование болевого синдрома, полноценное восстановление двигательной активности пациента при коротком реабилитационном периоде [1, 2].
Одним из ведущих осложнений эндопротезирования является перипротезная инфекция (ППИ). ППИ — тяжелое осложнение эндопротезирования как для пациента (необходимость в повторных операциях), так и для системы здравоохранения (увеличение длительности госпитализации, высокие экономические затраты) [3]. Частота ППИ после первичного эндопротезирования составляет 0,5-3,0% [4], а при повторных вмешательствах достигает 30% [5, 6, 7].
Фактором, существенно осложняющим течение ППИ, является быстрое формирование бактериальных биопленок на установленных металлоконструкциях [8]. Основная задача при лечении имплантат-ассоциированных инфекций — профилактика развития этих процессов [9].
Общепризнанным стандартом лечения ППИ является двухэтапное ревизионное эндопротезирование с применением артикулирующих спейсе- ров, как правило, импрегнированных антибиотиками [10]. Используются как спейсеры, компоненты которых изготовлены из одного материала, чаще всего полиметилметакрилата (ПММА), так и комбинированные (цемент-металлические, цементполиэтиленовые, цемент-керамические и т.д.)
ПММА используется как матрица для обеспечения депо антибиотика [10, 11]. Предпринимаются попытки включить в состав ПММА антисептики или частицы галогенов, металлов с антимикробной активностью (серебро, цинк, медь и др.), но таких работ крайне мало [12, 13]. Поскольку у микроорганизмов не формируется резистентность к таким веществам, обладающим широким спектром бактерицидной активности, создание новых антимикробных покрытий компонентов эндопротеза является перспективным направлением в лечении инфекционных осложнений эндопротезирования суставов с применением спейсеров [14, 15].
Поверхность имплантатов — идеальное место для бактериальной адгезии, способствующей образованию зрелой биопленки [16]. Для создания предотвращающего адгезию бактерий барьера необходимо изменить поверхность имплантированного устройства или материала либо напрямую, либо с помощью эффективного покрытия [17].
Способность модификации поверхности имплантата минимизировать бактериальную адгезию, ингибировать образование биопленки и обеспечивать эффективное уничтожение бактерий для защиты имплантированных биоматериалов изучалась в нескольких исследованиях. Некоторые авторы показали низкую эффективность использования алмазоподобных покрытий, содержащих сочетание sp2- и sp3-углеродных высокоэнергетических связей, ограничивающую их применение в травматологии и ортопедии [18, 19]. Результаты других исследований выявили преимущества покрытий на основе двумерно упорядоченного линейно-цепочечного углерода (ДУ ЛЦУ) в силу особенностей их структуры — хорошую адгезию к поверхности металлических имплантатов, прочность, биологическую совместимость [20]. Д.В. Тапальский с соавторами выполнили многоцентровое исследование, целью которого была оценка антибактериальной активности и биологической совместимости покрытий металлоконструкций на основе ДУ ЛЦУ. Результаты исследования показали, что покрытия на основе ДУ ЛЦУ+Ag обеспечивают выраженный поверхностный бактерицидный эффект и обладают способностью предотвращать формирование микробных биопленок на металлических поверхностях. Покрытия на основе ДУ ЛЦУ безопасны, они не вызывают цитотоксических эффектов [21].
Однако в литературе отсутствуют публикации о результатах клинических исследований эффективности покрытий на основе ДУ ЛЦУ.
Цель исследования — оценить среднесрочные результаты использования спейсеров с покрытием на основе двумерно упорядоченного линейно-цепочечного углерода, легированного серебром, при лечении перипротезной инфекции крупных суставов нижних конечностей.
Выполнено открытое проспективное когортное рандомизированное исследование.
Исследование выполнялось в Центре с 2017 по 2021 г. и было основано на результатах обследования и оперативного лечения пациентов с впервые выявленной ППИ коленных (КС) и тазобедренных (ТБС) суставов.
Критерием включения пациентов в исследование служил подтвержденный случай ППИ по критериям Международной согласительной конференции по перипротезной инфекции 2013 г. [22].
Критериями невключения являлись возраст пациента менее 18 лет, беременность, отказ пациента участвовать в исследовании на любой стадии исследования.
После применения критериев включения и невключения для исследования были отобраны 144 пациента: 82 — с ППИ ТБС и 62 пациента с ППИ КС, в том числе 71 женщина (49,3%) и 73 мужчины (50,7%).
Пациенты были рандомизированы на две группы методом генерации случайных чисел с использованием программы Excel.
В первой группе пациентам устанавливали артикулирующий спейсер с покрытием двумерно упорядоченным линейно-цепочечным углеродом, легированным серебром (ДУ ЛЦУ+Ag). Во второй группе пациентов использовали традиционный артикулирующий спейсер с антибиотиками (рис. 1).
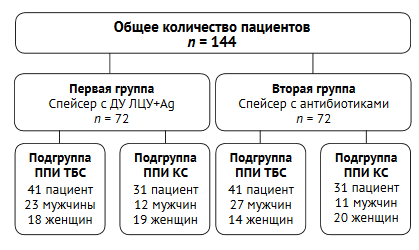
Рис. 1. Блок-схема исследования Fig. 1. Study flowchart
Пациенты обеих групп были сопоставимы по полу и возрасту (табл. 1).
В ходе исследования осуществляли тщательный сбор анамнеза с целью выявления сопутствующей патологии и возможных факторов риска, которые предположительно могли стать причиной развития ППИ. Проведен анализ наиболее часто встречающейся соматической патологии.
Лечение ППИ проводилось методом двухэтапного ревизионного эндопротезирования. Цель первого этапа — санация сустава с использованием спейсера в сочетании с механической обработкой патологических тканей. На втором этапе после купирования инфекции и оценки клиниколабораторных показателей производилась установка постоянного эндопротеза. Все пациенты получали эмпирическую или этиотропную антибиотикотерапию по результатам определения антибиотикочувствительности выделенного из очага патогена.
Оценка результатов
Сравнительная оценка болевого синдрома и лабораторных показателей (уровень СРБ, СОЭ, Д-димер) в первой и второй группах проводилась до и после лечения, оценка функции суставов на основе функциональных оценочных шкал выполнялась отдельно по тазобедренному и коленному суставам.
Интервал между двумя этапами реэндопротезирования оценивался в днях и в первой группе пациентов был статистически значимо ниже, чем во второй, — 64,5 (53-103) дней; во второй группе — 78 (63,5-111,0) дней, р = 0,010.
После проведенного лечения проводилась сравнительная оценка выраженности болевого синдрома, качества жизни, функции суставов (на основе оценочных шкал) и лабораторных показателей (уровень СРБ, СОЭ, прокальцитонина, пресепсина, цитоз и содержание нейтрофилов в суставном пун- ктате перед I и II этапами лечения). Оценка среднесрочных функциональных результатов лечения проводилась через 2 года после проведенного лечения по шкалам KSS, Harris, ВАШ боли, EO-5D-5L.
Статистический анализ
При статистической обработке данных рассчитывали среднее и стандартное отклонение (М±ст). При отсутствии нормального распределения либо ранговых данных определяли медиану (Me), верхний и нижний квартили — Q1-Q3.
Статистическую значимость различий между данными при нормальном распределении оценивали по t-критерию Стьюдента, а при отсутствии нормального распределения и для ранговых данных — по непараметрическому критерию Манна - Уитни, различия в динамике оценивали по критерию Вилкоксона. Для качественных данных оценка различий проводилась по критерию %2. Статистический анализ проводили в программе Statistka for Windows 10.0, данные считали статистически значимыми при вероятности ошибки (р) менее 0,05.
Таблица 1.
Распределение пациентов по полу и возрасту
|
Показатель |
Первая группа |
Вторая группа |
|
||
|
абс. |
% |
абс. |
% |
Р |
|
|
Мужчины |
35 |
48,6 |
38 |
52,8 |
0,617 |
|
Женщины |
37 |
51,4 |
34 |
47,2 |
0,617 |
|
Средний возраст, лет Me (Q1-O3) |
63,5 (57,5-70,0) |
62,0 (54,5-69,0) |
0,500 |
||
Результаты
По исходным показателям общего анализа крови группы исследования между собой не различались. Исходные показатели маркеров воспаления также были сопоставимы, однако в обеих группах в динамике произошло их снижение. Уровень СРБ был ниже в первой группе, уровни прокальцито- нина и пресепсина были сопоставимы. Произошла нормализация цитоза и числа нейтрофилов в суставном пунктате в обеих группах, все полученные значения находились в пределах референсного интервала (табл. 2).
Таблица 2
Результаты лабораторного обследования пациентов перед I и II этапами лечения
|
Показатель |
Срок обследования |
Первая группа (n = 72) |
Вторая группа (n = 72) |
Р |
|
Лейкоциты, *109/л |
Перед I этапом |
7,9 (7,0-9,8) |
8,5 (7,1-10,3) |
0,287 |
|
|
Перед II этапом |
6,5 (5,9-8,0)* |
7,2 (5,8-8,6)* |
0,275 |
|
СОЭ, мм/ч |
Перед I этапом |
46,5 (29,5-69,5) |
43,0 (25,5-73,5) |
0,694 |
|
|
Перед II этапом |
20,5 (12,0-32,0)* |
18,0 (10,0-34,0)* |
0,379 |
|
Гемоглобин, г/л |
Перед I этапом |
121,0 (112,0-132,0) |
122,0 (110,0-140,5) |
0,361 |
|
|
Перед II этапом |
121,0 (111,0-130,0) |
124,0 (113,5-136,0) |
0,145 |
|
Эритроциты, х1012/л |
Перед I этапом |
4,3 (4,0-4,7) |
4,45 (4,1-4,8) |
0,210 |
|
|
Перед II этапом |
4,4 (3,9-4,9) |
4,4 (4,2-4,9) |
0,225 |
|
Тромбоциты, х109/л |
Перед I этапом |
316,5 (275,5-385,5) |
337,5 (283,0-420,5) |
0,266 |
|
|
Перед II этапом |
270,5 (232,0-314,0) |
267,0 (222,0-330,5) |
0,951 |
|
СРБ, мг/л |
Перед I этапом |
17,6 (7,9-73,5) |
39,1 (12,7-71,3) |
0,082 |
|
|
Перед II этапом |
5,0 (2,6-8,2)* |
5,0 (4,5-11,8)* |
0,029 |
|
Прокальцитонин, нг/мл |
Перед I этапом |
0,032 (0,02-0,076) |
0,04 (0,02-0,0655) |
0,414 |
|
Перед II этапом |
0,02 (0,02-0,032)* |
0,023 (0,02-0,04) |
0,09 |
|
|
Пресепсин, пг/мл |
Перед I этапом |
300,0 (204,5-300,0) |
300,0 (250,0-448,0) |
0,055 |
|
|
Перед II этапом |
190,0 (150,0-191,0) |
200,0 (200,0-200,0) |
0,085 |
|
Цитоз, кл. х103/л |
Перед I этапом |
17500,0 (4312,5-49250,0) |
15000,0 (5370,0-45500,0) |
0,881 |
|
|
Перед II этапом |
382,5 (110,0-1100,0)* |
300,0 (150,0-814,0)* |
0,921 |
|
Нейтрофилы, % |
Перед I этапом |
93,0 (88,5-95,0) |
92,0 (88,5-95,0) |
0,854 |
|
|
Перед II этапом |
12,0 (12,0-48,0)* |
12,0 (12,0-70,0)* |
0,885 |
Различия в динамике по критерию Вилкоксона при p<0,05.
Частота рецидивов после I этапа лечения в первой группе составила 2,8% (2 из 72) по сравнению с 11,1% (8 из 72) во второй группе (р = 0,049). Рецидивов после II этапа в первой группе не было, и значения остались прежними — 2,8% (2 из 72) против 20,8% (15 из 72) во второй группе (р<0,001).
Функциональное состояние и уровень болевого синдрома при равных исходных показателях после II этапа лечения ППИ и в среднесрочном послеоперационном периоде были более благополучными в первой группе. Нами был проведен анализ болевого синдрома среди лиц, не имеющих рецидива ППИ. Оказалось, что среднесрочные результаты были лучше в первой группе и в этом случае. В группах также проведена оценка качества жизни по опроснику EO-5D-5L. Тестирование после проведенного лечения показало, что результаты были лучше в первой группе, чем во второй, по 100-балльной шкале EO-VAS общего самочувствия и интегральной оценке EO-5D-5L (табл. 3).
Положительная динамика лабораторных показателей сопровождалась и улучшением функции суставов. Через 2 года после окончания лечения в первой группе функция сустава по шкале Harris у пациентов после
Таблица 3
Среднесрочные результаты по опроснику EQ-5D-5L у пациентов без рецидива ППИ
|
Показатель |
Первая группа (n = 70) |
Вторая группа (n = 57) |
|
EO-5D-5L, доля |
0,88 (0,84-1,00) |
0,80 (0,64-0,88) |
|
EO-VAS, баллы |
90,00 (90,00-95,00) |
80,00 (70,00-90,00) |
p<0,001.
Таблица 4
Функциональное состояние тазобедренного сустава по шкале Harris у пациентов с ППИ
|
Срок наблюдения |
Первая группа |
Вторая группа |
Р |
|
Перед I этапом |
28,0 (23,0-37,0) |
28,0 (20,0-42,0) |
0,286 |
|
Перед II этапом |
38,0 (31,5-41,0) |
37,0 (31,3-40,0) |
0,818 |
|
Через 2 года после II этапа |
91,0 (87,0-93,3) |
84,0 (77,5-87,0) |
<0,001 |
Таблица 5
Функциональное состояние коленного сустава по шкале KSS у пациентов с ППИ
|
Оценочная шкала |
Срок наблюдения |
Первая группа |
Вторая группа |
Р |
|
KSS Knee Score, баллы |
Перед I этапом |
32 (32-35) |
32 (32-35) |
0,946 |
|
|
Перед II этапом |
50 (37-50) |
45 (31-45) |
0,046 |
|
|
Через 2 года после II этапа |
90 (74-95) |
70 (30-84) |
0,002 |
|
KSS Functional Score, баллы |
Перед I этапом |
30 (30-30) |
30 (30-30) |
0,966 |
|
|
Перед II этапом |
35 (35-45) |
35 (35-35) |
0,047 |
|
|
Через 2 года после II этапа |
75 (71-95) |
65 (47-83) |
0,005 |
Уровень болевого синдрома перед I и II этапами лечения в первой и во второй группах был сопоставим (табл. 6). Однако среднесрочные результаты были значительно лучше в первой группе.
По итогам микробиологического исследования образцов биологического материала возбудитель
не установлен у 21 пациента (14,6%), у 6 пациентов (4,2%) выделено несколько видов микроорганизмов. Значительную долю занимали стафилококки, в том числе S. aureus (27,6%) и коагулазонегатив- ные стафилококки (38,3%), в 13% случаев высевались стрептококки (табл. 7).
Таблица 6
Показатели боли по ВАШ
|
Срок наблюдения |
Первая группа |
Вторая группа |
Р |
|
Перед I этапом |
8,0 (7,0-8,5) |
8,0 (7,0-9,0) |
0,532 |
|
Перед II этапом |
5,0 (4,0-6,0) |
5,0 (5,0-6,0) |
0,137 |
|
Через 2 года после II этапа |
1,0 (1,0-2,0) |
3,0 (1,0-4,0) |
<0,001 |
Таблица 7
Результаты микробиологического исследования синовиальной жидкости, тканевых биоптатов и смывов с удаленных компонентов эндопротеза
|
Микроорганизм |
Положительные результаты |
|
|
n |
О/ % |
|
|
Анаэробы |
2 |
1,6 |
|
Грамотрицательные микроорганизмы |
10 |
8,0 |
|
Коагулазонегативные стафилококки |
41 |
33,3 |
|
Staphylococcus aureus |
34 |
27,6 |
|
Staphylococcus epidermidis |
13 |
10,6 |
|
Staphylococcus hemolyticus |
1 |
0,8 |
|
Staphylococcus lugdunensis |
3 |
2,4 |
|
Staphylococcus warneri |
1 |
0,8 |
|
Streptococcus sp. |
16 |
13,0 |
|
Corynebacterium striatum |
2 |
1,6 |
|
Всего |
123 |
100,0 |
обсуждение
Исследование показало статистически значимое снижение частоты рецидивов инфекции после применения покрытия на основе ДУ ЛЦУ+Ag по сравнению с результатами во второй группе. Необходимо отметить, что в большинстве исследований отмечалось абсолютное снижение частоты рецидивов в 1,5—2,0 раза, не имеющее при этом статистической значимости. Данный факт можно объяснить небольшим количеством наблюдений. Это подтверждается результатами метаанализа, выполненного M. Fiore с соавторами. Анализ исследований показал, что частота инфекций после ревизий составила 13,7% в группе пациентов, которым имплантировали эндопротезы с серебросодержащим покрытием, и 29,2% — при использовании эндопротеза без покрытия, что свидетельствует об эффективности серебросодержащих покрытий в предотвращении инфекций (р = 0,019) [23].
В нашем исследовании частота рецидивов во второй группе составила 20,8%, что сопоставимо с данными литературы. Так, В.В. Павлов с соавторами сообщают о 19,5% рецидивов при лечении пациентов с ППИ ТБС и КС [24].
В работе В.А. Иванцова с соавторами сообщается о 14,4% неудовлетворительных результатов при лечении ППИ КС [25]. Частота рецидивов ППИ ТБС в исследовании F. Schwolow с соавторами составила 14,4% при среднем сроке наблюдения 8 лет [26]. По данным A.S. Steinicke c соавторами, безрецидивная выживаемость эндопротезов КС и ТБС составила 77% (95% ДИ 64-89) через 1 год и 38% (95% ДИ 18-57) — через 5 лет [27]. В ходе данного исследования всем пациентам была выполнена стандартная двухэтапная ревизия эндопротеза. Одним из факторов, объясняющих разброс в доле рецидивов в исследованиях, могут служить различные сроки наблюдения.
При использовании нового покрытия в нашем исследовании достигнуты более низкие уровни содержания лейкоцитов, нейтрофилов и частота рецидивов в первой группе пациентов. Это свидетельствует об эффективном купировании инфекционного процесса. T. Shirai с соавторами наблюдали меньшую выраженность воспалительного процесса у пациентов с использованием спейсеров с йодным покрытием [28].
Использование нового покрытия может отразиться и на таких показателях, как функция сустава и болевой синдром. Лучшие результаты функции коленного и тазобедренного суставов (референс- ные значения цитоза и содержания нейтрофилов в пунктате, уменьшение значений маркеров воспаления в крови) после второго этапа санации наблюдались в первой группе. Это свидетельствует об ускоренном купировании инфекции при использовании легированного серебром углеродного покрытия, лучшей биологической совместимости в сравнении со спейсерами без покрытия, что в конечном итоге может положительно отразиться на функции суставов. При применении спейсеров с покрытием на основе ДУ ЛЦУ+Ag функция суставов по по шкале Харриса и шкале KSS была лучше, а болевой синдром менее выраженным, чем во второй группе [29, 30].
Эффективность лечения ППИ подтверждается повышением качества жизни пациентов. Так, J.L. Cahill с соавторами сообщили, что пациенты, у которых ППИ разрешилась, имели более высокий балл по шкалам качества жизни и ВАШ в сравнении с пациентами, у которых наблюдался рецидив ППИ [31]. Снижение качества жизни при развитии ППИ подтверждается и результатами исследования N.R. Poulsen с соавторами, в котором у пациентов с рецидивом ППИ было худшее качество жизни, чем у пациентов с разрешением ППИ после двухэтапной ревизии [32]. Наше исследование показало аналогичные результаты.
Использование спейсера с покрытием на основе ДУ ЛЦУ+Ag позволяет быстрее ликвидировать воспалительный процесс, достичь более низких показателей содержания нейтрофилов и СРБ в крови, цитоза и содержания нейтрофилов в суставном пунктате, снизить число рецидивов ППИ КС и ТБС.
Заявленный вклад авторов
Малюченко Л.И. — концепция или дизайн исследования, обзор публикаций по теме статьи, написание текста статьи.
Николаев Н.С. — концепция исследования, редактирование текста статьи.
Яковлев В.В. — сбор и обработка данных, редактирование текста статьи
Преображенская Е.В. — концепция и дизайн, анализ полученных данных, редактирование текста статьи.
Более быстрая и эффективная ликвидация ППИ при использовании спейсера с покрытием на основе ДУ ЛЦУ+Ag способствует и улучшению функционирования протеза. У этих пациентов группы достигнуты лучшие результаты функции КС и ТБС, качества жизни по опроснику EO-5D-5L, более низкий болевой синдром по шкале ВАШ.
Оценка среднесрочных результатов лечения ППИ дает основания прогнозировать активную защиту поверхности имплантата от колонизации микроорганизмами и формирования микробных биопленок, что вкупе с медикаментозной антибиотикопрофилактикой обеспечивает хороший лечебно-профилактический эффект в отношении рецидива перипротезной инфекции. С целью изучения отдаленных результатов применения спей- серов с покрытием на основе ДУ ЛЦУ+Ag исследование планируется продолжить.
Полученные результаты подтверждают обоснованность более широкого использования спейсеров с покрытием на основе ДУ ЛЦУ+Ag для лечения ППИ с учетом потребности в ревизионных операциях.
Литература1. Bilgen S., Eken G.
Surgical site infection after total knee arthroplasty: a descriptive study. Int
Multispecialty J Heal. 2016;2(2).
2. NiemelaInen M.J., MaKela K.T., Robertsson O., W-Dahl A., Fumes O., Fenstad A.M. et al. Different incidences of knee arthroplasty in the Nordic countries. Acta Orthop. 2017;88(2):173-178.
3. Tande A.J., Patel R. Prosthetic joint infection. Clin Microbiol Rev.
4. Fuchs M., von Roth P., Pfitzner T., Kopf S., Sass F.A., Hommel H. Contamination of irrigation fluid during primary total knee arthroplasty. J Am Acad Orthop Surg Glob Res Rev. 2018;2(5):e027. doi: 10.5435/JAAOSGlobal-D-17-00027.
5. Grammatopoulos G., Kendrick B., McNally M., Athanasou N.A., Atkins B., McLardy-Smith P. et al. Outcome Following Debridement, Antibiotics, and Implant Retention in Hip Periprosthetic Joint Infection- An 18-Year Experience. J Arthroplasty. 2017;32(7):2248- 2255. doi: 10.1016/j.arth.2017.02.066.
6. Jhan S.W., Lu Y.D., Lee M.S., Lee C.H., Wang J.W., Kuo F.C. The risk factors of failed reimplantation arthroplasty for periprosthetic hip infection. BMC Musculoskelet Disord. 2017;18(1):255. doi: 10.1186/s12891-017-1622-1.
7. Akgun D., Muller M., Perka C., Winkler T. Anoften-unrecognized entity as cause of recurrent infection after successfully treated two-stage exchange arthroplasty: hematogenous infection.
8. Koseki H., Yonekura A., Shida T., Yoda I., Horiuchi H., Morinaga Y. et al. Early staphylococcal biofilm formation on solid orthopaedic implant materials: in vitro study. PLoS One. 2014;9(10):e107588. doi: 10.1371/journal.pone.0107588.
9. Zimmerli W., Moser C. Pathogenesis and treatment concepts of orthopaedic biofilm infections. FEMS Immunol Med Microbiol. 2012;65(2):158-168.
10. Шпиняк С.П., Барабаш А.П., Лясникова
А.В. Применение спейсеров в лечении инфекционных осложнений тотального
эндопротезирования коленного сустава. Современные проблемы науки и образования.
2015;5. Shpinyak S.P., Barabash A.P., Lyasnikova A.V.
The use of spacers in the treatment of infectious complications of total knee
arthroplasty. Modern problems of science and education.2015;5. (In Russian).
11. Комаров Р.Н., Новиков А.В.,
Митрофанов В.Н., Акулов М.М., Корыткин А.А. Применение спейсеров в лечении
периимплантной инфекции после эндопротезирования тазобедренного сустава.
Современные проблемы науки и образования. 2014;5.
12. Leung D., Spratt D.A., Pratten J., Gulabivala K., Mordan N.J., Young A.M. Chlorhexidine- releasing methacrylate dental composite materials. Biomaterials. 2005;26(34):7145-7153.
13. Evans A., Kavanagh K.A. Evaluation of metal-based antimicrobial compounds for the treatment of bacterial pathogens. J Med Microbiol. 2021;70(5):001363. doi: 10.1099/jmm.0.001363.
14. Ермаков А.М., Клюшин Н.М., Абабков Ю.В., Тряпичников А.С., Коюшков А.Н. Одноэтапное ревизионное эндопротезирование при лечении перипротезной инфекции тазобедренного сустава. Гений ортопедии.
15. Kose N., Otuzbir A., Pek§en C., Kiremitgi A., Dogan A. A silver ion-doped calcium phosphate-based ceramic nanopowder-coated prosthesis increased infection resistance. Clin Orthop Relat Res. 2013;471(8):2532- 2539. doi: 10.1007/s11999-013-2894-x.
16. Arciola C.R., Campoccia D., Speziale P., Montanaro L., Costerton J.W. Biofilm formation in Staphylococcus implant infections. A review of molecular mechanisms and implications for biofilm-resistant materials. Biomaterials. 2012;33(26):5967-5982. doi: 10.1016/j.biomaterials.2012.05.031.
17. Bazaka
K., Jacob M.V., Crawford R.J., Ivanova E.P. Efficient surface modification of
biomaterial to prevent biofilm formation and the attachment of microorganisms.
Appl Microbiol Biotechnol. 2012;95: 299-311.
18. Grill A., Meyerson B.S. Development and status of diamond-like carbon. In: Synthetic Diamond: Emerging CVD Science and Technology. Ed. by K.E. Spear, J.P. Dismukes. New York: Wiley; 1994. р. 91-141.
19. Казбанов В.В., Баталов М.С., Вишневский А.А. Особенности биосовместимости и перспективы применения титановых имплантатов с алмазоподобными покрытиями на основе модифицированного углерода. Проблемы здоровья и экологии. 2015;(2):16-23
20. Бабаев В.Г., Новиков Н.Д., Гусева М.Б., Хвостов В.В., Савченко Н.Ф., Коробова Ю.Г. и др. Пленки линейноцепочечного углерода — упорядоченные ансамбли квантовых нитей — материал для наноэлектроники. Нанотехнологии: разработка, применение — XXI век. 2010;2(1):53-68.
21. Тапальский Д.В., Николаев Н.С., Овсянкин А.В., Кочаков В.Д., Головина Е.А., Матвеенков М.В. и др. Покрытия на основе двумерно упорядоченного линейно-цепочечного углерода для защиты титановых имплантатов от микробной колонизации. Травматология и ортопедия России. 2019;25(2):111- 120. doi: 10.21823/2311-2905-2019-25-2-111-120. Tapal’skii D.V., Nikolaev N.S., Ovsyankin A.V., Kochakov V.D., Golovina E.A., Matveenkov M.V. et al. Coatings based on two-dimensionally ordered linear chain carbon for protection of titanium implants from microbial colonization. Traumatology and Orthopedics in Russia. 2019;25(2):111-120. (In Russian).
22. Parvizi J., Gehrke T., Chen A.F. Proceedings of the International Consensus on Periprosthetic Joint Infection. Bone Joint J. 2013;95-B(11):1450-1452. doi: 10.1302/0301-620X.95B11.33135.
23. Fiore M., Sambri A., Zucchini R. et al. Silver-coated megaprosthesis in prevention and treatment of periprosthetic infections: a systematic review and meta-analysis about efficacy and toxicity in primary and revision surgery. Eur J Orthop Surg Traumatol. 2021;31:201-220. doi: 10.1007/s00590-020-02779-z.
24. Павлов В.В., Петрова Н.В., Шералиев Т.У. Среднесрочные результаты двухэтапного лечения перипротезной инфекции. Травматология и ортопедия России. 2019;25(4):109-116. doi: 10.21823/2311-2905-2019-25-4-109-116.
Pavlov V.V., Petrova N.V., Sheraliev T.U. Two- stage treatment of periprostetic infection: midterm results. Traumatology and Orthopedics of Russia.
25. Иванцов В.А., Лашковский В.В., Богданович И.П., Лазаревич С.Н. Лечение глубокой пе- рипротезной инфекции коленного сустава. Журнал Гродненского государственного медицинского университета. 2018; 16(1):96-100
26. Schwolow F., Fuchtmeier B., Muller F. Factors associated with infection recurrence after two-stage exchange for periprosthetic hip infection. Int Orthop. 2022;46(5): 953-961. doi: 10.1007/s00264-022-05333-0.
27. Steinicke A.C., Schwarze J., Gosheger G., Moellenbeck B., Ackmann T., Theil C. Repeat two-stage exchange arthroplasty for recurrent periprosthetic hip or knee infection: what are the chances for success? Arch Orthop Trauma Surg. 2023;143(4):1731-1740. doi: 10.1007/s00402-021-04330-z.
28. Shirai T., Tsuchiya H., Terauchi R., Tsuchida S., Mizoshiri N., Mori Y. et al. A retrospective study of antibacterial iodine-coated implants for postoperative infection. Medicine (Baltimore). 2019;98(45):e17932.
29. Kim D.Y., Seo Y.C., Kim C.W., Lee C.R., Jung S.H. Factors affecting range of motion following two- stage revision arthroplasty for chronic periprosthetic knee infection. Knee Surg Relat Res. 2022;34(1):33.
30. Golgelioglu F., Oguzkaya S., Misir A., Guney A. The effect of time spent with a dynamic spacer on clinical and functional outcomes in two-stage revision knee arthroplasty. Indian J Orthop. 2020;54(6):824-830.
31. Cahill
J.L., Shadbolt B., Scarvell J.M., Smith P.N. Quality of life after
infection in total joint replacement. J Orthop Surg (Hong Kong).
32. Poulsen N.R., Mechlenburg I., S0balle K., Lange J. Patient-reported quality of life and hip function after 2-stage revision of chronic periprosthetic hip joint infection: a cross-sectional study. Hip Int. 2018;28(4):407-414
Сведения об авторах
1. Малюченко Леонид Игоревич - ФГБУ «Федеральный центр травматологии, ортопедии и эндопротезирования» Минздрава России, г. Чебоксары, РоссияТеги: эндопротезирование
234567 Начало активности (дата): 05.01.2024 23:27:00
234567 Кем создан (ID): 989
234567 Ключевые слова: эндопротезирование, перипротезная инфекция сустава, инфекция, связанная с имплантатом, микробные биопленки, антибактериальное покрытие
12354567899
Похожие статьи
Перипротезная инфекция коленного и тазобедренного суставов - можно ли сравнивать результаты лечения?Рентген на дому 8 495 22 555 6 8
Замещение дефектов вертлужной впадины и бедренной кости с использованием импакционной костной пластики при ревизионном эндопротезировании тазобедренного сустава: клинический случай
Эндопротезирование коленного сустава в клинической практике: анализ 36 350 наблюдений из регистра НМИЦ ТО им. Р.Р. Вредена
Сравнительная оценка использования индивидуальных ЗЭ-компонентов и стандартных имплантатов для реконструкции вертлужной впадины при ревизионном эндопротезировании



