 01.02.2024
01.02.2024
Результаты ревизионного эндопротезирования коленного сустава с применением индивидуальных имплантатов
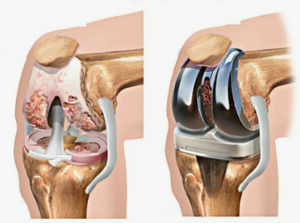
Наличие обширных костных дефектов существенно осложняет возможность стабиль ной фиксации и корректного пространственного позиционирования ревизионных компонентов эндопротеза
ВВЕДЕНИЕ
Тотальное эндопротезирование коленного сус тава (ТЭКС) является эффективным методом ле чения остеоартроза III стадии (по классификации Kellgren- Lawrence) [1]. В США ежегодно выполня ется более 400 000 ТЭКС [2]. В связи с ростом ко личества первичных эндопротезирований колен ного сустава (КС) возрастает и число ревизионных вмешательств. Основными их причинами являют ся перипротезная инфекция (ППИ), асептическое расшатывание компонентов эндопротеза, его не стабильность, перипротезные переломы, контрак тура сустава [3]. ППИ возникает в 0,5-2,0% случаев после первичного ТЭКС и в 15-20% после ревизи онного эндопротезирования КС [4].
Двухэтапное ревизионное эндопротезирова ние является золотым стандартом лечения хрони ческой ППИ [5]. Первый этап включает удаление инфицированных компонентов эндопротеза с по следующей обширной санацией нежизнеспособ ных тканей, радикальную некрэктомию. В резуль тате этих манипуляций формируются дефекты в области дистального отдела бедренной и прок симального отдела большеберцовой костей [6]. На втором этапе, после купирования инфекци онного процесса, выполняется ревизионное эн допротезирование КС с установкой компонентов эндопротеза, позволяющих заместить имеющиеся дефекты костной ткани.
Наличие обширных костных дефектов су щественно осложняет возможность стабильной фиксации и корректного пространственного по зиционирования ревизионных компонентов эн допротеза. Первостепенной задачей ревизионно го вмешательства является восполнение объема утраченной костной ткани [7]. Считается, что для стабильной фиксации и увеличения срока службы эндопротеза необходимо его зафиксировать как минимум в двух анатомических зонах бедренной и большеберцовой костей, что отражено в концеп ции R. Morgan-Jones [8, 9].
Поиск вариантов замещения утраченной кост ной ткани продолжается и в настоящее время. На сегодняшний день для замещения костных дефектов используют танталовые конусы, кост ный цемент, модульные металлические аугменты, ауто- и аллотрансплантаты [10]. Использование современных имплантатов позволяет замещать крупные по объему метафизарные дефекты боль шеберцовой и бедренной костей, включая повреждения костной ткани типов 2B и 3 по классифика ции AORI (Anderson Orthopaedic Research Institute) [8, 11, 12].
Однако использование официнальных им плантатов имеет значительные ограничения при наличии обширных дефектов костной ткани. Наиболее часто в подобных случаях выполняется мегапротезирование с заменой проксимально го отдела большеберцовой или дистального от дела бедренной кости, артродез или ампутация. С развитием аддитивных технологий появилась возможность создания имплантатов по данным компьютерной томографии (КТ), которые могут быть использованы для замещения костных де фектов практически любой сложности, формы и размеров [10]. 3D-печать позволяет изготавливать имплантаты с учетом индивидуальных особенно стей пациента, что способствует улучшению пос леоперационных результатов лечения [13].
Таким образом, опираясь на данные зарубеж ных источников, мы предполагаем, что исполь зование индивидуальных имплантатов позволяет заместить значительный дефицит костной ткани при ревизионном эндопротезировании. В связи с этим нами проведен анализ результатов опера тивного лечения пациентов с обширными костны ми дефектами (типы 2B и 3 по AORI) проксималь ного отдела большеберцовой и/или дистального отдела бедренной костей с использованием инди видуально изготовленных имплантатов.
Цель — представить клинико-рентгенологи ческие результаты оперативного лечения паци ентов с обширными костными дефектами (2B и 3 по AORI) проксимального отдела большеберцовой и/или дистального отдела бедренной костей с ис пользованием индивидуально изготовленных им плантатов для ревизионного эндопротезирования коленного сустава.
МАТЕРИАЛ И МЕТОДЫ
Дизайн исследования
Проведено одноцентровое ретроспективное исследование по результатам лечения пациентов в Университетской клинике, в которое вошли 24 пациента, проходившие оперативное лечение по поводу расшатывания спейсера коленного сустава с 2017 по 2021 г.
Критерии включения в исследование: наличие костных дефектов типов 2B и 3 по AORI, расшаты вание антибактериального спейсера.
Критерии исключения: наличие признаков декомпенсации тяжелой сопутствующей сома тической патологии (гематологических, имму нологических, урогенитальных, эндокринных, психиатрических, сердечно-сосудистых, дермато венерологических, неврологических и др.).
Всем пациентам было выполнено ревизионное эндопротезирование КС с использованием инди видуальных имплантатов (9 бедренных и 18 боль шеберцовых), изготовленных на 3D-принтере. Среди них было 20 (83%) женщин и 4 (17%) муж чины в возрасте от 35 до 79 лет (68,5 [62; 73,5]). Операции на правом КС выполнены 10 (42%) боль ным, на левом — 14 (58%).
Ревизионное вмешательство с использованием индивидуальных имплантатов у 23 (96%) пациен тов выполнено по поводу расшатывания антибак териального спейсера, у одного (4%) пациента — асептического расшатывания спейсера на фоне периимплантного перелома. У всех больных были обширные костные дефекты. Их объем и размеры определялись по данным рентгенографии и КТ на этапе предоперационного планирования.
Классификация костных дефектов осуществля лась по AORI [14]. Дефект проксимального отдела большеберцовой кости был выявлен у 15 (62,5%) из 24 пациентов, дистального отдела бедренной кости — у 6 (25%), дистального отдела бедренной и проксимального отдела большеберцовой костей — у 3 (12,5%). Дефект типа T3 по классифи кации AORI диагностирован у 12 (50%) больных, T2B — у 6 (25%), дефект F3 — у 1 (4,17%), F2B — у 8 (33,3%).
У пациентов в анамнезе имелось от 1 до 6 (2 [2; 3,5]) предшествующих операций на КС (табл. 1).
Сроки наблюдения пациентов составили от 5 мес. до 4,3 лет после операции (28 [8; 38] мес.). Продолжительность оперативного вмешатель ства составила 110 [92,5; 143] мин., кровопотеря — 250 [225; 300] мл, послеоперационный койко-день — 7 [5; 10] дней.
Всем пациентам выполнялась рентгенография КС в прямой и боковой проекциях до операции, сразу после операции, через 1,5, 6 и 12 мес. в пос леоперационном периоде.
Оценка объема движе ний проводилась на этапе предоперационной под готовки, через 3, 6 и 12 мес. после оперативного вмешательства.
Всем пациентам на этапе предоперационной подготовки проводилась пункция КС с последую щим бактериологическим посевом пунктата трех кратно с интервалом 1 месяц.
Клиническая характеристика пациентов
Таблица 1
|
ID |
Возраст, лет |
VAS до операции |
Тип дефекта |
Число предыдущих операций |
Причина операции |
|
1 |
71 |
8 |
F3 |
3 |
2 |
|
2 |
35 |
6 |
T2B |
3 |
1 |
|
3 |
69 |
4 |
T3 |
3 |
1 |
|
4 |
69 |
10 |
T3 |
2 |
1 |
|
5 |
65 |
7 |
F2B; T2B |
3 |
1 |
|
6 |
72 |
5 |
T3 |
4 |
1 |
|
7 |
61 |
8 |
T2B |
2 |
1 |
|
8 |
67 |
4 |
F2B |
3 |
1 |
|
9 |
58 |
6 |
F2B |
4 |
1 |
|
10 |
68 |
6 |
T3 |
5 |
1 |
|
11 |
79 |
5 |
T3 |
5 |
1 |
|
12 |
67 |
7 |
T2B |
2 |
1 |
|
13 |
67 |
6 |
T3 |
2 |
1 |
|
14 |
76 |
8 |
T3 |
4 |
1 |
|
15 |
71 |
7 |
T2B |
2 |
1 |
|
16 |
77 |
7 |
F2B |
1 |
1 |
|
17 |
47 |
6 |
T3 |
6 |
1 |
|
18 |
75 |
5 |
T3 |
2 |
1 |
|
19 |
79 |
6 |
T3; F2B |
2 |
1 |
|
20 |
70 |
8 |
T2B |
2 |
1 |
|
21 |
76 |
7 |
T3; F2B |
2 |
1 |
|
22 |
53 |
6 |
T3 |
2 |
1 |
|
23 |
63 |
8 |
F2B |
2 |
1 |
|
24 |
51 |
7 |
F2B |
2 |
1 |
|
Среднее |
66,1 |
6,2 |
- |
2,8 |
- |
1 — расшатывание антибактериального спейсера коленного сустава; 2 — асептическое расшатывание эндопроте за коленного сустава на фоне периимплантного перелома.
Предоперационное планирование и изготовление имплантата
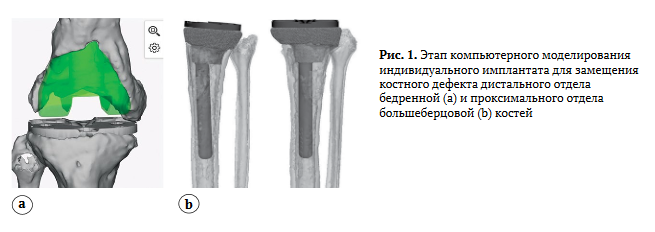
С целью изготовления индивидуального им плантата на первом этапе выполняли мультиспи ральную компьютерную томографию (МСКТ) КС с шагом в 1 мм и рентгенографию нижних конеч ностей на всем протяжении (Full Leg Full Spine — FLFS). После этого создавали трехмерную ком пьютерную модель коленного сустава. Затем вы полняли моделирование поверхности костного дефекта с использованием инструментов сгла живания и обрезки, которые позволяли удалить артефакты и гипертрофические рубцы, визуали зирующиеся как костные структуры. Далее осу ществляли зеркальное отражение трехмерной модели проксимального отдела большеберцовой и/или дистального отдела бедренной костей не поврежденного (контралатерального) сустава с последующим ее прецизионным позициони рованием на место костного дефекта с целью его замещения.
После этого выполняли булеву операцию вычитания с формированием трех мерной модели индивидуального имплантата. Для лучшей остеоинтеграции на поверхности имплантата создавали поры. Далее выполняли топологическую оптимизацию трехмерной мо дели имплантата с использованием SIMP-метода (рис. 1). Затем имплантат изготавливали на SD-принтере из сплава титан-алюминий-ванадий (Ti6Al4V) и стерилизовали.
Хирургическая техника
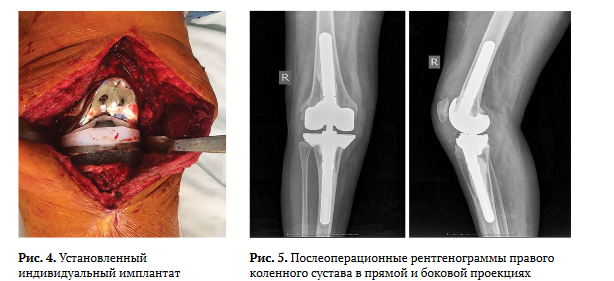
Оперативное вмешательство выполняли с при менением спинальной анестезии в положении пациента лежа на спине. По старому послеопера ционному рубцу осуществляли артротомию КС, удаление компонентов спейсера, краевую модели рующую резекцию и, при необходимости, денер вацию надколенника (рис. 2). Затем производили забор синовиальной жидкости, фрагментов мяг ких тканей из пяти различных участков для иссле дования в бактериологической лаборатории.
С использованием стандартного набора инстру ментов выполняли моделирование костного ложа для компонентов полусвязанного или связанного эндопротеза: размер бедренного и большеберцо вого компонентов подбирали индивидуально, по данным КТ. В зависимости от локализации кост ного дефекта (проксимальный отдел большебер цовой кости или дистальный отдел бедренной) осуществляли его замещение индивидуальным имплантатом, изготовленным на SD-принтере (рис. 3).

Затем производили окончательную установку компонентов эндопротеза на цемент (рис. 4). Для профилактики развития инфекционных ослож нений использовали две дозы костного цемента с добавлением терморезистентных антибиотиков. Затем осуществляли контроль движений, оценку стабильности сустава, послойный шов раны, рент генографию КС в двух проекциях (рис. 5).
Оценка результатов
У всех пациентов до операции и через 3, 6, 12 мес. после ее выполнения оценивали резуль таты путем анкетирования по международным шкалам VAS, KSS, WOMAC и SF-36.
В опроснике KSS результат оценивали как отличный при сумме баллов от 80 до 100, от 70 до 79 баллов — хороший, от 60 до 69 — удовлетворительный, менее 60 бал лов — неудовлетворительный. В анкете WOMAC при сумме баллов от 0 до 14 результат оценивали как отличный, от 15 до 28 баллов — хороший, от 29 до 38 — удовлетворительный, более 38 баллов — неудовлетворительный. В опроснике SF-36 оцени вали физический и психологический компоненты здоровья: чем больше балл, тем выше качество жизни.Послеоперационное ведение пациентов
Всем пациентам в послеоперационном периоде выполняли антибиотикопрофилактику (до опера ции, во время операции и через 8 ч. после ее за вершения) и профилактику тромбоэмболических осложнений (использование антикоагулянтов). Со 2-го дня после операции была разрешена ходь ба с частичной опорой на оперированную конеч ность при помощи костылей. Из стационара паци ентов выписывали в сроки от 4 до 14 дней (7,7±3,5). При наличии болевого синдрома им назначали анальгезирующую терапию. Швы снимали через 18-21 день после операции. Через 6 нед. после операции по результатам осмотра и рентгеногра фии разрешали ходьбу с полной опорой.
Статистический анализ
Статистическую обработку результатов иссле дования проводили с использованием програм мы Statistica 10.0 (StatSoft, США). Описательные статистики представляли в виде Ме [25р;75р] (где Ме — медиана, [25р;75р] — 25-й и 75-й пер центили) и/или относительной величины (%). Сравнение показателей в связанных группах осу ществляли с применением критерия Уилкоксона. Различия считали статистически значимыми при р<0,05.
Результаты
В послеоперационном периоде у 23 из 24 паци ентов (96%) отсутствовали признаки расшатыва ния индивидуального имплантата, у одной боль ной выявлено глубокое нагноение эндопротеза, по поводу которого выполнено ревизионное вмеша тельство. Во всех случаях достигнуто прецизион ное позиционирование компонентов эндопротеза в соответствии с параметрами предоперационно го планирования.
На контрольном осмотре через 12 мес. по сле операции без дополнительных средств опоры передвигались 9 из 24 пациентов (37,5%), с помо щью трости — 10 из 24 (41,7%), с использованием костылей — 4 из 24 (16,7%), ходунков — 1 из 24 (4,2%). Перипротезных переломов во время опе рации и в послеоперационном периоде не было зарегистрировано.
При оценке по шкале KSS через 12 мес. у 11 из 24 (45,8%) пациентов был отличный результат, у 9 (37,5%) — хороший, у 4 (16,67%) — удовлетво рительный. При оценке по шкале WOMA — у 8 из 24 (33,3%) пациентов был отличный результат, у 13 (54,2%) пациентов — хороший, у 3 (12,5%) — удов летворительный. При оценке по шкале VAS отме чалась положительная динамика в виде статисти чески значимого уменьшения болевого синдрома у всех больных (р<0,01).
У всех пациентов по данным анкетирования по шкале SF-36 также была получена положительная динамика как в физическом, так и в психологиче ском аспектах здоровья (р<0,01) (табл. 2).
У всех больных отмечено увеличение объема движений в оперированном суставе по сравне нию с предоперационными показателями (р<0,05) (табл. 3).
Таблица 2
Результаты анкетирования пациентов через 12 мес., Me [25р; 75р]
|
|
Шкала |
Перед операцией |
После операции |
Р |
|
VAS |
|
6,0 [5,5; 70] |
1,0 [0; 2] |
0,01 |
|
KSS |
|
40 [34; 42] |
84 [79; 88] |
0,01 |
|
WOMAC |
50,5 [46,5; 56,5] |
17,5 [13; 25] |
0,01 |
|
|
|
Физический компонент здоровья |
31 [19; 43] |
77 [67; 82] |
0,01 |
|
SF-36 |
Психологический компонент здоровья |
43 [34; 50] |
91 [87; 93] |
0,01 |
Таблица 3
изменение показателей функции коленного сустава после ревизионного эндопротезирования с применением индивидуального имплантата, Me [25р; 75р]
|
Показатель |
Срок наблюдения, мес. |
|||
|
0 |
3 |
6 |
12 |
|
|
Объем движения в коленном суставе, град. |
15 [13; 20] |
75 [70; 80]* |
85 [70; 95]* |
90 [85; 95]* |
|
Угол сгибания, град. |
20 [15; 25] |
75 [70; 80]* |
85 [70; 95]* |
90 [85; 95]* |
|
Угол разгибания, град. |
5 [3; 5]** |
0 [0; 0]* |
0 [0; 0]* |
0 [0; 0]* |
— статистическая значимость различий по сравнению с показателями до операции (р<0,05);
— дефицит разгибания КС
Обсуждение
В настоящее время все чаще в хирургической практике используются индивидуально изготов ленные имплантаты для лечения пациентов с на личием обширных костных дефектов [15]. Однако выбор метода, как правило, определяется пред почтениями хирурга и непосредственной доступ ностью каждой из технологий в определенном лечебном учреждении [16]. При отсутствии воз можности замещения костного дефекта с исполь зованием стандартных имплантатов одним из вариантов лечения является ампутация нижней конечности [17].
G. Burastero с соавторами продемонстрирова ли клинико-биомеханические результаты лече ния пациентов с костными дефектами бедренной и большеберцовой костей с использованием ин дивидуальных пористых метафизарных конусов. У всех пациентов были получены хорошие и от личные результаты по шкале KSS, что согласуется с нашими данными. Кроме того, авторы продемон стрировали, что индивидуально изготовленные имплантаты обеспечивают более равномерное распределение нагрузки на кость по сравнению со стандартными цементными или бесцементными ножками эндопротеза [4].
M.W. Tetreaulta соавторами приводят данные о выживаемости 202 (134 большеберцовых, 68 бед ренных) пористых индивидуальных титановых метафизарных конусов у 139 пациентов. У всех пациентов были метафизарные дефекты бедрен ной и большеберцовой костей типа 2B и 3 по AORI. Авторы продемонстрировали хорошие клинико рентгенологические результаты. Как и в нашем исследовании, средний балл по KSS у пациен тов значительно улучшился с 50 (от 0 до 94) до 87 (от 72 до 94) баллов (р<0,001) [18]. При оценке послеоперационных результатов лечения у трех пациентов диагностирована ППИ, у одного — перипротезный перелом, еще у одного — асепти ческое расшатывание большеберцового компо нента эндопротеза. В нашем исследовании только у одной пациентки возникло осложнение — ППИ. По нашему мнению, возможной его причиной яв ляется наличие трех операций в анамнезе (из них две операции — имплантация антибактериального спейсера по поводу ППИ), коморбидное состояние пациентки (наличие сахарного диабета II типа, ревматоидного артрита, постфлебитического син дрома), гипо- и атрофия мышц, множественные гипертрофические рубцы в области оперативного вмешательства.
А.А. Черный с соавторами приводят результа ты оперативного лечения 26 пациентов, которым были установлены 30 индивидуально изготовлен ных имплантатов (12 бедренных и 18 большебер цовых), использованных при ревизионном эндо протезировании коленного сустава. Так же, как и в нашем исследовании, авторами не было отме чено технических сложностей при позициониро вании и установке индивидуально изготовленных титановых конусов [17].
E.A. Remily с соавторами сообщают, что у 51 (98,1%) из 52 имплантатов отсутствовали рент генологические признаки расшатывания компо нентов эндопротеза. Средние показатели по KSS были статистически значимо (р<0,001) лучше по сравнению с предоперационными показателями (до операции — 52,0; после операции — 80,4) [19]. В нашем исследовании также отмечена положи тельная динамика в виде улучшения показателей по KSS в послеоперационном периоде по сравне нию с дооперационными данными.
В исследовании G. Piovan с соавторами пред ставлены результаты использования индивиду ально изготовленного метафизарного больше берцового конуса с отверстиями на его передней поверхности, которые позволяют хирургу добиться
ЗАКЛЮЧЕНИЕ
У всех пациентов в послеоперационном перио де отмечено улучшение показателей по SF-36, KSS, WOMAC и VAS. При рентгенологическом исследо вании у 23 из 24 больных отсутствовало расшаты вание компонентов эндопротеза. У всех пациен тов было достигнуто прецизионное соответствие имплантата костному дефекту. Использование индивидуальных имплантатов, изготовленных с помощью аддитивных технологий, при ревизи онном эндопротезировании коленного сустава в случае наличия обширных дефектов костной тка ни (2B и 3 по AORI) позволяет сохранить нижнюю конечность и ее статодинамическую функцию.
1. Price A.J., Alvand A., Troelsen A., Katz J.N., Hooper G., Gray A. et al. Knee replacement. Lancet. 2018;392(10158): 1672-1682. doi: 10.1016/S0140-6736(18)32344-4.
2. Guo E.W., Sayeed Z., Padela M.T., Oazi M., Zekaj M., Schaefer P. et al. Improving Total Joint Replacement with Continuous Quality Improvement Methods and Tools. Orthop Clin North Am. 2018;49(4):397-403. doi: 10.1016/j.ocl.2018.05.002.
3. van den Kieboom J., Tirumala V., Xiong L., Klemt C., Kwon Y.M. Periprosthetic joint infection is the main reason for failure in patients following periprosthetic fracture treated with revision arthroplasty. Arch Orthop Trauma Surg. 2022;142(12):3565-3574. doi: 10.1007/s00402-021-03948-3.
4. Burastero G., Pianigiani S., Zanvettor C., Cavagnaro L., Chiarlone F., Innocenti B. Use of porous custom-made cones for meta-diaphyseal bone defects reconstruction in knee revision surgery: a clinical and biomechanical analysis. Arch Orthop Trauma Surg. 2020;140(12):2041- 2055. doi: 10.1007/s00402-020-03670-6.
5. Cochran A.R., Ong K.L., Lau E., Mont M.A., Malkani A.L. Risk of Reinfection After Treatment of Infected Total Knee Arthroplasty. J Arthroplasty. 2016;31 (9 Suppl):156-161. doi: 10.1016/j.arth.2016.03.028.
6. Lu J., Han J., Zhang C., Yang Y., Yao Z. Infection after total knee arthroplasty and its gold standard surgical treatment: Spacers used in two-stage revision arthroplasty. Intractable Rare Dis Res. 2017;6(4):256- 261. doi: 10.5582/irdr.2017.01049.
7. Lee Y.S., Chen A.F. Two-Stage Reimplantation in Infected Total Knee Arthroplasty. Knee Surg Relat Res. 2018;30(2):107-114. doi: 10.5792/ksrr.17.095.
8. Divano S., Cavagnaro L., Zanirato A., Basso M., Felli L., Formica M. Porous metal cones: gold standard for massive bone loss in complex revision knee arthroplasty? A systematic review of current literature. Arch Orthop Trauma Surg. 2018;138(6):851-863. doi: 10.1007/s00402-018-2936-7.
9. Morgan-Jones R., Oussedik S.I., Graichen H., Haddad F.S. Zonal fixation in revision total knee arthroplasty. Bone Joint J. 2015;97-B(2):147-149. doi: 10.1302/0301-620X.97B2.34144.
10. Lei P.F., Hu R.Y., Hu Y.H. Bone Defects in Revision Total Knee Arthroplasty and Management. Orthop Surg. 2019;11(1):15-24. doi: 10.1111/os.12425. Funding source. State budgetary funding. Competing interests. The authors declare that they have no competing interests. Ethics approval. The study was approved by the local ethics committee of Privolzhsky Research Medical University, protocol No 6, 26.03.2021. Consent for publication. Not required.
11. Barnett S.L., Mayer R.R., Gondusky J.S., Choi L., Patel J.J., Gorab R.S. Use of stepped porous titanium metaphyseal sleeves for tibial defects in revision total knee arthroplasty: short term results. J Arthroplasty. 2014;29(6):1219-1224. doi: 10.1016/j.arth.2013.12.026.
12. Kim H.J., Lee O.S., Lee S.H., Lee Y.S. Comparative Analysis between Cone and Sleeve in Managing Severe Bone Defect during Revision Total Knee Arthroplasty: A Systematic Review and Meta-Analysis. J Knee Surg. 2018;31(7):677-685. doi: 10.1055/s-0037-1606564.
13. McNamara C.A., Gosthe R.G., Patel P.D., Sanders K.C., Huaman G., Suarez J.C. Revision total knee arthroplasty using a custom tantalum implant in a patient following multiple failed revisions. Arthroplast Today. 2016;3(1):13-17. doi: 10.1016/j.artd.2016.08.003.
14. Engh G.A., Parks N.L. The management of bone defects in revision total knee arthroplasty. Instr Course Lect. 1997;46:227-236.
15. Savov P., Tuecking L.R., Windhagen H., Ettinger M. Individual Revision Knee Arthroplasty Is a Safe Limb Salvage Procedure. J Pers Med. 2021;11(6):572. doi: 10.3390/jpm11060572.
16. Girerd D., Parratte S., Lunebourg A., Boureau F., Ollivier M., Pasquier G. et al. Total knee arthroplasty revision with trabecular tantalum cones: Preliminary retrospective study of 51 patients from two centres with a minimal 2-year follow-up. Orthop Traumatol Surg Res. 2016;102(4):429-433. doi: 10.1016/j.otsr.2016.02.010.
17. Черный А.А., Коваленко А.Н., Билык С.С., Денисов А.О., Каземирский А.В., Куляба Т.А. и др. Ранние результаты применения индивидуально из готовленных модульных конусов для замещения метафизарно-диафизарных костных дефектов при ревизионной артропластике коленного сустава. Травматология и ортопедия России. 2019;25(2):9-18. doi: 10.21823/2311-2905-2019-25-2-9-18.
18. Tetreault M.W., Perry K.I., Pagnano M.W., Hanssen A.D., Abdel M.P. Excellent two-year survivorship of 3D-printed metaphyseal cones in revision total knee arthroplasty. Bone Joint J. 2020;102-B(6_Supple_A):107-115. doi: 10.1302/0301-620X.102B6.BJJ-2019-1544.R1.
19. Remily E.A., Davila Castrodad I.M., Mohamed N.S., Wilkie W.A., Kelemen M.N., Delanois R.E. Short-term Outcomes of 3D-Printed Titanium Metaphyseal Cones in Revision Total Knee Arthroplasty. Orthopedics. 2021;44(1):43-47. doi: 10.3928/01477447-20201202-04.
20. Piovan G., Farinelli L., Screpis D., Povegliano L., Gigante A.P., Zorzi C. Tibial Tubercle Screw Fixation on Custom Metaphyseal Cone: Surgical Tip in Severe Metaphyseal Tibia Bone Loss. Arthroplast Today. 2022;15:93-97.
Сведения об авторах
ФГБОУ ВО «Приволжский исследовательский медицинский университет» Минздрава России, г. Нижний Новгород, Россия
Илларионова Татьяна Владимировна
Зыкин Андрей Анатольевич — канд. мед. наук
Герасимов Сергей Александрович — канд. мед. наук
Горбатов Роман Олегович — канд. мед. наук
Теги: коленный сустав
234567 Начало активности (дата): 01.02.2024 08:56:00
234567 Кем создан (ID): 989
234567 Ключевые слова: коленный сустав, ревизионное эндопротезирование, костный дефект, индивидуальный имплантат, аддитивные технологии, 3D-печать
12354567899
Похожие статьи
Варианты сухожильных трансферов при передневерхних разрывах вращательной манжеты плечевого сустава: обзор зарубежной литературыРентген на дому 8 495 22 555 6 8
Заднелатеральная ротационная нестабильность коленного сустава: эволюция и современные тренды хирургического лечения
Реконструкция медиальной лодыжки свободным аутотрансплантатом из гребня подвздошной кости после травматического дефекта: клинический случай
Ревизионная реконструкция шейного отдела позвоночника у пациента с ранней глубокой инфекцией области хирургического вмешательства, осложненной угловым кифозом: клинический случай и краткий обзор литературы



