 02.03.2024
02.03.2024
Расчет индекса коморбидности как фактора риска рецидива перипротезной инфекции после установки спейсера коленного сустава
В настоящее время подробно изучены связанные с пациентом факторы, повышающие риск возникновения перипротезной инфекции (ППИ), однако влияние тех же факторов на риск развития рецидива инфекции, а также кумулятивный эффект нескольких заболеваний на риск рецидива изучены недостаточно
Введение
За последнее десятилетие перипротезная инфекция (ППИ) прочно укрепилась среди наиболее частых причин ревизионных вмешательств после эндопротезирования коленного сустава [1, 2]. Учитывая неуклонный рост случаев ППИ, вызванных трудноизлечимыми возбудителями, а также немалую долю случаев осложненной ППИ (невыявленный возбудитель, свищевые формы ППИ, массивные костные дефекты), этапное реэндопротезирование остается одной из предпочтительных тактик хирургического лечения [3, 4, 5]. Лечение ППИ сопровождается значимо большими затратами и сопровождается большим числом осложнений по сравнению с эндопротезированием по асептическим причинам [6, 7]. По данным Z.C. Lum с соавторами, летальность варьирует от 1,7% до 34,0%, причинами могут быть как тяжесть течения инфекционного процесса, так и декомпенсация сопутствующей патологии [8].
В настоящее время подробно изучены связанные с пациентом факторы, повышающие риск возникновения ППИ, к которым относят наличие системных заболеваний, патологию печени, почек, иммунодефицитные состояния, ожирение, патологию периферических сосудов и др. [9]. Однако влияние тех же факторов, а также совокупное влияние нескольких заболеваний на риск развития рецидива изучены недостаточно. Представляется важным не только выявить, какие факторы оказывают влияние на риск рецидива, но и установить степень этого влияния. Учитывая, что ряд факторов риска, относящихся к пациенту, являются модифицируемыми, выявление ключевых патологий позволит на дооперационном этапе подготовить пациента к предстоящему хирургическому вмеша¬тельству, снизив вероятность возможного рецидива ППИ и летального исхода.
Цель исследования — изучить структуру сопутствующей патологии у пациентов с ППИ коленного сустава и на основании полученных данных создать оценочную шкалу, позволяющую прогнозировать вероятность развития рецидива инфекции после санирующего этапа.
Материал и методы
Дизайн исследования
Ретроспективное одноцентровое когортное исследование основано на полученных из меди¬цинской документации сведениях о 161 пациенте с ППИ после первичного эндопротезирования ко¬ленного сустава, прошедшем этапное лечение за период с января 2007 г. по январь 2017 г., собранных в ходе диссертационного исследования первого автора*. Средний период наблюдений составил 5,6 (2,4-7,2) лет.
Критериями невключения в исследование были ранее выполненные ревизионные вмешательства на коленном суставе, наличие у пациентов при¬знаков системной воспалительной реакции.
Диагностику ППИ коленного сустава прово¬дили в соответствии с критериями International Consensus Meeting [10]. Тип ППИ определяли, ис¬ходя из сроков ее манифестации после первич¬ного эндопротезирования: ранняя (<3 мес. после эндопротезирования), отсроченная (3-12 мес. после эндопротезирования) и поздняя (>12 мес. после эндопротезирования) [11].
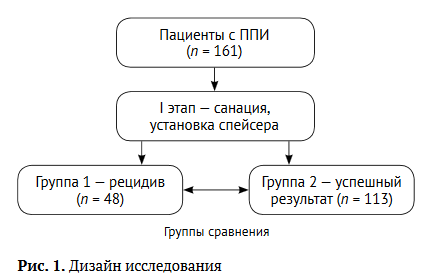
С целью уточнения структуры коморбидности и наиболее важных факторов риска рецидива ППИ пациентов разделили на две группы сравнения:
- группа 1 — пациенты с рецидивами ППИ после выполнения первого этапа лечения — 48 человек;
- группа 2 — пациенты с ППИ, успешно про¬шедшие этап имплантации спейсера — 113 человек (рис. 1).
В группах сравнения были проанализированы известные факторы риска возникновения инфекционных осложнений: структура исходных диагнозов, выявление типа возбудителя в пунктате на дооперационном этапе или диагностически значимых возбудителей из интраоперационного материала, наличие и выраженность патологии сердечно-сосудистой системы, дыхательной системы, печени и желчевыводящих путей, мочевыделительной системы, сахарного диабета, системных, гематологических и злокачественных заболеваний, нарушений системы свертывания, а также прием антикоагулянтов.
С целью определения степени предполагаемого риска рецидива ППИ нами был сформирован перечень сопутствующей патологии, состоящий из 17 пунктов, характеризующих наличие и степень выраженности различных сопутствующих заболеваний. Каждому пункту в зависимости от степени проявления заболевания присваивали от 0 до 3 баллов: 0 баллов — нет проявлений; 1 балл — незначительные проявления или их отсутствие, не требуется постоянная терапия; 2 балла — клинические проявления есть, но состояние пациента поддается контролю, требуется постоянная терапия; 3 балла — умеренные и тяжелые проявления болезни, несмотря на лечение (табл. 1).
В дальнейшем при помощи мультифакторного статистического анализа с использованием ме¬тода классификационных деревьев определяли значимость каждого фактора, пороговые значе¬ния для суммарного балла по сформулированной шкале коморбидности — индекса коморбиднос- ти для интерпретации полученных результатов. С использованием этой шкалы выполнен анализ результатов лечения всех пациентов, вошедших в исследование.
Всем пациентам, включенным в исследование, была выполнена санирующая операция в объеме артротомии, удаления компонентов эндопроте¬за и цементной мантии при ее наличии, дебридмента мягких и костной тканей, вовлеченных в инфекционный процесс, с обильным лаважом полости сустава раствором лавасепта (не менее 5 л) и дальнейшей имплантацией антимикробного артикулирующего или блоковидного цементного спейсера [4].
Первый этап хирургического лечения считали успешным, если у пациента при поступлении для ревизионного эндопротезирования отсутствовали клинико-лабораторные признаки рецидива ППИ. Повторные санирующие вмешательства между этапами санации трактовались как неудачный исход.


Статистический анализ
Полученные в процессе выполнения работы клинические результаты анализировали средства¬ми программной системы StatSoft STATISTICA 10. Сопоставление частотных характеристик (пол, тип ППИ, коморбидность и исход) качественных показателей проводили с помощью непараметрических методов х2, X2 Пирсона, критерия Фишера. В качестве центральной характеристики исполь¬зовали медиану, а в качестве мер рассеяния — нижний (Q1) и верхний (Q3) квартили (25-75% МКИ). Сравнение количественных параметров (возраст, длительность стационарного лечения, длительность операции и объем кровопотери) в исследуемых группах осуществляли с использованием критериев Манна- Уитни.
Различия между группами считали статистически значимыми при p<0,05.
Для определения значимости факторов и пороговых значений в предложенной шкале коморбидности был использован метод классификационных деревьев.
Результаты
Из 161 пациента, включенного в исследование, купировать инфекционный процесс после первой санирующей операции удалось у 113. Вторым эта¬пом им было выполнено ревизионное эндопроте-зирование. Таким образом, эффективность этапа санации составила 70,1%.
Общая характеристика как исследуемой когорты в целом, так и групп сравнения представлена в таблице 2. Распределение пациентов по полу и возрасту в группах сравнения было сопоставимым с незначительным преобладанием женщин. Средний возраст пациентов групп сравнения составил 60,5 лет (29-77). Гематогенный путь распространения инфекции с манифестацией симптомов позднее 12 мес. был наиболее распространенным у пациентов обеих групп. Первичное эндопротезирование у большинства пациентов, вошедших в исследование, было выполнено по поводу идиопатического гонартроза: 70,2% пациентов без рецидива ППИ и 50,0% — с рецидивами. Установлено, что посттравматический гонартроз значимо чаще (р = 0,05) встречался у пациентов с рецидивами ППИ, а системные заболевания как причина первичного эндопротезирования встречались с сопоставимой частотой.
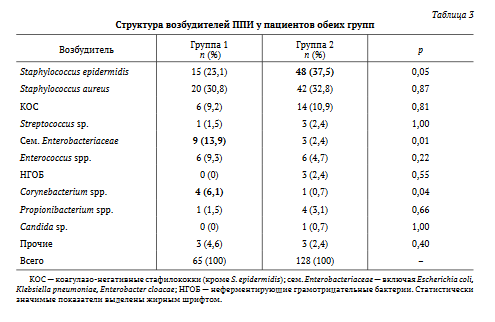
В структуре возбудителей ППИ у пациентов, успешно прошедших двухэтапное лечение, лидировал S. epidermidis, у пациентов с рецидивами инфекции наиболее частым возбудителем был S. aureus. Обращает на себя внимание, что 40% выделенных изолятов S. aureus у пациентов с рецидивами были устойчивы к метициллину, более чем в два раза (p = 0,086) превзойдя аналогичный показатель у пациентов без рецидивов (17,7%). При этом частота метициллин-резистентных штаммов эпидермального стафилококка в груп¬пах сравнения была сопоставимой. Представители Corynebacterium spp. и fam. Enterobacteriaceae чаще выделялись от пациентов с неблагоприятным исходом лечения (табл. 3).

КОС — коагулазо-негативные стафилококки (кроме S. epidermidis); сем. Enterobacteriaceae — включая Escherichia coli, Klebsiella pneumoniae, Enterobacter cloacae; НГОБ — неферментирующие грамотрицательные бактерии.
Статистически значимые показатели выделены жирным шрифтом.
Полимикробную инфекцию также в два раза чаще диагностировали при рецидивах ППИ — 22,6% по сравнению с 10,6% среди успешно про¬оперированных пациентов (p = 0,05).
Установлено, что наиболее часто встречающейся соматической патологией у пациентов обеих групп были заболевания сердечно-сосудистой системы: ИБС, артериальная гипертензия, сердечная недостаточность. При этом среди пациентов с рецидивами ППИ данная патология встречалась значимо чаще (p<0,001) (рис. 2).
Заболевания периферических сосудов, являясь фактором риска возникновения и рецидива ППИ и имея тенденцию к прогрессированию на фоне неоднократно перенесенных оперативных вмешательств, были выявлены у 48% пациентов группы 1 по сравнению с 24,8% пациентов группы 2 (p<0,001). Аналогичные различия в частоте встречаемости были выявлены для заболеваний печени и желчевыводящих путей, желудочно-кишечного тракта, а также почек и мочевыводящих путей (p<0,0001). Железодефицитная анемия, развивающаяся на фоне хронического длительно существующего инфекционного процесса, также значительно чаще (p<0,0001) выявлялась при лабораторном предоперационном обследовании пациентов группы 1.
Остальные включенные в анализ показатели не имели статистически значимых различий в группах сравнения.
В результате проведенного многофакторно¬го статистического анализа каждому показателю, использованному в шкале коморбидности, была присвоена своя степень значимости в зависимости от влияния этого фактора на полученный итоговый результат (табл. 4).
Установлено, что наибольшую значимость среди прочих факторов имеют гематологические заболевания (хроническая железодефицитная анемия), а также заболевания почек, ожирение и патология сердечно-сосудистой системы (артериальная гипертензия и ИБС).
Общая сумма баллов, полученная при заполнении шкалы для каждого пациента, получила название индекса коморбидности. В дальнейшем на основе статистического анализа определены значения пороговых критериевиндекса коморбидности, позволяющие трактовать полученный результат. У пациентов исследуемых групп было подсчитано количество баллов, соответствующее каждой категории результатов (рис. 3).
Также было проанализировано распределение пациентов по категориям риска внутри каждой группы и определены межгрупповые различия (табл. 5).
Итоговое среднее значение индекса коморбидности в группе пациентов без рецидива ППИ составило 7,4 (3-14), а для пациентов с рецидивами инфекции — 13,0 (6-21).
Обсуждение
Известно, что развитие рецидива после имплантации спейсера и дальнейшие попытки этапного хирургического лечения приводят к отягощению коморбидности и увеличению риска летального исхода [12]. Определение ключевых факторов риска рецидива, их взаимоотягощающий эффект и по возможности коррекция на дооперационном этапе могут как увеличить эффективность реэндо-протезирования, так и снизить летальность пациентов в послеоперационном периоде.
Дооперационная анемия у пациентов, которым выполняется первичное эндопротезирование, бо¬лее чем в 2 раза (с 2,0% до 4,2%) увеличивает риск манифестации ППИ, что установили М. Greenky с соавторами, проанализировав структуру ослож¬нений у 15707 пациентов. Практически полови¬не пациентов (44%) c дооперационной анемией потребовалось переливание донорской крови, при отсутствии этого фактора риска данный показатель составил 13,4% [13]. Несмотря на то, что переливание аллогенной крови увеличивает риск развития ППИ, E.T. Newman с соавторами не наш¬ли взаимосвязи этого метода коррекции уровня гемоглобина с рецидивом инфекционных ослож¬нений [14].
При помощи метода классификационных деревьев мы установили, что анемия у пациента с ППИ на дооперационном этапе является патологией, в наибольшей степени влияющей на риск развития рецидива. Однако этот фактор риска является модифицируемым, и своевременная коррекция уровня гемоглобина позволит повысить эффективность первого этапа хирургического лечения.
Еще одной группой заболеваний, повышающих риск неудач санирующих вмешательств у пациентов с ППИ, по нашим данным, является патология почек и мочевыводящих путей — ее частота у пациентов с рецидивом ППИ достигала 37,5%, значи¬мо превосходя (p<0,001) аналогичный показатель в группе 1 — 12,4%. К аналогичным выводам пришли M.A. McCleery с соавторами, доказав значимое увеличение относительного риска развития как ранней ППИ (ОР 1,52; p = 0,002), так и поздней гематогенной инфекции (ОР 2,22; p = 0,001) у пациентов с хронической болезнью почек после первичного эндопротезирования [15]. Еще больший риск развития инфекционных осложнений характерен для пациентов с терминальной ста¬дией хронической болезни почек, находящихся на гемодиализе (ОР 4,40; p = 0,001) [16].
Еще одним из весомых факторов риска развития рецидива в нашей работе была избыточная масса тела у пациентов с ППИ. Влияние этого фактора также подтверждают зарубежные публикации. A. Katakam с соавторами сообщают о более высоком проценте неудач у пациентов с ожирением, которым выполняли санацию инфекционного очага с сохранением компонентов эндопротеза (57,9%) по сравнению с группой пациентов без ожирения (36,8%; p = 0,035). C. Watts с соавторами продемонстрировали значимо меньшую эффективность этапа санации у пациентов с ППИ, проходящих этапное хирургическое лечение: при морбидном ожирении — 22% рецидивов по сравнению с 4% в группе сравнения (p<0,01) [17, 18].
Понимание значимости влияния кумулятивного эффекта различных патологий на продолжи¬тельность жизни пациентов привело к разработке различных калькуляторов, позволяющих прогнозировать как потенциальную продолжительность жизни пациента, так и, например, риск предстоящего оперативного вмешательства. M.E. Charlson с соавторами на основании данных о возрасте пациента и наличии сопутствующей патологии (сердечно-сосудистой системы, легких, печени, мочевыделительной системы, сахарного диабета, неврологических, онкологических заболеваний) создали калькулятор, позволяющий прогнозировать десятилетнюю выживаемость пациентов [19]. Степень выраженности заболевания по данной шкале учитывается только для патологии печени, сахарного диабета и онкологических заболеваний, для остальных включенных патологий имеет значение лишь факт их наличия.
В дальнейшем шкала Charlson была валидирована для прогнозирования ранней летальности (3 мес., 1 год, 5 лет) пожилых пациентов, госпитализированных с обострением хронической патологии [20]. Также эта шкала нашла свое применение при оценке риска выживаемости пациентов с терминальной стадией болезни почек, находящихся на гемодиализе, и пациентов с раком простаты в зависимости от типа выявленного простатспецифического антигена [21, 22]. Модификация шкалы Charlson позволила также использовать ее для оценки 30-дневной летальности у пациентов с бактериемией, вызванной Staphylococcus aureus [23].
Также была найдена корреляция баллов, полученных по шкале Американского общества анестезиологов (ASA), использующейся для прогнозирования риска оперативного вмешательства, с вероятностью возникновения ППИ. R.S. Namba с соавторами установили, что пациенты, получившие более 3 баллов по шкале ASA, относятся к категории высокого риска возникновения инфекционных осложнений [24].
Известно, что сочетание модифицируемых и немодифицируемых факторов риска оказывает влияние на вероятность развития ППИ. Анализ 64 различных факторов, выполненный T.L. Tan с соавторами, привел к появлению калькулятора, позволяющего рассчитать вероятность возникновения инфекционных осложнений. Однако такой калькулятор позволяет рассчитать лишь риск манифестации ППИ, при этом он не применим для прогнозирования риска рецидива инфекционного процесса ввиду особенностей структуры факторов риска [25].
Для прогнозирования исхода санации очага инфекционного воспаления с сохранением компонентов эндопротеза (DAIR-процедура) на основании наличия отдельных патологий, исходных заболеваний, приводящих к развитию гонартроза, и уровня С-реактивного белка двумя группами авторов были созданы два различных калькулятора. Шкала KLIC позволяет спрогнозировать вероятность успеха DAIR-процедуры вне зависимости от сроков манифестации ППИ, а шкала CRIME80 применяется для аналогичного оперативного вмешательства при острой гематогенной инфекции [26, 27].
C. Klemt с соавторами на основании анализа 56 факторов риска у 293 пациентов с ППИ установили, что наиболее сильными предикторами рецидива являются попытки санирующих вмешательств с сохранением компонентов эндопротеза, ожирение, наличие вредных привычек и выявление трудноизлечимого возбудителя (Enterococcus sp.). В то же время авторы не проводили подробный анализ сопутствующей патологии, ограничиваясь определением наличия наиболее известных патологий, повышающих риск возникновения ППИ [28].
Подсчет разработанного нами индекса комор- бидности показал, что для 58% пациентов с ре¬цидивами ППИ сумма баллов больше 12 соответ¬ствовала высокому риску рецидива ППИ. Высокий риск в группе пациентов без рецидивов был лишь у 6,2% (p<0,0001) пациентов, что говорит о высо¬кой чувствительности разработанной шкалы для расчета риска рецидива ППИ у пациентов.
Заключение
Проведение многофакторного анализа наличия и выраженности сопутствующей патологии позволило разработать шкалу коморбидности с расчетом интегрального показателя (индекса коморбидности) и установить его пороговые значения. Высокий показатель предложенного индекса (более 12 баллов) существенно повышает риск рецидива ППИ.
Предложенный индекс коморбидности может лечь в основу объединенного калькулятора риска рецидива и алгоритма тактики выбора хирургического лечения у пациентов с ППИ коленного сустава, что требует дальнейших исследований.
Литература
1. Корнилов Н.Н., Куляба Т.А., Филь А.С., Муравьёва Ю.В. Данные регистра эндопро¬тезирования коленного сустава РНИИТО им. Р.Р. Вредена за 2011-2013 годы. Травматология и ортопедия России. 2015;21(1):136-151.
3. Rosteius T., Jansen O., Fehmer T., Baecker H., Citak M., Schildhauer T.A. et al. Evaluating the microbial pattern of periprosthetic joint infections of the hip and knee. J Med Microbiol. 2018;67(11): 1608-1613. doi: 10.1099/jmm.0.000835.
4. Преображенский П.М., Божкова С.А., Пантелеев А.Н., Тихилов Р.М., Каземирский А.В. Свищевая и несвищевая формы перипротезной ин¬фекции коленного сустава: исходы лечения. Травматология и ортопедия России. 2020;26(4):21-31.
5. Di Benedetto P., Di Benedetto E.D., Buttironi M.M., De Franceschi D., Beltrame A., Gissoni R. et al. Two-stage revision after total knee arthroplasty. Acta Biomed. 2017;88(2S):92-97. doi: 10.23750/abm.v88i2-S.6519.
Bozhkova S.A. — the concept and design of the study, writing and editing of the manuscript, interpretation the obtained data.6. Sousa A., Carvalho A., Pereira C., Reis E., Santos A.C., Abreu M. et al. Economic Impact of Prosthetic Joint Infection - an Evaluation Within the Portuguese National Health System. J Bone Joint Infect. 2018;3(4):197-202. doi: 10.7150/jbji.28508.
7. Мурылев В., Куковенко Г., Елизаров П., Рукин Я., Цыгин Н. Перипротезная инфекция при эндопроте¬зировании тазобедренного сустава. Врач. 2018;(3): 17-22. doi: 10.29296/25877305-2018-03-04.
Murylev V., Kukovenko G., Elizarov P., Rukin Ya., Tsigin N. [Periprosthetic infection during hip arthroplasty]. Vrach [Doctor]. 2018;(3):17-22. (In Russian). doi: 10.29296/25877305-2018-03-04.8. Lum Z.C., Natsuhara K.M., Shelton T.J., Giordani M., Pereira G.C., Meehan J.P. Mortality During Total Knee Periprosthetic Joint Infection. J Arthroplasty. 2018;33(12):3783-3788. doi: 10.1016/j.arth.2018.08.021.
9. Parvizi J., Tan T.L., Goswami K., Higuera C., Della Valle C., Chen A.F. et al. The 2018 Definition of Periprosthetic Hip and Knee Infection: An Evidence- Based and Validated Criteria. J Arthroplasty. 2018;33(5): 1309-1314.e2. doi: 10.1016/j.arth.2018.02.078.
10. Parvizi J., Gehrke T., Chen A.F. Proceedings of the International Consensus on Periprosthetic Joint Infection. Bone Joint J. 2013;95-B(11):1450-1452. doi: 10.1302/0301-620X.95B11.33135.
11. Zimmerli W., Trampuz A., Ochsner P.E. Prosthetic- joint infections. N Engl J Med. 2004;351(16):1645-1654. doi: 10.1056/NEJMra040181.
12. Poultsides L.A., Liaropoulos L.L., Malizos K.N.
13. Greenky M., Gandhi K., Pulido L., Restrepo C., Parvizi J. Preoperative anemia in total joint arthroplasty: is it associated with periprosthetic joint infection? Clin Orthop Relat Res. 2012;470(10):2695-2701.
14. Newman E.T., Watters T.S., Lewis J.S., Jennings J.M., Wellman S.S., Attarian D.E. et al. Impact of perioperative allogeneic and autologous blood transfusion on acute wound infection following total knee and total hip arthroplasty. J Bone Joint Surg Am. 2014;96(4):279-284. doi: 10.2106/JBJS.L.01041.
15. McCleery M.A., Leach W.J., Norwood T. Rates of infection and revision in patients with renal disease undergoing total knee replacement in Scotland. J Bone Joint Surg Br. 2010;92(11):1535-1539. doi: 10.1302/0301-620X.92B11.23870.
16. Kim C.W., Kim H.J., Lee C.R., Wang L., Rhee S.J. Effect of chronic kidney disease on outcomes of total joint arthroplasty: a meta-analysis. Knee Surg Relat Res. 2020;32(1):12. doi: 10.1186/s43019-020-0029-8.
17. Katakam A., Melnic C.M., Bedair H.S. Morbid Obesity Is a Risk Factor for Infection Recurrence Following Debridement, Antibiotics, and Implant Retention for Periprosthetic Joint Infection. J Arthroplasty. 2020;35(12):3710-3715. doi: 10.1016/j.arth.2020.07.005.
18. Watts C.D., Wagner E.R., Houdek M.T., Lewallen D.G., Mabry T.M. Morbid Obesity: Increased Risk of Failure After Aseptic Revision TKA. Clin Orthop Relat Res. 2015;473(8):2621-2627. doi: 10.1007/s11999-015-4283-0.
19. Charlson M.E., Pompei P., Ales K.L., MacKenzie C.R. A new method of classifying prognostic comorbidity in longitudinal studies: development and validation. J Chronic Dis. 1987;40(5):373-383. doi: 10.1016/0021-9681(87)90171-8.
20. Frenkel W.J., Jongerius E.J., Mandjes-van Uitert M.J., van Munster B.C., de Rooij S.E. Validation of the Charlson Comorbidity Index in acutely hospitalized elderly adults: a prospective cohort study. J Am Geriatr Soc. 2014;62(2):342-346.
21. Park J.Y., Kim M.H., Han S.S., Cho H., Kim H., Ryu D.R. et al. Recalibration and validation of the Charlson comorbidity index in Korean incident hemodialysis patients. PLoS One. 2015;10(5):e0127240. doi: 10.1371/journal.pone.0127240.
22. Casas Duran F., Valduvieco I., Oses G., Cortes K.S.,
23. Ternavasio-de la Vega H.G., Castano-Romero F., Ragozzino S., R. Sanchez Gonzalez, M.P. Vaquero- Herrero, M. Siller-Ruiz et al. The updated Charlson comorbidity index is a useful predictor of mortality in patients with Staphylococcus aureus bacteraemia. Epidemiol Infect. 2018;f46(16):2122-2130. doi: 0.1017/S0950268818002480.
24. Namba R.S., Inacio M.C., Paxton E.W. Risk factors associated with deep surgical site infections after primary total knee arthroplasty: an analysis of 56,216 knees. J Bone Joint Surg Am. 2013;95(9):775-782. doi: 10.2106/JBJS.L.00211.
25. Tan T.L., Maltenfort M.G., Chen A.F., Shahi A., Higuera C.A., Siqueira M. et al. Development and Evaluation of a Preoperative Risk Calculator for Periprosthetic Joint Infection Following Total Joint Arthroplasty. J Bone Joint Surg Am. 2018;100(9):777-785. doi: 10.2106/JBJS.16.01435.
26. Tornero E., Morata L., Martmez-Pastor J.C., Bori G., Climent C., Garda-Velez D.M. et al. KLIC-score for predicting early failure in prosthetic joint infections treated with debridement, implant retention and antibiotics. Clin Microbiol Infect. 2015;21(8):786.e9-786. e17. doi: 10.1016/j.cmi.2015.04.012.
27. Sabater-Martos M., Hernandez Hermoso J.A., Garda Oltra E., Molinos S., Martmez-Pastor J.C. Validity of the KLIC and CRIME80 scores in predicting failure in late acute infection treated by debridement and implant retention. RevEsp Cir Ortop Traumatol (EnglEd). 2020;64(6):415-420. doi: 10.1016/j.recot.2020.05.002. (In English, Spanish).
28. Klemt C., Tirumala V., Smith E.J., Padmanabha A., Kwon Y.M. Development of a Preoperative Risk Calculator for Reinfection Following Revision Surgery for Periprosthetic Joint Infection.
Теги: перипротезная инфекция
234567 Начало активности (дата): 02.03.2024 22:12:00
234567 Кем создан (ID): 989
234567 Ключевые слова: перипротезная инфекция, коленный сустав, рецидив, коморбидность, факторы риска
12354567899
Похожие статьи
Сравнительная оценка использования индивидуальных ЗЭ-компонентов и стандартных имплантатов для реконструкции вертлужной впадины при ревизионном эндопротезированииРентген на дому 8 495 22 555 6 8
Эндопротезирование тазобедренного сустава у пациентов с посттравматическими дефектами и деформациями вертлужной впадины
Результаты ревизионного эндопротезирования коленного сустава с применением индивидуальных имплантатов
Инфекция, вызванная Stenotrophomonas maltophilia, у пациентов травматолого-ортопедического профиля: клинический опыт и обзор литературы



