 16.01.2024
16.01.2024
Эффективность современных пероральных форм нестероидных противовоспалительных препаратов для обезболивания после тотального эндопротезирования коленного сустава
Тотальное эндопротезирование коленного сустава (ТЭКС) характеризуется выраженным болевым синдромом в послеоперационном периоде с тенденцией к медленному снижению
Введение
Тотальное эндопротезирование коленного сустава (ТЭКС) сопровождается развитием выраженной боли в послеоперационном периоде, которая имеет тенденцию к снижению в течение недель, а у некоторых пациентов — даже месяцев [1]. Это обусловлено, с одной стороны, сложностью иннервации данной анатомической области [2], а с другой стороны, тем, что после ТЭКС формируются новые биомеханические и кинематические условия функционирования всей нижней конечности в целом.
Одним из достижений технологий артроплас- тики крупных суставов в XXI в. стало научное обоснование и клиническое внедрение мультимодального подхода к анальгезии, неотъемлемым элементом которого являются нестероидные противовоспалительные препараты (НПВП) [3, 4]. В настоящее время в РФ зарегистрировано около 30 молекул, относящихся к этой группе, которые представлены как оригинальными препаратами, так и дженериками. Выбор НПВП осуществляется эмпирически и в основном определяется наличием у пациента индивидуальных факторов риска, среди которых наиболее значимыми являются сердечнососудистая патология и заболевания органов желудочно-кишечного тракта [5]. Отдельные молекулы обладают более выраженным анальгетическим, нежели противовоспалительным/жаропонижающим эффектом, что может быть клинически значимым в раннем послеоперационном периоде. Тем не менее исследований, напрямую сравнивающих клиническую эффективность различных НПВП после ТЭКС, как в зарубежной, так и отечественной научной литературе встречается мало [6, 7]. Следует отметить и то, что в РФ для послеоперационного обезболивания традиционно применяются парентеральные формы НПВП, хотя за рубежом, в силу трансформации в последние два десятилетия артропластики крупных суставов в «хирургию одного дня», предпочтение отдается пероральным формам [8].
Цель исследования — сравнительная оценка эффективности и безопасности применения таблети- рованных форм кеторолака и кетопрофена для купирования послеоперационной боли у пациентов c гонартрозом после тотального эндопротезирования коленного сустава.
Материал и Методы
Выполнено открытое наблюдательное проспективное рандомизированное сравнительное.
Пациенты
В исследование вошли 100 пациентов (80 женщин и 20 мужчин, средний возраст 66,6 лет) с терминальной стадией гонартроза (3 ст. по классификации Н.С. Косинской или IV ст. по классификации Kellgren- Lawrence). Все пациенты были госпитализированы в НМИЦ ТО им. Р.Р. Вредена для планового первичного неосложненного ТЭКС с апреля по ноябрь 2022 г.
Критерии включения:
- варусная деформация не более 25°;
- ограничение объема движений не более 60°;
- ИМТ менее 36;
- отсутствие противопоказаний к использованию максимальных доз НПВП, местных анестетиков, гемостатического жгута;
- отсутствие костных дефектов, требующих восполнения.
Критерии невключения:
- корригирующие остеотомии бедренной или большеберцовой кости в анамнезе;
- посттравматический гонартроз;
- анкилоз коленного сустава;
- системные заболевания соединительной ткани;
- предшествующее эндопротезирование контралатерального коленного сустава;
- наличие клинически значимых внесуставных источников боли (дегенеративно-дистрофические заболевания позвоночника, коксартроз, невропатии и т.п.);
- гиперчувствительность к кеторолаку и кето- профену;
- наличие серьезной сопутствующей патологии, затрудняющей интерпретацию результатов лечения;
- злокачественные новообразования; застойная сердечная недостаточность (NYHA класс II- IV); почечная недостаточность (креатинин более 0,18 ммоль/л);
- лихорадка;
- нарушения сердечного ритма;
- неспособность пациента понять процедуру, незнание русского языка.
Критерии исключения из исследования: любые периоперационные осложнения, требующие изменения стандартного протокола ведения пациента (в том числе имплантация систем повышенной связанности), либо нарушение пациентом протокола исследования (отказ от приема обезболивающих препаратов, невозможность заполнения инструментов оценки и т.п.).
Пациенты были рандомизированы методом случайных чисел в две группы. В основной группе (49 пациентов) для обезболивания после ТЭКС использовали новую таблетированную форму кето- ролака 10 мг (1 диспергируемая таблетка Кеторол Экспресс 4 раза в сут.). В контрольной группе (51 пациент) с той же целью применяли таблетиро- ванную форму кетопрофена 100 мг (1 таблетка Кетонала 2 раза в сут.). Из исследования не было исключено ни одного пациента.
Оценка результатов
Оценка результатов лечения в обеих группах про-изводилась по балльным шкалам-опросникам, прошедшим культурную адаптацию и валидацию в РФ, перед операцией и ежедневно со дня опера-ции (день 0) до 4-х сут. после ее выполнения (день накануне выписки):
1. Цифровая рейтинговая шкала (NRS) предназначена для измерения интенсивности боли и измеряется в баллах от 1 до 10, где 1 — отсутствие боли и 10 — сильнейшая боль, какую можно только представить [9].
После операции первый раз пациенты отмечали уровень боли до приема препарата (Прием 1), а затем фиксиро-вали интенсивность боли через каждые 15 мин. в течение часа.
2. Визуальная аналоговая шкала (ВАШ) также предназначена для измерения интенсивности боли и представляет собой отрезок прямой длиной 10 см, начало которого соответствует отсутствию боли, а конечная точка — максимально возможной «невыносимой» боли. Расстояние между началом отрезка («боли нет») и сделанной пациентом отметкой измеряли в сантиметрах и округляли до целого: каждый сантиметр на линии соответствовал 1 баллу. Частота измерений по ВАШ была такой же, как и NRS.
3. Дневник боли (Pain Diary — PD) предло-жен для ежедневной оценки болевого синдрома. Опросник отражает шесть различных аспектов боли: наименьшую, среднюю и наивысшую силу болевых ощущений в течение суток и, кроме этого, уровень и продолжительность боли как в покое, так и при движениях в коленном суставе. Для градации используется NRS в пределах от 0 (нет боли) до 10 (максимальный уровень боли). Длительность болевых ощущений определяется количеством часов в день
4. Опросник коморбидности (The Self- Administered Comorbidity Questionnaire — SACO) предназначен для анализа сопутствующей патологии, которая является прогностическим фактором исходов лечения и возможных осложнений, а также функциональных результатов и продолжительности пребывания в ортопедическом стационаре [10].
5. Шкала Oxford Knee Score-12 (OKS) характеризует боль и функцию коленного сустава у пациентов с гонартрозом до и после ТЭКС, обладая высокой специфичностью и чувствительностью [11, 12].
Оценка нежелательных эффектов и побочных действий проводилась с использованием оригинального опросника, составленного на основе побочных действий кеторолака*/кетопрофена**, которые описаны в утвержденных инструкциях к препаратам с пометками «часто» и «менее часто».
Кроме этого, изучали:
1) переносимость препарата по четырехбалльной категориальной шкале: 1 балл — плохая переносимость, 2 — удовлетворительная, 3 — хорошая, 4 — отличная;
2) удобство применения формы препарата: да/ нет (приятный вкус, удобство применения, быстрота развития эффекта);
3) общую удовлетворенность лечением по пятибалльной категориальной шкале: 1 — состояние ухудшилось, 2 — состояние не изменилось, 3 — состояние частично удовлетворительное, 4 — состояние удовлетворительное, 5 — состояние значительно улучшилось.
Половозрастные, клинико-рентгенологические, функциональные и интраоперационные характеристики пациентов в обеих сравниваемых группах не имели статистически значимых отличий (табл. 1). Сравнение проводилось с помощью Х2-критерия Пирсона для качественных признаков и критерия Манна - Уитни для количественных признаков.
Таблица 1
Характеристика пациентов в группах сравнения, n (%), Me [Q1;Q2]
|
Параметр |
Основная группа (кеторолак) n = 49 |
Контрольная группа (кетопрофен) n = 51 |
|
Женщины |
43 (87,7) |
37 (72,5) |
|
Мужчины |
6 (12,3) |
14 (27,5) |
|
Возраст, лет |
65 [59;73] |
65 [59;70] |
|
Длительность заболевания, лет менее 5 |
29 (59,3) |
33 (64,3) |
|
более 5 |
17 (34,7) |
15(29,4) |
|
Время операции, мин. |
60 [55;65] |
60 [55;70] |
|
Кровопотеря, мл |
50 [50;85] |
50 [50;65] |
|
с гемостатическим жгутом |
38 (76,6) |
41 (80,4) |
|
без гемостатического жгута |
11 (22,4) |
10 (19,6) |
Окончание таблицы 1
|
Параметр |
Основная группа (кеторолак) n = 49 |
Контрольная группа(кетопрофен) n = 51 |
|
Продолжительность использования жгута, мин. |
60 [50;60] |
60 [50;70] |
|
Имплантат с сохранением ЗКС |
43 (87,8) |
48 (94,1) |
|
Имплантат с замещением ЗКС Модель эндопротеза |
6 (12,2) |
3 (5,9) |
|
AGC (Zimmer Biomet) |
18 (36,7) |
26 (51,1) |
|
Sigma (Johnson & Johnson, DePuy) |
23 (46,9) |
21 (41,2) |
|
NexGen (Zimmer Biomet) |
3 (6,1) |
3 (5,9) |
|
Anthem (Smith & Nephew) |
3 (6,1) |
1 (1,9) |
|
Triathlon (Stryker) |
2 (4,1) |
- |
|
NRS до операции |
5 [3;6] |
5 [3;7] |
|
OKS до операции |
33 [29;39] |
34 [27;40] |
|
Наличие сопутствующей патологии |
36 (73) |
39 (76) |
Во всех наблюдениях была использована спинномозговая анестезия с внутривенной седацией. ТЭКС выполнялось обоими авторами стандартизировано с применением техники измеряемой резекции и восстановлением нейтральной механической оси конечности с симметрией сгибательного и разгибательного промежутков, с использованием ограниченного срединного доступа с переднемедиальной артротомией [13]. Синовэктомия, эндопротезирование надколенника и дренирование раны не применялись. Во всех случаях осуществляли локальную инфиль- трационную анальгезию по методике, описанной нами ранее [14].
Обе группы исследования были сравнимы по количеству пациентов с коморбидностью, среди которой лидировали сердечно-сосудистые заболевания (62 или 81,6%) и боли в позвоночнике (52 или 68,4%), в то время как патология желудочно-кишечного тракта была более редкой (17 или 22,4%).
Статистический анализ
Применялись следующие статистические методы для обработки данных:
- описательные статистики (математическое ожидание, среднеквадратичное отклонение, медиана, квартили, минимум/максимум) для обобщения первичных результатов, полученных из индивидуальных регистрационных карт пациентов;
- доверительная оценка параметров (математическое ожидание, стандартное отклонение (SD)), позволяющая оценивать исследуемые параметры с заданной надежностью.
Качественные переменные описывались абсолютными и относительными частотами (процентами).
При сравнении качественных показателей использованы методы статистического анализа:
Х2-критерий Пирсона, парный и непарный t-критерии Стьюдента. Для параметров, распределение которых отличалось от нормального, использовали непараметрические тесты: при сравнении двух групп использовали критерий Манна - Уитни, критерий Вилкоксона. Различия считались статистически значимыми при p<0,05.
Статистическая обработка данных проводилась на персональном компьютере с помощью программы IBM SPSS Statistics 25. Статистический анализ данных проводился на выборке пациентов, имеющих данные об анализируемом параметре.
Результаты
Динамика уровня боли по шкалам NRS и ВАШ в обеих группах демонстрировала одинаковую тенденцию: средние значения достигали пика уровня умеренной боли в 1-е сут. после операции, снижаясь затем к 4-м сут. вдвое (рис. 1).
С помощью критерия Вилкоксона выявлено значимое снижение боли для обоих препаратов между днем операции и 4-м сут. наблюдения (р = 0,000). В каждой из точек наблюдения значимого различия на основе критерия Манна- Уитни по шкале NRS между группами не выявлено (р>0,05) (табл. 2).
Средний, минимальный и максимальный уровни боли в течение дня как в покое, так и при движениях, а также продолжительность умеренной/ сильной боли в течение дня значимо не отличались. Как кеторолак, так и кетопрофен позволяли эффективно контролировать уровень боли после ТЭКС: суточная динамика снижения боли представлена на рисунке 2.
В каждой из точек наблюдения значимых различий по шкале ВАШ на основе критерия Манна - Уитни между группами не выявлено (р>0,05) (табл. 3).
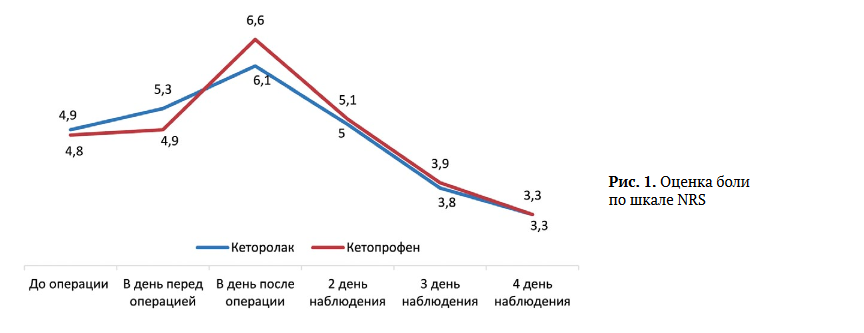
Оценка боли по шкале NRS на основе критерия Манна - Уитни, Me [Q1;Q2]
|
Срок наблюдения |
Основная группа (кеторолак) |
Контрольная группа (кетопрофен) |
Р |
|
До операции |
5 [3;6] |
5 [3;7] |
0,789 |
|
В день перед операцией |
5 [4;7] |
5 [4;6] |
0,169 |
|
В день после операции |
6[5;7] |
7 [5;8] |
0,144 |
|
2-й день наблюдения |
5 [4;6] |
5 [3;6] |
0,957 |
|
3-й день наблюдения |
4[3;5] |
4[3;5] |
0,808 |
|
4-й день наблюдения |
3 [2;4] |
3 [2;4] |
0,946 |
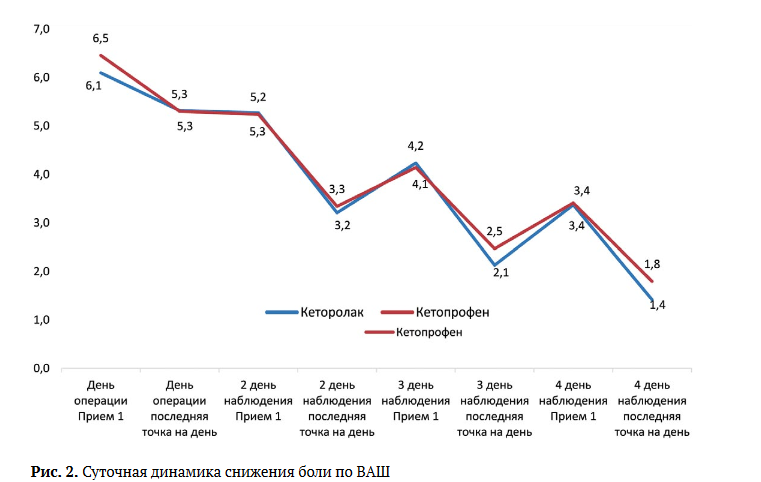
Таблица 3
Суточная динамика снижения боли по шкале ВАШ на основе критерия Манна - Уитни,
Me [Q1;Q2]
|
Срок наблюдения |
Основная группа (кеторолак) n = 49 |
Контрольная группа (кетопрофен) n = 51 |
Р |
|
День операции Прием 1 |
6[5;7] |
7 [5;8] |
0,402 |
|
День операции, последняя точка на день |
5,5 [4;7] |
5 [4;7] |
0,908 |
|
2-й день наблюдения Прием 1 |
6 [4;7] |
5 [4;6] |
0,700 |
|
2-й день наблюдения Последняя точка на день |
2,5 [1;5] |
3 [2;5] |
0,531 |
|
3-й день наблюдения Прием 1 |
4[3;5] |
4[3;5] |
0,666 |
|
3-й день наблюдения Последняя точка на день |
2 [1;3] |
2 [1;3] |
0,349 |
|
4-й день наблюдения Прием 1 |
3 [3;4] |
3 [3;4] |
0,916 |
|
4-й день наблюдения Последняя точка на день |
1 [1;2] |
1 [1;2] |
0,395 |
Скорость наступления обезболивающего эффекта в течение первого часа после приема препарата статистически значимо не отличалась в обеих группах пациентов.
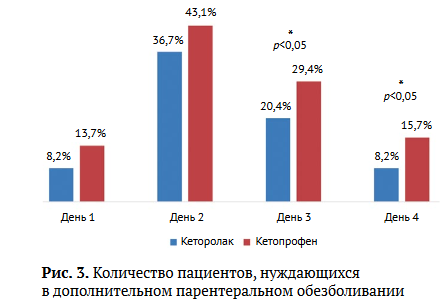
В обеих группах выявлено сравнимое число пациентов, которым дополнительно к пероральному приему потребовалось парентеральное введение анальгетиков: в среднем 3,57 инъекции в основной группе и 4,41 — в контрольной. Однако на 3-и и 4-е сут. после операции среди пациентов, получавших кеторолак, необходимость в дополнительном обезболивании была статистически значимо ниже: примерно на треть к 3-м сут.и почти вдвое — к 4-м сут. (рис. 3).
Наркотические анальгетики (трамадол 2 мл в/м одно-двукратно) и ненаркотические (р-р парацетамола — 500 мг / 50 мл в/в одно-двукратно) рутинно применялись только в 1-е сут. после операции 43,1% по требованию пациента при условии недостаточной анальгезии. В дальнейшем доля пациентов, нуждающихся в их использовании, была крайне низкой, значимо не отличаясь между обеими группами.
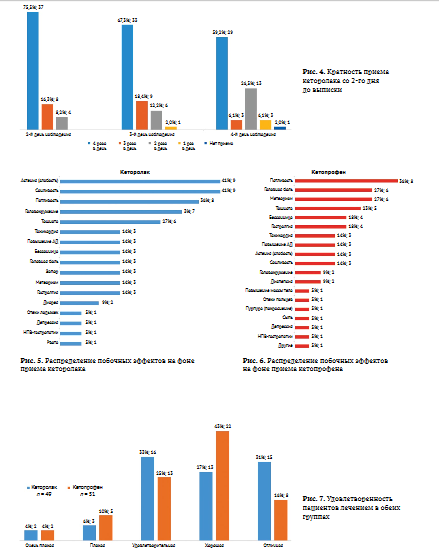
Среди пациентов, принимавших Кеторол Экспресс, начиная со 2-го дня после операции, некоторые снижали кратность его приема в течение суток в связи с минимальным уровнем болевых ощущений, в отличие от контрольной группы (рис. 4). В итоге к 4-м сут. после операции около трети пациентов не нуждались в четырехкратном приеме этого препарата. При этом среди пациентов, уменьшавших кратность приема до трех, двух или даже одного раза, к 3-4-м сут. боль продолжала оставаться на низком уровне: 0,6-1,8 по NRS. Среди пациентов, принимавших Кетонал, на однократный прием со 2-го дня перешли двое (3,9%), с 3-го дня трое (5,9%), и с 4-го дня — двое (3,9%).
Частота нежелательных явлений была схожа в обеих группах пациентов — 47% (22) и 44% (22) соответственно. Их распределение представлено на рисунках 5 и 6. Анализ наличия или отсутствия связи отмеченных нежелательных явлений с используемыми препаратами не проводился, изменения протокола лечения или дополнительной коррекции не потребовалось. Следует подчеркнуть, что ни у одного из находившихся под наблюдением пациентов не развилось серьезное нежелательное явление или реакция по критериям ВОЗ.
Более 2/3 пациентов отметили переносимость обоих препаратов как хорошую и отличную. Однако об отличном уровне удовлетворенности проводимым лечением среди пациентов, принимавших кеторолак, сообщило вдвое больше, чем среди получавших кетопрофен (рис. 7).
Обсуждение
Во-первых, полученные результаты свидетельствуют о том, что пероральное применение современных форм НПВП после ТЭКС позволяет добиться адекватного уровня анальгезии на протяжении всего периода, пока пациент находится в стационаре, тем самым снизив нагрузку на средний медицинских персонал. В проведенном нами ранее исследовании, посвященном изучению траекторий боли после ТЭКС, в котором НПВП применяли парентерально, абсолютные величины и динамика среднего, минимального и максимального уровней боли в течение дня (в покое и при движениях), а также количество часов умерен- ной/сильной боли в течение суток даже несколько превышали значения, продемонстрированные при использовании таблетированных форм [14]. Парентеральное введение ненаркотических и наркотических аналгетиков остается востребованным в 1-е сут. после хирургического вмешательства, когда использование пероральных форм может быть затруднено из-за заторможенного или возбужденного состояния пациента [15].
При этом НПВП в сочетании с опиоидными анальгетиками являются моделью мультимодальной анальгезии [16, 17]. Тем не менее, учитывая, что большинству пациентов после ТЭКС прием НПВП может быть необходим до 3 мес. после операции, важным является подбор схемы эффективной пероральной аналгезии еще в период стационарного лечения, так как умеренная/сильная боль, сохраняющаяся к 3-м сут. после вмешательства, является значимым прогностическим фактором риска развития хронического послеоперационного болевого синдрома [18].
Во-вторых, оба сравниваемых препарата (ке- торолак в форме диспергируемой таблетки и кетопрофен в таблетированной форме) не показали значимых отличий по переносимости в сопоставимых группах пациентов, у которых лидирующим фактором коморбидности была патология сердечно-сосудистой системы [19]. Зафиксированные нежелательные явления среди пациентов обеих групп не потребовали дополнительной терапии или отмены НПВП и купировались самостоятельно. Учитывая, что пациенты в раннем послеоперационном периоде, кроме НПВП, получают лекарственные средства для профилактики инфекционных и тромбоэмболических осложнений, а также терапии сопутствующих заболеваний, размер проанализированной выборки недостаточен для выявления корреляционных взаимосвязей между конкретным НПВП и побочным эффектом.
Полученные нами данные об относительной эффективности и безопасности НПВП соответствуют выводам системного метаанализа 25 РКИ, посвященного применению НПВП у пациентов после тотальной артропластики коленного и тазобедренного суставов и рекомендациям рабочей группы PROSPECT (PROcedure SPEcific Postoperative Pain ManagemenT), которая представляет собой глобальное сотрудничество хирургов и анестезиологов, формулирующих рекомендации по лечению боли после распространенных операций [20, 21]. Относительно клинически значимых осложнений со стороны желудочно-кишечного тракта, применение НПВП после подобных хирургических вмешательств характеризуется низким риском (0,6%), однако если и развивается, то приводит к существенному удлинению пребывания в стационаре и повышению внутрибольничной смертности [22, 23]. Поэтому перед эндопротезированием крупных суставов конечностей обоснованным является проведение фиброгастродуоденоскопии для скрининга пациентов со скрытыми гастропатиями. Таким образом, результаты исследования подтверждают актуальность тезиса, отраженного в отечественных клинических рекомендациях, о возможности эмпирического подхода к выбору НПВП для послеоперационной анальгезии, но с учетом имеющейся у пациента соматической патологии [24].
В-третьих, если у пациента после операции достигнут низкий уровень боли, стабильно сохраняющейся и в периоды двигательной активности, например при ходьбе и занятиях лечебной физкультурой, суточная доза препарата может быть снижена. С одной стороны, это оптимизирует расход лекарственных средств, а с другой — является профилактикой развития нежелательных явлений, для некоторых из которых характерен дозозависимый эффект.
Ограничения исследования
К ограничениям исследования следует отнести неравномерное гендерное и смешанное этническое распределение пациентов в изучаемой выборке, что, хотя и отражает реальную клиническую практику работы НМИЦ ТО им. Р.Р. Вредена, требует взвешенной трактовки полученных результатов. При сложных случаях первичного ТЭКС или ревизионных вмешательствах степень хирургической агрессии, включая продолжительность и кровопотерю, могут отражаться как на уровне послеоперационной боли, так и на эффективности обезболивания, что требует отдельного изучения.
Заключение
Пероральные формы кеторолака и кетопрофе- на демонстрируют сопоставимую высокую эффективность при купировании боли после ТЭКС и хорошо переносятся пациентами.
К 3-4-м сут. после операции в группе пациентов, получавших кеторолак, на 30% сокращается количество нуждающихся в его четырехкратном приеме, а также снижается доля больных, добровольно на фоне низкого уровня боли отказывающихся от дополнительного парентерального обезболивания. Таким образом, таблетированные формы НПВП являются адекватной альтернативой парентеральному применению препаратов данной группы в раннем послеоперационном периоде после ТЭКС.
Сведения об авторах
Сараев Александр Викторович — канд. мед. наук, сбор клинического материала, редактирование статьи.
Корнилов Николай Николаевич — д-р мед. наук, анализ литературы, написание и редактирование статьи.
Литература1. Li J.W., Ma Y.S., Xiao L.K. Postoperative Pain Management in Total Knee Arthroplasty. Orthop Surg. 2019;11(5):755-761. doi: 10.im/os.12535.
2. Fonkoue L., Behets C., Kouassi J.K., Coyette M., Detrembleur C., Thienpont E. et al. Distribution of sensory nerves supplying the knee joint capsule and implications for genicular blockade and radiofrequency ablation: an anatomical study. Surg Radiol Anat. 2019;41(12):1461- 1471. doi: 10.1007/s00276-019-02291-y.
3. Elmara R.K., Chugtai M., Khlopas A., Newman J.M., Stearns K.L., Roche M. et al. Anesthesia during total knee replacement. J Knee Surg. 2018;31(6):504-513. doi: 10.1055/S-0037-1604152.
4. Harrison A.E., Kozarek J.D.B., Yeh J., MacDonald J.H., Ruiz-Pelaez J.G., Barengo N.C. et al. Postoperative outcomes of total knee arthroplasty across varying levels of multimodal pain management protocol adherence. J Orthop. 2021;28:26-33. doi: 10.1016/j.jor.2021.10.005.
5. Suri P., Morgenroth D.C., Hunter D.J. Epidemiology of osteoarthritis and associated comorbidities. PM R. 2012;4(5 Suppl):S10-19. doi: 10.1016/j.pmrj.2012.01.007.
6. Haffar
A., Fillingham Y.A., Breckenridge L., Gursay D., Lonner J.H. Meloxicam versus
Celecoxib for Postoperative Analgesia after Total Knee Arthroplasty: Safety,
Efficacy and Cost. J Am Acad Orthop Surg Glob Res Rev. 2022;6(4):e22.00032.
7. Laoruengthana A., Rattanaprichavej P., Reosanguanwong K., Chinwatanawongwan B., Chompoonutprapa P., Pongpirul K. A randomized controlled trial comparing the efficacies of ketorolac and parecoxib for early pain management after total knee arthroplasty. Knee. 2020;27(6):1708-1714. doi: 10.1016/j.knee.2020.10.005.
8. Grifka J., Greimel F., Maderbacher G. Outpatient endoprosthetics in a day hospital. Orthopedics. 2022;51(5):380-384. (In German).
9. Alghadir
A.H., Anwer S., Iqbal A., Iqbal Z.A. Test-retest reliability, validity, and
minimum detectable change of visual analog, numerical rating, and verbal rating
scales for measurement of osteoarthritic knee pain. J Pain Res.
2018;11:851-856.
10. Sangha
O., Stucki G., Liang M.H., Fossel A.H., Katz J.N. The Self-Administered
Comorbidity Questionnaire: a new method to assess comorbidity for clinical and
health services research. Arthritis Rheum. 2003;49(2):156-163.
11. Dawson
J., Fitzpatrick R., Murray D., Carr A. Questionnaire on the perceptions of
patients about total knee replacement. J Bone Joint Surg Br. 1998;80(1): 63-69.
12. Синеокий А.Д., Билык С.С., Близнюков В.В., Ефимов Н.Н., Коваленко А.Н., Бадмаев А.О. Кросскультурная адаптация и валидация русскоязычной версии анкеты Oxford Knee Score для пациентов с гонартрозом, ожидающих выполнения первичного эндопротезирования. Современные проблемы науки и
образования. 2017;(2).
13. Руководство по первичному эндопротезированию коленного сустава. 2-е изд. Под ред. Т.А. Кулябы, Н.Н. Корнилова, Р.М. Тихилова. Санкт-Петербург: НМИЦ ТО им. Р.Р.Вредена; 2022. С. 177-183.
14. Kornilov N., Lindberg M.F., Gay C., Saraev A., Kuliaba T., Rosseland L.A. et al. Factors Related to Postoperative Pain Trajectories following Total Knee Arthroplasty: A Longitudinal Study of Patients Admitted to a Russian Orthopaedic Clinic. Pain Res Treat. 2016;2016:3710312. doi: 10.1155/2016/3710312.
15. Каратеев А.Е. Насколько оправдано применение инъекционных форм нестероидных противовоспалительных препаратов? РМЖ. Медицинское обозрение. 2020;4(8):518-524. doi: 10.32364/2587-6821-2020-4-8-518-524.
16. Itticikultol V., Prachanpanich N., Kositchayvat S., Intapan T. Postoperative analgesic efficacy of celecoxib compared with placebo and parecoxib after total hip or knee replacement. J Med Assoc Thai. 2010;93(8):937-942.
17. Li J.V., Ma Y.S., Xiao L.K. Postoperative anesthesia for total knee replacement. Orthop Surg. 2019;11(5):755- 761. doi: 10.1111/os.12535.
18. Zhang Y., Li Z., Su O., Ge H., Cheng B., Tian M. The duration of postoperative analgesic use after total knee arthroplasty and nomogram for predicting prolonged analgesic use. Front Surg. 2022;9:911864. doi: 10.3389/fsurg.2022.911864.
19. Алексеева Л.И., Лила А.М.,
Шарапова Е.П., Таскина Е.А., Кашеварова Н.Г., Стребкова Е.А. и др.
Многоцентровое проспективное исследование эффективности и безопасности
гликозами- ногликан-пептидного комплекса в комбинации с диацереином у пациентов
с остеоартритом коленных суставов. Терапия. 2022;(2):6-18.
20. Fillingham Y.A., Hannon C.P., Roberts K.C., Mullen K., Casambre F., Riley C. et al. The Efficacy and Safety of Nonsteroidal Anti-Inflammatory Drugs in Total Joint Arthroplasty: Systematic Review and Direct MetaAnalysis. J Arthroplasty. 2020;35(10):2739-2758. doi: 10.1016/j.arth.2020.05.035.
21. Lavand’homme P.M., Kehlet H., Rawal N., Joshi G.P. Pain management after total knee arthroplasty: PROcedure SPEcific Postoperative Pain ManagemenT recommendations. Eur J Anaesthesiol. 2022;39(9):743- 757. doi: 10.1097/EJA.0000000000001691.
22. Massaglia J., Yayac M., Star A., Deirmengian G., Courtney P.M., Saxena A. Gastrointestinal Complications Following Total Joint Arthroplasty Are Rare but Have Severe Consequences. J Arthroplasty. 2021;36(8):2974- 2979.
23. Adenikinho A.S., Feng J.E., Namba K.A., Lutringer T.A., Lajam K.M. Gastrointestinal complications requiring invasive interventions after total joint replacement. J Arthroplasty. 2019;34(11):2780-2784. doi: 10.1016/j.arth.2019.06.026.
24. Каратеев А.Е., Насонов Е.Л., Ивашкин В.Т., Мартынов А.И., Яхно Н.И., Арутюнов Г.П. и др. Рациональное использование нестероидных противовоспалительных препаратов. Клинические рекомендации. Научно-практическая ревматология. 2018;56 (Прил. 1):1-29. doi: 10.14412/1995-4484-2018-1-29. Karateev A.E., Nasonov E.L., Ivashkin V.T., Martynov A.I., Yakhno N.N., Arutyunov G.P. et al. Rational use of nonsteroidal anti-inflammatory drugs. Clinical guidelines. Rheumatology Science and Practice. 2018;56(Suppl. 1):1-29 (In Russian).
Теги: эндопротезирование коленного сустава
234567 Начало активности (дата): 16.01.2024 15:00:00
234567 Кем создан (ID): 989
234567 Ключевые слова: эндопротезирование коленного сустава, послеоперационный болевой синдром, аналгезия, нестероидные противовоспалительные препараты
12354567899
Похожие статьи
Замещение костного дефекта таранной кости аутотрансплантатом, взятым из пяточной кости, с применением AMIC-технологии: клинический случайРентген на дому 8 495 22 555 6 8
Эндопротезирование коленного сустава у пациентов, находящихся на хроническом гемодиализе: стандартная операция или сложный случаи?
Результаты лечения пациентов с переломами лодыжек и заднего края большеберцовой кости с использованием различных вариантов хирургической техники
Перипротезная инфекция коленного и тазобедренного суставов - можно ли сравнивать результаты лечения?



