 15.01.2024
15.01.2024
Выбор метода остеосинтеза при внутрисуставных переломах проксимального эпифиза плечевой кости
Наиболее тяжелой категорией переломов проксимального эпифиза плечевой кости являются внутрисуставные повреждения.
Введение
Переломы проксимального отдела плечевой кости (ПОПК) составляют около 6% всех переломов, а пик заболеваемости приходится на возрастную группу от 60 до 90 лет [1]. У пациентов старше 65 лет они находятся на третьем месте по частоте после повреждений критических зон остеопороза [2]. Несмотря на многие исследования, доказывающие неэффективность консервативных методов лечения ПОПК, работа по сравнению оперативного и консервативного методов проводится постоянно. Доминирующей точкой зрения в настоящий момент является мнение, что консервативное лечение нестабильных многофрагментных переломов проксимального отдела плечевой кости в большинстве случаев приводит к неудовлетворительным результатам [3]. Их хирургическое лечение представлено тремя основными направлениями: накостный остеосинтез пластинами с угловой стабильностью, интрамедуллярный блокирующий остеосинтез различными модификациями проксимальных плечевых гвоздей (PHN) и эндопротезирование плечевого сустава.
Существуют также оригинальные авторские фиксаторы, имеющие ограниченную распространенность. Чрескостный остеосинтез переломов ПОПК не получил широкого распространения в связи с технической сложностью и необходимостью постоянного контроля за состоянием аппаратов внешней фиксации.
Несмотря на разработанные клинические рекомендации по лечению, выбор метода остеосинтеза при внутрисуставных переломах ПОПК остается актуальной проблемой, прежде всего, вследствие частого развития постишемических изменений головки плечевой кости.
Цель исследования — уточнить показания к различным методам хирургического лечения внутрисуставных переломов проксимального отдела плечевой кости.
Материалы и методы
Дизайн
Выполнено одноцентровое ретроспективно-проспективное когортное нерандомизированное контролируемое (активный контроль) исследование, в которое вошли 48 наблюдений пациентов с внутрисуставными переломами ПОПК, лечившихся стационарно и в дальнейшем наблюдавшихся амбулаторно.
Критерии включения в исследование: пациенты в возрасте от 20 до 80 лет включительно с переломами типов 11-С1 и 11-С2 по классификации AO/ASIF [4] (исключая переломовывихи) или с последствиями переломов ПОПК, нуждающиеся в оперативном лечении.
Из общего количества пациентов были сформированы две группы. В ретроспективную (контрольную) группу вошли 25 пациентов, которых лечили с использованием накостного остеосинтеза пластиной с угловой стабильностью или интрамедуллярного блокируемого остеосинтеза проксимальными плечевыми штифтами. В проспективную (основную) группу вошли 23 пациента, при лечении которых дополнительно использовали пересадку в зону перелома несвободного костно-мышечного трансплантата из клювовидного отростка лопатки.
Обследование пациентов
Все пациенты проходили клиническое и лучевое обследования. Клиническое обследование включало сбор анамнеза и жалоб, оценку локального статуса. Лучевое исследование состояло из рентгенографии плечевого сустава в двух или трех проекциях, магнитно-резонансной томографии и мультиспиральной компьютерной томографии и имело целью оценку степени остеосклероза и сопутствующих дистрофических изменений и/или повреждений сухожилий вращательной манжеты плеча и степени развития вторичного омартроза. Изучали рентгенологическую динамику изменений в зоне перелома и костной структуры головки плечевой кости.
Оценка результатов
Оценку клинических результатов проводили с использованием опросника ASES: выраженность болевого синдрома (PS) и уровень повседневной активности (ADL). Степень асептического некроза головки плечевой кости (АНГПК) оценивали по рентгенологическим данным.
Статисческий анализ
Выборочные распределения непрерывных показателей возраста, времени осмотра после операции, ASES, отведения, сгибания, внутренней и наружной ротации исследовались на согласие с законом нормального распределения критерием Шапиро - Уилка, равенство дисперсий в сравниваемых группах — критерием Фишера. Большинство распределений оказались ненормальными и гете- роскедастичными. Поэтому сравнение непрерывных показателей проводилось непараметрическим U-критерием Манна - Уитни. Для оценки величины различия в группах рассчитывалась псевдомедиана разностей значений (ПМ) и стандартизованная разность средних (СРС).
Непрерывные показатели описывались в виде медианы [первый квартиль; третий квартиль] (М [Q1; Q3], минимальное и максимальное значения (мин-макс).
Бинарные показатели консолидации и элевации описывались как количество событий и частоты с построением 95% доверительного интервала (ДИ) по формуле Вильсона (n, % [95% ДИ]). Для оценки различия групп рассчитывалась разность рисков (РР) и отношение шансов (ОШ) с 95% ДИ. Для степеней категориальных показателей АНГПК рассчитаны количество пациентов и частота выявления (степень — n(%)). Бинарные и категориальные показатели сравнивались с применением точного двустороннего критерия Фишера. При сравнении степеней в категориальных показателях проводилась коррекция ошибки множественного сравнения критерием Бенджамини- Хохберга.
Проверка статистических гипотез проводилась при критическом уровне значимости p = 0,05, т.е. различие считалось статистически значимым, если p<0,05. Все статистические расчеты проводились в программе Rstudio (версия 2022.07.2+576, 2022-09-06) на языке R (версия 4.1.3).
Результаты
Результаты оценивались в сроки 12-24 мес. после операции (табл. 1).
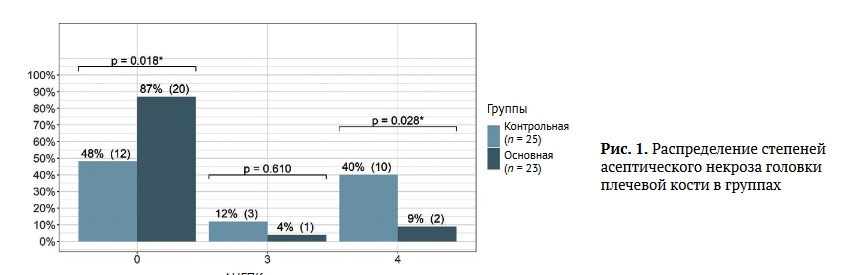
Распределение степеней АНГПК в основной и контрольной группах статистически значимо различалось (р = 0,010): 0 степень — у 12 (48,0%) и 20 (87,0%) пациентов соответственно (р = 0,018), 4 степень — у 10 (40%) и 2 (8,7%) пациентов соответственно (р = 0,028). Различий по 3 степени не обнаружено (р = 0,610) (рис. 1).
Объем активных движений в группах находился в сопоставимых пределах: в основной группе был ниже в среднем на 5-10° (р = 0,483-0,532) (рис. 2).
Таблица 1
Сравнение показателей между группами исследования и контроля
|
Показатель |
Контрольная группа |
Основная группа |
Оценка |
р |
|
n = 25 |
n = 23 |
различия |
||
|
Возраст, лет М [Q1; Q3] |
67 [55; 70] |
65 [62; 76] |
ПМ: 4 [-3; 9] |
0,296 |
|
(мин-макс) |
(33-77) |
(46-81) |
СРС: 0,43 |
|
|
Срок осмотра после операции, мес. М [Q1; Q3] |
48 [24; 48] |
18 [11; 24] |
ПМ: 24 [12; 36] |
<0,001* |
|
(мин-макс) |
(12-68) |
(6-36) |
СРС: 1,52 |
|
|
Консолидация Абс. ч. (%) |
23 (92) |
23 (100) |
РР: 8% |
0,491 |
|
[95% ДИ] |
[75%; 98%] |
[86%; 100%] |
[3%; 19%] |
|
|
PS, баллы М [Q1; Q3] |
45 [35; 50] |
45 [45; 50] |
ПМ: 5 [0; 10] |
0,017* |
|
(мин-макс) |
(5-50) |
(35-50) |
СРС: 0,83 |
|
|
ADL, баллы М [Q1; Q3] |
37 [22; 45] |
33 [29.5; 42] |
ПМ: 0 [-6; 10] |
0,877 |
|
(мин-макс) |
(12-50) |
(22-50) |
СРС: 0,18 |
|
|
ASES, общ. баллы М [Q1; Q3] |
80 [62; 88] |
80 [77; 88.5] |
ПМ: 4 [-5; 16] |
0,535 |
|
(мин-макс) |
(27-100) |
(68-95) |
СРС: 0,54 |
— обозначены статистически значимо различающиеся значения.

Значения PS в основной и контрольной группах составили в среднем 45 [35; 50] и 45 [45; 50] баллов соответственно. В основной группе PS был статистически значимо больше в среднем на 5 баллов (р = 0,017). Значения ADL составили в среднем 37 [22; 45] и 33 [29; 42] балла. В основной группе ADL был статистически значимо больше в среднем на 3-5 баллов (р = 0,088) (рис. 3).

В контрольной группе консолидация переломов произошла в 92% случаев (23 пациента) (р = 0,491), в остальных 8% (2 пациента) отмечен исход в виде ложного сустава области анатомической или хирургической шейки плечевой кости в течение 6 мес. после операции. В основной группе случаев развития ложных суставов не отмечено — у всех пациентов переломы консолидировались.
Обсуждение
При выборе метода остеосинтеза внутрисуставного перелома проксимального эпифиза плечевой кости практикующий хирург сталкивается с проблемой уменьшения травматичности операции и сохранения кровоснабжения отломков, с одной стороны, и обеспечения точной репозиции и стабильной жесткой фиксации, с другой. Интрамедуллярный остеосинтез широко используется при лечении переломов типа С в основном благодаря усовершенствованной системе блокирования винтов и считается методом выбора у пациентов старших возрастных групп, так как обеспечивает достаточную стабильность отломков [5]. Блокируемые системы фиксации с угловой стабильностью обладают более высокими показателями внутренней стабильности, поэтому они лучше удерживают репозицию на этапе послеоперационного функционального лечения [6]. П.Г. Коган с соавторами в 2013 г. считали интрамедуллярный остеосинтез одним из наиболее перспективных методов лечения оскольчатых переломов проксимального эпифиза плечевой кости [7]. Однако по мере развития малоинвазивных методик появились исследования, которые выявили и отрицательные стороны закрытой репозиции переломов.
C. Rajasekhar с соавторами сообщили о 59 осложнениях у 115 пациентов. Наибольшее количество (26 из 59) составила миграция винтов. Авторы обращают внимание на необходимость более тщательной фиксации бугорков и улучшения техники установки винтов для предотвращения этого осложнения [8]. Схожую частоту осложнений, которая составляло 39% (26 из 61 пациента), отметили C. Witney-Lagen с соавторами. Наибольшее количество (7 из 26) осложнений пришлось на им- пинджмент-синдром, что потребовало удаления штифта [9].
Вследствие технических трудностей восстановления анатомических соотношений в суставе при закрытой репозиции разрабатываются методики репозиции из мини-доступа с мягкотканной стабилизацией бугорков [10] либо фиксация бугорков отдельными конструкциями. Дополнение стабилизации отломков ПОПК методикой «screw- in-screw» (винт-в-винте) в некоторой мере решает проблему вторичного смещения отломков, однако по надежности уступает накостному остеосинтезу пластиной с угловой стабильностью (LC).
Методом выбора при многофрагментарных переломах ПОПК принято считать первичное эндопротезирование плечевого сустава. Большинство последних исследований показывают, что раннее эндопротезирование обычно предпочтительнее, чем артропластика в отдаленном периоде, так как первичную операцию выполнить технически проще [11]. Тем не менее, U. Prakash с соавторами не нашли разницы между первичным и отсроченным эндопротезированием при прошествии более 30 дней после травмы [12]. В последнее время появляется все больше сообщений о неудовлетворительных результатах эндопротезирования плечевого сустава при переломах ПОПК. D. den Hartog с соавторами в 2010 г. опубликовали результаты метаанализа 33 исследований, в которые вошли 1096 пациентов с трех- и четырехфрагментарными переломами ПОПК. У пациентов, которым выполнялось эндопротезирование, выявлен худший функциональный результат по сравнению с неоперированными больными с разницей в 10,9 балла по 100-балльной шкале Constant [13]. При сравнительном изучении отдаленных последствий эндопротезирования умеренное и резкое нарушение функции конечности выявлено в 30% случаев [14]. Несмотря на неоднозначность полученных результатов протезирования плечевого сустава при переломах, в настоящее время превалирует мнение, что внутрисуставные переломы ПОПК являются показанием для первичного эндопротезирования сустава [15]. Кроме технических трудностей, отдаленный результат остеосинтеза внутрисуставных переломов ПОПК всегда сомнителен вследствие нарушения его васкуляризации в момент травмы и операции, что приводит затем к некрозу головки и коллапсу, который возникает в 30-100% случаев [16]. Таким образом, одним из основных факторов, влияющих на выбор метода оперативного пособия в случае внутрисуставных переломов ПОПК, является вероятность повреждения основных источников кровоснабжения головки плечевой кости.
Исследования сосудистой сети ПОПК показали, что кровоснабжение головки плечевой кости осуществляется в основном через дугообразную артерию, которая ответвляется от восходящей ветви передней огибающей плечо артерии. При повреждении дугообразной артерии кровоснабжение головки не может быть компенсировано другими источниками, что и приводит к АНГПК [17].
Принципиальное значение повреждения дугообразной артерии подтвердили C.H. Brooks с соавторами, изучавшие анатомию артерий ПОПК и влияние четырехфрагментарных переломов на кровоснабжение головки плечевой кости. В боль
шинстве случаев имитированные четырехфрагментарные переломы прекращали перфузию головки плечевой кости. Однако если линия перелома проходила дистально ниже суставной поверхности и медиально, некоторая перфузия головки сохранялась за счет заднемедиальных сосудов. Эти сосуды играют важную роль в лечении оскольчатых переломов ПОПК [18]. Исходя из этого возникает необходимость стимуляции репаративного остеогенеза при внутрисуставных повреждениях для сокращения сроков достижения сращения и профилактики ишемических изменений головки плечевой кости. Наиболее перспективным для стимуляции остеогенеза представляется использование несвободных аутотрансплантатов.
Кровоснабжаемость остеотомированного фрагмента коракоида доказана результатами анатомо-морфологического исследования R. Khundkar с соавторами. Экспериментальные кадаверные и клинические исследования продемонстрировали наличие ранее не идентифицированной прямой артериальной ветви от второй (средней) части подмышечной артерии, питающей передние 2-3 см клювовидного отростка лопатки [19]. A. Hamel с соавторами выполнили посмертные артериографии верхней конечности. Результаты: вертикальная часть клювовидного отростка снабжалась надлопаточной артерией, а горизонтальная часть — ветвями подмышечной артерии [20]. В другом исследовании кровоснабжаемости клювовидного отростка, проведенного Z. Deng с соавторами, выявлено, что клювовидный отросток снабжается надлопаточной артерией, грудно-акромиальной артерией и ответвлением от второй части подмышечной артерии. Кроме того, существует вероятность того, что сосуды, полученные из m. biceps, питали нижнюю сторону клювовидного отростка [21].
Рассматриваются современные способы стимуляции репаративных процессов, которые наиболее доступны для реализации в многопрофильном стационаре. Использование свободных губчатых костных аутотрансплантатов из крыла подвздошной кости рассматривается исключительно для замещения дефектов ПОПК, возникающих вследствие смятия остеопорозной кости в момент травмы [1]. Данный вариант костной пластики является оптимальным по многим параметрам, включающим отсутствие иммунного ответа, наличие живых остеогенных клеток. Главные недостатки аутопластики хорошо известны любому практикующему травматологу: нанесение дополнительной травмы донорскому участку, удлинение времени операции, возникновение дополнительных ворот инфекции. Некоторые источники указывают на возможность использования аллокости и синтетических материалов для этой цели [22]. К сожалению, данные материалы никаким образом не могут стимулировать остеогенез в зоне ишемии костной ткани, за исключением случаев насыщения костной структуры аллотрансплантата остеостимулирующими субстратами. Примером может являться исследование остеостимуляции трансплантата из препарата головки, шейки и части диафиза малоберцовой кости када- вера, насыщенного раствором коллагена. Согласно результатам работы, разработанный комбинированный аллогенный трансплантат из головки малоберцовой кости, насыщенный коллагеном I типа, не токсичен, не обладает иммуногенностью, при этом имеет более выраженные остеокондуктивные свойства по сравнению с нативными костными аллотрансплантатами, что способствует его заселению клетками [22].
Широкое применение аутологичной плазмы, обогащенной тромбоцитами, аутологичного тромбоцитарного лизата человека и аспирата аутологичного костного мозга человека ограничено необходимостью использования специального дорогостоящего оборудования. Наиболее перспективным для стимуляции остеогенеза представляется использование несвободных аутотрансплантатов, сохраняющих кровоснабжение парафрактурной области из дополнительного источника. Помимо предложенной нами методики, обращает на себя внимание метод несвободной костной пластики для лечения ложных суставов в верхней трети плечевой кости, предложенный Р.М. Тихиловым с соавтора-ми [23]. Суть метода заключается в формировании костно-мышечного трансплантата, включающего фрагмент нижнего угла лопатки, который перемещают в зону реконструкции в верхней трети плеча.Заключение
Показанием для остеосинтеза являются внутрисуставные переломы ПОПК со смещением отломков по межбугорковой борозде более 2 мм. Показанием для накостного остеосинтеза без несвободной трансплантации костно-мышечного лоскута следует считать переломы без нарушения целостности межбугорковой борозды. Применение блокирующего остеосинтеза при внутрисуставных переломах ПОПК значительно затруднено необходимостью репозиции головки и бугорковой зоны. При блокирующем остеосинтезе снижается жесткость фиксации отломков, что может способствовать их вторичному смещению. Учитывая закрытый характер репозиции отломков, вероятность повреждения дугообразной ветви передней огибающей плечо артерии возрастает.
Литература
1. Slobogean G.P., Johal H., Lefaivre K.A,. MacIntyre N.J., Sprague S., Scott T. et al. A scoping review of the proximal humerus fracture literature. BMC Musculoskelet Disord. 2015;16:112. doi: 10.1186/s12891-015-0564-8.
2. Nguyen TV., Center J.R., Sambrook P.N., Eisman J.A. Risk factors for proximal humerus, forearm, and wrist fractures in elderly women: the Dubbo Osteoporosis Epidemiology Study. Am J Epidemiol. 2001;153(6): 587-595.
3. Nalla R.K., Kruzic J.J., Kinney J.H., Ritchie R.O. Aspects of in vitro fatigue in human cortical bone: time and cycle dependent crack growth. Biomaterials. 2005;26(14): 2183-2195. doi: 10.1016/j.biomaterials.2004.05.024.
4. Muller M.E., Koch P., Nazarian S., Schatzker J. Principles of the Classification of Fractures. In: The Comprehensive Classification of Fractures of Long Bones. Berlin, Heidelberg: Springer; 1990.
5. Rothstock S., Plecko M., Kloub M., Schiuma D., Windolf M., Gueorguiev B. Biomechanical evaluation of two intramedullary nailing techniques with different locking options in a three-part fracture proximal humerus model. ClinBiomech (Bristol, Avon). 2012;27(7): 686-691. doi: 10.1016/j.clinbiomech.2012.03.003.
6. Егиазарян К.А., Ратьев А.П., Гордиенко Д.И., Григорьев А.В., Овчаренко Н.В. Среднесрочные результаты лечения переломов проксимального отдела плечевой кости методом внутрикостного остеосинтеза. Травматология и ортопедия России. 2018;24(4): 81-88. doi: 10.21823/2311-2905-2018-24-4-81-88.
7. Коган П.Г., Воронцова Т.Н., Шубняков И.И., Воронкевич И.А., Ласунский С.А. Эволюция лечения переломов проксимального отдела плечевой кости (обзор литературы). Травматология и ортопедия России. 2013;19(3):154-161. doi: 10.21823/2311-2905-2013--3-154-161.
8. Rajasekhar C., Ray P.S., Bhamra M.S. Fixation of proximal humeral fractures with the Polarus nail. J Shoulder Elbow Surg. 2001;10(1):7-10. doi: 10.1067/mse.2001.109556.
9. Witney-Lagen C., Datir S., Kumar V., Venkateswaran B. Treatment of Proximal Humerus Fractures with the Stryker T2 Proximal Humeral Nail: A Study of 61 Cases. J Shoulder Elbow. 2013;5(1):48-55. doi: 10.1111/j.1758-5740.2012.00216.x.
10. Егиазарян К.А., Ратьев А.П., Тамазян В.О., Глазков К.И., Ершов Д.С. Результаты остеосинтеза переломов проксимального отдела плечевой кости интрамедуллярным штифтом с дополнительной мягкотканной стабилизацией бугорков. Политравма. 2019;(2):32-39.
11. Лазишвили Г.Д., Григорьев А.В., Кузин В.В., Гордиенко Д.И., Ратьев А.П., Семенов П.В. Хирургическое лечение переломов проксимального отдела плечевой кости. Московский хирургический журнал. 2016;1(47):22-23.
12. Prakash U., McGurty D.W., Dent J.A. Hemiarthroplasty for severe fractures of the proximal humerus. J Shoulder Elbow Surg. 2002;11(5):428-430.
13. den Hartog D., de Haan J., Schep N.W., Tuinebreijer W.E. Primary shoulder arthroplasty versus conservative treatment for comminuted proximal humeral fractures: a systematic literature review. Open Orthop J. 2010;4: 87-92. doi: 10.2174/1874325001004020087.
14. Zyto K., Wallace W.A., Frostick S.P., Preston B.J. Outcome after hemiarthroplasty for three- and four-part fractures of the proximal humerus. J Shoulder Elbow Surg. 1998;7(2):85-89. doi: 10.1016/s1058-2746(98)90215-4.
15. Neer C.S. 2nd. Displaced proximal humeral fractures: part I. Classification and evaluation. 1970. Clin Orthop Relat Res. 2006;442:77-82.
16. Resch H., Povacz P., Frohlich R., Wambacher M. Percutaneous fixation of three- and four-part fractures of the proximal humerus. J Bone Joint Surg Br. 1997;79(2):295-300. doi: 10.1302/0301-620x.79b2.6958.
17. Robinson B.C., Athwal G.S., Sanchez-Sotelo J., Rispoli D.M. Classification and imaging of proximal humerus fractures. Orthop Clin North Am. 2008;39(4):393- 403, v. doi: 10.1016/j.ocl.2008.05.002.
18. Brooks C.H., Revell W.J., Heatley F.W. Vascularity of the humeral head after proximal humeral fractures. An anatomical cadaver study. J Bone Joint Surg Br. 1993;75(1):132-136.
19. Khundkar R., Giele H. The coracoid process is supplied by a direct branch of the 2nd part of the axillary artery permitting use of the coracoid as a vascularised bone flap, and improving it’s viability in Latarjet or Bristow procedures. J Plast Reconstr Aesthet Surg. 2019;72(4): 609-615. doi: 10.1016/j.bjps.2019.01.014.
20. Hamel A., Hamel O., Ploteau S., Robert R., Rogez J.M., Malinge M. The arterial supply of the coracoid process. Surg Radiol Anat. 2012;34(7):599-607.
21. Deng Z., Liang D., Zhu W., Liu H., Xu J., Peng L. et al. A pilot study of blood supply of the coracoid process and the coracoid bone graft after Latarjet osteotomy. Biosci Rep. 2019;39(11):BSR20190929. doi: 10.1042/BSR20190929.
22. Ваза А.Ю., Файн А.М., Боровкова Н.В., Галанкина И.Е., Макаров М.С., Забавская О.А. и др. Первый опыт использования разработанных модифицированных аллогенных костных трансплантатов при хирургическом лечении пациентов с тяжелыми переломами хирургической шейки плечевой кости. Журнал им. Н.В. Склифосовского «Неотложная медицинская помощь». 2021;10(1):83-90. 10.23934/2223-9022-2021-10-1-83-90.
23. Тихилов Р.М., Лушников С.П., Кочиш А.Ю. Использование латерального края лопатки для пластики верхней трети плечевой кости. Травматология и ортопедия России. 2009;(2):7-14.
Сведения об авторе
Афанасьев Юрий Андреевич
Теги: перелом проксимального отдела плечевой кости
234567 Начало активности (дата): 15.01.2024 13:11:00
234567 Кем создан (ID): 989
234567 Ключевые слова: внутрисуставной перелом проксимального отдела плечевой кости, накостный остеосинтез, стимуляция репаративного остеогенеза, несвободный костно-мышечный трансплантат, асептический некроз прок-симального эпифиза плечевой кости
12354567899
Похожие статьи
Лечение пациента с ятрогенным повреждением лучевого нерва после остеосинтеза плечевой кости: клинический случайРентген на дому 8 495 22 555 6 8
Миграция спицы Киршнера в позвоночный канал после восстановления акромиально-ключичного сочленения (клинический случай)
Ранняя диагностика и лечение полиорганной недостаточности у больного с тяжелой сочетанной травмой
Неотложная травматология в НИИ скорой помощи им. Н.В. Склифосовского: история и современность



