 21.12.2023
21.12.2023
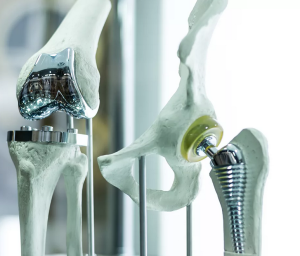
Биосовместимые имплантаты в травматологии и ортопедии (обзор литературы)
Показаны преимущества и недостатки имплантов, пути совершенствования их биологических и механических свойств
За последнее столетие широкое распространение получили методы оперативного лечения переломов и заболеваний костной системы. Предложены внутренние (внутрикостные и накостные) и внешние (спицевые и стержневые) фиксаторы для обеспечения максимально надежного остеосинтеза сломанной кости. Хорошо изучены условия для поддержания репаративной регенерации костной ткани: полная репозиция костных отломков; стабильная фиксация костных фрагментов; сберегательное отношение к остеогенным тканям; хорошее кровоснабжение оперированной конечности; оптимальный темп и ритм дистракции (при необходимости удлинения конечности); возможность функционального использования конечности с первых дней после операции [9, 10]. Большинство хирургов считают, что в большей мере эти условия обеспечивает метод Илизарова. Тем не менее, клиническая практика показывает, что остеосинтез аппаратом Илизарова даже в специализированном медицинском учреждении при закрытом переломе длинных трубчатых костей продолжается до 4-х месяцев. При удлинении конечности с помощью этого метода отличным результатом считается срок порядка 30 дней/см, хорошим - 45 дней/см, удовлетворительным - 60 дней/см [14, 15,17, 18, 22, 32, 38]. L. Eralp et al. (2004) приводят индекс 1,65 мес./см при удлинении большеберцовой кости фиксатором Илизарова. Подобные сроки лечения, естественно, не могут удовлетворять ни пациента и его родственников, ни государство. Поэтому идет постоянный поиск способов стимуляции остеогенеза как консервативными способами, так и инвазивными методами [6, 11]. Чаще всего для этого предлагают аутотрансплантаты костной ткани и различные биоактивные изделия из декальцинированной кости, биокомпозиционных матриксов, рекомбинантных костных морфогенетических белков, а также из керамики; расширяются экспериментальные исследования с использованием клеточных технологий [4, 6]. С практической точки зрения врача-хирурга управление процессом формирования костной ткани рассматривается с двух сторон:
1) активное влияние на скорость репаративной регенерации поврежденной костной ткани;
2) возможность влияния в постнатальном периоде на развитие скелета, которое по каким-либо причинам затормозилось в эмбриональном периоде.
В последние годы наметилась активная тенденция в разработке материалов, направленных на создание тканей, заменяющих поврежденные кожные покровы, мышечную ткань, кровеносные сосуды, нервные волокна, костную ткань.
Такие материалы получили название биоматериалов. «Биоматериалы - это материалы, предназначенные для того, чтобы служить границей раздела с биологическими системами, для того чтобы оценивать, лечить, наращивать или заменять любую ткань, орган или функцию тела» [43].
Наиболее успешно эта работа проводится при лечении патологии костно-мышечной системы, чему способствовало развитие индустрии эндопротезирования крупных суставов.
Данная область современного материаловедения называют еще биокерамикой, подчеркивая ведущее значение керамической составляющей в используемых имплантатах для эндопротезирования, в пломбировочных материалах для стоматологии, в имплантатах для челюстно-лицевой хирургии, в медико-косметических средствах [23, 40]. Число больных, нуждающихся в операциях по восстановлению целостности кости, довольно велико: для России или США эта цифра составляет более 1 млн. человек ежегодно (из них 200300 тыс. - протезирование тазобедренного и коленного суставов).
Биоматериалы должны обладать определенными химическими свойствами (отсутствие нежелательных химических реакций с тканями и межтканевыми жидкостями, отсутствие коррозии), механическими характеристиками (прочность, стойкость к образованию трещин, сопротивление замедленному разрушению, износостойкость), биологическими свойствами (отсутствие реакций со стороны иммунной системы, консолидация с костной тканью, стимулирование остеогенеза).
Биоматериалы, которые используют в качестве имплантатов, заменяющих участок кости (эндопротезы), или в качестве временных фиксаторов для сломанной кости (накостные пластины, интрамедуллярные стержни) оценивают и по активности влияния на репаративную способность последней. Это могут быть:
• биотолерантные материалы (нержавеющая сталь и кобальтохромовые сплавы) - поверхность таких имплантатов отделяется от смежной кости слоем фиброзной ткани, репаративная регенерация поврежденной кости происходит в обычные сроки и на некотором расстоянии от имплантата (дистантный остеогенез);
• биоинертные материалы (оксиды титана и алюминия) - не вызывают образования фиброзной ткани, репаративный остеогенез протекает в непосредственном контакте с поверхностью имплантата, но консолидация происходит в обычные сроки;
• биоактивные материалы (кальций-фосфатная керамика и биостекло на основе кремния) - характеризуются образованием очень тесной химической связи с костью (связующий остеогенез), усиливают реакции образования костной ткани начиная с поверхности имплантата и индуцируют образование непрерывной связи от ткани к его поверхности.
В травматологии имплантаты из металлов занимают прочное место. Легированные стали чаще всего используют для замены значительных участков кости (эндопротезы) либо для восстановления целостности сломанной кости. Имплантаты внутренней фиксации изготавливают из таких материалов, которые должны, прежде всего, отвечать задачам обеспечения надежной фиксации перелома для проведения функционального лечения в течение определенного периода - обычно 12-18 месяцев. Это достаточно длительный промежуток времени, поэтому выбирают материалы, устойчивые к усталостному разрушению. От них требуется хорошая пластичность для возможности индивидуального моделирования по костной поверхности, в то же время пластическая деформация имплантата должна быть минимальной при максимальной прочности после фиксации на поверхности костных отломков с целью поддержания их в репонированном положении даже при физической нагрузке.
Материал, используемый для имплантации, должен сохранять биосовместимость и не изменять своих физических и химических свойств. Все металлы, используемые в медицине, по влиянию на живые ткани делят на три основные группы: 1) токсические металлы (ванадий, никель, хром, кобальт); 2) промежуточные металлы (железо, золото, алюминий); 3) инертные металлы (титан, цирконий). Основываясь на результатах изучения электрохимических реакций, M. Pourbaix (1984) пришел к выводу, что теоретически в качестве имплантатов можно использовать либо благородные металлы (с чисто металлической поверхностью), либо пять металлов, которые покрыты слоем защитных оксидов (Ti, Ta, Nb, Zr, Cr).
По активности влияния на репаративный остеогенез все металлы можно отнести к биотолерантным (нержавеющая сталь и кобальтохромовые сплавы) или к биоинертным (оксиды титана и алюминия) материалам.
Биоактивных металлов, которые бы ускоряли репаративный остеогенез, не существует.
В современной медицине для хирургических имплантатов чаще всего применяют хромоникелевые и хромоникельмолибденовые коррозионно-стойкие стали, сплавы кобальта, тантала, титана, чистые металлы - никель, серебро, титан. Например, в стоматологии в настоящее время зубные имплантаты изготавливаются из титана и его сплавов, поскольку титан является биосовместимым и коррозионно-стойким материалом. Собственно говоря, все металлы в той или иной степени подвергаются коррозии под воздействием жидкостей человеческого организма. И все без исключения металлические имплантаты защищены от коррозии пассивным слоем, состоящим из нерастворимых продуктов их окисления. Коррозия усиливается примерно в 100 раз, если этот защитный слой повреждается, например, при трении [37]. В этих условиях имплантат не сможет обеспечить стабильную фиксацию в течение длительного, необходимого для консолидации перелома кости времени. Дальнейший алгоритм процесса хорошо известен: наступает разрушение имплантата, смещение костных фрагментов, замедляется процесс консолидации, формируется ложный сустав и все заканчивается инвалидностью для пациента.
Несомненно, титан - один из самых перспективных материалов для изготовления хирургических имплантатов, широко используемых в травматологии. Хотя этот металл и является достаточно прочным, тем не менее, в некоторых случаях требуются еще более высокие прочностные качества. Легированные сплавы титана (с добавлением алюминия и ванадия) наряду с повышением прочности оказывают определенное вредное воздействие на организм. Компромиссным вариантом может стать формирование наноразмерных зерен на поверхности титана посредством пластической деформации. Для создания в структуре титана наноразмерных зерен ученые использовали оригинальный метод пластической деформации, сочетающий в себе поперечно-винтовую и продольную прокатки. В результате, в структуре появлялись зерна различных размеров, в том числе менее 100 нм, средний же размер образованных зерен составлял 290 нм. Многочисленные опыты и клиническая практика определили титан и его сплавы как наиболее оптимальные среди металлов для имплантации [42].
К типичным представителям биоактивных материалов относятся биостекла (наиболее часто используется состав: 24,5 % Na2O, 24,5 % CaO, 45,0 % SiO2, 6 % P2O5 - варьируя состав, можно изменять их биоактивность и резорбируемость) и материалы на основе гидроксиапатита (ГА) - Ca10(PO4)6(OH)2 (плотная и пористая керамика) [19, 21].
Гидроксиапатит, Ca10(PO4)6(OH)2, входит в число немногих биоактивных материалов, и это означает, что он будет поддерживать врастание кости и остеоинтеграцию при использовании в ортопедических, стоматологических и челюстно-лицевых имплантатах в силу своей высокой биосовместимости. В наибольшей степени этим отличается ГА со структурой материала, образованной контактирующими друг с другом зернами размером от одного до нескольких сотен нанометров (наногидроксиапатит). В последние годы в литературе появился специальный термин - «нанокерамика биосовместимая» (англ. biocompatibnanoceramicsили nanostructuredbioceramics), обозначающий наноструктурированный керамический материал, используемый в медицине для восстановления (замещения) поврежденных твердых тканей [13, 40].
Одним из перспективных направлений является создание композитных материалов на основе бифазной керамики (БФК) с использованием разных связующих компонентов, биологически активных веществ, которые обеспечивали бы остеоиндукцию остеопластического материала для образования матрицы, на которой будет формироваться костная ткань [30]. Среди композиционной БФК наибольшее внимание уделяется системе «гидроксиапатит - трикальцийфосфат» (ГА - ТКФ), материалам на основе карбонатсодержащего гидроксиапатита (КГА) и октакальцийфосфата (ОКФ). Концепция бифазных композиционных материалов в системе «ГА - ТКФ» разработана, исходя из предположения о возможности регулирования кинетики биодеградации изменением соотношения менее (ГА) и более (ТКФ) растворимых фаз в одном материале. Растворение ТКФ-составляющей в жидкости организма способствует процессу минерализации, и биологическое поведение БФК зависит от соотношения ГА/ТКФ [34].
Явление биоактивности определяется преимущественно химическими факторами, такими как кристаллическая фаза и молекулярная структура материала, а также физическими факторами - шероховатость и пористость поверхности материала. Еще в 1973 г. S.F. Hulbert et al. [24] предложили новую концепцию так называемой биологической фиксации скелетных имплантатов активным ростом кости на их поверхности. Материалами были оксидные керамические и углеродные соединения, а также металлы, покрытые стабильными оксидными слоями. Позднее определились с понятием биоактивности материалов, т.е. их способностью взаимодействовать с окружающей костью и образовывать с ней химическую связь [19, 20, 23, 33]. Ионообменная реакция между биоактивным имплантатом и окружающими телесными жидкостями приводит к образованию на нем слоя карбонатного апатита, который химически и кристаллографически эквивалентен минеральному составу кости. Такая способность имплантата инициировать образование фосфата кальция в условиях in vitro интерпретируется как первое указание на возможную биоактивность in vivo.
На поверхности биоактивного имплантата происходит ряд сложных и тесно взаимосвязанных процессов. Во-первых, там адсорбируются ионы и протеины, образуя на поверхности имплантата биопленку. Этот процесс сильно зависит от физико-химических характеристик поверхности, таких как топография (шероховатость, пористость, морфология и т.д.), химический состав, энергия, заряд. В результате, как количество, так и функциональность адсорбированных протеинов в значительной степени управляется поверхностью биоматериала. Адсорбированная биопленка способствует адгезии клеток, прикрепляющихся на протеины. Это осуществляется посредством интегринов, которые являются специфическими чрезмембранными рецепторами. Интегрины связываются с адгезивными протеинами на поверхности биоматериала и компонентами цитоскелета посредством их вне- и внутриклеточных доменов соответственно [23, 29]. Поверхность материала, ее биосовместимость тесно связана с адгезией остеогенных и мезенхимальных стволовых клеток на их поверхности [12, 26, 49]. Именно адгезия, а также распределение этих клеток будут влиять на их способность пролиферировать и дифференцироваться в остеобласты при контакте с имплантатом. Последнее является определяющим в процессе установки механически прочной границы раздела с полным слиянием между поверхностью имплантата и костной тканью без слоя фиброзной ткани, который обычно образуется на поверхности биоинертного металлического имплантата [16, 25, 35, 39, 41].
ТЕНДЕНЦИИ РАЗВИТИЯ БИОИМПЛАНТАЛОГИИ
В современной травматологии существуют два принципиально различных подхода к решению проблемы лечения повреждений и заболеваний: 1) простая замена поврежденного участка кости имплантатом, вплоть до создания огромной биоинженерной конструкции, замещающей кость и смежные с ней суставы, или 2) создание условий для регенерации (восстановления) кости в зоне повреждения с помощью имплантата.
Анализ современной литературы показывает, что оба направления все чаще связаны с биокерамикой, применение которой в медицине расширяется по мере углубления разработок в области химии и усовершенствования технологий производства материалов, близких по своим свойствам к костной ткани.
Воспроизвести досконально морфологию костной ткани искусственно и, следовательно, достичь такого же, как у кости, сочетания биологических и механических свойств этого уникального композиционного материала пока не представляется возможным, но биоматериалы, претендующие на роль имплантатов, должны удовлетворять требованиям, диктуемым описанными выше структурой, составом и свойствами костной ткани:
1) химические свойства - отсутствие нежелательных химических реакций с тканями и межтканевыми жидкостями, отсутствие коррозии;
2) механические характеристики биоматериала должны быть близкими к таковым для кости - жесткость (упругость) и трещиностойкость (например, различие в упругости может привести к тому, что кость, находящаяся в контакте с имплантатом, утратит нагрузку, вследствие чего начнется ее резорбция);
3) биоактивность материала - отсутствие реакций со стороны иммунной системы, остеокондуктивность (способность к перемещению по поверхности материала микрососудов, а затем и остеогенных клеток с образованием костной ткани, в том числе и внутри сквозных пор оптимального размера) и остеоиндуктивность (способность материала к адгезии и дифференцировке мезенхимальных стволовых клеток, вплоть до остеобластов, и стимуляции их остеогенной функции), что способствует «срастанию» с костной тканью.
Из всех синтетических материалов, которые можно использовать для имплантации, наиболее перспективным является керамика на основе фосфатов кальция. Среди них гидроксиапатит не только биосовместим, но и наиболее биоактивен (особенно, если присутствует, как и в кости, в виде наноразмерных кристаллов). Однако основным недостатком керамики является ее хрупкость, поэтому самым рациональным в создавшейся ситуации будет применение композитов «гидроксиапатит - полимер», которые обладают близкими к кости механическими свойствами и высокой биоактивностью
Наилучшими при создании ортопедических устройств для опорно-двигательного аппарата, испытывающего значительные механические нагрузки, являются биоинертные металлы и сплавы с кальций-фос- фатным покрытием, обеспечивающим биологическую совместимость и выраженную биологическую активность в образовании костной ткани вокруг металла. Здесь просматриваются два направления исследований:
1. Разработка эндопротезов суставов, металлическая несущая часть которых покрывается керамикой с целью остеоиндукции и образования обширной костной муфты, обеспечивающей надежный контакт металла с костной тканью на максимальной площади, чем исключается несостоятельность фиксации элементов сустава на кости на долгие годы (30 лет и более).
2. Разработка интрамедуллярных имплантатов для замещения обширных дефектов костной ткани после травмы или радикальных резекций при ортопедических или онкологических операциях. Ввиду хрупкости современной керамики ею покрывают металлическую подложку (титан, нержавеющая сталь). Подобное покрытие призвано индуцировать репаративный остеогенез вокруг имплантата, способствуя тем самым заполнению обширных дефектов кости. Созданная таким образом вокруг имплантата муфта обеспечивает оптимальные условия для сращения переломов костей или ложных суставов, формирование дистракционного регенерата (при необходимости удлинения конечности) в самые короткие сроки [7].
Основное биологическое достоинство ГА-покрытий - это усиление образования кости, ускоренное связывание между поверхностью имплантата и окружающей тканью и снижение потенциально вредного высвобождения ионов металлов. Он также создает сильные связи на границе раздела с титановыми имплантатами, что, возможно, объясняется наличием некоторой химической связи между гидроксиапатитом и титановой подложкой [27].
Методы нанесения биоактивного покрытия на имплантаты многочисленны. Современная литература показывает, что наиболее часто используют базовые технологии для нанесения гидроксиапатита : микродуговое оксидирование, магнетронное напыление, формирование композитных полимерных покрытий, вакуумно-дуговое напыление в условиях короткоимпульсного высокочастотного плазменно-иммерсионного ионного ассистирования. Технология покрытия определяет механические свойства покрытия и наряду с физико-химическими характеристиками поверхности имплантата определяют успех работы хирурга в травматологии и ортопедии [1, 2, 3, 44, 45, 51, 52].
К недостаткам таких имплантатов относится необходимость повторной операции для их удаления через 3-6 месяцев после консолидации перелома. Естественно, напрашивается решение данной проблемы путем создания подобного интрамедуллярного имплантата из прочного композиционного материала, который по мере заполнения дефекта собственной костью постепенно подвергается резорбции.
Применение того или иного материала зависит как от медико-биологических характеристик костного дефекта, так и от конкретного клинического случая. Следовательно, для решения многочисленных клинических задач необходимо наличие целого спектра биоматериалов. Выбор из них максимально удовлетворяющего требованиям конкретного случая позволит хирургу перейти от реконструктивно-заместительного принципа лечения на более высокий уровень - к инженерии костной ткани (тканевой инженерии).
В настоящее время, тканевая инженерия является одной из наиболее молодых отраслей медицины и базируется на принципах молекулярной биологии и генной инженерии.
Используемый в ней междисциплинарный подход направлен, в первую очередь, на создание новых биокомпозиционных материалов для восстановления утраченных функций отдельных тканей или органов в целом [28, 36]. Основные принципы такого подхода заключаются в разработке и применении при имплантации в поврежденный орган или ткань носителей из биодеградирующих материалов, которые используются в сочетании с донорскими клетками и/или биоактивными веществами. В последние годы разработаны технологии выделения ростовых факторов, таких как трансформирующий фактор-бета-3, и их аналогов - костных морфогенетических протеинов - bone morphogenic proteins (BMPs/BMP-2 и BMP-7 (OP-1)), что позволяет использовать их в клинической практике для расширения зоны и увеличения скорости костной репарации при проведении трансплантации.
Формирование костной ткани для последующего применения в клинической практике впервые продемонстрировано в 1965 г [46, 49]. Позже были выделены BMPs, которые могли стимулировать дифференцировку мезенхимальных стволовых клеток в клетки-предшественники остеогенеза с последующим формированием костной ткани [50]. Человеческая cDNA BMP-7 (OP-1) была синтезирована в 1990 г Следующим стал рекомбинантный человеческий остеогенный протеин-1 (recombinant human osteogenic protein-1 (rhOP-1)), индуцирующий in vivo формирование новой костной ткани и обладающий схожей специфической активностью с натуральным остеогенным протеином, стимулируя пролиферацию и диффе- ренцировку остеобластов in vitro. Он способен вызывать образование костной ткани посредством стимуляции мезенхимальных стволовых клеток и их дальнейшей диф- ференцировки в клетки-предшественники остеогенеза. Введение rhOP-1 в область дефекта кости и в зону перелома привело к полному восстановлению кости через 30 месяцев. Данный материал использован австралийскими учеными в исследованиях, проведенных у пациентов с переломами длинных трубчатых костей. В 65 % случаев наблюдалось полное восстановление дефекта костной ткани. Интраоперационное применение клеточных технологий на основе взрослых стволовых клеток получило широкое распространение при лечении старых и многооскольчатых переломов. Основанием для такого лечения являются достоверные данные о содержании клеток- предшественников остеогенеза в костном мозге взрослого человека - 1 клетка на 23 000 [5, 8]. Эта манипуляция может проводиться непосредственно у операционного стола, что позволяет незамедлительно использовать полученные клетки. Теоретически использование взрослых клеток- предшественников остеогенеза в достаточном количестве в комбинации с подходящей матрицей может быть более эффективным, чем традиционная аутологичная пересадка костной ткани. Это связано с тем, что остеогенные стволовые клетки способны сразу же начать пролиферировать и покрывать костную неоматрицу без необходимости удаления «старой» матрицы, присутствующей при аутологичной пересадке костной ткани.
По-видимому, одной из основных задач тканевой инженерии в области лечения костных патологий будет создание искусственных композитов, способных в сочетании с биоактивными молекулами (костными морфогенетическими белками, факторами роста и т.д.) индуцировать остеогенез, а при восстановлении суставных поверхностей и хондрогенез (последнее направление пока не находит практического применения). При этом такие материалы должны иметь ряд необходимых свойств кости [6, 31,48]:
• выполнять и поддерживать (scaffold) объем дефекта;
• обладать остеоидуктивностью, т.е. активно побуждать остеобласты к формированию костного матрикса и мезенхимальные клетки к дифференцировке в остеогенные клетки;
• иметь хорошие показатели биосовместимости, т.е. быть биодеградируемыми и не вызывать у реципиента воспалительных реакций.
Совокупность этих свойств позволит таким материалам параллельно с опорной функцией обеспечивать биоинтеграцию - врастание клеток и сосудов в структуры имплантата (остеокондуктивность) - и стимулировать образование костной ткани вокруг имплантата на значительном протяжении (остеоиндуктивность),
Производство имплантатов должно быть достаточно дешевым, а клиническое использование при наличии остеоиндуктивных возможностей реально гарантировать консолидацию поврежденной кости в самые короткие сроки.
Консолидация простого перелома длинных трубчатых костей не должна превышать 3-4-х недель, а формирование дистракционного регенерата при удлинении кости, время его минерализации до такого уровня, который позволит снять аппараты внешней фиксации, должно стремиться к нулю (процесс минерализации должен совпадать с процессом формирования органического матрикса).
ЛИТЕРАТУРА
1. Остеоиндуктивные покрытия на основе фосфатов кальция и перспективы их применения при лечении политравм / В.В Агаджанян, С.И. Твер- дохлебов, Е.Н. Больбасов, В.П. Игнатов, Е.В. Шестериков // Политравма. 2011. № 3. С. 5-13.
2. Аронов А.М., Больбасов Е.Н., Гузеев В.В. Биокомпозиты на основе сополимера тетрафторэтилена с винилиденфторидом,наполненного гидроксиапатитом, и возможность их применения в качестве покрытия для интрамедуллярных имплантатов // Мед. технол. 2010. № 3. С. 5-13.
3. Аронов А.М., Пичугин В.Ф., Твердохлебов С.И. Методические основы разработки и организации производства медицинских изделий. Томск : Ветер, 2007. 334 с.
4. Баринов С.М. Керамические и композиционные материалы на основе фосфатов кальция для медицины // Успехи химии. 2010. Т. 79, № 1. С. 15-32. Barinov S.M. Keramicheskie i kompozitsionnye materialy na osnove fosfatov kal'tsiia dlia meditsiny [Ceramic and composite materials based on calcium phosphates for medicine] // Uspekhi Khimii. 2010. T. 79, N1. S. 15-32.
5. Гольдберг Е.Д., Дыгай А.М., Шахов В.П. Методы культуры ткани в гематологии. Томск : изд-во Томского ун-та, 1992. 264 с.
6. Миронов С.П., Гинцбург А.Л., Еськин Н.А. Остеоиндуктивные имплантаты на основе биокомпозитных матриксов и рекомбинантных костных морфогенетических белков (RHBMP). Состояние вопроса, перспектива применения в травматологии и ортопедии // Сборник тезисов IX съезда травматологов-ортопедов : в 3-х т. Саратов, 2010. Т. III. С. 1122-1123.
7. Попков А.В., Попков Д.А. Биоактивные имплантаты в травматологии и ортопедии. Иркутск : НЦРВХ СО РАМН, 2012. 438 с.
8. Фриденштейн А.Я. Стромальные клетки костного мозга и кроветворное микроокружение// Архив патологии. 1982. Т. 44, № 10. С. 3-11.
9. Шевцов В.И., Попков А.В. Оперативное удлинение нижних конечностей. М.: Медицина, 1998. 192 с.
10. Шевцов В.И. Швед С.И., Сысенко Ю.М. Чрескостный остеосинтез при лечении оскольчатых переломов. Курган, 2002. 331 с.
11. Инвалидность вследствие травм и заболеваний опорно-двигательной системы и пути ее профилактики в Российской Федерации / И.В. Шведовченко, В.П. Шестаков, Н.Н. Лебедева, И.И. Никитченко, А.А. Свинцов // Сборник тезисов IX съезда травматологов-ортопедов. Саратов, 2010. С. 1043-1044.
12. Anselme K., Noel B., Hardouin P. Human osteoblast adhesion on titanium alloy, stainless steel, glass and plastic substrates with same surface topography // J. Mater. Sci. Mater. Med. 1999. Vol. 10, No 12. P. 815-819.
13. Bauer T.W., Muschler G.F. Bone graft materials. An overview of the basic science // Clin. Orthop. Relat. Res. 2000. No 371. P. 10-27.
14. Internalization of hydroxyapatite nanoparticles in liver cancer cells / I.W. Bauer, S.P Li, Y.C. Han, L. Yuan, M.Z. Yin // J. Mater. Sci. Mater. Med. 2008. Vol. 19, No 3. P. 1091-1095.
15. Bone tissue engineering for bone defect therapy / A.M. Boos, A. Arkudas, U. Kneser, R.E. Horch, J.P Beier // Handchir. Mikrochir. Plast. Chir. 2010. Vol. 42, No 6. P 360-368.
16. Caton J. Comment etablir un plan d’egalisation? Elements du choix // Les inegalites de longueur des membres / Sous la direction de A. Dimeglio, J. Caton, C. Herisson, L. Simon. Paris: Masson, 1994. P 174-176.
17. Curran A.R., Kuo K.N., Lubicky J.P. Silmultaneous ipsilateral femoral and tibial lengthening with the Ilizarov method // J. Pediatr. Orthop. 1999. Vol. 19, No 3. P. 386-390.
18. A histological and histomorphometrical investigation of fluorapatite, magnesiumwhitlockite, and hydroxylapatite plasma-sprayed coatings in goats / W.J. Dhert, C.P. Klein, J.A. Jansen, E.A. van der Velde, R.C. Vriesde, PM. Rozing, K. de Groot // J. Biomed. Mater. Res. 1993. Vol. 27, No 1. P 127-138.
19. A comparison of two osteotomy techniques for tibial lengthening / L. Eralp, M. Kocaoglu, K. Ozkan, M. Turker // Arch. Orthop. Trauma Surg. 2004. Vol. 124, No 5. P. 298-300.
20. Glorion Ch. Complications des allongements des membres // Cahiers d’enseignement de la SOFCOT. Elsevier, 2000. P. 165-182.
21. Greenspan D.C., Hench L.L. Chemical and mechanical behavior of bioglass-coated alumina // J. Biomed. Mater. Res. 1976. Vol. 10, No 4. P 503-509.
22. Gross K.A., Ray N., Rakkum M. The contribution of coating microstructure to degradation and particle release in hydroxyapatite coated prostheses // J. Biomed. Mater. Res. 2002. Vol. 63, No 2. P. 106-114.
23. The ultrastructure of the interface between a glass ceramic and bone / U. Gross, J. Brandes, V. Strunz, I. Bab, J. Sela // J. Biomed. Mater. Res. 1981. Vol. 15, No 3. P 291-305.
24. Les allongements progressifs de l’avant-bras chez l’enfant. A propos d’une serie de 14 cas / F. Launay, J.L. Jouve, E. Guillaume et al. // Rev. Chir. Orthop. 2001. Vol. 87. P. 786-795.
25. Hench L.L. Bioceramics // J. Amer. Ceram. Soc. 1998. Vol. 81, No 7. P 1705-1728.
26. Attachment of prostheses to the musculoskeletal system by tissue ingrowth and mechanical interlocking / S.F. Hulbert, F.W. Cooke, J.J. Klawitter, R.B. Leonard, B.W. Sauer, D.D. Moyle, H.B. Skinner // J. Biomed. Mater. Res. 1973. Vol. 7, No 3. P. 1-23.
27. Histologic evaluation of the osseous adaptation to titanium and hydroxylapatite-coated implants / J.A. Jansen, J.P. van der Waerden, J.G. Wolke, K. de Groot // J. Biomed. Mater. Res. 1991. Vol. 25, No 8. P. 973-989.
28. In vitro attachment of osteoblast-like cells to osteoceramic materials / J.C. Keller, J.G. Collins, G.G. Niederauer, T.D. McGee // Dent. Mater. 1997. Vol. 13, No 1. P. 62-68.
29. Khor K.A., Cheang P., Wang Y Plasma spraying of combustion flame spheroidized hydroxyapatite (HA) powders // J. Therm. Spray Technol. 1998. No 7. P. 254-260.
30. Langer R., Vacanti J.P. Tissue engineering // Science. 1993. Vol. 260, No 5110. P 920-926.
31. The effect of hydroxyapatite nanocrystals on microvascular endothelial cell viability and functions / S. Pezzatini, R. Solito, L. Morbidelli, S. Lamponi, E. Boanini, A. Bigi, M. Ziche // J. Biomed. Mater. Res. A. 2006. Vol. 76, No 3. P. 656-663.
32. Plenk H. Jr. Prosthesis-bone interface // J. Biomed. Mater. Res. 1998. Vol. 43, No 4. P 350-355.
33. Pourbaix M. Electrochemical corrosion of metallic biomaterials // Biomaterials. 1984. Vol. 5, No 3. P. 122-134.
34. Reddi A.H. Role of morphogenetic proteins in skeletal tissue engineering and regeneration // Nat. Biotechnol. 1998. Vol. 16, No 3. P 247-252.
35. Tibial lengthening and concomitant foot deformity correction in 14 patients with permanent deformity after poliomyelitis / H.R. Song, V. Myrboh, C.W. Oh, S.T. Lee, S.H. Lee // Acta Orthop. 2005. Vol. 76, No 2. P 261-269.
36. Bioactivity of gel-glass powders in the CaO-SiO2 system: a comparison with ternary (CaO-P2O5-SiO2) and quaternary glasses (SiO2-CaO-P2O5-Na2O) / P Saravanapavan, J.R. Jones, R.S. Pryce, L.L. Hench // J. Biomed. Mater. Res. 2003. Vol. 66, No 1. P 110-119.
37. Lower limb deformities in children: two-stage correction using Taylor spatial frame / M. Sluga, M. Pfeiffer, R. Kotz, S. Nehrer // J. Pediatr. Orthop. 2003. Vol. 12, No 2. P. 123-128.
38. Gap healing enhanced by hydroxyapatite coating in dogs / K. S0balle, E.S. Hansen, H. Brockstedt-Rasmussen, V.E. Hjortdal, G.I. Juhl, C.M. Pedersen, I. Hvid, C. Bunger // Clin. Orthop. Relat. Res. 1991. No 272. P 300-307.
39. Spector M. Basic principles of scaffolds in tissue engineering // Tissue Engineering. Applications in Oral and Maxillofacial Surgery and Periodontics / Eds. S.E. Lynch, R.E. Marx, M. Nevins, L.A. Lynch. 2nd ed. Chicago: Quintessence Publishing, 2006. P 26-32.
40. Steinemann S.G. Corrosion of surgical implants - in vivo and in vitro tests // Evaluation of Biomaterials / Eds. G.D. Winter, J.L. Leray, K. de Groot. Chichester: John Wiley & Sons, 1980. P 1-34.
41. Stanitski D., Dixon D., Stanitski C. Fibular hemimelia: guidelines for treatment based on a new classification // ASAMI First International Meeting. New Orleans, 1998. P. 53.
42. The effect of hydroxyapatite coating on ingrowth of bone into cavities in an implant / PK. Stephenson, M.A. Freeman, PA. Revell, J. Germain, M. Tuke, C.J. Pirie // J. Arthroplasty. 1991. Vol. 6, No 1. P. 51-58.
43. Suchanek W., Yoshimura M. Processing and properties of hydroxyapatite-based biomaterials for use as hard tissue replacement implants // J. Mater. Res. 1998. Vol. 13, Iss. 1. P 94-117.
44. Biologic response to hydroxylapatite-coated titanium hips. A preliminary study in dogs / K.A. Thomas, C.D. Cook, R.J. Kay, M. Jarcho // J. Arthroplasty. 1989. Vol. 4, No 1. P. 43-53.
45. Thull R. Titan in der Zahnheikunde-Grundlangen // Zahnarztl. Mitt. 1992. Vol. 82. P 40-45.
46. Williams D.F. Corrosion of Implant Materials // Ann. Rev. Mater. Sci. 1976. Vol. 6. P. 237-266.
47. Research of the surface properties of the thermoplastic copolymer of Vinilidene Fluoride and Tetrafluoroethylene modified with radio-frequency magnetron sputtering for medical application / S.I. Tverdokhlebov, E.N. Bolbasov, E.V. Shesterikov, A.I. Malchikhina, V.A. Novikov, YG. Anissimov // Applied Surface Science. 2012. Vol. 263, No 1. P 187-194.
48. Hybrid method for the formation of biocomposites on the surface of stainless steel implants / S.I. Tverdokhlebov, V.P Ignatov, I.B. Stepanov, D.O. Sivin, D.G. Petlin // Engineering. 2012. Vol. 4, No 10. P. 613-618.
49. Urist M.R. Bone: formation by autoinduction // Science. 1965. Vol. 150, No 3698. P. 893-899.
50. Urist M.R., Strates B.S. Bone morphogenetic protein // J. Dent. Res. 1971. Vol. 50, No 6. P 1392-1406.
51. Yannas I.V. What criteria should be used for designing artificial skin replacements and how well do the current grafting materials meet these criteria? // J. Trauma. 1984. Vol. 24, Suppl. No 9. P. S29-39.
52. Time-dependent morphology and adhesion of osteoblastic cells on titanium model surfaces featuring scale-resolved topography / O. Zinger, K. Anselme, A. Denzer, P Habersetzer, M. Wieland, J. Jeanfils, P Hardouin, D. Landolt // Biomaterials. 2004. Vol. 25, No 14. P 2695-2711.
Сведения об авторе:
Теги: имплант
234567 Начало активности (дата): 21.12.2023 13:14:00
234567 Кем создан (ID): 989
234567 Ключевые слова: имплант, биокерамика, остеоиндукция, остеокондукция, биополимеры, нанопокрытия, костный морфогенетический белок, биоактивность
12354567899
Похожие статьи
Комплексный подход к уменьшению боли в раннем послеоперационном периоде после протезирования коленного суставаПерелом верхней челюсти
Злокачественные новообразования костей и суставных хрящей: остеосаркома, саркома Юинга
Рентген на дому 8 495 22 555 6 8
Клинические и экспериментально-теоретические аспекты восстановления дефектов гиалинового хряща коленного сустава



