 05.10.2023
05.10.2023
Роль ультразвука в диагностике внебольничной пневмонии
Анализ информативности ультразвукового исследования (УЗИ) легких при внебольничной пневмонии в современной отечественной и зарубежной доказательной базе врача анестезиолога- реаниматолога
«Нужно, конечно, стремиться к техническому прогрессу в медицине, но так, чтобы не растерять драгоценные качества врача — сердечность, любовь к людям, человечность. Несмотря на техническое вооружение, медицина не перестает быть медициной личности».
А.Ф. Билибин
ВВЕДЕНИЕ
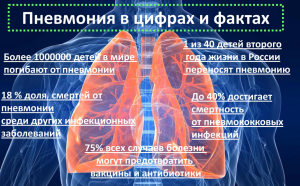
Пневмония — острое полиэтиологическое инфекционное заболевание/осложнение, характеризующееся развитием воспаления легких (очаговое, лобарное, тотальное), клиническими и лабораторными признаками высокой точности и воспроизводимости. Пневмония — это одно из наиболее часто встречаемых заболеваний органов дыхания с высокой летальностью. Смертность на территории России составляет примерно 4 случая на 1000 человек взрослого населения, а у людей пожилого возраста с сопутствующими заболеваниями летальность может достигать 40-50%. Данная категория пациентов требует пристального внимания с более глубоким мониторингом воспалительного инфильтрата [1-3]. Внебольничной считают пневмонию, которая развилась вне стационара, либо диагностированную в первые 48 ч с момента госпитализации [1, 2]. У пожилых людей заболевание протекает тяжело и часто приводит к смертельному исходу. Внебольничная пневмония (ВП) уносит больше жизней людей, чем все другие инфекционные заболевания в мире, что суммарно достигает показателей до 3 млн в год [4].
Идеальный, эталонный диагноз пневмонии основывается на обнаружении патогенных агентов в паренхиме легких, однако это не всегда удается в рутинной клинической практике. Таким образом, для дифференциальной диагностики пневмонии и других респираторных заболеваний применяется комплексная оценка, включающая физикальное обследование, лабораторный анализ крови (в том числе с оценкой маркеров воспаления), визуализирующие методы (такие как компьютерная томография (КТ), рентгенография (Rg) органов грудной клетки (ОГК) и ультразвуковое исследование (УЗИ) легких [5].
Целью данного обзора литературы является анализ современной отечественной и зарубежной доказательной базы на основе информативности УЗИ легких при ВП в практике врача-анестезиолога-реаниматолога.
МАТЕРИАЛ И МЕТОДЫ
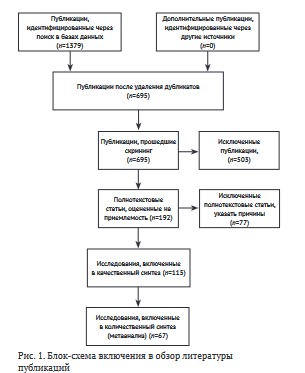
Поиск отечественных публикаций проводили в базе данных eLibrary.ru, зарубежных — в базе данных PubMed. Блок-схема включения в обзор литературы публикаций представлена на рис. 1. Был проведен поиск по публикациям (обзоры литературы, обсервационные исследования, двойные слепые рандомизированные исследования) за период 2010-2020 гг. Первично было выбрано 1379 публикаций, идентифицированных через поиск баз данных. После удаления повторов количество публикаций сократилось до 695. Из этого числа исключили 503 публикации. Оставшиеся 192 полнотекстовые статьи оценивались на приемлемость текста. По причине несоответствия основным разделам обзора из них было удалено 77 статей. Остальные 115 были включены в качественный синтез и 67 избраны в количественный синтез. Для формирования блока литературы использовали следующие поисковые запросы: «пневмония», «ультразвуковое исследование легких», «ультразвук», “pneumonia”, “ultrasound examination of the lungs”, “community acquired pneumonia ultrasound”.
Все источники отечественной и зарубежной литературы были поделены на основные главы: а) морфология пневмонии, очаги и субстраты; б) сравнительная характеристика методов диагностики, в том числе лучевых; в) ультразвуковая (УЗ) картина пневмонии, методика исследования и характеристика данного метода.
РЕЗУЛЬТАТЫ ПОИСКА
АНАМНЕЗ И ФИЗИКАЛЬНОЕ ОБСЛЕДОВАНИЕ
Анамнез и физикальное обследование должны быть направлены на распознавание клинического синдрома ВП, оценку его тяжести, осложнений и оценку сопутствующих заболеваний, которые влияют на симптомокомплекс каждого пациента. Классически ВП характеризуется острым началом лихорадки, кашлем (с выделением мокроты или без нее) и одышкой [6]. В некоторых случаях также может присутствовать боль в груди. Менее распространены симптомы со стороны желудочно-кишечного тракта (например, тошнота, рвота, диарея, боль в животе), потеря аппетита и изменения психического статуса. У пациентов пожилого возраста либо с ослабленной иммунной системой симптоматика может быть стертой. Например, у пожилых пациентов лихорадка часто не наблюдается, а единственным симптомом, указывающим на заболевание, является изменение психического статуса [7].
Также при физикальном обследовании могут встречаться тахикардия, тахипноэ, гипоксемия или задействование дополнительных мышц, участвующих в акте дыхания. При аускультации грудной клетки выявляются влажные и сухие хрипы вместе с другими признаками консолидации (например, голосовым дрожанием, бронхофонией, притуплением при перкуссии). По мере прогрессирования инфекции доминирующей клинической картиной становятся сепсис и/или респираторный дистресс-синдром. Хотя клинические признаки, описанные выше, подтверждают диагноз пневмонии, не было обнаружено комбинации симптомов и признаков, позволяющей точно поставить диагноз [6, 8]. В исследовании с охватом более 28 000 взрослых, обратившихся за первичной помощью с острым кашлем, связанным с инфекцией нижних дыхательных путей, независимыми предикторами рентгенологически подтвержденной пневмонии были лихорадка, тахикардия, хрипы при аускультации грудной клетки и сатурация кислорода менее 95% [6]. Однако положительное прогностическое значение всех вместе взятых четырех переменных находилось лишь в пределах 67%. Аналогичные результаты были получены и в других исследованиях, посвященных сравнению клинической оценки пациентов с результатами Rg ОГК. Например, исследование van Vugt et al. с участием более 2800 взрослых с острым кашлем оценивает положительное прогностическое значение клинической оценки в 57% [5]. McGee рассмотрел методы физикального обследования более 6000 пациентов с острой лихорадкой, кашлем, выделением мокроты и одышкой. В итоге каждому пациенту была проведена Rg ОГК, которая использовалась в качестве эталона для диагностики легочного инфильтрата. Некоторые результаты, обнаруженные при осмотре, значительно увеличивают вероятность диагноза пневмонии: асимметричное увеличение грудной клетки (отношение правдоподобия (LR)=44,1), эгофония (LR=4,1), кахексия (LR=4), бронхиальное дыхание (LR=3,3), сатурация кислорода менее 95% (LR=3,1) и тупой перкуторный звук над поверхностью легких (LR=3). Некоторые признаки, обнаруженные при осмотре, только умеренно увеличивают вероятность: частота дыхания более 28 (LR=2,7), хрипы (LR=2,3), ослабление дыхания (LR=2,2), температура тела выше 37,8°C (100°F) (LR=2,2) и нарушение сознания (LR=1,9). Один признак сильно снижает вероятность диагноза пневмонии — это нормальные показатели всех параметров жизнедеятельности (LR=0,3) [9].
Многие из этих симптомов по отдельности не вносят значительный вклад в дифференциальную диагностику, но некоторые из них могут помочь в окончательной постановке диагноза. Например, шкала Хекерлинга объединяет 5 симптомов для повышения точности прикроватного осмотра:
— температура тела выше 37,8°C (100°F);
— частота пульса более 100 ударов в минуту;
— хрипы при аускультации;
— ослабление дыхания при аускультации;
— отсутствие бронхиальной астмы в анамнезе [9, 10].
McGee также было показано, что как низкие, так и высокие баллы могут быть использованы для принятия решения: оценка от 0 до 1 свидетельствует против пневмонии (LR=0,3), а оценка от 4 до 5 — в пользу пневмонии (LR=8,2) [9]. Проведение осмотра и сбор анамнеза, хоть и не позволяют точно поставить диагноз ВП, являются ключевыми этапами, за которыми следуют визуализация ОГК и выбор терапии [8].
ЛАБОРАТОРНАЯ ОЦЕНКА И СЫВОРОТОЧНЫЕ БИОМАРКЕРЫ
Как правило, большинству пациентов с известной или предполагаемой ВП, которые госпитализированы или которым может потребоваться госпитализация (в зависимости от их возраста, сопутствующих заболеваний, показателей жизнедеятельности или клинической картины) проводится полный анализ крови. Наиболее распространенная находка — лейкоцитоз со сдвигом лейкоцитарной формулы влево. Лейкопения (менее 4000 клеток на мм3) встречается реже, но обычно означает более неблагоприятный прогноз. Точно так же тромбоцитопения (количество тромбоцитов менее 100 000 клеток на мм3) является редкой находкой, но она предполагает более неблагоприятный исход. Динамика уровня креатинина и азота мочевины крови в сторону повышения также указывает на неблагоприятный прогноз и часто является аргументом за госпитализацию. Эти значения вместе с повышенными значениями маркеров функции печени в крови также могут быть признаками сепсиса, что требует немедленного дополнительного обследования и лечения [11].
Актуальными являются использование исследований уровней в крови С-реактивного белка (СРБ) и прокальцитонина (ПКТ) в диагностике пневмонии, а также исследований, служащих различению бактериальных и вирусных причин ВП [5, 12, 13], хотя остается под вопросом: могут ли эти тесты надежно повысить ценность первоначальной клинической и Rg оценки [14-16]. Ebell M. et al. был проведен метаанализ, по результатам которого такие биомаркеры, как СРБ, ПКТ и количество лейкоцитов имеют достаточную точность для диагностики ВП у взрослых. Выбранное пороговое значение будет определять, является ли тест полезным для исключения (например, содержание СРБ менее 10 или 20 мг/л) или для диагностики пневмонии (например, содержание СРБ более 50 или 100 мг/л). СРБ является наиболее точным из трех изученных биомаркеров, которые в настоящее время используются для диагностики ВП. Измерение СРБ является недорогим и легкодоступным исследованием, за счет чего может быть легко интегрировано в клиническую рутину для диагностики ВП у пациентов [17]. Низкий уровень ПКТ (менее 0,1 нг/мл) может быть использован в качестве отрицательного предиктора 30-дневной летальности у пациентов с клиническим и подтвержденным с помощью Rg диагнозом ВП (чувствительность 92%, LR-0,22), даже среди пациентов с высоким риском по Индексу тяжести пневмонии (PSI) и шкале Британского торакального общества CURB-65 (LR-0,09). Среди пациентов, поступивших в больницу, низкий уровень ПКТ был связан с более короткой продолжительностью госпитализации, меньшим числом пациентов, переведенных на искусственную вентиляцию легких, и госпитализаций в отделение интенсивной терапии и менее тяжелым течением сепсиса [18].
Ограничения использования ПКТ в качестве предиктора включают его стоимость и доступность во многих больничных лабораториях. FDA (Food and Drug Administration) одобрило анализ ПКТ для определения терапевтами начала и окончания антибактериальной терапии у пациентов с подозрением на инфекцию нижних дыхательных путей в отделении неотложной помощи или стационаре [19].
МЕТОДЫ ВИЗУАЛИЗАЦИИ ОРГАНОВ ГРУДНОЙ КЛЕТКИ
Любой метод инструментальной диагностики пневмонии заключается в верификации морфологического субстрата болезни — очага инфильтрации. Под термином «инфильтрация» принято понимать локальное снижение воздушности легочной ткани, возникающей из-за накопления экссудата в респираторных отделах легких. Характер ВП определяется типом инфильтрации и стадией воспалительного процесса. В случае, если это консолидация (альвеолярный тип), происходит заполнение альвеол, мешочков, ходов и бронхиол воспалительным экссудатом. В связи с этим легочная ткань становится безвоздушной и обозначается как симптом воздушной бронхографии. Эта особенность определяется как плевропневмония, что чаще всего встречается при инфицировании бактериальными возбудителями, особенно пневмококками [20].
Другая инфильтрация, по типу «матового стекла», характерна для интерстициального типа и наблюдается при заполнении межальвеолярных пространств воспалительным экссудатом. В этом случае ее интенсивность многократно снижена, а участок поражения характеризуется малой интенсивностью тени, особенно при Rg ОГК. Для улучшения визуализации стенок бронхов и определения сосудистого рисунка в зонах инфильтрации используют КТ высокого разрешения. Инфильтрация в этом случае будет определяться как интерстициальная. При обследовании у пациентов может отсутствовать четкая симптоматика, а инфильтрация может быть и не видна при классической Rg ОГК. Эти особенности наиболее характерны для вирусных пневмоний [20]. Существует еще один тип инфильтрации — очаговый. Он характеризуется неоднородной структурой, состоящей из множества полиморфных очагов с нечеткими контурами, часто сливающимися между собой. Для данного типа воспаления характерна бронхопневмония: переход воспаления от мелких внутридольковых бронхов к окружающей легочной ткани. Односторонние и часто двухсторонние повреждения могут возникать и при небактериальных инфекциях нижних дыхательных путей [20]. Учитывая особенности инфильтраций, установить этиологию ВП по Rg картине (характер воспаления, расположение инфильтрата и т.д.) в большинстве случаев не представляется возможным [20].
РЕНТГЕНОГРАФИЯ ОРГАНОВ ГРУДНОЙ КЛЕТКИ
С момента открытия рентгеновских лучей в конце XIX века Rg ОГК является стандартным методом для диагностики пневмонии. Преимущества Rg включают простоту использования, экономичность по сравнению с более продвинутыми методами, такими как КТ, и признание во всех медицинских дисциплинах [21]. Таким образом, всем пациентам с целью диагностики ВП рекомендовано выполнение Rg ОГК в прямой и боковой проекциях. Rg ОГК направлена на выявление наличия легочной инфильтрации, определение границ и ее размеров, распространенности процесса, а также наличия возможных осложнений. Важнейшей задачей рентгенографического исследования является проведение дифференциальной диагностики с другими патологическими состояниями [1, 2, 22]. Хотя некоторые Rg-признаки указывают на специфические причины пневмонии (например, долевые консолидации указывают на инфекцию типичными бактериальными патогенами), одна только Rg картина не позволяет надежно дифференцировать этиологию заболевания [23]. Существуют также значительные различия в интерпретации рентгенограмм грудной клетки у пациентов с возможной пневмонией у разных рентгенологов [24] и между врачами отделений неотложной помощи и радиологами [25]. Рентгенограмма грудной клетки имеет чувствительность от 38 до 64% для диагностики пневмонии [26, 27], хотя клиницисты часто рассматривают отрицательную Rg ОГК как средство для исключения пневмонии [21]. Достаточно часто возникают сложности в интерпретации результатов данного исследования, например, вследствие конституциональных особенностей пациента, а также «эффекта суммации» за счет нарушенной гемодинамики или пневмофиброза [28, 29]. Из ограничений в использовании Rg ОГК стоит отметить высокую лучевую нагрузку, что становится особенно актуальным при необходимости динамического мониторинга пациента в критическом состоянии. Авторами отдельно была проведена сравнительная характеристика Rg ОГК в сопоставлении с УЗИ легких. По результатам Rg ОГК уступила УЗИ легких в диагностике наличия жидкости в плевральных полостях. Чувствительность УЗИ при оценке плеврального выпота достигает 100%, специфичность — 99,7%. Следует отметить, что чувствительность Rg ОГК в диагностике ВП остается весьма невысокой, особенно на начальных стадиях развития заболевания [30].
КОМПЬЮТЕРНАЯ ТОМОГРАФИЯ ОРГАНОВ ГРУДНОЙ КЛЕТКИ
По данным Shah V.P. et al. (2013), выявление при КТ ОГК инфильтрата размером до 10 мм с наличием бронхограммы расценивается как очаговая пневмония. КТ ОГК может с высокой точностью выявить мелкие инфильтраты и консолидации в легких [31]. В целом КТ ОГК является «золотым стандартом» в диагностике заболеваний легких [1]. КТ высокого разрешения более чувствительна для выявления пневмонии, чем Rg ОГК [27]. КТ может помочь лучше охарактеризовать пневмонию и выявить осложнения. Это особенно верно для пациентов с ослабленным иммунитетом, которые подвержены риску заражения широким спектром патогенов. Повышенная чувствительность и специфичность КТ могут помочь установить этиологию ВП (например, инвазивные грибковые инфекции, пневмоцистную пневмонию, бактериальные патогены) [32]. У пациентов с подозрением на ВП, поступивших в отделение неотложной помощи, КТ ОГК также может быть полезна для исключения пневмонии в случае сомнительных клинических синдромов и недиагностических результатов Rg ОГК (присутствуют затемнения, но неясно, вызваны ли они пневмонией или отеком легких, ателектазом, хроническим заболеванием легких или имеют другую этиологию). Это чаще всего встречается у пациентов с множественными сопутствующими заболеваниями, проявляющимися неспецифическими синдромами. КТ ОГК, дополняющая RgОГК, в таких случаях заметно влияет как на диагностику, так и на клиническое ведение пациентов. В исследовании Claessensetal. были включены 319 пациентов с клиническими симптомами ВП, которым КТ проводили в течение 4 часов с момента поступления. До и после исследования врачи оценивали вероятность диагноза ВП как а) определенную; б) вероятную; в) возможную или исключали диагноз и в зависимости от этого выбирали тактику лечения. По результатам исследования после КТ были реклассифицированы 187 пациентов (58,6%; 95% доверительный интервал (ДИ) 53,2-64,0), что привело к установлению 50,8% случаев определенной и 28,8% случаев исключенной ВП. Также благодаря результатам КТ лечение антибиотиками было начато у 51 (16%) и прекращено у 29 (9%) пациентов, решение о госпитализации было принято у 22 пациентов, а выписаны 23 [26].
Однако использование КТ ОГК для непрерывного мониторирования и оценки динамики воспалительного инфильтрата ограничено в использовании ввиду высокой лучевой нагрузки и необходимости транспортировки пациента [33, 34]. В Китае Hu Q.J., Shen Y. С. (2014) опубликовали результаты исследования, в которых подтверждают, что УЗИ легких играет важную роль в диагностике пневмонии и является многообещающей привлекательной альтернативой Rg ОГК и КТ ОГК. Но важно помнить, что его результаты следует интерпретировать параллельно с клиническими данными [35].
Возможности применения
За последние годы в литературе появилось множество данных о возможности эффективного использования УЗИ в качестве прикроватного метода с целью диагностики и мониторинга эффективности лечения ВП.
Неинвазивность, доступность, отсутствие ионизирующего излучения, скорость выполнения и простота данной методики делает УЗИ легких возможной альтернативой в сравнении с традиционными техниками лучевой диагностики, что особенно актуально у реанимационных пациентов с тяжелым течением ВП [2, 36-39]. При прохождении УЗ-луча через мягкие ткани грудной клетки, плевру и паренхиму легкого выявляются различные УЗ-сигналы и артефакты, исходящие из плевры, формирующие различные УЗ-профили, соответствующие тому или иному заболеванию легких [40]. Использование УЗИ в диагностике заболеваний легких, а именно пневмонии, отеке легких, эмфиземе, патологических периферических образований и заболеваний плевры и пневмотораксе доказало свою эффективность [29, 41-44]. Объемные образования, повреждения, опухоли плевры, в том числе расположенные на поверхности париетальной плевры, хорошо визуализируются с помощью УЗИ [45].
Ультразвуковая картина пневмонии
В 2008 году во Франции Lichtenstein D. разработал и внедрил BLUE (Bedside Lung Ultrasound in Emergency) протокол УЗИ с целью диагностики острой дыхательной недостаточности (ОДН). Данный протокол позволяет установить причину ОДН в 90,5% случаях. Выявление В-линий позволяет мониторировать количество жидкости в легких, для этого был разработан FALLS (Fluid Administration Limited by Lung Sonography) протокол — введение жидкости на основе результатов УЗИ. Мониторирование отека легких с помощью УЗИ позволяет своевременно скорректировать лечебную тактику, что особенно актуально при ведении тяжелых реанимационных пациентов [3, 46]. Bedetti G. et al., показали, что одним из главных преимуществ УЗИ является возможность быстрого обучения и получение воспроизводимых, достоверных результатов не только опытными специалистами, но и начинающими. Важно также то, что качество прибора не имеет большого значения [47] и не сказывается на диагностике отека легких [48, 49]. Reissig А. et al. (2012) в исследованиях по диагностике ВП предлагают следующую схему мониторинга: 1-е, 5-е, 8-е, 13-е и 16-е сутки лечения. По мнению авторов, это оптимальные дни мониторинга динамики заболевания [50]. В диагностике ВП используется полипозиционный метод. Применяются субкостальный, парастернальный, межреберный, паравертебральный и надключичные доступы. Положение пациента при этом - сидя и лежа. Доступ, частота, положение пациента и другие факторы исследования всегда определяются индивидуально [31, 39]. Очаг пневмонии описан как воспалительный субстрат, инфильтрация с однородной либо неоднородной структурой, преимущественно гипоэхогенной, который составляет в размере не более 20 мм [43].
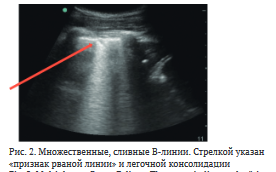
Когда легочная ткань повреждена и в ней образуется очаг воспалительного инфильтрата, в альвеолах усиливается кровоснабжение и формируется экссудат. Все это приводит к тому, что легочная ткань становится видимой ультразвуку [51]. При легочных консолидациях плевральная линия изменяется, она становится более утолщенной и у нее появляется характерный «признак рваной линии» (рис. 2). Иногда в инфильтрате могут определяться различные гиперэхогенные включения, их называют «аэробронхограммы». По сути своей это неспадающиеся участки бронхов и бронхиол. Однако в случае наличия экссудата визуализируются гиперэхогенные структуры с анэхогенными прослойками внутри — «жидкостные аэробронхограммы». Для них характерны «трубчатые» структуры внутри инфильтрации [52]. Характерным УЗ-признаком отека легких является появление артефактов — В-линий — в легких за счет утолщения междольковых перегородок, в которых накапливается жидкость [53]. Их наличие может свидетельствовать также в пользу интерстициальной пневмонии, а в случае увеличения числа В-линий до более 5 может быть неспецифичным признаком начинающегося отека легких [44, 54, 55].
D. Lichtenstein et al. предложили дифференцировать эти артефакты по принципу единичных и множественных, что соответствовало наличию: а) менее 3 B-линий в одном межреберном промежутке; в) более 3 B-линий соответственно [56]. В 2004 году стали появляться сообщения о корреляции количества этих артефактов с наличием внесосудистой жидкости в легких, которая подтверждалась при Rg ОГК [57]. Caiulo V.A. et al. (2013) отметили, что появление нескольких сливающихся В-линий характерно для очаговой пневмонии [39]. Появление В-линий не всегда означает наличие патологического процесса. В норме они могут наблюдаться в среднем в 15-30% случаев [58]. Для УЗ-оценки пневмонии оцениваются участки безвоздушной ткани, их края, наличие деструктивных очагов, а также феномен «воздушной бронхограммы» [41]. Степень тяжести течения ВП напрямую зависит от количества и распределения «воздушной бронхограммы». Чувствительность УЗИ при наличии бронхограммы доходит до 90% [59].
Чувствительность и специфичность метода для диагностики внебольничной пневмонии
В последние годы многие авторы стали глубже изучать вопросы применения УЗИ в диагностике ВП и ее осложнений [3, 60]. В случае подозрения на наличие плеврита у пациентов с ВП рекомендовано выполнение УЗИ грудной полости [1]. Плевральный выпот — частое осложнение ВП примерно в 10-25% случаев. Ультразвук позволяет с высокой степенью чувствительности и специфичности определить плевральный выпот и его характер [1, 2]. Чувствительность метода в диагностике пневмоторакса достигает 100%, специфичность — 96%. Эти показатели намного превосходят результаты КТ и Rg ОГК [35, 61]. Из метаанализа Chavez М.А. et al. (2014) известно, что при диагностике пневмонии с помощью УЗИ чувствительность составляет 97%, а специфичность — 94% [62]. Несколько исследований продемонстрировали превосходство УЗИ перед Rg ОГК и КТ, обнаружив чувствительность, составляющую 97% и специфичность, равную 93% [63]. Систематический обзор и метаанализ 2019 года показали, что УЗИ в месте оказания медицинской помощи (POCUS) превосходит Rg грудной клетки при диагностике пневмонии и других легочных заболеваний. В этом обзоре в 14 исследованиях пневмонии указана точность каждого сонографического признака при определении диагноза. Во многих из этих исследований были использованы различные диагностические эталоны (клиническое заключение группы экспертов, Rg и КТ ОГК). При УЗИ консолидация, обнаруженная в переднем, боковом или заднем отделах, имела лучший общий профиль (LR +15,8, LR -0,18) [64]. Обнаружение либо этой модели консолидации, либо фокального интерстициального синдрома имело наилучшую чувствительность (0,96); выявление изолированного фокального интерстициального синдрома или изолированной передней консолидации имело наилучшую специфичность (0,97) [64].
Ограничения метода
Поскольку POCUS выполняется у постели больного, результаты доступны врачу в режиме реального времени, что помогает в диагностике и выборе тактики лечения. Последовательные обследования могут быть выполнены для отслеживания динамики заболевания и реакции на лечение. Однако во многих учреждениях нет возможности сохранять УЗ-изображения, поэтому другие медицинские работники не могут их видеть. Без возможности задокументировать изображение диагноз по прикроватному исследованию не может быть обоснован. Еще одно важное ограничение — это опыт врача, который проводит и интерпретирует результаты обследования. Однако по данным исследований компетентность достигается после 9 часов обучения [65].
ЗАКЛЮЧЕНИЕ
Ультразвуковое исследование легких — это один из актуальных способов в анестезиологии-реаниматологии для решения проблем диагностики пневмонии. На сегодняшний день определены как преимущества, так и недостатки данного метода. Из несомненных преимуществ можно выделить высокую скорость исследования и чувствительность метода, проведение исследования непосредственно у постели больного, отсутствие ионизирующих изучений и возможность многократных повторений. Ультразвуковое исследование легких вряд ли сможет заменить компьютерную томографию органов грудной клетки, так как не обладает 100% специфичностью, однако оно незаменимо в прикроватном исследовании и является сонографическим «стетоскопом» врача, который значительно расширяет диагностические возможности.
Таким образом, ультразвук является многообещающей и достойной альтернативой другим методам лучевой диагностики.
СПИСОК источников
1. Чучалин А.Г., Синопальников А.И., Козлов Р.С., Тюрин И.Е., Рачи- на С.А. Внебольничная пневмония у взрослых. Практические рекомендации по диагностике, лечению и профилактике (пособие для врачей). Клиническая микробиологическая антимикробная химиотерапия. 2010;12(3):186-225.
2. Синопальников А.И., Козлов Р.С. (ред.) Внебольничные инфекции дыхательных путей: руководство для врачей. Москва: Премьер МТ: Наш Город; 2007. с. 295-333.
3. Lichtenstein
DA. BLUE-protocol and FALLS-protocol: two applications of lung ultrasound in
the critically ill. Chest. 2015;147(6):1659-1670.
4. GBD 2015 Mortality and Causes of Death Collaborators. Global, regional, and national life expectancy, all-cause mortality, and cause-specific mortality for 249 causes of death, 1980-2015: a systematic analysis for the Global Burden of Disease Study 2015. Lancet. 2016;388(10053):1459- 1544
5. van Vugt SF, Verheij
TJM, de Jong PA, Butler CC, Hood K, Coenen S, et al. Diagnosing pneumonia in
patients with acute cough: clinical judgment compared to chest radiography. Eur
Respir J. 2013;42(4):1076-1082.
6. Moore M,
Stuart B, Little P, Smith S, Thompson MJ, Knox K, et al. Predictors of
pneumonia in lower respiratory tract infections: 3C prospective cough
complication cohort study. Eur Respir J. 2017;50(5):1700434.
7. Takada T, Yamamoto Y, Terada K, Ohta M, Mikami W, Yokota H, et al. Diagnostic utility of appetite loss in addition to existing prediction models for community-acquired pneumonia in the elderly: a prospective diagnostic study in acute care hospitals in Japan. BMJ Open. 2017;7(11): e019155.
8. Ebell MH,
Chupp H, Cai X, Bentivegna M, Kearney M. Accuracy of Signs and Symptoms for the
Diagnosis of Community-acquired Pneumonia: A Meta-analysis. Acad Emerg Med.
2020;27(7):541-553.
9. McGee S. Teaching Evidence-Based Physical Diagnosis: Six Bedside Lessons. South Med J. 2016;109(12):738-742. PMID: 27911963 https:// doi.org/10.14423/SMJ.0000000000000572
10. Heckerling
PS, Tape TG, Wigton RS, Hissong KK, Leikin JB, Ornato JP, et al. Clinical
prediction rule for pulmonary infiltrates. Ann Intern Med. 1990;113(9):664-670.
11. Salih W,
Schembri S, Chalmers JD. Simplification of the IDSA/ATS criteria for severe CAP
using meta-analysis and observational data. Eur Respir J. 2014;43(3):842-851.
12. Self WH,
Balk RA, Grijalva CG, Williams DJ, Zhu Y, Anderson EJ, et al. Procalcitonin as
a Marker of Etiology in Adults Hospitalized With Community-Acquired Pneumonia.
Clin Infect Dis. 2017;65(2):183-190.
13. Kamat IS,
Ramachandran V, Eswaran H, Guffey D, Musher DM. Procalcitonin to Distinguish
Viral from Bacterial Pneumonia: A Systematic Review and Meta-analysis. Clin
Infect Dis. 2020;70(3):538- 542.
14. Metlay
JP, Waterer GW, Long AC, Anzueto A, Brozek J, Crothers K, et al. Diagnosis and
Treatment of Adults with Community-acquired Pneumonia. An Official Clinical
Practice Guideline of the American Thoracic Society and Infectious Diseases
Society of America. Am J Respir Crit Care Med. 2019;200(7):e45-e67.
15. Huang DT, Yealy DM, Filbin MR, Brown AM, Chang C-CH, Doi Y, et al. Procalcitonin-Guided Use of Antibiotics for Lower Respiratory Tract Infection. N Engl J Med. 2018;379(3):236-249. PMID: 29781385 https:// doi.org/10.1056/NEJMoa1802670
16. Daubin C,
Valette X, Thiolliere F, Mira J-P, Hazera P, Annane D, et al. Procalcitonin
algorithm to guide initial antibiotic therapy in acute exacerbations of COPD
admitted to the ICU: a randomized multicenter study. Intensive Care Med.
2018;44(4):428-437.
17. Ebell MH, Bentivegna M, Cai X, Hulme C, Kearney M. Accuracy of Biomarkers for the Diagnosis of Adult Community-acquired Pneumonia: A Meta-analysis. Acad Emerg Med. 2020;27(3):195-206.
18. Huang DT, Weissfeld LA, Kellum JA, Yealy DM, Kong L, Martino M, et al. Risk prediction with procalcitonin and clinical rules in community- acquired pneumonia. Ann Emerg Med. 2008;52(1):48-58.e2.
19. Discussion
and recommendations for the application of procalcitonin to the evaluation and
management of suspected lower respiratory tract infections and sepsis. FDA
Executive Summary 2016.
20. Тюрин И.Е. Методы визуализации. В кн.: Чучалин А.Г. (ред.) Респираторная медицина: в 2-х томах. Москва: ГЭОТАР-Медиа; 2017. T.1. c. 245-302.
21. Hunton
R. Updated concepts in the diagnosis and management of community-acquired
pneumonia. JAAPA. 2019;32(10):18-23.
22. Гельфанда Б.Р., Проценко Д.Н., Белоцерковского Б.З. (ред.) Нозокомиальная пневмония у взрослых: Российские национальные рекомендации. Москва: Медицинское информационное агентство; 2016. с. 72-105.
23. Jartti A, Rauvala E, Kauma H, Renko M, Kunnari M, Syrjala H. Chest imaging findings in hospitalized patients with H1N1 influenza. Acta Radiol. 2011;52(3):297-304.
24. Makhnevich A, Sinvani L, Cohen SL, Feldhamer KH, Zhang M, Lesser ML, et al. The Clinical Utility of Chest Radiography for Identifying Pneumonia: Accounting for Diagnostic Uncertainty in Radiology Reports. AJR Am JRoentgenol. 2019;213(6):1207-1212.
25. Atamna A, Shiber S, Yassin M, Drescher MJ, Bishara J. The accuracy of a diagnosis of pneumonia in the emergency department. Int J Infect Dis. 2019;89:62-65.
26. Claessens
Y-E, Debray M-P, Tubach F, Brun A-L, Rammaert B, Hausfater P, et al. Early
Chest Computed Tomography Scan to Assist Diagnosis and Guide Treatment Decision
for Suspected Community- acquired Pneumonia. Am J Respir Crit Care Med.
2015;192(8):974-982.
27. Loubet P, Tubiana S, Claessens YE, Epelboin L, Ficko C, Bel JL, et al. Community-acquired pneumonia in the emergency department: an algorithm to facilitate diagnosis and guide chest CT scan indication. Clin Microbiol Infect. 2020;26(3):382.e1-382.e7. PMID: 31284034
28. Cortellaro F, Ceriani E, Spinelli M, Campanella C, Bossi I, Coen D, et al. Lung ultrasound for monitoring cardiogenic pulmonary edema. Intern Emerg Med. 2017;12(7):1011-1017.
29. Wang G, Ji X, Xu Y, Xiang X. Lung ultrasound: a promising tool to monitor ventilator-associated pneumonia in critically ill patients. Crit Care. 2016;20(1):320.
30. Self WH,
Courtney DM, McNaughton CD, Wunderink RG, Kline JA. High discordance of chest
x-ray and computed tomography for detection of pulmonary opacities in ED
patients: implications for diagnosing pneumonia. Am J Emerg Med.
2013;31(2):401-405.
31. Shah VP,
Tunik MG, Tsung JW. Prospective evaluation of point-of-care ultrasonography for
the diagnosis of pneumonia in children and young adults. JAMA Pediatr.
2013;167(2):119-125.
32. Kunihiro
Y, Tanaka N, Kawano R, Yujiri T, Kubo M, Ueda K, et al. Differential diagnosis
of pulmonary infections in immunocompromised patients using high-resolution
computed tomography. Eur Radiol. 2019;29(11):6089-6099.
33. Alzahrani
SA, Al-Salamah MA, Al-Madani WH, Elbarbary MA. Systematic review and
meta-analysis for the use of ultrasound versus radiology in diagnosing of
pneumonia. Crit Ultrasound J. 2017;9(1):6.
34. Unluer EE, Karagoz A, Senturk GO, Karaman M, Olow KH, Bayata S, et al. Bedside lung ultrasonography for diagnosis of pneumonia. Hong Kong Am J Emerg Med. 2013;20(2):98-104.
35. Hu 0-J,
Shen Y-C, Jia L-0, Guo S-J, Long H-Y, Pang C-S, et al. Diagnostic performance
of lung ultrasound in the diagnosis of pneumonia: a bivariate meta-analysis. Int
J Clin Exp Med. 2014;7(1):115-121.
36. Orso D,
Guglielmo N, Copetti R. Lung ultrasound in diagnosing pneumonia in the
emergency department: a systematic review and meta-analysis. Eur J Emerg Med.
2018;25(5):312-321.
37. Ye Х, Xiao H, Chen B, Zhang S. Accuracy of Lung Ultrasonography versus
Chest Radiography for the Diagnosis of Adult Community-Acquired Pneumonia:
Review of the Literature and Meta-Analysis. PLoS One. 2015;10(6):e0130066.
38. Boursiani
C, Tsolia M, Koumanidou C, Malagari A, Vakaki M, Karapostolakis G, et al. Lung
Ultrasound as First-Line Examination for the Diagnosis of Community-Acquired
Pneumonia in Children. Pediatr Emerg Care. 2017;33(1):62-66.
39. Caiulo VA, Gargani L, Caiulo S, Fisicaro A, Moramarco F, Latini G, et al. Lung ultrasound characteristics of community-acquired pneumonia in hospitalized children. Pediatr Pulmonol. 2013;48(3):280-287.
40. Сафарова А.Ф. Роль прикроватного ультразвукового исследования лёгких при различных респираторных заболеваниях. Медицинский алфавит. 2021;(42):42-47.
41. Volpicelli G. Lung sonography. J Ultrasound Med. 2013;32(1):165-171.
42. Shumbusho JP, Duanmu Y, Kim SH, Bassett IV, Boyer EW, Ruutiainen AT, et al. Accuracy of Resident-Performed Point-of-Care Lung Ultrasound Examinations Versus Chest Radiography in Pneumothorax Follow-up After Tube Thoracostomy in Rwanda. J Ultrasound Med. 2020;39(3):499- 506
43. Smargiassi
A, Inchingolo R, Soldati G, Copetti R, Marchetti G, Zanforlin A, et al. The
role of chest ultrasonography in the management of respiratory diseases:
document II. Multidiscip Respir Med. 2013;8(1):55.
44. Gargani L,
Frassi F, Soldati G, Tesorio P, Gheorghiade M, Picano E. Ultrasound lung comets
for the differential diagnosis of acute cardiogenic dyspnoea: a comparison with
natriuretic peptides. Eur J Heart Fail. 2008;10(1):70-77.
45. Gehmacher
O, Kopf A, Scheier M, Bitschnau R, Wertgen T, Mathis G. Ist eine Pleuritis
sonographisch darstellbar? [Can pleurisy be detected with ultrasound?].
Ultraschall Med. 1997;18(5):214-219.
46. Lichtenstein
DA. Lung ultrasound in the critically ill. Ann Intensive Care. 2014;4(1):1.
47. Bedetti G, Gargani L, Corbisiero A, Frassi F, Poggianti E, Mottola G. Evaluation of ultrasound lung comets by hand-held echocardiography. Cardiovasc Ultrasound. 2006;4:34.
48. Vitturi N, Soattin M, Allemand E, Simoni F, Realdi G. Thoracic ultrasonography: A new method for the work-up of patients with dyspnea. J Ultrasound. 2011;14(3):147-151.
49. Xirouchaki N, Magkanas E, Vaporidi K, Kondili E, Plataki M, Patrianakos A, et al. Lung ultrasound in critically ill patients: comparison with
50. Reissig
A, Copetti R, Mathis G, Mempel C, Schuler A, Zechner P, et al. Lung ultrasound
in the diagnosis and follow-up of community-acquired pneumonia: a prospective,
multicenter, diagnostic accuracy study. Chest. 2012;142(4):965-972.
51. Murphy CV, Schramm GE, Doherty JA, Reichley RM, Gajic O, Afessa B, et al. The importance of fluid management in acute lung injury secondary to septic shock. Chest. 2009;136(1):102-109.
53. Picano E, Frassi F, Agricola E, Gligorova S, Gargani L, Mottola G. Ultrasound lung comets: a clinically useful sign of extravascular lung water. J Am Soc Echocardiogr. 2006;19(3):356-363.
54. Gargani L, Volpicelli G. How I do it: lung ultrasound. Cardiovasc Ultrasound. 2014;12:25.
55. Noble VE,
Murray AF, Capp R, Sylvia-Reardon MH, Steele DJR, Liteplo A. Ultrasound
assessment for extravascular lung water in patients undergoing hemodialysis.
56. Lichtenstein D, Meziere G, Biderman P, Gepner A, Barre O. The comet- tail artifact. An ultrasound sign of alveolar-interstitial syndrome. Am J Respir Crit Care Med. 1997;156(5):1640-1646.
57. Jambrik Z, Monti S, Coppola V, Agricola E, Mottola G, Miniati M, et al. Usefulness of ultrasound lung comets as a nonradiologic sign of extravascular lung water. Am J Cardiol. 2004;93(10):1265-1270.
58. Reissig A, Kroegel C. Transthoracic sonography of diffuse parenchymal lung disease: the role of comet tail artifacts. J Ultrasound Med. 2003;22(2):173-180.
59. Mongodi
S, Via G, Girard M, Rouquette I, Benoit Misset, MD, Antonio Braschi, et al.
Lung Ultrasound for Early Diagnosis of Ventilator- Associated Pneumonia. Chest.
2016;149(4):969-980.
60. Лахин Р.Е., Щеголев А.В., Жирнова Е.А., Емельянов А.А., Грачёв И.Н. Характеристика ультразвуковых признаков в диагностике объема и характера поражения легких. Вестник интенсивной терапии. 2016;4:5-11.
61. Rowan KR, Kirkpatrick AW, Liu D, Forkheim KE, Mayo JR, Nicolaou S. Traumatic pneumothorax detection with thoracic US: correlation with chest radiography and CT--initial experience. Radiology. 2002;225(1):210-214.
62. Chavez MA, Shams N, Ellington LE, Naithani N, Gilman RH, Steinhoff MC, et al. Lung ultrasound for the diagnosis of pneumonia in adults: a systematic review and meta-analysis. Respir Res. 2014;15(1):50.
63. Testa A,
Soldati G, Copetti R, Giannuzzi R, Portale G, Gentiloni-Silveri N. Early
recognition of the 2009 pandemic influenza A (H1N1) pneumonia by chest
ultrasound. Crit Care. 2012;16(1):R30.
64. Staub LJ,
Biscaro RRM, Kaszubowski E, Maurici R. Lung Ultrasound for the Emergency
Diagnosis of Pneumonia, Acute Heart Failure, and Exacerbations of Chronic
Obstructive Pulmonary Disease/ Asthma in Adults: A Systematic Review and
Meta-analysis. J Emerg Med. 2019;56(1):53-69.
65. Mozzini C, Fratta Pasini AM, Garbin U, Cominacini L. Lung ultrasound in internal medicine: training and clinical practice. Crit Ultrasound J. 2016;8(1):10.
ИНФОРМАЦИЯ ОБ АВТОРАХ
Старостин Даниил Олегович - ассистент кафедры анестезиологии и реаниматологии ИВДПО ФНКЦ РР;
60%: подбор литературы, анализ и интерпретация результатов, написание рабочего варианта рукописи
Кузовлев Артём Николаевич доктор медицинских наук, профессор, заместитель директора - руководитель НИИ общей реаниматологии им. В.А. Неговского ФНКЦ РР
40%: концепция исследования, анализ и интерпретация результатов, редактирование рукописи Авторы заявляют об отсутствии конфликта интересов
Теги: внебольничная пневмония
234567 Начало активности (дата): 05.10.2023 09:38:00
234567 Кем создан (ID): 989
234567 Ключевые слова: внебольничная пневмония, ультразвуковое исследование легких, ультразвук
12354567899
Похожие статьи
Септическая эмбологенная пневмония при инфекционном эндокардите правых отделов сердца: лучевая диагностикаПовреждения диафрагмы при сочетанной закрытой травме живота: особенности диагностики и лечения
Рентген на дому 8 495 22 555 6 8
Хирургические методы стабилизации грудной клетки при множественных переломах ребер
Рентгеноанатомические основы исследования легких. Рентгенологический серий томограмм. Глава 32



