 02.10.2023
02.10.2023
Септическая эмбологенная пневмония при инфекционном эндокардите правых отделов сердца: лучевая диагностика
Ранняя и правильная диагностика инфекционного эндокардита (ИЭ) правых отделов сердца не теряет своей важности из-за сохранения проблемы инъекционной наркомании и увеличения количества хирургических вмешательств на сердце
Преобладающая локализация в правых отделах (до 92,3%) наиболее характерна для ИЭ иньекционных наркоманов; также ИЭ обычно локализуется в правых отделах сердца у больных с постоянным электрокардиостимулятором (ЭКС) [1, 7, 14, 15]. Значительно реже ИЭ правых отделов сердца связан у взрослых с предрасполагающими врожденными пороками сердца — дефектом межжелудочковой перегородки, дефектом межпредсердной перегородки, тетрадой Фалло, открытым артериальным протоком, возникает на протезированном клапане, либо, как рецидив, на ранее пораженном ИЭ нативном клапане [1, 13]. К ИЭ правых отделов сердца предрасполагают внутривенные катетеры и программный гемодиализ; случаи правостороннего ИЭ у пациентов без каких-либо факторов риска описываются очень редко [12, 13, 16].
Достоверный диагноз ИЭ в соответствии с действующими диагностическими критериями (DUKE — критерии) базируется на визуализации типичных «свежих» вегетаций на эндокарде и новых деструкций пораженных клапанов при эхокардиографии (ЭхоКГ) или позитронно-эмиссионной компьютерной томографии (ПЭТ-КТ) сердца, а также выделении типичных возбудителей при бактериологическом исследовании крови [17]. Однако на догоспитальном этапе заболевания эти необходимые исследования проводятся менее чем у трети больных [18].
Предиктором диагноза ИЭ считается аускультация нового шума клапанной регургитации, возникающего при формировании клапанной недостаточности в результате деструктивных изменений створок, но при ИЭ правых отделов у 50-80% больных шум появляется поздно либо вообще не выслушивается [18-21]. В дебюте ИЭ правых отделов и в первые недели заболевания преобладают неспецифические симптомы: лихорадка с ознобами — у 95-97,1% больных и «легочная маска» — респираторные проявления, обусловленные септической эмбологенной пневмонией (СЭП), развивающейся при фрагментации вегетаций, содержащих колонии микроорганизмов, и распространении инфицированных эмболов в артериях малого круга [15, 18, 21, 22].
Септическая эмбологенная
пневмония наблюдается у 53-100% больных ИЭ правых отделов, поражение обычно
двустороннее, часто множественное и имеет рецидивирующий характер [3, 15].
Содержащие колонии микроорганизмов тромбы вызывают механическую обструкцию преимущественно мелких ветвей легочной артерии с формированием участков инфаркта легочной ткани, инфекционным воспалением и образованием абсцесса в результате распада легочной ткани.
Макроскопически в легком выявляются красновато-синюшные или коричневато-красные умеренно уплотненные фокусы геморрагических инфарктов различных размеров (в зависимости от калибра обтурированного кровеносного сосуда). В большинстве случаев это инфарцированные участки легкого неправильной треугольной формы, основанием обращенные к плевре, а верхушкой — к корню легкого. В просвете кровеносного сосуда вблизи инфаркта обнаруживается эмбол. В инфарцированном участке легкого происходит секвестрация некротических масс с форми
рованием в последующем полости распада (рис. 1) и нагноение некротических масс геморрагического инфаркта с абсцедированием. Стенки абсцесса имеют обычно желтовато-коричневатый цвет. Пиемические очаги могут быть микроскопически малых размеров и выявляться только при гистологическом исследовании (рис. 2).
Микроскопически в участке геморрагического инфаркта легкого межальвеолярные перегородки разрушены, могут определяться только их очертания, ядра клеток и границы между клетками отсутствуют, в просвете альвеол гемолизированные и негемолизированные эритроциты. В просвете кровеносного сосуда видны тромбоэмболические обтурирующие массы с лейкоцитарной инфильтрацией и/или микробные эмболы (рис. 3).
При формировании полости распада в геморрагическом инфаркте внутренний слой представлен некротическими массами с гемолизированными и негемолизированными эритроцитами, могут быть выявлены скопления микробной флоры, наружный слой — ткань легкого с экссудативными изменениями (рис. 4).
Клинически СЭП проявляется неспецифическими респираторными симптомами: кашлем с мокротой — у 17,5-58,8% больных, одышкой — у 22,3-48,2%, плевральными болями — у 10,8-48%, кровохарканьем — у 14,3%. У 15,5-51% больных при поступлении имеет место гипоксемия [2, 22]. Аускультативная картина в легких также не имеет специфических отличий от пневмоний другой природы. Состояние может осложниться развитием респираторного дистресс-синдрома, септическим шоком, эмпиемой, пневмотораксом и легочной гипертензией [20, 22, 23]. Не удивительно, что 80% больных ИЭ правых отделов госпитализируют с ошибочным диагнозом «двусторонняя пневмония» [18, 24].
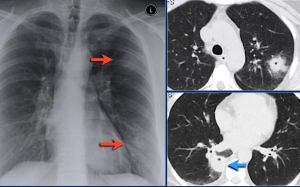
Лучевые исследования легких у Больных ИЭ правых отделов сердца позволяют визуализировать патологические изменения, характерные для СЭП, которые зачастую становятся «визитной карточкой» заболевания, дают основание заподозрить ИЭ и назначить ЭхоКГ и бактериологическое исследование крови. Рентгенологическое исследование при СЭП в 50-100% случаев выявляет типичное двустороннее поражение легких с наличием множественных небольших очагов, нечетких округлых или овальных теней различных размеров, клиновидных теней в периферических зонах легких (рис. 5). При активном течении ИЭ характерна быстрая динамика появления новых очагов и затемнений различного объема, их склонность к распаду с возникновением тонкостенных полостей; возможно развитие плеврального выпота [3, 23, 25]. Но отечественные и зарубежные авторы указывают на низкую чувствительность метода (22-40%), особенно при начальных изменениях [26, 27]. В практику все шире входит компьютерная томография органов грудной клетки (КТ ОГК). Она позволяет выявить характерные изменения уже на самых ранних стадиях СЭП, более объективно отслеживать динамику (что важно как в диагностическом отношении — быстрая динамика — один из признаков СЭП, так и в плане ответа на проводимую терапию), выявлять возможные осложнения [23].
У больных с подозрением на СЭП в настоящее время чаще проводится нативная КТ со стандартными параметрами сканирования. При выявлении характерных изменений в легких исследование целесообразно дополнить внутривенным контрастным усилением для исключения окклюзии крупных ветвей легочной артерии (сканирование в артериальную и венозную фазы). Но в отличие от более часто встречающейся неинфекционной тромбоэмболии дефекты наполнения в мелких ветвях сосудов (которые служат своеобразной «ловушкой» для инфицированных тромбов) в рамках КТ-ангиопульмонографии на практике не всегда удается выявить из-за малого калибра пораженных артерий [28]. При контрастном исследовании также полезно дать оценку органов средостения в целом, отметить соотношение левых и правых отделов сердца — при длительном или рецидивирующем течении ИЭ с развитием недостаточности ТК происходит увеличение правых отделов сердца.
Патологические изменения на КТ при СЭП разнообразны. Понимание данных изменений лучше происходит через сопоставление их с морфологией [29]. Можно выделить три основных вида изменений, которые встречаются у больных с СЭП — очаги, инфильтраты-уплотнения и полости [30]. В большинстве случаев у одного больного присутствуют все эти изменения одномоментно или с течением времени переходят из одной патологической формы в другую. Так, сливающиеся или увеличивающиеся в размерах очаги могут формировать инфильтраты, а на фоне тех же очагов и инфильтратов с течением времени формируются полости распада. Преобладает поражение обоих легких, хотя односторонний процесс может наблюдаться в самом начале заболевания.
Очаги по отношению к структурам легочной дольки являются гематогенными (хаотичными — не удается установить связь таких очагов с интерстицием, часть очагов расположена вдоль плевры) [31], обычно располагаются с 2 сторон (до 90%) [32], в большинстве своем солидной структуры, округлой формы, с четкими и ровными контурами. По наблюдениям J.E. Kuhlman et al., очаги более чем в половине случаев расположены в базальных отделах легких (61%) [33]. В толще очагов в динамике можно наблюдать появление распадов или их полное превращение в мелкие тонкостенные полости (рис. 6). Иногда можно заметить, что очаги близко или вовсе неотделимо расположены рядом с сосудистыми ветвями — так называемый симптом «питающего сосуда» [34], который также характерен для гематогенных процессов.
Инфильтраты-уплотнения в большинстве случаев также расположены в субплевральных зонах (рис. 7). Их форма может быть как треугольной или близкой к ней, так и полукруглой или неправильной [35].
R.R. Almeida et al. обнаружили уплотнения по типу «обратного венца» в 59,7% случаев, при этом у 46,7% пациентов подобные уплотнения были не единичными. Из них 79,5% были отмечены уже при первичном сканировании, остальные в динамике. Этот симптом встретился даже чаще симптома «венца» (37,1%) [36].
На фоне очагов и инфильтратов достаточно быстро появляются полости распада — они имеют преимущественно четкие и ровные контуры, хорошо определяемый внутренний и наружный края, стенка их ближе по определению к эластическим полостям — имеет небольшую толщину, а часть полостей и вовсе могут напоминать кисты из-за тонкой стенки, хотя истинно ими не являются (рис. 8) [37]. Различного рода полости при СЭП по современным данным обнаруживаются в легких в 91,9% [36]. В ряде случаев отмечается бухтообразный контур полостей и наличие в их просвете содержимого с горизонтальным уровнем, можно проследить и связь с бронхом.
Такую близкую к правильной форму полостей объясняют тракционной способностью легких и их эластическими свойствами [38]. Именно подобные полости с 2 сторон в легких достаточно патогномоничны для СЭП, и их диагностика является особенно специфичной при рентгенографии (что сложно сказать об очагах и инфильтратах).
Очаги, инфильтраты, полости могут быть расположены не только субплеврально, но и периваскулярно, то есть по ходу крупных легочных сосудов, что также отражает их гематогенный характер. Но данное наблюдение в меньшей степени относится к инфильтратам по типу «обратного венца», так как они в большинстве своем отображают инфаркты легкого, имеющие типичное субплевральное положение.
Увеличение внутригрудных лимфатических узлов является дополнительным неспецифическим симптомом СЭП. Оно встречается в 24,4-27,3% случаев, носит реактивный характер и никогда не принимает вида распространенной лимфаденопатии [39]. Плевральный выпот может выявляться при СЭП, особенно при наличии субплеврально расположенных полостей или инфарктов, что будет определять характер выпота (экссудат, эмпиема, геморрагическая жидкость). В некоторых наблюдениях встречаемость плеврального выпота доходит до 64,3%, уступая только очаговым изменениям [40]. Сводная характеристика основных КТ-симптомов СЭП представлена в табл. 1.
Несмотря на кажущуюся сложность и полимор- фность проявлений, КТ-семиотика СЭП достаточно стереотипна, и, понимая ее патогенез, проще охарактеризовать имеющиеся элементы картины, особенно если исследование в динамике.
К непосредственным осложнениям СЭП можно отнести прогрессирование полостей распада с их возможным слиянием и формированием крупных абсцессов, возникновение массивной пневмонической инфильтрации в легких, формирование свищей, в том числе с плеврой и развитие эмпиемы, пневмоторакса, а также острого респираторного дистресс-синдрома (ОРДС) [30]. Пневмоторакс как осложнение СЭП может быть односторонний или двусторонний [41]. Как и в иных случаях при полостях легких, он развивается при близком расположении последних к плевре, разрыве и формировании между ними и плевральной полостью сообщения, через которое и попадает воздух (рис. 9).
Основные КТ-симптомы септической эмбологенной пневмонии
|
КТ-симптом |
Характеристика |
|
Очаги |
- Хаотичные - Субплевральные или периваскулярные - Размер от 5,0 мм - Преобразование с распадом - Симптом «питающего сосуда» |
|
Инфильтраты |
- Субплевральные или периваскулярные - Клиновидной или неправильной формы - Контуры часто достаточно четкие - Симптом «венца» или «обратного венца» - Распады в толще |
|
Полости распада |
- Субплевральные или периваскулярные - Множественные, преимущественно тонкостенные - Возможно содержимое с горизонтальным уровнем, сообщение с бронхами |
|
Изменения плевры |
- Реактивный выпот или эмпиема (утолщение листков плевры, контрастное усиление) - Пневмоторакс (при прорыве полостей) или сочетание его с плевральным выпотом |
|
Лимфатические узлы |
- Увеличение единичных (реактивного типа) - Без структурных изменений (нет кальцинатов, распадов, патологического контрастного усиления) |
|
Общие признаки |
- В подавляющем большинстве случаев - двусторонний процесс и одновременное присутствие всех вышеописанных признаков - Возможны дефекты наполнения в ветвях легочной артерии при контрастировании - Преобразование одних патологических структур в другие с течением времени - Быстрая динамика прогрессирования с формированием полостей распада (без терапии) - Заживление обычно с образованием участков фиброза, реже - бесследное |
Обычно ОРДС развивается при неконтролируемом септическом процессе. Морфологически картина диффузного альвеолярного повреждения при СЭП на КТ выглядит как появление на фоне вышеописанных характерных изменений сливных фокусов и участков «матового стекла» и консолидаций с 2 сторон, которые более тяготеют к ядерным отделам легких или расположены диффузно, возможно сочетание «матовых стекол» с утолщением внутридолькового интерстиция по типу «булыжной мостовой» (рис. 10).
Дифференциальный диагноз СЭП включает ряд заболеваний, где преобладает формирование очагов с полостями распада [34].
Соответствующие дифференциально-диагностические критерии представлены нами в табл. 2.
Важная часть дифференциальной диагностики очаговых поражений — определение характера очагов. СЭП — гематогенный процесс, поэтому наблюдаются гематогенные очаги, а инфильтраты и полости также тяготеют к периваскулярному расположению. Наличие бронхогенных очагов как правило исключает СЭП.
Для дифференциальной диагностики важно проведение КТ в динамике — для СЭП характерно достаточно быстрое течение процесса — преобразование имевшихся очагов и инфильтратов в полости в течении 2-7 суток, появление новых патологических изменений в ранее интактных зонах легких (что отражает рецидивы эмболий, особенно частые при крупных клапанных вегетациях без специфической терапии) (рис. 11) [37]. Это помогает дифференцировать СЭП от таких нозологий, как грибковое поражение легких, при которых полости формируются медленнее, обычно их меньше, а в полостях выявляются грибковые тела в виде симптома «погремушки» — именно множественные мицетомы наиболее схожи с СЭП по данным КТ-картины (рис. 12). Но наличие грибковых тел не является обязательным условием полостей при аспергиллезе, что затрудняет интерпретацию. Не все формы аспергиллеза могут быть похожи на СЭП по КТ- картине — дифференцировки требуют аспергиллемы, а также хроническая полостная форма [42].
Таблица 2
Дифференциальная диагностика септической эмбологенной пневмонии по данным компьютерной томографии органов грудной клетки
|
Нозология |
Основные КТ-признаки |
|
Туберкулез легких |
- Полости ближе к неправильной форме, бухтообразными внутренними контурами, более толстые стенки - Число полостей обычно меньшее, тяготеют к верхним отделам - Очаги бронхогенного обсеменения (!) - При диссеминированных формах - гематогенные очаги, чаще неправильной формы, более кучно расположены - Кальцинаты и бронхоэктазы в легких, кальцинаты внутригрудных лимфатических узлов - Относительно медленная динамика изменений |
|
Грибковое поражение |
- Медленное развитие полостей, чаще - единичные - Симптом «погремушки» - Бронхоэктазы, бронхогенные очаги («дерево в почках» - Симптом «венца» при ангиоинвазивных формах |
|
Гранулематоз с полиангиитом |
- Субплевральные инфильтраты (в том числе с симптомом «венца» и «обратного венца») - Распады на фоне инфильтратов, тонкостенные полости - Гематогенные очаги, округлые образования - Утолщение стенок бронхов, трахеи (!) - Медленное развитие изменений в динамике |
|
Ревматоидные очаги в легких |
- Немногочисленные хаотичные очаги с четкими контурами - Возможны распады в очагах - Инфильтраты и полости не характерны - Медленная динамика появления очагов - Встречается сочетание с интерстициальными проявлениями (UIP/NSIP) |
|
Кавитирующие метастазы |
- Очаги и образования с распадами - обычно, малого или среднего размера, толщина стенки различна - Сочетание с «классическими» солидными метастазами - Инфильтраты и крупные полости не характерны - Медленная динамика в отсутствии химиотерапии |
Примечания: UIP- обычная интерстициальная пневмония; NSIP- неспецифическая интерстициальная пневмония
Наиболее актуальна дифференциация СЭП с туберкулезом легких — подострым гематогенным диссеминированным туберкулезом, а также деструктивными формами. При туберкулезе находят иной вид полостей с более толстыми стенками (чаще — неправильной формы без содержимого внутри, с бухтообразными внутренними контурами, вокруг полости при длитель-
В материале смывов при бронхоскопии — рост кандид, аспергиллном течении наблюдается фиброзная трансформация, в полостях редко имеет место жидкостное содержимое), типично наличие кальцинатов и бронхоэктазов, бронхогенных очагов обсеменения, которые не встречаются при СЭП, значительно более медленная динамика изменений (рис. 13, 14). Не стоит забывать и о нетуберкулезных микобактериозах, так как полостные формы и очаговое поражение могут напоминать КТ-картину СЭП [43]
Множественные двусторонние субплевральные/ перибронхиальные инфильтраты наблюдаются при гранулематозе с полиангиитом (почти в 70% случаев), в толще этих уплотнений возможно формирование асептических распадов без содержимого в просвете или тонкостенных полостей, а у 46,7% больных имеется утолщение стенок сегментарных и субсегментарных бронхов [44]. Как и при СЭП, в легких встречаются очаги (чаще — гематогенного типа) и более крупные образования, уплотнения по типу «венца» и «обратного венца» (рис. 15). В связи с большой схожестью лучевых признаков дифференциальная диагностика в данном случае должна преимущественно основываться на характере клинического течения и сочетанных проявлениях (геморрагический ринит, синусит, поражение почек), а также динамики процесса [45]. Одним из важных дифференциальных КТ-признаков может быть циркулярное утолщение стенки трахеи, в том числе ее мембранозной части, которое не встречается при СЭП [46].
Некротические (ревматоидные) очаги в легких встречаются при системных заболеваниях соединительной ткани (например, при ревматоидном артрите), но крупные полости и инфильтраты при данном процессе практически никогда не формируются. Возможно сочетание очаговых изменений с интерстициальным поражением по типу обычной (UIP) или неспецифической интерстициальной пневмонии (NSIP), что упрощает интерпретацию КТ-картины у впервые обратившихся больных. Преобладает бессимптомное течение — это, напротив, затрудняет постановку диагноза у пациентов, не наблюдающихся у ревматолога по поводу основного заболевания [45, 47].
Различные по размеру полости, чаще с тонкой стенкой, можно обнаружить при кавитирующих метастазах в легких. Возникновение полостей в метастазах связывают с некрозом в их толще (при нарушениях кровоснабжения), мукоидной дегенерацией центра метастаза или клапанным механизмом при наличии связи с бронхами. Распады могут формироваться и под действием химиотерапии [48]. Возможно их сочетание с характерными гематогенными очагами с бугристыми и лучистыми контурами (рис. 16). По данным КТ, кавитирующие метастазы составляют 8,3% всех типов метастазов. Чаще подобные метастазы встречаются при аденокарциномах молочной железы, желудочно-кишечного тракта (преобладает толстая кишка), саркомах, плоскоклеточном раке области головы и шеи (например, носоглотка), шейки матки и др. [49]. В отличие от СЭП, для метастатического поражения не характерны инфильтраты, крупные полости, а динамика изменений значительно более медленная. Клинические проявления данных изменений могут длительно отсутствовать.
Сравнить вид типичных полостей и деструкций в легких по данным КТ при наиболее часто встречающихся нозологиях можно на рис.
С начала пандемии, вызванной вирусом nSARS- CoV2, актуальным видится вопрос о дифференциальной диагностике этих двух заболеваний, так как пациенты с СЭП при первичной госпитализации нередко попадают в стационары для лечения COVID-19 из- за схожей клинической картины (лихорадка, кашель, одышка). В большинстве случаев КТ помогает уже на уровне приемного отделения провести дифференциальную диагностику, с высокой вероятностью позволяя исключить или подтвердить СЭП из-за различной KT-семиотики — при вирусном повреждении не характерна очаговость, формирование полостей, в подавляющем большинстве преобладают участки по типу «матового стекла» субплеврально и по ходу сосудистых пучков в сочетании с ретикулярной исчерченностью или без нее [50-52]. Симптом же «матового стекла» сам по себе не типичен для СЭП. При этом субплевральные консолидации образуются у ряда больных на месте «матового стекла» лишь в динамике и представлены участками организующейся пневмонии или геморрагиями, по данным KT имеют иную форму и сочетаются с тяжами, перилобулярными уплотнениями [53]. Симптом «обратного венца» редко, но можно наблюдать и в остром периоде течения COVID-19, однако уплотнения выглядят по-иному (рис. 18).
Сложности могут возникнуть, когда вирусное повреждение легких сочетается с участками инфарктов на фоне тромбоэмболии легочной артерии (ТЭЛА) [54]. Однако, в отличие от СЭП, инфаркты при ТЭЛА редко бывают множественными, распады на их фоне имеют неправильную форму (не происходит образования характерных полостей) (рис. 19). Распады при инфарктах на фоне ТЭЛА развиваются относительно медленно, а для СЭП характерно быстрое формирование деструкций.
Хотя ИЭ правых отделов сердца является причиной около четверти случаев СЭП, инфицированные тромбы могут попадать в правые отделы сердца и далее в систему легочной артерии и из других источников. Нередко источником септических эмболов являются нагноительные процессы в коже и мягких тканях, реже септический тромбофлебит внутренней яремной вены при инфекции полости рта и глотки (синдром Lemierre), абсцессы полости рта, периферические абсцессы, остеомиелит, инфицированные тромбы периферических вен и полой вены [41, 55]. Диагноз правостороннего ИЭ в этой клинической ситуации наиболее вероятен у наркоманов, использующих внутривенное введение наркотических веществ, или при наличии предрасполагающих заболеваний сердца. Поэтому в протоколе лучевых исследований целесообразно указывать наличие клапанных протезов, а также провода электродов кардиостимулятора как предрасполагающих к ИЭ состояний сердца [56], а также выявленные изменения на уровне сканирования — например, увеличение селезёнки, характерное для ИЭ [33]. СЭП входит в число малых диагностических признаков ИЭ правых отделов сердца, но для верификации ИЭ правых отделов сердца всем больным с СЭП необходимо проведение трансторакальной ЭхоКГ (или чреспищеводной ЭхоКГ при наличии постоянного электрокардиостимулятора) и бактериологического исследования крови в течение 24 часов [17].
Заключение
Для инфекционного эндокардита правых отделов сердца характерна «легочная маска», обусловленная септической эмбологенной пневмонией, возникающей при рецидивирующих эмболиях артерий малого круга инфицированными фрагментами вегетаций. Хотя септическая эмбологенная пневмония не имеет специфических клинических симптомов, множественные быстро меняющиеся легочные очаги и инфильтраты с абсцедированием вызывают подозрение на септическую эмбологенную пневмонию и правосторонний инфекционный эндокардит. В большинстве случаев диагноз септической эмбологенной пневмонии ставится на основании результатов компьютерной томографии грудной клетки. Поэтому данное исследование, наряду с эхокардиографией и бактериологическим исследованием крови, обязательно во всех случаях предполагаемого инфекционного эндокардита правых отделов сердца, а также у всех пациентов с факторами риска правостороннего инфекционного эндокардита (наркомания с использованием внутривенного введения наркотических веществ, постоянный электрокардиостимулятор, программный гемодиализ и др.) при лихорадке неуточненного генеза, сохраняющейся более недели и неспецифических респираторных симптомах.
список источников
1. Lee MR, Chang SA, Choi SH, Lee GY, Kim EK, Peck KR, et al. Clinical Features of Right-Sided Infective Endocarditis Occurring in Non-Drug. Users J Korean Med Sci. 2014;29(6):776-781. PMID: 24932077
2. Yuan SM. Right-sided infective endocarditis: recent epidemiologic changes. Int J Clin Exp Med. 2014;7(1):199-218. PMID: 24482708 eCollection 2014.
3. Чипигина H.C., Шостак H.A., Виноградова Т.Л., Малышева А.М. Инфекционный эндокардит у инъекционных наркоманов. Вестник Российского государственного медицинского университета. 2009;(7):97-101.
4. Cresti A, Baratta Р, De Sensi F, D’Aiello I, Costoli A, Limbruno U. Frequency and Clinical Significance of Right Atrial Embryonic Remnants Involvement in Infective Endocarditis. J Heart Valve Dis. 2017;26(6):700-707. PMID: 30207121
5. Song G, Zhang J, Zhang X, Yang H, Huang W, Du M, et al. Right-sided infective endocarditis with coronary sinus vegetation. BMC Cardiovasc Disord. 2018;18(1):111. PMID: 29866073
6. Rudasill SE, Sanaiha Y, Mardock AL, Khoury H, Xing H, Antonios JW, et al. Clinical Outcomes of Infective Endocarditis in Injection Drug Users. J Am Coll Cardiol. 2019;73(5):559-570. PMID: 30732709
7. Чипигина H.C., Карпова Н.Ю., Аничков Д.А., Кондратьева Т.Б. Инфекционный эндокардит у пожилых - сравнительный анализ клиники, течения и исходов. Рациональная Фармакотерапия в Кардиологии. 2020;16(2):66-174.
8. Моисеев B.C., Кобалава Ж.Д., Писарюк A.C., Мильто A.C., Котова Е.О., Караулова Ю.Л. и др. Инфекционный эндокардит: клиническая характеристика и исходы (7-летний опыт лечения и наблюдения в многопрофильной городской больнице). Кардиология. 2018;58(12):66-75.
9. Frontera JA, Gradon JD. Right-side endocarditis in injection drug users: review of proposed mechanisms of pathogenesis. Clin Infect Dis. 2000;30(2):374-379. PMID: 10671344
10. Revilla A, Lopez J, Villacorta Е, Gomez I, Sevilla T, Angel del Pozo M, et al. Isolated right-sided valvular endocarditis in non-intravenous drug users. Rev Esp Cardiol. 2008;61(12):1253-1259. PMID: 1908096311. Asgeirsson H, Thalme A, Weiland 0. Low mortality but increasing incidence of Staphylococcus aureus endocarditis in people who inject drugs: Experience from a Swedish referral hospital. Medicine (Baltimore). 2019;95(49):e5617. PMID: 27930590
12. Чипигина H.C., Карпова Н.Ю., Тулинов М.М., Головко Е.В., Голоухо- ва Л.М., Корниенко В.С. и др. Первичный инфекционный эндокардит с изолированным поражением клапана легочной артерии, не связанный с наркоманией. Клиницист. 2019;13(1-2):65-71. https:// doi.org/10.17650/1818-8338-2019-13-1-2-65-71
13. Hussain ST, Shrestha NK, Witten J, Gordon SM, Houghtaling PL, Tingleff J, et al. Rarity of invasiveness in right-sided infective endocarditis. J Thorac Cardiovasc Surg. 2018;155(1):54-61. PMID: 28951083
14. Blomstrom-Lundqvist
C, Traykov V, Erba РА, Burri H, Nielsen JC, Bongiorni MG, et al. ESC
Scientific Document Group. European Heart Rhythm Association (EHRA)
international consensus document on how to prevent, diagnose, and treat cardiac
implantable electronic device infections-endorsed by the Heart Rhythm Society
(HRS), the Asia Pacific Heart Rhythm Society (APHRS), the Latin American Heart
Rhythm Society (LAHRS), International Society for Cardiovascular Infectious
Diseases (ISCVID) and the European Society of Clinical Microbiology and
Infectious Diseases (ESCMID) in collaboration with the European Association for
Cardio-Thoracic Surgery (EACTS). Europace. 2020;22(4):515-549. PMID: 31702000
15. Демко И.В., Пелиновская Л.И., Манхаева М.В., Ищенко О.П., Мосина В.А., Крапошина А.Ю., и др. Особенности течения инфекционного эндокардита у инъекционных наркоманов. Российский кардиологический журнал. 2019;(6):97-102.
16. Hatori К, Ohki S, Obayashi T, Yasuhara K, Hirai H, Miki T. Surgical casE of
isolatEd pulmonary valvE Endocarditis in a patiEnt without prEdisposing
factors. Gen Thorac Cardiovasc Surg. 20l8;66(4):235-238. PMID: 28589481
17. Habib G, LancEllotti P, AntunES MJ, Bongiorni MG, Casalta J-P, DeI Zotti F, Et al.; ESC SciEntific DocumEnt Group. 2015 ESC GuidElinES for thE managEmEnt of infEctivE Endocarditis: ThE Task ForcE for thE ManagEmEnt of InfEctivE Endocarditis of thE EuropEan SociEty of Cardiology (ESC). EndorsEd by: EuropEan Association for Cardio- Thoracic SurgEry (EACTS), thE EuropEan Association of NuclEar MEdicinE (EANM).EurHeart J. 20l5;36(44):3075-3l28. PMID: 26320109
18. Чипигинэ H.C., Карпова Н.Ю., Белова М.В., Сэвилов Н.П. Инфекционный эндокардит: трудности диагностики. Клиницист. 2020;14(1- 2):82-90.
19. Столбова М.В., Лисковэ Ю.В., Артемова Н.Э., Сайфутдинов Р.И., Бугрова О.В. Особенности инфекционного эндокардита у инъекционных «солевых» наркоманов. Архивъ внутренней медицины. 2017;7(4):267-270.
20. Swaminath D, Yaqub Y,
Narayanan R, PaonE R, NugEnt К, Arvandi A. IsolatEd Pulmonary ValvE Endocarditis
ComplicatEd with SEptic Emboli to thE Lung Causing PnEumothorax, PnEumonia, and
SEpsis in an IntravEnous Drug AbusEr. J Investig Med High Impact Case Rep.
2013;1(4):2324709613514566. PMID: 26425590
21. Chahoud J, Sharif Yakan A, Saad H, Kanj SS. Right-SidEd InfEctivE Endocarditis and Pulmonary InfiltratEs: An UpdatE. Cardiol Rev. 2016;24(5):230-237. PMID: 26501991
22. Ye R, Zhao L, Wang C, Wu X, Yan H. Clinical charactEristics of
SEptic pulmonary Embolism in adults: a systEmatic rEviEW. Respir Med.
20l4;l08(l):l-8. PMID: 24183289
23. ShmuEli H, Thomas F, Flint N, SEtia G, Janjic A, SiEgEl R. Right-SidEd InfEctivE Endocarditis 2020: ChallEngES and UpdatES in Diagnosis and TrEatmEnt. J Am Heart Assoc. 2020;9(15):e017293. PMID: 32700630
24. Bamford P, Soni R, Bassin L, Kull A. DElayEd diagnosis of right-sidEd valvE Endocarditis causing rECurrEnt pulmonary abscESSEs: a casE rEport. J Med Case Rep. 20l9;l3(l):97. PMID: 30999926
25. Zuo LE, Guo S. SEptic pulmonary Embolism in intravEnous drug usErs. Zhonghua Jie He He Hu Xi Za Zhi. 2007;30(8):569-572. PMID: 17988547
26. Королева И.М., Соколина И.А., Лемешко З.А., Ганина С.С., Кокина Н.И. Лучевая диагностика септической эмболии легких у пациентов с гнойными заболеваниями челюстно-лицевой области. Медицинская визуализация. 2007;(l):69-73.
27. MEndEZ-EchEvarria A,
Coronado-Poggio M, BaquEro-Artigao F, Rosal TD, Rodado-Marina S, Calvo C, Et
al. SEptic pulmonary Emboli dEtECtEd by 18F-FDG PET/CT in childrEn with S.
aurEus cathEtEr- rElatEd bactErEmia. Infection. 2017;45(5):691-696. PMID: 28243995
28. Chou DW, Wu SL, Chung KM, Han SC. SEptic pulmonary Embolism causEd by a KlEbsiElla pnEumoniaE livEr abscESs: clinical charactEristics, imaging findings, and clinical courses. Clinics. 20l5;70(6):400-407. PMID: 26106957
29. Huang RM, Naidich DP, Lubat E, SchinElla R, Garay SM, McCaulEy D. SEptic pulmonary Emboli: CT-radiographic corrElation. AJR Am J Roentgenol. l989;l53(l):4l-45. PMID: 2735296
30. Винокуров A.C., Юдин А.Л., Беленькая О.И. КТ-семиотика септической эмболии легких и ее осложнений. Медицинская визуализация. 2018;22(6):23-32.
31. Тюрин И.Е. Диагностический алгоритм очаговых изменений в легких по данным высокоразрешающей компьютерной томографии. Вестник рентгенологии и радиологии. 2013;(6):44-50.
32. OjEda GomEZ JSA, Carrillo Bayona JA, MoralES CifuEntES LC. SEptic pulmonary Embolism SECondary to KlEbsiElla pnEumoniaE Epididymitis: CasE rEport and LitEraturE rEviEW. Case Rep Radiol. 20l9;20l9:5395090. PMID: 31016062
33. Kuhlman JE, Fishman ЕК, TEigEn C. Pulmonary SEptic Emboli: diagnosis with CT. Radiology. I990;l74(l):2ll-2l3. PMID: 2294550
34. InchaustEgui CA, Wang KY, TEniola 0, RosEn VL. LargE SEptic pulmonary Embolus complicating strEptococcus mutans pulmonary valvE Endocarditis. Radiology Case. 20l8;l2(2):l8-27. PMID: 29875987
35. Iwasaki
Y, Nagata К, Masaki N, Natuhara A, Harada H, Kubota Y, Et al.
Spiral CT findings in SEptic pulmonary Emboli. EJR Eur J Radiol.
200l;37(3):l90-l94. PMID: 11274848
36. AlmEida RR, Marchiori Е, FlorES EJ. FrEquEncy and rEliability of thE rEvErsEd halo sign in patiEnts with SEptic pulmonary Embolism duE to IV substancE use disordEr. AJR Am J Roentgenol. 2020;214(1):59-67. PMID: 31670590
37. Власов П.В., Кармазановский Г.Г., Шейх Ж.В., Вилянин М.Ю. Кисты и кистоподобные образования легких. Медицинская визуализация. 2005;(l):82-94.
38. Богатов А.И., Мустафин Д.Г. Осложненная стафилококковая пневмония у взрослых. Москва: Медицина;1984.
39. 0h GH, Cha SI, Shin KM, Lim JK, Kim HJ, Yoo SS, Et al. Risk factors for
mortality in patiEnts with SEptic pulmonary Embolism. J Infect Chemoter.
20l6;22(8):553-558. PMID: 27346380
40. Jiang J, Liang QL, Liu LH, Cai SO, Du ZY, Kong JL, Et al. SEptic pulmonary Embolism in China: clinical fEaturES and analysis of prognostic factors for mortality in 98 casES. BMC Infectious Diseases. 20l9;l9(l):l082. PMID: 31881849
41. Galili Y, LytlE M, Carlan S, Madruga M. BilatEral pnEumothoracEs: a rarE complication of SEptic pulmonary Emboli in intravEnous drug abusErs. Am J Case Rep. 2018;19:829-832. PMID: 30006503
42. Kosmidis C, DEnning DW. ThE clinical spECtrum of pulmonary aspErgillosis. Thorax. 20l5;70(3):270-277. PMID: 25354514
43. Гаврилов П.В., Арчакова Л.И., Анисимова А.И., Колесниченко О.М. Лучевая семиотика микобактериозов легких, вызванных MycobactErium avium, у имунокомпетентных пациентов. Медицинский альянс. 20l9;(l):3l-37.
44. Соколина И.А., Королева И.М. Возможности компьютерной томографии в диагностике первичных легочных васкулитов. Вестник рентгенологии и радиологии. 20l4;(l):l0-l8.
45. Аверьянов А.В., Лесняк В.Н., Коган Е.А. Редкие заболевания легких: диагностика и лечение. Москва: Медицинское информационное агентство; 2016.
46. MartinEZ F, Chung JH, Digumarthy SR, KannE JP, Abbott GF, 0 ShEpard JA, Et al. Common and uncommon manifEStation of WEgEnEr granulomatosis at chESt CT: radiologic-pathologic corrElation. RadioGraphics. 20l2;32(l):5l-69.
47. AyEr
A, SliESoraitis S, ValEZ R. NEcrobiotic cavitary pulmonary nodulEs: a casE
rEport. J Pulmon Resp Med. 2012;2(4):126.
48. Seo JB, Im JG, Goo JM, Chung MJ, Kim MY. Atypical
pulmonary mEtastasEs: spECtrum of radiologic findings. RadioGraphics.
200l;2l(2):403-4l7.
49. Yu X, Wang P, Liang Zh.
Cavitary pulmonary mEtastasEs: CT fEaturES and thEir corrElation with thE
pathology of thE primary malignancy. Chinese-German J Clin Oncol. 2004;3(l):29-33.
50. Винокуров A.C., Беленькая О.И., Золотова Е.А., Мичурина С.В., Винокурова О.О., Никифорова М.В. и др. Дифференциальная диагностика двусторонних изменений легких на опыте стационара по приему внебольничных пневмоний - не только C0VID-19. Медицинская визуализация. 2020;24(2):78-95
51. SalEhi S, AbEdi A,
Balakrishnan S, GholamrEzanEzhad A. Coronavirus DisEasE 2019 (COVID-19): A
SystEmatic RevIew of Imaging
Findings in 919 PatiEnts. AJR Am J Roentgenol. 2020;2l5(l):87-93. PMID:
32174129
52. REvzin MV, Raza S, Warshawsky R, D’Agostino C, Srivastava NC, BadEr AS, Et al. MultisystEm Imaging ManifEStations of C0VID- 19, Part l: Viral PathogEnEsis and Pulmonary and Vascular SystEm Complications. Radiographics. 2020;40(6):l574-l599. PMID: 33001783
53. Першина E.C., Черняев А.Л., Самсонова М.В., Варясин В.В., Омарова Ж.Р., Перешивайлов С.О. и др. Сопоставление рентгенологической
и патоморфологической картины легких
у пациентов с C0VID-19. Медицинская визуализация. 2020;24(3):37-53.
54. SulEmanE S,
BaltabaEva A, Barron AJ, ChEStEr R, Rahman-HalEy S. AcutE pulmonary Embolism in
conjunction with intramural right vEntricular thrombus in a SARS-CoV-2-positivE
patiEnt. Eur Heart J Cardiovasc Imaging. 2020;2l(9):l054.
55. Goswami U, BrEnES JA, Punjabi GV, LEClairE MM, Williams DN. Associations and OutcomES of SEptic Pulmonary Embolism. Open Respir Med J. 2014;8:28-33. PMID: 25184008
56. Пелиновская Л.И. Особенности современного течения протезного и электродного эндокардитов. Сибирское медицинское обозрение. 20l5;(l):l04-l09.
Информация об авторахЧипигина Наталья Семеновна - врач-рентгенолог отделения магнитно-резонансной томографии и компьютерной томографии, ГБУЗ «ГКБ им. В.П. Демихова ДЗМ», отделения лучевой диагностики ГБУЗ «ММКЦ «Коммунарка» ДЗМ», ассистент кафедры лучевой диагностики и терапии ФГАОУ ВО «РНИМУ им. Н.И. Пирогова»;
Зюзя Юлия Рашидовна - кандидат медицинских наук, доцент кафедры факультетской терапии им. А.И. Нестерова ФГАОУ ВО «РНИМУ им. Н.И. Пирогова»;
Юдин Андрей Леонидович - кандидат медицинских наук, врач-патологоанатом централизованного патологоанатомического отделения и центра борьбы с туберкулезом ГБУЗ ИКБ № 2 ДЗМ, ГБУЗ МНПЦБТ ДЗМ, ФГБУ НМИЦ ФПИ;
Теги: пневмания
234567 Начало активности (дата): 02.10.2023 23:10:00
234567 Кем создан (ID): 989
234567 Ключевые слова: трикуспидальный клапан, тромбоэмболия легочной артерии, электрокардиостимулятор, эхокардиография, обычная интерстициальная пневмония, неспецифическая интерстициальная пневмония
12354567899
Похожие статьи
В Роспотребнадзоре предупредили о росте заболеваемости свиным гриппом типа BРентген на дому 8 495 22 555 6 8
Дифференциальная рентгенодиагностика заболеваний органов дыхания и средостения(часть 24)
Дифференциальная рентгенодиагностика заболеваний органов дыхания и средостения(часть 9)
Оценка динамики цитокинов у пострадавших с осложненными множественными и сочетанными закрытыми повреждениями груди



