 26.08.2023
26.08.2023
Эффективность транспедикулярной репозиции интраканальных костных фрагментов при оскольчатых переломах тела LI позвонка
Прогнозирование эффективного выполнения лигаментотаксиса важно для выбора оптимальной хирургической тактики
ВВЕДЕНИЕ
Травма позвоночника и спинного
мозга - это большое
разрушительное событие с далеко идущими физическими, эмоциональными и экономическими затратами для пациента, семьи и общества в целом [1, 2]. Отмечается увеличение количества
травм, связанных с ДТП (22-70 %), падением с высоты (18-61 %) [3, 4].
Повреждения, осложненные неврологическими расстройствами, составляют 39,2 % в нижнегрудном и 48,5 % - в поясничном отделе позвоночника [5].
Спинной мозг страдает как от первичного, так и от вторичного повреждения после полученной травмы. Если первичное повреждение спинного мозга уже произошло, то на снижение тяжести вторичного повреждения направлены современные терапевтические стратегии. Вторичные механизмы повреждения могут быть вызваны нарушением кровоснабжения [6, 7], электролитным дисбалансом [8, 9], клеточным апоптозом [10].
Декомпрессия спинного мозга с реконструкцией переднего и среднего отделов позвоночника через задний срединный доступ с транспедикулярной фиксацией является безопасным и эффективным методом при лечении переломов грудопоясничного отдела позвоночника [11-13]. Восстановление формы позвоночного канала может быть достигнуто как путем прямого удаления костных фрагментов 14, 15], так и их вправления за счет “эффекта" лигаментотаксиса [16, 17]. Существует мнение, что смещение фрагмента в позвоночный канал не является поводом для хирургического лечения, только совокупность факторов, включающих деформацию и стабильность, актуальна при выборе тактики лечения, так как происходит спонтанное ремоделирование позвоночного канала в процессе консолидации позвонка [18]. Основным фактором, способствующим редукции фрагмента из позвоночного канала, является дистракция, приводящая к напряжению задней продольной связки и задней порции фиброзного кольца диска [19].
Однако не все костные фрагменты могут быть смещены из позвоночного канала с помощью лигаменто- таксиса [20, 21]. Довольно мало исследований, оценивающих эффективность репозиции позвоночника в зависимости от размеров и положения внутриканальных костных фрагментов.
Цель - ретроспективный анализ взаимосвязи между параметрами и положением внутриканальных костных фрагментов при оскольчатых переломах LI позвонка и их влияние на неврологический статус и восстановление передней стенки позвоночного канала с помощью транспедикулярного репозиционного устройства.
МАТЕРИАЛЫ И МЕТОДЫ
Материалом для исследования послужили до- и послеоперационные СКТ-исследования 45 пациентов (25 мужчин, 20 женщин) с позвоночно-спинномозговой травмой на уровне LI позвонка. В исследование включены пациенты с многооскольчатыми переломами, в том числе и внутриканальными костными фрагментами от задней верхней части тела LI позвонка. Критерии исключения: множественные переломы позвонков, нетравматические переломы.
Данное исследование выполнено с соблюдением Хельсинской декларации Всемирной медицинской ассоциации «Этические принципы проведения научных медицинских исследований с участием человека в качестве субъекта» с изменениями от 2000 г. Средний возраст пострадавших - 38,2 ± 3,9 года. По классификации АО: повреждения типа А3 выявлены у 3 пациентов, А4 - у 39, В2 - у 3 больных. В неврологическом статусе степень тяжести повреждения спинного мозга определяли по шкале ASIA. Тип C - у 20, тип D - у 13 и тип E - у 12 пострадавших. Все пациенты оперированы из заднего доступа с использованием 5- или 6-винтовой транспедикулярной конструкции. Имплантировались транспедикулярные винты в тела ThXII, LI, LII позвонков. С помощью репозиционного устройства для чрескостного транспедикулярного остеосинтеза фирмы “Синтез" устранялась угловая деформация поврежденного сегмента позвоночника, выполнялось восстановление высоты поврежденного позвонка и закрытая декомпрессия спинного мозга за счет феномена лигаментотаксиса. У всех пациентов в разной степени добились смещения костных фрагментов из позвоночного канала в вентральном направлении.
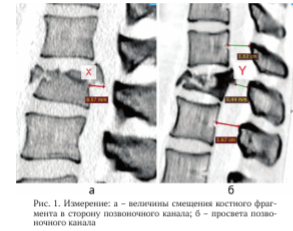
По смещению внутриканального костного фрагмента (X) после операции сформированы 2 группы. Первая группа (n = 25) - смещение костных фрагментов из позвоночного канала составило 50 % и более от размера первоначального смещения; вторая группа (n = 20) - костные фрагменты удалось сместить менее чем на 50 %. Измерение Х представлено на рисунке 1, а. Характеристика сформированных групп по типам повреждения позвоночника, полу, возрасту и неврологическому статусу представлена в таблице 1.
На дооперационных и послеоперационных СКТ-сканах с помощью программы RadiAnt выполняли мультипланарную реконструкцию (формат DICOM). Проводили расчет и оценку дефицита просвета и дефицита площади позвоночного канала на уровне повреждения; измеряли длину и ширину костных фрагментов, заднюю высоту поврежденного и смежных тел позвонков (PVH), угол инверсии костного фрагмента (Р) и угол между нижней кортикальной пластинкой тела ThXII позвонка и кортикальной частью отломка (X); измеряли и рассчитывали поперечный диаметр позвоночного канала (L), ширину костного фрагмента относительно поперечного диаметра позвоночного канала. Для уменьшения погрешности в измерениях все измерения повторены дважды и усреднены.
Характеристика групп сравнения
Таблица 1
|
Группа |
Тип повреждения по АО |
Пол |
Возраст, лет |
Неврологический статус ASIA |
|||||
|
А3 |
А4 |
В2 |
М |
Ж |
С |
D |
E |
||
|
1 |
1 |
22 |
2 |
15 |
10 |
39,6 ± 5,4 |
13 |
9 |
3 |
|
2 |
2 |
17 |
1 |
10 |
10 |
36,5 ± 5,8 |
7 |
4 |
9 |
Измерение просвета позвоночного канала показано на рисунке 1, б. Расчетный диаметр позвоночного канала (Y) на уровне повреждения определялся путем усреднения диаметров позвоночных каналов соседних позвонков выше и ниже уровня повреждения. Дефицит просвета позвоночного канала рассчитывали по формуле (Y-Y1)/ Y х 100 %, где Y1 - размер позвоночного канала на уровне LI позвонка.
Измерение поперечного диаметра позвоночного канала (L) представлено на рисунке 2, а
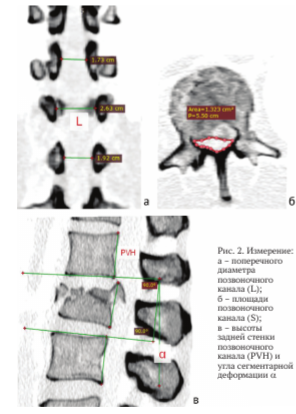
Расчет дефицита площади позвоночного канала проводили по аналогии с дефицитом просвета позвоночного канала. По СКТ в аксиальной проекции на уровне повреждения и смежных уровнях проводилось измерение площади позвоночного канала (рис. 2, б). Расчет дефицита площади проводили по формуле (S-S1)/S х 100 %, где S1 - площадь позвоночного канала на уровне LI позвонка.
Высоту задней стенки позвоночного канала (PVH) на уровне повреждения рассчитывали в процентах от её нормальной высоты. Среднее значение высоты задней стенки выше и нижележащего позвонка регистрировалось как нормальная высота задней стенки поврежденного позвонка (рис. 2, в).
Угол кифотической деформации а измеряли между нижней замыкательной пластинкой тела ThXII и верхней замыкательной пластинкой тела LII позвонка.
Измерение длины и ширины костного фрагмента представлено на рисунке 3.
Угол разворота костного фрагмента (Р) образован пересечением линии вдоль задней стенки поврежденного позвонка и линии на костном фрагменте, как продолжение задней стенки позвонка (рис. 4, а).
В исследование ввели угол (Л), образованный нижней кортикальной пластинкой тела вышележащего позвонка и частью верхней кортикальной пластинки поврежденного позвонка, находящейся на костном фрагменте (рис. 4, б). Нами замечено, что данный угол в процессе репозиции позвоночника практически не меняется.
Статистическая обработка материала проводилась с помощью пакета статистических программ SPSS Statistic ver. 23. Описательная статистика включала расчет средних величин с 95 % доверительным интервалом. Проведен перекрестный статистический анализ измеряемых параметров в двух группах с использованием t-критерия для независимых выборок, однофакторный дисперсионный анализ ANOVA. Разница считалась статистически значимой при p < 0,05.
РЕЗУЛЬТАТЫ
Выявленный неврологический статус у пациентов не зависел от дефицита просвета позвоночного канала, что наглядно представлено на ящичной диаграмме (рис. 5, а).
Методом дисперсионного анализа не получено статистически значимого отличия степени неврологических нарушений от дефицита просвета позвоночного канала (p = 0,27). В первой группе отмечен значимо больший дефицит просвета позвоночного канала (p = 0,018), но это не повлияло на эффективность его реформации.
На ящичной диаграмме (рис. 5, б) представлена зависимость неврологических нарушений от дефицита площади позвоночного канала. Наглядно бросается в глаза больший дефицит площади позвоночного канала при неврологических нарушениях степени C, но статистического подтверждения не получили (р = 0,17). Дефицит площади позвоночного канала превалировал в 1 группе - 47,2 ± 5,8 % против 38,4 ± 6,7 % во 2 группе (р = 0,05). В таблице 2 представлен статистический анализ сравниваемых параметров.
Пациенты с двумя костными фрагментами присутствовали в двух группах. В первой группе этих пациентов было больше: 1,5 ± 0,2 против 1,2 ± 0,2. На неврологический статус не влияет длина (р = 0,5), ширина (р = 0,6) и количество костных отломков (р = 0,48), что отражено на рисунке 6.
Средняя ширина позвоночного канала на уровне LI: в первой группе 22,2 ± 0,34 мм, во второй группе - 22,2 ± 0,38 мм. Учитывая, что у большинства пациентов отмечалось расхождение корней дуг, истинные размеры позвоночного канала на уровне LI составили: в первой группе 22,2 ± 0,34 мм, во второй группе - 22,1 ± 0,38 мм.
Глубина смещения костных фрагментов в позвоночный канал (Х) не повлияла на эффективность проводимой закрытой декомпрессии. Так, в 1 группе значение Х до операции было статистически больше (р = 0,006), а после операции - статистически меньше (р = 0,0001). Возможно, это связано со сроком выполнения операции, т.к. в более поздние сроки репаративные процессы, происходящие в позвоночном канале, ограничивают смещение костных фрагментов.
Таблица 2
Результаты статистического анализа сравниваемых параметров в двух группах до и после операции
|
Параметры (единицы) |
Среднее и 95 % доверительный интервал |
Значимость (Р) |
|
|
Группа 1 |
Группа 2 |
||
|
От травмы до операции (дни) |
6,7 ± 3 (3,6-9,8) |
15,5 ± 5,6 (9,6-21,5) |
0,01 |
|
Количество отломков (1 или 2) |
1,5 ± 0,2 |
1,2 ± 0,2 |
0,01 |
|
Высота отломка (мм) |
14,4 ± 1,2 (13,2-15,5) |
13,9 ± 1,1 (12,8-15,1) |
0,56 |
|
Ширина отломка (мм) |
18,2 ± 2,3 (15,5-20,9) |
22,3 ± 2,6 (19,5-25,1) |
0,03 |
|
Дефицит просвета позвоночного канала (%) |
51,3 ± 4,6 (46,5-56,2) |
42,9 ± 5,0 (37,7-48,1) |
0,018 |
|
Дефицит площади позвоночного канала (%) |
47,2 ± 5,8 (41,2-53,3) |
38,4 ± 6,7 (31,3-45,5) |
0,05 |
|
PVH до операции (%) |
92 ± 1,5 (90,4-93,5) |
93,5 ± 1,5 (92,0-95,0) |
0,15 |
|
Х до операции (мм) |
8,2 ± 0,7 (7,5 - 9,0) |
6,7 ± 0,8 (5,8 - 7,5) |
0,006 |
|
Угол а до операции (градусы) |
-5,9 ± 1,6 (-7,6 - - 4,2) |
-6,6 ± 2,3 (-9,1 - -4,2) |
0,6 |
|
Угол р до операции (градусы) |
31,2 ± 4,2 (26,9-35,8) |
29,8 ± 4,2 (25,2--34,4) |
0,38 |
|
Угол X до операции (градусы) |
42,1 ± 5,0 (36,9-47,4) |
38,9 ± 3,2 (35,4-42,4) |
0,28 |
|
Поперечный диаметр позвоночного канала рассчитанный (мм) |
22,2 ± 0,34 (21,8-22,5) |
22,1 ± 0,38 (21,7-22,6) |
0,81 |
|
Истинный поперечный диаметр позвоночного канала (мм) |
26,0 ± 0,9 (25,1-26,9) |
25,2 ± 1,0 (24,2-26,2) |
0,79 |
|
Ширина костного фрагмента относительно истинного поперечного диаметра позвоночного канала (%) |
69,2 ± 9,2 (59,5-78,9) |
86,2 ± 9,6 (76,1-96,2) |
0,015 |
|
Х после операции (мм) |
3,2 ± 0,5 (2,7-3,8) |
4,9 ± 0,5 (4,3-5,4) |
0,0001 |
|
PVH после операции (%) |
97,7 ± 1,8 (95,7-99,7) |
96,1 ± 2,0 (93,8-98,3) |
0,31 |
|
Угол а после операции (градусы) |
6,1 ± 1,3 (4,8-7,5) |
3,8 ± 2,0 (1,6-6,0) |
0,42 |
|
Угол р после операции (градусы) |
14,8 ± 2,7 (12,0-17,6) |
23,6 ± 4,1 (19,1-28,1) |
0,002 |
|
Угол X после операции (градусы) |
42,6 ± 4,0 (38,5--46,8) |
41,1 ± 4,0 (36,6-45,5) |
0,58 |
|
Средний угол исправления деформации (градусы) |
11,7 ± 1,2 (10,4-13,1) |
10,6 ± 2,8 (7,5-13,7) |
0,85 |
Различия в углах кифотической деформации (а) до операции и после операции были статистически не значимы. В первой группе до операции средний угол составлял 5,9 ± 1,6 градуса, во второй группе - 6,6 ± 2,3 градуса; после операции - 6,1 ± 1,3 и 3,8 ± 2,0 градуса соответственно. Средние углы разворота костных фрагментов (Р) до операции были близки в двух группах (р = 0,38). В первой группе разброс средних величин угла разворота костных фрагментов с 95 % доверительным интервалом составляет 26,9-35,8, во второй группе 25,2-34,4 градуса. После операции угол разворота костных фрагментов значительно уменьшился в первой группе, что привело к лучшей реформации позвоночного канала.
Углы между нижней кортикальной пластинкой тела вышележащего позвонка и кортикальной пластинкой костного фрагмента (X) в двух группах были близки друг к другу (р = 0,28). После операции в первой группе угол практически не поменялся, произошло незначительное, статистически не значимое его увеличение во второй группе с 38,9 ± 3,2 до 41,1 ± 4,0 градусов. Объяснения этому мы не нашли.
Статистически значимой разницы в высоте костных отломков между группами не обнаружено (р = 0,56). Наблюдалась значительная разница между группами по ширине отломка (р = 0,03). Во второй группе средняя ширина отломка 22,3 ± 2,6 мм, против 18,2 ± 2,3 мм в первой. Мы рассчитали отношение ширины костного фрагмента к истинному поперечному диаметру позвоночного канала и также получили статистически больший процент во второй группе (р = 0,015). Если отношение ширины костного фрагмента к истинному поперечному диаметру позвоночного канала составляло более 86,2 ± 9,6 %, то сместить данный фрагмент из позвоночного канала более чем на 50 % не удавалось.
На рисунке 7 представлен клинический пример эффективности транспедикулярной репозиции при оскольчатом переломе тела LI позвонка. С помощью транспедикулярной репозиционной системы удалось восстановить форму и размеры поврежденного тела позвонка и выполнить закрытую декомпрессию спинного мозга.
ОБСУЖДЕНИЕ
Процесс разрушения тела позвонка развивается в определенной последовательности. Причиной такого перелома, по мнению ряда авторов, является обязательное компрессионное воздействие по вертикальной оси с первоначальным разрывом верхней кортикальной пластинки и последующим внедрением внутрь позвонка пульпозного ядра, которое и разрывает тело на отдельные фрагменты [22, 23]. Роль пульпозного ядра в механизме перелома тела позвонка доказана при использовании динамической нагрузки с использованием высокоскоростной кинорадиографии [24]. При нагрузке на пульпозное ядро до 14 142 ± 486 Н ломалась кортикальная пластинка, и костные фрагменты выбрасывало в позвоночный канал со скоростью около 2,9 м/с.
Костные фрагменты, выступающие в позвоночный канал, остаются проблемой, поскольку они могут вызвать неврологический дефицит после травмы. Значительно повышается риск неврологических нарушений при стенозе: 35 % и более для уровня ThXI-ThXII, 45 % и более для уровня LI, 55 % и более для уровня LII-LIII [25].
Разработана шкала оценки риска неврологических осложнений в процессе хирургического лечения пациентов с посттравматической деформацией грудного и поясничного отделов позвоночника [26]. Неврологический дефицит при переломах грудопоясничного отдела позвоночника можно оценить и по данным компьютерной томографии: степени стеноза позвоночного канала, степени компрессии передних отделов тела позвонка, по расстоянию от интраканального костного фрагмента до тела вышележащего позвонка [27].
Влияние костного фрагмента в позвоночном канале на восстановление неврологических нарушений остается неясным за счет того, что со временем происходит резорбция костных фрагментов и ремоделирование позвоночного канала [28].
Декомпрессия позвоночного канала может быть выполнена прямым или непрямым методом. Непрямая декомпрессия позвоночного канала, так называемый лигаментотаксис, тесно связана с задней продольной связкой, средняя ширина которой составила 7,8 мм на уровне LI. А отношение ширины задней продольной связки к ширине тела LI позвонка составило 21 % [29].
Прогнозирование эффективного выполнения лига- ментотаксиса важно для выбора оптимальной хирургической тактики. Трудно оценить целостность задней продольной связки с помощью предоперационной компьютерной или магнитно-резонансной томографии [30], поэтому не всегда точно можно предсказать ожидаемый эффект от лигаментотаксиса.
Немаловажным фактором, влияющим на устранение локальной посттравматической деформации, являются сроки, прошедшие с момента перелома позвонков [31]. Если в течение 72 часов не устранить посттравматическую деформацию, то происходит фиксация порочного положения, и в позвоночном канале развиваются рубцовые сращения [32].
Доказана высокая эффективность закрытой репозиционной декомпрессии при позвоночно-спинномозговой травме в нижнегрудном и поясничном отделе в сроки до 10 дней [33].
Переломы в грудопоясничном отделе с неполными неврологическими нарушениями можно эффективно лечить с помощью непрямой декомпрессии без ламинэктомии [34]. Непрямая декомпрессия позвоночного канала приводит к хорошему ремоделированию позвоночного канала, однако это может не улучшить неврологическое восстановление [35].
Дистракция и лигаментотаксис приводят к восстановлению высоты тела поврежденного позвонка, коррекции кифоза, смещению костных фрагментов из позвоночного канала и, соответственно, расширению канала. Это позволяет проводить непрямую декомпрессию содержимого позвоночного канала без резекции сдавливающих фрагментов [36].
Во время дистракции необходимо стремиться к восстановлению высоты поврежденного позвонка. Так, на модели перелома LIII позвонка показано увеличение напряжения в диске LII-LIII над телом поврежденного позвонка на 154 % (с 0,93 до 2,37 МПа) в случае неполного восстановления высоты тела позвонка [37]. В нашем исследовании задняя стенка поврежденного тела LI позвонка была восстановлена почти на 100 %.
По данным Crutcher et al., с помощью задней дистракции с лигаментотаксисом можно достичь почти 50 %-ного уменьшения стеноза позвоночного канала [38]. Дистракция, независимо от того, применялась ли она до или после коррекции кифоза, была эффективным механизмом смещения костных фрагментов из позвоночного канала [39]. Однако чрезмерное разгибание в поврежденном двигательном сегменте без дистракции может поставить под угрозу смещение внутриканального фрагмента [40].
При исследовании биомеханики непрямого вправления костных фрагментов, выступающих в позвоночный канал, дистракция была определяющим фактором в создании силы в задней продольной связке. Устранение угловой деформации перед дистракцией значительно ослабляет заднюю продольную связку, поэтому рекомендуется выполнять дистракцию перед угловой коррекцией [41]. Средняя сила при дистракции, которая приводила к разрыву задней продольной связки, составляла 48,3 Н в шейном отделе, 61,3 Н - в грудном отделе и 48,8 Н - в поясничном отделе [42].
При оскольчатых переломах тел
позвонков интраканальный костный фрагмент может разворачиваться до 180° так,
что губчатая кость становится обращенной кзади [43]. Это указывает на то, что
свободный костный фрагмент перелома полностью отделен от связки. В этом случае
дистракция может привести к дальнейшему смещению фрагмента в сторону спинного
мозга, что является противопоказанием к выполнению лига- ментотаксиса [44].
Неповрежденное заднее фиброзное кольцо, первоначально прикрепленное к концевой
пластине костного фрагмента, предотвращает разворот фрагмента более чем на 90°,
и в этих случаях показано выполнение лигаментотаксиса [45]. Разрыв задней
продольной связки можно предположить, если по данным компьютерной томографии
дефицит просвета позвоночного канала составляет 52 %, а угол разворота
костного фрагмента 33 градуса [46].
По данным авторов, наблюдается корреляция между размером костного фрагмента и повреждением задней продольной связки [47, 48]. Большие костные фрагменты сопротивлялись вправлению с помощью лигаментотаксиса. Когда ширина костного фрагмента составляла более 75 % поперечного диаметра позвоночного канала, а его высота составляла более 47 % высоты поврежденных позвонков, выполнить закрытую декомпрессию за счет лигаментотаксиса было невозможно [49]. В нашем исследовании при ширине костного фрагмента 86,2 ± 9,6 % от поперечного диаметра удавалось сместить костный фрагмент из позвоночного канала до 50 %. Причиной отсутствия эффекта от лигаментотаксиса, по мнению авторов, является ущемление костного фрагмента в разрыве задней продольной связки. По данным Tan et al., не наблюдалась корреляция между повреждением задней продольной связки, локальным кифозом и степенью компрессии тела позвонка [50].
Расстояние смещения и угол поворота костного фрагмента являются важнейшими параметрами, указывающими на конечное состояние фрагмента в процессе выполнения лигаментотаксиса [51]. Так, если расстояние смещения более 0,85 см и угол поворота превышает 55 градусов, сместить костный фрагмент с помощью лигаментотаксиса Wang et al. не удалось.
ЗАКЛЮЧЕНИЕ
При оскольчатых переломах тела LI позвонка не получено достоверного влияния дефицита просвета и дефицита площади позвоночного канала, длины и ширины внутриканального костного фрагмента на неврологические нарушения типов C, D и E по ASIA.
На закрытую декомпрессию спинного мозга при позвоночно-спинномозговой травме на уровне LI влияла ширина внутриканальных костных фрагментов и
время до начала операции. Сместить данный фрагмент из позвоночного канала более чем на 50 % не удавалось, если отношение ширины костного фрагмента к поперечному диаметру позвоночного канала составляло более 86,2 ± 9,6 %. Если ширина костного фрагмента была менее 69,2 ± 9,2 % к поперечному диаметру позвоночного канала, размер смещения данного фрагмента из позвоночного канала составлял более 50 %.
СПИСОК ИСТОЧНИКОВ
1. Badhiwala JH, Ahuja CS, Fehlings MG. Time is spine: a review of translational advances in spinal cord injury. J Neurosurg Spine. 2018 Dec 20;30(1):1-18. doi: 10.3171/2018.9.SPINE18682
2. Quadri SA, Farooqui M, Ikram A, Zafar A, Khan MA, Suriya SS, Claus CF, Fiani B, Rahman M, Ramachandran A, Armstrong IIT, Taqi MA, Mortazavi MM. Recent update on basic mechanisms of spinal cord injury. Neurosurg Rev. 2020 Apr;43(2):425-441. doi: 10.1007/s10143-018-1008-3
3. Johansson E, Luoto TM, Vainionpaa A, Kauppila AM, Kallinen M, Vaarala E, Koskinen E. Epidemiology of traumatic spinal cord injury in Finland. Spinal Cord. 2021 Jul;59(7):761-768. doi: 10.1038/s41393-020-00575-4
4. Chen J, Chen Z, Zhang K, Song D, Wang C, Xuan T. Epidemiological features of traumatic spinal cord injury in Guangdong Province, China. J Spinal Cord Med. 2021 Mar;44(2):276-281. doi: 10.1080/10790268.2019.1654190
5. Marino RJ, Leff M, Cardenas DD, Donovan J, Chen D, Kirshblum S, Leiby BE. Trends in Rates of ASIA Impairment Scale Conversion in Traumatic Complete Spinal Cord Injury. Neurotrauma Rep. 2020 Nov 13;1(1):192-200.
6. Ziu E, Mesfin FB. Spinal Shock. In: StatPearls [Internet]. Treasure Island (FL), StatPearls Publishing, 2022.
7. Biering-S0rensen F, Biering-S0rensen T, Liu N, Malmqvist L, Wecht JM, Krassioukov A. Alterations in cardiac autonomic control in spinal cord injury. Auton Neurosci. 2018 Jan;209:4-18. doi: 10.1016/j.autneu.2017.02.004
8. Rowland JW, Hawryluk GW, Kwon B, Fehlings MG. Current status of acute spinal cord injury pathophysiology and emerging therapies: promise on the horizon. Neurosurg Focus. 2008;25(5):E2. doi: 10.3171/FOC.2008.25.11.E2
9. Figley SA, Khosravi R, Legasto JM, Tseng YF, Fehlings MG. Characterization of vascular disruption and blood-spinal cord barrier permeability following traumatic spinal cord injury. J Neurotrauma. 2014 Mar 15;31(6):541-552.
10. Chen Y, Liu S, Li J, Li Z, Quan J, Liu X, Tang Y, Liu B. The Latest View on the Mechanism of Ferroptosis and Its Research Progress in Spinal Cord Injury. Oxid Med Cell Longev. 2020 Aug 28;2020:6375938. doi: 10.1155/2020/6375938
11. Rerikh V.V., Baidarbekov M.U., Sadovoi M.A., Batpenov N.D., Kirilova I.A. Surgical treatment of fractures of the thoracic and lumbar vertebrae using transpedicular plasty and fixation. Khirurgiia Pozvonochnika. 2017;14(3):54-61.
12. Шульга А.Е., Зарецков В.В., Лихачев С.В., Смолькин А.А. Дорзальная коррекция грубых посттравматических деформаций грудного отдела позвоночника при позвоночно-спинномозговой травме. Саратовский научно-медицинский журнал. 2018;14(3):611-617.
13. Wu LY, Huang XM, Wang Y, Yang ZB, Su SH, Wang C. [Posterior spinal canal decompression with screw fixation and reconstruction of three vertebral column for thoracolumbar burst fractures complicated with nerve injury]. Zhongguo Gu Shang. 2018 Apr 25;31(4):322-327. Chinese. doi: 10.3969/j.issn.1003-0034.2018.04.006
14. Lutsik A.A., Bondarenko G.Iu., Bulgakov V.N., Epiphantsev A.G. Anterior decompression and stabilization surgery for complicated thoracic and thoracolumbar spinal injuries. Khirurgiia Pozvonochnika. 2012;(3):8-16.
15. Yao Y, Yan J, Jiang F, Zhang S, Qiu J. Comparison of Anterior and Posterior Decompressions in Treatment of Traumatic Thoracolumbar Spinal Fractures Complicated with Spinal Cord Injury. Med Sci Monit. 2020 Nov 19;26:e927284.
16. Усиков В.Д., Куфтов В.С., Ершов Н.И. Тактика хирургического лечения при позвоночно-спинномозговой травме грудного и поясничного отделов позвоночника. Травматология и ортопедия России. 2013;(3):103-112.
17. Ding S, Lu X, Liu Z, Wang Y. Reduce the fractured central endplate in thoracolumbar fractures using percutaneous pedicle screws and instrumentational maneuvers: Technical strategy and radiological outcomes. Injury. 2021 Apr;52(4):1060-1064. doi: 10.1016/j.injury.2020.10.014
18. Moon YJ, Lee KB. Relationship Between Clinical Outcomes and Spontaneous Canal Remodeling in Thoracolumbar Burst Fracture. World Neurosurg. 2016 May;89:58-64. doi: 10.1016/j.wneu.2016.02.010
19. Xue
X, Zhao S. Posterior monoaxial screw fixation combined with
distraction-compression technology assisted endplate reduction for
thoracolumbar burst fractures: a retrospective study. BMC Musculoskelet Disord.
2020 Jan 9;21(1):17.
20. Benek HB, Akcay E, Yilmaz H, Yurt A. Efficiency of Distraction and Ligamentotaxis in Posterior Spinal Instrumentation of Thoracolumbar Retropulsed Fractures. Turk Neurosurg. 2021;31(6):973-979. doi: 10.5137/1019-5149.JTN.34860-21.3
21. Dai J, Lin H, Niu S, Wu X, Wu Y, Zhang H. Correlation of bone fragments reposition and related parameters in thoracolumbar burst fractures patients. Int J Clin Exp Med. 2015 Jul 15;8(7):11125-31.
22. Fields AJ, Lee GL, Keaveny TM. Mechanisms of initial endplate failure in the human vertebral body. J Biomech. 2010 Dec 1;43(16):3126-3131. doi: 10.1016/j.jbiomech.2010.08.002
23. Jackman TM, Hussein AI, Adams AM, Makhnejia KK, Morgan EF. Endplate deflection is a defining feature of vertebral fracture and is associated with properties of the underlying trabecular bone. J Orthop Res. 2014 Jul;32(7):880-886. doi: 10.1002/jor.22620
24. Diotalevi L, Wagnac E, Laurent H, Petit Y. In vitro assessment of the role of the nucleus pulposus in the mechanism of vertebral body fracture under dynamic compressive loading using high-speed cineradiography. Annu Int Conf IEEE Eng Med Biol Soc. 2020 Jul;2020:4717-4720. doi: 10.1109/ EMBC44109.2020.9176150
25. Kim NH, Lee HM, Chun IM. Neurologic injury and recovery in patients with burst fracture of the thoracolumbar spine. Spine (Phila Pa 1976). 1999 Feb 1;24(3):290-293; discussion 294. doi: 10.1097/00007632-199902010-00020
26. Афаунов А.А., Кузьменко А.В., Басанкин И.В., Агеев М.Ю. Шкала оценки риска неврологических осложнений хирургического лечения больных с посттравматическими деформациями грудного и поясничного отделов позвоночника. Кубанский научный медицинский вестник. 2019;26(1):45-57. doi: 10.25207/1608- 6228-2019-26-1-45-57
27. Tang P, Long A, Shi T, Zhang L, Zhang L. Analysis of the independent risk factors of neurologic deficit after thoracolumbar burst fracture. J Orthop Surg Res. 2016 Oct 24;11(1):128. doi: 10.1186/s13018-016-0448-0
28. Meves R, Avanzi O. Correlation among canal compromise, neurologic deficit, and injury severity in thoracolumbar burst fractures. Spine (Phila Pa 1976). 2006 Aug 15;31(18):2137-2141. doi: 10.1097/01.brs.0000231730.34754.9e
29. Salaud C, Ploteau S, Hamel O, Armstrong O, Hamel A. Morphometric study of the posterior longitudinal ligament at the lumbar spine. Surg Radiol Anat. 2018 May;40(5):563-569. doi: 10.1007/s00276-017-1964-2
30. Grenier N, Greselle JF, Vital JM, Kien P, Baulny D, Broussin J, Senegas J, Caille JM. Normal and disrupted lumbar longitudinal ligaments: correlative MR and anatomic study. Radiology. 1989 Apr;171(1):197-205. doi: 10.1148/radiology.171.1.2928526
31. Рерих В.В., Садовой М.А., Рахматиллаев Ш.Н. Остеопластика в системе лечения переломов тел грудных и поясничных позвонков. Хирургия позвоночника. 2009;(2):25-34.
32. Аганесов А.Г. Хирургическое лечение осложненной травмы позвоночника - прошлое и настоящее. Хирургия. Журнал им. Н.И. Пирогова. 2013;(1):5-12.
33. Афаунов А.А., Кузьменко А.В., Басанкин И.В. Дифференцированный подход к лечению больных с травматическими стенозами позвоночного канала на нижнегрудном и поясничном уровне. Инновационная медицина Кубани. 2016;(2):5-16.
34. Zhang Z, Chen G, Sun J, Wang G, Yang H, Luo Z, Zou J. Posterior indirect reduction and pedicle screw fixation without laminectomy for Denis type B thoracolumbar burst fractures with incomplete neurologic deficit. J Orthop Surg Res. 2015 May 29;10:85. doi: 10.1186/s13018-015-0227-3
35. Mohanty
SP, Bhat SN, Ishwara-Keerthi C. The effect of posterior instrumentation of the
spine on canal dimensions and neurological recovery in thoracolumbar and lumbar
burst fractures. Musculoskelet Surg. 2011 Aug;95(2):101-106.
36. Yoshihara H. Indirect decompression in spinal surgery. J Clin Neurosci. 2017 Oct;44:63-68. doi: 10.1016/j.jocn.2017.06.061
37. Jhong
GH, Chung YH, Li CT, Chen YN, Chang CW, Chang CH. Numerical comparison of
restored vertebral body height after Incomplete burst fracture of the lumbar
spine. J Pers Med. 2022 Feb 10;12(2):253.
38. Crutcher JP Jr, Anderson PA, King HA, Montesano PX. Indirect spinal canal decompression in patients with thoracolumbar burst fractures treated by posterior distraction rods. J Spinal Disord. 1991 Mar;4(1):39-48.
39. Fredrickson BE, Mann KA, Yuan HA, Lubicky JP. Reduction of the intracanal fragment in experimental burst fractures. Spine (Phila Pa 1976). 1988 Mar;13(3):267-271. doi: 10.1097/00007632-198803000-00008
40. Fredrickson
BE, Edwards WT, Rauschning W, Bayley JC, Yuan HA. Vertebral burst fractures: an
experimental, morphologic, and radiographic study. Spine (Phila Pa 1976). 1992
Sep;17(9):1012-1021.
41. Harrington RM, Budorick T, Hoyt J, Anderson PA, Tencer AF. Biomechanics of indirect reduction of bone retropulsed into the spinal canal in vertebral fracture. Spine (Phila Pa 1976). 1993 May;18(6):692-699.
42. Tubbs RS, Loukas M, Phantana-Angkool A, Shoja MM, Ardalan MR, Shokouhi G, Oakes WJ. Posterior distraction forces of the posterior longitudinal ligament stratified according to vertebral level. Surg Radiol Anat. 2007 Dec;29(8):667-670. doi: 10.1007/s00276-007-0269-2
43. Arlet V, Orndorff DG, Jagannathan J, Dumont A. Reverse and pseudoreverse cortical sign in thoracolumbar burst fracture: radiologic description and distinction--a propos of three cases. Eur Spine J. 2009 Feb;18(2):282-287.
44. Aebi M. Classification of thoracolumbar fractures and dislocations. Eur Spine J. 2010 Mar;19 Suppl 1(Suppl 1):S2-7. doi: 10.1007/s00586-009- 1114-6
45. Jeong WJ, Kim JW, Seo DK, Lee HJ, Kim JY, Yoon JP, Min WK. Efficiency of ligamentotaxis using PLL for thoracic and lumbar burst fractures in the load-sharing classification. Orthopedics. 2013 May;36(5):e567-574.
46. Chen F, Shi T, Li Y, Wang H, Luo F, Hou T. Multiple parameters for evaluating posterior longitudinal ligaments in thoracolumbar burst fractures. Orthopade. 2019 May;48(5):420-425. English. doi: 10.1007/s00132-018-03679-1
47. Mueller
LA, Mueller LP, Schmidt R, Forst R, Rudig L. The phenomenon and efficiency of
ligamentotaxis after dorsal stabilization of thoracolumbar burst fractures.
Arch Orthop Trauma Surg. 2006 Aug;126(6):364-368.
48. Hu Z, Zhou Y, Li N, Xie X. Correlations between posterior longitudinal ligament status and size of bone fragment in thoracolumbar burst fractures. Int J Clin Exp Med. 2015 Feb 15;8(2):2754-2759
49. Peng Y, Zhang L, Shi T, Lv H, Zhang L, Tang P. Relationship between fracture-relevant parameters of thoracolumbar burst fractures and the reduction of intra-canal fracture fragment. J Orthop Surg Res. 2015 Aug 27;10:131.
50. Tan J, Shen L, Fang L, Chen D, Xing S, Shi G, He X, Wang J, Zhang J, Liao T, Su J. Correlations between posterior longitudinal injury and parameters of vertebral body damage. J Surg Res. 2015 Dec;199(2):552-556.
51. Wang XB, Lu GH, Li J, Wang B, Lu C, Phan K. Posterior Distraction and Instrumentation Cannot Always Reduce Displaced and Rotated Posterosuperior Fracture Fragments in Thoracolumbar Burst Fracture. Clin Spine Surg. 2017 Apr;30(3):E317-E322. doi: 10.1097/BSD.0000000000000192
Информация об авторах:
1. Владимир Дмитриевич Усиков - доктор медицинских наук, профессор
2. Владимир Сергеевич Куфтов - кандидат медицинских наук
Теги: позвоночно-спинномозговая травма
234567 Начало активности (дата): 26.08.2023 13:43:00
234567 Кем создан (ID): 989
234567 Ключевые слова: позвоночно-спинномозговая травма, внутриканальные костные фрагменты, транспедикулярная репозиция
12354567899
Похожие статьи
Анализ среднесрочных результатов оперативного лечения пациентов с нестабильными переломами лодыжек аппаратом ИлизароваРентген на дому 8 495 22 555 6 8
Цифровое моделирование критических состояний эндопротезирования пястно-фалангового сустава
Остеопороз в ракурсе оказания профильной травматолого-ортопедической помощи при низкоэнергетических переломах проксимального отдела бедренной кости



