 12.01.2023
12.01.2023
Злокачественные новообразования ободочной кишки и ректосигмоидного отдела
У 3-5 % пациентов развитие рака ободочной кишки связано с наличием известных наследственных синдромов, наиболее распространенные из которых - синдром Линча, семейный аденоматоз толстой кишки и Mii1YH-ассоциированный полипоз.
Разработчик клинической рекомендации
• Общероссийский национальный союз "Ассоциация онкологов России"
• • Общероссийская общественная организация "Российское общество клинической онкологии"
• • Общероссийская общественная организация "Российское общество специалистов по колоректальному раку"
• • Общероссийская общественная организация "Ассоциация колопроктологов России"
Одобрено Научно-практическим Советом Минздрава РФ
Список сокращений
БДУ - без дополнительных условий
ВОЗ - всемирная организация здравоохранения
КТ - компьютерная томография
ЛФК-лечебная физкультура
МКА - моноклональные антитела
МРТ - магнитно-резонансная томография
ПЦР - полимеразная цепная реакция
ПЭТ - позитронно-эмиссионная томография
ПЭТ-КТ - позитронно-эмиссионная томография, совмещенная с компьютерной томографией
РЭА - раково-эмбриональный антиген УЗИ - ультразвуковое исследование ЭКГ - электрокардиография
ECOG - англ. The ECOG Scale of Performance Status - Критерии оценки по шкале ECOG
MSI - микросателлитная нестабильность
MSI-H - микросателлитная нестабильность высокого уровня
MSS - микросателлитная стабильность
Термины и определения
Предреабилитация (prehabilitation) - реабилитация с момента постановки диагноза до начала лечения (хирургического лечения/химиотерапии/лучевой терапии).
I этап реабилитации - реабилитация в период специализированного лечения основного заболевания (включая хирургическое лечение/химиотерапию/лучевую терапию) в отделениях медицинских организаций по профилю основного заболевания;
II этап реабилитации - реабилитация в стационарных условиях медицинских организаций (реабилитационных центров, отделений реабилитации), в ранний восстановительный период течения заболевания, поздний реабилитационный период, период остаточных явлений течения заболевания.
III этап реабилитации - реабилитация в ранний и поздний реабилитационный периоды, период остаточных явлений течения заболевания в отделениях (кабинетах) реабилитации, физиотерапии, лечебной физкультуры, рефлексотерапии, мануальной терапии, психотерапии, медицинской психологии, кабинетах логопеда (учителя-дефектолога), оказывающих медицинскую помощь в амбулаторных условиях, дневных стационарах, а также выездными бригадами на дому (в т.ч. в условиях санаторно-курортных организаций).
BRAF - ген - v-raf murine sarcoma viral oncogene homolog В1
FOLFIRI - режим химиотерапии - Иринотекан** 180 мг/м2 90-минутная инфузия в 1-й день, кальция фолинат** 400 мг/м2 в/в в течение 2 часов с последующим болюсом фторурацила** 400 мг/м2 в/в струйно и 46-часовой инфузией фторурацила** 2400 мг/м2 (по 1200 мг/м2 в сутки). Начало очередного курса на 15-й день.
11FOLFOX6 - режим химиотерапии - Оксалиплатин** 85 мг/м2 2-часовая инфузия в 1-й день, кальция фолинат** 400 мг/м2 в/в в течение 2 часов с последующим болюсом ФУ** 400 мг/м2 в/в струйно и 46-часовой инфузией ФУ**
2400 мг/м2 (по 1200 мг/м2 в сутки). Начало очередного курса на 15-й день
FOLFOXIRI - режим химиотерапии - Иринотекан** 165 мг/м2 90-минутная инфузия в 1-й день, оксалиплатин** 85 мг/м2 2-часовая инфузия в 1-й день, кальция фолинат** 200 мг/м2 в/ в в течение 2 часов с последующей 46-часовой инфузией фторурацила** 3200 мг/м2. Начало очередного курса на 15-й день
FLOX - режим химиотерапии - Оксалиплатин** 85 мг/м2 в течение 2 часов (дни 1; 15 и 29 каждого цикла) + кальция фолинат** 250 мг/м2 в/в струйно и с последующим болюсом ФУ** 500 мг/м2 еженедельно в течение 6 недель с последующим 2-недельным перерывом
МЕК - ген - Mitogen-activated protein kinase
RAS - гены - NRAS и KRAS -
XELOX - режим химиотерапии - Оксалиплатин** 130 мг/м2 в 1-й день, капецитабин** 825 мг/ м2 2 раза в сутки 1-14 дни. Начало очередного курса на 22-й день
XELIRI - режим химиотерапии - #Иринотекан** 180-200 мг/.лг2 в 1-й день, Якапецитабин** 1600-1800 мг/м2 в сутки в 1-14-й дни. Начало очередного курса на 22-й день
1. Краткая информация
1.1 Определение заболевания или состояния (группы заболеваний или состояний1)
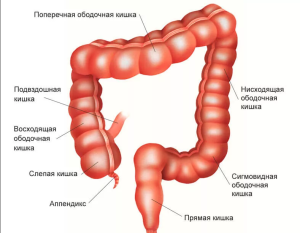
Рак ободочной кишки и ректосигмоидного отдела - злокачественная опухоль, исходящая из слизистой оболочки толстой кишки.
1.2 Этиология и патогенез заболевания или состояния (группы заболеваний или состояний1)
У 3-5 % пациентов развитие рака ободочной кишки связано с наличием известных наследственных синдромов, наиболее распространенные из которых - синдром Линча, семейный аденоматоз толстой кишки и Mii1YH-ассоциированный полипоз. У остальных пациентов рак ободочной кишки и ректосигмоидного отдела носит спорадический характер. В качестве факторов риска развития данной патологии рассматриваются хронические воспалительные заболевания толстой кишки (например, неспецифический язвенный колит, болезнь Крона), курение, употребление алкоголя, преобладание в рационе красного мяса, сахарный диабет, ожирение или повышенный индекс массы тела, низкая физическая активность [1-13].
1.5 Эпидемиология заболевания или состояния (группы заболеваний или состояний1)
Рак ободочной кишки и ректосигмоидного отдела среди других злокачественных опухолей занимает лидирующие позиции по заболеваемости и смертности. В 2017 г. в России зарегистрировано 42 087 новых случаев рака ободочной кишки и 23 022 пациентов умерли от этого заболевания [14].
1.4 Особенности кодирования заболевания или состояния (группы заболеваний или состояний1) по Международной статистической классификации болезней и проблем, связанных со здоровьем
Злокачественное новообразование ободочной кишки (С 18)
С18.0 - Злокачественное новообразование слепой кишки
С18.1 - Злокачественное новообразование червеобразного отростка
С18.2 - Злокачественное новообразование восходящей ободочной кишки
С18.3 - Злокачественное новообразование печеночного изгиба ободочной кишки
С18.4 - Злокачественное новообразование поперечной ободочной кишки
С18.5. - Злокачественное новообразование селезеночного изгиба ободочной кишки
С18.6 - Злокачественное новообразование нисходящей ободочной кишки
С18.7 - Злокачественное новообразование сигмовидной кишки
С18.8 - Поражение ободочной кишки, выходящее за пределы одной и более вышеуказанных локализаций
С18.9 - Злокачественное новообразование ободочной кишки неуточненной локализации Злокачественное новообразование ректосигмоидного соединения (С 19)
1.5 Классификация заболевания или состояния (группы заболеваний или состояний).
Международная гистологическая классификация (всемирная организация здравоохранения (ВОЗ), 2019)
Эпителиальные опухоли
I. Доброкачественные опухоли
a. 8211/0 Тубулярная аденома
b. 8261/0 Ворсинчатая аденома
c. 8263/0 Тубулярно-ворсинчатая аденома
d. 8220/0 Аденоматозный полип
e. 8213/0 Зубчатая дисплазия
II. Интраэпителиальная неоплазия (дисплазия), связанная с хроническими воспалительными заболеваниями кишечника
a. 8148/2 Железистая интраэпителиальная неоплазия высокой степени
b. 8148/0 Железистая интраэпителиальная неоплазия низкой степени
III. Рак
a. 8140/3 Аденокарцинома без дополнительных условий (БДУ)Ц]
b. 8215/5 Зубчатая аденокарпинома[2]
c. 8262/5 Аленомополобная аленокарттинома[5]
d. 8265/5 Микропапиллярная аленокарттинома
e. 8480/5 Муцинозная /слизистая') аденокарпинома[4]
f. 8490/5 Рак с диффузным типом роста[5]
g. 8490/5 Перстневилно-клеточный рак[6]
h. 8560/5 Железисто-плоскоклеточный рак
i. 8510/5 Медуллярный рак[7]
j. 8220/5 Недифференцированный рак БДУ[8]
k. 8055/5 Рак с саркоматоидным компонентом[9]
l. 8240/5 Нейроэндокринная опухоль В/ГУ ш. 8240/5 Нейроэндокринная опухоль G1
п. 8249/5 Нейроэндокринная опухоль G2
о 8249/5 Нейроэндокринная опухоль G5
р. 8246/5 Нейроэндокринный рак БДУ[10] q. 8041 /5 Мелкоклеточный рак
г. 8015/5 Крупноклеточный нейроэндокринный рак
s. 8154/5 Смешанное нейроэндокринно-ненейроэндокринное новообразование!!!]
Согласно Классификации ВОЗ 120191 гистологическая градация аленокарттиномы/рака /исключая нейроэндокринные новообразования') толстой кишки:
• основана на подсчете доли железистых структур в инвазивной опухоли (с игнорированием мелких кластеров и отдельных клеток инвазивного фронта);
• в случае неоднородного строения опухоли оценка осуществляется по наименее дифференцированному компоненту (с игнорированием мелких кластеров и отдельных клеток инвазивного фронта);
• в целях преемственности рекомендуется временно указывать оба показателя, например аденокарцинома низкой степени злокачественности (G2).
Стадирование
Стадирование рака ободочной кишки по системе TNM-8 (2017)
Для рака ободочной и ректосигмоидного отдела толстой кишки используется единая классификация.
Символ Т имеет следующие градации:
Тх - недостаточно данных для оценки первичной опухоли.
Т;8 - преинвазивный рак (интраэпителиальная инвазия или инвазия собственной пластинки слизистой оболочки).
Ti - опухоль распространяется в подслизистый слой стенки кишки
Т2 - опухоль распространяется на мышечный слой без прорастания в стенку кишки.
Тз - опухоль прорастает во все слои стенки кишки с распространением в жировую клетчатку без поражения соседних органов.
В отношении опухолей, расположенных в верхнеампулярном отделе прямой кишки и ректосигмоидном отделе ободочной кишки (покрытых брюшиной), символ Тз обозначает распространение до субсерозы (опухоли не прорастают в серозную оболочку).
Т4 - опухоль прорастает в окружающие органы и ткани или серозную оболочку.
Т4а - прорастание в висцеральную брюшину.
Т4ь - прорастание в другие органы и структуры.
Символ N указывает на наличие или отсутствие метастазов в регионарных лимфатических узлах.
Nx - недостаточно данных для оценки регионарных лимфатических узлов.
No - поражения регионарных лимфатических узлов нет.
Ni - метастазы в 1-3 (включительно) регионарных лимфатических узлах.
Nia — метастазы в 1 регионарном лимфатическом узле.
Nib - метастазы в 2-3 лимфатических узлах.
Nic - диссеминаты в брыжейке без поражения регионарных лимфатических узлов.
N2 - метастазы более чем в 3 регионарных лимфатических узлах.
N2a - поражено 4-6 лимфатических узлов.
N2b - поражено 7 и более лимфатических узлов.
Символ М характеризует наличие или отсутствие отдаленных метастазов.
Мо - отдаленных метастазов нет.
Mi - наличие отдаленных метастазов.
- наличие отдаленных метастазов в 1 органе.
Мщ - наличие отдаленных метастазов более чем в 1 органе.
Mic - метастазы по брюшине.
Группировка по стадиям представлена в таблице 1.
Таблица 1 - Стадии рака толстой кишки
Таблица 2 - Регионарные лимфатические узлы в зависимости от локализации первичной опухоли
При планировании местного иссечения рака ободочной кишки Ti предлагается детальное стадирование заболевания на основании данных магнитно-резонансной томографии (МРТ) и колоноскопии (в сочетании с одномоментным исследованием степени инвазии ультразвуковым методом) по нижеследующим критериям.
Tlsml - глубина инвазии подслизистого слоя до 1/3.
Tism2 - умеренная глубина инвазии подслизистого слоя - до 2/3.
ТцтЗ - полная инвазия опухолью всего подслизистого слоя.
Окончательное стадирование проводится по результатам патолого-анатомического исследования операционного материала.
Стадирование по Haggitt малигнизированных полипов ободочной кишки
Для определения тактики лечения малигнизированных полипов ободочной кишки предлагается стадирование по результатам морфологического исследования.
Уровень 0 - отсутствие инвазивной карциномы.
Уровень I - инвазия в «головку» полипа.
Уровень II - инвазия в «шейку» полипа.
Уровень III - инвазия в «ножку» полипа.
Уровень IV - инвазия в «основание» полипа.
Уровни I—III соответствуют Тismi, а уровень IV может соответствовать Tismi-Tism3.
1.6 Клиническая картина заболевания или состояния (группы заболеваний или состояний1).
Заболевание может манифестировать с симптомов нарушения функции желудочно-кишечного тракта (тошнота, рвота, диарея, запоры, метеоризм, отсутствие аппетита, боли в животе), анемии, снижения веса, слабости, лихорадки, выделения крови и слизи с калом.
Также заболевание может манифестироваться картиной острой или частичной кишечной непроходимости.
[1] Аденокарцинома кишечного типа, без дополнительного уточнения. По степени дифференцировки (и соответствующей степени злокачественности) опухоли делятся на высокодифференцированные/Gl (96-100 % эпителиальных элементов инвазивной опухоли представлено железистыми структурами), умеренно-дифференцированные/С2 (50-95 % эпителиальных элементов инвазивной опухоли представлено железистыми структурами), низкодифференцированные/СЗ (0-49 % эпителиальных элементов инвазивной опухоли представлено железистыми структурами).
[2] При правосторонней локализации опухоль часто ассоциирована с MSI-H.
[3] Нозологическая единица впервые введена комитетом IARC/WHO в МКБ-0 в 2019 г.
[4] Диагноз устанавливается, если >50 % объема опухоли представлено внеклеточной слизью, допустимо наличие перстневидно-клеточных элементов (<50 % всех клеток инвазивной опухоли). Оценка степени дифференцировки аналогична таковой при типичной аденокарциноме. При правосторонней локализации опухоль часто ассоциирована с MSI-H.
[5.] Опухоль всегда соответствует G3.
[6] Диагноз устанавливается, если >50 % клеток опухоли представлено перстневидноклеточными элементами. Опухоль всегда соответствует G3. При правосторонней локализации опухоль часто ассоциирована с MSI-H.
[7] Опухоль всегда соответствует G3. При правосторонней локализации опухоль часто ассоциирована с MSI-H.
[8] Является диагнозом исключения: устанавливается только по результатам дополнительных исследований (иммуногистохимическое исследование при выполнении патолого-анатомического исследования, электронной микроскопии). Соответствует G4.
[9] Нозологическая единица впервые введена комитетом IARC/WHO в МКБ-0 в 2019 г. Является диагнозом исключения, соответствует G3-G4.
[10] Диагноз устанавливается только по результатам по результатам дополнительных исследований (иммуногистохимическое исследование при выполнении патологоанатомического исследования, электронной микроскопии). Всегда соответствует G3.
[11] Диагноз устанавливается только по результатам дополнительных исследований: смешанное нейроэндокринно-ненейроэндокринное новообразование является диморфным раком, сочетающим компоненты аденокарциномы и нейроэндокринного рака/опухоли (доля любого компонента должна составлять не менее 30 %).
2. Диагностика
Критерии установления диагноза/состояния:
Диагноз устанавливается на основании данных жалоб, анамнеза, физикального обследования, морфологического исследования опухолевого материала, данных инструментальных и лабораторных методов обследования.
2.1 Жалобы и анамнез
• Рекомендуется тщательный сбор жалоб и анамнеза пациентов с раком ободочной кишки с целью выявления факторов, которые могут повлиять на выбор тактики лечения [15,16].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Комментарии: у 3-5 % пациентов с раком ободочной кишки развитие заболевания связано с наличием известных наследственных синдромов. Наиболее распространенные из них -синдром Линча, семейный аденоматоз толстой кишки и MutYH-ассоциированный полипоз.
• Рекомендуется собрать семейный анамнез и проанализировать его на соответствие критериям Amsterdam II (Приложение Г1) и рекомендациям Bethesda (Приложение Г2) у всех пациентов с раком ободочной кишки [2,122,123].
Уровень убедительности рекомендаций - А (уровень достоверности доказательств - 2).
Комментарии: соответствие критериям Amsterdam - показание к направлению на консультацию генетика и генетическое тестирование. Соответствие рекомендациям Bethesda - показание к тестированию опухоли на определение микросателлитных повторов ДНК в биопсийном (операционном) материале методом полимеразной цепной реакции (ПЦР) (на микросателлитную нестабильность (MSI).
При выявлении микросателлитной нестабильности высокого уровня (MSI-H) показано направление к генетику, генетическое тестирование. Однако в РФ до 25-30 % пациентов с генетически подтвержденным синдромом Линча не соответствуют критериям Amsterdam II, поскольку у них отсутствует отягощенный семейный анамнез. В этой связи для отбора российских пациентов с подозрением на синдром Линча были разработаны оригинальные критерии (приложение Г), которые учитывают их популяционные особенности [17]. Соответствие рекомендациям - показание к тестированию опухоли на определение микросателлитных повторов ДНК в биопсийном (операционном) материале методом ПЦР (MSI). При выявлении MSI-H показано направление к генетику, генетическое тестирование.
2.2 Физикальное обследование
• Пациентам раком ободочной кишки до начала лечения рекомендуются тщательный физикальный осмотр, включающий пальцевое ректальное исследование, оценка нутритивного статуса, с целью исключения синхронных опухолей прямой кишки и оценки потенциальной переносимости противоопухолевого лечения [15].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• Рекомендуется определение функционального статуса пациента перед началом любого противоопухолевого лечения с целью оценки потенциальной переносимости противоопухолевого лечения [16].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств -5).
2.5 Лабораторные диагностические исследования
• Пациентам с раком ободочной кишки до начала лечения рекомендуется выполнять общий (клинический) анализ крови, анализ крови биохимический (общетерапевтический), когулограмму (ориентировочное исследование системы гемостаза) с целью оценки распространения болезни и потенциальной переносимости противоопухолевого лечения [16,18].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств -5).
• Комментарии: коагулограмму обязательно выполняют пациентам при подготовке к хирургическому лечению, у остальных - при наличии клинических показаний. Анализ крови на маркер РЭА показан всем пациентамна этапе первичного стадирования. Перечень параметров биохимического анализа крови и коагулограммы лечащий врач должен определять для каждого пациента индивидуально с учетом его особенностей.
• Рекомендуется выполнять молекулярно-генетическое исследование мутаций в гене KRAS, NRAS, BRAF и определение микросателлитных повторов ДНК в биопсийном (операционном) материале методом ПЦР, если диагностированы отдаленные метастазы, что может повлиять на выбор таргетного агента в лечении метастатического процесса [39-41,124].
Уровень убедительности рекомендаций А (уровень достоверности доказательств - 2).
• Генетическое тестирование рекомендуется в следующих случаях:
1. Подозрение на синдром Линча. Выполняется молекулярно-генетическое исследование мутаций MLH1, MSH2, MSH6, PMS2 в крови:
о при соответствии пациента критериям Amsterdam II;
о при наличии у пациента родственника 1-й или 2-й линии с установленным диагнозом синдрома Линча;
о при развитии у пациентки рака эндометрия в возрасте до 50 лет.
2. Подозрение на синдром Линча у пациентов, не соответствующих критериям Amsterdam II. При соответствии критериям Bethesda выполняется тестирование опухоли на определение микросателлитных повторов ДНК в биопсийном (операционном) материале методом ПЦР, при выявлении MSI-H - молекулярно-генетическое исследование мутаций в генах MLH1, MSH2, MSH6, PMS2 в крови.
3. Подозрение на семейный аденоматоз. Выполняется молекулярногенетическое исследование мутаций в гене АРС в крови:
о при наличии у пациента более 100 полипов кишечника;
о при наличии у пациента родственника 1-й линии с установленным диагнозом семейного аденоматоза толстой кишки (при наличии родственника с выявленной наследственной мутацией гена APQ.
4. Подозрение на наличие аттенуированной формы семейного аденоматоза (от 20 до 100 полипов). Проводят молекулярно-генетическое исследование мутаций в гене АРС в крови. Mm УН-ассоциированный полипоз - молекулярно-генетическое исследование мутаций в гене МУН в крови - пациенты, у которых выявлено более 20 полипов толстой кишки, но с отрицательным анализом на мутацию АРС:
о пациенты, у которых в семье прослеживается рецессивное наследование семейного аденоматоза;
о пациенты, у которых полипы выявляются в более позднем возрасте (34-44 лет) [2,16,17].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
Комментарии: за исключением MntYH-ассоциированного полипоза и синдрома Блума, все наследственные синдромы, связанные с развитием колоректального рака, носят аутосомно-доминантный характер. При наличии яркого семейного анамнеза злокачественных заболеваний пациентам с исключенным семейным аденоматозным полипозом и синдромом Линча показана консультация генетика для диагностики более редких заболеваний: синдромов Пейтца-Егерса, Ли-Фраумени, Блума, Коудена, ювенильного полипоза, олигодонтии и колоректального рака [2].
• Рекомендуется проводить патологоанатомическое исследование биопсийного (операционного) материала [16].
Комментарий: в морфологическом заключении рекомендуется отразить следующие параметры:
1. Расстояние до проксимального и дистального краев резекции.
2. Размеры опухоли.
3. Гистологический тип опухоли (согласно Классификации ВОЗ).
4. Степень злокачественности опухоли (низкая, высокая).
5. рТ.
6. pN (с указанием общего числа исследованных и пораженных лимфатических узлов).
7. В случае выявления в лимфатическом узле при рутинном окрашивании или иммуногистохимическом исследование при выполнении патологоанатомического исследования i200 изолированных опухолевых клеток считать его метастаз-негативным (N0).
8. Наличие в иериколярной жировой ткани изолированных опухолевых депозитов без иредсуществующих структур лимфатического узла (иначе следует относить к метастазам), сосудистых структур (иначе следует считать сосудистой инвазией) или нервов (иначе следует считать периневральной инвазией).
9. Наличие поражения проксимального края резекции (отрицательный результат также должен быть констатирован).
10. Наличие поражения дистального края резекции (отрицательный результат также должен быть констатирован).
11. Наличие интрамуральной и экстрамуральной сосудистой инвазии (отрицательный результат также должен быть констатирован).
12. Наличие периневральной инвазии (отрицательный результат также должен быть констатирован).
13. Гистологическая градация инвазивного фронта опухоли (tumor-budding) но 3-ступенчатой схеме, а также характера роста аденокарциномы/рака (инфильтративный, экспансивный).
14. Гистологические признаки, значимо ассоциированные с MSI-H (зубчатая, перстневидноклеточная, муцинозная и медуллярная аденокарцинома, интра- и иеритуморальная лимфоидная инфильтрация).
15. Степень регрессии опухоли (TRG1-TRG5) но критериям Mandard (при наличии предшествующего комбинированного лечения) (Приложение ГЗ).
16. Поражение апикального лимфатического узла (отрицательный результат также должен быть констатирован).
• Пациентам с раком ободочной кишки до начала лечения рекомендуется выполнять исследование уровня ракового эмбрионального антигена в крови (РЭА) с целью оценки прогноза заболевания [18].
Уровень убедительности рекомендаций - А (уровень достоверности доказательств - 1).
2.4 Инструментальные диагностические исследования
• Пациентам раком ободочной кишки до начала лечения рекомендуется выполнять колоноскопию с взятием биопсийного материала - наиболее информативное исследование при раке ободочной кишки, позволяющее непосредственно визуализировать опухоль, определить ее размеры, локализацию и макроскопический тип, оценить угрозу осложнений (кровотечения, перфорации), а также получить материал для морфологического исследования. Для получения достаточного количества материала требуется выполнить несколько (3-5) взятий биопсийного материала стандартными эндоскопическими щипцами [16,19, 20].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств -5).
Комментарии: план лечения не следует составлять до получения данных патологоанатомического исследования биопсийного материала. При подслизистом инфильтративном росте опухоли возможен ложноотрицательный результат, что требует повторного взятия биопсийного материала.
Чувствительность и специфичность метода возрастает при использовании современных технологий эндоскопической визуализации (увеличительной эндоскопии, узкоспектральной эндоскопии, хромоэндоскопии, флуоресцентной диагностики).
• Пациентам с установленным диагнозом рака ободочной кишки при невозможности выполнения тотальной колоноскопии рекомендуется с целью исключения синхронных опухолей выполнять ирригоскопию или КТ-колонографию до начала лечения, либо тотальную колоноскопию в течение 3-6 месяцев после операции [19-22].
Уровень убедительности рекомендаций - А (уровень достоверности доказательств - 2).
Комментарии: в 4-5 % случаев встречаются синхронные образования, которые могут быть пропущены при иалыгаторной ревизии на операции [15, 16]. Поэтому полное обследование толстой кишки рекомендуется всем пациентам до хирургического лечения, при технической невозможности - не позднее 6 мес. после хирургического лечения.
КТ-колонография имеет большую но сравнению с ирригосконией чувствительность в выявлении полипов, особенно в проксимальных отделах толстой кишки [21 ].
• Пациентам, страдающим раком ободочной кишки до начала лечения рекомендуется выполнять КТ органов брюшной полости с внутривенным контрастированием, при невозможности - ультразвукового исследования (УЗИ) органов брюшной полости и забрюшинного пространства с целью исключения метастатического поражения органов брюшной полости [23].
Уровень убедительности рекомендаций - А (уровень достоверности доказательств - 1).
Комментарии: КТ органов брюшной полости в большинстве развитых стран является стандартом уточняющей диагностики при раке ободочной кишки. Выполнение только УЗИ брюшной полости допустимо только при технической невозможности проведения КТ.
• Пациентам, страдающим раком ободочной кишки, до начала лечения рекомендуется выполнять рентгенографию грудной клетки в 2 проекциях либо КТ органов грудной клетки с целью исключения метастатического поражения органов грудной клетки [16, 24].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Комментарии: КТ органов грудной клетки в большинстве развитых стран является стандартом уточняющей диагностики при раке ободочной кишки для исключения метастазов в легких, лимфатических узлы средостения. На практике данное исследование может быть отчасти заменено у пациентов с небольшой местной распространенностью опухолевого процесса.
• Рекомендуется при раке ректосигмоидного отдела толстой кишки до начала лечения выполнять МРТ малого таза либо КТ малого таза с внутривенным контрастированием с целью оценки распространения опухоли [25, 26].
Уровень убедительности рекомендаций - А (уровень достоверности доказательств - 2)
Комментарии: выполнение МРТ малого таза предпочтительнее, так как позволяет осуществить более детальную предоперационную оценку местного распространения опухолевого процесса.
• Всем пациентам с раком ободочной кишки до начала лечения, рекомендуется выполнять электрокардиографию (ЭКГ) с целью оценки потенциальной переносимости противоопухолевого лечения [27].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• Рекомендуется выполнять эндоскопическое ультразвуковое исследование при планировании местного иссечения раннего рака и ворсинчатых опухолей ободочной кишки [28, 29].
Уровень убедительности рекомендаций - А (уровень достоверности доказательств - 1).
• Рекомендуется оценивать резектабельность метастазов в печени по данным МРТ брюшной полости с внутривенным контрастированием или компьютерной томографии (КТ) органов брюшной полости с внутривенным контрастированием. Рекомендуется выполнять МРТ органов брюшной полости с внутривенным контрастированием при планировании резекции печени в случаях, когда КТ с внутривенным контрастированием не позволяет в полной мере оценить распространенность процесса в печени [30-32].
Уровень убедительности рекомендаций - А (уровень достоверности доказательств - 1).
Комментарии: для оценки резектабельности метастазов колоректального рака в печени предпочтительна МРТ органов брюшной полости с внутривенным контрастированием. У пациентов с противопоказаниями к использованию внутривенного контрастирования возможно выполнение МРТ в режиме DWI. МРТ позволяет у 10-20 % пациентов выявить не определяемые но данным УЗИ метастазы и сократить количество эксплоративных операций и операций в объеме R2 [33]. Пациентам с противопоказаниями к проведению МРТ рекомендуется выполнение КТ с внутривенным контрастированием или ПЭТ-КТ. МРТ обладает наиболее высокой чувствительностью по сравнению с другими диагностическими методами, в особенности в отношении метастазов размером <1 см [32].
Не допускается планирование резекции метастазов на основании только данных УЗИ печени или КТ без внутривенного контрастирования.
• Рекомендуется выполнять остеосцинтиграфию при подозрении на метастатическое поражение костей скелета [34].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств -5).
• Рекомендуется биопсия лимфатических узлов, подозрительных в отношении метастатических очагов, выполнять под контролем УЗИ или КТ, если их верификация принципиально меняет тактику лечения [35].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств -5).
• Рекомендуется выполнять ПЭТ-КТ при подозрении на метастазы по данным КТ или МРТ, если их подтверждение принципиально меняет тактику лечения [31, 36].
Уровень убедительности рекомендаций - В (уровень достоверности доказательств - 2).
Комментарии: мета-анализ рандомизированных исследований по определению необходимости выполнения ПЭТ-КТ для исключения экстрапеченочных метастазов при решении вопроса о необходимости метастазэктомии печени показал, что данный метод обследования меняет тактику лечения у 8 % пациентов и не влияет на общую выживаемость [36].
• Рекомендуется выполнять лапароскопию при подозрении на диссеминацию опухоли по брюшине, если ее выявление принципиально меняет тактику лечения [37].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 2).
• Рекомендуется выполнять МРТ или КТ головного мозга с внутривенным контрастированием при подозрении на метастатическое поражение головного мозга [12, 35].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств -5).
2.5 Иные диагностические исслелования
• Рекомендуется пациентам с подозрением на рак ободочной кишки при сомнительном результате биопсии выполнить взятие биопсийного материала повторно для исключения или подтверждения наличия рака прямой кишки [1].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5)
• Рекомендуется пациентам при положительном результате биопсии в заключении указывать гистологический тип опухоли и степень её дифференцировки для определения оптимальной тактики лечения [1].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5)
• Рекомендуется пациентам с подозрением на рак ободочной кишки при отрицательном результате биопсии (диагноз новообразования не верифицирован) для определения тактики лечения принимать решение о необходимости выполнения повторной биопсии индивидуально, с учётом наличия признаков злокачественного роста по данным эндоскопических и рентгенологических методов обследования [1].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5)
• Рекомендуется при подготовке к хирургическому лечению в целях выбора алгоритма лечения пациента и оценки его функционального статуса выявлять сопутствующие заболевания у пациента с проведением необходимых диагностических исследований в соответствии с клиническими рекомендациями по данным заболеваниям, состояниям [38].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств -5).
Комментарий: проводятся эхокардиография, холтеровское мониторирование сердечной сердечного деятельностиритма, исследование функции внешнего дыхания, УЗДГ сосудов шеи и нижних конечностей, консультации вра-ча-кардиолога, врача-эндокринолога, врача-невропатолога и других профильных специалистов.
3. Лечение
Назначение и применение лекарственных препаратов, указанных в клинических рекомендаций, направлено на обеспечение пациента клинически эффективной и безопасной медицинской помощи, в связи с чем их назначение и применение в конкретной клинической ситуации определяется в соответствии с инструкциями по применению конкретных лекарственных препаратов с реализацией представленных в инструкции мер предосторожности при их применении, также возможна коррекция доз с учетом состояния пациента.
• Рекомендуется рассматривать хирургическое вмешательство как основной метод радикального лечения пациентов раком ободочной кишки или ректосигмоидного отдела толстой кишки [16].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Комментарии: по показаниям дополнительно проводится адъювантная/неоадъювантная химиотерапия.
• При раннем раке ободочной кишки 0-1 стадии (TiS-TismiNoMo) рекомендуется рассмотреть возможность применения органосохраняющих и функционально-щадящих способов лечения (эндоскопическая резекция слизистой оболочки с диссекцией в подслизистом слое) с высокой эффективностью [43,44].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 4) .
Комментарии: при определении тактики лечения следует учитывать факторы прогноза. Предпочтение следует отдавать методике эндоскопической подслизистой диссекции [42]. При выявлении после эндоскопического удаления факторов негативного прогноза выполняют резекцию соответствующего участка ободочной кишки.
Факторы негативного прогноза:
° стадия >Gj,
о поражение краев резекции,
о лимфатическая, сосудистая или периневральная инвазия,
о IVуровень инвазии (вовлечение подслизистой оболочки толстой кишки), >pTjsmi.
Эндоскопическая резекция слизистой оболочки допускается при инвазивных формах рака ободочной кишки (уровни I-III по классификации Haggitt) при отсутствии факторов негативного прогноза. Выявление по данным патологоанатомического исследования биопсийного материала низкой степени дифференцировки опухоли и/или определение при эндоскопическом исследовании уровня IV по классификации Haggitt и/или глубины инвазии
>uTismi (при эндоУЗИ) является абсолютным противопоказанием к выполнению эндоскопической резекции слизистой оболочки (требуется удаление сегмента кишки). Наличие инвазивного рака в полипах на широком основании
(>Т/,„,/) приравнивается к уровню IV по классификации Haggitt и требует резекции соответствующего участка ободочной кишки. Остальные факторы негативного прогноза (поражение краев резекции, лимфатическая, сосудистая, периневральная инвазия) определяются после эндоскопической резекции. При их выявлении осуществляют дополнительную резекцию соответствующего сегмента кишки. Адъювантная терапия не проводится [45].
• При резектабельном локализованном и местно-распространенном раке ободочной кишки I—III стадий (Tism2-T4No-2Mo) рекомендуется при отсутствии абсолютных противопоказаний на 1-м этапе проводить хирургическое лечение; объем операции определяется локализацией и местным распространением опухоли [46].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5) .
• При резектабельном локализованном и местно-распространенном раке ободочной кишки П-Ш стадий (Ti_4Ni_2Mo, T4N0-2M0) адъювантную химиотерапию рекомендуется проводить при выявлении поражения регионарных лимфатических узлов, прорастании
опухолью серозной оболочки (рТ4а), врастании в соседние органы (рТ4ь) и наличии факторов риска (см. пункт «Адъювантная химиотерапия») [47].Уровень убедительности рекомендаций - А (уровень достоверности доказательств - 1).
• При нерезектабельном раке ободочной кишки (T4N0-2M0) рекомендуется направлять пациентов в крупные медицинские организации, в которых имеется опыт лечения данной группы пациентов, для повторной оценки возможности удаления опухоли [48].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств -5).
Комментарии: при невозможности проведения хирургического лечения в объеме R0-1 операции возможны только при высоком риске развития кишечной непроходимости и ограничиваются формированием обходных анастомозов/колостомы/илеостомы. В дальнейшем пациентам показана паллиативная химиотерапия.
• При генерализованном раке ободочной кишки с резектабельными/потенциально резектабельными синхронными метастазами в печени или легких (Mia) рекомендуется при исходной возможности выполнения RO-резекции метастазов рака ободочной кишки в печени или легких, а также при переходе метастатического поражения этих органов в резектабельное состояние в процессе химиотерапевтического лечения проводить резекцию указанных органов с метастазами в объеме R0 [16, 49-51, 125].
Уровень убедительности рекомендаций - В (уровень достоверности доказательств - 2).
• Рекомендуется тактику лечения всех пациентов с изолированным метастатическим поражением печени/легких на долечебном этапе обсуждать совместно с торакальными хирургами/абдоминальными хирургами/хирургами, специализирующимися на хирургии печени с целью корректной и своевременной оценки резекгабельности метастатических очагов [16, 52, 53].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств -5).
Комментарии: тактика лечения зависит от исходной резектабельности метастатических очагов. Наилучших результатов возможно добиться при достижении края резекции >1 мм [49-52]. Операцию в объеме R0 необходимо выполнять, как только метастазы станут резектабельными. Пролонгация химиотерапии может приводить к повышению частоты токсических поражений печени, а также к «исчезновению» части метастазов, которое затрудняет их идентификацию хирургом во время резекции. При наличии симптомной первичной опухоли (при угрозе кишечной непроходимости или кровотечения) на 1-м этапе проводится хирургическое удаление первичной опухоли с лимфодиссекцией. Радиочастотная аблация метастазов в печени или стереотаксическое лучевое воздействие может стать как дополнением к резекции печени для достижения радикальности вмешательства, так и самостоятельным методом при невозможности хирургического лечения [54]. Внутриартериальная химиотерапия остается экспериментальным методом и не рекомендована к рутинному применению в 1-й линии терапии.
• При исходно резектабельных метастатических очагах рекомендуется их хирургическое удаление, при этом в случае функциональной переносимости предпочтение отдается одномоментным хирургическим вмешательствам [16,49-52].
Уровень убедительности рекомендаций - В (уровень достоверности доказательств - 2).
• При исходно резектабельных метастатических очагах после успешного проведения резекции в объеме R0 или R1 рекомендуется проведение адъювантной химиотерапии (6 мес. лечения по схеме FOLFOX, XELOX, применение фгорпиримидинов в монорежиме) [54, 55].
Уровень убедительности рекомендаций - А (уровень достоверности доказательств - 1).
Комментарии: альтернативой немедленному хирургическому лечению является проведение периоперационной системной химиотерапии (FOLFOX, XELOX). Данный вариант стратегии
выбирается при высоком риске прогрессирования заболевания (например, высоком риске по классификации Fong или любой другой). После 4-6 циклов выполняется одновременное или последовательное удаление метастазов и первичной опухоли, а после операции продолжается проводимая ранее химиотерапия до достижения суммарной продолжительности 6 мес. Добавление моноклональных антител к химиотерапии при резектабельных метастазах в печень не показано, так как оно может ухудшить отдаленные результаты [51, 53].• При потенциально резектабельных метастатических очагах рекомендуется проведение максимально активной химиотерапии, цель которой - достижение объективного эффекта и переход нерезекгабельных метастазов в резектабельные (FOLFOX, XELOX или FOLFIRI, XELIRI, FOLFOXIRI) [16,42,54, 57, 58,111-113].
Уровень убедительности рекомендаций - А (уровень достоверности доказательств - 1).
Комментарии: оптимальной опцией для повышения резектабельности является применение «тройной» комбинации FOLFOXIRI [57, 58]. После 4-6 циклов выполняется повторная оценка резектабельности, при отсутствии прогрессирования - одновременное или последовательное удаление метастазов и первичной опухоли. Далее проводится адъювантная химиотерапия но программе FOLFOX или XELOX до достижения суммарной продолжительности 6 мес. (с учетом предоперационной химиотерапии). В случае прогрессирования метастатических очагов или невозможности их удаления лечение проводят в соответствии с принципами, которые указаны в пункте, описывающем лечение пациентов с нерезектабельными метастазами [16].
• При потенциально резектабельных метастатических очагах в случае отсутствия мутации RAS и BRAF рекомендуется рассмотреть добавление к режимам химиотерапии FOLFIRI, или FOLFOX, или FOLFOXIRI цетуксимаба** или панитумумаба** независимо от локализации первичной опухоли [16, 39-42, 57].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств -5).
• При потенциально резектабельных метастатических очагах при наличии мутации RAS рекомендовано рассмотреть добавление бевацизумаба** к любому из указанных выше режимов химиотерапии независимо от локализации первичной опухоли [16, 39,42, 59].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств -5).
• При потенциально резектабельных метастатических очагах при наличии мутации BRAF рекомендован режима химиотерапии FOLFOXIRI с применением моноклональных антител (МКА) (бевацизумаба** или цетуксимаба** или панитумумаба**) [16, 57, 58].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств -5).
Комментарии: в случае назначения таргетных препаратов после перехода метастазов в резектабельное состояние и выполнения RO-резекции метастатических очагов проводится химиотерапия до достижения суммарной продолжительности 6 мес. Цетуксимаб**, панитумумаб**, бевацизумаб** и иринотекан** следует в послеоперационном периоде отменить.
При резекции в объеме R1-R2 возможно продолжение терапии предоперационной комбинацией химиопрепаратов и МКА до достижения суммарной продолжительности 6 мес.
• При генерализованном раке ободочной кишки с незеректабельными синхронными метастазами рекомендуется применение комбинаций химиопрепаратов (FOLFOX, XELOX, XELIRI, FOLFIRI, FOLFOXIRI) с или без добавлением таргетных препаратов (цетуксимаб**, панитумумаб**, бевацизумаб**) [16].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств -5).
Комментарии: цетуксимаб** или панитумумаб** применяются при отсутствии мутации RAS и BRAF и локализации первичной опухоли в левых отделах толстой кишки (границей которых считают селезеночный изгиб ободочной кишки), бевацизумаб** - вне зависимости от статуса RAS и BRAF и локализации первичной опухоли [16, 40, 42]. Цетуксимаб** и панитумумаб** не должны применяться в комбинации с капецитабином** (монотерапия
капецитабином, режимы XELOX и XELIRI) или струйными режимами аналогов пиримидина (режим Мейо, FLDX). Цель лечения - максимально длительный контроль заболевания при сохранении удовлетворительного качества жизни; у ряда пациентов возможно добиться перехода нерезектабельных метастазов в резектабельные. В процессе химиотерапии каждые 1,5-2 мес. проводится повторная оценка резектабельности.Различные методы эмболизации печеночной артерии, внутриартериальная химиотерапия могут применяться у отдельных пациентов с изолированным или преобладающим метастатическим поражением печени при исчерпании возможностей системной терапии. Вопрос об удалении первичной опухоли решается индивидуально с учетом риска развития связанных с ней осложнений. Пациенты, у которых ответ на лечение недостаточен для перехода метастазов в резектабельное состояние, подлежат паллиативному лекарственному лечению (см. раздел 3.3).
• В случае метахронных резектабельных или потенциально резектабельных метастазов рака ободочной кишки в печени или легких рекомендуется выполнять операцию с адъювантной химиотерапией в течение 6 мес. (FOLFOX или XELOX) или пери-операционную химиотерапию FOLFOX или XELOX (в течение 3 мес. до операции и 3 мес. после нее), если ранее адъювантная химиотерапия не проводилась или с момента ее окончания прошло более 12 мес. В остальном лечение проводят в соответствии с принципами, описанными выше [16, 55, 56].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• При функционально-неоперабельном раке ободочной кишки (на фоне тяжелой сопутствующей патологии) рекомендуется проведение паллиативного противоопухолевого лекарственного лечения либо симптоматической терапии (см. раздел 3.3). Возможно стентирование опухоли или формирование разгрузочной кишечной стомы [60,114,115].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 2).
Комментарии: риск, связанный с проведением операции, превышает риск, связанный с прогрессированием онкологического заболевания. Решение о наличии противопоказаний к хирургическому лечению может приниматься
только на консилиуме с участием хирурга, терапевта, анестезиолога, реаниматолога.
• При рецидиве рака ободочной кишки рекомендовано рассмотреть возможность повторного хирургического лечения [61, 62]; при невозможности проведения повторного хирургического лечения рекомендована системная химиотерапия (см. раздел 3.3).
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 4).
Комментарии: в сложных клинических случаях лечебную тактику определяют на мулыпидисциплинарном консилиуме с участием проктолога, абдоминального хирурга, врач-радиотерапевт и онколога на основании результатов дооперационного обследования с определением клинической стадии заболевания.
3.1 Хирургическое лечение
• Эндоскопическое лечение раннего рака ободочной кишки рекомендуется при:
о тубулярно-ворсинчатых аденомах с дисплазией эпителия тяжелой степени; о аденокарциномах с инвазией в пределах слизистого и подслизистого слоя по данным эндоскопического УЗИ;
о аденокарциномах с умеренной или высокой степенью дифференцировки [16, 29].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 4).
Комментарии: противопоказания:
о низкодифференцированная или слизистая аденокарцинома;
Возможные варианты:
• эндоскопическая полипэктомия;
• эндоскопическая подслизистая резекция.
Наиболее частые осложнения - болевой синдром, кровотечение, перфорация.
Следует учитывать, что при последующем патологоанатомическом исследовании материала эндоскопически резецированного раннего рака ободочной кишки будут выявлены пациенты, которым потребуется резекция соответствующего участка толстой кишки, например стадия >pTlsml, или поражение краев резекции)
• Не рекомендуется рутинная механическая подготовка кишечника [63].
Уровень убедительности рекомендаций - А (уровень достоверности доказательств - 1).
Комментарии: в приведенных в списке литературы исследованиях установлено, что механическая подготовка кишечника не влияла на частоту осложнений, однако она может выполняться по усмотрению оперирующего хирурга [63].
• Рекомендуется при технической доступности и наличии хирургической бригады соответствующей квалификации проводить хирургическое лечение рака ободочной кишки с использованием лапароскопического доступа [29, 64-67,116].
Уровень убедительности рекомендаций - А (уровень достоверности доказательств -
1).Комментарии: лапароскопические резекции ободочной кишки гсмеют ряд прешгуществ: ранняя реабилитация пациентов, снижение частоты развития спаечного процесса и его выраженности, меньшее использование опиоидных анальгетиков, сокращение сроков госпитализации, меньший риск развития послеоперационных грыж [64-67]. Диссекция должна осуществляться вдоль эмбриональных (фасциальных) слоев со стремлением к обеспечению целостности фасции мезоколона.
• Рекомендуется при локализации опухоли в слепой, восходящей ободочной кишке, печеночном изгибе ободочной кишки, проксимальной трети поперечной ободочной кишки выполнять правостороннюю гемиколэктомию или расширенную правостороннюю гемиколэктомию с обязательным лигированием у основания a. ileocolica, a. colica dextra, а также a. colica media у основания либо правой ветви a. colica media [64-67].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств -5).
• Рекомендуется при локализации опухоли в средней трети поперечной ободочной кишки решение об объеме хирургического вмешательства принимать индивидуально с учетом возраста, сопутствующих заболеваний, размеров и распространенности опухоли. Допустима резекция поперечной ободочной кишки, расширенная право- или левосторонняя гемиколэкгомия (в зависимости от более точной локализации опухоли), однако предпочтительный объем - субтотальная колэктомия [62-65].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств -5).
• Рекомендуется при локализации опухоли в дистальной трети поперечной ободочной кишки, селезеночном изгибе ободочной кишки, нисходящей ободочной кишке, проксимальной трети сигмовидной кишки выполнять левостороннюю гемиколэктомию или расширенную левостороннюю гемиколэктомию с лигированием a. colica sinistra у места отхождения, а также левой ветви a. colica media либо самой a. colica media у места отхождения [64-67].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств -5). •
• Рекомендуется при локализации опухоли в средней трети сигмовидной кишки выполнять резекцию сигмовидной кишки или операцию типа Гартмана (при наличии противопоказаний к формированию первичного анастомоза) с лигированием нижней брыжеечной артерии [64-67].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• Рекомендуется при локализации опухоли в дистальной трети сигмовидной кишки выполнять резекцию сигмовидной кишки с чрезбрюшной резекцией прямой кишки или операцию типа Гартмана с лигированием нижней брыжеечной артерии у основания либо непосредственно дистальнее уровня отхождения левой ободочной артерии [64-67].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств -5).
• Рекомендуется соблюдение края резекции >10 см от опухоли при операциях по поводу рака ободочной кишки, >5 см - при операциях по поводу рака дистальной трети сигмовидной кишки и ректосигмоидного отдела толстой кишки [64-67].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств -5).
• Комментарии: необходимо учитывать тот факт, что объем оперативного
вмешательства не должен различаться при экстренном и плановом хирургическом лечении рака ободочной кишки, поэтому объем оперативного вмешательства но экстренным показаниям определяется индивидуально. Если соблюдение онкологических принципов вмешательства невозможно (вследствие отсутствия технической возможности, квалификации, наличия изменений органов брюшной полости на фоне острой хирургической патологии), а также если из-за тяжести состояния пациента высок риск выполнения расширенной операции, рекомендуется проводить симптоматическую операцию (формирование кишечной стомы или обходного анастомоза) с последующим направлением пациента на плановое хирургическое лечение в специализированную клинику. При локализации опухоли в слепой, восходящей ободочной кишке, печеночном изгибе ободочной кишки, проксимальной трети поперечной ободочной кишки допустимо формирование первичного анастомоза [68, 69].• При проведении экстренного хирургического лечения по поводу рака левых отделов
толстой кишки рекомендуется выполнение операций Микулича, типа Гартмана.Допустимо формирование первичного анастомоза после декомпрессии кишки [70].
Уровень убедительности рекомендаций - В (уровень достоверности доказательств - 3).
5.2 Адъювантная химиотерапия• Рекомендуется выполнить оценку факторов риска прогрессирования у пациентов со II стадией заболевания с целью определения прогноза и выбора адъювантного лечения [47].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств -5).
• Рекомендовано назначать адъювантную химиотерапию пациентам с раком PT4N0 или pTi_4N+, а также она может быть рекомендована пациентам с раком ободочной кишки PT3N0M0 и факторами негативного прогноза (низкой степенью дифференцировки, лимфоваскулярной/периневральной инвазией, при проведении операции в условиях кишечной непроходимости/перитонита, при операции с неадекватным объемом лимфодиссекции (если изучено <12 лимфатических узлов), tumor-budding, РЭА >2,35 после операции) [47].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств -5).
Комментарии: необходимо определение микросателлитных повторов ДНК в биопсийном (операционном) материале методом ПЦР - MSI при II стадии болезни с целью определения показаний к проведению адъювантной химиотерапии [47, 71, 72]
• При раке ободочной кишки PT3N0M0 с единственным фактором негативного прогноза при неизвестном уровне MSI или микросателлитной стабильности (MSS) рекомендуется проведение адъювантной химиотерапии аналогами пиримидина в монорежиме в течение 6 мес. или по схеме XELOX (расшифровка схем представлена в таблицах 3-6) в течение 3 мес. При MSI-H в случае PT3N0M0 рекомендуется наблюдение. При отсутствии MSI-H в сочетании с 2 и более неблагоприятными факторами прогноза рекомендуется адъювантная химиотерапия по схеме XELOX в течение 3 мес. или по схеме FOLFOX в течение 6 мес. [12,47, 71, 72].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• При раке ободочной кишки PT4N0M0 вне зависимости от уровня MSI рекомендуется проведение адъювантной химиотерапии по схеме XELOX в течение 3 мес. или по схеме FOLFOX в течение 6 мес с целью снижения риска прогрессирования заболевания. [73].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 2).
• Рекомендуется пациентам с pTi_3NiMo стадией рака ободочной кишки проводить адъювантную химиотерапию по схеме XEFOX в течение 3 месяцев, либо по схеме FOEFOX в течение 6 месяцев с целью снижения риска
прогрессирования заболевания [73].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 2).
Комментарии: по результатам объединенного анализа 6 рандомизированных исследований, 3-месячная терапия по схеме ХЕЕОХ (но не FOEFOX) обладает не меньшей эффективностью в отношении 3-летней выживаемости без признаков болезни, чем 6-месячная [73].
• При pN2 или PT4N1 раке ободочной кишки рекомендуется проведение адъювантной химиотерапии по схеме ХЕЕОХ или FOLFOX в течение 6 мес с целью снижения риска прогрессирования заболевания. [73].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 2).
Комментарии: оптимальный срок начала адъювантной терапии - в течение 28 дней с момента оперативного лечения в случае отсутствия послеоперационных осложнений и при наличии в клинике лекарственных препаратов. При увеличении данного срока >2 мес. проведение адъювантной химиотерапии малоэффективно. Комбинация оксалиплатина** со струйным введением фторурацила** (режим FLOX) обладает схожей эффективностью, но высокой токсичностью (является вариантом выбора при развитии кардиотоксичности при применении капецитабина** или 46-часовых инфузий фторурацила**) (табл. 3). При развитии в процессе химиотерапии симптомов иолинейроиатии II степени рекомендуется отмена оксалинлатина** и продолжение монотерапии аналогами пиримидина. В адъювантной терапии колоректального рака не должны применяться иринотекан** и таргетные препараты, в частности бевацизумаб** и цетуксимаб** панитумумаб** афлиберцепт** регорафениб* * [74, 75].
Таблица 3 - Режимы применения оксалинлатина** и аналогами пиримидина в лечении колоректального рака
Уровень убедительности рекомендаций - С (уровень достоверности доказательств -5).
Комментарии: терапия оксалиплатином** в монорежпме малоэффективна; он должен применяться в комбинации с аналогами пиримидина. При прогрессировании заболевания после ранее достигнутого эффекта необходимо рассмотреть вопрос о повторном применении эффективного ранее режима.
• У пациентов с клинически значимыми симптомами заболевания (ECOG 1-2) и обширной диссеминацией рекомендуется использование в 1-й линии двойных комбинаций препаратов (FOLFOX, XELOX или XELIRI, FOLFIRI) на протяжении не менее 3-4 мес. с последующей возможной поддерживающей терапией аналогами пиримидина [16, 79].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств -5).
Комментарии: если после 1-й линии терапии опухолевый процесс прогрессирует, 2-я линия терапии может быть назначена пациентам с удовлетворительным общим статусом (ECOG i
2). При резистентности к режиму FOLFOX (XELOX) в качестве 2-й линии обычно назначают режим FOLFIRI/XELIRI или монотерапию иринотеканом** при резистентности к иринотекану** в 1-й линии в режиме FOLFIRI - FOLFOX/XELOX (см. табл. 3, 5) [80]. В случае химиорезистентной опухоли (если заболевание прогрессирует в ходе терапии или ближайшее время после окончания терапии с включением иринотекана** оксалиплатина** и аналоги пиримидина) проведение дальнейшей химиотерапии не показано. Если прогрессирование заболевания наблюдается в ходе адъювантной химиотерапии или в течение 12 мес. после нее, оптимальным вариантом 1-й линии терапии будет режим с применением иринотекана** (FOLFIRI/XELIRI), который, по результатам поданализов рандомизированных исследований, дает лучшие результаты в сравнении с режимом FOLFOX или FOLFOXIRI.Таблица 5 - Режимы с применением иринотекана** и таргетной и иммунотерапии в лечении колоректального рака
• Ослабленным пациентам с ECOG >2 рекомендуется малотоксичная монохимиотерапия аналогами пиримидина или симптоматическая терапия [16].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств -5).
• Рекомендуется к вышеперечисленным режимам при неоперабельном генерализованном раке толстой кишки рассмотреть добавление МКА: бевацизумаба**, цетуксимаба** или панитумумаба**, что увеличивает продолжительность жизни [16, 81,117].
Уровень убедительности рекомендаций - А (уровень достоверности доказательств - 2).
Комментарии: в режиме монотерапии бевацизумаб** малоэффективен. Рекомендуется продолжение терапии бевацизумабом** с аналогами пиримидина до прогрессирования заболевания. В случае прогрессирования возможно продолжение применения бевацизумаба** со сменой режима. На сегодняшний день неизвестны клинические или молекулярные факторы, предсказывающие эффективность бевацизумаба**. Наибольшую активность бевацизумаб** демонстрирует в 1-й и 2-й линиях терапии; добавление бевацизумаба** к режимам на основе оксалиплатина** или иринотекана** во 2-й линии лечения достоверно увеличивает продолжительность жизни. Во 2-й линии терапии возможно назначение других антиангиогенных моноклональных антител - афлиберцепта** или рамуцирумаба** которые применяются только в сочетании с режимом FOLFIRI. В отличие от бевацизумаба** цетуксимаб** или панитумумаб** активны как в режиме монотерапии, так и в комбинации с химиотерапией, но лишь у пациентов с отсутствием мутации RAS и BRAF и при локализации первичной опухоли в левых отделах толстой кишки. Цетуксимаб** или панитумумаб** не должны применяться с капецитабином** режимами FLOX, XELOX. Самостоятельная активность цетуксимаба** и панитумумаба** позволяет рекомендовать их режиме монотерапии в качестве 3-4-й линии. Совместное применение бевацизумаба** и цетуксимаба** или панитумумаба** ухудшает результаты лечения и не рекомендуется.
Цели паллиативной химиотерапии - увеличение продолжительности жизни, уменьшение симптомов болезни и улучшение качества жизни. Пациенты, получившие все 3 активных химиопрепарата (иринотекан** оксалиплатин** и аналоги пиримидина), имеют достоверно большую продолжительность жизни. При этом неважно, за сколько линий терапии это удается реализовать. До сих нор не ясна оптимальная продолжительность 1-й линии терапии.
Возможные варианты:
1) непрерывная терапия до прогрессирования заболевания или развития неприемлемых токсических явлений;
2) проведение лечения на протяжении не менее 6 мес. с последующим наблюдением;
3) применение двойной комбинации в течение не менее 3-4 мес. с последующей поддержкой аналогами пиримидина (стратегия «поддерживающей» терапии имеет преимущества перед полным прекращением лечения).
В случае применения комбинации химиотерапии с применением бевацизумаба** поддерживающая терапия бевацизумабом** и аналогами пиримидина должна проводиться до появления признаков прогрессирования болезни или неприемлемой токсичности. При использовании комбинации химиотерапии с цетуксимабом** или панитумумабом** также рекомендуется поддерживающая терапия комбинацией инфузий кальция фолината** фторурацила** и цетуксимаба** или панитумумаба** или монотерапия моноклональными антителами до прогрессирования заболевания [26].
У пациентов с прогрессированием заболевания при применении оксалиплатина** иринотекана** и аналогов пиримидина, бевацизумаба** и цетуксимаба** или панитумумааб** (по показаниям) возможно назначение регорафениба**. В случае низкого функционального статуса пациента начальная доза регорафениба** может быть снижена в 1-м курсе. Проведенные исследования показали, что возможно проводить терапию #регорафенибом** в режиме: 80мг в сутки внутрь -1-я неделя, 120 мг в сутки внутрь - 2-я неделя, 160 мг в сутки внутрь - 3-я неделя, затем 1 неделя перерыва. Эскалация дозы возможна только при удовлетворительной переносимости препарата.
Во 2-й и последующих линиях терапии при наличии в опухоли микросателлитной MIS-H возможно назначение монотерапии #ниволумаба** или #пембролизумаб** в монорежиме или комбинацией #ниволумаба** и #ипилимумаба**.
Последний вариант характеризуется большей частотой получения объективного ответа, однако данные о сравнении отдаленных параметров выживаемости в научной литературе не представлены [82-84].
• Рекомендуется при мутации в гене BRAF в качестве 1-й линии при удовлетворительном состоянии пациента и при отсутствии противопоказаний назначать режим FOLFOXIRI в комбинации с применением МКА бевацизумаба** [58].
Уровень убедительности рекомендаций - В (уровень достоверности доказательств - 2).
Комментарии: при прогрессировании заболевания в ходе 1-й линии терапии при мутации в гене BRAF возможно назначение режима FOLFIRI с использованием афлиберцепта**/ бевацизумаба**/рамуцирумаба** [85] или комбинации цетуксимаба** или панитумумаба** с #вемурафенибом**/#дабрафенибом**и #траметинибом**[86, 87] (табл. 6).
Таблица 6 - Режимы применения препаратов во 2-й и последующих литшх терапии колоректального рака с мутацией в гене BRAF
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 4).
5.4 Симптоматическая терапия
• Пациентам с острым кровотечением рекомендуется выполнить срочное эндоскопическое исследование органов желудочно-кишечного тракта, системную гемостатическую терапию. В зависимости от результатов исследования производят эндоскопическую остановку кровотечения. При невозможности/неэффективности эндоскопического гемостаза проводится экстренное хирургическое вмешательство [89].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• При опухолевом стенозе рекомендуется эндоскопическое стентирование зоны опухолевого стеноза или оперативное лечение [89, 90].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств -5).
• В лечении хронического болевого синдрома рекомендуется проведение дистанционной лучевой терапии, медикаментозной терапии, локорегионарной анестезии в зависимости от причины болевого синдрома [89].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств -5).
• При лечении асцита рекомендуется рассмотреть возможность применения лапароцентеза [91].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Комментарии: целью так называемой «нашучшей поддерживающей терапии» (best supportive саге) является профилактика и облегчение симптомов заболевания и поддержание качества жизни пациентов и их близких, независимо от стадии заболевания и потребности в других видах терапии. В случае рака ободочной кишки меры, направленные на облегчение основных симптомов, способствуют увеличению продолжительности жизни.
4. Реабилитация
• Во время предреабилитации рекомендовано проведение лечебной физкультуры (ЛФК), психологической и нутритивной поддержки, информирования пациентов [92-95].
Уровень убедительности рекомендаций - В (уровень достоверности доказательств - 3).
Комментарии: программа комплексной преабплитации у пациентов с колоректальным раком, в которую входят занятия ЛФК дома (комплекс физической нагрузки средней интенсивности, включающей в себя как аэробную, так и анаэробную нагрузку), консультирование по питанию, работа с психологом на преодоление тревоги и депрессии (начинается за 28 дней до операции и продолжается в течение 8 недель после), значительно улучшает качество жизни в послеоперационном периоде. Психологическая преабилитация, использующая методики, направленные на работу со стрессом (методики релаксации, формирование позитивного настроя) в течение 40-60 мин 6 дней в неделю, начинающаяся за 5 дней до операции и продолжающаяся 30 дней после нее, значительно улучшает качество жизни.
• Рекомендуется применять тактики реабилитации fast track («быстрый путь») и ERAS (early rehabilitation after surgery - ранняя реабилитация после операции), предполагающие комплексное обезболивание, раннее энтеральное питание, отказ от рутинного применения зондов и дренажей, раннюю мобилизацию (активизацию и вертикализацию) пациентов уже с 1-2-х суток после операции [96].
Уровень убедительности рекомендаций - А (уровень достоверности доказательств - 1).
Комментарии: применение побудительной спирометрии, подъем головного конца кровати, раннее начало дыхательной гимнастики и ранняя активизация пациентов помогает профилактике застойных явлений в легких в послеоперационном периоде [97].
Для профилактики снижения мышечной массы, легочных и тромботических осложнений показано пребывание в кровати 2 ч до операции и не более 6 ч после нее. Дыхательная гимнастика начинается сразу после нормализации сознания пациента после операции. Тактике дыхательной гимнастики в послеоперационном периоде пациента обучают до операции. После оперативного лечения у пациентов колоректальным раком рекомендовано выполнение диафрагмального дыхания, которое способствует улучшению циркуляции лимфы в организме и позволяет вентилировать нижние доли легких, которые при грудном типе дыхания обычно наполняются воздухом недостаточно.
• Во время 2-го этапа реабилитации лечение синдрома передней резекции прямой кишки рекомендуется проводить функционального обследования, включающего применение методик измерения сокращения прямой кишки и сфинктера ануса (аноректальной зоны) [98-101,118,119].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств -5).
Комментарии: при данном синдроме рекомендованы выполнение комплекса упражнений для укрепления мышц тазового дна, biofeedback-терапия, тибиальная нейромодуляция, электростимуляция мышц тазового дна и промежности [98-101]. При нарушении мочеиспускания и при эректильной дисфункции показаны упражнения для укрепления мышц тазового дна, eiofeedback-терапия, тибиальная нейромодуляция, электростимуляция мышц тазового дна и промежности. При возникновении лимфедемы нижних конечностей следует проводить полную противоотечную терапию, включающую мануальный лимфодренаж, ношение компрессионного трикотажа, выполнение комплекса ЛФК, уход за кожей. При возникновении лимфедемы нижних конечностей также нужно назначить перемежающую пневмокомпрессию конечностей в сочетании с полной противоотечной терапией, низкоинтенсивную лазеротерапию в сочетании с полной противоотечной терапией, электротерапию в сочетании с полной противоотечной терапией, низкочастотную магнитотерапию в сочетании с полной противоотечной терапией, глубокую осцилляцию (массаж переменным электрическим полем) в сочетании с полной противоотечной терапией.
• Во время проведения химиотерапии рекомендуется выполнение комплекса ЛФК, применение методик релаксации, включающих диафрагмальное дыхание и прогрессирующую мышечную релаксацию, рассмотреть возможность назначения курса массажа [102-104].
Уровень убедительности рекомендаций - В (уровень достоверности доказательств - 1).
Комментарии: объем и интенсивность ЛФК подбирается индивидуально исходя из степени слабости (легкая, средняя, тяжелая). При улучшении общего состояния возможно увеличить интенсивность ЛФК. Рекомендуется сочетание аэробной нагрузки и силовой.
• Во время 3-го этапа реабилитации рекомендовано ведение активного образа жизни, выполнение комплексов ЛФК после комбинированного лечения рака ободочной кишки [105-109].
Уровень убедительности рекомендаций - В (уровень достоверности доказательств - 3).
Комментарии: выполнение комплекса ЛФК пациентами с рецидивом рака снижает риск общей смертности на 29 %. Выполнение комплекса ЛФК и физическая активность пациентов с диссеминированным опухолевым процессом уменьшает слабость, увеличивает мобильность, снижает уровень депрессии и улучшает качество жизни.
• Не рекомендуется ограничивать пациентов с раком толстой кишки в применении методов реабилитации с включением курортологического лечения в отсутствии данных за негатитивое их влияние на здоровье.
Уровень убедительности рекомендаций - С (уровень достоверности доказательств -5).
Комментарий: в настоящее время отсутствуют какие-либо данные, в том числе опубликованные исследования, о повышении риска прогрессирования опухолевого процесса при использовании данных методов реабилитации.
5. Профилактика
• Рекомендуется соблюдать следующую периодичность и использовать следующие методы наблюдения после завершения лечения по поводу рака толстой кишки: в первые 1-2 года физикальный осмотр и сбор жалоб - каждые 3-6 мес., через 3-5 лет с момента операции -1 раз в 6-12 мес. Через 5 лет и более с момента операции визиты проводятся ежегодно или при появлении жалоб.
Объем обследования:
1. Анамнез и физикальное обследование.
2. Исследование уровня РЭА в крови каждые 3 мес. в первые 2 года и далее каждые 6 мес. в последующие 3 года (если РЭА был исходно повышен).
3. Колоноскопия через 1 и 3 года после резекции первичной опухоли, далее каждые 5 лет для выявления метахронной опухоли или удаления обнаруженных полипов толстой кишки. При выявлении полипов колоноскопия выполняется ежегодно (В). В случае если до начала лечения колоноскопия не была выполнена по причине стенозирующей опухоли, ее производят в течение 3-6 мес. после резекции.
4. УЗИ органов брюшной полости и малого таза (комплексное) каждые 3-6 мес. в зависимости от риска прогрессирования.
5. Рентгенография легких или прицельная рентгенография органов органов грудной клетки каждые 12 мес.
6. КТ органов грудной и брюшной полости с внутривенным болюснымв контрастированием однократно через 12-18 мес. после операции (Приложениеприложение Д) [16, 59,120].
Уровень убедительности рекомендаций - А (уровень достоверности доказательств - 1).
Комментарии: задачей наблюдения является раннее выявление прогрессирования заболевания с целью раннего начала химиотерапии или хирургического лечения резектабельных метастатических очагов, рецидивных опухолей, а также выявление метахронных опухолей ободочной кишки. Профилактику и лечение осложнений, вызванных системным противоопухолевым лечением и лучевой терапией, целесообразно проводить но соответствующим рекомендациям
Уровень убедительности рекомендаций - С (уровень достоверности доказательств -5).
6. Организация оказания медицинской помощи.
Медицинская помощь, за исключением медицинской помощи в рамках клинической апробации, в соответствии с федеральным законом от 21.11.2011 № 323-ФЗ (ред. от 25.05.2019) «Об основах охраны здоровья граждан в Российской Федерации» организуется и оказывается:
1) в соответствии с положением об организации оказания медицинской помощи по видам медицинской помощи, которое утверждается уполномоченным федеральным органом исполнительной власти;
2) в соответствии с порядком оказания помощи по профилю «онкология», обязательным для исполнения на территории Российской Федерации всеми медицинскими организациями;
3) на основе настоящих клинических рекомендаций;
4) с учетом стандартов медицинской помощи, утвержденных уполномоченным федеральным органом исполнительной власти.
Первичная специализированная медико-санитарная помощь оказывается врачом-онкологом и иными врачами-специалистами в центре амбулаторной онкологической помощи либо в первичном онкологическом кабинете, первичном онкологическом отделении, поликлиническом отделении онкологического диспансера.
При выявлении у пациента рака ободочной кишки и ректосигмоидного отдела или подозрении на него врачи-терапевты, врачи-терапевты участковые, врачи общей практики
(семейные врачи), врачи-специалисты, средние медицинские работники в установленном порядке направляют пациента на консультацию в центр амбулаторной онкологической помощи либо в первичный онкологический кабинет, первичное онкологическое отделение медицинской организации для оказания ему первичной специализированной медико-санитарной помощи.Консультация в центре амбулаторной онкологической помощи либо в первичном онкологическом кабинете, первичном онкологическом отделении медицинской организации должна быть проведена не позднее 5 рабочих дней с даты выдачи направления на консультацию. Врач-онколог центра амбулаторной онкологической помощи (в случае отсутствия центра амбулаторной онкологической помощи врач-онколог первичного онкологического кабинета или первичного онкологического отделения) организует взятие биопсийного (операционного) материала, а также организует выполнение иных диагностических исследований, необходимых для установления диагноза, включая распространенность онкологического процесса и стадию заболевания.
В случае невозможности взятия в медицинской организации, в составе которой организован центр амбулаторной онкологической помощи (первичный онкологический кабинет, первичное онкологическое отделение), биопсийного (операционного) материала, проведения иных диагностических исследований пациент направляется лечащим врачом в онкологический диспансер или в медицинскую организацию, оказывающую медицинскую помощь пациентам с онкологическими заболеваниями.
Срок выполнения патологоанатомических исследований, необходимых для гистологической верификации злокачественного новообразования, не должен превышать 15 рабочих дней с даты поступления биопсийного (операционного) материала в патологоанатомическое бюро (отделение).
При выявлении рака ободочной кишки и ректосигмоидного отдела или подозрении на него в ходе оказания скорой медицинской помощи пациента переводят или направляют в медицинские организации, оказывающие медицинскую помощь пациентам с онкологическими заболеваниями, для определения тактики ведения и необходимости применения дополнительно других методов специализированного противоопухолевого лечения.Врач-онколог центра амбулаторной онкологической помощи (первичного онкологического кабинета, первичного онкологического отделения) направляет пациента в онкологический диспансер или в медицинские организации, оказывающие медицинскую помощь пациентам с онкологическими заболеваниями, для уточнения диагноза (в случае невозможности установления диагноза, включая распространенность онкологического процесса и стадию заболевания, врачом-онкологом центра амбулаторной онкологической помощи, первичного онкологического кабинета или первичного онкологического отделения) и оказания специализированной, в том числе высокотехнологичной, медицинской помощи.
Срок начала оказания специализированной, за исключением высокотехнологичной, медицинской помощи пациентам с онкологическими заболеваниями в медицинской организации, оказывающей медицинскую помощь пациентам с онкологическими заболеваниями, не должен превышать 14 календарных дней с даты гистологической верификации злокачественного новообразования или 14 календарных дней с даты установления предварительного диагноза рака ободочной кишки и ректосигмоидного отдела (в случае отсутствия медицинских показаний к проведению патологоанатомических исследований в амбулаторных условиях).
Специализированная, в том числе высокотехнологичная, медицинская помощь оказывается врачами-онкологами, врачами-радиотерапевтами в онкологическом диспансере или в медицинских организациях, оказывающих медицинскую помощь пациентам с раком ободочной кишки и ректосигмоидного отдела, имеющих лицензию, необходимую материально-техническую базу, сертифицированных специалистов, в стационарных условиях и условиях дневного стационара и включает в себя профилактику, диагностику, лечение онкологических заболеваний, требующих использования специальных методов и сложных уникальных медицинских технологий, а также медицинскую реабилитацию.
В медицинской организации, оказывающей медицинскую помощь пациентам с раком ободочной кишки и ректосигмоидного отдела, тактика медицинского обследования и лечения устанавливается консилиумом врачей-онкологов и врачей-радиотерапевтов с привлечением при необходимости других врачей-специалистов. Решение консилиума
врачей оформляется протоколом, подписывается участниками консилиума врачей ивносится в медицинскую документацию пациента.
Показания к госпитализации в круглосуточный или дневной стационар медицинской организации, оказывающей специализированную, в том числе высокотехнологичную, медицинскую помощь по профилю «онкология» определяются консилиумом врачей-онкологов и врачей-радиотерапевтов с привлечением при необходимости других врачей-специалистов.
Показаниями к госпитализации в медицинскую организацию в экстренной или неотложной форме являются:
1) наличие осложнений рака ободочной кишки и ректосигмоидного отдела, требующих оказания специализированной медицинской помощи в экстренной и неотложной форме;
2) наличие осложнений лечения (хирургическое вмешательство, лучевая терапия, лекарственная терапия и т. д.) рака ободочной кишки и ректосигмоидного отдела.
Показаниями к госпитализации в медицинскую организацию в плановой форме являются:
1) необходимость выполнения сложных интервенционных диагностических медицинских вмешательств, требующих последующего наблюдения в условиях круглосуточного или дневного стационара;
2) наличие показаний к специализированному противоопухолевому лечению (хирургическому вмешательству, лучевой терапии, в том числе контактной, дистанционной и лучевой терапии других видов, лекарственной терапии и др.), требующему наблюдения в условиях круглосуточного или дневного стационара.
Рекомендуется перед операцией у всех пациентов раком ободочной кишки получить информированное согласие на проведение хирургического вмешательства и формирование колостомы (даже если это не входит в план операции) [33,110].
Показаниями к выписке пациента из медицинской организации являются:
1) завершение курса лечения или одного из этапов оказания специализированной, в том числе высокотехнологичной, медицинской помощи, в условиях круглосуточного или дневного стационара при условии отсутствия осложнений лечения, требующих медикаментозной коррекции и/или медицинских вмешательств в стационарных условиях;
2) отказ пациента или его законного представителя от специализированной, в том числе высокотехнологичной, медицинской помощи в условиях круглосуточного или дневного стационара, установленной консилиумом медицинской организации, оказывающей онкологическую помощь, при условии отсутствия осложнений основного заболевания и/или лечения, требующих медикаментозной коррекции и/или медицинских вмешательств в стационарных условиях;
3) необходимость перевода пациента в другую медицинскую организацию по соответствующему профилю оказания медицинской помощи.
Заключение о целесообразности перевода пациента в профильную медицинскую организацию составляется после предварительной консультации по предоставленным медицинским документам и/или предварительного осмотра пациента врачами специалистами медицинской организации, в которую планируется перевод.6. Дополнительная информация, влияющая на течение и исход заболевания
Дополнительной информации нет.
Критерии оценки качества медицинской помощи
1. Terzic J., Grivennikov S., Karin E., Karin M. Inflammation and colon cancer. Gastroenterology 2010,138:2101-14.
2. Johns L.E., Houlston R.S. A systematic review and meta-analysis of familial colorectal cancer risk. Am J Gastroenterol 2001;96:2992-3003.
3. Tenesa A., Dunlop M.G. New insights into the aetiology of colorectal cancer from genome-wide association studies. Nat Rev Genet 2009;10:353-8.
4. Huxley R.R., Ansary-Moghaddam A., Clifton P. et al. The impact of dietary and lifestyle risk factors on risk of colorectal cancer: A quantitative overview of the epidemiological evidence. Int J Cancer 2009;125:171-80.
5. Watson A.J.M., Collins P.D. Colon cancer: a civilization disorder. DigDis 2011;29:222-8.
6. Meyerhardt J.A., Catalano P.J., Haller D.G. et al. Impact of diabetes mellitus on outcomes in patients with colon cancer. J Clin Oncol 2003;21:433-40.
7. Hjartaker A., Aagnes B., Robsahm T.E. et al. Subsite-specific dietary risk factors for colorectal cancer: a review of cohort studies. J Oncol 2013;2013:703854.
8. Theodoratou E., Farrington S.M., Tenesa A. et al. Associations between dietary and lifestyle risk factors and colorectal cancer in the Scottish population. Eur J Cancer Prev 2014;23:8-17.
9. Rasool S., Kadla S. A., Rasool V., Ganai B.A. A comparative overview of general risk factors associated with the incidence of colorectal cancer. Tumor Biol 2013;34:2469-76.
10. Esposito K., Chiodini P., Capuano A. et al. Colorectal cancer association with metabolic syndrome and its components: a systematic review with meta-analysis. Endocrine 2013;44:634-47.
11. Larsson S.C., Orsini N., Wolk A. Diabetes mellitus and risk of colorectal cancer: a meta-analysis. J Natl Cancer Inst 2005;97:1679-87.
12. Raskov H., Ponnnergaard H. C., Burcharth J., Rosenberg J. Colorectal carcinogenesis - update and perspectives. World J Gastroenterol 2014;20:18151-64.
13. Donohoe C., O’Farrell N., Doyle S., Reynolds J. The role of obesity in gastrointestinal cancer: evidence and opinion. Therap Adv Gastroenterol 2014;7:38-50.
14. Давыдов М.И., Аксель E.M. Статистика злокачественных новообразований в России и странах СНЕ в 2014 г. М.: Издательская группа РОНЦ, 2016. 217 с.
15. Speights V.O.. lohnson M.W.. Stoltenherg Р.Н. et al. Colorectal cancer: current trends in initial clinical manifestations. South Med 1 1991:84('51:575-8.
16. Schmoll Н.1.. Van Cutsern E.. Stein A. et al. ESMO consensus guidelines for management of patients with colon and rectal cancer. A personalized approach to clinical decision making. Ann Oncol 2012:23:2479-516.
17. Цуканов A.C.. Шелыгин Ю.А.. Фролов C.A. и др. Рекомендации по отбору пациентов для молекулярно-генетической диагностики синдрома Линча. Методические рекомендации. М..2019.
18. l.iu 7... Zhang Y.. Niu Y. et al. A systematic review and meta-analvsis of diagnostic and prognostic serum hiomarkers of colorectal cancer. Pl.oS One 2014:9f8l:e103910.
19. Langevin 1M. Nivatvongs S. The true incidence of synchronous cancer of the large bowel. A prospective study. Anri Surg 1984:147('51:550-5.
20. Mulder S.A.. Kranse R.. Danrhuis R.A. et al. Prevalence and prognosis of synchronous colorectal cancer: a Dutch population-based study. Cancer Epidemiol 2011:35(5):442-7.
21. Finan Р.1.. Ritchie 1.К.. Hawlev P.R. Synchronous and ‘early’ metachronous carcinomas of the colon and rectum. Br 1 Surg 1987:74:945-47.
22. Computed tomographic colonographv compared with colonoscopy or barium enema for diagnosis of colorectal cancer in older symptomatic patients: two multicentre randomised trials with economic evaluation (the S1GGAR trials). Health Technol Assess 2015:196541:1 -134.
23. Floriani 1. Torri V. Rulli E. et al. Performance of imaging modalities in diagnosis of liver metastases from colorectal cancer: a systematic review and meta-analvsis. 1 Magn Reson Imaging. 2010 1ап:51П):19-51
24. Nordholm-Carstensen A.. Wille-lorgensen P.A.. lorgensen E.N. et al. Indeterminate pulmonary nodules at colorectal cancer staging: a systematic review of predictive parameters for malignancy. Ann Surg Oncol 2015:201121:4022-50.
25. Sun S. Yang C. Huang Z. et al. Diagnostic value of magnetic resonance versus computed tomography colonographv for colorectal cancer: A PRISMA-compliant systematic review and meta-analvsis. Medicine (Baltimore). 2018 Iun:97t22t:e10885
26. Brown G„ Radcliffe A.G.. Newcomhe R.G. et al. Preoperative assessment of prognostic factors in rectal cancer using high-resolution magnetic resonance imaging. Br 1 Surg 2005:90('51:555-64.
27. Herrmann L. Lerman A.. Sanrihu N.P. et al. F,valuation and management of patients with heart disease and cancer: cardio-oncologv. Mavo Clin Proc 2014:89t9'):1287-506.
28. Starck M.. Bohe M.. Simanaitis M.. Valentin L. Rectal endosonographv can distinguish benign rectal lesions from invasive early rectal cancers. Colorectal Pis 2005:C5'):246-50.
29. l.ee E.L. l.ee LB.. l.ee S.H. et al. F.ndoscopic submucosal dissection for colorectal tumors—1.000 colorectal F.SD cases: one specialized institute's experiences. Sure F.ndosc 2015:27(41:51-9.
30. Diagnostic value of endorectal ultrasound in preoperative assessment of lvmph node involvement in colorectal cancer: A meta-analvsis //Asian Рас 1 Cancer Prev. - 2015. - T. 16. - C. 5485-5491.
31. Choi S.H.. Kim S.Y.. Park S.H. et al. Diagnostic performance of CT. eadoxetate disodium-enhanced MRL and PF.T/CT for the diagnosis of colorectal liver metastasis: systematic review and meta-analvsis. 1Maen Reson Imaging 2018:47:1257-50.
32. Ко Y.. Kim 1.. Park l.K. et al. Limited detection of small (410 mini colorectal liver metastasis at preoperative CT inpatients undergoing liver resection. PloS One 2017:12(421 :e0189797.
33. Ribas Y„ Hotonras A.. Wexner S.D.. D"Hoore A. Shared decision-making and informed consent process in rectal cancer treatment: weighing up oncological and functional outcomes. Colorectal Pis 2016:18(11:9-12.
34. Roth E.S.. Fetzer D.T.. Barron B.l. et al. Does colon cancer ever metastasize to bone first? a temporal analysis of colorectal cancer progression. BMC Cancer 2009:9:274.
35. Aneestad K.M.. Bakaki P.M.. Rose I. et al. Metastatic spread pattern after curative colorectal cancer surgery. A retrospective, longitudinal analysis. Cancer Epidemiol 2015:59С51:754-44.
36. Daza I.F.. Solis N.M.. Parpia S. et al. A meta-analvsis exploring the role of PET and PET-CT in the management of potentially resectable colorectal cancer liver metastases. Eur 1 Surg Oncol 2019:45181:1541 -8.
37. Mnntean V.. Onin T.. Lungoci C. et al. Staging laparoscopy in digestive cancers. 1 Gastrointestin Liver Pis 2009:18141:461-7.
38. De Marco M.F.. lanssen-Heiinen M.L.. van der Heiiden L.H.. Coebergh l.W. Comorbiditv and colorectal cancer according to subsite and stage: a population-based study. Eur 1 Cancer 2000:36(41:95-9.
39. Фепянин М.Ю.. Трякин A.A.. Тюлянлин C.A. Потенттиалъные предикторы эффективности aHTM-EGFR-Tepannn при метастатическом раке толстой кишки. Онкологическая колопрокгология 2015:С21:21-50.
40. Khattak М.А.. Martin Н.. Davidson A. Phillips М. Role of first-line anti-epidennal growth factor receptor therapy compared with anti-vascular endothelial growth factor therapy in advanced colorectal cancer: a meta-analvsis of randomized clinical trials. Clin Colorectal Cancer. 2015 lun:14t21:81-90. doi: 10.1016/i.clcc.2014.12.011
41. Pietrantonio F. Petrelli F. Coinu A. et al. Predictive role of BRAF mutations in patients with advanced colorectal cancer receiving cetnximah and panitnmnmah: a meta-analvsis. Fur 1 Cancer. 2015:51651:587-594.
42. Yoshino T.. Arnold D.. Taniguchi H. et al. Pan-Asian adapted ESMO consensus guidelines for the management of patients with metastatic colorectal cancer: a 1SMO-ESMO initiative endorsed bv CSCO. KACO. MOS. SSO and TOS. Ann Oncol 2018:29111:44-70
43. Hurl stone D.P.. Cross S.S.. Drew K. et al. An evaluation of colorectal endoscopic mucosal resection using high-magnification chromoscopic colonoscopy: a prospective study of 1000 colonoscopies. Endoscopy 2004:56(061:491-8.
44. Chiba H.. Tachikawa L. Kurihara D. et al. Safety and efficacy of simultaneous colorectal ESP for large synchronous colorectal lesions. Endosc Int Open 2017:517'):E595-602.
45. Lee E.L. Lee LB.. Lee S.H. et al. Endoscopic submucosal dissection for colorectal tumors—1.000 colorectal ESP cases: one specialized institute's experiences. SurgEndosc 2015:27C1'):51-9.
46. Landmann R.G.. Weiser M.R. Surgical management of locally advanced and locally recurrent colon cancer. Clin Colon Rectal Surg 2005:18('51:182-9.
47. Adjuvant chemotherapy for resected colorectal cancer metastases: Literature review and meta-analvsis /'/World journal of gastroenterology. - 2016. - T. 22. - №. 2. - C. 519.
48. Keikes L.. Koopman M.. Tanis P.L et al. Evaluating the scientific basis of quality indicators in colorectal cancer care: a systematic review. Eur 1 Cancer 2017:86:166-77.
49. Yin Z.. Liu C.. Chen Y. et al. Timing of hepatectomv in resectable synchronous colorectal liver metastases (SCRLM): Simultaneous or delayed? Hepatology 2015:57161:2546-57.
50. Feng O.. Wei Y„ Zhu D. et al. Timing of hepatectomv for resectable synchronous colorectal liver metastases: for whom simultaneous resection is more suitable - a meta-analvsis. PLoS One 2014:9181:6104548.
51. Garden O.L. Rees M.. Poston G.L et al. Guidelines for resection of colorectal cancer liver metastases. Gut 2006:55 Suppl 5:iii 1 —8.
52. Hughes K.S.. Simon R.. Songhorahodi S. et al. Resection of the liver for colorectal carcinoma metastases: a multi-institutional study of patterns of recurrence. Surgery 1986:100121:278-84.
53. Richardson В.. Preskitt b. T.ichliter W. et al. The effect of multidisciplinary teams for rectal cancer on delivery of care and patient outcome: has the use of multidisciplinary teams for rectal cancer affected the utilization of available resources, proportion of patients meeting the standard of care, and does this translate into changes in patient outcome? Am I Sure 2016:211(1):46-52.
54. Chow F.C.. Chok K.S. Colorectal liver metastases: An update on multidisciplinary approach. World 1 Hepatol 2019: Ш21:150-72.
55. Brandi G.. De Lorenzo S.. Nannini M. et al. Adjuvant chemotherapy for resected colorectal cancer metastases: literature review and meta-analvsis. World 1 Gastroenterol 2016:2212'):519-Ж
56. Primrose 1.. Falk S„ Finch-lones M. et al. Systemic chemotherapy with or without cetuximah in patients with resectable colorectal liver metastasis: the New EPOC randomised controlled trial. Lancet Oncol 2014:15(61:601-11.
57. Geissler M.. Riera-Knorrenschild b. Tannapfel A. et al. niFOLFOXIRI + panitumumab versus FOLFOX1R1 as first-line treatment in patients with RAS wild-tvpe metastatic colorectal cancer mtCRCl: a randomized phase 11 VOLF! trial of the AlO 1A1O-KRK0IQ91. T Clin Oncol 2018:П5 Suppll:5509.
58. Cremolini C.. Loupakis F.. Antoniotti C. et al. FOLFOXIRI plus bevacizumab versus FOLFIRI plus bevacizumab as first-line treatment of patients with metastatic colorectal cancer: updated overall survival and molecular subgroup analyses of the open-label, phase 5 TR1BF, study. Lancet Oncol 2015:16(151:1506-15.
59. Baraniskin A. Buchberger B. Pox C. et al. Efficacy of bevacizumab in first-line treatment of metastatic colorectal cancer: A systematic review and meta-analvsis. Eur 1 Cancer. 2019 lan:106:57-44.
60. Cetinkava F... Dogrul A.B.. Timaksiz M.B. Role of self expandable stents in management of colorectal cancers. World 1 Gastrointest Oncol 2016:8П):115-20.
61. Goldberg R.M.. Fleming T.R.. Tangen C.M. et al. Surgery for recurrent colon cancer: strategies for identifying resectable recurrence and success rates after resection. Ann Intern Med 1998:12901:27-55.
62. Bowne W.B.. Lee B.. Wong W.D. et al. Operative salvage for locoregional recurrent colon cancer after curative resection: an analysis of 100 cases. Pis Colon Rectum 2005:48151:897-909.
63. Guenaga K.F.. Matos D.. Wille-lorgensen P. Mechanical bowel preparation for elective colorectal surgery. Cochrane Database Svst Rev 2011491 :CD001544.
64. Lacv A.M.. Garcia-Valdecasas 1.С.. Delgado S. et al. Laparoscopy-assisted colectomy versus open colectomy for treatment of non-metastatic colon cancer: a randomised trial. Lancet 2002:559195251:2224-9.
65. Veldkamp R.. Kuhrv E.. Hop W.C. et al. Laparoscopic surgery versus open surgery for colon cancer: short-term outcomes of a randomised trial. Lancet Oncol 2005:6171:477-84.
66. Guillou P.L. Ouirke P. Thorpe H. et al. Short-term endpoints of conventional versus laparoscopic-assisted surgery in patients with colorectal cancer 1MRC CLASICC trial!: multicentre, randomised controlled trial. Lancet 2005:565194721:1718-26.
67. Fleshman b. Sargent P.L. Green E. et al. Laparoscopic colectomy for cancer is not inferior to open surgery based on 5-vear data from the COST Study Group trial. Ann Sure 2007:246141:655-62.
68. De Salvo G.L.. Gava C.. Pucciarelli S.. Lise M. Curative surgery for obstruction from primary left colorectal carcinoma: primary or staged resection? Cochrane Database Svst Rev 2004: 121:CD002101.
69. Khot IJ.P.. Lang A.W.. Murali K.. Parker M.C. Systematic review of the efficacy and safety of colorectal stents. Brl Surg 2002:89191:1096-20.
70. Mever F.. Marusch F.. Coch A. et al. Emergency operation in carcinomas of the left colon: value of Hartmann's procedure. Tech Coloproctol 2004:8 Suppl l:S226-9.
71. Iveson T„ Sohrero A.F.. Yoshino T. et al. Prospective pooled analysis of four randomized trials investigating duration of adjuvant ladjl oxaliplatin-hased therapy 15 vs 6 months {m}l for patients Iptsl with high-risk stage II colorectal cancer 1CC1.1 Clin Oncol 2019:Suppl:5501.
72. Федянин М.Ю. Современная клиническая и молекулярно-биологическая платформа лечения пациентов ракомтолстой кишки: дис.... д-ра мед, наук. М.. 2018.414 с.
73. Grothev A.. Sohrero A.F.. Shields A.F. et al. Duration of adjuvant chemotherapy for stage 111 colon cancer. N F.ngl 1 Med 2018:578:1177-88.
74. Alberts S.R.. Sargent P.L. Nair S. et al: Effect of oxaliplatin. fluorouracil. and leucovorin with or without cetuximah on survival among patients with resected stage III colon cancer: a randomized trial. 1AMA 2012:507:1585-95.
75. Allegra C.L. Yothers G„ O’Connell M.L et al. Bevacizumab in stage 11-111 colon cancer: 5-vear update of the National Surgical Adjuvant Breast and Bowel Project C-08 trial. 1 Clin Oncol 2015:51:559-64.
76. Seymour M.T.. Maughan T.S.. Ledermann T.A. et al. Different strategies of sequential and combination chemotherapy for patients with poor prognosis advanced colorectal cancer (MRC FOCUS1): a randomised controlled trial. Lancet 2007:570:145-52.
77. Cunningham D.. Sirohi B.. Pluzanska A. et al. Two different first-line 5-fluorouracil regimens with or without oxaliplatin in patients with metastatic colorectal cancer. Ann Oncol 2009:20:244-50.
78. Ackland S.P.. Tones M.. Tu D. et al. A meta-analvsis of two randomised trials of early chemotherapy in asymptomatic metastatic colorectal cancer. Br I Cancer 2005:95:1256-45.
79. Tonker D.. Rumble R.B.. Maroun I.. Gastrointestinal Cancer Disease Site Group of Cancer Care Ontario’s Program in F.vidence-Based Care. Role of oxaliplatin combined with 5-fluorouracil and folinic acid in the first-and second-line treatment of advanced colorectal cancer. Curr Oncol 2006:15(э1:175.
80. Toumigand C.. Andre T.. Achille E. et al. FOLFIRI followed bv FOLFOX6 or the reverse sequence in advanced colorectal cancer: a randomized GERCOR study. I Clin Oncol 2004:22:229-57.
81. van Ffelden F.T. Menke-van der Ffouven van Oordt CW. Hevmans MW. et al. Optimal use of anti-F.GFR monoclonal antibodies for patients with advanced colorectal cancer: a meta-analvsis. Cancer Metastasis Rev. 2017 lun:56f2'):595-406.
82. Le D.T.. Urarn T.N.. Wang H. et al. PD-1 blockade in tumors with mismatch-repair deficiency. N F.ngl I Med 2015:572:2509-20.
83. Ovenuan M.T.. McDermott R„ beach T.l,. et al. Nivolumah in patients with metastatic DNA mismatch repair-deficient or microsatellite instabilitv-high colorectal cancer CCheckMate 1421: an open-label, multicentre, phase 2 study. Lancet Oncol 2017:18691:1182-91.
84. Ovennan M.T.. Lonardi S.. Wong K.Y.M. et al. Durable clinical benefit with nivolumah plus ipilimumah in DNA mismatch repair-deficient/microsatellite instabilitv-high metastatic colorectal cancer. I Clin Oncol 2018:56181:775-9.
85. Wirapati P.. Pomella V.. Vandenbosch B. et al. Velour trial biomarkers update: impact of RAS. BRAF. and sidedness on aflibercept activity. I Clin Oncol 2017:<15 Suppl1) :5558.
86. Kopetz S.. McDonough S.L.. Morris V.K. et al. Randomized trial of irinotecan and cetuximab with or without vemurafenih in ff/?4F-mutant metastatic colorectal cancer tSWOG 140611 Clin Oncol 2017:5514 Suppl):520.
87. Corcoran R.B.. Andre T.. Atreva C.E. et al. Combined BRAF. EGFR. and MEK inhibition in patients withBlMF^^-mutant colorectal cancer. Cancer Discov 2018:8(41:428-45.
88. Hansen R. et al. Continuous systemic 5-fluorouracil infusion in advanced colorectal cancer: Results in 91 patients //journal of surgical oncology. - 1989. - T. 40. - №. 5. - C. 177-181.
89. Cost! R.. l.eonardi F.. Zanoni D. et al. Palliative care and end-stage colorectal cancer management: the surgeon meets the oncologist. World 1 Gastroenterol 2014:20124):7602-21.
90. Bavraktar B.. Ozemir I.A.. Kefeli U. et al. Colorectal stenting for palliation and as a bridge to surgery: a 5-vear follow-up study. World 1 Gastroenterol 2015:211511:9575-9.
91. Saif MW. Siddiqui 1AP. and Sobail MA. Management of ascites due to gastrointestinal malignancy. Ann Saudi Med. 2009 Sep-Oct: 29151: 569-577.
92. Silver 1.А.. Bairna 1. Cancer prehabilitation: an opportunity to decrease treatment related morbidity, increase cancer treatment options, and improve physical and psychological health outcomes. Am 1 Pbvs Med Rebahil 2015:92:715-27.
93. Hiiazia Y„ Gondal lb. Aziz O. A systematic review of prehabilitation programs in abdominal cancer surgery. Int 1 Surg2017:59:156-62.
94. Gillis C.. Li C.. Lee L. et al. Prehabilitation versus rehabilitation: a randomized control trial in patients undergoing colorectal resection for cancer. Anesthesiology 2014:121:957-47.
95. Tsimopoulou 1.. Pasquali S„ Howard R. et al. Psychological prehabilitation before cancer surgery: a systematic review. Ann Surg Oncol 2015:221151:4117-25.
96. Li P.. Fang F.. Cai l.X. et al. Fast-track rehabilitation vs conventional care in laparoscopic colorectal resection for colorectal malignancy: a meta-analvsis. World 1 Gastroenterol 2015:19:9119-26.
97. Wren S.M.. Martin M.. Yoon 1.К.. Becb F. Postoperative pneumonia-prevention program for the inpatient surgical ward. 1 Am Coll Surg 2010:210(41:491-5.
98. Soh I.S.. Lee Н.1.. lung K.W. et al. The diagnostic value of a digital rectal examination compared with high-resolution anorectal manometry in patients with chronic constipation and fecal incontinence. Am 1 Gastroenterol 2015:110:1197-204.
99. Lundhv L.. Duelund-lakohsen 1. Management of fecal incontinence after treatment for rectal cancer. Curr Opin Support Palliat Care 2011:5:60-4.
100. Sokol E.R. Management of fecal incontinence - focus on a vaginal insert for bowel control. Med Devices tAuckl1) 2016:9:85-91.
101. Benezecb A.. Bouvier M„ Vitton V. Faecal incontinence: current knowledges and perspectives. World! Gastrointest Patbopbvsiol 2016:7111:59-71.
102. Kralievi N. Rehabilitation for colorectal cancer. Review. Libri Oncol 2015:4Ш-5'):87-92.
103. Mustlan K.M.. Alfano C.M.. Heckler C. et al: Comparison of pharmaceutical, psychological, and exercise treatments for cancer-related fatigue: a meta-analvsis. IAMA Oncol 2017:3:961 -8.
104. Kinkead B.. Schettler P.T.. Larson E.R. et al. Massage therapy decreases cancer-related fatigue: Results from a randomized early phase trial. Cancer 2018:124f5'):546-54.
105. Wonga C.L.. Lee H.H.C.. Chang S.C. Colorectal cancer rehabilitation review, i Cancer Res Pract 2016:5121:51-5.
106. Wolin K.Y.. Yan Y.. Colditz G.A.. et al. Physical activity and colon cancer prevention: a meta-analvsis Br 1 Cancer 2009:100:611-6.
107. leon 1.. Sato K.. Niedzwiecki D. et al. Impact of physical activity after cancer diagnosis on survival in patients with recurrent colon cancer: findings from CAl.GB 89905/Alliance. Clin Colorectal Cancer 2015:12141:255-8.
108. Seeal R.. Zwaal C.. Green E. et al. Exercise for people with cancer: a systematic review. Curr Oncol 2017:24141:e290-515.
109. Carmichael 1.С.. Keller D.S.. Baldini G. et al. Clinical practice guidelines for enhanced recovery after colon and rectal surgery from the American Society of Colon and Rectal Surgeons and Society of American Gastrointestinal and
Endoscopic Surgeons. Pis Colon Rectum 2017:60181:761-84.
110. Fuiino S.. Mivoshi N.. Ohue M.. Takahashi Y. Prediction model and treatment of high-output ileostomy in colorectal cancer surgery. Mol Clin Oncol 2017:7151:468-72.
111. Guo Y. et al. XF.l.OX vs. FOl.FOX in metastatic colorectal cancer: An updated meta-analvsis //Cancer investigation. - 2016. - T. 54. - №. 2. - C. 94-104.
112. Marques R. P. et al. Triplet 1FOLFOXIRI1 versus doublet 1FOLFOX or FOLFIRI1 backbone chemotherapy as first-line treatment of metastatic colorectal cancer: A systematic review and meta-analvsis //Critical reviews in oncologv/hematologv. - 2017. - T. 118. - C. 54-62.
113. Guo Y. et al. Capecitahine plus irinotecan versus 5-FIJ/leucovorin plus irinotecan in the treatment of colorectal cancer: a meta-analvsis //Clinical colorectal cancer. - 2014. - T. 15. - №.
2.-C. 110-118.114. Zhao X. D. et al. Palliative treatment for incurable malignant colorectal obstructions: a meta-analvsis //World loumal of Gastroenterology: WIG. - 2015. - T. 19. - №. 55. - C. 5565.
115. Stillwell A. P.. Buettner P. G.. Ho Y. H. Meta-analvsis of survival of patients with stage IV colorectal cancer managed with surgical resection versus chemotherapy alone //World journal of surgery. - 2010. - T. 54. - №. 4. - C. 797-807.
116. A meta-analvsis of laparoscopic surgery versus conventional open surgery in the treatment of colorectal cancer //Medicine. - 2019. - T. 98. - №. 17. - C. e15547.
117. da Silva WC. de Arauio YE. e Abreu Lima EM. et al. Comparative Effectiveness and Safety of Monoclonal Antibodies CBevacizumab. Cetuximab. and Panitumumab') in Combination with Chemotherapy for Metastatic Colorectal Cancer: A Systematic Review and Meta-Analvsis. BioDrugs. 2018: 52161: 585-606.
118. Visser W. S„ Те Riele W. W„ Boerma D„ van Ramshorst B.. van Westreenen H. 1,. Pelvic floor rehabilitation to improve functional outcome after a low anterior resection: a systematic review //Ann Coloproctol. - 2014. - T. 50. № 5. - C. 109-14.
119. Efthimiadis C.. Basdanis G.. Zatagias A.. Tzeveleki I.. Kosmidis C.. Karamanlis E.. Harlaftis N. Manometric and clinical evaluation of patients after low anterior resection for rectal cancer // Techniques in со I op roctoloev. - 2004. - T. 8. № 1. - C. s205-s207.
120. lefferv M.. Hickev В. E.. Hider P. N. Follow-up strategies for patients treated for non-metastatic colorectal cancer //Cochrane Database of Systematic Reviews. - 2019. - №. 9.
121. Amsterdam Criteria: Vasen HF. et al. The International Collaborative Group on hereditary non-polvposis colorectal cancer (1CG-HNPCC1. Pis Colon Rectum. 1991:54:424-5.
122. Svngal S. Fox EA. Eng C.et al. Sensitivity and specificity of clinical criteria for hereditary non-polvposis colorectal cancer associated mutations in MSH2 and MLH1. 1 Med Genet. 2000 Sep:57f91:641-5.
123. Moreira L. Balaguer F. Lindor N. et al. Identification of Lvnch syndrome among patients with colorectal cancer. 1 AMA. 2012 Oct 17:508(4 51:1.555-65.
124. Therkildsen C.. Bergmann T. K.. Henrichsen-Schnack T.. Ladelund S.. Nilbert M. The predictive value of KRAS. NRAS. BRAF. PIK5CA and PTEN for anti-EGFR treatment in metastatic colorectal cancer: A systematic review and meta-analvsis //Acta Oncol. - 2014. - T. 55. № 7. - C. 852-64.
125. Zahaleta 1. et al. Individual data meta-analvsis for the study of survival after pulmonary metastasectomv in colorectal cancer patients: A history of resected liver metastases worsens the prognosis //European loumal of Surgical Oncology. - 2018. - T. 44. - №. 7. - C. 1006-1012.
126. Chu E and DeVita VT lr. Physicians’ Cancer Chemotherapy Drug Manual 2015. 2015 bv lones & Bartlett Learning. LLC. an Ascend Learning Company.
127. Fernandes GPS. Braghiroli Ml. Artloli M. et al. Combination of Irinotecan. Oxaliplatin and 5-Fluorouracil as a Rechallenge Regimen for Heavily Pretreated Metastatic Colorectal Cancer Patients. 1 Gastrointest Cancer. 2018 Dec:49(41:470-475.
128. Xu RH. Muro K. Morita S. et al. Modified XF.T.TRT (capecitahine plus irinotecanl versus FOT.FTRT deucovorin. fluorouracil. and irinotecanl. both either with or without hevacizumah. as second-line therapy for metastatic colorectal cancer 1AXEPT): a multicentre, open-label, randomised. non-inferioritv. phase 5 trial. Lancet Oncol. 2018 Mav:1915'):660-671.
129. Femandez-Plana I. Pericav C. Quintero G. et al. Biweekly cetuximah in combination with FOl,FOX-4 in the first-line treatment of wild-type KRAS metastatic colorectal cancer: final results of a phase II. open-label, clinical trial (OPTIMIX-ACROSS Study). BMC Cancer. 2014 Nov 22:14:865.
130. Bekaii-Saab T. S. et al. Regorafenib dose-optimisation in patients with refractory metastatic colorectal cancer IReDOSl: a randomised, multicentre, open-label, phase 2 study //The Lancet Oncology. -2019. -T. 20. - №. 8.-C. 1070-1082.
Приложение А1. Состав рабочей группы
1. Федянин М.Ю., д.м.н., старший научный сотрудник онкологического отделения лекарственных методов лечения (химиотерапевтического) № 2 ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России; конфликта интересов нет.
2. Мамедли 3.3., к.м.н., заведующий отделением хирургического отделения № 3 (прокгологического) ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России; конфликта интересов нет.
3. Гордеев С.С., к.м.н., врач-онколог хирургического отделения № 3 (прокгологического) ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России; конфликта интересов нет.
4. Ачкасов С.И., д.м.н., проф., руководитель отделения онкологии и хирургии ободочной кишки ФГБУ «ГНЦК им. А.Н. Рыжих» Минздрава России; конфликта интересов нет.
5. Болотина Л.В., д.м.н., заведующая отделением химиотерапии МНИО им. П.А. Герцена - филиала ФГБУ «НМИЦ радиологии» Минздрава России; конфликта интересов нет.
6. Гладков О.А., д.м.н., ООО «Эвимед», Челябинск; конфликта интересов нет.
7. Глебовская В.В., д.м.н., старший научный сотрудник радиологического отделения ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России; конфликта интересов нет.
8. Карачун А.М., профессор, д.м.н. заведующий хирургическим отделением абдоминальной онкологии ФГБУ «НМИП онкологии им. Н.Н. Петрова» Минздрава России, сотрудник кафелры онкологии Северо-Запалного госуларственного мелиттинского университета им. Н.Н. Мечникова: конфликта интересов нет.
9. Козлов Н.А.. к.м.н. врач-патологоанатом патологоанатомического отделения отдела морфологической и молекулярно-генетической диагностики опухолей ФГБУ «НМИП онкологии им. Н.Н. Блохина» Минздрава России: конфликта интересов нет.
10. Любченко Л.Н.. д.м.н.. заведующая отделением генетики ФГБУ «НМИП онкологии им. Н.Н. Блохина» Минздрава России: конфликта интересов нет.
11. Малихова О.А.. д.м.н.. проф.. заведующая отделением эндоскопии ФГБУ «НМИП онкологии им. Н.Н. Блохина» Минздрава России: конфликта интересов нет.
12. Медведева Б.М.._д.м.н.. ведущий научный сотрудник рентгенодиагностического отделения ФГБУ «НМИП онкологии им. Н.Н. Блохина» Минздрава России: конфликта интересов нет.
13. Обухова О.А.. к.м.н.. заведующая отделением реабилитации ФГБУ «НМИП онкологии им. Н.Н. Блохина» Минздрава России: конфликта интересов нет.
14. Петров А.С.. к.м.н.. врач-онколог отделения абдоминальной хирургии хирургического отделения абдоминальной онкологии ФГБУ «НИИ онкологии им. Н.Н. Петрова» Минздрава России: конфликта интересов нет.
15. Поддужный Д.В.. д.м.н.. заведующий отделением опухолей печени и поджелудочной железы ФГБУ «НМИП онкологии им. Н.Н. Блохина» Минздрава России: конфликта интересов нет.
16. Пропенко С.А.. проф.. д.м.н.. заведующий отделением химиотерапии и инновационных технологий ФГБУ «НМИП онкологии им. Н.Н. Петрова» Минздрава России: конфликта интересов нет.
17. Рыжков А.Д.. проф.. д.м.н.. ведущий научный сотрудник лаборатории радиоизотопной диагностики отдела радиоизотопной диагностики и терапии НИИ клинической и экспериментальной радиологии ФГБУ «НМИП онкологии
им. Н.Н. Блохина» Минздрава России: конфликта интересов нет.18. Рыков И.В.. заместитель ставного врача по клинической работе Медицинского института им. Березина Сергея (МИБО. Санкт-Петербург: конфликта интересов нет.
19. Сидоров 7Т.В.. д.м.н.. руководитель абдоминального отделения МНИОИ им. П.А. Герттена - филиала ФГБУ «НМИП радиологии» Минздрава России: конфликта интересов нет.
20. Трякин А.А..д.м.н.. главный научный сотрудник онкологического отделения лекарственных методов лечения (химиотерапевтического! № 2 ФГБУ «НМИП онкологии им. Н.Н. Блохина» Минздрава России:
21. Цуканов А.С.. д.м.н.. руководитель отдела лабораторной генетики ФГБУ «ГНПК им. А.Н. Рыжих» Минздрава России, конфликта интересов нет.
22. Шелыгин Ю.А.. чл.-корр. РАН, д.м.н.. проф.. президент Общероссийской общественной некоммерческой организаттии «Ассоттиаттия колопроктологов России» директор
ФГБУ «ГНПК им. А.Н. Рыжих» Минздрава России, главный внештатный спеттиалист-колопроктолог Минздрава Росси23. Петров Л.О.. к.м.н.. руководитель отделения лучевого и хирургического лечения заболеваний абдоминальной области Медицинского радиологического научного центра им. А.Ф. Пыба - филиала ФГБУ «НМИП Радиологии» Минздрава России, конфликта интересов нет.
24. Лротнева И.В. завепукштий отлелением-врач-ралиотерапевт Отделения лучевой терапии МНИОИ им. П.А. Герттена-филиал ФГБУ «НМИТТ радиологии» Минздрава России
25. Феденко А.А.. заведующий Отдела лекарственного лечения опухолей МНИОИ им. П.А. Герпена-филиал ФГБУ «НМИП радиологии» Минздрава России
26. Фалалеева Н.А..заведующий отделом лекарственного лечения злокачественных новообразований МРНТТ им. А.Ф. ТТыба- филиал ФГБУ «НМИТТ радиологии» Минздрава России
27. Филоненко Е.В.. заведующий Центра лазерной и фотодинамической диатостики и терапии опухолей МНИОИ им. П.А. Герпена-филиал ФГБУ «НМИП радиологии» Минздрава России
Блок по организации медицинской помощи
28. Невольских А.А., д.м.н., заместитель директора по лечебной работе МРНЦ им. А.Ф. Цыба - филиала ФГБУ «НМИЦ радиологии» Минздрава России.
29. Иванов С.А., проф. РАН, д.м.н., директор МРНЦ им. А.Ф. Цыба - филиала ФГБУ «НМИЦ радиологии» Минздрава России.
30. Хайло ва Ж.В., к.м.н., заместитель директора по организационно-методической работе МРНЦ им. А.Ф. Цыба - филиала ФГБУ «НМИЦ радиологии» Минздрава России.
31. Геворкян Т.Г., заместитель директора НИИ клинической и экспериментальной радиологии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
Конфликт интересов отсутствует.Приложение А2. Методология разработки клинических рекомендации
Целевая аудитория данных клинических рекомендаций:
1. Врачи -онкологи.
2. Врачи-хирурги.
3. Врачи-радиологи.
4. Врачи-генетики.
5. Врачи-радиотерапевты.
6. Врачи-колопроктологи.
7. Врачи-эндоскописты.
8. Клинические фармакологи.
9. Специалисты по медицинской реабилитации.
Методы, использованные для сбора/селекции доказательств: поиск в электронных базах данных; анализ современных научных разработок по проблеме рака ободочной кишки и ректосигмоидного перехода в РФ и за рубежом; обобщение практического опыта российских и зарубежных специалистов.
Шкала оценки уровней достоверности доказательств для методов диагностики, профилактики, лечения и реабилитации (диагностических, профилактических, лечебных, реабилитационных вмешательств) и шкала оценки уровней убедительности рекомендаций для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств) представлены ниже.
Шкала оценки уровней достоверности доказательств для методов диагностики (диагностических вмешательств)
Уровень достоверности доказательств Расшифровка
1 Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением мета-анализаметаанализа
2 Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением мета-анализаметаанализа
3 Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода или нерандомизированные сравнительные исследования, в том числе когортные исследования
4 Несравнительные исследования, описание клинического случая
5 Имеется лишь обоснование механизма действия или мнение экспертов
Шкала оценки уровней достоверности доказательств для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)
Уровень достоверности доказательств Расшифровка
1 Систематический обзор рандомизированных контролируемых исследований с применением мета-анализаметаанализа
2 Отдельные рандомизированные контролируемые исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных контролируемых исследований, с применением мета-анализаметаанализа
3 Нерандомизированные сравнительные исследования, в том числе когортные исследования
4 Несравнительные исследования, описание клинического случая или серии случаев, исследования «случай-контроль»
5 Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов
Шкала оценки уровней убедительности рекомендаций для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств)
Экономический анализ. Анализ стоимости не проводился и публикации по фармакоэкономике не анализировались.
Метод валидизации рекомендаций:
• Внешняя экспертная оценка.
• Внутренняя экспертная оценка.
Описание метода валидизации рекомендаций
Настоящие рекомендации в предварительной версии рецензированы независимыми экспертами, которые попросили прокомментировать, прежде всего, насколько интерпретация доказательств, лежащих в основе рекомендаций, доступна для понимания.
Получены комментарии врачей-детских онкологов первичного звена в отношении доходчивости изложения рекомендаций и их оценка важности рекомендаций как рабочего инструмента повседневной практики.
Комментарии, полученные от экспертов, тщательно систематизировались и обсуждались председателем и членами рабочей группы. Каждый пункт обсуждался и вносимые в результате этого изменения в рекомендации регистрировались. Если же изменения не вносились, то регистрировались причины отказа от внесения изменений.
Консультации и экспертная оценка: проект рекомендаций рецензирован также независимыми экспертами, которых попросили прокомментировать, прежде всего, доходчивость и точность интерпретации доказательной базы, лежащей в основе рекомендаций.
Для окончательной редакции и контроля качества рекомендации повторно проанализированы членами рабочей группы, которые пришли к заключению, что все замечания и комментарии экспертов приняты во внимание, риск систематических ошибок при разработке рекомендаций сведен к минимуму.
Обновления клинических рекомендаций: актуализация проводится не реже чем 1 раз в 3 года с учетом появившейся новой информации о диагностике и тактике ведения пациентов раком ободочной кишки и ректосигмоидного перехода, но не чаще чем 1 раз в 6 месяцев.
Решение об обновлении принимает Министерство здравоохранения РФ на основе предложений, внесенных медицинскими профессиональными некоммерческими организациями. Сформированные предложения должны учитывать результаты комплексной оценки лекарственных препаратов, медицинских изделий, а также результаты клинической апробации.
При отборе публикаций как потенциальных источников доказательств использованная в каждом исследовании методология изучается для того, чтобы убедиться в ее достоверности. Результат изучения влияет на уровень доказательств, присваиваемый публикации, что, в свою очередь, влияет на силу вытекающих из нее рекомендаций.
Приложение АЗ. Связанные документы
Приложение Г.
Критерии для генетического обследования пациентов с подозрением на синдром Линча, разработанные ФГБУ «ГНЦК им. А.Н. Рыжих» для российских пациентов.
1. Пациент с колоректальным раком в возрасте до 43 лет.
2. Наряду с колоректальным раком еще 2 случая и более злокачественных опухолей любой локализации у самого пациента или у кровных родственников независимо от возраста.
Критерии Amsterdam I
1. По крайней мере у 3 родственников присутствует гистологически верифицированный колоректальный рак, один из них - родственник 1-й линии.
2. Заболевание прослеживается по крайней мере в 2 поколениях.
3. По крайней мере у 1 из родственников колоректальный рак диагностирован в возрасте до 50 лет.
4. Семейный аденоматозный полипоз исключен [121].
Приложение Г2. Критерии Amsterdam II
Название на русском: Критерии Amsterdam II
Оригинальное название: Amsterdam II Criteria
Источник: Amsterdam II Criteria: Vasen HF, et al. New clinical criteria for hereditary nonpolyposis
colorectal cancer (HNPCC, Lynch syndrome) proposed by the International Collaborative group onHNPCC. Gastroenterology. 1999;116:1453-6.
Тип: критерии
Назначение: оценка целесообразности выполнения тестирования на MSI
Содержание и интерпретация:
Критерии:
1. По крайней мере у 3 родственников развился рак, связанный с синдромом Линча (колоректальный рак, рак эндометрия, рак желудка, яичников, мочеточника/почечной лоханки, головного мозга, тонкой кишки, гепатобилиарного тракта и кожи (сальных желез)), один из них - родственник 1-й линии.
2. Заболевание прослеживается по крайней мере в 2 поколениях.
3. По крайней мере у 1 из родственников связанный с синдромом Линча рак диагностирован в возрасте до 50 лет.
4. Семейный аденоматозный полипоз исключен в случаях наличия колоректального рака.
5. Опухоли по возможности должны быть верифицированы.
Приложение ГЗ. Критерии Bethesda для тестирования на MSI (микросателлитную нестабильность)
Название на русском: Критерии Bethesda для тестирования на MSI
Оригинальное название: The Revised Bethesda Guidelines for testing colorectal tumors for microsatellite instability (MSI)
Источник: Laghi L. et al. Re: Revised Bethesda guidelines for hereditary nonpolyposis colorectal cancer (Lynch syndrome) and microsatellite instability //Journal of the National Cancer Institute. -2004. - T. 96. - №. 18. - C. 1402-1403.
Тип: критерии
Назначение: оценка целесообразности выполнения тестирования на MSI
Содержание и интерпретация:
Критерии:
1. Колоректальный рак у пациента младше 50 лет.
2. Наличие синхронного, метахронного колоректального рака для другого рака, который может быть связан с синдромом Линча, вне зависимости от возраста.
3. Колоректальный рак с выявленным при гистологическом исследовании высоким уровнем микросателлитной нестабильности (MSI-H) у пациента в возрасте до 60 лет.
4. Колоректальный рак у одного или более родственника 1-й линии с заболеванием, которое может быть связано с синдромом Линча, по крайней мере 1 из случаев заболевания выявлен в возрасте до 50 лет.
5. Колоректальный рак у 2 или более родственников 1-й или 2-й линии с заболеваниями, которые могут быть связаны с синдромом Линча, вне зависимости от возраста.
Приложение Г4. Критерии степени оценки регрессии опухоли в ответ на лечение по Mandard
Название на русском: Критерии степени оценки регрессии опухоли в ответ на лечение по Mandard
Оригинальное название: Prognostic value of mandard and dworak tumor regression grading
Источник: Santos M. D. et al. Prognostic value of mandard and dworak tumor regression grading in rectal cancer: study of a single tertiary center //ISRN surgery. - 2014. - T. 2014.
Тип: критерии
Назначение: оценка регрессии опухоли в ответ на лечение Содержание и интерпретация:
I степень регрессии опухоли (полная регрессия) (TRGI) отсутствие опухолевых клеток, наличие очага фиброза на месте опухоли (возможно отсутствие фиброза).II степень регрессии опухоли (TRG2) отсутствие опухолевых клеток, наличие очага фиброза на месте опухоли (возможно отсутствие фиброза).
III степень регрессии опухоли (TRG3) большое количество сохраненных опухолевых клеток на фоне преобладания фиброза.
IV степень регрессии опухоли (TRG4) опухолевые элементы преобладают над фиброзными изменениями.
V степень регрессии опухоли (TRG5) отсутствие признаков регрессии опухоли, отсутствие фиброза
Приложение Г5. Критерии оценки по шкале
Название на русском: Критерии оценки по шкале ECOG Оригинальное название: The ECOG Scale of Perfonnance Status
Источник: Oken M.M. et al. Toxicity and response criteria of the Eastern Cooperative Oncology Group //Am. J. Clin. Oncol. 1982. Vol. 5, № 6. P. 649-65
Тип: шкала оценки
Теги: новообразования
234567 Начало активности (дата): 12.01.2023 21:37:00
234567 Кем создан (ID): 989
234567 Ключевые слова: новообразования ободочной кишки, ректосигмоидный отдел, рентген, лимфотические узлы
12354567899
Похожие статьи
Лимфома из клеток мантииЗлокачественные новообразования влагалища
Рентген на дому 8 495 22 555 6 8
Злокачественные опухоли слюнных желез
Забрюшинные неорганные саркомы



