 09.01.2023
09.01.2023
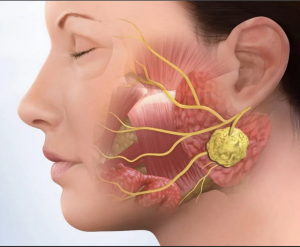
Злокачественные опухоли слюнных желез
Основные этиологическии факторы злокачественных опухолей слюнных желез
Разработчик клинической рекомендации
• • Общероссийский национальный союз "Ассоциация онкологов России"
• • Общероссийская общественная организация "Российское общество специалистов по опухолям головы и шеи"
• • Общероссийская общественная организация "Федерация специалистов по лечению заболеваний головы и шеи"
Одобрено Научно-практическим Советом Минздрава РФ
Список сокращений
Гр - ГрейДЛТ - дистанционная лучевая терапия
ЗНО - злокачественное новообразование
ЛУ - лимфатические узлы нед - неделя
УЗИ - ультразвуковое исследование
КТ - компьютерная томография
ЛФК - лечебная физическая культура
ТАБ - тонкоигольная аспирационная биопсия
ЛТ - лучевая терапия
МРТ - магнитно-резонансная томография
ПЭГ - перкутанная эндоскопическая гастростома
ПЭТ-КТ - позитронно-эмиссионная томография, совмещенная с компьютерной томографией
УДД - уровень достоверности доказательств
УУР - уровень убедительности рекомендаций
ХЛТ - химиолучевая терапия
XT - химиотерапия
AJCC - Американский объединенный комитет по изучению злокачественных опухолей (American Joint Committee on Cancer)
ECOG - шкала оценки общего состояния онкологического больного по версии Восточной объединенной группы онкологов
ENE - экстранодальное распространение опухоли в лимфатических узлах (extranodalextension)
NaF - фторид натрия
R0 - свободный от опухоли край резекции R1 - микроскопическая остаточная опухоль
TNM - (аббревиатура от tumor, nodus и metastasis) международная классификация стадий развития раковых опухолей
Термины и определения
Большие слюнные железы - околоушная слюнная железа, подчелюстная слюнная железа, подъязычная слюнная железа.
Комплексное противоопухолевое лечение - специализированное лечение онкологических пациентов, включающее в себя сочетание трех методов (хирургическое лечение, лучевая терапия и химиотерапия)
Пререабилитация (prehabilitation) - реабилитация с момента постановки диагноза до начала лечения (хирургического лечения/химиотерапии/лучевой терапии).
I этап реабилитации - реабилитация в период специализированного лечения основного заболевания (включая хирургическое лечение/химиотерапию/лучевую терапию) в отделениях медицинских организаций по профилю основного заболевания.
II этап реабилитации - реабилитация в стационарных условиях медицинских организаций (реабилитационных центров, отделений реабилитации) в ранний восстановительный период течения заболевания, поздний реабилитационный период, период остаточных явлений течения заболевания.
III этап реабилитации - реабилитация в ранний и поздний реабилитационный периоды, период остаточных явлений течения заболевания в отделениях (кабинетах) реабилитации, физиотерапии, лечебной физкультуры, рефлексотерапии, мануальной терапии, психотерапии, медицинской психологии, кабинетах логопеда (учителя-дефектолога), оказывающих медицинскую помощь в амбулаторных условиях, дневных стационарах, а также выездными бригадами на дому (в т.ч. в условиях санаторно-курортных организаций).
1. Краткая информация
1.1. Определение заболевания или состояния (группы заболеваний или состояний)
Злокачественные опухоли слюнных желез - злокачественные новообразования слюнных желез, различающиеся по своему морфологическому строению [1].
1.2. Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
Основными этиологическими факторами развития злокачественных опухолей слюнных желез являются:
• воспалительные заболевания;
• алиментарные факторы;
• гормональные и генетические нарушения;
• курение [1].
1.3. Эпидемиология заболевания или состояния (группы заболеваний или состояний)
Новообразования слюнных желез составляют 1-5 % среди всех злокачественных опухолей и 3 % среди опухолей головы и шеи. Пик заболеваемости приходится на возраст 15-39 лет [2] [3].
1.4. Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификаций болезней и проблем, связанных со здоровьем
Злокачественное новообразование околоушной слюнной железы (С07).
Злокачественное новообразование других и неуточненных больших слюнных желез (С08).
С08.0 - Злокачественное новообразование поднижнечелюстной железы.
С08.1 - Злокачественное новообразование подъязычной железы.
С08.8 - Поражение больших слюнных желез, выходящее за пределы одной или более вышеуказанных локализаций.
С08.9 - Злокачественное новообразование большой слюнной железы неуточненной.
1.5. Классификация заболевания или состояния (группы заболеваний или состояний)
Международная гистологическая классификация опухолей слюнных желез (классификация Всемирной организации здравоохранения, 4-е издание, 2010 г.).
Злокачественные эпителиальные опухоли:
8550/3 Ацинозно-клеточный рак.
8430/3 Мукоэпидермоидный рак.
8200/3 Аденокистозный рак.
8525/3 Полиморфная аденокарцинома низкой степени злокачественности.
8562/3 Эпителиально-миоэпителиальный рак.
8310/3 Светлоклеточная аденокарцинома, БДУ.
8147/3 Базальноклеточная аденокарцинома.
8440/3 Цистаденокарцинома.
8480/3 Муцинозная аденокарцинома.
8290/3 Оксифильная аденокарцинома.
8500/3 Инфильтрирующий протоковый рак, БДУ.
8140/3 Аденокарцинома, БДУ.
8982/3 Злокачественная миоэпителиома.
8941/3 Рак в плеоморфной аденоме.
8980/3 Карциносаркома.
8940/3 Смешанная опухоль, злокачественная, БДУ.
8070/3 Плоскоклеточный рак, БДУ.
8041/3 Мелкоклеточный рак.
8012/3 Крупноклеточный рак, БДУ.
8082/3 Лимфоэпителиальный рак.
8974/1 Сиалобластома.
Доброкачественные эпителиальные опухоли:
8940/0 Плеоморфная аденома.
8982/0 Миоэпителиома.
8147/0 Базальноклеточная аденома.
8561/0 Аденолимфома.
8290/0 Оксифильная аденома.
8149/0 Канальцевая аденома.
8410/0 Аденома сальных желез.
8503/0 Внутрипротоковая папиллома.
8406/0 Папиллярная сирингоаденома.
8440/0 Цистаденома, БДУ.
Международная классификация стадий развития раковых опухолей TNM
Степень распространенности злокачественных опухолей слюнных желез представлена в международной классификации стадий развития раковых опухолей TNM 8-е издание в редакции Американский объединенный комитет по изучению злокачественных опухолей (American Joint Committee on Cancer).
Основную группу новообразований слюнных желез составляют опухоли эпителиального происхождения (95 %), причем в 80-90 % случаев они развиваются в больших слюнных железах, в 10 % - в малых слюнных железах.
Значительную роль в прогнозе имеет степень злокачественности опухоли.
Символ Т содержит следующие градации:
Тх - недостаточно данных для оценки первичной опухоли.
То - первичная опухоль не определяется.
Ti - опухоль 2 см или менее в наибольшем измерении без распространения за пределы паренхимы железы.
Т2 - опухоль более 2 см, но не более 4 см в наибольшем измерении без распространения за пределы паренхимы железы.
Тз - опухоль более 4 см в наибольшем измерении и/или распространение за пределы паренхимы железы.
Т4а - опухоль распространяется на кожу, нижнюю челюсть, слуховой проход и/или лицевой нерв.
Т4ь - опухоль распространяется на крыловидные отростки, основание черепа или на внутреннюю сонную артерию.
Символ cN указывает на наличие или отсутствие метастазов в регионарных лимфатических узлах (ЛУ) по данным клинико-инструментальных исследований.
1.6. Клиническая картина заболевания или состояния (группы заболеваний или состояний)
Клиническое течение опухолей слюнных желез во многом определяется локализацией, распространенностью и морфологическим строением. Опухоль, как правило, представляет собой безболезненное узловое образование плотноэластической консистенции, не спаянное с кожей, подвижное при пальпации. Клиническое течение опухолей, локализующихся в глоточном отростке околоушной слюнной железы, имеет особенности. Снаружи опухоль не пальпируется, определяется лишь незначительная припухлость в околоушной области. Со стороны глоточной стенки выявляется деформация, которая может быть выражена различно, в зависимости от размеров образования.
Рост опухоли всегда происходит в направлении ротовой полости, кнаружи опухоль не распространяется, т.к. этому мешает нижняя челюсть. При распространенных процессах не редко отмечается инфильтрация кожи, ограничение смещаемости образования, иногда болезненность при пальпации. Явления пареза мимической мускулатуры являются крайне неблагоприятным прогностическим признаком, свидетельствующим о местной распространенности процесса
2. Диагностика
Диагноз устанавливается на основании:
1. анамнестических данных, а именно наличие новообразования;
2. физикального обследования, включающего тщательный клинический осмотр, пальпацию образования и прилежащих тканей и регионарных ЛУ;
3. цитологического исследования биопсийного материала (первичной опухоли, увеличенных или подозрительных ЛУ);
4. патолого-анатомического исследования операционного материала;
5. инструментального обследований, включая ультразвуковое исследование (УЗИ) мягких тканей лица, дна полости рта, УЗИ шеи, компьютерную томографию (КТ)/ магнитно-резонансную томографию (МРТ), позитронно-эмиссионную компьютерную томографию, совмещенную с компьютерной томографией (ПЭТ-КТ) [5].
2.1. Жалобы и анамнез
• Рекомендуется тщательный сбор жалоб и анамнеза у всех пациентов при подозрении на злокачественное новообразование слюнных желез с целью выявления факторов, которые могут повлиять на выбор тактики лечения [6] [7].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 4)
2.2. Физикальное обследование
Рекомендуется при подозрении на злокачественное новообразование слюнных желез тщательный физикальный осмотр пациента, включающий осмотр и бимануальную пальпацию очага поражения и регионарных ЛУ, оценку нутритивного статуса и других аспектов с целью выявления факторов, которые могут повлиять на выбор тактики лечения[4,7].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5)
2.3. Лабораторные диагностические исследований
• Рекомендуется в рамках проведения цитологического исследования биопсийного материала (см. 2.5) и патологоанатомического исследования операционного материала (см. 3.1) с целью выявления факторов, которые могут повлиять на выбор тактики лечения и прогноз заболевания оценить следующие параметры с их отражением в заключении:
1. размеры опухоли;
2. глубина инвазии опухоли;
3. гистологическое строение опухоли;
4. степень дифференцировки опухоли;
5. наличие лимфоваскулярной, периневральной инвазии (отрицательный результат также должен бьггь констатирован);
6. рТ;
7. pN (с указанием общего числа исследованных и поражённых лимфоузлов, признаков экстранодального распространения опухоли);
8. наличие поражения краев резекции (отрицательный результат также должен бьггь констатир ован)
9. степень лечебного патоморфоза опухоли (TRG) (при ранее проведенном лечении) [5,6,8-11].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 4)
2.4. Инструментальные диагностические исследования
• Рекомендуется всем пациентам с подозрением на злокачественное новообразование слюнных желез выполнить УЗИ мягких тканей, ЛУ шеи и подозрительных ЛУ с целью верификация заболевания и определения распространенности [12].
Уровень убедительности рекомендаций - В (уровень достоверности доказательств - 1)
• Рекомендуется всем пациентам со злокачественными новообразованиями слюнных желез выполнить КТ органов грудной полости с целью выявления факторов, которые могут повлиять на выбор тактики лечения - для исключения отдаленных метастазов [7].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5)
• Рекомендуется выполнить КТ или МРТ лицевого отдела черепа с внутривенным контрастированием в случае подозрения распространения опухоли на нижнюю/верхнюю челюсти, основание черепа, с целью исключения вовлечения указанных структур [7,13].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 4)
• Рекомендуется выполнить ПЭТ-КТ всего тела при подозрении на наличие отдаленных метастазов с целью уточнения распространенности заболевания [14].
Уровень убедительности рекомендаций - В (уровень достоверности доказательств - 2)
2.5. Иные диагностические исследования
• Рекомендуется всем пациентам с подозрением на злокачественное новообразование слюнных желез выполнить тонкоигольную аспирационную биопсию (ТАБ) первичной опухоли и подозрительных ЛУ с последующим цитологическим исследованием биопсийного материала в целях дифференциальной диагностики с доброкачественными новообразованиями, верификации диагноза и определения степени распространенности опухолевого процесса [12,15].
Уровень убедительности рекомендаций - В (уровень достоверности доказательств - 1)
Комментарий: при неинформативности цитологического исследования целесообразно выполнить патоморфологшеское исследование биопсийного материала. При положительном результате патолого-анатомического исследования биопсийного материала (злокачественная опухоль верифицирована) необходимо определить гистологический тип опухоли, при этом целесообразно установить степень дифференцировки опухоли. При сомнительном результате патолого-анатомического исследования биопсийного материала (диагноз новообразования не верифицирован) необходимо в обязательном порядке выполнить повторную биопсию новообразования в достаточном объеме для проведения дополнительных специальных методов прижизненного патолого-анатомического исследования (иммуногистохимическое типирование). При отрицательном результате патолого-анатомического исследования биопсийного материала повторная биопсия целесообразна при наличии убедительных клинических и/или рентгенологических признаков злокачественного новообразования.
3. Лечение
Назначение и применение лекарственных препаратов, указанных в клинических рекомендаций, направлено на обеспечение пациента клинически эффективной и безопасной медицинской помощи, в связи с чем их назначение и применение в конкретной клинической ситуации определяется в соответствии с инструкциями по применению конкретных лекарственных препаратов с реализацией представленных в инструкции мер предосторожности при их применении, также возможна коррекция доз с учетом состояния пациента.
3.1. Выбор метода лечения
Далее представлены принципы лечения эпителиальных злокачественных новообразований слюнных желез. Принципы лечения неэпителиальных злокачественных опухолей (сарком, лимфом) слюнных желез не отличаются от таковых при иных локализациях указанных нозологий (см. соответствующие клинические рекомендации по вопросам оказания медицинской помощи пациентам при злокачественных новообразованиях лимфоидной, кроветворной и родственной им тканей и злокачественных новообразованиях других типов соединительной и мягких тканей.
• Рекомендуется рассматривать хирургическое вмешательство как основной метод радикального лечения пациентов со эпителиальными злокачественными новообразованиями слюнных желез [16,17].
Уровень убедительности рекомендаций - В (уровень достоверности доказательств - 3)
• При стадиях Т1-Т2, N0 рекомендовано полное хирургическое удаление первичной опухоли. В случае выявления при плановом патолого-анатомическом исследовании операционного материала аденокистозного рака средней/низкой степени дифференцировки, мукоэпидермоидного рака низкой степени дифференцировки или неблагоприятных гистологических признаков (положительные края, периневральная инвазия) рекомендовано проведение послеоперационной дистанционной лучевой терапии (ДЛТ) [ 16,18].
Уровень убедительности рекомендаций - В (уровень достоверности доказательств - 3).
• При стадиях Tl-2, N+M0 рекомендовано полное хирургическое удаление первичной опухоли в сочетании с шейной лимфодиссекцией с последующим проведением в послеоперационном периоде ДЛТ [16,19].
Уровень убедительности рекомендаций - В (уровень достоверности доказательств - 3)
• При стадиях Т3-4а, N0 МО рекомендовано полное хирургическое удаление первичной опухоли, в случае аденокистозного рака средней или низкой степени дифференцировки -в сочетании с шейной лимфодиссекцией, в послеоперационном периоде рекомендовано проведение ДЛТ [16].
Уровень убедительности рекомендаций - В (уровень достоверности доказательств - 3).
• При стадиях Т3-4а, N0 МО в случае выявления при плановом патолого-анатомическом исследовании операционного материала неблагоприятных гистологических признаков (средне-, низкодифференцированная опухоль, положительные края, периневральная инвазия, сосудистая эмболия) рекомендовано рассмотреть вопрос о проведении конкурентной химиолучевой терапии (ХЛТ) [7].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5)
• При стадии Т3-4а, N + МО рекомендовано полное хирургическое удаление первичной опухоли в сочетании с шейной лимфодиссекцией с последующим проведением в послеоперационном периоде ДЛТ [16].
Уровень убедительности рекомендаций - В (уровень достоверности доказательств - 3).
• При стадии Т3-4а, N + МО в случае выявления при плановом патолого-анатомическом исследовании операционного материала неблагоприятных гистологических признаков
(средне-, низкодифференцированная опухоль, положительные края, периневральная инвазия, опухолевые эмболы в сосудах) рекомендовано рассмотреть вопрос о проведении конкурентной ХЛТ [7,13]
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• При невозможности выполнения радикального оперативного вмешательства на первом этапе всем пациентам рекомендовано проведение ЛТ или конкурентной ХЛТ с учетом общего состояния пациента [7].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5)
• При стадии Т4Ь рекомендована ЛТ или конкурентная ХЛТ с учетом общего состояния пациента [16].
Уровень убедительности рекомендаций - В (уровень достоверности доказательств - 3).
• При локорегионарном рецидиве заболевания без предшествующей лучевой
терапии (ЛТ) рекомендовано полное хирургическое удаление опухоли с последующим проведением послеоперационной ДЛТ. В случае выявления при плановом патологоанатомическом исследовании операционного материала неблагоприятных гистологических признаков (средне-, низкодифференцированная опухоль, положительные края, периневральная инвазия, сосудистая эмболия) рекомендовано рассмотреть вопрос о проведении конкурентной ХЛТ. При невозможности выполнения радикального оперативного вмешательства на первом этапе рекомендована конкурентная ХЛТ [7].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• При локорегионарном рецидиве после ЛТ рекомендовано полное хирургическое удаление с решением вопроса о повторной лучевой терапией с/без комбинированной химиотерапии. При невозможности выполнения радикального оперативного вмешательства рекомендовано рассмотреть вопрос о повторной ЛТ [7].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5)
• В случае выявления отдаленных метастазов и состояния пациента 0-3 по шкале оценки общего состояния онкологического больного по версии Восточной объединенной группы онкологов (ECOG) рекомендовано проведение XT, или выжидательная тактика (при медленной прогрессии опухоли), или селективная метастазэктомия, или антиандрогенная терапия при наличии рецепторов к андрогенам [7,13]
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5)
• При наличии рецепторов к андрогенам у пациента с отдаленными метастазами и состоянием по ECOG 0-3 рекомендовано в рамках антиандрогенной терапии назначение #бикалутамида** в дозе 150 мг 1 раз в сутки энтерально до прогрессирования или неприемлемой токсичности [20].
Уровень убедительности рекомендаций - В (уровень достоверности доказательств - 3)
• При HER2- положительном раке слюнных желез у пациента с отдаленными метастазами и состоянием по ECOG 0-3 в случае отсутствия отчета на иное лечение, в том числе комбинированную химиотерапию, рекомендуется назначение #трастузумаба** 2мг/кг массы тела (4 мг/кг - нагрузочная доза) в/в кап 1 раз в неделю (нед) в виде монотерапии [21] или 4 мг/кг (8 мг/кг - нагрузочная доза) в/в кап 1 раз в 3 нед в составе комбинированной химиотерапии [22].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 4)
3.2. Принципы ЛТ
• В случае назначения ЛТ в самостоятельном варианте рекомендована
дистанционная ЛТ в следующем режиме - первичный очаг и клинически определяемые регионарные метастазы - 66-70 (2 Ерей (Ер)/фракция), 5 раз в неделю в течение 6-7 недель; клинически не измененные ЛУ- 50 Ер (2,0 Ер/фракция) [16,23,24].
Уровень убедительности рекомендаций - В (уровень достоверности доказательств - 3)
• В качестве послеоперационной ЛТ при наличии неблагоприятных гистологических признаков рекомендована дистанционная ЛТ в следующем режиме - первичный очаг и клинически определяемые регионарные метастазы - 60-66 Гр (2 Гр/фракция), 5 раз в неделю течении 6-6,5 недель; клинически не измененные ЛУ -50 Гр (2,0 Гр/фракция), интервал между оперативным вмешательством и сроком начала послеоперационной-ной ЛТ не должен превышать 6 недель [16,23,24].
Уровень убедительности рекомендаций - В (уровень достоверности доказательств - 3)
3.3. Принципы химиотерапии
Выбор XT должен быть индивидуализирован в зависимости от характеристик пациента (общее состояние, цели лечения).
• В качестве конкурентной ХЛТ рекомендовано назначение цисплатина**+ ЛТ с соблюдением следующего режима: ЛТ на первичный очаг (70 Гр) и ЛУ (50 Гр) - фракция 2 Гр/сут ежедневно (понедельник - пятница) в течение 7 нед.; Цисплатин** в дозе 100 мг/м2 на фоне гипергидратации в 1, 22 и 43-й дни ЛТ (суммарная доза во время ЛТ - 300 мг/м2) [25].
Уровень убедительности рекомендаций - В (уровень достоверности доказательств - 2)
• При рецидивных неоперабельных опухолях или наличии инкурабельных отдаленных метастазов рекомендованными предпочтительными режимами XT являются:
• #паклитаксел** 175 мг/м2 в/в в 1-й день (3-часовая инфузия) + карбоплатин** AUC 5,5 в/в в 1-й день, каждые 3 нед. [26];
• доксорубицин** 50 мг/м2 в 1 день + блеомицин** 30 мг в/в в 1-5 дни + цисплатин** 20 мг/ м2 1-5 дни каждые 3 нед. [27].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 4)
• При рецидивных неоперабельных опухолях или наличии инкурабельных отдаленных метастазов рекомендованными дополнительными режимами XT являются:
• доксорубицин** 60 мг/м2 1-й день + цисплатин** 40 мг/м2 1-й день каждые 3 нед;
• доксорубицин** 30 мг/м2 в/в в 1-й и 8-й дни + цисплатин** 50 мг/м2 в/в в 1-й и 8-й дни, каждые 3 нед;
• #паклитаксел** 60-80 мг/м2 в/в еженедельно + карбоплатин** AUC-2 в/в еженедельно до прогрессирования или неприемлемой токсичности;
Кумулятивная доза доксорубицина не должна превышать 450-500 мг/м2, количество курсов
XT зависит от эффекта и переносимости проводимого лечения [28].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5)
3.4. Принципы хирургического лечения
• Рекомендована оценка всех пациентов до лечения хирургом-онкологом, специализирующимся на опухолях головы и шеи, которому рекомендовано предпринять следующие действия:
• рассмотреть адекватность биопсийного материала, стадирования и визуализации опухолевого процесса (КТ, МРТ) для определения степени распространения опухоли,
• исключить наличие синхронной первичной опухоли,
• оценить текущий функциональный статус и возможность хирургического лечения, если первичное лечение было нехирургическим,
• разработать проспективный план наблюдения пациента, который будет включать адекватное обследование зубов, питания и здорового образа жизни, а также вмешательства и любые другие дополнительные исследования, которые необходимы для полной реабилитации пациента.
• для пациентов, которым выполняют плановые операции - проработать хирургическое вмешательство, края резекции клинически определяемой опухоли со свободными от опухоли хирургическими краями.
Хирургическое вмешательство не следует модифицировать на основании клинического ответа, полученного до лечения, при настоящем осмотре (регрессии опухоли), за исключением случаев прогрессии опухоли, которая вынуждает проводить более обширную операцию для охвата всей опухоли во время окончательной резекции [7,29]
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Комментарии:
Оценка операбельности.
Поражение опухолью следующих структур связано с плохим прогнозом или классифицируется как стадия Т4Ь (например, неоперабельность, связанная с технической невозможностью выполнить микроскопически радикальное оперативное вмешательство): значительное поражение крыловидно-нёбной ямки, тяжелые тризмы из-за инфильтрации опухолью крыловидных мышц; макроскопическое распространение опухоли на основание черепа (например, эрозия крыловидных пластинок или основной кости, расширение овального отверстия и др.); возможная инвазия (охват) стенки общей или внутренней сонной артерии. Охват обычно оценивается радиологически (по данным КТ и МРТ) и диагностируется, если опухоль окружает >270° окружности сонной артерии; непосредственное распространение опухоли из регионарных ЛУ с поражением кожи, прямое распространение на структуры средостения, предпозвоночную фасцию или шейные позвонки[ 17,29].
Удаление первичного очага.
По возможности рекомендовано выполнять удаление первичной опухоли единым блоком. Рекомендовано планировать хирургическое удаление в зависимости от степени распространения первичной опухоли, установленной при клиническом исследовании, и тщательной интерпретации соответствующих радиографических снимков. В случае если опухоль прилежит к двигательному или сенсорному нерву, не исключено наличие периневральной инвазии. В данной ситуации следует выделить нерв в проксимальном и дистальном направлениях и выполнить его резекцию до получения чистого края. Доказано, что для получения ткани, свободной от опухоли, полезна диагностика проксимального и дистального краев нерва методом замороженных срезов (срочное патолого-анатомическое исследование операционного материала). Предпочтительно выполнять одномоментную реконструкцию резецированного участка нерва [17] [30].
Края резекции.
Адекватное удаление определяется как расстояние от края резекции до макроскопически видимой опухоли >2 см или отрицательный край замороженного среза. В целом оценку замороженных срезов рекомендовано проводить интраоперационно в следующих случаях: если зона, макроскопически свободная от опухоли, по краю резекции составляет <2 см, невозможно определить линию резекции в связи с нечеткой границей опухоли, имеется подозрение на наличие резидуальной опухоли. Необходимо включать подробное описание края резекции в операционный журнал. Края можно оценить по удаленному препарату или, как альтернатива, из ложа опухоли с правильным ориентированием. Чистый край определяется как расстояние от инвазивного края опухоли до края резекции >5 мм. Близкий край определяется как расстояние от инвазивного края опухоли до края резекции <5 мм.
Первичную опухоль следует помечать таким образом, чтобы патологоанатом мог адекватно оценить ориентацию препарата. Шейную диссекцию необходимо ориентировать или выполнять срезы по порядку для определения уровня ЛУ, включенных в зону диссекции. Реконструкцию хирургических дефектов нужно проводить с использованием конвенциальной техники по усмотрению хирурга. По возможности рекомендуется первичное ушивание, но при этом не следует пренебрегать широкими краями резекции. По усмотрению врача-хирурга выполняется пластика с применением местных/регионарных лоскутов, свободных лоскутов, расщепленного кожного лоскута или других лоскутов с/без реконструкции нижней челюсти [17,31].
3.5 Обезболивание
Порядок и рекомендации по обезболиванию при злокачественных новообразованиях слюнных желез соответствуют рекомендациям, представленным в клинических рекомендациях «Хронический болевой синдром (ХБС) у взрослых пациентов, нуждающихся в паллиативной медицинской помощи».
4. Реабилитация
В случае реабилитации онкологических пациентов тактика восстановительного лечения и выбор ее методов не привязана к срокам госпитализации.На втором и третьем этапах реабилитации не исключается возможность применения гидротерапии, бальнеотерапии. Без уровня доказательности.
4.1. Пререабилитация
• Всем пациентам со злокачественными новообразованиями слюнных желез рекомендовано проведение пререабилитации, так как она значительно ускоряет функциональное восстановление, сокращает сроки пребывания в стационаре после операции и снижает частоту развития осложнений и летальных исходов на фоне лечения онкологического заболевания. Пререабилитация включает в себя физическую подготовку, психологическую и нутритивную поддержку, информирование пациентов [32].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• Пациентам со злокачественными новообразованиями слюнных желез, в особенности тем из них, у которых имеется выраженная мышечная слабость и высокая утомляемость, рекомендованы занятия лечебной физкультурой.
Физическая пререабилитация, как правило, состоит из аэробной нагрузки средней интенсивности, которая улучшает толерантность к физическим нагрузкам, улучшает качество жизни и увеличивает тонус мышц [33].
Уровень убедительности рекомендаций - А (уровень достоверности доказательств - 1)
• Пациентам со злокачественными новообразованиями слюнных желез, которым назначено хирургическое лечение, рекомендовано проведение лечебной физкультуры на предоперационном этапе, так как это уменьшает общее число осложнений в послеоперационном периоде, снижает частоту развития лимфедемы [34].
Уровень убедительности рекомендаций - В (уровень достоверности доказательств - 3)
• Пациентам со злокачественными новообразованиями слюнных желез, которым назначено комплексное противоопухолевое лечение, рекомендованы программы профилактической гимнастики и обучение тактике глотания до начала лечения, так как может уменьшить нарушения глотания при проведении данного вида лечения [35,36]
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• Нутритивно-метаболическая реабилитация в предоперационном периоде рекомендована при наличии хотя бы одного из указанных факторов: непреднамеренном снижении веса за последние 3 месяца (потеря 10 % и более), индексе массы тела менее 18,5 кг/м2, ухудшении возможности приема пищи за последнюю неделю, низкого объема пищи (калорийность менее 1500 ккал/сутки) [37].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Комментарии: Предпочтительный способ нутритивной поддержки - пероральное питание (сиппинг). При невозможности или неадекватности перорального питания необходима установка назогастрального зонда или наложение временной чрескожной (перкутанной) эндоскопической гастростомы (ПЭГ). При невозможности использования энтерального питания показано проведение парентерального питания. Калорийность рациона должна составлять 25-30 ккал/кг массы тела в сутки, доза белка - 1,0-1,5 г/кг массы тела в сутки. Необходимо восполнение суточной потребности в витаминах и микроэлементах. Предпочтительнее использовать готовые смеси, обогащенные белком и омега-3 жирными кислотами. Их использование достоверно снижает частоту инфекционных осложнений в послеоперационном периоде. Профилактическая установка назогастрального зонда или ПЭГ не рекомендована при нормальном питательном статусе, незначительной потере массы тела, отсутствии обструкции дыхательных путей, тяжелой дисфагии. Однако эти больные нуждаются в последующем мониторинге калорийности рациона и оценке динамики массы тела на протяжении всей противоопухолевой терапии. При необходимости во время
противоопухолевого лечения пли после его окончания может быть установлена временная ПЭГ или назогастральный зонд. Показаниями для профилактической установки назогастрального зонда или наложения ПЭГ являются: 1) достоверная значительная потеря массы тела (5 % от исходной массы тела за предыдущий месяц или 10 % от исходной массы тела за предшествующие 6 месяцев); 2) имеющаяся дегидратация, дисфагия, анорексия, болевой синдром, который ограничивает способность больного достаточно питаться или пить; 3) значимые коморбидные и морбидные состояния, которые могут усугубляться обезвоживанием, гипокалорийным рационом, невозможностью проглатывания необходимых медикаментов; 4) аспирационный синдром, особенно у пожилых людей или у пациентов, имеющих сердечно-легочную недостаточность; 5) пациенты, у которых вероятны длительные нарушения глотания, в том числе ожидаемые при проведении облучения. Однако следует учитывать и другие факторы риска нарушения функции глотания. Для поддержания функции глотания во время и после проведения противоопухолевой терапии при сохраненном акте глотания и отсутствия опасности аспирации показано естественное питание. Следует учитывать, что изменения функции глотания могут появиться в течение всего времени лечения и после его окончания и должны быть отслежены в течение всей жизни пациента.
• При невозможности перорального приема пищи пациентом рекомендуется зондовое, парентеральное или смешанное питание согласно расчетной потребности [37-39]
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Комментарии: Нутритивная поддержка, проводимая на амбулаторном этапе и продолженная в течение всего периода обследования, вплоть до проведения оперативного вмешательства, снижает число послеоперационных осложнений и длительность госпитализации. При сохранении перорального приема пищи предпочтение отдается высокобелковым готовым смесям, суточная дозировка не менее 400 мл в сутки.
Адекватная питательная поддержка в течение, как минимум, 7 суток снижает число послеоперационных осложнений и длительность пребывания в стационаре [40].
4.2.1 этап реабилитации при хирургическом лечении
• При хирургическом лечении пациента рекомендовано выполнение протоколов Fast track rehabilitation («быстрый путь») и Enhanced recovery after surgery (ускоренное восстановление после операции), в которые входит комплексное обезболивание, раннее начало энтерального питания, отказ от рутинного использования катетеров и дренажей, ранняя мобилизация пациентов с первых-вторых послеоперационных суток (активизация и вертикализация), с целью уменьшения длительности пребывания пациента в стационаре, снижения числа нехирургических осложнений и общего количества послеоперационных осложнений [41,42]
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 4)
• Ранняя мобилизация (вертикализация, выполнение комплекса лечебной физической культуры (ЛФК) с аэробной нагрузкой, упражнениями на сопротивление под контролем инструктора) рекомендована все пациентам при хирургическом лечении с целью улучшения функциональных возможностей пациента [43,44]
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• Купирование болевого синдрома в раннем послеоперационном периоде в сочетании с и физиотерапией, ЛФК, лечением положением, методами психологической коррекции, чрескожной электростимуляцией и применением акупунктуры рекомендовано всем пациентам с ЗНО слюнных желез с целью улучшения функциональных результатов [44].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• Массаж медицинский в послеоперационном периоде у пациентов, перенесших операцию на органах головы и шеи, рекомендован с целью улучшения качества жизни [45].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• В предоперационном периоде и в раннем послеоперационном периоде рекомендована консультация логопеда, который назначает комплекс специальных упражнений для восстановления функции глотания и обучения больного способности говорить. Для логопедической реабилитации существует ряд ограничений: не рекомендуется проводить
активную функциональную тренировку в раннем послеоперационном периоде, на этапе первичного заживления и при возникновении свищей. Недопустимо нарушение режима функциональных тренировок [46].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Комментарий: Для восстановления функции глотания у больных ЗНО слюнных желез используются упражнения на увеличение объема движения и силы мышц и на усиление произвольного контроля над временем и координацией глотка. Важна и постуральная поддержка, т. е. следует найти подходящую позу во время глотка. Дополнительно используются фонопедические техники (например, соскальзывание на фальцет), глотательные маневры (например, глоток с усилием), подбор текстур для глотания [47][48]. Для улучшения функции дыхания, особенно после наложения трахеостом, целесообразно использование координации вдоха и выдоха, совершение вдоха, достаточного для высказывания, поиск оптимального положения тела, паузация и дыхательные упражнения. Работа над дыханием строится но принципу восхождения от простого к сложному. Сначала предлагается сдувать легкие предметы с ладони и стола, отрабатывается последовательность фаз вдоха и выдоха, наращивается фаза выдоха, затем подключается фонационный выдох и также отрабатывается диафрагмальное дыхание. Во время функциональной тренировки выполняются упражнения для всех органов артикуляции: губы, щеки, язык, дно полости рта, твердое нёбо, мышцы мягкого нёба, мышцы глотки и наружные мышцы шеи [49] [50].
4.3. II этап реабилитации при хирургическом лечении
• Выполнение комплексов ЛФК после проведения радикального хирургического лечения по поводу рака головы и шеи рекомендовано всем пациентам с целью быстрейшего восстановления физической формы и улучшения качества жизни пациента [51].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• Поддержание стабильной массы тела и активный образ жизни всем пациентам с злокачественными новообразованиями слюнных желез после проведения хирургического лечения рекомендованы с целью увеличения общей выживаемости. Режим - аэробная нагрузка умеренной интенсивности 3-5 раз в неделю (суммарно 150 мин в неделю) в сочетании с тренировками на сопротивление 2-3 раза в неделю. Упражнения на сопротивление должны вовлекать основные группы мышц (8-10 групп мышц, 8-10 повторений, 2 подхода). Каждый сеанс должен включать разминку и заминку [52].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5)
4.4. II этап реабилитации при хирургическом лечении
• С целью преодоления тризма - тонического спазма группы жевательных мышц, который приводит к ограничению подвижности височно-нижнечелюстного сустава, - всем пациентам после проведения хирургического лечения рекомендованы упражнения, регулирующие степень открытия рта. Это статические, динамические упражнения и упражнения на сопротивление. Движения выполняются не только в плоскости опускания и поднятия челюсти. Для восстановления функции необходимы также другие движения: боковые, передние, задние и круговые [53].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 3)
• Рекомендовано раннее выявление и начало терапии при лимфедеме области головы и шеи, так как помогает избежать проблем, связанных с речью, дыханием, глотанием. Наибольшая эффективность терапии лимфедемы после комбинированного лечения опухолей головы и шеи отмечается при использовании всего комплекса противозастойной терапии (complete decongestive therapy) [54].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5)
• Полная противоотечная терапия (complete decongestive therapy) рекомендована в качестве «золотого стандарта» в лечении лимфедемы всех локализаций. Она включает ЛФК, компрессионную терапию, массаж шеи, волосистой части головы и лица медицинский и уход за кожей [55].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5)
• В лечении лимфедемы области головы и шеи в качестве ведущего метода рекомендован массаж шеи, волосистой части головы и лица медицинский [56].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 4)
• С целью лечения лимфедемы рекомендована низкочастотная магнитотерапия в сочетании с полной противоотечной терапией [57].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 4)
• Использование низкоинтенсивной лазеротерапии в комбинации с полной противозастойной терапией рекомендовано с целью ускорения снижения выраженности отека [58].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5)
4.5. Реабилитация при химиотерапии, комбинированной химиолучевой терапии
Противоопухолевое лечение рака головы и шеи вызывает психологический дистресс,
тревогу, депрессию, что ухудшает качество жизни пациентов [59].
• Всем пациентам, получающим послеоперационную XT, рекомендовано выполнение упражнений с нагрузкой с целью уменьшения слабости, улучшения качества жизни и психологического состояния. Раннее начало физических нагрузок на фоне XT рекомендовано в качестве профилактики мышечной слабости, возникновения и прогрессирования саркопении, снижения толерантности к физической нагрузке [60].
Уровень убедительности рекомендаций - В (уровень достоверности доказательств - 2).
• Всем пациентам, получающим XT, рекомендовано проведение комплекса ЛФК с включением аэробной нагрузки, элементов Тайчи в течение 4 месяцев на фоне XT с целью увеличения жизненной емкости легких, насыщенности крови кислородом, силы мышц, объема движений в крупных суставах, снижения индекса массы тела [61].
Уровень убедительности рекомендаций - А (уровень достоверности доказательств - 2)
• Для уменьшения утомляемости и повышения выносливости на фоне проведения ХЛТ рекомендовано проведение ЛФК. Оптимальный эффект дают аэробные упражнения средней интенсивности в сочетании с упражнениями на сопротивление [62].
Уровень убедительности рекомендаций -С (уровень достоверности доказательств - 2).
• Сочетание ЛФК с психологической поддержкой рекомендовано для лечения слабости на фоне XT [63].
Уровень убедительности рекомендаций - А (уровень достоверности доказательств - 1)
• Рекомендуется применение низкоинтенсивной лазеротерапии для лечения периферической полинейропатии, вознигоцей на фоне XT [64].
Уровень убедительности рекомендаций - В (уровень достоверности доказательств - 2)
• Рекомендована низкочастотная магнитотерапия для лечения периферической полинейропатии, вознигоцей на фоне XT [65].
Уровень убедительности рекомендаций - В (уровень достоверности доказательств - 2)
• Рекомендована чрескожная электростимуляция в течение 1 часа с перерывом в 5 часов в день на протяжении 4 недель для лечения полинейропатии на фоне химиотерапии [66].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 4)
• Рекомендована низкоинтенсивная лазеротерапия в профилактике мукозитов полости рта на фоне XT [67].
Уровень убедительности рекомендаций - А (уровень достоверности доказательств - 1)
• Рекомендовано проведение низкоинтенсивной лазеротерапии для лечения мукозита полости рта, возникшего на фоне XT [68].
Уровень убедительности рекомендаций - А (уровень достоверности доказательств - 1)
4.6. Реабилитация при лучевой терапии
• Через 3 дня после начала лучевой терапии рекомендовано подключить низкоинтенсивную лазеротерапию, 3 дня в неделю для профилактики лучевого дерматита [69].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5)
5. Профилактика
• Рекомендуется в целях своевременного выявления и предупреждения осложнений и обострений заболевания соблюдать следующую периодичность обследований пациентов после завершения лечения - в первые 1-2 года обследование пациента с рекомендуется проводить каждые 3-6 месяца, на сроке 3-5 лет - 1 раз в 6-12 месяцев, после 5 лет с момента операции обследование проводятся ежегодно или при появлении жалоб. У пациентов с высоким риском рецидива перерыв между обследованиями может бьггь сокращен. Обследование пациента включает следующие мероприятия:1. сбор анамнеза и физикальное обследование;
2. УЗИ области первичной опухоли, ЛУ шеи с 2-х сторон,
3. КТ/МРТ области головы и шеи при выявлении признаков рецидива по результатам УЗИ и физикального осмотра, а также при недоступности зоны адекватному физикальному осмотру;
4. КТ органов грудной клетки каждые 12 месяцев;
5. определение уровня тиреотропного гормона каждые 6-12 месяцев, если проводилось облучение шеи с целью оценки функции щитовидной железы [70,71]
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5)
Комментарии: задачей наблюдения является раннее выявление прогрессирования заболевания с целью раннего начала химиотерапии или хирургического лечения резектабельных метастатических очагов, рецидивных опухолей, а также выявление метахронных опухолей головы и шеи [29].
• Рекомендуется наблюдение всех пациентов до, во время и после лучевой терапии у врача-стоматолога с целью оценки состояния полости рта, риска развития кариеса и пародонтоза, удаления «проблемных» зубов, профилактики радиоиндуцированного остеонекроза, устранения потенциальных источников инфекции, мотивации пациента к поддержанию гигиены полости рта. Проблемные зубы должны бьггь удалены не менее чем за 2 недели до начала специализированного лечения [72-77].
Уровень убедительности рекомендаций - В (уровень достоверности доказательств - 3)
Комментарий: ЛТ на область головы и шеи может являться причиной ксеростомии и дисфункции слюнных желез, что существенно повышает риск развития кариеса и ассоциированных нежелательных последствий, таких как дентоальвеолярная инфекция и остеорадионекроз. ЛТ также воздействует на ткани зуба, в результате чего повышается вероятность деминерализации на фоне ксеростомии, изменения микрофлоры после ЛТ и возникает приверженность к рациону питания, ассоциированному с кариесом. Более того, инфекционные процессы в полости рта ухудшают эффективность процессов репарации после хирургического лечения, требуют усиления режимов антибактериальной терапии. Радиоассоциированный кариес и другие изменения ткани зуба могут развиться в течение первых трех месяцев после завершения ЛТ.
• Рекомендуется всем пациентам после окончания лучевой терапии с целью профилактики кариеса применять ежедневно длительно местные средства с фтором -0,4% гель с фторидом олова или 1,1 % гель с фторидом натрия (NaF) (эффективность ниже фторида олова), или комбинацию - 0,4% гель с фторидом олова, 0,32% зубной порошок с NaF и препараты-заменители слюны с фосфатом кальция [78,79].
Уровень убедительности рекомендаций - В (уровень достоверности доказательств - 2)
Организация оказания медицинской помощи
Показания для госпитализации в медицинскую организацию в экстренном порядке:
1. Явления кровотечения с признаками угрозы жизни для пациента.
2. Обтурация верхних дыхательных путей с показаниями для трахеостомии.
3. Острая потеря сознания, кома.
4. Явления компрессии с развитием синдрома сдавления верхней полой вены.
5. Фебрильная нейтропения.
Показания для госпитализации в медицинскую организацию в плановом порядке:
1. Проведение уточняющей диагностики.
2. Проведение этапов специального лечения (хирургического, лучевого, лекарственного).
3. Симптоматическая терапия.
Показания к выписке пациента из медицинской организации:
1. Завершенный случай оказания медицинской помощи, в том числе при циклическом лечении, когда по состоянию здоровья пациент может без ущерба для здоровья продолжать лечение амбулаторно под наблюдением участкового врача.
2. При отсутствии показаний к дальнейшему лечению в стационаре.
3. При необходимости перевода пациента в другое лечебное учреждение.
4. По требованию пациента или его законного представителя.
Медицинская помощь, за исключением медицинской помощи в рамках клинической апробации, в соответствии с федеральным законом от 21.11.2011 № 323-ФЗ (ред. от 25.05.2019) «Об основах охраны здоровья граждан в Российской Федерации» организуется и оказывается:
1. в соответствии с положением об организации оказания медицинской помощи по видам медицинской помощи, которое утверждается уполномоченным федеральным органом исполнительной власти;
2. в соответствии с порядком оказания помощи по профилю «онкология», обязательным для исполнения на территории Российской Федерации всеми медицинскими организациями;
3. на основе настоящих клинических рекомендаций;
4. с учетом стандартов медицинской помощи, утвержденных уполномоченным федеральным органом исполнительной власти.
Первичная специализированная медико-санитарная помощь оказывается врачом-онкологом и иными врачами-специалистами в центре амбулаторной онкологической помощи либо в первичном онкологическом кабинете, первичном онкологическом отделении, поликлиническом отделении онкологического диспансера.
При подозрении или выявлении у пациента онкологического заболевания врачи-терапевты, врачи-терапевты участковые, врачи общей практики (семейные врачи), врачи-специалисты, средние медицинские работники в установленном порядке направляют пациента на консультацию в центр амбулаторной онкологической помощи либо в первичный онкологический кабинет, первичное онкологическое отделение медицинской организации для оказания ему первичной специализированной медико-санитарной помощи.
Консультация в центре амбулаторной онкологической помощи либо в первичном онкологическом кабинете, первичном онкологическом отделении медицинской организации должна быть проведена не позднее 5 рабочих дней с даты выдачи направления на консультацию. Врач-онколог центра амбулаторной онкологической помощи (в случае отсутствия центра амбулаторной онкологической помощи врач-онколог первичного онкологического кабинета или первичного онкологического отделения) организует взятие биопсийного (операционного) материала, а также организует выполнение иных диагностических исследований, необходимых для установления диагноза, включая распространенность онкологического процесса и стадию заболевания.
В случае невозможности взятия в медицинской организации, в составе которой организован центр амбулаторной онкологической помощи (первичный онкологический кабинет, первичное онкологическое отделение), биопсийного (операционного) материала, проведения иных диагностических исследований пациент направляется лечащим врачом в онкологический диспансер или в медицинскую организацию, оказывающую медицинскую помощь пациентам с онкологическими заболеваниями.
Срок выполнения патологоанатомических исследований, необходимых для гистологической верификации злокачественного новообразования (ЗНО) слюнных желез, не должен превышать 15 рабочих дней с даты поступления биопсийного (операционного) материала в патологоанатомическое бюро (отделение).
При подозрении и (или) выявлении у пациента онкологического заболевания в ходе оказания ему скорой медицинской помощи таких пациентов переводят или направляют в медицинские организации, оказывающие медицинскую помощь больным с онкологическими заболеваниями, для определения тактики ведения и необходимости применения дополнительно других методов специализированного противоопухолевого лечения.
Врач-онколог центра амбулаторной онкологической помощи (первичного онкологического кабинета, первичного онкологического отделения) направляет пациента в онкологический диспансер или в медицинские организации, оказывающие медицинскую помощь пациентам с онкологическими заболеваниями, для уточнения диагноза (в случае невозможности установления диагноза, включая распространенность онкологического процесса и стадию заболевания, врачом-онкологом центра амбулаторной онкологической помощи, первичного онкологического кабинета или первичного онкологического отделения) и оказания специализированной, в том числе высокотехнологичной, медицинской помощи.
Срок начала оказания специализированной, за исключением высокотехнологичной, медицинской помощи пациентам с онкологическими заболеваниями в медицинской организации, оказывающей медицинскую помощь пациентам с онкологическими заболеваниями, не должен превышать 14 календарных дней с даты патологоанатомической верификации ЗНО слюнных желез или 14 календарных дней с даты установления предварительного диагноза ЗНО слюнных желез (в случае отсутствия медицинских показаний для проведения патологоанатомических исследований в амбулаторных условиях).
Специализированная, в том числе высокотехнологичная, медицинская помощь оказывается врачами-онкологами, врачами-радиотерапевтами в онкологическом диспансере или в медицинских организациях, оказывающих медицинскую помощь пациентам с онкологическими заболеваниями, имеющих лицензию, необходимую материально-техническую базу, сертифицированных специалистов, в стационарных условиях и условиях дневного стационара и включает в себя профилактику, диагностику, лечение онкологических заболеваний, требующих использования специальных методов и сложных уникальных медицинских технологий, а также медицинскую реабилитацию.
В медицинской организации, оказывающей медицинскую помощь пациентам с онкологическими заболеваниями, тактика медицинского обследования и лечения устанавливается консилиумом врачей-онкологов и врачей-радиотерапевтов, с привлечением при необходимости других врачей-специалистов. Решение консилиума врачей оформляется протоколом, подписывается участниками консилиума врачей и вносится в медицинскую документацию пациента.
Показания для госпитализации в круглосуточный или дневной стационар медицинской организации, оказывающей специализированную, в том числе высокотехнологичную медицинскую помощь по профилю «онкология» определяются консилиумом врачей-онкологов и врачей-радиотерапевтов, с привлечением при необходимости других врачей-специалистов.
Заключение о целесообразности перевода пациента в профильную медицинскую организацию осуществляется после предварительной консультации по предоставленным медицинским документам и/или предварительного осмотра больного врачами специалистами медицинской организации, в которую планируется перевод.
6. Дополнительная информация, влияющая на течение и исход заболевания
Факторами, влияющими на прогноз заболевания, являются:
• размеры и распространенность первичной опухоли;
• степень дифференцировки опухоли;
• наличие/отсутствие периваскулярной, перилимфатической, периневральной инвазии;
• статус регионарных ЛУ (pN) (метастазы в ЛУ шеи вдвое снижают выживаемость пациентов)
• экстранодальное распространение опухоли;
• активность клеточной пролиферации (индекс ki-67);
• статус краев резекции (R0-1).
Критерии оценки качества медицинской помощи
Список литературы
1. Давыдов М.И. Энциклопедия клинической онкологии. - М.: ООО «РЛС-2004», 2004.
2. Каприн А.Д., Старинский В.В. Злокачественные новообразования в России в 2015 году (заболеваемость и смертность). - М.: МНИОИ им. П. А. Герцена - филиал ФГБУ «НМИРЦ» Минздрава России, 2017. - С.11,15,16.
3. CANCER TODAY.
4. Snyderman N.L., Johnson J.T. Salivary gland tumors. Diagnostic characteristics of the common types. Postgrad Med. 1987 Oct. 82(5):105-8,110-2.
5. Calearo C, Pastore A, Storchi OF, Polli G. Parotid gland carcinoma: analysis of prognos-tic factors. Ann Otol Rhinol Laryngol 1998; 107:969-973.
6. Bobati S.S., Patil B.V., Dombale V.D. Histopathological study of salivary gland tumors J Oral Maxillofac Pathol. 2017 Jan-Apr; 21(1): 46-50.
7. NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines®). Salivary Gland Tumors. Version 3.2019.
8. Hocwald, E., Korkmaz, H., Yoo, G. H., Adsay, V., Shibuya, T. Y., Abrams, J., & Jacobs, J. R. (2001). Prognostic Factors in Major Salivary Gland Cancer. The Laryngoscop.
9. Stodulski, D., Mikaszewski, B., & Stankiewicz, C. (2011). Are all prognostic factors in parotid gland carcinoma well recognized? European Archives of Oto-Rhino-Laryngology, 269(3), 1019-1025.
10. Suzuki M., Ichimiya I., Matsushita F., et al. Histological features and prognosis of pa-tients with mucoepidermoid carcinoma of the parotid gland. J Laryngol Otol. 1998 Oct. 112(10) :944-7.
11. Ghosh-Laskar S., Murthy V., Wadasadawala T., Agarwal J., Budrukkar A., Patil N., et al.Mucoepidennoid carcinoma of the parotid gland: Factors affecting outcome. Head Neck. 2011 Apr.33(4):497-503.
12. De Bondt R. B. J. et al. Detection of lymph node metastases in head and neck cancer: a metaanalysis comparing US, USgFNAC, CT and MR imaging //European journal of ra-diology. - 2007. -T. 64. - №. 2. - C. 266-272.
13. Rice D.H., Becker T. Magnetic resonance imaging of the salivary glands. A comparison with computed tomographic scanning. Arch Otolaryngol Head Neck Surg. 1987 Jan. 113(1) :78—80.
14. Ruhlmann V., Poeppel T.D., Veit J. et al. Diagnostic accuracy of 18F-FDG PET/CT and MR imaging in patients with adenoid cystic carcinoma. BMC Cancer. 2017; 17: 887.
15. Liu С. C. et al. Sensitivity, specificity, and posttest probability of parotid fine-needle aspiration: a systematic review and meta-analysis //Otolaryngology--Head and Neck Sur-gery. -2016. - T. 154. - №. 1. - C. 9-23.
16. Wang X., Luo Y., Li M. et al., Management of salivary gland carcinomas - a review.Oncotarget, 2017, Vol. 8, (No. 3), pp: 3946-3956.
17. Johns M.E. Parotid cancer: a rational basis for treatment. Head Neck Surg. 1980 NovDec.3(2):132-41.
18. Chen AM, Garcia J, Granchi PJ. Late recurrence from salivary gland cancer: when does “cure” mean cure? Cancer. 2008;112(2):340-4.
19. Sood, S., McGurk, M., & Vaz, F. (2016). Management of Salivary Gland Tumours: Unit-ed Kingdom National Multidisciplinary Guidelines. The Journal of Laryngology & Otol-ogy, 130(S2),S142-S149.
20. Boon E, van Boxtel W, Buter J, et al. Androgen deprivation therapy for androgen recep-tor-positive advanced salivary duct carcinoma: A nationwide case series of 35 patients in The Netherlands. Head Neck 2018;40:605-613.
21. Haddad, R., Colevas, A. D., Krane, J. F., Cooper, D., Glisson, B., Amrein, P. C.,... Pos-ner, M. (2003). Herceptin in patients with advanced or metastatic salivary gland carcino-mas. A phase II study. Oral Oncology, 39(7), 724-727.
22. Perissinotti A. J. et al. The role of trastuzumab in the management of salivary ductal carcinomas //Anticancer research. - 2013. - T. 33. - №. 6. - C. 2587-2591.
23. Terhaard С. H. J. et al. The role of radiotherapy in the treatment of malignant salivary gland tumors //International Journal of Radiation Oncology* Biology* Physics. - 2005. - T. 61. - №. 1. -C. 103-111.
24. Cheraghlou S, Kuo P, Mehra S et al. Adjuvant therapy in major salivary gland cancers: Analysis of 8580 patients in the National Cancer Database. Head Neck. 2018 Jul;40(7):1343-1355.
25. Adelstein, D. J., Li, Y., Adams, G. L., Wagner, H., Kish, J. A., Ensley, J. F.,... Foras-tiere, A. A. (2003). An Intergroup Phase III Comparison of Standard Radiation Therapy and Two Schedules of Concurrent Chemoradiotherapy in Patients With Unresectable S.
26. Airoldi M, Fornari G, Pedani F, et al. Paclitaxel and carboplatin for recurrent sali-vary gland malignancies. Anticancer Res 2000; 20: 3781-83.
27. Dick Haan, L. D., De Mulder, P. H. M., Vermorken, J. B., Schomagel, J. H., Venney, A., & Verweij, J. (1992). Cisplatin-based chemotherapy in advanced ad-enoid cystic carcinoma of the head and neck. Head & Neck, 14(4), 273-277.
28. Болтина Л.В., Владимирова Ю.В., Деньгина H.B. и соавт. Практические рекомен-дации по лекарственному лечению злокачественных опухолей головы и шеи. Зло-качественные опухоли: Практические рекомендации по лекарственному лечению злокачественных опухолей (RUSS.
29. NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines®). Principles of Surgery. Version 2.2018.
30. Domenick N.A., Johnson J.T. Parotid tumor size predicts proximity to the facial nerve. Laryngoscope. 2011 Nov. 121(ll):2366-70.
31. Ord, R. A., & Ghazali, N. (2017). Margin Analysis. Oral and Maxillofacial Surgery Clin-ics of North America, 29(3), 315-324.
32. Silver J.A., Baima J. Cancer prehabilitation: anopportunity to decrease treatment related morbidity, increase cancer treatment options, and improve physical and psychological health outcomes. Am J Phys Med Rehabil 2103; 92: 715-727.
33. Buffart L.M., Sweegers M.G., May A.M., et al. Targeting Exercise Interventions to Pa-tients With Cancer in Need: An Individual Patient Data Meta-Analysis. J Natl Cancer Inst. 2018 Nov 1; 110(11): 1190-1200. DOI: 10.1093/jnci/djyl61.
34. Paskett ED, Dean JA, Oliveri JM, Harrop JP. Cancer-related lymphedema risk fac-tors, diagnosis treatment and impact: a review. J Clinl Oncol. 2012;30(30):3726-3733.
35. Clarke P., Radford K., Coffey M., Stewart M. Speech and swallow rehabilitation in head and neck cancer: United Kingdom National Multidisciplinary Guidelines. J Laryngol Otol. 2016 May;130(S2):S176-S180.
36. Colevas A.D., Yom S.S., Pfister D.G., et al. NCCN Guidelines Insights: Head and Neck Cancers, Version 1.2018. J Natl Compr Cane Netw. 2018 May;16(5):479-490. DOI: 10.6004/jnccn.2018.0026.
37. Практические рекомендации по нутритивной поддержке у онкологических боль-ных / Снеговой А.В., Бесова Н.С., Веселов А.В., Кравцов С.А., Ларионова В.Б., Сельчук В.Ю. и соавт. Злокачественные опухоли. 2016. № 4. Спецвыпуск 2. С. 434-450.
38. Arends J., Bachmann R, Baracos V., et al. ESPEN guidelines on nutrition in cancer pa-tients. Clinical Nutrition. 2017;36: Pp. 11-48.
39. Thompson KL, Elliott L, Fuchs-Tarlovsky V, et al. Oncology evidence-based nutrition practice guideline for.
40. Kim W.S., Lee H.S., Park Y.M., et al. Surgical Outcomes of Parotid Cancer: A 10-Year Experience. Otolaryngol Head Neck Surg. 2012 Aug. 147(2 suppl):Pp. 180-181.
41. Hubera G.F., Dort J.C. Reducing morbidity and complications after major head and neck cancer surgery: the (future) role of enhanced recovery after surgery protocols. Curr Opin Otolaryngol Head Neck Surg 2018.
42. Coyle, M. J., Main, B., Hughes, C., et al. (2016). Enhanced recovery after surgery (ERAS) for head and neck oncology patients. Clinical Otolaryngology, 41(2), 118-126.
43. Midgley A.W., Lowe D., Levy A.R., Mepani V., Rogers S.N. Exercise program design considerations for head and neck cancer survivors. Eur Arch Otorhinolaryngol. 2018;275(1):169-179.
44. Guru K., Manoor U.K., Supe S.S. A comprehensive review of head and neck cancer rehabilitation: physical therapy perspectives. Indian J Palliat Care. 2012 May-Aug;18(2):87-97.
45. Goel V., Nemade H., Raju K.V.V.N., Rao C.S. (2017) Physiotherapy and Head and Neck Cancers. J Nov Physiother 7:337.
46. Logemann J.A., Pauloski B.R., et al. Speech and Swallowing Rehabilitation for Head and Neck Cancer Patients. ONCOLOGY ll(5):651-659,1997.
47. Wall L.R., Ward E.C., Cartmill B., Hill A.J. Physiological changes to the swallowing mechanism following (chemo)radiotherapy for head and neck cancer: a systematic review. Dysphagia 2013;28(4):481-93.
48. Govender R., Smith C.H., Taylor S.A. et al. Swallowing interventions for the treatment of dysphagia after head and neck cancer: a systematic review of behavioural strategies used to promote patient adherence to swallowing exercises. BMC Cancer 2017;17(1).
49. Zagari P.R.P.P., Paulon R.M.C., Farias L.P. (2018) Rehabilitation After Tracheostomy. In: de Farias T. (eds) Tracheostomy. Springer, Cham.
50. Stanner, H. M., Ayoub, N., Byward, C., Kizner, J., Le, О., Нага, W., & Holsinger, F. C. (2017). The impact of developing a speech and swallow rehab program: Improving patient satis-faction and multidisciplinary care. The Laryngoscope, 127(11), 2578-2581.
51. Mina D.S., Alibhai S.M.H., Matthew A.G., Guglietti C.L., Steele J., Trachtenberg J., Ritvo P.G. Exercise in clinical cancer care: a call to action and program development de-scription. Curr Oncol, 2012; 19(3), pp. el36-144.
52. Segal R., Zwaal C., Green E., Tomasone J.R., Loblaw A., Petrella T. Exercise for people with cancer: a clinical practice guideline. Curr Oncol. 2017;24(l):40-46.
53. Pauli N., Svensson U., Karlsson T., Finizia C. Exercise intervention for the treatment of trismus in head and neck cancer - a prospective two-year follow-up study. Acta Oncol. 2016 Jun;55(6):686-92.
54. Smith B.G., Lewin J.S. Lymphedema management in head and neck cancer. Curr Opin Otolaryngol Head Neck Surg 2010;18(3):153-8.
55. Vignes S. Lymphedema: from diagnosis to treatment. Rev Med Interne 2017;38(2):97-105.
56. Doke K.N., Bowman L., Shnayder Y., et al. Quantitative clinical outcomes of therapy for head and neck lymphedema. Adv Radiat Oncol. 2018 Apr 27;3(3):366-371.
57. Tacani P.M., Franceschini J.P., Tacani R.E., et al. Retrospective study of the physical therapy modalities applied in head and neck lymphedema treatment. Head Neck. 2016 Feb;38(2):301-8.
58. Wigg J. Use and response to treatment using low level laser therapy. J Lymphoedema 2009;4(2):73-6. Lee N., Wigg J., Carroll J. D. The use of low level light therapy in the treatment of head and neck oedema. J Lymphoedema 2013;8(l):35-42.
59. Ткаченко F.A. Клинико-психологическое исследование качества жизни больных, страда-ющих злокачественными новообразованиями челюстно-лицевой области. Вестник психо-терапии. 2012. № 44 (49). С. 57-63.
60. Zhao, S. G., Alexander, N. В., Djuric, Z., Zhou, J., Tao, Y., Schipper, M., ... Jolly, S. (2015). Maintaining physical activity during head and neck cancer treatment: Results of a pilot controlled trial. Head & Neck, 38(S1), E1086-E1096.
Приложение А1. Состав рабочей группы
1. Алиева Севил Багатуровна, д.м.н., ведущий научный сотрудник, отделение радиационной онкологии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, член Общероссийской общественной организации «Российское общество специалистов по опухолям головы и шеи».2. Чойнзонов Евгений Лхамацыренович, д.м.н., академик РАН, директор НИИ онкологии Томского НИМЦ, заведующий отделением опухолей головы и шеи НИИ онкологии Томского НИМЦ, заведующий кафедрой онкологии ФГБОУ ВО СибГМУ Минздрава России, член Общероссийской общественной организации «Российское общество специалистов по опухолям головы и шеи».
3. Алымов Юрий Владимирович к.м.н., врач-онколог, отделение хирургическое № 11 опухолей головы и шеи ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, исполнительный директор Общероссийской общественной организации «Российское общество специалистов по опухолям головы и шеи».
4. Болотин Михаил Викторович, к.м.н., старший научный сотрудник, отделение хирургическое № 11 опухолей головы и шеи ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, член Общероссийской общественной организации «Российское общество специалистов по опухолям головы и шеи».
5. Мудунов Али Мурадович, д.м.н., профессор, заведующий хирургическим отделением № 11 опухолей головы и шеи ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, президент Общероссийской общественной организации «Российское общество специалистов по опухолям головы и шеи».
6. Поляков Андрей Павлович, д.м.н., заведующий отделением микрохирургии МНИОИ им. П. А. Герцена - филиал ФГБУ «НМИЦ радиологии» Минздрава России, член Общероссийской общественной организации «Российское общество специалистов по опухолям головы и шеи».
7. Подвязников Сергей Олегович, д.м.н., профессор, ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России, вице-президент Общероссийской общественной организации «Российское общество специалистов по опухолям головы и шеи».
8. Решетов Игорь Владимирович, д.м.н., академик РАН, заведующий кафедрой онкологии, радиотерапии и пластической хирургии Первого московского медицинского университета им. И.М. Сеченова, президент Российской федерации специалистов по заболеваниям органов головы и шеи.
9. Дронова Екатерина Леонидовна, врач-радиолог ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, член Общероссийской общественной организации «Российское общество специалистов по опухолям головы и шеи».
10. Рыжова Ольга Дмитриевна, врач-радиолог ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
11. Жаров Андрей Александрович, патологоанатом ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
12. Снеговой Антон Владимирович, д.м.н., заведующий отделением амбулаторной химиотерапии (дневной стационар) ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, член Общероссийской общественной организации «Российское общество специалистов по опухолям головы и шеи».
13. Болотина Лариса Владимировна, д.м.н., заведующая отделением химиотерапии МНИОИ им. П. А. Герцена - филиал ФГБУ «НМИЦ радиологии» Минздрава России, член Общероссийской общественной организации «Российское общество специалистов по опухолям головы и шеи».
14. Корниецкая Анна Леонидовна, с.н.с., к.м.н., отделение химиотерапии отдела лекарственного лечения опухолей, МНИОИ им. П. А. Герцена - филиал ФГБУ «НМИЦ радиологии» Минздрава России.
15. Геворков Артем Рубенович, к.м.н., с.н.с., врач-радиотерапевт отделения лучевой терапии с модификацией МНИОИ им. П. А. Герцена - филиал ФГБУ «НМИЦ радиологии» Минздрава России, член Общероссийской общественной организации «Российское общество специалистов по опухолям головы и шеи».
16. Оджарова Акгуль Атаевна, к.м.н., в.н.с. отделения позитронно-эмиссионной томографии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, член Общероссийской общественной организации «Российское общество специалистов по опухолям головы и шеи».
17. Кондратьева Татьяна Тихоновна, д.м.н., в.н.с., врач клинической лабораторной диагностики ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, член Общероссийской общественной организации «Российское общество специалистов по опухолям головы и шеи».
18. Севрюков Феликс Евгеньевич, к.м.н., заведующий отделом лучевого и хирургического лечения заболеваний головы и шеи, МРНЦ им. А.Ф. Цыба - филиал ФГБУ «НМИЦ радиологии» Минздрава России.
19. Саприна Оксана Александровна, к.м.н., врач-онколог, отделение хирургическое №11 опухолей головы и шеи ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, член Общероссийской общественной организации «Российское общество специалистов по опухолям головы и шеи».
20. Нариманов Мехти Нариманович, д.м.н., химиотерапевт, член Общероссийской общественной организации «Российское общество специалистов по опухолям головы и шеи».
21. Аванесов Анатолий Михайлович, д.м.н., проф., заведующий кафедрой общей и клинической стоматологии ФГАОУ ВО РУДН, старший научный сотрудник отдела хирургии и хирургических методов лечения в онкологии Российского научного центра рентгенорадиологии.
22. Енгибарян Марина Александровна, д.м.н., заведующая отделением опухолей головы и шеи ФГБУ «РНИОИ» Минздрава России, член Общероссийской общественной организации «Российское общество специалистов по опухолям головы и шеи».
23. Раджабова Замира Ахмедовна, к.м.н., заведующая хирургическим отделением опухолей головы и шеи ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России, член Общероссийской общественной организации «Российское общество специалистов по опухолям головы и шеи».
24. Кончугова Татьяна Венедиктовна, д.м.н., профессор, врач-физиотерапевт, заведующая отделом преформированных физических факторов ФГБУ «НМИЦ реабилитации и курортологии» М3 РФ.
25. Еремушкин Михаил Анатольевич, д.м.н., профессор, заведующий отделением ЛФК и клинической биомеханики ФГБУ «НМИЦ реабилитации и курортологии» М3 РФ.
26. Гильмутдинова Ильмира Ринатовна, к.м.н., заведующая отделом биомедицинских технологий и лаборатория клеточных технологий, врач-трансфузиолог, дерматовенеролог, специалист в области клеточных технологий ФГБУ «НМИЦ реабилитации и курортологии» М3 РФ.
27. Буланов Анатолий Анатольевич, д.м.н., старший научный сотрудник отделения клинической фармакологии и химиотерапии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» М3 РФ.
28. Бутенко Алексей Владимирович, д.м.н., профессор, главный врач НИИ Клинической онкологии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» М3 РФ, председатель НС «Ассоциация специалистов по онкологической реабилитации».
29. Назаренко Алексей Витальевич, к.м.н., врач высшей квалификационной категории, заведующий отделением радиологии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» М3 РФ, член РАТРО (Российской Ассоциации Терапевтических Радиационных Онкологов), ESTRO (European Society for Radiotherapy & Oncology), Российско-Американского альянса по изучению рака (ARCA), представитель Российской Федерации в МАГАТЭ.
30. Обухова Ольга Аркадьевна, к.м.н., врач-физиотерапевт, заведующий отделением реабилитации ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» М3 РФ, член европейской ассоциации парентерального и энтерального питания (ESPEN), член Российской ассоциации парентерального и энтерального питания (RESPEN).
31. Хуламханова Марина Муратовна, врач-физиотерапевт, врач-онколог отделения реабилитации ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» М3 РФ.
32. Ткаченко Галина Андреевна, психолог отделения реабилитации ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» М3 РФ.
33. Петрова Татьяна Анатольевна, логопед-педагог отделения реабилитации ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» М3 РФ.
34. Семиглазова Татьяна Юрьевна, доктор медицинских наук, доцент, заведующая отделом, ведущий научный сотрудник научного отдела инновационных методов терапевтической онкологии и реабилитации ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России, доцент кафедры онкологии ФГБОУ ВО «СЗГМУ им. Н.Н. Мечникова» Минздрава России.
35. Пономаренко Геннадий Николаевич, доктор медицинских наук, профессор, заслуженный деятель науки РФ, генеральный директор ФГБУ «ФНЦРИ им. Г.А. Альбрехта» Минтруда России, заведующий кафедрой курортологии и физиотерапии ФГБВОУ ВО «Военно-медицинская академия им. С.М. Кирова» Минобороны России.
36. Ковлен Денис Викторович, доктор медицинских наук, доцент кафедры курортологии и физиотерапии ФГБВОУ ВО «Военно-медицинская академия им. С.М. Кирова» Минобороны России.
37. Каспаров Борис Сергеевич, кандидат медицинских наук, заместитель главного врача по амбулаторной помощи заведующий клинико-диагностическим отделением ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России.
38. Крутов Антон Андреевич, врач-онколог клинико-диагностического отделения ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России.
39. Зернова Маргарита Александровна, инструктор-методист по лечебной физкультуре ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России.
40. Кондратьева Кристина Орхановна, медицинский психолог ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России.
41. Иванова Галина Евгеньевна, д.м.н., главный специалист по медицинской реабилитации Минздрава России, заведующая отделом медико-социальной реабилитации инсульта НИИ ЦВПиИРНИМУ имени Н.И. Пирогова Минздрава России.
42. Романов Александр Иванович, д.м.н., профессор, академик РАН, главный врач ФГБУ «Центр реабилитации» Управления делами Президента Российской Федерации.
43. Филоненко Елена Вячеславовна, д.м.н., профессор, врач-онколог, заведующая центром лазерной и фотодинамической диагностики и терапии опухолей МНИОИ им. П. А. Герцена - филиал ФГБУ «НМИЦ радиологии» Минздрава России.
44. Степанова Александра Михайловна, заместитель директора по науке, заведующий отделением реабилитации Частный многопрофильный диагностический и реабилитационный центр «Восстановление».
45. Бойко Анна Владимировна, д.м.н., проф., заведующая отделением лучевой терапии с модфификацией МНИОИ им. П.А.Герцена - филиал ФГБУ НМИЦ радиологии Минздрава России
46. Феденко Александр Александрович, заведующий Отдела лекарственного лечения опухолей МНИОИ им. П.А. Герцена-филиал ФГБУ «НМИЦ радиологии» Минздрава России
47. Фалалеева Наталья Александровна, Заведующий отделом лекарственного лечения злокачественных новообразований МРНЦ им. А.Ф. Цыба- филиал ФГБУ «НМИЦ радиологии» Минздрава России
Блок по организации медицинской помощи:
1. Невольских Алексей Алексеевич - доктор медицинских наук, заместитель директора по лечебной МРНЦ им. А.Ф. Цыба - филиал ФГБУ "НМИЦ радиологии" Минздрава России.
2. Иванов Сергей Анатольевич - профессор РАН, доктор медицинских наук, директор МРНЦ им. А.Ф. Цыба - филиал ФГБУ "НМИЦ радиологии" Минздрава России.
3. Хайлова Жанна Владимировна - кандидат медицинских наук, заместитель директора по организационно-методической работе МРНЦ им. А.Ф. Цыба - филиал ФГБУ "НМИЦ радиологии" Минздрава России.
4. Геворкян Тигран Гагикович - Заместитель директора НИИ КЭР ФГБУ НМИЦ Онколгии им.Н.Н. Блохина
Приложение А2. Методология разработки клинических рекомендации
Целевая аудитория данных клинических рекомендаций:
1. врачи-онкологи;
2. врачи-хирурги;
3. врачи-радиологи;
4. врачи-генетики;
5. студенты медицинских ВУЗов, ординаторы и аспиранты.
Методы, использованные для сбора/селекции доказательств: поиск в электронных базах данных; анализ современных научных разработок по проблеме РБ в РФ и за рубежом; обобщение практического опыта российских и зарубежных специалистов.
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию - не реже чем один раз в три года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, наличии обоснованных дополнений/замечаний к ранее утверждённым КР, но не чаще 1 раза в 6 месяцев.
Приложение Б. Алгоритмы ведения пациента
Приложение В. Информация для пациентов
Рекомендации по наблюдению после завершенного лечения
Наблюдение после завершенного лечения имеет важное значение для поддержания здоровья пациента. Обычно в первые 1-2 года наблюдаться у врача-онколога рекомендуется с частотой каждые 3-6 месяцев, на сроке 3-5 лет - 1 раз в 6-12 месяцев. После 5 лет с момента операции визиты проводятся ежегодно или при появлении жалоб. Тем не менее, частота визитов к врачу может быть увеличена в зависимости от характеристик заболевания и ассоциированных рисков и оговаривается индивидуально в каждом конкретном случае. При появлении жалоб, а также возобновлении симптомов, отмечавшихся до лечения, необходимо незамедлительно обратиться к врачу, не дожидаясь очередного срока запланированного визита.
Целью визитов является контроль не только онкологического заболевания, но и побочных эффектов, в том числе отсроченных (например, гипотиреоз после проведенной ЛТ на область шеи, снижения нутритивного статуса, оценка речевой и глотательной функции и Т.Д.).
Рекомендации относительно образа жизни и питания должны быть индивидуализированы с учетом объема проведенного лечения, рисков и выраженности осложнений, особенностей пациента.
Преимущества отказа от табакокурения и потребления алкоголя:
- Более высокие показатели выживаемости;
- большая эффективность лечения;
- меньшее количество и выраженность побочных эффектов противоопухолевого лечения (сердечно-легочные осложнения, утомляемость, снижение массы тела, мукозиты, потеря вкуса);
- ускоренное восстановление общего состояния после лечения;
- ниже риск рецидива;
- меньший риск вторых опухолей;
- меньший риск инфекций;
- выше качество жизни.
Рекоменлапии при осложнениях химиотерапии/химиолучевой терапии - связаться с химиотерапевтом, .радиологом:
1. При повышении температуры тела 38 °С и выше: начать прием антибиотиков (по назначению врача!.
2. При стоматите:
1. Диета - механическое, термическое и химическое щажение, а также применение лечебного питания (препараты по назначению врача1 2 3 4).
2. Частое полоскание рта (каждый час) - ромашка, кора дуба, шалфей, смазывать рот облепиховым (персиковым) маслом.
3. Обрабатывать полость рта по назначению врача.
3. При диарее:
1. Диета - исключить жирное, острое, копченое, сладкое, молочное, клетчатку. Можно нежирное мясо, мучное, кисломолочное, рисовый отвар. Обильное питье.
2. Принимать препараты по назначению врача.
4. При тошноте.
Принимать препараты по назначению врача.
Приложение Г.
Приложение Г1. Шкала ECOG (0-5 балла)
Предназначена для оценки общего состояния онкологического пациента.
В левом столбце представлены баллы, в правом - описание состояния, соответствующее указанному баллу.
Материал адаптирован из Oken, М.М., Creech, R.H., Tonney, D.C., Horton, J., Davis, T.E., McFadden, E.T., Carbone, P.P.: Toxicity And Response Criteria Of The Eastern Cooperative Oncology Group. Am J Clin Oncol 5:649-655,1982
Приложение Г2. Шкала оценки лечебного патоморфоза опухоли по Г. А. Лавниковой
Источник (официальный сайт разработчиков, публикация с валидацией): Лавникова Г.А. (1979) Гистологический метод количественной оценки терапевтического повреждения опухоли. Москва.: Методические рекомендации, 13 с
Тип: шкала оценки.
Назначение: оценка лечебного патоморфоза опухоли.
Содержание (шаблон) и Ключ (интерпретация).
Оценка
I степень — более 50% опухолевой паренхимы сохранено;
II степень — сохранено 20-50% опухолевой паренхимы;
III степень — до 20% паренхимы опухоли сохранилось в виде отдельных очагов;
IV степень — полное отсутствие опухолевой паренхимы
Пояснения: отсутствуют.
Теги: опухоли слюнных желез
234567 Начало активности (дата): 09.01.2023 14:50:00
234567 Кем создан (ID): 989
234567 Ключевые слова: лучевая терапия, опухоли слюнных желез, позитронно-эмиссионная томография, перкутанная эндоскопическая гастростома
12354567899
Похожие статьи
Злокачественные новообразования губыРак носоглотки
Рентген на дому 8 495 22 555 6 8
Курс медицинской рентгенологии. Рентгенотерапия.Часть 3. Глава 14.3
А. П. Быстров "Прошлое, настоящее, будущее человека". Часть 2. Глава 4



