 10.01.2023
10.01.2023
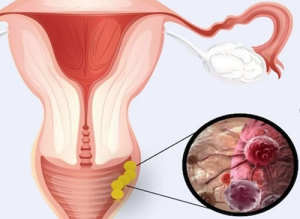
Злокачественные новообразования влагалища
Этиология и патогенез рака влагалища
Кодирование по Международной статистической классификации болезней и проблем, связанных со здоровьем:С52
Год утверждения (частота пересмотра) :2020
Возрастная категория :Взрослые
Год окончания действия:2022
Разработчик клинической рекомендации
• Общероссийский национальный союз "Ассоциация онкологов России"
• • Общероссийская общественная организация "Российское общество клинической онкологии"
• • Общероссийская общественная организация "Российское общество специалистов по профилактике и лечению опухолей репродуктивной системы
Одобрено Научно-практическим Советом Минздрава РФ
Список сокращений
CTV - клинический объем мишени
ECOG - Eastern Cooperative Oncology Group (Восточная объединенная группа онкологов)
FIGO - Международная федерация гинекологов и акушеров
GTV - непосредственный опухолевый объем (макроскопически визуализируемый) IMRT - лучевая терапия с модулированной интенсивностью PTV - планируемый опухолевый объем
SCC—антиген плоскоклеточной карциномы, опухолевый маркер.
TNM - Международная классификация стадий злокачественных новообразований
VMAT, или RapidArc - модулированная по интенсивности в объеме лучевая терапия
в/в - внутривенно
в/м - внутримышечно
ВПЧ—вирус папилломы человека
Гр - грей
ЗНО—злокачественное новообразование
КТ - компьютерная томография
ЛТ - лучевая терапия
ЛУ - лимфатические узлы
МРТ - магнитно-резонансная томография
ПЭТ - позитронно-эмиссионная томография
РВл - рак влагалища
РОД - разовая очаговая доза
РШМ - рак шейки матки
СЛТ - сочетанная лучевая терапия
СОД - суммарная очаговая доза
Термины и определения
Предреабилитация (prehabilitation) - реабилитация с момента постановки диагноза до начала лечения (хирургического лечения/химиотерапии/лучевой терапии).
I этап реабилитации - реабилитация в период специализированного лечения основного заболевания (включая хирургическое лечение/химиотерапию/лучевую терапию) в отделениях медицинских организаций по профилю основного заболевания.
II этап реабилитации - реабилитация в стационарных условиях медицинских организаций (реабилитационных центров, отделений реабилитации), в ранний восстановительный период течения заболевания, поздний реабилитационный период, период остаточных явлений течения заболевания.
III этап реабилитации - реабилитация в ранний и поздний реабилитационный периоды, период остаточных явлений течения заболевания в отделениях (кабинетах) реабилитации, физиотерапии, лечебной физкультуры, рефлексотерапии, мануальной терапии, психотерапии, медицинской психологии, оказывающих медицинскую помощь в амбулаторных условиях, дневных стационарах, а также выездными бригадами на дому (в том числе в условиях санаторно-курортных организаций), кабинетах логопеда (учителя-дефектолога).
1. Краткая информация
1.1 Определение заболевания или состояния (группы заболеваний или состояний)
Злокачественное новообразование влагалища (ЗНО) -ЗНО стенки влагалища. Плоскоклеточный рак влагалища (РВл) - ЗНО, возникающие из покровного плоского эпителия влагалища женщины.
1.2 Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
Этиология и патогенез рака влагалища (РВл) во многом остаются неясными в первую очередь из-за низких показателей заболеваемости. С учетом единого эмбриогенеза вульвы, влагалища и шейки матки из урогенитального синуса предполагается, что они имеют общие этиологию и патогенез [1].
В патогенезе РВл возможную отрицательную роль играют следующие факторы:
• инфицирование женщины в течение жизни вирусом папилломы человека (ВПЧ) (при плоскоклеточном РВл ВПЧ обнаруживается более чем в 60% наблюдений), вирусом простого герпеса 2-го типа и вирусом иммунодефицита человека с проявлением ВПЧ в виде остроконечных кондилом [1];
• постменопаузальная гипоэстрогения;
• тяжелые хронические сенильные кольпиты;
• инволютивные, дистрофические посткастрационные и возрастные процессы;
• хронические неспецифические вагиниты;
• канцерогенный эффект лучевой терапии (ЛТ) в развитии РВл подтверждается многочисленными сообщениями о возникновении ЗНО данной области через 10-30 лет после сочетанной лучевой терапии (СЛТ) рака шейки матки (РШМ). Относительный риск развития РВл после СЛТ РШМ в 300 раз больше, чем в популяции [2].
С клинических позиций сегодня следует рассматривать 3 наиболее вероятные причины развития РВл:
1. Развитие злокачественной опухоли, обусловленной ВПЧ.
2. Радиоиндуцированные опухоли влагалища после ЛТ РШМ.
3. Метастатические опухоли (матка, яичники, др.).
1.5 Эпидемиология заболевания или состояния (группы заболеваний или состояний)
Первичный РВл встречается достаточно редко. В структуре заболеваемости ЗНО женских половых органов первичный РВл составляет около 1 %. В России в 2017 г. зарегистрировано 505 впервые выявленных случаев РВл.
Стандартизованный показатель заболеваемости РВл в 2017 г. составил 0,35 на 100 тыс. женского населения [3]. Почти 90 % всех гистологических типов новообразований влагалища приходится на плоскоклеточный рак [4].
1.4 Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
С52 - злокачественное новообразование влагалища
1.5 Классификация заболевания или состояния (группы заболеваний или состояний)
1.5.1. Международная гистологическая классификация
Международная морфологическая классификация РВл (классификация IARC, 4-е издание, Лион, 2014 г.) [5]:
I. Эпителиальные опухоли
1. Опухоли из плоского эпителия:
а) плоскоклеточный рак 8070/3:
- 8071/3 ороговевающий;
- 8072/3 неороговевающий;
- 8083/3 базалоидный;
- 8051/3 кондиломатозный (бородавчатый);
- 8051/3 веррукозный;
б) интраперитонеальная неоплазия:
- 8077/2 поражение плоского эпителия тяжелой степени;
- 8070/2 плоскоклеточный рак in situ.
2. Опухоли из железистого эпителия:
- 8310/3 светлоклеточный рак;
- 8380/3 эндометриоидный рак;
- 8480/3 муцинозный рак;
- 9110/3 мезонефроидный рак;
- 8140/0 аденокарциномы других типов.
II. Неэпителиальные опухоли
III. Меланоцитообразующие опухоли
IV. Смешанные опухоли
V. Вторичные опухоли
1. Прочие опухоли
2. Опухоли меланообразующей системы 1.5.2 .Стадирование.
В таблице 1 представлено стадирование РВл по двум классификациям: TNM 8-го пересмотра (2017 г.) и FIGO (2009 г.). Классификация применяется только для первичного РВл. Метастатические опухоли влагалища исключаются.
Опухоль влагалища, распространяющаяся на вульву, классифицируется как рак вульвы.
Таблица 1. Стадирование РВл по TNM (8-е издание, 2017 г.) и FIGO (2009 г.).
N - регионарные лимфатические узлы (ЛУ)
Nx - регионарные ЛУ не могут быть оценены No - нет метастазов в регионарных ЛУ Ni - есть метастаз в регионарном ЛУ М - отдаленные метастазы Мо - нет отдаленных метастазов Mi - есть отдаленный метастаз
Примечание. Регионарными ЛУ являются для верхних двух третей влагалища -тазовые ЛУ, включая запирательные, внутренние подвздошные (подчревные), наружные подвздошные и тазовые ЛУ без дополнительного уточнения, для нижней трети влагалища - паховые и бедренные ЛУ.
Таблица 2. Группировка критериев TNM для определения стадии РВл
Течение болезни, особенно на ранних стадиях, может быть бессимптомным. При дальнейшем развитии опухолевого процесса присоединяются боли, расстройства и/ или затруднения мочеиспускания и дефекации, лимфостаз нижних конечностей. Заболевание в основном встречается у женщин старше 50-60 лет [2,3].
2. Диагностика
Критерии установления диагноза заболевания или состояния:
1) данные анамнеза;
2) данные физикалъного обследования;
3) данные патологоанатомического исследования;
5) данные методов лучевой диагностики.
2.1. Жалобы и анамнез
• Рекомендуется сбор жалоб и анамнеза у всех пациенток с РВл и подозрением на РВл с целью выявления факторов, которые могут повлиять на выбор тактики лечения. В клинической картине преобладают бели и кровянистые выделения из половых путей. При распространенном заболевании присоединяется симптомокомплекс, включающий болевой синдром, нарушение тазовых функций, тенезмы [2].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5)
2.2. Физикальное обследование
• Рекомендуется тщательное физикальное обследование всем пациентам. Физикальное обследование включает в себя ректо-вагинальное исследование, пальпацию органов брюшной полости и всех групп периферических лимфатических узлов, аускультацию и перкуссию легких, пальпацию молочных желез [2, 6, 7].
В диагностике первичного РВл должны учитываться следующие критерии:
• первичный очаг опухоли должен располагаться только во влагалище, в преобладающем большинстве случаев поражается верхняя треть влагалища;
• эпителий шейки матки, канала шейки матки, эндометрия должен быть интактным (негативная аспирационная биопсия);
• первичный РВл может иметь бессимптомное течение [2,6].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5)
Комментарий: Осмотр и пальпация вульвы; осмотр влагалища, шейки матки проводится с использованием влагалищных зеркал по Симсу, поскольку при использовании влагалищных зеркал по Куско некоторые зоны влагалища (передняя и задняя стенки) плохо просматриваются [2,6,7].
2.5 Лабораторные диагностические исследования
• Рекомендуется выполнять всем пациенткам с РВл и подозрением на него в целях оценки состояния пациента, определения тактики и алгоритма лечения, оценки прогноза заболевания:
1. общий (клинический) анализ крови развернутый;
2. анализ крови биохимический общетерапевтический (общий белок, глюкоза, билирубин, креатинин, мочевина, железо, аланинаминотрасфераза (АЛТ), аспартатаминотрансфераза (ACT), билирубин общий, лактатаминотрансфераза (ЛДГ), щелочная фосфатаза (ЩФ), электролиты плазмы (калий, натрий, хлор) с оценкой показателей функции печени, почек;
3. общий (клинический) анализ мочи;
4. коагулограмма (фибриноген, протромбин, международное нормализированное отношение (МНО), протромбиновое время, протромбиновый индекс, активированное частичное тромбопластиновое время (АЧТВ), тромбиновое время)
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5)
Комментарии: Клинический анализ крови выполняется (повторяется) не менее чем за 5 дней до начала очередного курса XT. [2,7]
В общем (клиническом) анализе крови развернутом целесообразна оценка следующих параметов - гемоглобин, гематокрит, эритроциты, средний объем эритроцитов,распределение эритроцитов по величине, среднее содержание гемоглобина в эритроцитах, средняя концентрация гемоглобина в эритроцитах, тромбоциты лейкоциты, лейкоцитарная формула, скорость оседания эритроцитов; в анализе крови биохимическом общетерапевтическом оцениваются показатели функции печени, почек, в общем (клиническом) анализе мочи - определение цвета, прозрачности мочи, ее удельного веса, белка в моче, pH, глюкозы, кетоновых тел, уробилиногена, лейкоцитарной эстеразы, путем аппаратной микроскопии-клеток эпителия, эритроцитов, цилиндров, соли, слизи, бактерий и грибов.[2,6,7]
В рамках исследования свертывающей системы крови оценивается коагулограмма, а по показаниям, дополнительно—антитромбин III, Д-димер, плазминоген, % активности).
• Рекомендуется исследование уровня антигена плоскоклеточного рака - SCC (при возможности) у всех пациенток с плоскоклеточным РВл и подозрением на него с целью оценки текущей клинической ситуации и дальнейшего мониторинга заболевания. [2]
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5)
2.4 Инструментальные диагностические исследования
Выполнение биопсии опухоли влагалища с ее последующей морфологической верификацией - главный диагностический критерий при РВл.
• Рекомендуется морфологическая верификация диагноза у всех пациенток с подозрением на РВл до начала лечения. Забор материала для исследования может быть осуществлён в ходе биопсии опухоли или ее хирургического удаления с последующим паталого-анатомическим исследованием биопсийного (операционного) материала, путем взятия мазков с опухоли для цитологического исследования, пункции увеличенных ЛУ с последующим цитологическим исследованием [8,14].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5)
Комментарий: При необходимости с целью верификации диагноза патологоанатомическое исследование биопсийного (операционного) материала может дополняться иммуногистохимическим титрованием, а цитологическое исследование -имуноцитохимическим шинированием.
• Рекомендуется цитологическое исследование мазков с шейки матки и цервикального канала, забор аспирата из полости матки на диагностическом этапе всем пациенткам с РВл для верификации диагноза и диагностики сопутствующей патологии [8,14].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• Рекомендуется всем пациенткам с РВл и подозрением на РВл выполнение вульвоскопии, вагиноскопии и кольпоскопии для верификации диагноза и диагностики сопутствующей патологии [2,6].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5)
• Рекомендуется всем пациенткам с РВл выполнять УЗИ (ультразвуковое исследование) органов малого таза, брюшной полости, пахово-бедренных, забрюшинных ЛУ (подвздошных и парааортальных ЛУ), надключичных ЛУ для оценки распространенности опухолевого процесса [2, 6].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5)
Комментарий: УЗИ является поисковым методом визуализации распространенности опухолевого процесса в брюшной полости, полости малого таза, а также в регионарных и отдаленных ЛУ[2,6].
• Рекомендуется выполнять рентгенографию и/или КТ органов грудной клетки с целью оценки распространенности опухолевого процесса всем пациенткам с РВл [2,6,8].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств -5)
Комментарий: КТ органов грудной клетки с большей чувствительностью и специфичностью способно выявить метастазы в легких, а также в лимфоузлах средостения [8].
• Рекомендуется выполнять цистоскопию и ректороманоскопию всем пациенткам при распространенных стадиях РВл с целью выявления инвазии опухоли в мочевой пузырь и прямую кишку[2,6].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5)
• Рекомендуется выполнять магнитно-резонансную томографию (МРТ) и/или компьютерную томографию (КТ) мягких тканей промежности, органов малого таза, брюшной полости и забрюшинного пространства, регионарных ЛУ с внутривенным контрастированием для выявления распространенности опухоли в мягких тканях, наличия метастазов в ЛУ всем пациенткам с РВл [8].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5)
Комментарий: МРТ и/или КТ с внутривенным контрастированием с наибольшей чувствительностью и специфичностью, чем УЗИ, способны выявить распространенность опухоли и наличие метастазов в ЛУ[8].
• Рекомендуется выполнение раздельного диагностического выскабливания слизистой оболочки матки и цервикального канала пациентам при подтвержденном варианте аденокарциномы влагалища для исключения первичного рака эндометрия [8].
• Рекомендуется всем пациенткам с РВл выполнять остеосцинтиграфию (сцинтиграфия костей скелета) при подозрении на метастатическое поражение костей скелета для диагностики распространённости опухолевого процесса [8].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5)
Комментарий: при подозрении на отдаленное метастатическое поражение выполняется ПЭТ-КТ[14].
• Рекомендуется выполнять МРТ или КТ головного мозга с внутривенным контрастированием пациенткам с РВл с подозрением на метастатическое поражение головного мозга для диагностики распространенности опухолевого процесса [8].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5)
• Рекомендуется при подготовке к хирургическому лечению в целях оценки функционального статуса по показаниям проводить дополнительное обследование: эхокардиографию, холтеровское мониторирование сердечной деятельности, исследование функции внешнего дыхания, ультразвуковую допплерографию сосудов шеи и нижних конечностей, а также консультации врача-кардиолога, врача-эндокринолога, врача-невролога и др. [8].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5)
2.5. Иные диагностические исследования
• Рекомендуется проводить патологоанатомическое исследование биопсийного (операционного) материала (в том числе, с применением иммуногистохимических методов) для верификации диагноза, при этом в морфологическом заключении рекомендуется отразить следующие параметры:
1. размер и распространенность первичной опухоли;
2. глубину инвазии первичной опухоли;
3. гистологическое строение опухоли;
4. степень дифференцировки опухоли;
5. наличие периваскулярной, перилимфатической, периневральной инвазии (отрицательный результат также должен быть констатирован);
6. статус регионарных ЛУ (pN) с указанием общего числа исследованных и пораженных ЛУ, признаков экстранодального распространения опухоли (ENE+/-);
7. микроскопическую оценку краев резекции (статус) R0-1 с указанием расстояния до ближайшего края резекции в мм [6,8,14].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Комментарии: при сомнительных или отрицательных результатах первичной биопсии новообразования по результатам морфологического исследования пациенткам с подозрением на РВл показано проведение или повторной биопсии, или при возможности, хирургического вмешательства с интраоперационным патологоанатомическим исследованием биопсийного (операционного) материала.
3. Лечение
• Рекомендуется рассматривать лучевую терапию ЛТ как основной метод лечения всех пациенток с РВл для достижения ремиссии [11,13].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 4)
Комментарий: в ряде случаев, оговариваемых далее, возможно применение при РВл различных вариантов хирургических вмешательств и химиотерапии (XT) [2, 6,14-17]
5.1. Общие принципы лечения в зависимости от стадии
5.1.1. Лечение рака влагалища TisNOMO
• Рекомендуется всем пациенткам при РВл in situ применение нескольких различных тактик: лазерная хирургия, широкая локальная эксцизия, фотодинамическая терапия, контактная ЛТ с целью достижения клинического эффекта и достижения ремиссии [8].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5)
5.1.2. Лечение рака влагалища I стадии (T1N0M01
• Рекомендуется всем пациенткам при РВл I стадии (T1N0M0) радикальная сочетанная ЛТ; возможно проведение внутриполостной ЛТ (брахитерапии) в самостоятельном варианте, преимущественно при опухолях до 1 см или при противопоказаниях к проведению дистанционной ЛТ с целью достижения клинического эффекта [6,10,11,14].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 4)
Комментарий:
ТВариант внутриполостной ЛТ (брахитерапии), эндовагинальное устройство (аппликатор) для ее проведения и, соответственно, режим ее проведения и разовая очаговая доза (РОД) выбираются с учетом локализации опухоли в той или иной части влагалища и распространенности по влагалищной трубке.
2. Внутриполостная ЛТ предпочтительнее в случаях поверхностного роста опухоли влагалища (с глубиной инвазии <0,5 см).
3. В случаях локализованных опухолей наибольшим размером до 1,5 см возможно проведение внутритканевого облучения. [6,10,11,14].
• Рекомендуется хирургическое лечение пациенток с локализованным опухолевым процессом в верхней трети влагалища: выполняется расширенная гистерэктомия (экстирпация матки) с удалением верхней (до средней) трети влагалища, с придатками (или без них), околоматочной клетчатки и региональных лимфатических узлов (тип В 2 по классификации Ouerleu-Morrow, 2017) с целью достижения клинического эффекта и достижения ремиссии. Для сохранения функции яичников возможна их транспозиция [10].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств- 4)
Комментарий: Возможно рассматривать такие варианты хирургического лечения, как широкая локальная эксцизия, резекция влагалища или вагинэктомия с реконструкцией влагалища [10].
• Рекомендуется рассматривать адъювантную ЛТ у пациенток с РВл при наличии следующих факторов неблагоприятного прогноза: положительные края резекции, неблагоприятные гистологические формы опухоли, мульцентрические очаги опухолевого роста в удаленном препарате, признаки лимфоваскулярной и периневральной инвазии, эмболы в сосудистых щелях с целью повышения эффективности проводимой терапии [10,12].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств- 4)
5.1.5. Лечение рака влагалища II стадии (T2N0M01
• Рекомендуется проведение радикальной ЛТ пациенткам с РВл II стадии (T2N0M0) с целью достижения клинического эффекта и ремиссии [9,12,14,19, 20].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 4)
Комментарий:
1 .Наиболее предпочтительным вариантом лечения является радикальная сочетанная ЛТ, предусматривающая последовательное проведение дистанционной и контактной ЛТ [9,10,12,19-21].
2. При выявлении противопоказаний к контактной ЛТ, включая отсутствие преференций от применения или отказ пациента от эндовагинальных методик лечения, возможно проведение дистанционного облучения на область первичного очага в радикальной эквивалентной дозе (с применением высокопрецизионных методик (IMRT, VMAT, STRT).
3. Наиболее часто встречающимися противопоказаниями к проведению контактной ЛТ при местно-распространенном РВл являются субкомпенсация соматической патологии, препятствующая адекватному размещению эндостатических устройств, отсутствие по достижении эквивалентной суммарной очаговой дозы (СОДэкв) 40 Гр на первичный очаг условий для адекватного проведения контактного облучения по основным дозиметрическим показателям - покрытие всего объема GTV и HR-CTV изодозой ^80 %, превышение толерантных доз в органах риска, сопутствующая патология органов риска - мочевого пузыря, уретры, прямой кишки, ректосигмоида, ассоциированная с высоким риском острых и поздних лучевых повреждений III-IV стадий) [6, 8,12, 21-24].
4. Экстраполируя опыт и положительные результаты лечения влагалищных вариантов распространения этиопатогенетически схожих опухолей шейки матки, целесообразно проведение лечения на фоне радиомодификации, в том числе с применением платиносодержащей XT, а также дополнение лучевого лечения адъювантной XT (см. п. 3.2. КР) [22, 25, 26].
5. В случаях персистенции первичного опухолевого процесса (неустойчивая стабилизация или локальное прогрессирование в ходе лучевого лечения, зафиксированное по клинико-инструментальным данным (физикальный и визуальный осмотр, инструментальные методы исследования) на СОДэкв 40 Гр), вопрос дальнейшей тактики лечения рассматривается на онкологическом консилиуме. В индивидуальных случаях возможно выполнение расширенных и комбинированных хирургических вмешательств, включая различные варианты эвисцерации таза [6, 8] и/или системного лекарственного лечения.
5.1.4. Лечение рака влагалища ПТ стадии (T5N0M0: T1N1M0: T2N1M0: T3N1MQ)
• Рекомендуется пациенткам с РВл III стадии радикальная ЛТ, как основной метод лечения для достижения клинического эффекта и ремиссии [9,14,19, 20, 22].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 4)
Комментарий:
1 .Наиболее предпочтительным вариантом лечения является радикальная сочетанная ЛТ, предусматривающая последовательное проведение дистанционной и контактной ЛТ[9,12,19, 20, 22, 24, 25].
2. Хирургическое лечение при III стадии РВл не показано.
3. Тактику лечения при противопоказаниях кЛТ (см. п. 3.3. КР).
5.1.5. Лечение рака влагалища стадии IVa (Тлюбое]МлюбоеМ01
• Рекомендуется условно-радикальная или паллиативная ЛТ пациентам с РВл IVa стадии для улучшения качества жизни пациента. Принципы лечения соответствуют таковым при стадиях ТЗМпобаяМО [12,19].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 4)
Комментарий: Особого внимания при проведении паллиативной терапии требует оценка состояния тяжести пациента по версии B03/EC0G и/или шкале Карновского (см.Приложение Г1-2).
5.1.6. Лечение рака влагалища стадии ГУЪ (ТлюбоеМлюбоеМИ• Рекомендуется пациенткам с РВл IVb (Тлюбое1ЧлюбоеМ1) стадии системная XT, как основной метод первичного лечения. ЛТ (см. п. 3.2. КР) может проводиться как паллиативное лечение для облегчения симптомов и улучшения качества жизни пациентов; возможны различные варианты химиотерапевтического лечения, включая методики региональной XT, применяемые при плоскоклеточном раке других локализаций [60,61].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5)
Комментарий: Особого внимания при проведении паллиативной терапии требует оценка состояния тяжести пациента по версии ВОЗ/ECOG и/или шкале Карновского (см. Приложение Г1-2).
5.1.7. Лечение рецидивов рака влагалища.
• Рекомендуется проводить лечение диссеминированного РВл по индивидуальному плану, что включает в себя XT, различные варианты ЛТ по резерву толерантности с паллиативной целью для улучшения качества жизни. В индивидуальных случаях возможно выполнение расширенных и комбинированных хирургических вмешательств, в том числе различных вариантов эвисцерации таза [6, 9].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 4)
5.2. Принципы лучевой терапии
При ЛТ используются конформные варианты дистанционной и контактной ЛТ, основанные на индивидуальном объемном планировании параметров проводимого облучения по данным современных методов медицинской визуализации, в первую очередь мулыпипараметрической МРТ, КТ с внутривенным контрастированием, ПЭТ-КТ, для обеспечения адекватных онкологических результатов лечения, его эффективности и безопасности. Конкретные методики проведения ЛТ зависят от локализации первичной опухоли, степени ее вертикального распространения по влагалищной трубке и глубины опухолевой инфильтрации.
Топометрическая подготовк
• Рекомендуется топографическое и топометрическое планирование ЛТ в соответствии с ниже следующими принципами для подготовки лучевой терапии:
• топометрическая подготовка проводится в положении лежа на спине с иммобилизацией верхней и нижней части тела (подголовник и подставка под колени).
• проводится с использованием наружных и эндовагинальных рентгенконтрастных маркеров с целью верификации нижней границы опухоли (GTV) и входа во влагалище (introittus). Для более точного оконтуривания первичной опухоли (GTV), тазовых и паховых ЛУ, включаемых в облучаемый объем (CTV, PTV), возможно использование данных КТ/МРТ с внутривенным контрастированием, ПЭТ-КТ, полученных как в ходе процедуры топометрии, так и при интеграции данных первичного обследования с применением fusion-технологий. [2,18, 22, 30, 31].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств 4)
5.2.1. Дистанционная лучевая терапия
• Рекомендуется проведение дистанционной ЛТ пациенткам с РВл с учетом стадии заболевания, морфологического типа опухоли, общего состояния пациентки с целью достижения положительного клинического эффекта и ремиссии [2,18, 22, 30, 31].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств 4)
Комментарии:
Основные принципы проведения дистанционной ЛТ при РВл:
-В случае локализации опухоли в верхних двух третях влагалища в облучаемый объем включаются только структуры малого таза. Облучаемый объем в зоне первичного очага (CTV-T) включает всю влагалищную трубку, шейку и парацервикальную область, паравагинальные ткани. Облучаемый объем регионарных путей лимфооттока (CTV-N) включает различные тазовые ЛУ ниже уровня общих подвздошных ЛУ с учетом локализации первичной опухоли: при локализации в верхних двух третях влагалища -запирательные, наружные и внутренние подвздошные, пресакральные и параректальные ЛУ. [2,18,22,30,31].
-При локализации опухоли в нижней трети влагалища облучение малого таза дополняется облучением паховых областей. Облучаемый объем в зоне первичного очага (CTV-T) включает всю влагалищную трубку, включая introittus, шейку и парацервикальную область, паравагинальные ткани. Облучаемый объем регионарных путей лимфооттока (CTV-N) включает пахово-бедренные и дистальные наружные/внутренние подвздошные ЛУ. [2, 18,22,30,31].
-При опухолях, локализующихся на задней стенке влагалища, в облучаемый объем регионарных путей лимфооттока (CTV-N) должны быть включены пресакралъные и параректальные тазовые ЛУ.
Планируемые терапевтические объемы формируются как:
PTV1 = CTV-T+ 7-12 мм PTV2 = CTV-N + 5-7 мм РТУсум = PTV1 + PTV2
-Величина отступа зависит в первую очередь от набора методов медицинской визуализации, используемых для оконтуривания: чем ниже точность визуализации, тем больше отступ доверительных границ. [2,18, 22, 30, 31].
-ОРГАНЫ РИСКА. Обязательными для оконтуривания с целью расчета подводимых толерантных доз по гистограммам доза-объем (DVH) являются мочевой пузырь, прямая кишка, петли тонкого кишечника, анус, костный мозг (крестцовая кость, копчик, тело L5, вертлужная впадина, проксимальная часть бедренной кости), головка бедренной кости.
ДОЗА-ФРАКЦИОНИРОВАНИЕ. Рекомендуется проведение дистанционного этапа облучения в режиме традиционного фракционирования - РОД PTVcyM 1,8-2 Гр 23 25 фракций до СОДэкв 45-50 Гр.
-В случаях местнораспространенных опухолевых процессов, распадающихся опухолей влагалища для ускорения регрессии опухоли по аналогии с влагалищными вариантами распространения РШМ возможно применение режимов динамического фракционирования - РОД PTVcyM 4 Гр 5 фракций. Впоследствии продолжение лечения РОД РТУсум 1,25 Гр мульфракционно 2 раза в день с интервалом в 4ч до СОДэкв 45-50 Гр или традиционным фракционированием до указанных суммарных доз.
-При выявлении противопоказаний к контактной ЛТ, включая отсутствие преференций от смены метода облучения или отказ пациентки от эндовагинальных методик лечения, возможно продолжение дистанционного облучения на область первичного очага в виде локального буста в радикальной эквивалентной дозе (с применением высокопрецизионных методик (IMRT, VMAT, STRT) до СОДэкв 60-64 Гр при Т1-2 и 66-70 Гр при Т3~4а-стадиях. [2,18, 22, 30, 31].
5.2.2. Контактная лучевая терапия (брахитерапия)
• Рекомендуется применять все варианты контактного облучения пациенткам при плоскоклеточном РВл: внутриполостная, внутритканевая, аппликационная брахитерапия, как высоко- (HDR) и низкомощностная (LDR), так и в режиме PDR для достижения положительного клинического эффекта и ремиссии [2,18, 22, 30, 31].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств -4)
Комментарий: оснащенность лечебного центра оборудованием для брахитерапии является определяющей в применении тех или иных вариантов контактного облучения. На сегодняшний день оптимальной признана высокомощностная брахитерапия с применением источника ионизирующего излучения 192IrHDR как наиболее эффективный и безопасный вариант лечения, однако эквивалентные методики доступны в России и для брахитерапевтических комплексов с источниками 60Со HDR, и для PDR-режимов брахитерапии, и для методик ручного afterloading с использованием штырьковых источников 60Со LDR.
Для внутриполостного облучения наиболее часто применяются цилиндрические аппликаторы, размер которых должен соответствовать анатомическим параметрам влагалища пациентки и плотно прилегать к облучаемым стенкам влагалища.
Принципы топометрии, оконтуривания и планирования соответствуют общим принципам. Методики 3D-4D визуально-контролируемой брахитерапии имеют преимущества в эффективности и безопасности перед 20-методиками планирования контактного облучения [2,18, 22, 30, 31].
Предпочтительным методом визуализации для определения границ облучаемых объемов (GTV, HR-CTV, IR-CTV) является мулыпипараметрическая МРТ с напряженностью магнитного поля не менее 1,5 Тл.
Планирование проводится на основании опухоли в зонах ее визуализации и на 0,5 см от поверхности слизистой вне зон опухолевого поражения.
ДОЗА-ФРАКЦИОНИРОВАНИЕ в монорежиме: РОД 3-7 Гр 3-5 фракций в неделю до СОДэкв 40-50 Гр; в виде буста при сочетанной ЛТ: РОД 3-5 Гр 3-5 фракций в неделю до СОДэкв 20-30 Гр (до суммарных эквивалентных доз СОДэкв 60-64 Гр на область первичного очага при Т1-2, СОДэкв 66-70 Гр - при ТЗ 4a-cmaduu).
При локализации опухоли в верхних двух третях влагалища проводится внутриполостная ЛТ трехканальными аппликаторами (типа Флетчер, Манчестер). Принципы топометрии, оконтуривания и дозиметрического планирования соответствуют таковым при лечении РШМ.
5.5. Принципы системной химиотерапии
• Рекомендуется проведение XT пациенткам с распространенным РВл с паллиативной целью. Лечение проводится до прогрессирования или непереносимой токсичности [27,24].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 4)
Комментарий:
-минимальный объем XT показан ослабленным пациентам:
Щисплатин**50мг/м21 раз в 21-й день до 6 курсов [32,55,56];
-режимы оптимального объема XT при РВл аналогичны таковым при лечении РШМ [53,53, 62-70]: Шаклитаксел** + Щисплатин**, Шаклитаксел**2 + Жарбоплатин**;
Щисплатин** + яГемцитабин**; Шаклитаксел** в монорежиме и представлены в соответствующих клинических рекомендациях по РШМ.
Пациентам с прогрессирующим РВл рекомендуется назначение:
• Шембролизумаб** 200 мг в/в 1 раз в 3 нед при наличии микросателлитной нестабильности высокого уровня, включая нарушения системы репарации ДНК (dMMR) при возникновении рецидива заболевания [69].
• яКапецитабин** 20002500мг/м2/сут внутрь в 1-14-й дни в течение 21 дневного цикла (в качестве XT 2-й и последующих линий)[66,68]
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 4)
Комментарий: Возврат к платиносодержащей XT, как при 1-й линии, возможен при бесплатиновом интервале >6мес.
В настоящее время при распространенном плоскоклеточном РВ проводится лучевая терапия с платиносодержащей сенсибилизирующей химиотерапией, как при плоскоклеточном раке шейки матки, например, Щисплатин**40мг/м2 в/в 1 раз в неделю до 7 циклов [70].
5.4. Лечение болевого синдрома
Порядок и рекомендации по обезболиванию при РЯ соответствуют рекомендациям, представленным в рубрикаторе «Хронический болевой синдром (ХБС) у взрослых пациентов, нуждающихся в паллиативной медицинской помощи»
5.5. Диетотерапия
• К настоящему моменту имеются данные о повышенном риске развития онкологических заболеваний у пациенток с избыточной массой тела (ожирением) [8]. В этой связи рекомендуются мероприятия, направленные на снижение избыточного веса пациенток до нормальных значений. Коррекция привычного рациона питания у таких пациенток будет способствовать профилактике осложнений проводимого лечения (хирургического, лекарственного или лучевого). [8]
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5)
4. Реабилитация
• Рекомендуется всем пациенткам с РВл проведение предреабилитации, значительно ускоряющая функциональное восстановление, сокращаются сроки пребывания в стационаре после операции и снижается частота развития осложнений и летальных исходов на фоне лечения онкологического заболевания. Предреабилитация включает в себя лечебную физкультуру (ЛФК), психологическую и нутритивную поддержку, информирование пациентов [35].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• Рекомендуется физическая предреабилитация всем пациенткам с РВл, состоящая из комбинации аэробной и анаэробной нагрузки. Подобная комбинация улучшает толерантность к физическим нагрузкам, улучшает качество жизни и увеличивает тонус мышц. [36,37,57,58].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Комментарии: Увеличение физической активности за 2 недели до операции улучшает качество жизни в послеоперационном периоде, позволяя вернуться к полноценной повседневной активности уже через 3 недели после операции. Проведение ЛФК на предоперационном этапе уменьшает частоту послеоперационных осложнений [37].
• Рекомендуется всем пациентам тренировка дыхательных мышц в ходе предреабилитации для снижения послеоперационных легочных осложнений и продолжительности пребывания в стационаре [36,57,58].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• Рекомендуется нейропсихологическая реабилитация всем пациенткам с РВл с участием медицинского психолога для улучшения настроения, снижения уровня тревоги и депрессии. Пациентки, прошедшие курс психологической предреабилитации, лучше адаптируются к повседневной жизни после хирургического лечения [35,57,58].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Комментарий: тестирование, консультация медицинского психолога включает в себя методики, направленные на работу со стрессом (методики релаксации, формирование позитивного настроя), в течение 40-60 мин 6 дней в неделю, которая начинается за 5 дней до операции и продолжается 30 дней после и значительно улучшает качество жизни пациенток [35,57,58]
• Рекомендуется медицинская реабилитации пациентам, перенесшим операцию по поводу онкологического заболевания -Тактика fast track rehabilitation («быстрый путь») и ERAS (early rehabilitation after surgery - ранняя реабилитация после операции)), включающая в себя комплексное обезболивание, раннее энтеральное питание, отказ от рутинного применения зондов и дренажей, ранняя мобилизация (активизация и вертикализация) пациентов уже с 1-2-х суток после операции не увеличивают риски ранних послеоперационных осложнений, частоту повторных госпитализаций. Тактика fast track rehabilitation уменьшает длительность пребывания в стационаре и частоту послеоперационных осложнений. [38,39, 40,41,57,58].
Уровень убедительности рекомендаций - А (уровень достоверности доказательств - 2).
Комментарии: Раннее начало выполнения комплекса ЛФК с включением в программу аэробной, силовой нагрузок и упражнений на растяжку не увеличивает частоту послеоперационных осложнений, улучшая качество жизни [38,39,40,41,57,58].
Применение побудительной спирометрии, подъем головного конца кровати, раннее начало дыхательной гимнастики и ранняя активизация пациенток помогают профилактике застойных явлений в легких в послеоперационном периоде [38,39, 40,41,57,58].
• Рекомендуется пациентам ранняя активизация, назначение антикоагулянтов с профилактической целью и ношение компрессионного трикотажа, которые помогают профилактике тромботических осложнений в послеоперационном периоде у онкогинекологических пациентов [42,57,58].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• Лечение болевого синдрома в послеоперационном периоде носит междисциплинарный характер и помимо медикаментозной коррекции рекомендуется физическая реабилитация (ЛФК), лечение положением, психологические методы коррекции боли (релаксация), чрескожная электростимуляция, акупунктура [43,57,58].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• Рекомендуется пациенткам с РВл проведение сеансов медицинского массажа начиная со 2-х суток после операции для уменьшения интенсивности болевого синдрома, беспокойства, напряжения, улучшения качества жизни [44,57,58].
• Рекомендуется проведение клинико-психологической коррекции и методик релаксации в послеоперационном периоде, позволяющим снизить кратность обезболивания и улучшить качество жизни у онкогинекологических пациентов [45,57,58].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• Рекомендуется при возникновении лимфостаза нижних конечностей проводить полную противоотечную терапию, включающую в себя мануальный лимфодренаж (массаж нижней конечности медицинский), ношение компрессионного трикотажа, выполнение комплекса ЛФК, уход за кожей с целью снижения отеков [46,50].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• Рекомендуется пациентам при возникновении лимфедемы нижних конечностей с целью противоотечной терапии проведение по показаниям одного или нескольких методов физиотерапевтического лечения [48, 50, 51, 52]:
• перемежающую пневмокомпрессию конечностей в сочетании с полной противоотечной терапией [51, 52].
• низкоинтенсивную лазеротерапию в сочетании с полной противоотечной терапией [52]
• электротерапию в сочетании с полной противоотечной терапией [71].
• низкочастотную магнитотерапию в сочетании с полной противоотечной терапией [72].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
5. Профилактика
• Рекомендуется всем пациенткам с РВл соблюдать следующую периодичность и методы наблюдения у врача-онколога после завершения лечения [8,14]:
1. последующие консультации каждые 3 месяца в течение первых 2 лет;
2. каждые 6 месяцев до 5 лет после лечения;
3. каждый год после 5 лет
или при появлении жалоб;
Объем обследований при каждом посещении:
• Физикальное обследование, сбор жалоб, изучение анамнеза пациентки;
• УЗИ органов брюшной полости, малого таза, регионарных ЛУ;
• КТ/МРТ-исследование малого таза и брюшной полости проводится при недостаточной информативности УЗИ или при подозрении на рецидив заболевания;
• КТ или рентгенография органов грудной клетки каждые 6-12 месяцев. При недостаточной информативности рентгенографии органов грудной клетки или при подозрении на рецидив заболевания проводится КТ/МРТ органов грудной клетки с/ без внутривенного контрастирования.
• ПЭТ/КТ проводится при недостаточной информативности проведенных обследований или при подозрении на рецидив заболевания [8,14,55].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5)
Комментарий: задачей наблюдения является раннее выявление прогрессирования заболевания с целью раннего начала хирургического и/или химиолучевого лечения. У пациентов с высоким риском прогрессирования заболевания перерыв между обследованиями может быть сокращен.
Организация оказания медицинской помощи
Медицинская помощь, за исключением медицинской помощи в рамках клинической апробации, в соответствии с Федеральным законом от 21.11.2011 № 323-ФЗ (ред. от 25.05.2019) «Об основах охраны здоровья граждан в Российской Федерации» организуется и оказывается:
1. в соответствии с положением об организации оказания медицинской помощи по видам медицинской помощи, которое утверждается уполномоченным федеральным органом исполнительной власти;
2. в соответствии с порядком оказания помощи по профилю «онкология», обязательным для исполнения на территории Российской Федерации всеми медицинскими организациями;
3. на основе настоящих клинических рекомендаций;
4. с учетом стандартов медицинской помощи, утвержденных уполномоченным федеральным органом исполнительной власти.
Первичная специализированная медико-санитарная помощь оказывается врачом-онкологом и иными врачами-специалистами в центре амбулаторной онкологической помощи либо в первичном онкологическом кабинете, первичном онкологическом отделении, поликлиническом отделении онкологического диспансера.
При подозрении на РВл у пациентки или его выявлении врачи-терапевты, врачи-терапевты участковые, врачи общей практики (семейные врачи), врачи-специалисты, в установленном порядке направляют пациента на консультацию в центр амбулаторной онкологической помощи либо в первичный онкологический кабинет, первичное онкологическое отделение медицинской организации для оказания ему первичной специализированной медико-санитарной помощи.
Консультация в центре амбулаторной онкологической помощи либо в первичном онкологическом кабинете, первичном онкологическом отделении медицинской организации должна быть проведена не позднее 5 рабочих дней с даты выдачи направления на консультацию. Врач-онколог центра амбулаторной онкологической помощи (в случае отсутствия центра амбулаторной онкологической помощи - врач-онколог первичного онкологического кабинета или первичного онкологического отделения) организует взятие биопсийного (операционного) материала, а также выполнение иных диагностических исследований, необходимых для установления диагноза, включая распространенность онкологического процесса и стадию заболевания.
В случае невозможности взятия в медицинской организации, в составе которой организован центр амбулаторной онкологической помощи (первичный онкологический кабинет, первичное онкологическое отделение), биопсийного (операционного) материала, проведения иных диагностических исследований пациент направляется лечащим врачом в онкологический диспансер или в медицинскую организацию, оказывающую медицинскую помощь пациентам с онкологическими заболеваниями.
Срок выполнения патологоанатомических исследований, необходимых для гистологической верификации злокачественного новообразования, не должен превышать 15 рабочих дней с даты поступления биопсийного (операционного) материала в патологоанатомическое бюро (отделение).
При подозрении на РВл или его выявлении в ходе оказания скорой медицинской помощи пациентов переводят или направляют в медицинские организации, оказывающие медицинскую помощь пациентам с онкологическими заболеваниями, для определения тактики ведения и необходимости применения дополнительно других методов специализированного противоопухолевого лечения.
Врач-онколог центра амбулаторной онкологической помощи (первичного онкологического кабинета, первичного онкологического отделения) направляет пациента в онкологический диспансер или в медицинские организации, оказывающие медицинскую помощь пациентам с онкологическими заболеваниями, для уточнения диагноза (в случае невозможности установления диагноза, включая распространенность онкологического процесса и стадию заболевания, врачом-онкологом центра амбулаторной онкологической помощи, первичного онкологического кабинета или первичного онкологического отделения) и оказания специализированной, в том числе высокотехнологичной, медицинской помощи.
Срок начала оказания специализированной, за исключением высокотехнологичной, медицинской помощи пациентам с онкологическими заболеваниями в медицинской организации, оказывающей медицинскую помощь пациентам с онкологическими заболеваниями, не должен превышать 14 календарных дней с даты гистологической верификации злокачественного новообразования или 14 календарных дней с даты установления предварительного диагноза злокачественного новообразования (в случае отсутствия медицинских показаний для проведения патологоанатомических исследований в амбулаторных условиях).
Специализированная, в том числе высокотехнологичная, медицинская помощь оказывается врачами-онкологами, врачами-радиотерапевтами в онкологическом диспансере или в медицинских организациях, оказывающих медицинскую помощь пациентам с онкологическими заболеваниями, имеющих лицензию, необходимую материально-техническую базу, сертифицированных специалистов, в стационарных условиях и условиях дневного стационара и включает профилактику, диагностику, лечение онкологических заболеваний, требующих использования специальных методов и сложных уникальных медицинских технологий, а также медицинскую реабилитацию.
В медицинской организации, оказывающей медицинскую помощь пациентам с онкологическими заболеваниями, тактика медицинского обследования и лечения устанавливается консилиумом врачей-онкологов и врачей-радиотерапевтов с привлечением при необходимости других врачей-специалистов. Решение консилиума врачей оформляется протоколом, подписывается участниками консилиума врачей и вносится в медицинскую документацию пациента.
Показания для госпитализации в круглосуточный или дневной стационар медицинской организации, оказывающей специализированную, в том числе высокотехнологичную, медицинскую помощь по профилю «онкология», определяются консилиумом врачей-онкологов и врачей-радиотерапевтов с привлечением при
необходимости других врачей-специалистов.
Показаниями для госпитализации в медицинскую организацию в экстренной или неотложной форме являются:
1. наличие осложнений РВл, требующих оказания специализированной медицинской помощи в экстренной и неотложной форме;
2. наличие осложнений лечения (хирургическое вмешательство, ЛТ, лекарственная терапия и т.д.) РВл.
Показаниями для госпитализации в медицинскую организацию в плановой форме являются:
1. необходимость выполнения сложных интервенционных диагностических медицинских вмешательств, требующих последующего наблюдения в условиях круглосуточного или дневного стационара;
2. наличие показаний к специализированному противоопухолевому лечению (хирургическое вмешательство, ЛТ, в том числе контактная, дистанционная и другие виды ЛТ, лекарственная терапия и др.), требующему наблюдения в условиях круглосуточного или дневного стационара.
Показаниями к выписке пациента из медицинской организации являются:
1. завершение курса лечения или одного из этапов оказания специализированной, в том числе высокотехнологичной, медицинской помощи в условиях круглосуточного или дневного стационара при условиях отсутствия осложнений лечения, требующих медикаментозной коррекции и/или медицинских вмешательств в стационарных условиях;
2. отказ пациента или его законного представителя от специализированной, в том числе высокотехнологичной, медицинской помощи в условиях круглосуточного или дневного стационара, установленной консилиумом медицинской организации, оказывающей онкологическую помощь, при условии отсутствия осложнений основного заболевания и/или лечения, требующих медикаментозной коррекции и/ или медицинских вмешательств в стационарных условиях;
3. необходимость перевода пациента в другую медицинскую организацию по соответствующему профилю оказания медицинской помощи. Заключение о целесообразности перевода пациента в профильную медицинскую организацию осуществляется после предварительной консультации по предоставленным медицинским документам и/или данным предварительного осмотра пациента врачами-специалистами медицинской организации, в которую планируется перевод.
Критерии оценки качества медицинской помощи
Список литературы
1. FUTURE I/II Study Group, Dillner J., Kjaer S.K., Wheeler C.M. et al. Four year efficacy of prophylactic human papillomavirus quadrivalent vaccine against low grade cervical, vulvar, and vaginal intraepithelial neoplasia and anogenital warts: randomised controlled trial. BMJ 2010;341:3493.
2. Eifel P.J., Berek J.S., Markman M.A. Cancer of the cervix, vagina, and vulva. In: De Vita VT Jr, Lawrence TS, Rosenberg SA: Cancer: Principles and Practice of Oncology. 9th ed. Philadelphia, Pa: Lippincott Williams & Wilkins, 2011. Pp.: 1311-44.
3. Злокачественные новообразования в России в 2017 году (заболеваемость и смертность). Под ред. А.Д. Каприна, В.В. Старинского, Г.В. Петровой. М., 2018.
4. Бохман Я.В. Руководство по онкогинекологии. Л.: Медицина, 1989. С. 462.
5. Kurman R., Carcangiu М., Herrington С. WHO Classification of tumours of female reproductive organs. Revised 4th edn. Lyon: IARC Press, 2014.
6. Коржевская E.B., Кузнецов B.B., Грицай A.H. Злокачественные опухоли влагалища. Клиническая онко гинекология: руководство для врачей под ред. В.П. Козаченко. 2-е изд., перераб. и доп. М.: Издательство Бином, 2016. С. 97-108.
7. Gallup D.G., Talledo О.Е., Shah K.J., Hayes C. Invasive squamous cell carcinoma of the vagina: a 14-year study. Obstet Gynecol 1987;69(5):782—5.
8. Perez C.A., Gersell D.J., McGuire W.P., Morris M. Vagina. In: Hoskins W.J., Perez C.A., Young R.C., eds. Principles and Practice of Gynecologic Oncology. Philadelphia, Pa: Lippincott Williams & Wilkins, 2000. Pp.: 811—40.
9. Frank S.J., Jhingran A., Levenback C. et al. Definitive radiation therapy for squamous cell carcinoma of the vagina. Int J Radiat Oncol Biol Phys 2005 ;62(1): 138—47.
10. Stock R.G., Chen A.S., Seski J. A 30-year experience in the management of primary carcinoma of the vagina: analysis of prognostic factors and treatment modalities. Gynecol Oncol 1995 ;56(1) :45—52.
11. Perez C.A., Camel H.M., Galakatos A.E. et al. Definitive irradiation in carcinoma of the vagina: long-term evaluation of results. Int J Radiat Oncol Biol Phys 1988; 15(6) :1283—90.
12. Tran P.T., Su Z., Lee P. et al. Prognostic factors for outcomes and complications for primary squamous cell carcinoma of the vagina treated with radiation. Gynecol Oncol 2007;105(3):641-9.
13. Frank C.A., Korba A., Sharma S. Dosimetricconsiderations in irradiation of carcinoma of the vagina. Int J Radiat Oncol Biol Phys 1977;62:138-47.
14. Rubin S.C., Young J., Mikuta J.J. Squamous carcinoma of the vagina: treatment, complications, and long-term follow-up. Gynecol Oncol 1985;20(3):346-53.
15. Raitanen M., Rantanen V., Kulmala J. et al. Supra-additive effect with concurrent paclitaxel and cisplatin in vulvar squamous cell carcinoma in vitro Int J Cancer 2002;100:238-43.
16.. Koh WJ et al. Vulvar Cancer, Version 2.2019, NCCN Clinical Practice Guidelines in Oncology
17. Chung H.C., Ros W., Delord J.P. et al. Efficacy and safety of pembrolizumab in previously treated advanced cervical cancer: results from the phase II KEYNOTE-158 Study. J Clin Oncol 2019;37(17):1470-8.
18. Chyle V., Zagars G.K., Wheeler J.A. et al. Definitive radiotherapy for carcinoma of the vagina: outcome and prognostic factors. Int J Radiat Oncol Biol Phys 1996;35(5):891-905.
19. Lian J., Dundas G., Carlone M. et al. Twenty-year review of radiotherapy for vaginal cancer: an institutional experience. Gynecol Oncol 2008;lll(2):298-306.
20. Andersen E.S. Primary carcinoma of the vagina: a study of 29 cases. Gynecol Oncol 1989;33(3):317-20.
21. Grigsby P.W. Vaginal cancer. Curr Treat Options Oncol 2002;3(2): 125-30.
22. Dalrymple J.L., Russell A.H., Lee S.W. et al. Chemoradiation for primary invasive squamous carcinoma of the vagina. Int J Gynecol Cancer 2004; 14(1): 110-7.
23. Samant R., Lau B., Choan E. et al. Primary vaginal cancer treated with concurrent chemoradiation using Cis-platinum. Int J Radiat Oncol Biol Phys 2007;69(3):746-50.
24. Tabata T., Takeshima N., Nishida H. et al. Treatment failure in vaginal cancer. Gynecol Oncol 2002 ;84(2) :309-14.
25. Tjalma W.A., Monaghan J.M., de Barros Lopes A. et al. The role of surgery in invasive squamous carcinoma of the vagina. Gynecol Oncol 2001;81(3):360-5.
26. Mell L.K., Mundt A.J. Survey of IMRT use in the United States, 2004. Cancer J 2005;104:1296-303.
27. Benedetti Panici P., Bellati F., Plotti F. et al. Neoadjuvant chemotherapy followed by radical surgery in patients affected by vaginal carcinoma. Gynecol Oncol 2008;111(2):307-11.
28. Salani R., Backes F.J., Fung M.F. et al. Posttreatment surveillance and diagnosis of recurrence in women with gynecologic malignancies: society of gynecologic oncologists recommendations. Am J Obstet Gynecol 2011;204(6):466-78.
29. Mell L.K., Mundt A.J. Survey of IMRT use in the United States, 2004. Cancer J 2005;104:1296-303.
30. Каприн А.Д., Мардынский Ю.С. Терапевтическая радиология: национальное руководство. М.: ГОЭТАР-Медиа, 2018. 704 с.
31. Т.Труфанов Г.Е., Асатурян М.А., Жаринов Г.М. Лучевая терапия: учебник. Т.2. М.: ГЭОТАР-Медиа, 2010; 192 с.
32. Thigpen Т.Т.. Blessing LA.. Homeslev H.D. et al. Phase II trial of cisplatin in advanced or recurrent cancer of the vagina: a gynecologic oncology group study. Gvnecol Oncol 1986:23111:101—4.
33. Cancer Facts and Figures. ACS 2016.
34. Хохлова C.B., Коломиец Л.А., Кравец O.A. и др. Практические рекомендации по лекарственному лечению рака шейки матки. Злокачественные опухоли: Практические рекомендации. RUSSCO 2018;8:178-89.
35. Silver J.A., Baima J. Cancer prehabilitation: an opportunity to decrease treatmentrelated morbidity, increase cancer treatment options, and improve physical and psychological
health outcomes. Am J Phys Med Rehabil 2013;92(8):715—27.
36. Nilsson H., Angeras U., Bock D. et al. Is preoperative physical activity related to postsurgery recovery? BMJ Open 2016;6(l):e007997. DOI: 10.1136/bmjopen-2015-007997.
37. Hijazi Y., Gondal U., Aziz O. et al. A systematic review of prehabilitation programs in abdominal cancer surgery. Int J Surg 2017;39:156-62. DOI: 10.1016/j.ijsu.2017.01.111.
38. Tsimopoulou I., Pasquali S., Howard R. et al. Psychological prehabilitation before cancer surgery: a systematic review. Ann Surg Oncol 2015;22(13):4117—23. DOI: 10.1245/s 10434-015-4550-z.
39. Carter J. Fast-Track Surgery in Gynaecology and Gynaecologic Oncology: A Review of a Rolling Clinical Audit. ISRN Surg 2012;2012(368014): 19.
40. Nelson G., Bakkum-Gamez J., Kalogera E. et al. Guidelines for perioperative care in gynecologic/oneology: Enhanced Recovery After Surgery (ERAS) Society recommendations - 2019 update. Int J Gynecol Cancer 2019. DOI: 10.1136/ijgc-2019-000356.
41. De Almeida E.P.M., de Almeida J.P., Landoni G. et al. Early mobilization programme improves functional capacity after major abdominal cancer surgery: a randomized controlled trial. Br J Anaesth 2017;119(5):900—7.
42. Wren S.M., Martin M., Yoon J.K., Bech F. Postoperative pneumonia-prevention program for the inpatient surgical ward. J Am Coll Surg 2010;210(4):491-5.
43. Peedicayil A., Weaver A., Li X., Carey E. et al. Incidence and timing of venous thromboembolism after surgery for gynecological cancer. Gynecol Oncol 2011 ;121(1):64— 9.
44. Swarm R., Abernethy A.P., Anghelescu D.L. et al. NCCN Adult Cancer Pain. Adult cancer pain. J Natl Compr Cane Netw 2010;8:1046-86.
45. Ben-Arye E., Samuels N., Lavie O. Integrative medicine for female patients with gynecologic cancer. J Altern Complement Med 2018;24(9,10):881-9.
46. Goerling U., Jaeger C., Walz A. et al. The efficacy of psycho-oncological interventions for women with gynaecological cancer: a randomized study. Oncology 2014;87:114-24.
47. Smits A., Lopes A., Bekkers R. et al. Body mass index and the quality of life of endometrial cancer survivors - a systematic review and meta-analysis. Gynecol Oncol 2015;137:180-7. D01:10.1016/j.ygyno.2015.01.540.
48. Schmitz K.H., Courneya K.S., Matthews C. et al. American College of Sports Medicine roundtable on exercise guidelines for cancer survivors. Med Sci Sports Exerc 2010;42(7):1409-26.
49. Zhou Y., Chlebowski R., La Monte M.J. et al. Body mass index, physical activity, and mortality in women diagnosed with ovarian cancer: results from the Women"s Health Initiative. Gynecol Oncol 2014;133(1):4-10.
50. Biglia N., Zanfagnin V., Daniele A. et al. Lower body lymphedema in patients with gynecologic cancer. Anticancer Res 2017;37(8):4005-15.
51. Shaitelman S.F., Cromwell K.D., Rasmussen J.C. et al. Recent progress in the treatment and prevention of cancer-related lymphedema. CA Cancer J Clin 2015;65(1):55—81. DOI: 10.3322/caac.21253.
52. Borman P. Lymphedema diagnosis, treatment, and follow-up from the view point of physical medicine and rehabilitation specialists. Turk J Phys Med Rehab
2018;64(3) :179—97.
53. Zhou М. et al. Tumor regression grading after neoadjuvant chemotherapy predicts longterm outcome of stage IIIC epithelial ovarian cancer./Journal of Clinical Oncology 2018 36:15_suppl, 5547-5547.
54. Kudelka AP, Winn R, Edwards CL, et al.: Activity of paclitaxel in advanced or recurrent squamous cell cancer of the cervix. Clin Cancer Res 2 (8): 1285-8,1996.
55. Saito T. Japan Society of Gynecologic Oncology guidelines 2015 for the treatment of vulvar cancer and vaginal cancer/Int I Clin Oncol. 2018 Apr;23(2):201-234. doi: 10.1007/sl0147-017-1193-z. Epub 2017 Nov 20.
56. Shrivastava SB Management of Vaginal Cancer/Rev Recent Clin Trials. 2015;10(4):289-97.
57. Schneider S/ Prehabilitation programs and ERAS protocols in gynecological oncology: a comprehensive review/ Arch Gvnecol Ohstet. 2019 Nov 25. doi: 10.1007/s00404-019-05321-7.
58. Miralpeix Е/ Role and impact of multimodal prehabilitation for gynecologic oncology patients in an Enhanced Recovery After Surgery (ERAS) program./ Int I Gvnecol Cancer. 2019 Oct;29(8):1235-1243. doi: 10.1136/ijgc-2019-000597. Epub 2019 Aug 30
59. Kim, Ji-Young et al. “Vaginal cancer with multiple liver and pulmonary metastases that achieved long-term survival.” Obstetrics & gynecology science vol. 56,6 (2013): 416-9. doi:10.5468/ogs.2013.56.6.416
60. Stock RG, Chen AS, Seski J: A 30-year experience in the management of primary carcinoma of the vagina: analysis of prognostic factors and treatment modalities. Gynecol Oncol 56(1): 45-52,1995.
61. Eifel PJ, Klopp AH, Berek JS, et al.: Cancer of the cervix, vagina, and vulva. In: DeVita VT Jr, Lawrence TS, Rosenberg SA, et al., eds.: DeVita, Heilman, and Rosenberg’s Cancer : Principles & Practice of Oncology. 11th ed. Philadelphia, Pa: Wolters Kluwer, 2019, pp 1171-1210.
62. Rose PG., et al. “Paclitaxel and cisplatin as first-line therapy in recurrent or advanced squamous cell carcinoma of the cervix: a gynecologic oncology group study”. Journal of Clinical Oncology 17.9 (1999): 2676-2680.
63. Santeufemia D. A. Et al. Cisplatin-gemcitabine as palliative chemotherapy in advanced squamous vulvar carcinoma: report of two cases./Eur J Gynaecol Oncol. 2012; 33(4): 421-422
64. Witteveen P.O.et al. Phase II study on paclitaxel in patients with recurrent, metastatic or locally advanced vulvar cancer not amenable to surgery or radiotherapy: a study of the EORTC-GCG ^European Organisation for Research and Treatment of Cancer--Gynaecological Cancer Groupl./ Ann
65. Oonk. M. H.M. et al. European Society of Gynaecological Oncology Guidelines for the Management of Patients With Vulvar Cancer/ Int I Gvnecol Cancer 2017:27: 832Y837
66. Garcia A. A. et al. Phase II clinical trial of capecitahine in the treatment of advanced. persistent or recurrent squamous cell carcinoma of the cervix with translational research:
Приложение А1. Состав рабочей группы
1. Ашрафян Л.А., академик РАН, д.м.н., профессор, заместитель директора ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России, директор института онкогинекологии и маммологии.
2. Антонова И.Б., д.м.н., заведующая лабораторией профилактики, ранней диагностики и комбинированного лечения онкологических заболеваний, ФГБУ «РНЦРР» Минздрава России.
3. Берлев И.В., д.м.н., профессор, заведующий научным отделением онкогинекологии ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России.
4. Вереникина Е.В., к.м.н., заведующая отделением онкогинекологии ФГБУ «РНИОИ» Минздрава России.
5. Гриневич В.Н., к.м.н., заведующий отделением онкопатологии МНИОИ им. П.А. Герцена - филиала ФГБУ «НМИЦ радиологии» Минздрава России.
6. Демидова Л.В., д.м.н., в.н.с. отдела лучевой терапии МНИОИ им. П.А. Герцена -филиала ФГБУ «НМИЦ радиологии» Минздрава России.
7. Коломиец Л.А., д.м.н., профессор, заведующая отделением гинекологии НИИ онкологии ФГБНУ «Томский НИМЦ РАН»
8. Кравец О.А., д.м.н., руководитель группы лучевой терапии онкогинекологических заболеваний ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
9. Крейнина Ю.М., д.м.н., в.н.с. лаборатории инновационных технологий радиотерапии и химиолучевого лечения злокачественных новообразований ФГБУ «РНЦРР» Минздрава России.
10. Кузнецов В.В., д.м.н., профессор, в.н.с. отделения онкогинекологического ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
11. Мухтаруллина С.В., д.м.н., заведующая отделением онкогинекологии МНИОИ им. П.А. Герцена - филиала ФГБУ «НМИЦ радиологии» Минздрава России.
12. Новикова Е.Г., д.м.н., профессор МНИОИ им. П.А. Герцена - филиала ФГБУ «НМИЦ радиологии» Минздрава России.
13. Снеговой А.В., д.м.н., заведующий отделением онкологического дневного стационара ФБГУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
14. Тюляндина А.С., д.м.н., с.н.с. онкологического отделения лекарственных методов лечения (химиотерапевтического) № 2 ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
15. Шевчук А.С., к.м.н., заведующий онкологического отделения хирургических методов лечения № 8 ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
16. Ульрих Е.А., д.м.н., профессор ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России.
Блок по медицинской реабилитации:
1. Кончугова Т.В., д.м.н., профессор, врач-физиотерапевт, заведующая отделом преформированных физических факторов ФГБУ «НМИЦ реабилитации и курортологии» Минздрава России.
2. Еремушкин М.А., д.м.н., профессор, заведующий отделением ЛФК и клинической биомеханики ФГБУ «НМИЦ реабилитации и курортологии» Минздрава России.
3. Гильмутдинова И.Р., к.м.н., заведующая отделом биомедицинских технологий и лаборатория клеточных технологий, врач-трансфузиолог, дерматовенеролог, специалист в области клеточных технологий ФГБУ «НМИЦ реабилитации и курортологии» Минздрава России.
4. Буланов А.А., д.м.н., с.н.с. отделения клинической фармакологии и химиотерапии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
5. Бутенко А.В., д.м.н., профессор, главный врач НИИ клинической онкологии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, председатель НС «Ассоциация специалистов по онкологической реабилитации».
6. Назаренко А.В., к.м.н., врач высшей квалификационной категории, заведующий отделением радиологии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, член Российской ассоциации терапевтических радиационных онкологов (РАТРО), European Society for Radiotherapy & Oncology (ESTRO), Российско-американского альянса по изучению рака (ARCA), представитель России в МАГАТЭ.
7. Обухова О.А., к.м.н., врач-физиотерапевт, заведующий отделением реабилитации ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, член Европейской ассоциации парентерального и энтерального питания (ESPEN), Российской ассоциации парентерального и энтерального питания (RESPEN).
8. Хуламханова М.М., врач-физиотерапевт, врач-онколог отделения реабилитации ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
9. Ткаченко Г.А., психолог отделения реабилитации ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
10. Петрова Т.А., логопед-педагог отделения реабилитации ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
11. Семиглазова Т.Ю., д.м.н., в.н.с. научного отдела инновационных методов терапевтической онкологии и реабилитации ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России, доцент кафедры онкологии ФГБОУ ВО «СЗГМУ им. И.И. Мечникова» Минздрава России.
12. Пономаренко Г.Н., д.м.н., профессор, заслуженный деятель науки РФ, генеральный директор ФГБУ «ФНЦРИ им. Г.А. Альбрехта» Минтруда России, заведующий кафедрой курортологии и физиотерапии ФГБВОУ ВО «Военно-медицинская академия им. С.М. Кирова» Минобороны России.
13. Ковлен Д.В., д.м.н., доцент кафедры курортологии и физиотерапии ФГБВОУ ВО «Военно-медицинская академия им. С.М. Кирова» Минобороны России.
14. Каспаров Б.С., к.м.н., заместитель главного врача по амбулаторной помощи заведующий клинико-диагностическим отделением ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России.
15. Крутов А.А., врач-онколог клинико-диагностического отделения ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России.
16. Зернова М.А., инструктор-методист по лечебной физкультуре ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России.
17. Кондратьева К.О., медицинский психолог ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России.
18. Иванова Г.Е., д.м.н., главный специалист по медицинской реабилитации Минздрава России, заведующая отделом медико-социальной реабилитации инсульта НИИ ЦВПиИ ФГБОУ ВО «РНИМУ им. Н.И. Пирогова» Минздрава России.
19. Романов А.И., академик РАН, д.м.н., профессор, главный врач ФГБУ «Центр реабилитации» Управления делами Президента РФ.
20. Филоненко Е.В., д.м.н., профессор, заведующая центром лазерной и фотодинамической диагностики и терапии опухолей МНИОИ им. П.А. Герцена -филиала ФГБУ «НМИЦ радиологии» Минздрава России, врач-онколог.
21. Степанова А.М., заместитель директора по науке, заведующая отделением реабилитации частного многопрофильного диагностического и реабилитационного центра «Восстановление».
Блок по организации медицинской помощи:
Невольских А.А., д.м.н., профессор, заместитель директора по лечебной работе МРНЦ им. А.Ф. Цыба - филиала ФГБУ «НМИЦ радиологии» Минздрава России.
Хайлова Ж.В., к.м.н., главный врач клиники МРНЦ им. А.Ф. Цыба - филиала ФГБУ «НМИЦ радиологии» Минздрава России.
Иванов С.А., д.м.н., профессор РАН, директор МРНЦ им. А.Ф. Цыба - филиала ФГБУ «НМИЦ радиологии» Минздрава России.
Геворкян Т.Г., заместитель директора НИИ КЭР ФГБУ НМИЦ онкологии им. Н.Н. Блохина.
Приложение А2. Методология разработки клинических рекомендации
• врачи-онкологи;
• врачи-хирурги;
• врачи-радиологи;
• врачи-генетики;
• врачи-дерматовенерологи;
• врачи-патологоанатомы
Методы, использованные для сбора/селекции доказательств: поиск в электронных базах данных; анализ современных научных разработок по проблеме РБ в РФ и за рубежом; обобщение практического опыта российских и зарубежных специалистов.
Методы, использованные для формулирования рекомендаций - консенсус экспертов.
Экономический анализ
Анализ стоимости не проводился и публикации по фармакоэкономике не анализировались.
Метод валидизации рекомендаций:
• внешняя экспертная оценка;
• внутренняя экспертная оценка.
Описание метода валидизации рекомендаций
Настоящие рекомендации в предварительной версии рецензированы независимыми экспертами, которые попросили прокомментировать, прежде всего, насколько интерпретация доказательств, лежащих в основе рекомендаций, доступна для понимания.
Комментарии, полученные от экспертов, тщательно систематизировались и обсуждались председателем и членами рабочей группы. Каждый пункт обсуждался и вносимые в результате этого изменения в рекомендации регистрировались. Если же изменения не вносились, то регистрировались причины отказа от внесения изменений.
Консультации и экспертная оценка: проект рекомендаций рецензирован также независимыми экспертами, которых попросили прокомментировать, прежде всего, доходчивость и точность интерпретации доказательной базы, лежащей в основе рекомендаций.
Для окончательной редакции и контроля качества рекомендации повторно проанализированы членами рабочей группы, которые пришли к заключению, что все замечания и комментарии экспертов приняты во внимание, риск систематических ошибок при разработке рекомендаций сведен к минимуму.
Порядок обновления клинических рекомендаций
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию - не реже чем 1 раз в 3 года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, при наличии обоснованных дополнений/замечаний к ранее утвержденным клиническим рекомендациям, но не чаще 1 раза в 6 мес.
Приложение Б. Алгоритмы ведения пациента
Приложение В. Информация для пациентов
Рекомендуется: при осложнениях XT - связаться с врачом-онкологом.
1. При повышении температуры тела 38 °С и выше:
• обратиться на прием к врачу-онкологу
2. При стоматите:
• диета - механическое, термическое щажение;
• частое полоскание рта (каждый час) - ромашка, кора дуба, шалфей, смазывать рот облепиховым (персиковым) маслом—по рекомендации врача-онколога:
• обрабатывать полость рта по рекомендации врача-онколога.
3. При диарее:
• диета - исключить жирное, острое, копченое, сладкое, молочное, клетчатку. Можно нежирное мясо, мучное, кисломолочное, рисовый отвар. Обильное питье.
• принимать препараты по рекомендации врача-онколога.
4. При тошноте:
• принимать препараты по рекомендации врача-онколога.
Приложение Г.
Приложение Г1. Шкала оценки тяжести состояния пациента по версии B03/EC0G
Название на русском языке: Шкала оценки тяжести состояния пациента по версии B03/EC0G [82]
Оригинальное название: The Eastern Cooperative Oncology Group/World Health Organization Performance Status (ECOG/WHO PS)
Источник (официальный сайт разработчиков, публикация с валидацией): https://ecog-acri n.org/resources/ecog-performance-status
Oken MM, Creech RH, Tormey DC, Horton J, Davis ТЕ, McFadden ET, Carbone PP: Toxicity and response criteria of the Eastern Cooperative Oncology Group. Am J Clin Oncol 1982, 5(6):649-655
Тип: шкала оценки
Назначение: описать уровень функционирования пациента с точки зрения его способности заботиться о себе, повседневной активности и физических способностях (ходьба, работа и т. д.).
Приложение Г2. Шкала Карновского
Название на русском языке: Шкала Карновского [83].
Оригинальное название (если есть): KARNOFSKY PERFORMANCE STATUS
Источник (официальный сайт разработчиков, публикация с валидацией): Karnofsky DA, Burchenal JH: The clinical evaluation of chemotherapeutic agents in cancer. In: Evaluation of chemotherapeutic agents, edn. Edited by MacLeod C. New York: Columbia University Press; 1949:191-205
Тип: шкала оценки
Назначение: описать уровень функционирования пациента с точки зрения его способности заботиться о себе, повседневной активности и физических способностях (ходьба, работа и т. д.).
Содержание (шаблон):
Ключ (интерпретация): приведен в самой шкале
Шкала Карновского
100— Состояние нормальное, жалоб нет
90— Способен к нормальной деятельности, незначительные симптомы или признаки заболевания
80— Нормальная активность с усилием, незначительные симптомы или признаки заболевания 70— Обслуживает себя самостоятельно, не способен к нормальной деятельности или активной работе
60— Нуждается порой в помощи, но способен сам удовлетворять большую часть своих потребностей 50— Нуждается в значительной помощи и медицинском обслуживании
40— Инвалид, нуждается в специальной помощи, в т.ч. медицинской
30— Тяжелая инвалидность, показана госпитализация, хотя смерть непосредственно не угрожает
20— Тяжелый больной. Необходимы госпитализация и активное лечение 10— Умирающий
О— Смерть
Теги: новообразования влагалища
234567 Начало активности (дата): 10.01.2023 13:15:00
234567 Кем создан (ID): 989
234567 Ключевые слова: новообразования влагалища, опухоль, компьютерная томография, лимфатические узлы
12354567899
Похожие статьи
Злокачественные опухоли слюнных железЗлокачественные новообразования почек, почечных лоханок, мочеточника, других и неуточненных мочевых органов
Рентген на дому 8 495 22 555 6 8
Забрюшинные неорганные саркомы
Дифференцированный рак щитовидной железы



