 08.01.2023
08.01.2023
Злокачественные новообразования почек, почечных лоханок, мочеточника, других и неуточненных мочевых органов
Опухоль может прилежать к капсуле печени, что не является инфильтрацией прилежащих органов.
Разработчик клинической рекомендации • Национальное общество детских гематологов и онкологов
Одобрено Научно-практическим Советом Минздрава РФ
Список сокращений
SIOP - The International Society of Paediatric Oncology (Международное общество детских онкологов)
NSS - органосохраняющая операция PD - прогрессия заболевания SD - стабилизация заболевания
WAGR Syndrome - Wilms tumor - Aniridia - Genital anomalies - mental Retardation Syndrome (Нефробластома - Аниридия - Аномалии мочеполового тракта - Умственная отсталость)
АГ - ангиография
АЛТ - аланинаминотрансфераза
ACT- аспартатаминотрансфераза
АЧТВ - активированное частичное тромбопластиновое время
БСВ - бессобытийная выживаемость
ВМК - ванилил-миндальная кислота
в/в кап. - внутривенно капельно
в/в стр. - внутривенно струйно
ГВК - гомованилиновая кислота
Гр - грей
ЗНО - злокачественное образование
КТ - компьютерная томография
к/у - контрастное усиление
ЛДГ - лактатдегидрогеназа
ЛТ - лучевая терапия
л/у - лимфатические узлы
мг/кг - миллиграмм на килограмм
мг/м2 - миллиграмм на метр квадратный
М3 РФ - Министерство здравоохранения Российской Федерации
мкг/кг - микрограмм на килограмм
мкг/м2 - микрограмм на метр квадратный
МНО - международное нормализованное отношение
МРТ - магнитно-резонансная томография
НБ - нефробластома
НПВ - нижняя полая вена
ОБП - органы брюшной полости
ОВ - опухоль Вилмса
ОГК - органы грудной клетки
ПЭП - парентеральное питание
ПХТ - полихимиотерапия
РАН - Российская академия наук
РИД - радиоизотопная диагностика
РКИ - рандомизированное контролируемое исследование
РОД - разовая очаговая доза
РФ - Российская Федерация
ТВ - тромбиновое время
ТО - тотальное облучение
ТОЛ - тотальное облучение легких
СОД - суммарная очаговая доза
УЗИ - ультразвуковое исследование
XT - химиотерапия
ЧЛС - чашечно-лоханочная система
ЩФ - щелочная фосфатаза
ЭКГ - электрокардиограмма
Эхо-КГ - эхокардиография
Термины и определения
Бессобытийная выживаемость (БСВ) - время наблюдения от момента диагностики заболевания до момента возникновения события
Билатеральная нефробластома - двустороннее поражение почек нефробластомой
Общая выживаемость - время наблюдения от начала лечения до смерти больного
Полихимиотерапия - схема введения нескольких химиопрепаратов, в которой учитывается доза, кратность, дни и способ введения цитостатика
Прогрессирование заболевания - появление нового поражения и/или любой рост первичных поражений более чем на 25%
Лучевая терапия - метод локального лучевого воздействия на опухоль/ткани/органы
1. Краткая информация
Нефробластома или опухоль Вилмса (НБ) - злокачественная эмбриональная опухоль почки у детей, развивающаяся из плюрипотентных клеток-предшественников нефрогенной ткани [1].
1.2 Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
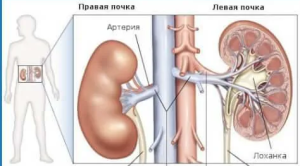
Почка образуется из трех источников: нефрогенной ткани/бластемы (образует строму и дифференцируется в почечные канальцы путем мезенхимально-эпителиального перехода), мезонефрального протока (дает начало мочеточнику, почечной лоханке, почечным чашечкам, сосочковым каналам и собирательным трубкам) и мезенхимы (сосудистая система). Бластема обычно исчезает к 36 неделе гестации, однако приблизительно у 1% детей нефрогенные остатки могут персистировать после рождения [1-3]. Остатки нефрогенной стромы имеют высокий потенциал к озлокачествлению и обнаруживаются у 40% пациентов с нефробластомой [4,5].
В мировой литературе описано до 40 генов, альтерации которых приводят к развитию нефробластомы, наиболее изученными из них являются гены WT1, WT2, ассоциированные с рядом генетических синдромов, таких как: синдромы Беквита-Видемана, Дениса-Драша, Перлмана, изолированная гемигипертрофия, WAGR-синдром [6,7]. Генетические синдромы встречаются в 5-10% случаев нефробластом и в основном представляют собой сочетание опухоли с пороками развития мочеполовой системы, нефропатию, макросомию [6-8].
Клиническими критериями наследственного характера развития НБ являются: билатеральность (до 10% в структуре нефробластомы) и мультифокальность поражения, ранний детский возраст клинической манифестации заболевания, наличие аналогичной опухоли у других членов семьи (семейная форма встречается в 1% случаев), сочетание опухоли с генетическими синдромами [2,3].
1.3 Эпидемиология заболевания или состояния (группы заболеваний или состояний)
Частота встречаемости 0,7-0,8 до 1 на 100 000 населения детского возраста до 14 лет, что составляет около 5% от общего числа злокачественных новообразований детского возраста. На долю нефробластомы приходится примерно 90% случаев опухолей почек у детей. Около 80% случаев диагностируется в возрасте до 5 лет, из них 15% до 1 года, медиана возраста составляет 3,5 года. Частота заболевания у девочек и мальчиков приблизительно одинакова. В 5-10% случаев встречается билатеральное поражение почек. Описаны случаи поражения единственной подковообразной почки, а также случаи экстраренального расположения НБ [9,10].
1.4 Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
С64 - Злокачественные новообразования (ЗНО) мочевых путей, кроме почечной лоханки; С65 - ЗНО почечной лоханки;
С66 - ЗНО мочеточника;
С68 - ЗНО других и неуточнённых мочевых органов.
1.5 Классификация заболевания или состояния (группы заболеваний или состояний)
НБ классифицируется по гистологическому типу опухоли (см. раздел 1.5.1 Международная гистологическая классификация НБ), по стадиям в зависимости от радикальности оперативного вмешательства (см. раздел 1.5.2
Классификация послеоперационного стадирования), по группам риска согласно гистологическому варианту опухоли (см. раздел 1.5.3 Группы риска согласно гистологическому варианту опухоли). Классификации основаны на рекомендациях SIOP [11].
1.5.1 Международная гистологическая классификция НБ
Гистологическая классификация основана на результатах патолого-анатомического исследования ткани опухоли (таб. 1).
Таблица 1. Гистологическая классификация НБ
1.5.2 Классификация послеоперационного стадирования
Классификация основана на радикальности оперативного вмешательства, а также на распространенности процесса. При метастатической форме или билатеральной форме нефробластомы, локальная стадия может не совпадать с клинической (например, стадия IV, локальная стадия III).
Стадия I:
• Опухоль ограничена почкой или окружена капсулой/псевдокапсулой, если выходит за контуры почки. Капсула/псевдокапсула могут быть инфильтрированы опухолью, но неопластическая ткань не достигает наружной ее границы;
• Опухоль может пролабировать в лоханку (так называемое «выпячивание») или «провисать» в мочеточник, не инфильтрируя его стенки;
• Сосуды почечного синуса интактны;
• Возможны инвазия и опухолевые эмболы в сосудах паренхимы почки.
Наличие зрелых тубулярных структур в мягких тканях почечного синуса не свидетельствует о его инфильтрации и представляет собой структуры интралобарных остатков нефрогенной стромы. Перилобарные остатки нефрогенной стромы могут так же быть иногда обнаружены в мягких тканях почечного синуса. Истинной инфильтрацией мягких тканей почечного синуса/ворот почки является обнаружение очагов бластемы в непосредственной близости к нервным стволикам.
Аспирационная или игольная («tru-cut», трепан-биопсия) биопсия в анамнезе не повышает стадию.
Наличие некроза или признаков терапевтического патоморфоза (гемосидероз, инфильтрация пенистыми макрофагами) в мягких тканях почечного синуса, почечной вене и/или в периренальной жировой ткани не повышает стадию.
Инфильтрация надпочечника не повышает стадию, если наружная поверхность капсулы его не вовлечена в опухолевый процесс.
Опухоль может прилежать к капсуле печени, что не является инфильтрацией прилежащих органов. Только наличие истинной инфильтрации паренхимы печени должно быть расценено как стадия III.
• Витальная опухоль визуализируется в периренальной жировой ткани и не покрыта капсулой/псевдокапсулой, но удалена радикально («чистые» края резекции);
• Витальная опухоль инфильтрирует мягкие ткани почечного синуса;
• Витальная опухоль инфильтрирует кровеносные и лимфатические сосуды почечного синуса или почечной вены, или визуализируется в периренальных мягких тканях, но удалена радикально;
• Витальная опухоль инфильтрирует стенку мочеточника;
• Витальная опухоль инфильтрирует прилежащие органы или нижнюю полую вену, но удалена радикально.
Только наличие нервов в мягких тканях, наряду с сосудами, дает основание считать визуализируемые структуры почечным синусом.
Стадия III:
• Витальная опухоль визуализируется в маркированных краях резекции («опухоль в краске»). При наличии опухоли с патоморфозом в крае резекции стадия III выставляется при условии обнаружения витальной опухоли менее чем в 5мм от маркированного краской края резекции. При наличии витальной опухоли более чем в 5мм от маркированного краской края резекции стадия не повышается до III. Расстояние минимум 5мм от витальной опухоли до края резекции с патоморфозом должно быть подтверждено несколькими блоками фрагментов, выделенных из этой области;
• Любые абдоминальные лимфатические узлы поражены витальной опухолью или опухолью с терапевтическим патоморфозом;
• Пре- или интраоперационый разрыв опухоли, видимый при патоморфологическом исследовании, вне зависимости от остальных критериев стадирования;
• Наличие опухолевого тромба в крае резекции мочеточника, почечной вены или нижней полой вены (края резекции в этом случае всегда обсуждаются с хирургом);
• Опухолевый тромб, вплотную прилежащий к стенке нижней полой вены, удален хирургом частями;
• Открытая/клиновидная биопсия опухоли до предоперационной химиотерапии или хирургического этапа лечения;
• Витальная опухоль или опухоль с патоморфозом проникают за пределы забрюшинного пространства;
• Опухолевые импланты (витальные или с патоморфозом) найдены в любом месте брюшной полости/забрюшинного пространства.
Сокращение почечной вены: зачастую опухолевый тромб пролабирует в почечную вену и выходит за макроскопические края резекции. Это в большей степени заметно после хирургической резекции с последующей фиксацией.
Такие случаи в обязательном порядке обсуждаются с хирургом, для того, чтобы выяснить, легко ли тромб был им выделен и удален или же вплотную был прикреплен к стенке нижней полой вены; прилагал ли хирург дополнительные усилия для его отделения или даже инструменты. Если хирург лишь с легкостью вытянул тромб, то пролабирующий в краях резекции тромб не означает стадию III. Стадия III выставляется только при условии фрагментации тромба в процессе выделения или же если выделение вызвало значительные затруднения со стороны хирурга.
Наличие некротизированной опухоли или опухоли с патоморфозом в лимфатических узлах расценивается как предсуществовавший витальный метастаз и выставляется стадия III (возможно витальная опухоль имеет место быть за пределами исследуемого лимфатического узла). Регрессивные (терапевтически индуцированные) изменения в лимфатическом узле должны иметь форму предсуществовавшего метастаза. Интрасинусоидальное распределение пенистых макрофагов не расценивается как опухоль с патоморфозом.
Иногда в ткани лимфатического узла могут быть обнаружены зрелые тубулярные структуры, что ассоциировано с депозитами белка Тамм-Хорсфалла, но также встречается и без него. Данное явление не расценивается как метастаз.
Наличие повреждения/разрыва опухоли расценивается как значимое для стадии III только если визуализируется при нефрэктомии. Если нет, то стадирование проводится согласно остальным критериям, а случай обязательно обсуждается на междисциплинарной конференции/консилиуме.
Гематогенные метастазы (лёгкие, печень, кости, головной мозг и др.) или метастазы в отдалённые лимфатические узлы (вне брюшной полости и полости таза).
Стадия V:
Двусторонняя нефробластома.
Опухоль с каждой стороны стадируется согласно описанным критериям отдельно.
1.5.3 Группы риска (согласно гистологическому варианту опухоли)
Гистологическое разделение на группы риска зависит от факта наличия или отсутствия предоперационной химиотерапии.
Гистологическая классификация в случае проведения предоперационной химиотерапии:
Группа низкого риска:
• Кистозная частично дифференцированная НБ;
• Полностью некротизированная НБ.
Группа промежуточного риска:
• Эпителиальный тип;
• Стромальный тип;
• Смешанный тип;
• Регрессивный тип;
• Фокальная анаплазия.
Группа высокого риска:
• Бластемный тип;
• Диффузная анаплазия;
Гистологическая классификация в случае нефрэктомии на первом этапе лечения: Группа низкого риска:
• Кистозная частично дифференцированная НБ.
Группа промежуточного риска:
• НБ без анаплазии и ее варианты;
• Фокальной анаплазия.
Группа высокого риска:
• Диффузная анаплазия.
В дополнении к анаплазированным типам НБ, для последующей терапии необходимо выделять три основных типа: тотально некротизированный (группа низкого риска), бластемный тип (группа высокого риска) и остальные типы (промежуточный риск). Тем не менее, прогностически важно указывать соотношение каждого компонента опухоли в процентном соотношении. Кистозная частично дифференцированная нефробластома диагностируется методами визуализации и единственным методом лечения является хирургический.
1.5.4 Стадирование нефробластомы в случае органосохраняющей операции [11]:
R0: Интактная паренхима почки по краю опухоли (исключая нефробластоматоз);
R1: Интактная псевдокапсула по краю опухоли;
R2: Опухоль в крае резекции.
В данных случаях необходимо аккуратно и прицельно исследовать края резекции, так как зачастую очаги удаляются с небольшим ободком почечной паренхимы по краю (особенно в случаях мультинодулярного поражения почки).
Используемые хирургические термины:
• резекция/частичная нефрэктомия - удаление очага с ободком почечной паренхимы;
• энуклеация - выделение опухолевого узла без паренхимы почки;
Должно быть выполнено патолого-анатомическое исследование всего края резекции по почке. В случае небольшого объема узла, он забирается в работу полностью. Должно быть указано минимальное расстояние до края резекции. Интактный край (паренхима почки) не должен быть меньше 1мм. В случае обнаружения остатков нефрогенной стромы в крае резекции такой край не считается вовлеченным в опухолевый процесс и стадия не повышается [11].
1.6 Клиническая картина заболевания или состояния (группы заболеваний или состояний)
Клиническая картина может складываться из общих и местных симптомов. Выраженность симптомов будет зависеть от локализации опухоли в почке, ее размеров, а также наличия отдаленного метастазирования. При НБ небольших размеров без вовлечения ЧЛС, опухоль может стать случайной находкой на УЗИ, тогда как образование больших размеров с прорастанием ЧЛС и вовлечением близлежащих структур может сопровождаться макро-/ микрогематурией, артериальной гипертензией ввиду вовлечения ренальных сосудов, рвотой при поддавливают желудка большим образованием левой почки. Общая симптоматика может включать симптомы интоксикации, боли в животе. При локализации отдаленного метастазирования в легких возможно развитие респираторной симптоматики.
на 0, 15, 28 дни терапии (для локализованных стадий) или на на 0, 15, 28, 42 дни терапии (для генерализованных стадий), на этапе послеоперационной терапии - перед каждым введением химиопрепаратов или, если интервал между введениями препаратов больше 1 недели, то не менее 1 раза в неделю (по показаниям возможно более частый забор анализов);
• биохимического общетерапевтического анализа крови (мочевина, креатинин, электролиты, глюкоза, лакгатдегидрогеназа, аланинаминотрансфераза, аспартатаминотрансфераза, биллирубин общий и прямой, щелочная фосфатаза, общий белок, альбумин) - перед началом лечения на этапе предоперационной терапии, перед началом специфической терапии, в процессе лечения на 0, 15, 28 дни терапии (для локализованных стадий) или на на 0, 15, 28, 42 дни терапии (для генерализованных стадий), на этапе послеоперационной терапии - перед каждым введением химиопрепаратов или, если интервал между введениями препаратов больше 1 недели, то не менее 1 раза в неделю (по показаниям возможно более частый забор анализов);
• коагулограммы (уровень протромбина, фибриногена, антитромбина III, международное нормализованное отношение (МНО), активированное частичное тромбопластиновое время (АЧТВ), протромбиновое время (ТВ)) - перед началом лечения на этапе предоперационной терапии, перед началом специфической терапии;
• определение основных групп крови по системе АВО, определение антигена D системы резус (резус-фактора), определение фенотипа антигенов эритроцитов для возможности выполнения гемотрансфузии при наличии показаний - перед началом лечения на этапе предоперационной терапии;
• общего (клинического) анализа мочи - перед началом лечения на этапе предоперационной терапии, перед началом специфической терапии, на этапе послеоперационной терапии - перед каждым введением химиопрепаратов или, если интервал между введениями препаратов больше 1 недели, то не менее 1 раза в неделю (по показаниям возможно более частый забор анализов).
• госпитальный скрининг при госпитализации в медицинскую организацию - определение антигена (HBsAg) вируса гепатита В (Hepatitis В virus) в крови, качественное исследование, определение антител к вирусу гепатита С (Hepatitis С virus) в крови, определение антител классов М, G (IgM, IgG) к вирусу иммунодефицита человека ВИЧ-1 (Human immunodeficiency virus HIV 1) в крови [18]
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Комментарии: наиболее частыми клиническими и лабораторным проявлением опухолей ночек является макро-/микрогематурия вследствие кровотечения в чашечно-лоханочную систему ночки, сопровождающаяся развитием анемического синдрома [12].
На фоне проводимой терапии возможно развитие индуцированной аплазии кроветворения, что может потребовать терапии колониестимулирующими факторами, а также трансфузий компонентов крови.
2.4. Инструментальные диагностические исследования
• Пациентам с НБ рекомендовано для оценки распространенности процесса УЗИ органов брюшной полости и забрюшинного пространства в следующих ситуациях [12,19]:
• всем пациентам - перед началом лечения на этапе предоперационной терапии, а также перед началом специфической терапии
• пациентам с геренализованной формой НБ на этапе предоперационной терапии - на О, 15, 28,42 дни терапии
• пациентам с геренализованной формой НБ на этапе послеоперационной терапии - на 1, 6, 10, 24 неделе и в конце терапии
• пациентам с локализованной формой НБ на этапе предоперационной терапии - на 0, 15, 28 дни терапии
• пациентам с локализованной формой НБ на этапе послеоперационной терапии - на 1, 6, 10, 24 неделе и в конце терапии
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Комментарии: обследовать необходимо всю брюшную полость, обязательно детальное исследование контралатеральной ночки (также в положении лежа на спине и на боку) на предмет двусторонней опухоли, нефрогенных остатков или других патологических изменений, которые могут повлиять на функцию почек. Необходимо проводить скрининг паренхимы печени на предмет метастазов. УЗИ является исследованием выбора при изучении почечной вены и нижней полой вены на предмет внутривенного опухолевого тромба (как с помощью 2D УЗИ, так и посредством цветного допплеровского картирования), а также для оценки взаимоотношения опухоли с прилежащими органами в режиме реального времени.
• Пациентам с НБ рекомендована МРТ брюшной полости и забрюшинного пространства с контрастным усилением (или как альтернатива - КТ брюшной полости с контрастным усилением, если невозможно МРТ исследование) для оценки распространенности процесса в следующих ситуациях [19-22]:
• всем пациентам - перед началом лечения на этапе предоперационной терапии, а также перед началом специфической терапии
• пациентам с геренализованной формой НБ на этапе предоперационной терапии - на 0,42 дни терапии
• пациентам с геренализованной формой НБ на этапе послеоперационной терапии - только при подозрении на наличие остаточного компонента опухоли и/или при прогрессировании по данным УЗИ ОБП
• пациентам с локализованной формой НБ на этапе предоперационной терапии - на 0, 28 дни терапии
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Комментарии: исследование проводится с целью определения топографии и органной принадлежности образования, выявление опухоли в трех измерениях и определение объема опухоли, поиск очагов отдаленного метастазирования. Благодаря отсутствию ионизирующего излучения и высокой контрастности мягких тканей, МРТ является более предпочтительным методом по сравнению с КТ. Обследовать необходимо всю брюшную полость (от купола печени до полости таза включительно). Протокол исследования должен выполняться МРТ-рентгенологами, имеющими опыт в проведении детской МРТ брюшной полости. При выполнении процедуры у детей младшего возраста рекомендуется применение седации или общей анестезии - в соответствии с принятой местной практикой. Введение гадолиния рекомендовано, но не является обязательным. КТ брюшной полости является дополнительным к УЗИ исследованием "второго выбора". Введение внутривенного йодированного контрастного вещества является обязательным условием проведения исследования. Необходимо провести объемную съемку первой (портально-венозной) фазы. Обследовать необходимо всю брюшную полость (включая печень целиком и полость таза).
• Пациентам с НБ рекомендована для оценки распространенности процесса рентгенография в 2-х проекциях или КТ органов грудной клетки в следующих ситуациях [12,19-21]:
о всем пациентам - перед началом лечения на этапе предоперационной терапии, а также перед началом специфической терапии
о пациентам с геренализованной формой НБ на этапе предоперационной терапии - на О (КТ и рентгенография), 28 (рентгенография), 42 (КТ) дни терапии о пациентам с геренализованной формой НБ на этапе послеоперационной терапии - на 10 неделе и в конце терапии (если на 10 неделе не было достигнуто полной санации очагов)
о пациентам с локализованной формой НБ на этапе предоперационной терапии - на 0, 28 дни терапии
о пациентам с локализованной формой НБ на этапе послеоперационной терапии -рентгенография на 10 неделе и в конце терапии, КТ - только в случае подозрения на появление метастатических очагов по рентгену ОГК
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Комментарии: нативная КТ грудной клетки является обязательной диагностической процедурой, необходимой для оценки наличия легочных метастазов. Внутривенное контрастирование необязательно (но может применяться, если КТ ОГК проводится в сочетании с КТ брюшной полости, а не с МРТ брюшной полости).
Наиболее частыми органами-мишенями для отдаленного метастазирования являются легкие. Согласно рекомендациям SIOP имеются определенные характеристики очагового поражения легких, трактующегося как метастатическое или неметастатическое: •
• округлые солидные очаги размерами 1-2мм не классифицируются как метастазы, эти пациенты получают предоперационную XT, как при локальных стадиях;
• округлые солидные очаги размерами 3-5мм классифицируются как метастазы, такие пациенты получают предоперационную XT, как при генерализованной форме заболевания. Перед нефрэктомией проводится оценка динамики со стороны легочных метастазов (КТ).
При сохранении очагов в легких рекомендуется их оперативное удаление после нефрэктомии. Если гистология удаленных очагов выявляет отсутствие опухолевых клеток или тотальный некроз - послеоперационное лечение проводится согласно локальной стадии. Если в метастазах выявляются живые опухолевые клетки - продолжение лечения согласно рекомендациям для IV стадии;
• очаги размером > 5 мм классифицируются как метастазы. Такие пациенты получают предоперационную XT, как при генерализованной форме заболевания. Перед нефрэктомией проводится оценка динамики со стороны легочных метастазов (КТ).
• Пациентам с подозрением на НБ, если нельзя исключить нейробластому, рекомендовано проведение сцинтиграфии с йобенгуаном [1231] перед началом специфической терапии [20,21,23].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Комментарии: подозрения на нейробластому могут быть в случаях, если но результатам методов визуализации (КТ/МРТ ОБП): нет вовлечения почечных чашечек или почечной лоханки в процесс; есть вовлечение в процесс крупных сосудов брюшной полости; в опухоли встречаются кальцинаты; образование вовлекает в процесс всю ночку. Уровень катехоламинов в моче повышен.
• Рекомендовано в целях оценки размера и локализации опухоли, вовлеченности сосудов при планировании хирургического лечения проведение ангиографии сосудов почек, а также реносцинтиграфии пациентам с двусторонними опухолями почек, опухолями подковообразной почки, а также иных состояниях на усмотрение врача-хирурга при планировании частичной нефрэктомии [15];
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Комментарии: предпочтительно, чтобы ее проводил опытный врач-рентгенолог, непосредственно перед операцией.
• Всем пациентам с НБ перед началом терапии для своевременного выявления сопутствующей патологии со стороны сердечно-сосудистой системы и оценки рисков лечения, определения безопасной тактики лечения рекомендуется выполнение электрокардиографии [12,24-26]
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 4).
Комментарии: показатели фракции укорочения, фракции выброса и конечно-систолического напряжения стенки должны быть документально зафиксированы перед введением первой дозы Доксорубицина всем пациентам, которые планируют получать Доксорубицин, т.е. пациентам с TV стадией заболевания и гистологической группой высокого риска.
• Пациентам НБ рекомендовано выполнение эхо-кардиографии в следующих ситуациях [12]
о пациентам с генерализованной формой НБ на этапе предоперационной терапии на 0, 42 сутки;
о пациентам с генерализованной формой НБ на этапе послеоперационной терапии - на 10 неделе и в конце терапии;
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Комментарии: показатели фракции укорочения, фракции выброса и конечно-систолического напряжения стенки должны быть документально зафиксированы перед введением первой дозы доксорубицина• ** всем пациентам, которые планируют получать доксорубицин** т.е. пациентам с IV стадией заболевания и гистологической группой высокого рискас НБ перед началом терапии для своевременного выявления сопутствующей патологии со стороны сердечно-сосудистой системы и оценки рисков лечения, определения безопаносной тактики лечения рекомендуется выполнение электрокардиографии
• Рекомендовано проведение аудиологического тестирования на 1 неделе терапии и в конце терапии у детей, получавших в ходе лечения платиносодержащие препараты (карбоплатин) для выявления тугоухости, вызванной ототоксическим действием лекарственных препаратов с возможным использованием следующих методов [27,28]:
• Тональная пороговая аудиометрия в стандартном и расширенном диапазоне частот до 16-20 кГц (методика определения тональных порогов слуха зависит от возраста и уровня
развития ребенка: аудиометрия со зрительным подкреплением от 6 до 24 мес., игровая аудиометрия от 2 до 5 лет или стандартная аудиометрия от 5 лет).• Регистрация отоакустической эмиссии на частоте продукта искажения в диапазоне частот до 8-10 кГц.
• Импедансометрия.
• Регистрация коротколатентных и тоно-специфичных слуховых вызванных потенциалов (например, стационарных слуховых вызванных потенциалов - ASSR) для детей раннего возраста при отсутствии отоакустической эмиссии и невозможности проведения тональной пороговой аудиометрии.
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Комментарии: объем возможного акустического обследования зависит от оснащенности стационара.
Желательные сроки проведения аудиологического тестирования:
• Базовое тестирование перед началом лечения.
• Через 4-6 недель после завершения лечения (последнего введения карбонлатина).
• 1-2 раза в год в течение 3-5 лет после завершения лечения для пациентов с нормой слуха.
При выявлении тугоухости пациент направляется к врачу-оториноларингологу (сурдологу) для определения индивидуальной программы наблюдения, лечения, реабилитации.
2.5. Иные диагностические исследования
• Пациентам с подозрением на НБ рекомендовано проведение биопсии с последующим патолого-анатомическим исследованием биопсийного (операционного) материала в случае невозможности исключения других опухолей почки/экстрапочечной этиологии на основании данных визуализации и клинической картины, а именно в следующих случаях [29,30]:
• наблюдается необычная клиническая картина: Возраст > 6 лет (риск опухолей почки другой этиологии); имеется инфекция мочеполовых путей или септицемия (подозрение на абсцесс); инфильтрация поясничной мышцы (подозрение на нейробластому); наличие метастазов в легких у пациентов младше 2 лет, экстрапеченочные и экстрапульмональные метастазы (подозрение на злокачественную рабдоидную опухоль почки, ЗРО);
• есть необычные находки по результатам визуализации: многочисленные кальцинаты (подозрение на нейробластому); обширная лимфаденопатия (подозрение на ЗРО), паренхима почек не визуализируется; практически полностью экстраренальный процесс.
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5)
Комментарии: трепан-биопсия не должна применяться в случаях, если возраст пациента 6 месяцев и младше, в данной ситуации предусмотрена первичная хирургическая операция, а также при наличии опухоли, представленной только кистозным компонентом (следует рассмотреть возможность проведения первичной хирургической операции, высок риск разрыва капсулы опухоли в процессе биопсии). Проведение открытой биопсии не рекомендовано. Открытая биопсия опухоли ночки в постхирургическом стадировании трактуется как 3 стадия и требует проведения локальной лучевой терапии (см. раздел 3.3 Лучевая терапия).
У пациентов с кистозным вариантом опухоли высок риск разрыва капсулы опухоли в процессе биопсии.
• Рекомендовано в целях подтверждения диагноза и для принятия решения о тактике адъювантной терапии выполнение патолого-анатомического исследования операционного материала во всех случаях [12].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Комментарии: референс должен осуществляться в сроки до 2-х недель от оперативного вмешательства для принятия решения о тактике адъювантной терапии. •
• Всем пациентам с нефробластомой рекомендована консультация врача-диетолога с последующей коррекцией основного рациона и возможным назначением дополнительно лечебных питательных смесей в целях обеспечения адекватной и своевременной нутритивной поддержки (см. раздел 7.2) [31-40]
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5)
• При наличии у пациента с НБ стигм дисэмбриогенеза и врождённых пороков развития, особенно урогенитального тракта, аниридии, макросомии, гемшипертрофии, а также при подозрении на билатеральное поражение, рекомендована консультация врача-генетика, так как генетические синдромы встречаются в 5-10% случаев нефробластом и в основном представляют собой сочетание опухоли с пороками развития мочеполовой системы, нефропатию, макросомию [6-8,12,13].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5)
• Всем пациентам с НБ с коморбидностью, которая может повлиять на выбор тактики противоопухолевого лечения, перед началом терапии рекомендуется консультация соответствующего врача-специалиста (врача - детского кардиолога, врача - невролога, врача - офтальмолога и др.) [16].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Комментарии: пациенты с подозрением на генетические синдромы должны быть осмотрены узкими специалистами в зависимости от органов-мишеней (например, пациенты с подозрением на WAGR-синдром и аниридией должны быть консультированы врачом -офтальмологом) [13].
3. Лечение
Терапия НБ базируется на химиотерапии и оперативном лечении Очень небольшая часть пациентов нуждается в лучевой терапии. Выбор тактики лечения зависит от стадии заболевания, группы риска и возраста пациента [41 ].
• Пациентам младше 7 месяцев или пациентам старше 16 лет, а также пациентам с кистозным вариантам опухоли в качестве первого этапа лечения рекомендовано хирургическое вмешательство [41].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Комментарии: У детей младше 7 месяцев чаще всего наблюдается врожденная мезобластная нефрома, для излечения которой достаточно лишь хирургического вмешательства.
У пациентов старше 16 лет необходимо исключить почечно-клеточную карциному, требующую проведения первичной операции во всех случаях, когда это возможно.
У пациентов с кистозным вариантом опухоли высок риск разрыва капсулы опухоли в процессе биопсии.
3.1 Неоадъювантная химиотерапия
• Всем пациентам с верифицированной НБ, которым на первом этапе лечения не была показана операция, рекомендовано проведение предоперационной (неоадъюватной) химиотерапии [41,42].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• При локализованной форме НБ (стадии I-III) рекомендована неоадъювантная химиотерапия в режиме AV, 4 недели: винкристин** 1,5 мг/м2/сут, в/в болюсно - 1, 2, 3, 4 недели; #дактиномицин** 45 мкг/кг/сут, в/в болюсно - 1, 3 недели (см. приложение А3.1) [41.43] .
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 4).
Комментарии: Максимальная разовая доза винкристина** 2 мг. Дактиномицин не применяется у детей весом менее 5 кг. Хирургическое лечение проводится на 7-й неделе [5,11].
3.2 Хирургическое лечение
• Всем пациентам с унилатеральной НБ после неоадъювантной терапии рекомендовано проведение туморнефруретерэктомии [42,44-47]
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Комментарии: при проведении нефрэктолиш руководствоваться следующими принципами:
• Срединная поперечная лапаротомия в качестве хирургического доступа.
• Проведение ревизии брюшной полости выполняется до нефрэктолиш. Необходимо исследовать печень, лимфатические узлы и брюшину на предмет метастатического поражения и внутрибрюшных метастазов. Любое подозрительное в отношении опухоли новообразование иссекается или выполняется биопсия при её нерезектабельности. Это
касается и биопсии лимфатических узлов, даже, если они макроскопически выглядят непоражёнными.
• Нефрэктомию целесообразно начинать с лигирования почечных сосудов. Почечная артерия перевязывается первой с целью предотвращения разрыва опухоли из-за её хрупкости и возможности диссеминации через иеринефральные перфорантные вены. В протоколе операции регистрируются этапы мобилизации. Если опухоль больших размеров и доступ к сосудам затруднен, то вначале производят её выделение из окружающих тканей, а сосуды лигируются но возможности.
• Пересечение мочеточника производится максимально близко к мочевому пузырю;
• Удалять опухоль ночки целесообразно с окружающей клетчаткой и поражёнными структурами;
• Необходимо тщательное исследование контралатерального ретроперитонеалъного пространства при билатеральном поражении;
• Необходима тщательная ревизия почечной вены и нижней полой вены (НПВ) во время операции - неиротяжённый тромб почечной вены резецируется вместе с веной. Тромбы инфранеченочного сегмента НПВ удаляются через венотомию. При наличии большого тромба и инфильтрации стенки НПВ выполнение радикального удаления невозможно, в послеоперационном периоде эта область должна быть включена в иоле облучения [42,46].
• Рекомендована биопсия лимфатических узлов с последующим патолого-анатомическим исследованием для корректного стадирования и назначения адекватной последующей терапии [42,44,45,48].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 4).
Комментарии: лимфатические узлы ворот ночки, почечной артерии у места ее отхождения от аорты (регионарные узлы), верхние и нижние иарааортальные (экстрарегионарные) должны быть направлены на патолого-анатомическое исследование даже если выглядят неизмененными. Лимфатические узлы должны быть удалены без нарушения их целостности. Каждый удаленный лимфоузел должен быть маркирован с описанием точного расположения и послан врачу-патологоанатому отдельно. На исследование должно быть взято не менее 7 лимфатических узлов.
• Лапароскопическая туморнефруретерэктомия рекомендована при соблюдении следующих критериев [42,47,49-51]:
• объемные образования в почке, размерами не превышающие объем здоровой почки, без видимых на МРТ/КТ увеличенных контралатеральных лимфоузлов;
• резекция должна быть проведена в соответствии с онкологическими принципами и включать биопсию лимфатических узлов;
• наличие центрально расположенных опухолей с четкой границей с «нормальной» тканью почки, окружающей опухоль;
• извлечение опухоли должно быть произведено посредством мешка без повреждения капсулы опухоли через адекватное отверстие в брюшной стенке не только для профилактики диссеминации опухоли, но и для обеспечения адекватного стадирования;
• если возможно проведение органосохраняющей операции - необходимо ее проведение путем лапаротомии.
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Комментарии: Малоинвазивные и органосохраняющие операции должны проводиться в федеральных центрах, имеющих опыт проведения подобных операций [42,52,53]!
Во всех возможных случаях проведения лапароскопической радикальной нефрэктомии необходимо получение мнения специалиста референсного хирургического центра, так же подтверждающего необходимость направления пациента для проведения лапароскопической операции в центр, сотрудники которого имеют соответствующий опыт.
Противопоказания к проведению лапароскопической нефрэктомии:
• Опухоль, инфильтрирующая экстраренальные структуры или распространяющаяся за ипсилатеральную границу позвоночного столба;
• Тромб в почечной или полой вене;
• Расположение опухоли на периферии почки, при которой невозможно проведение органосохраняющей операции;
• Опухоль, не отвечающая на химиотерапию, ввиду риска разрыва капсулы опухоли;
• Отсутствие достаточного опыта проведения лапароскопической нефрэктомии.
• Проведение органосохраняющего хирургического вмешательства рекомендовано при унилатеральной нефробластоме, без генетической предрасположенности, при соблюдении следующих критериев [42,47,52,53]:
• Опухоль, ограниченная одним полюсом почки или расположенная на периферии почки;
• Объем опухоли менее 300 мл на момент постановки диагноза (риск наличия метастатического поражения регионарных лимфоузлов около 2%);
• Отсутствие данных за инициальный разрыв капсулы опухоли;
• Отсутствие вовлечения в процесс лоханки;
• Отсутствие инвазии в окружающие органы;
• Отсутствие тромба в почечной или полой венах;
• Отсутствие мультифокального характера опухоли;
• Органосохраняющая операция возможна только с соблюдением онкологических правил безопасного отступа от края опухоли;
• Ожидается, что остаточная паренхима почки будет достаточной для адекватного функционирования;
• Необходимо сохранить не менее 66% почечной паренхимы после резекции опухоли для исключения гиперперфузии. Для определения функционального резерва почки необходимо проведение предоперационного радиоизотопного исследования.
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Комментарии: Резекция почки возможна и при унилатеральном поражении почки, однако необходимо четко оценивать преимущества данного хирургического метода (процент оставшейся паренхимы почки, риск возникновения локального рецидива).
Преимущества от проведения органосохраняющих операций могут быть получены при наличии урологических и нефрологических нарушений в контралатеральной почке, а также при наличии генетических синдромов, ассоциированных с риском развития НБ (что повышает риск возможной операции на контрлатеральной почке в случае развития метахронной опухоли).
Энуклеация (резекция опухоли без неизмененной почечной паренхимы) не является надлежащей локальной терапией. В случае неполной резекции с микроскопической остаточной опухолью проведение дальнейшей локальной терапии зависит от ряда факторов и должно быть вынесено на обсуждение с многопрофильной группой специалистов. Однако, полная нефрэктомия при неблагоприятных подтипах ренальных опухолей представляется необходимой.
Положительные ЛУ при патологическом исследовании после проведения органосохраняющих операций указывают на необходимость проведения лучевой терапии, но не обязательно нефрэктомии.
После резекции почки следует осуществлять тщательный последующий мониторинг функционального состояния (краткосрочный и долгосрочный): допплерография почечных сосудов через 2 дня после операции. Спустя 6 месяцев следует оценить функциональный резерв сохраненной почечной ткани по реносцинтиграфии. Необходимо проводить оценку клиренса креатинина, исключение ренальной гипертензии, признаков почечной недостаточности. Эта информация важна для определения наличия или отсутствия потенциальных прешгуществ органосохраняющей операции для функции почек в отсроченном периоде.
Нефробластоматоз в почечной паренхиме в препарате, полученном при органосохраняющей операции, может способствовать развитию метахронной нефробластомы в оставшейся почке. Следует осуществлять тщательное наблюдение за этими пациентами.
• Метастазэктомию рекомендуется проводить после нефрэктомии и после 1-2 курсов послеоперационной ПХТ [42,49].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• При метастазировании опухоли в легкие при наличии возможности рекомендуется хирургическое удаление метастазов. [42,49].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Комментарии: торакоскопия может быть применима только при субплевральном расположении метастазов. Предпочтение отдается торакотомии. Предпочтительно -клиновидная резекция с достижением «чистых» краев резекции. Если путем клиновидной резекции не достичь радикального удаления, возможно проведение сегмент- или лобэктомии. Пульмонэктомия не оправдана.
Метастазы в печень
• Для изолированных метастазов в печень рекомендуется проведение клиновидной резекции. Не рекомендуется проведение обширных и потенциально калечащих резекций до изучения вопроса о возможности проведения дальнейшей химиотерапии [42,49].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Комментарии: метастазы в других местах должны быть радикально удалены без калечащих операций.
3.3 Послеоперационная терапия
Послеоперационное лечение зависит от стадии процесса, гистологического тина и объема опухоли после неоадъювантной химиотерапии и основана на рекомендациях SIOP [41].
Послеоперационную XT целесообразно начать в течение 2-х недель после оперативного лечения. Объем послеоперационной терапии при локализованной форме заболевания - см. табл. 2.
Таблица 2. Объем послеоперационной терапии при локализованной форме заболевания
• - кроме стромального и эпителиального подтипов (лечение не зависит от размера опухоли:
AV1 - при стадии I uAV2 при стадии II).
Большая часть пациентов П/Ш стадии, группы низкого и промежуточного риска получает терапию по схеме AV-2, у пациентов, имеющих гистологический тип опухоли фокальная анаплазия, смешанный пли регрессивный, и объем опухоли после завершения неоадъювантной химиотерапии > 500 мл, в режим AV-2 добавляют доксорубицин** (лечение по режиму AVD, как для опухолей стадии I высокого риска).
Максимальная разовая доза винкристина** 2 мг. Первое введение винкристина** - после восстановления перистальтики кишечника в послеоперационном периоде, в срок до 21 дня от последнего введения неоадъювантной химиотерапии. Дактиномицин не применяется у детей весом менее 5 кг.
Послеоперационная химиотерапия проводится в зависимости от гистологического типа опухоли и ответа первичного очага и метастазов на предоперационное лечение - см. табл. 3
Таблица 3. Оценка метастазов перед проведением операции
* В случае с целевыми поражениями размером 3-5 мм, единственными вариантами ответа являются полный ответ (ПО) и неполный ответ (не-ПО).
Сокращения: ПО - полный ответ, 40 - частичный ответ, ОХЧО - очень хороший частичный
ответ, ПРЗ - прогрессирование заболевания, СБЗ - стабилизация заболевания.
Послеоперационная химиотерапия при размерах легочных очагов менее 3мм:
• Пациентам с генерализованной НБ с исходными легочными очагами менее 3 мм в случае исчезновения очагов (на КТ) после предоперационной XT лечение рекомендовано проводить в соответствии с локальной сталией и гистологическим подтипом [41].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• Пациентам с генерализованной НБ с исходными легочными очагами менее 3 мм в случае сохранения очагов в легких рекомендовано их полное хирургическое удаление (если возможно), или хотя бы резекция наиболее крупного очага для последующего патологоанатомического исследования и принятие решения о дальнейшей тактике лечения (схемы терапии - см. приложение А3.1) [41]:
• если при патолого-анатомическом исследовании удаленных метастазов не выявляется живой опухолевой ткани или тотального некроза - проводится лечение в соответствии с локальной сталией и гистологическим полтипом:
• если по гистологии сохраняется витальная опухоль или отмечается тотальный некроз -лечение по программе АУР 250 (см. приложение А3.1). При сохранении микрометастазов на 10 неделе послеоперационного лечения - показано тотальное облучение обоих легких;
• при выявлении диффузной анаплазии - показано тотальное облучение легких в случае, если метастазы гистологически подтверждены;
• если биопсия невозможна - продолжение химиотерапии в соответствии с гистологическим подтипом Скак минимум. AV21. независимо от стадии. Оценка динамики очагов в легких на 10 неделе послеоперационной терапии.
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• Пациентам с генерализованной НБ с исходными легочными очагами менее 3 мм в случае увеличения размеров метастазов по КТ, рекомендована резекция хотя бы одного узла для последующего патолого-анатомического исследования операционного материала и принятие решения о дальнейшей тактике лечения (схемы терапии - см. приложение А3.1) [41]:
• Если при гистологическом исследовании удаленных метастазов не выявляется живой опухолевой ткани или тотального некроза - проводится лечение в соответствии с локальной стадией и гистологическим подтипом (минимум AV21:
• Если по гистологии сохраняется витальная опухоль или выявляется тотальный некроз -лечение по программе АУР. При сохранении микрометастазов на 10 неделе послеоперационного лечения - показано тотальное облучение обоих легких;
• При выявлении диффузной анаплазии - показано тотальное облучение легких в случае, если метастазы гистологически подтверждены;
• Если биопсия невозможна - продолжение химиотерапии в соответствии с гистологическим подтипом Сне менее АУР1), независимо от стадии. Контрольное обследование на 10 неделе.
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Послеоперационная химиотерапия при наличии легочных очагов более 5мм:
• Пациентам с генерализованной НБ с исходными легочными метастазами более 3 мм группы А (метастазы (очаги) отсутствуют или полностью удалены) с гистологическими подтипами низкого и промежуточного риска рекомендованы следующие терапевтических подходы, в засисимости от размеров метастазов и гистологического подтипа опухоли (схемы терапии - см. приложение АЗ. 1) [41]:
• А1. Легочные узлы более 3 мм, но менее 5 мм в момент диагностики с гистологией низкого или промежуточного риска: лечение режимом АУР 130. Если при гистологическом исследовании выявляется живая опухолевая ткань - показано тотальное облучение легких;
• А2. Легочные узлы более 5 мм в момент диагностики и с гистологией низкого или промежуточного риска: лечение режимом АУР 230. Если при гистологическом исследовании выявляется живая опухолевая ткань - показано облучение легких;
• АЗ. Полное хирургическое удаление узлов и не получено гистологического подтверждения о наличии метастазов (не выявлена витальная опухоль или тотальный некроз) - лечение по локальной стадии и в соответствии с гистологическим подтипом.
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• Пациентам с генерализованной НБ с исходными легочными метастазами более 3 мм группы В (локальной стадии I/ II/ III с гистологией низкого риска с множественными нерезектабельными очагами или неполностью удаленными хирургически очагами) рекомендованы следующие терапевтических подходы, в зависимости от результатов оперативного вмешательства и патолого-анатомического исследования (схемы терапии -см. приложение А3.1) [41]:
• Если гистологически не доказано наличие метастазов (исключены витальные метастазы и тотальный некроз) - лечение по локальной стадии:
• Если гистологически нет живой опухолевой ткани, но выявлен тотальный некроз -лечение по режиму АУР 150. 27 недель химиотерапии: винкристин• ** 1,5 мг/м2/сут, в/в болюсно - 1, 2, 3, 4, 5, 6, 7, 8, 11, 12, 14, 15, 17, 18, 20, 21, 23, 24, 26, 27 недели; #дактиномицин** 45 мкг/кг/сут, в/в болюсно - 2, 5, 8, 11, 14, 17, 20, 23, 26 недели; доксорубицин** 50 мг/м2/сут, в/в капельно 2-6 часовая инфузия - 2 неделя. Оценка динамики по данным КТ OFK проводится на 10 неделе. В случае сохранения очагов -рекомендуется полное хирургическое удаление. Тотальное облучение легких не проводится:
• Если гистологически выявляется живая опухолевая ткань - лечение по режиму АУР 250. 27 недель химиотерапии: винкристин** 1,5 мг/м2/сут, в/в болюсно -1, 2, 3,4, 5, 6, 7, 8,11, 12,14, 15,17,18, 20, 21, 23, 24, 26, 27 недели; #дактиномицин** 45 мкг/кг/сут, в/в болюсно -2, 5, 8, 11, 14, 17, 20, 23, 26 недели; доксорубицин** 50 мг/м2/сут, в/в капельно 2-6 часовая инфузия - 2, 8,14 недели, с облучением легких;
• Если легочные очаги не могут быть резецированы - лечение по режиму АУР 250. Если при обследовании на 10 неделе послеоперационной XT легочные очаги все еще определяются - повторная биопсия. Дополнительно - облучение легких, поскольку легочные узлы могут быть с гистологией не низкого риска.
Уровень убедительности рекомендаций - С (уровень достоверности доказательств -5).
Комментарий: при необходимости облучения ложа опухоли и легких целесообразно проводить лучевую терапию одновременно для предотвращения перекрытия полей облучения. В связи с этим лучевая терапия может быть отложена до 10 недели.
• Пациентам с генерализованной НБ с исходными легочными метастазами более 3 мм
группы С (локальной стадии I/ II/ III с гистологией промежуточного риска с множественными нерезектабельными очагами или неполностью удаленнымихирургически очагами) рекомендованы следующие терапевтических подходы, в зависимости от результатов оперативного вмешательства и патолого-анатомического исследования (схемы терапии - см. приложение А3.1) [41]:
• Если гистологически не доказано наличие метастазов (отсутствуют витальные метастазы или тотальный некроз) - лечение в соответствии с локальной сталией, но, если множественные узлы в легких исчезли после предоперационной химиотерапии AVD, а оставшиеся узлы признаны незлокачественными - продолжение терапии по режиму АУР 250:
• Если гистологически не найдено живой опухолевой ткани, но присутствует тотальный некроз - лечение по режиму АУР 250 в течение 27 недель. Если на 10 неделе послеоперационной XT легочные узлы персистируют - повторная резекция или облучение легких. При выявлении жизнеспособной опухолевой ткани - облучение легких;
• Если гистологически в удаленных узлах выявляется живая опухолевая ткань - переход на лечение по HR2. 54 недели химиотерапии: 1 курс - циклофосфамид** + доксорубицин** (всего 4 курса): циклофосфамид** 450 мг/м2/сут в/в капельно за 1 час - 1, 2, 3 дни, в недели 1, 7, 19, 31; доксорубицин** 50 мг/м2/сут в/в капельно за 2-6 часов - 1 день, в недели 1, 7, 19, 31; 2 курс - #этопозид** + #карбоплатин** (всего 8 курсов): #этопозид** 150 мг/м2/сут в/в капельно за 1 час - 1, 2, 3 дни, в недели 4, 10, 13, 16, 22, 25, 28, 34; #карбоплатин** 200 мг/м2/сут в/в капельно за 1 час - 1, 2, 3 дни, в недели 4,10,13,16, 22, 25, 28, 34, с тотальным облучением легких, независимо от состояния легких на 10 неделе лечения;
• Если легочные узлы не могут быть резецированы - проведение терапии по HR2 и облучение легких, при сохранении очагов на 10 неделе;
• Если метастатические очаги в других кроме легких и печени местах не могут быть радикально удалены, они должны подвергнуться облучению, независимо от ответа на химиотерапию;
Уровень убедительности рекомендаций - С (уровень достоверности доказательств -5).
Комментарии: Пациенты с локальной стадией III получают лучевую терапию на соответствующую половину брюшной полости. Лучевая терапия может быть отложена до 10 недели (оценка персистирующих очагов) для комбинации с тотальным облучение легких, если это необходимо (для избежания наложения нолей облучения).
• Пациентам с генерализованной НБ с исходными легочными метастазами более 3 мм группы D (с гистологией высокого риска независимо от степени распространения) рекомендована консультация с экспертами федерального профильного центра для индивидуального подбора терапии пациента [41].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств -5).
• Пациентам с НБ низкого гистологического риска, которым по тем или иным причинам было выполнено первичное оперативное вмешательство без предоперационной химиотерапии, не рекомендовано проведение послеоперационной химиотерапии [55-59].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств -5).
Комментарии: в случае стадии III необходима консультация федерального/национального центра для получения дальнейших рекомендаций.
• Пациентам с НБ промежуточного гистологического риска (за исключением фокальной анаплазии), стадия I, которым по тем или иным причинам было выполнено первичное оперативное вмешательство без предоперационной химиотерапии, рекомендовано проведение послеоперационной химиотерапии по схеме Режим 1 (интенсивный VCR): винкристин** 1,5 мг/м2/сут, в/в болюсно - в 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 недели (всего 10 доз) - см. приложение А3.1 [55-59].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств -5).
Комментарии: Максимальная разовая доза винкристина** 2 мг. Первое введение винкристина** - после восстановления перистальтики кишечника в послеоперационном периоде, в срок до 14 дней от оперативного вмешательства.
Младенцам и детям весом < 12 кг следует вводить полную дозу винкристина** если используется только один этот препарат и
не наблюдается признаков токсичности. В случае токсических явлений последующая доза должна быть уменьшена на 50%, после чего дозы можно осторожно увеличивать (при хорошей переносимости).• Пациентам с НБ промежуточного гистологического риска (фокальная анаплазия), стадия I и промежуточного гистологического риска стадия II, которым по тем или иным причинам было выполнено первичное оперативное вмешательство без предоперационной химиотерапии, рекомендовано проведение послеоперационной химиотерапии по схеме Режим 2 (AV): винкристин** 1,5 мг/м2/сут, в/в болюсно - в 1, 2, 3,4, 5, 6, 7, 8, 9, 10, 11, далее 14, 17, 20, 23 и 26 недели (всего 16 доз); #дакгиномицин** 45 мкг/ кг/сут, в/в в 2, 5, 8,11,14,17, 20, 23 и 26 недели (всего 9 доз) - см. приложение А3.1 [60].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств -5).
Комментарии: Максимальная разовая доза винкристина** 2 мг. Первое введение винкристина** - после восстановления перистальтики кишечника в послеоперационном периоде, в срок до 14 дней от оперативного вмешательства.
Младенцы и дети весом < 12 кг получают терапию в возрастных дозировках (см. приложение А3.2).
• Пациентам с НБ промежуточного гистологического риска стадия III, которым по тем или иным причинам было выполнено первичное оперативное вмешательство без предоперационной химиотерапии, рекомендовано проведение послеоперационной химиотерапии по схеме Режим 3 (AVD): винкристин** 1,5 мг/м2/сут, в/в болюсно - в 1, 2, 3, 4, 5, 6, 7, 8, 9,10, далее 13,16,19, 22, 25 и 28 недель (всего 16 доз); #дактиномицин** 45 мкг/ кг/сут, в/в болюсно - 2/3 дозы на неделе 2, затем полная доза на неделях 10, 16, 22, 28 (всего 5 доз); доксорубицин** 50 мг/м2/сут, в/в капельно 4-6 часовая инфузия - на 7,13,19, 25 неделе) - см. приложение А3.1 [60].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств -5).
Комментарии: Максимальная разовая доза винкристина** 2 мг. Первое введение винкристина** - после восстановления перистальтики кишечника в послеоперационном периоде, в срок до 14 дней от оперативного вмешательства.
Младенцы и дети весом < 12 кг получают терапию в возрастных дозировках (см. приложение А3.2).
• Пациентам с НБ стадии IV, которым по тем или иным причинам было выполнено первичное оперативное вмешательство без предоперационной химиотерапии, рекомендовано проведение терапии по следующей схеме [60]:
о послеоперационная химиотерапия согласно "предоперационной" химиотерапии, схема AVD 6 недель - см. приложение А3.1;
о оценка ответа со стороны метастазов на неделе 6 с помощью КТ органов грудной клетки;
о последующая химиотерапия в зависимости от того, была ли достигнута полная ремиссия со стороны метастазов с помощью химиотерапии +/- хирургического вмешательства, в соответствии с основными рекомендациями по адъювантной терапии для генерализованной НБ, см. приложение АЗ.З.
Уровень убедительности рекомендаций - С (уровень достоверности доказательств -5).
Комментарии: Опухоли с преобладанием бластемного компонента после первичной хирургической операции относятся к группе промежуточного риска.
• Пациентам с НБ I-IV стадии с гистологическим типом «диффузная анаплазия», группы высокого риска, независимо от локальной стадии процесса рекомендовано проведение послеоперационной химиотерапии в соответствии с рекомендациями по адъювантной терапии для высокой группы риска (для пациентов с локализованной стадией - режим HR-1 - 34 недели химиотерапии, для пациентов с генерализованной стадией - режим HR-2 - 34 недели химиотерапии) - см. приложение А3.1 [60].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств -5).
Комментарии: лучевая терапия брюшной полости назначается пациентам с локальными абдоминальными стадиями II и III. Лучевая терапия легких проводится всем пациентам с опухолями TV стадии с легочными метастазами, независимо от ответа метастазов на химиотератио/хирургическое вмешательство.
3.4 Лучевая терапия
При локализованной НБ, стадии II (диффузная анаплазия) и III (промежуточная и высокая группы гистологического риска) стадии, после органосохраняющих оперативных вмешательств, целесообразна консультация в специализированном федеральном/ национальном медицинском центре для определения показаний и объема лучевой терапии.
Суммарные рекомендации по лучевой терапии брюшной полости представлены в таблице 4.
Таблица 4. Суммарные рекомендации по лучевой терапии брюшной полости
• Локальное послеоперационное облучение или облучение половины брюшной полости (фланк) рекомендовано проводить через 2-4 недели после операции следующим группам пациентов с локализованной формой НБ [41]:
• НБ промежуточного гистологического риска, стадия III (пораженные парааортальные лимфатические узлы, наличие остаточной опухоли после операции, разрывы опухоли): локальное облучение в СОД 14.4 Гр на половину брюшной полости, буст на макроскопическую резидуальную опухоль 10,8 Гр;
• НБ высокого гистологического риска (кроме бластемного типа), стадия II: локальное облучение в СОД 25,2 Гр на половину брюшной полости, буст на макроскопически остаточную опухоль 10,8 Гр;
• НБ высокого гистологического риска, стадия III (все гистологические подтипы): локальное облучение в СОД 25,2 Гр на половину брюшной полости, буст на макроскопически остаточную опухоль 10,8 Гр.
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Комментарии: при планируемой ЛТ на легкие, облучение живота можно отложить, чтобы
проводить ЛТ на живот и легкие одним полем.
• У пациентов с двухсторонней НБ рекоменовано проведение лучевой терапии в соответствии с локальной стадией [41]
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5)
• Не рекомендовано проведение облучения парааортальных лимфоузлов у пациентов без макроскопически значимых увеличенных лимфоузлов [41].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• Послеоперационное облучение всей брюшной полости рекомендовано проводить через 2-4 недели после операции следующим группам пациентов с локализованной формой НБ [41]:
• диффузное интраабдоминальное распространение (стадия III ввиду макроскопических метастазов по брюшине): облучение всей брюшной полости в СОД 19,5 Гр, на ограниченные зоны макроскопического метастазирования возможен буст до СОД 25 Гр (гистологическая промежуточная группа риска) или 30,6 Гр (гистологическая высокая группа риска);
• массивный пре- или интраоперационный разрыв опухоли (стадия III ввиду разрыва опухоли): облучение всей брюшной полости в дозе 15 Гр (гистологическая промежуточная группа риска) или 19.5 Гр (гистологическая высокая группа риска);
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Комментарии: у детей до 2-х лет предусмотрена редукция дозы до 12 Гр.
• Пациентам с локализованной НБ, стадии II (диффузная анаплазия) и III (промежуточная и высокая группы гистологического риска) стадии после органосохраняющих оперативных вмешательств рекомендовано обращение в федеральные/национальные центры для определения показаний и объема лучевой терапии [41].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
При наличии НБ низкой группы гистологического риска, а также в случае, если пациент меньше 2 лет с метастазами в легкие или метастазы НБ представлены жизнеспособной опухолевой тканью (после XT и операции), при генерализованной форме НБ, стадии II (диффузная анаплазия) и III (промежуточная и высокая группы гистологического риска) стадии, после органосохраняющих оперативных вмешательств, целесообразна консультация в специализированном федеральном/национальном медицинском центре для определения показаний и объема лучевой терапии.
Суммарные рекомендации по лучевой терапии метастазов представлены в таблице 5.
Таблица 5. Суммарные рекомендации по лучевой терапии метастазов
Во время лучевой терапии и первом после ЛТ курсе химиотерапии дозы цитостатиков должны быть редуцированы до 2/3
• У пациентов с генерализованной формой НБ рекомендовано проводить облучение легких в следующих случаях [41]:
• отсутствие полной санации метастазов в легких по результатам КТ грудной клетки на 10 неделе послеоперационной терапии;
• если метастазы НБ представлены жизнеспособной опухолевой тканью (после XT и операции) гистологической промежуточной группы риска, показано проведение ЛТ в объеме тотального облучения легких в СОД 12 Гр;
• все случаи НБ с первичными метастазами в легких, вне зависимости от ответа на химиотерапию или хирургическое лечение, гистологической высокой группы риска, должны получать ЛТ в объеме тотального облучения легких, СОД 15 Гр;
• в случае необходимости проведения облучения брюшной полости и легких, рекомендуется проводить облучение грудной клетки и брюшной полости одновременно в рамках одной процедуры планирования (с одного поля) во избежание возникновения перерыва в лечении или наложения обоих полей;
• в случае стадии III (макроскопически остаточная опухоль), с высокой вероятностью локального рецидива, как случаи с гистологическим вариантом диффузной анаплазии, облучение брюшной полости может проводиться после операции, а облучение легких -позднее, с отдельного поля.
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• Всем пациентам после инициальной нефрэктомии с гистологическим типом опухоли «диффузная анаплазия», при наличии метастатитического поражения легких рекомендовано выполнение лучевой терапии легких независимо от ответа метастазов на химиотерапию/хирургическое вмешательство [41].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• Облучение печени у пациентов с генерализованной формой НБ рекомендовано в следующих случаях [41]:
• Наличие метастазов в печени, которые сохранились после XT и которые не могут быть радикально удалены;
• Для пациентов с НБ гистологической группой промежуточного риска в СОД 14,4 Гр на всю печень и буст на остаточные метастазы до 25,2 Гр;
• Для пациентов с НБ гистологической группой высокого риска в СОД 19,8 Гр на всю печень и буст на остаточные метастазы до 30,6 Гр.
Комментарии: СОД на область всей печени не должна превышать 20 Гр.
• У пациентов с генерализованной формой НБ при наличии отдаленного гематогенного метастазирования в другие органы, кроме печени и легких, рекомендовано проведение лучевой терапии в следующих случаях [41]:
о метастазирование в головной мозг, вне зависимости от ответа на химиотерапию в СОД при тотальном облучении головного мозга 15.0 Гр для НБ гистологической группы промежуточного риска с бустом до 25.2 Гр и в СОД при тотальном облучении головного мозга 25,2 Гр для НБ гистологической группы высокого риска с бустом до 30,6 Гр;
о Метастазирование в кости, вне зависимости от ответа на химиотерапию. Доза облучения костных метастазов составляет 30 или 30.6 Гр.
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Комментарии: учитывая редкость наличия гематогенного метастазирования вне печени и
головного мозга, ситуация требует обсуждения с федеральным/национальным центром.
3.5 Тактика ведения пациентов с двусторонними опухолями (стадия V), а также с односторонней нефробластомой с генетической предрасположенностью к двусторонней локализации
Тактика терапии двухсторонней нефробластомы базируется на 3 пунктах:
1. Предоперационная XT для уменьшения опухолевого объема насколько это возможно;
2. Органосохраняющая операция, насколько возможно;
3. Послеоперационная XT - но наивысшей стадии и наихудшей гистологии [41].
• Пациентам с билатеральной нефробластомой рекоменлована следующая тактика лечения [41,61-64]:
• длительность предоперационной XT должна составлять не более 12 недель;
• первоначальное лечение: неоадъювантная терапия в режиме VA, 6 недель - винкристин** 1,5 мг/м2/сут, в/в болюсно - 1, 2, 3, 4, 5, 6 недели; #дактиномицин** 45 мкг/кг/сут, в/в болюсно -1, 3, 5 недели (см. приложение А3.1);
• первая оценка ответа с использованием МРТ (КТ) ОБП с к/у;
• если возможно по результатам оценки ответа - оперативное лечение (органосохраняющая операция) хотя бы на одной почке;
• при частичной ремиссии - продолжение XT по той же программе - 6 недель в режиме VA (см. приложение А3.1);
• при отсутствии ответа или прогрессировании, если органосохраняющая операция невозможна - рекомендовано изменить схему XT на режим Карбоплатин**/Этопозид**: этопозид** 150 мг/м2/сут в/в капельно за 1 час 1, 2, 3 дни, 1 и 4 недели; карбоплатин** 200 мг/м2/сут в/в капельно за 1 час 1, 2, 3 дни, 1 и 4 недели (см. приложение А3.1) - 2 цикла
• вторая оценка ответа: МРТ (КТ) ОБП с к/у после еще 6 недель VA или 2 циклов #карб оплатин* */этопозид* *;
• обсуждение возможности проведения 2 этапа операции;
• послеоперационное лечение - по наивысшей стадии и наихудшей гистологии (см. раздел 3.3. Послеоперационная терапия).
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Комментарии: у пациентов с генерализованным заболеванием, предоперационная терапия проходит но схеме AVD. (см. раздел 3.1. неоадъювантная химиотерапия для метастатической формы заболевания). Требуется консультация в федеральном/национальном центре для определения последующей тактики ведения пациента.
• Пациентам с односторонней нефробластомой и контрлатеральным нефробластоматозом рекомендована следующая тактика лечения [41,61-64]:
• Неоадъювантная терапия в режиме VA, 6 недель - винкристин** 1,5 мг/м2/сут, в/в болюсно - 1, 2, 3, 4, 5, 6 недели; #дактиномицин** 45 мкг/кг/сут, в/в болюсно - 1, 3, 5 недели; (см. приложение АЗ. 1);
• Первая оценка ответа: МРТ (КТ) ОБП с к/у после 6 недель XT;
• Если возможно - оперативное лечение (органосохраняющая операция) хотя бы на одной почке;
• При частичной ремиссии - продолжение XT по той же программе - 6 недель в режиме VA (см. приложение А3.1);
• При отсутствии ответа или прогрессировании, если органосохраняющая операция невозможна - рекомендовано изменить схему XT на режим #карбоплатин• **/этопозид**: этопозид** 150 мг/м2/сут в/в капельно за 1 час 1, 2, 3 дни, 1 и 4 недели; карбоплатин** 200 мг/м2/сут в/в капельно за 1 час 1, 2, 3 дни, 1 и 4 недели (см. приложение А3.1) - 2 цикла;
• Вторая оценка ответа: МРТ (КТ) ОБП с к/у после еще 6 недель VA или 2 циклов #Карбоплатин/Этопозид;
• Обсуждение возможности проведения 2 этапа операции;
• Послеоперационное лечение - по наивысшей стадии и наихудшей гистологии (см. Раздел 3.3. Послеоперационная терапия).
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• Пациентам с односторонним или двухсторонним нефробластоматозом рекомендована следующая тактика лечения [41,61-64]:
• Неоадъювантная терапия в режиме VA, 6 недель: - винкристин** 1,5 мг/м2/сут, в/в болюсно -1, 2, 3,4, 5, 6 недели; #дактиномицин** 45 мкг/кг/сут, в/в болюсно -1, 3, 5 недели (см. приложение А3.1);
• Первая оценка ответа: МРТ (КТ) ОБП с к/у после 6 недель VA;
• Дальнейшая терапия зависит от ответа на индукционную химиотерапию и подробно представлена на схеме алгоритма терапии пациентов с односторонним или двухсторонним нефробластоматозом, см. приложение Б5.
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Комментарии: у пациентов с односторонней нефробластолюй и контрлатеральным нефробластоматозом с IV стадией процесса, предоперационная терапия проходит по схеме AVD (см. раздел 3.1. неоадъювантная химиотерапия для метастатической формы заболевания). Требуется консультация в федеральном/национальном центре для определения последующей тактики ведения пациента.
• Пациентам с односторонней нефробластомой и синдромом предрасположенности к развитию опухоли рекомендована следующая тактика лечения [41,61-64]:
• Неоадъювантная терапия в режиме VA, 6 недель - винкристин** 1,5 мг/м2/сут, в/в болюсно - 1, 2, 3, 4, 5, 6 недели; #дактиномицин** 45 мкг/кг/сут, в/в болюсно - 1, 3, 5 недели (см. приложение АЗ. 1);
• Первая оценка ответа: МРТ (КТ) ОБП с к/у после 6 недель XT;
• Если возможно - оперативное лечение (органосохраняющая операция) хотя бы на одной почке;
• При частичной ремиссии - продолжение XT по той же программе - 6 недель в режиме VA (см. приложение А3.1);
• При отсутствии ответа или прогрессировании, если органосохраняющая операция невозможна - рекомендовано изменить схему XT на режим #Карбоплатин**/Этопозид** -этопозид** 150 мг/м2/сут в/в капельно за 1 час 1, 2, 3 дни, 1 и 4 недели; карбоплатин** 200 мг/м2/сут в/в капельно за 1 час 1, 2, 3 дни, 1 и 4 недели (см. приложение А3.1) - 2 цикла;
• Вторая оценка ответа: МРТ (КТ) ОБП с к/у после 6 еще недель VA или 2 циклов #Карбоплатин/Этопозид;
• Обсуждение возможности проведения 2 этапа операции;
• Послеоперационное лечение - согласно локальной стадии и группы риска (см. Раздел 3.3. Послеоперационная терапия).
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Комментарии: эти пациенты относятся к группе высокого риска развития метахронной двусторонней опухоли, и им должна помочь стратегия лечения, подразумевающая проведение по возможности нефронсохраняющей операции. Поэтому к ним применимы варианты лечения, предусмотренные для двустороннего заболевания.
Лечение таких пациентов требует индивидуального подхода. Хирургическое лечение должно проводиться опытной хирургической командой после консультации в федеральном/ национальном центре [61-64].
• При билатеральной нефробластоме рекомендовано проведение органосохраняющей операции после ответа опухолей на химиотерапию: при уменьшении размеров или
визуализирующих признаках наличия некроза в опухолях [61-64];Комментарии: хирургическое лечение должно проводиться в отделениях, имеющих опыт органосохраняющих операций. Цель лечения - максимальное сохранение функционирующей почечной иаренхимы. Первый оперативный этап проводится на наименее пораженной ночке, второй оперативный этап - на наиболее пораженной ночке. Допускается проведение полной нефрэктомии на одной стороне и резекция ночки - на другой, при условии, что будет сохранен достаточный объем функциональной почечной ткани. При необходимости можно проводить несколько операций с целью достижения полной резекции.
Рекомендации но дозам и области облучения аналогичны рекомендациям для одностороннего заболевания. По показаниям лучевая терапия может быть начата одновременно с началом адъювантной терапии (см. раздел 3.4 Лучевая терапия) [41].
3.6 Нутритивный скрининг и мониторинг
• Всем пациентам, получающим лечение в стационаре по поводу нейробластомы, при поступлении в стационар и далее от 1 до 4 раз в месяц рекомендуется проводить нутритивный скрининг с целью выявления белково-энергетической недостаточности либо риска ее развития [31,32].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 4)
Комментарии: критерии белково-энергетической недостаточности и факторы
нутритивного риска - см. приложение Г2. Первичный скрининг проводится либо с помощью оценки антропометрических показателей и выявления риска, либо с использованием стандартных шкал/утилит для проведения нутритивного скрининга [33,34]. Основными антропометрическими параметрами для оценки нутритивного статуса являются: масса тела, рост, индекс массы тела, окружность плеча (ОП), толщина кожно-жировой складки над трицепсом (КЖСТ), окружность мышц плеча (ОМП) [35,36].
Нутритивный скрининг заключается в первичной и затем регулярной оценке нутритивного статуса и риска развития белково-энергетической недостаточности, в том числе скрытой, у каждого пациента, с момента поступления в стационар. Частота проведения нутритивного скрининга может варьировать от 1 до 4 раз в месяц и должна определяться конкретной клинической ситуацией и особенностями проводимого лечения [37,38].
• Пациентам с нейробластомой с выявленными нутритивными нарушениями при поверхностном скрининге с помощью специальных шкал, либо в результате антропометрии рекомендуется более детальное обследование нутритивного статуса: анализ питания, оценка тканевого состава тела, оценка лабораторных показателей, а также детальный физикальный осмотр на предмет выявления нутритивнометаболических нарушений и их предикторов [39].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5)
• Всем пациентам с белково-энергетической недостаточностью или высоким риском ее развития (независимо от нутритивного статуса) рекомендуется проведение нутритивной поддержки (НП) [31,40].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5)
Комментарии: первой формой НП должно являться диетологическое консультирование с последующей коррекцией основного рациона и возможным назначением дополнительно лечебных питательных смесей.
Расчет тотального расхода энергии (ТРЭ) проводится по формуле: ТРЭ = ЭОО * КК, где ЭОО -энергия основного обмена, КК - конверсионный коэффициент. Золотым стандартом для определения ЭОО является непрямая калориметрия. При невозможности проведения непрямой калориметрии, ЭОО возможно вычислять по формуле (например, Schofield) [65]. Во избежание гипералиментации на начальных этапах нутритивной поддержки детям с хронической белково-энергетической недостаточностью и/или с предполагаемым дефицитом поступления нутриентов 3 и более месяцев подряд в анамнезе для вычисления ТРЭ используется КК=0,85-1,4. Точный объем нутритивного вмешательства определяется в зависимости от конкретной клинической ситуации.
При выборе формы, метода, вида и объема НП необходимо руководствоваться, в первую очередь, принципом индивидуального подхода - сообразно клинической ситуации и логике.
Энтеральное питание (ЭП) является приоритетным при выборе метода нутритивной поддержки [40]: оно является наиболее физиологичным, обеспечивая внутрипросветную трофику слизистой оболочки ЖКТ, иренятсвует микробной транслокации из просвета кишечника в кровь, является экономически более выгодным, чем парентеральное питание.
Выбор метода ЭП определяется сохранностью глотательной функции, а также функциональным состоянием ЖКТ: отсутствие аппетита, нежелание принимать пищу и смеси для ЭП, нарушение глотательной функции, невозможность перорального восполнения потребности в нутриентах и энергии - показания для проведения ЭП через назогастралъный питательный зонд. Наличие патологических состояний, при которых пациент не должен принимать пищу естественным путем (острый панкреатит, стеноз выходного отдела желудка, высокие проксимальные свищи) - в этих случаях показана реализация ЭП через назоеюналъный зонд. Выбор режима введения энтерального питания определяется конкретной клинической ситуацией, состоянием гастроинтестинального тракта: в зависимости от клинического состояния используется болюсный или капельный (непрерывное или сеансовое введение) режим введения питательной смеси.
Начинать энтеральное питание истощенным пациентам рекомендуется с изокалорической полимерной смеси с последующим переходом на гииеркалорийную (иод контролем переносимости). При наличии явлений мальабсорбции следует рассмотреть вопрос о назначении полу элементной/олигомерной смеси.
При необходимости проведения зондового питания продолжительностью более 6 недель, а также при невозможности адекватной алиментации другими методами энтерального питания и при отсутствии противопоказаний для проведения ЭП и самой гастростомии показано выполнение гастростомии. В случае, когда на начальных этапах нутритивной поддержки выявляется необходимость длительного проведения энтерального питания и прогнозируется риск развития нутритивной недостаточности (в т.ч. при проведении химиолучевого лечения), либо при наличии у ребенка тяжелой хронической белковоэнергетической недостаточности с высоким риском ее усугубления в дальнейшем возможно превентивное наложение гастростомы, минуя этап зондового питания. Преимущественным и, желательно, единственным питательным субстратом, вводимым в гастростому должны являться специализированные питательные смеси.
• Всем пациентам, которым невозможно обеспечить расчетную нутритивную потребность энтеральным путем, рекомендуется назначение парентерального питания [66].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5)
Комментарии: ключевым (и единственным) показанием для назначения парентерального питания (ПП) является невозможность обеспечить расчетную нутритивную потребность пациента энтеральным путем - текущая или потенциально возможная в краткосрочной перспективе. Потребность в парентеральном введении аминокислот рассчитывается индивидуально и зависит от возраста пациента, клинического статуса, количества поступающего белка энтеральным путем (см. приложение Г2). Парентеральное поступление жиров должно быть ограничено до максимум 4 г/кг/сут у доношенных и недоношенных детей и 3 г/кг/сут у детей старшего возраста. Введение жиров нужно начинать с меньших доз, за 3-4 дня наращивая объем до расчетных значений, следя за переносимостью по лабораторным показателям [66]. В процессе ПП необходим постоянный мониторинг уровня триглицеридов в плазме крови и уменьшение введения липидов при необходимости. Отсутствуют точные данные о том, какой уровень триглицеридов у детей может приводить к неблагоприятным последствиям - предположительно, их максимальная концентрация не должна превышать 250 мг/дл (2,8 ммолъ/л) для новорожденных и 400 мг/дл (4,5 ммоль/л) для детей более старшего возраста [66]. Потребность в парентеральном введении глюкозы рассчитывается индивидуально и зависит от возраста пациента, клинического статуса, количества поступающих углеводов энтеральным путем. Введение глюкозы нужно начинать с меньших объемов, за 3-4 дня наращивая объем до расчетных значений - следя за уровнем гликемии.
• Всем пациентам, получающим НП, рекомендуется нутритивный мониторинг, который может включать антропометрию, анализ тканевого состава тела, лабораторные показатели (биохимическое исследование крови, копрологическое исследование) [31,40].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5)
4. Реабилитация
• Всем пациентам с НБ на всех этапах терапии заболевания, а также после завершения лекарственного лечения рекомендуется комплексная реабилитация, а также при необходимости сопроводительная терапия для улучшения результатов лечения и качества жизни пациента, в зависимости от коморбидной патологии и осложнений основной терапии [67].Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5)
Комментарии: специальных методов реабилитации при НБ не существует. Реабилитация пациентов должна носить комплексный характер, охватывая не только медицинские, но и социально-психологические аспекты адаптации пациента к нормальной жизни. Такая реабилитация требует, кроме медицинской помощи, обязательного участия психологов. Программы реабилитации разрабатываются индивидуально в зависимости от выявленных осложнений лекарственного лечения, сопутствующей патологии, социальных и психологических проблем. Реабилитация при возникновении осложнений заболевания и лечения проводится в рамках соответствующих нозологий. Врач - детский онколог по месту жительства руководствуется рекомендациями, которые даны специалистами учреждения, проводившего лечение.
5. Профилактика
Методов профилактики НБ в настоящее время не существует, поскольку большинство случаев развития имеет спорадический характер.• Пациентам у которых проводилось/проводится лечение по поводу НБ, рекомендуется проведение регулярных плановых скрининговых обследований из-за риска развития рецидива, вторых опухолей (см. таблицу 6) [41].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 4).
Комментарии:
Таблица 6. Лабораторная и инструментальная диагностика на этапе динамического наблюдения
Организация оказания медицинской помощи
Госпитализация в круглосуточный стационар по профилю «детская онкология/гематология» осуществляется по следующим показаниям:
• в случае подозрения на НБ (первичная диагностика);
• при установленном диагнозе НБ для проведения или продолжения оперативного лечения или этапной терапии;
• при установленном диагнозе НБ для проведения контрольного обследования для оценки статуса по основному заболеванию и оценке токсичности терапии
Требования к условиям пребывания пациента в стационаре и терапии:
• Желательно наличие в палатах воздухоочистителей или центральной вентиляции;
• Необходимо наличие в структуре ЛПУ, проводящего лечение пациентов со злокачественными опухолями, в том числе с НБ, отделения или палаты интенсивной терапии, оснащенного всеми необходимыми препаратами и оборудованием для ведения больного с тяжелой дыхательной и сердечно-сосудистой недостаточностью, септическим и др. видами шока, геморрагическим синдромом, почечной недостаточностью и др. Необходимо иметь возможность проведения экстракорпоральной детоксикации (гемодиализ), аппаратной ИВЛ;
Требования к наличию специалистов и лечебно-диагностических площадок смежных специальностей:
• В случае отсутствие вышеперечисленных условий или невозможности проведения ряда лечебных процедур, пациенты должны быть направлены в профильные медицинские учреждения более высокого уровня (федеральные, национальные центры);
Показанием для выписки пациента из стационара является завершение всей проводимой терапии или одного из этапов лечения при удовлетворительном соматическом статусе.
Пациент передается педиатру (если есть должность - гематологу/онкологу) по месту жительства после завершения этапа или всего протокола лечения. Педиатр (гематолог/ онколог) по месту жительства руководствуется рекомендациями, данными специалистами учреждения, проводившего основные этапы лечения.
Диспансерный учет педиатром, детским онкологом/гематологом ведется до передачи пациента во взрослую сеть.
6. Дополнительная информация, влияющая на течение и исход заболевания
6.1 Этапы патолого-анатомического исследования операционного материалаОперационный материал направляется на исследование непосредственно сразу после вмешательства интактным. Недопустимо вскрытие хирургом ни одного из образцов, выделенных фрагментов.
Этапы патолого-анатомического исследования:
1. Макроскопическое описание с обязательным указанием всех видимых наружных повреждений - разрывы капсулы, видимая опухоль с поверхности почки. Недопустимо отделять фиброзную капсулу почки (остается со всем объемом паранефральной жировой ткани).
2. Измерение, взвешивание.
3. Все лимфатические узлы, помимо выделейных хирургом, должны быть выделены и маркированы отдельно с указанием локализации.
4. Почечные вена и артерия и мочеточник описываются дополнительно. Края их резекции (наиболее дистально расположенный поперечно выделенный фрагмент) маркируются отдельно.
5. Маркировка краской всего препарата по периферии, включая синус. В отдельных случаях отек паранефральной жировой ткани или капсулы почки/опухоли не позволяет закрепиться маркировочной краске на поверхности образца. В таком случае рекомендуется предфиксация в 10% формалине в течение 15-20 минут с последующей маркировкой краской.
6. Продольное вскрытие почки через опухоль от полюса к полюсу после того, как маркировочная краска полностью высохнет. Описание топографии опухоли относительно капсулы, синуса. Обязательное указание макроскопически видимых очагов некроза с указанием в процентах от площади среза опухоли.
7. Измерение опухоли в трех проекциях (для последующего расчета объема опухоли и объема бластемного компонента).
8. Выделение нескольких фрагментов, визуально различных, для биобанка и генетического исследования. Указанные фрагменты рассекаются пополам - одна часть отправляется в лаборатории, другая - в плановую проводку (позволяет идентифицировать компоненты в каждом из взятых образцов, о чем сообщается генетикам).
9. Разрезанная пополам почка фиксируется в 10% забуференном формалине от 12 до 48 часов. При больших размерах почки для лучшей фиксации возможно выполнение нескольких параллельных центральному разрезов. Для уменьшения времени предподготовки и ускорения диагностики - фиксация продольной пластины толщиной до 1 - 1,5 см в 20% забуференном формалине до 12 часов максимум.
10. Выделение фрагментов для гистологического исследования: как минимум одна продольная пластина должна быть выделена для гистологического исследования и забирается в плановую проводку целиком;
срез через почку обязательно проходит через почечный синус;
из пластины выделяются фрагменты толщиной до 3 мм, что не допускает неполноценной проводки;
размер фрагментов соответствует площади используемых гистологических кассет (так, использование мега кассет ускоряет этап просмотра и экономит время как врача, так и лаборанта);
11. Для гистологического исследования должны быть выделены (в дополнение к выше указанному, если отсутствуют):
макроскопически различные по виду очаги опухоли;
все вызывающие подозрение очаги, маркированные хирургом отдельно (маркируются краской, отличающейся по цвету от основной);
лимфатические узлы синуса почки;
мягкие ткани почечного синуса, края резекции мочеточника, сосудов ворот;
каждый узел опухоли, отельный от основного объема (при мультифокальном поражении);
часть капсулы опухоли/почки, подозрительные в отношении опухолевого роста;
минимум два фрагмента визуально интактной почки (для возможного обнаружения остатков нефрогенной стромы).
12. Для пересмотра материала в других лабораториях необходимо предоставить макрофотографии почки до и после первого разреза, фото выделенной для исследования пластины, карту блоков. Все фрагменты, выделенные для исследования, раскладываются согласно локализации в почке, им присваиваются порядковые номера, проводится фото документирование.
13. Гистологический тип и стадия выставляется согласно протоколу SIOP, раздел патоморфологии.
Критерии оценки качества медицинской помощи
1. Davidoff A.M. Wilms’ tumor // Current Opinion in Pediatrics. Curr Opin Pediatr, 2009. Vol. 21, №3. P.357-364.
2. Rivera M.N., Haber D.A. Wilms’ tumour: Connecting tumorigenesis and organ development in the kidney // Nature Reviews Cancer. Nature Publishing Group, 2005. Vol. 5, № 9. P. 699-712.
3. Buckley K.S. Pediatric genitourinary tumors. // Curr. Opin. Oncol. 2011. Vol. 23, № 3. P. 297-302.
4. Beckwith J.B., Kiviat N.B., Bonadio J.F. Nephrogenic rests, nephroblastomatosis, and the pathogenesis of wilms’ tumor // Fetal Pediatr. Pathol. Infonna Healthcare, 1990. Vol. 10, № 1-2. P. 1-36.
5. Breslow N.E. et al. Age distributions, birth weights, nephrogenic rests, and heterogeneity in the pathogenesis of Wilms tumor // Pediatr. Blood Cancer. 2006. Vol. 47, № 3. P. 260-267.
6. Gadd S. et al. A Children’s Oncology Group and TARGET initiative exploring the genetic landscape of Wilms tumor // Nat. Genet. Nature Publishing Group, 2017. Vol. 49, № 10. P. 1487-1494.
7. Szychot E., Apps J., Pritchard-Jones K. Wilms’ tumor: biology, diagnosis and treatment. // Transl. Pediatr. AME Publications, 2014. Vol. 3, № 1. P. 12-24.
8. Szychot E., Brodkiewicz A., Pritchard-Jones K. Review of Current Approaches to the Management of Wilms’ Tumor // Int. J. Clin. Rev. Remedica Medical Education and Publishing, 2012.
9. Chu A. et al. Wilms’ tumour: A systematic review of risk factors and meta-analysis // Paediatric and Perinatal Epidemiology. 2010. Vol. 24, № 5. P. 449-469.
10. Spreafico F., Bellani F.F. Wilms’ tumor: Past, present and (possibly) future // Expert Review of Anticancer Therapy. Expert Rev Anticancer Ther, 2006. Vol. 6, № 2. P. 249-258.
11. Beckwith J.B. National Wilms Tumor Study: An update for pathologists // Pediatr. Dev. Pathol. Springer, 1998. Vol. 1, № 1. P. 79-84.
12. Green D.M. Wilms’ Tumor // Diagnosis and Management of Malignant Solid Tumors in Infants and Children. Springer US, 1985. P. 129-186.
13. Scott R.H. et al. Syndromes and constitutional chromosomal abnonnalities associated with Wilms tumour // Journal of Medical Genetics. BMJ Publishing Group, 2006. Vol. 43, № 9. P. 705-715.
14. Sandoval J.A., Malkas L.H., Hickey R.J. Clinical significance of serum biomarkers in pediatric solid mediastinal and abdominal tumors // Int. J. Mol. Sci. MDPI AG, 2012. Vol. 13, № 1. P. 1126-1153.
15. Magee F. et al. Neural differentiation in Wilms’ tumor. // Hum. Pathol. 1987. Vol. 18, № 1. P. 33-37.
16. Детская онкология. Национальное руководство. Под ред. М.Д. Алиева, В.Г. Полякова, Г.Л. Менткевича, С.А. Маяковой. М.: Издательская группа РОНЦ. Практическая медицина, 2012.684 р.
17. Zamperlini-Netto G. et al. РО-60 - Renal tumors with extensive vascular disease: management challenges in a pediatric series from the Hospital for Sick Children. // Thromb. Res. 2016. Vol. 140 Suppl 1. P. S198-9.
18. Kebudi R. et al. Seroprevalence of hepatitis b, hepatitis c, and hiv in children with cancer at diagnosis and following therapy in turkey: Progress within the last 25 years // Turk Pediatr. Ars. AVES, 2019. Vol. 54, № 2. P. 82-85.
19. Riccabona M. Imaging of renal tumours in infancy and childhood // European Radiology. 2003. Vol. 13, № SUPPL. 4.
20. Grundy P.E. et al. Clinical significance of pulmonary nodules detected by CT and Not CXR in patients treated for favorable histology Wilms tumor on national Wilms tumor studies-4 and -5: A report from the Children’s Oncology Group // Pediatr. Blood Cancer. 2012. Vol. 59, № 4. P. 631-635.
21. Smets A.M.J.B. et al. The contribution of chest CT-scan at diagnosis in children with unilateral Wilms’ tumour. Results of the SIOP 2001 study // Eur. J. Cancer. Eur J Cancer, 2012. Vol. 48, №7. P.1060-1065.
22. Stanescu A.L. et al. Pediatric Renal Neoplasms:: MR Imaging-Based Practical Diagnostic Approach // Magnetic Resonance Imaging Clinics of North America. W.B. Saunders, 2019. Vol. 27, № 2. P. 279-290.
23. Voss S.D. Staging and following common pediatric malignancies: MRI versus CT versus functional imaging//Pediatric Radiology. Springer Verlag, 2018. Vol. 48, № 9. P. 1324-1336.
24. Massin M.M. et al. Acute arrhythmogenicity of first-dose chemotherapeutic agents in children // Med. Pediatr. Oncol. 2002. Vol. 39, № 2. P. 93-98.
25. Blatt J. et al. Pilot study of cardiac function after treatment of childhood wilms’ tumor with doxorubicin// Pediatr. Hematol. Oncol. Infonna Healthcare, 1995. Vol. 12, № 1. P. 61-66.
26. Agarwala S. et al. High incidence of adriamycin cardiotoxicity in children even at low cumulative doses: Role of radionuclide cardiac angiography // J. Pediatr. Surg. W.B. Saunders, 2000. Vol. 35, № 12. P. 1786-1789.
27. Durrant J.D. et al. American Academy of Audiology Position Statement and Clinical Practice Guidelines: Ototoxicity Monitoring Task Force Members. 2009.
28. Brooks B., Knight K. Ototoxicity monitoring in children treated with platinum chemotherapy // Int. J. Audiol. Taylor and Francis Ltd, 2018. Vol. 57, № sup4. P. S34-S40.
29. Vujanic G.M. et al. The role of biopsy in the diagnosis of renal tumors of childhood: Results of the UKCCSG Wilms Tumor Study 3 // Med. Pediatr. Oncol. Wiley-Liss Inc., 2003. Vol. 40, № 1. P. 18-22.
30. Unal E. et al. Twenty children with non-wilms renal tumors from a reference center in central anatolia, Turkey // Turkish J. Med. Sci. Turkiye Klinikleri, 2020. Vol. 50, № 1. P. 18-24.
31. August D.A., Huhmann M.B. A.S.P.E.N. Clinical guidelines: Nutrition support therapy during adult anticancer treatment and in hematopoietic cell transplantation // Journal of Parenteral and Enteral Nutrition. JPEN J Parenter Enteral Nutr, 2009. Vol. 33, № 5. P. 472-500.
32. Васильева E.C., Вашура А.Ю., Литвинов Д.В. Нутритивный статус детей с онкологическими и гематологическими заболеваниями, находящихся на лечении в ФЕБУ «ФНКЦ ДЕОИ им. Дмитрия Рогачева» (результаты скринингового исследования) // Современная онкология. 2016. Vol. 18, № 4. Р. 48-52.
33. Isenring Е., Elia М. Which screening method is appropriate for older cancer patients at risk for malnutrition? // Nutrition. Elsevier Inc., 2015. Vol. 31, № 4. P. 594-597.
34. Martin L. et al. Diagnostic criteria for the classification of cancer-associated weight loss // J. Clin. Oncol. American Society of Clinical Oncology, 2015. Vol. 33, № 1. P. 90-99.
35. Manary M.J., Sandige H.L. Management of acute moderate and severe childhood malnutrition//BMJ. BMJ, 2008. Vol. 337, № 7680. P. 1227-1230.
36. van den Broeck J., Eeckels R., Massa G. Validity of Single-Weight Measurements to Predict Current Malnutrition and Mortality in Children // J. Nutr. 1996. Vol. 126, № 1. P. 113-120.
37. Meijers J.M.M. et al. Nutritional care; do process and structure indicators influence malnutrition prevalence over time? // Clin. Nutr. Churchill Livingstone, 2014. Vol. 33, № 3. P. 459-465.
38. Muscaritoli M. et al. Consensus definition of sarcopenia, cachexia and pre-cachexia: Joint document elaborated by Special Interest Groups (SIG) “ cachexia-anorexia in chronic wasting diseases” and “ nutrition in geriatrics” // Clin. Nutr. Clin Nutr, 2010. Vol. 29, № 2. P. 154-159.
39. Kondrup J. et al. ESPEN guidelines for nutrition screening 2002 // Clin. Nutr. Churchill Livingstone, 2003. Vol. 22, № 4. P. 415-421.
40. Arends J. et al. ESPEN guidelines on nutrition in cancer patients // Clin. Nutr. Churchill Livingstone, 2017. Vol. 36, № 1. P. 11-48.
41. Van Den Heuvel-Eibrink M.M. et al. Position Paper: Rationale for the treatment of Wilms tumour in the UMBRELLA SIOP-RTSG 2016 protocol // Nat. Rev. Urol. Nature Publishing Group, 2017. Vol. 14, № 12. P. 743-752.
42. Kieran K., Ehrlich P.F. Current surgical standards of care in Wilms tumor // Urologic Oncology: Seminars and Original Investigations. Elsevier Inc., 2016. Vol. 34, № 1. P. 13-23.
43. Israels T. et al. The efficacy and toxicity of SIOP preoperative chemotherapy in Malawian children with a Wilms tumour // Pediatr. Blood Cancer. 2012. Vol. 59, № 4. P. 636-641.
44. Fuchs J. et al. Surgical aspects in the treatment of patients with unilateral wilms tumor: A report from the SIOP 93-01/Gennan society of pediatric oncology and hematology // Ann. Surg. 2009. Vol. 249, № 4. P. 666-671.
45. Elgendy A. et al. National Survey on the Management of Wilms Tumor //J. Pediatr. Hematol. Oncol. Lippincott Williams and Wilkins, 2019. Vol. 41, № 4. P. 280-285.
46. Cox S., Buyukiinal C., Millar A.J.W. Surgery for the complex Wilms tumour // Pediatr. Surg. Int. Springer, 2020. Vol. 36, № 2. P. 113-127.
47. Alkazemi M.H. et al. Partial and radical nephrectomy in children, adolescents, and young adults: Equivalent readmissions and postoperative complications // J. Pediatr. Surg. W.B. Saunders, 2019. Vol. 54, № 11. P. 2343-2347.
48. Walker J.P. et al. Factors affecting lymph node sampling patterns and the impact on survival of lymph node density in patients with Wilms tumor: a Surveillance, Epidemiology, and End Result (SEER) database review // J. Pediatr. Urol. Elsevier Ltd, 2019.
49. Godzinski J., Graf N., Audry G. Current concepts in surgery for Wilms tumor-the risk and function-adapted strategy // European Journal of Pediatric Surgery. Georg Thieme Verlag, 2014. Vol. 24, № 6. P.457-460.
50. Varlet F. et al. Laparoscopic treatment of renal cancer in children: A multicentric study and review of oncologic and surgical complications // J. Pediatr. Urol. Elsevier Ltd, 2014. Vol. 10, № 3. P. 500-505.
51. Varlet F. et al. Laparoscopic radical nephrectomy for unilateral renal cancer in children // Surg. Laparosc. Endosc. Percutaneous Tech. Lippincott Williams and Wilkins, 2009. Vol. 19, № 2. P. 148-152.
52. Kieran K. et al. Repeat nephron-sparing surgery for children with bilateral Wilms tumor // J. Pediatr. Surg. J Pediatr Surg, 2014. Vol. 49, № 1. P. 149-153.
53. Godzinski J. The current status of treatment of Wilms’ tumor as per the SIOP trials //Journal of Indian Association of Pediatric Surgeons. Medknow Publications, 2014. Vol. 20, № 1. P. 16-20.
54. Israels T. et al. SIOP PODC: Clinical guidelines for the management of children with Wilms tumour in a low income setting// Pediatr. Blood Cancer. 2013. Vol. 60, № 1. P. 5-11.
55. Pritchard J. et al. Results of the United Kingdom Children’s Cancer Study Group first Wilms’ tumor study // J. Clin. Oncol. J Clin Oncol, 1995. Vol. 13, № 1. P. 124-133.
56. Mitchell C. et al. The treatment of Wilms’ tumour: Results of the United Kingdom Children’s Cancer Study Group (UKCCSG) second Wilms’ tumour study // Br. J. Cancer. Churchill Livingstone, 2000. Vol. 83, № 5. P. 602-608.
57. Green D.M. et al. Effect of duration of treatment on treatment outcome and cost of treatment for Wilms’ tumor: A report from the National Wilms’ Tumor Study Group // J. Clin. Oncol. American Society of Clinical Oncology, 1998. Vol. 16, № 12. P. 3744-3751.
58. Dome J.S. et al. Treatment of anaplastic histology Wilms’ tumor: Results from the fifth National Wilms’ Tumor Study// J. Clin. Oncol. J Clin Oncol, 2006. Vol. 24, № 15. P. 2352-2358.
59. Malogolowkin M. et al. Treatment of Wilms tumor relapsing after initial treatment with vincristine, actinomycin D, and doxorubicin. A report from the national Wilms tumor study group // Pediatr. Blood Cancer. Pediatr Blood Cancer, 2008. Vol. 50, № 2. P. 236-241.
60. UMBRELLA Protocol SIOP-RTSG 2016 [Electronic resource], 2016. P. 336. URL: http ://www.fnkc .ru/docs/SIOP-RTSG2016.pdf.
61. Owens C.M. et al. Bilateral disease and new trends in Wilms tumour // Pediatric Radiology. Pediatr Radiol, 2008. Vol. 38, № 1. P. 30-39.
62. Hamilton T.E. et al. The management of synchronous bilateral wilms tumor: A report from the National Wilms Tumor Study Group //Ann. Surg. Ann Surg, 2011. Vol. 253, № 5. P. 1004-1010.
63. Sudour H. et al. Bilateral Wilms tumors (WT) treated with the SIOP 93 protocol in Prance: Epidemiological survey and patient outcome // Pediatr. Blood Cancer. Pediatr Blood Cancer, 2012. Vol. 59, № 1. P.57-61.
64. Indolfi P. et al. Synchronous bilateral Wilms tumor: A report from the Associazione Italiana Ematologia Oncologia Pediatrica (AIEOP) // Cancer. Cancer, 2013. Vol. 119, № 8. P. 1586-1592.
65. Joosten K.F.M., Kerklaan D., Verbruggen S.C.A.T. Nutritional support and the role of the stress response in critically ill children // Current Opinion in Clinical Nutrition and Metabolic Care. Lippincott Williams and Wilkins, 2016. Vol. 19, № 3. P. 226-233.
66. Koletzko B. et al. Guidelines on Paediatric Parenteral Nutrition of the European Society of Paediatric Gastroenterology, Hepatology and Nutrition (ESPGHAN) and the European Society for Clinical Nutrition and Metabolism (ESPEN), Supported by the European Society of Paediatri // Journal of Pediatric Gastroenterology and Nutrition. J Pediatr Gastroenterol Nutr, 2005. Vol. 41, № SUPPL. 2. 87 p.
67. Tanner L. et al. Cancer Rehabilitation in the Pediatric and Adolescent/Young Adult Population // Seminars in Oncology Nursing. Elsevier Inc, 2020. Vol. 36, № 1. P. 150984.
68. Oken M.M. et al. Toxicity and response criteria of the Eastern Cooperative Oncology Group // Am. J. Clin. Oncol. 1982. Vol. 5, № 6. P. 649-655.
69. SB L. et al. The Measurement of Performance in Childhood Cancer Patients // Cancer. Cancer, 1987. Vol. 60, № 7.
Приложение А1. Состав рабочей группы
1. Руководитель:
Белогурова Маргарита Борисовна, д.м.н., проф., член НОДГО, зав. отделением химиотерапии (противоопухолевой лекарственной терапии) и комбинированного лечения опухолей у детей ГБУЗ СПб КНпЦСВМП(о), заведующая кафедрой онкологии, детской онкологии и лучевой терапии ГБОУ ВПО СПбГПМУ
2. Клинические онкологи:
Варфоломеева Светлана Рафаэлевна, д.м.н., проф., заместитель директора по научной и лечебной работе - директор НИИ ДОиГ ФГБУ НМИЦ онкологии им. Н. Н. Блохина
Качанов Денис Юрьевич, д.м.н., член НОДГО, заведующий отделением клинической онкологии ФГБУ НМИЦ ДГОИ им. Д. Рогачева, зам. директора Института онкологии, радиологии и ядерной медицины ФГБУ НМИЦ ДГОИ им. Д. Рогачева
Телешова Маргарита Викторовна, член НОДГО, врач - детский онколог отделения клинической онкологии ФГБУ НМИЦ ДГОИ им. Д. Рогачева
3. Хирургическая группа:
Меркулов Николай Николаевич, член НОДГО, врач-детский хирург отделения онкологии и детской хирургии ФГБУ НМИЦ ДГОИ им. Д. Рогачева
Рубанский Михаил Александрович, к.м.н., врач - детский онколог хирургического отделения № 2 опухолей торакоабдоминальной локализации НИИ ДОиГ НМИЦ онкологии им. Н.Н. Блохина
4. Лаборатория патологической анатомии
Митрофанова Анна Михайловна, член НОДГО, врач отделения патологической анатомии ФГБУ НМИЦ ДГОИ им. Д. Рогачева
Приложение А2. Методология разработки клинических рекомендации
Целевая аудитория данных клинических рекомендаций:
1. Врачи-детские онкологи;
2. Врачи-педиатры;
3. Студенты медицинских ВУЗов, ординаторы, аспиранты.
В данных клинических рекомендациях все сведения ранжированы по уровню достоверности (доказательности) в зависимости от количества и качества исследований по данной проблеме.
Методология сбора доказательств
Методы, использованные для сбора / селекции доказательств: поиск публикаций в специализированных периодических печатных изданиях с импакт-факгором >0,3.
Поиск в электронных базах данных.
Доказательной базой для рекомендаций являются публикации, вошедшие в Кокрейновскую библиотеку, базы данных PubMed и MEDLINE. Елубина поиска составляла 30 лет.
Методы, использованные для анализа доказательств:
• обзоры опубликованных метаанализов;
• систематические обзоры с таблицами доказательств.
Методы, использованные для качества и силы доказательств:
• консенсус экспертов;
• оценка значимости доказательств в соответствии с рейтинговой схемой доказательств (табл. А1-АЗ).
Порядок обновления клинических рекомендаций.
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию - не реже чем один раз в три года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, наличии обоснованных дополнений/замечаний к ранее утверждённым КР, но не чаще 1 раза в 6 месяцев.
Приложение АЗ. Связанные документы
Приложение А3.1. Схемы лекарственного лечения нефробластомы
VCR - винкристин** 1,5 мг/м2/сут, в/в болюсно -1, 2, 3,4, 5 и 6 недели;
ACT - дактиномицин 45 мкг/кг/сут, в/в болюсно -1, 3 и 5 недели;
DOX - доксорубицин** 50 мг/м2/сут, 2-6 часовая инфузия -1, 5 недели.
Режим AV1 адъювантной химиотерапии у пациентов с локализованной формой НБ. I стадия, группа промежуточного риска [41.54]:
VCR - винкристин** 1,5мг/м2/сут, в/в болюсно -1, 2, 3, 4, 5, 6, 7, 8, 11,12,14, 15,17,18, 20, 21, 23, 24, 26, 27 недели;
ACT - дактиномицин 45 мкг/кг/сут, в/в болюсно - 2, 5, 8,11, 14,17, 20, 23, 26 недели;
DOX-доксорубицин**50мг/м2/сут, в/в каиельно 2-6 часовая инфузия - 2, 8, 14, 20, 26 недели. Примечание: доксорубицин** - всего 5 доз, общая кумулятивная доза: 250мг/м2.
Режим AV-2 адъювантной химиотерапии у пациентов с локализованной формой НБ. TI/III стадия, группа промежуточного риска Iкроме опухолей с фокальной анаплазией, смешанным ши регрессивным типом при объем опухоли после завершения неоадъювантной химиотерапии > 500мл) [41.60]:
VCR - винкристин** 1,5мг/м2/сут, в/в болюсно -1, 2, 3, 4, 5, 6, 7, 8, И, 12,14, 15,17,18, 20, 21, 23, 24, 26, 27 недели;
ACT - дактиномицин 45 мкг/кг/сут, в/в болюсно - 2, 5, 8,11, 14,17, 20, 23, 26 недели;
ТЮХ- доксорубицин** 50 мг/м2/сут, в/в каиельно 2-6 часовая инфузия -2,8,14 недели.
Примечание: максимальная разовая доза винкристина** 2 мг. Первое введение винкристина** - после восстановления перистальтики кишечника в послеоперационном периоде, в срок до 21 дня от последнего введения неоадъювантной химиотерапии; дактиномицин не применяется у детей весом менее 5 кг; с учетом предоперационной XT кумулятивная доза доксорубицина** составляет 250 мг/м2; во время проведения лучевой терапии доксорубицин** не вводится, доза дактиномицина снижается на 1/3.
Режим HR-1 - адъювантной химиотерапии у пациентов с локализованной формой НБ. П/Ш стадия, группа высокого риска [41.60]:
CYCLO - циклофосфамид** 450 мг/м2/сут в/в капельно за 1 час - 1, 2, 3 дни, в недели 1, 7, 13, 19, 25,31;
DOX - доксорубицин** 50 мг/м2/сут в/в капельно за 2-6 часов - 1 день, в недели 1, 7,13,19, 25, 31;
VP16 - #этопозид** 150 мг/м2/сут в/в капельно за 1 час - 1, 2, 3 дни, в недели 4,10, 16, 22, 28, 34;
CARBO - #карбоплатин** 200 мг/м2/сут в/в капельно за 1 час - 1, 2, 3 дни, в недели 4, 10, 16, 22, 28, 34 [17];
Примечание: первый курс должен быть начат не позднее 21 дня после окончания предоперационной химиотерапии. Доксорубицин** вводится в 1 день после циклофосфамида
АУР 160 - 27 недель химиотерапии [41.60]
VCR - винкристин** 1,5 мг/м2/сут, в/в болюсно -1, 2, 3,4, 5, 6, 7, 8, 11, 12, 14,15, 17, 18, 20, 21, 23, 24, 26, 27 недели;
ACT - дактиномицин 45 мкг/кг/сут, в/в болюсно - 2, 5, 8,11,14,17, 20, 23, 26 недели;
DOX - доксорубицин** 50 мг/м2/сут, в/в капельно 2-6 часовая инфузия - 2 неделя.
Примечание: максшюлъная разовая доза винкристина** 2мг. Первое введение винкристина** -после восстановления перистальтики кишечника в послеоперационном периоде, в срок до 21 дня от последнего введения неоадъювантной химиотерапии; дактиномицин не применяется у детей весом менее 5 кг; с учетом предоперационной XT кумулятивная доза доксорубицина** составляет 150 мг/м2; во время проведения лучевой терапии доксорубицин** не вводится, доза дактиномицина снижается на 1/3.
АУР 250 - 27 недель химиотерапии [41.60]
CARBO - #карбоплатин** 200 мг/м2/сут в/в капельно за 1 час - 1, 2, 3 дни, в недели 4, 10, 13, 16, 22, 25, 28, 34.
Режим 1 (интенсивный VCRJ>_[ 60]
Общая продолжительность курса - 6 недель.
VP16 - #этопозид** 150 мг/м2/сут в/в капельно за 1 час 1, 2, 3 дни, 1 и 4 недели;
CARBO - #карбоплатин** 200 мг/м2/сут в/в капельно за 1 час 1, 2, 3 дни, 1 и 4 недели. Проводится 2 таких цикла.
Приложение АЗ.2 Правила применения химиотерапевтических препаратов и возрастные дозировки
1. Введение дактиномицина, доксорубицина, циклофосфамида, этопозида и карбоплатина должно быть отложено до восстановления показателей: нейтрофилы - более 1,0х109/л, тромбоциты - более 100х109/л [41];
2. Введение дактиномицина должно быть отложено: при повышении уровня билирубина выше 1,5 от нормы; при повышении уровня АЛТ выше 5 от нормы; при клинических признаках веноокклюзионной болезни [41];
3. Введение доксорубицина должно быть отложено: при повышении билирубина выше 2 от нормы; при повышении АЛТ выше 5 от нормы: при наличии мукозита 1 степени и выше [41];
4. Если следующий курс начинается с задержкой более 1 недели, необходимо обсудить снижение дозы препаратов на 33% [41];
5. Дозы химиопрепаратов рассчитываются в зависимости от веса пациента и представлены в таблице 7 [41].
Таблица 7. Дозы химиопрепаратов для детей в соответствии с их весом [41,60]
" - Эхокардиография: в начале лечения, перед неделями 19, 31 и в конце лечения;
А - скорость клубочковой фильтрации (СКФ) (измерять при проведении каждого третьего курса или чаще при наличии признаков ренальной дисфункции).
Приложение Б. Алгоритмы ведения пациента
Приложение Б1. Алгоритм первичной диагностики НБ
Приложение В. Информация для пациентов
Нефробластома (опухоль Вилмса) - это высокозлокачественная солидная опухоль почек. Она также называется нефробластома (часть слова „нефро“ обозначает почку, а „бластома“ обозначает опухоль). Опухоль названа по имени немецкого хирурга из Гейдельберга Макса Вилмса. На рубеже прошлого века Макс Вилме занимался этой болезнью и впервые её подробно описал.Нефробластома возникает из зародышевой ткани, которая начинает развиваться в период внутриутробного развития организма. В ней может быть несколько типов, поэтому нефробластому называют „смешанной опухолью", но основной из них - клетки-предшественники почечной ткани.
У 90% пациентов опухоль имеет локализованную форму, однако, примерно у 10 % детей на момент диагноза уже есть метастазы, это могут быть близлежащие лимфатические узлы, а также лёгкие и печень, и более редкие локализации. У некоторых детей (около 5%) нефробластома сразу поражает обе почки. Обычно у этих детей опухоль вырастает из клеток-предшественников почечной ткани, которая не регрессировала в необходимые сроки, и имеет название - нефробластоматоз (незрелая эмбриональная ткань почек). Чаще, чем при других онкологических болезнях в детском возрасте, нефробластомой болеют дети с определёнными аномалиями развития и/или с наследственными онкологическими синдромами.
Нефробластома - самая частая опухоль почки детского возраста, пик заболеваемости приходится на возраст от 2 до 5 лет. Но нефробластома бывает также и у пациентов более младшего возраста, и подростков.
Опухоль связана с изменениями определённых генов и хромосом, наиболее изученным из которых является ген 1 опухоли Вилмса [ген WT1].
Нефробластома часто встречается у детей, у которых уже есть врождённый опухолевый синдром, например, синдром WAGR (объединяет несколько симптомов неправильного развития), синдром Беквита-Видемана (увеличивается масса тела и внутренних органов), синдром Дениса Дрэша (недоразвитие половых органов). У детей с этими болезнями есть нарушения в развитии и повышен риск заболеть раком. Если в семье у кого-то была нефробластома, то у ребёнка из этой семьи также повышается вероятность заболеть нефробластомой. „Семейные" случаи встречаются довольно редко (примерно около 1 %), и у этих детей опухоль обычно поражает обе почки или нефробластома имеет многоочаговый характер. Однако, в большинстве случаев нефробластома носит спорадический характер.
У заболевших детей живот увеличивается в размерах, и опухоль - случайная находка на УЗИ. Могут быть боли в животе, кровь в моче. Также ребёнок может худеть, у него может быть высокая температура. Если у ребёнка уже есть определённые генетические синдромы и аномалии развития, то они помогают заподозрить у него нефробластому.
После клинико-рентгенологического подтверждения того, что опухоль исходит из почки, в большинстве случаев начинается предоперационная терапия. Еистологическая верификация до начала лечения применяется только при сильных сомнениях в отношении диагноза нефробластома. У части пациентов (дети младше 6 месяцев и старше 7-10 лет) проводят гистологическое исследование ткани до терапии ввиду риска отличной от нефробластомы опухоли.
После того, как поставили окончательный диагноз (после хирургического вмешательства после предоперационной химиотерапии), врачи составляют план лечения. Специалисты, которые ведут пациента, составляют индивидуальную программу лечения (т.н. риск-адаптированное лечение), в которой учитываются определённые моменты. Их называют факторами риска (прогностические факторы), и они влияют на прогноз развития болезни.
Важнейшие прогностические факторы у детей с нефробластомой это: стадия болезни (насколько опухоль распространилась по организму к моменту диагноза, и в каком объёме её можно удалить хирургическим путём), гистологический вариант нефробластомы (по ним можно понять, как опухоль растёт, то есть какая у неё степень злокачественности), ответ опухоли на химиотерапию.
Лечение детей с нефробластомой комбинированное. Это значит, оно состоит в основном из операции и химиотерапии. Чаще всего детей начинают лечить курсом химиотерапии, чтобы уменьшить размер опухоли. Тоща опухоль становится более операбельной. У некоторых детей лечение сразу начинается с операции. Цель хирургической операции - удалить опухоль и возможные метастазы. Как правило, после операции продолжается (или начинается) химиотерапия. В зависимости от стадии опухоли после операции и/или в зависимости от того, есть ли ещё метастазы, дополнительно могут назначать облучение опухолевого региона. Во всех крупных лечебных центрах детей и подростков с нефробластомой лечат по стандартизированным протоколам. Цель всех программ -увеличить долговременную выживаемость и одновременно снизить отдалённые последствия на организм ребёнка.
Шансы вылечить ребёнка от нефробластомы очень хорошие. Благодаря высокоточным новым методам диагностики и стандартизированным протоколам комбинированной терапии выздоравливают примерно 90% больных.
Однако, у каждого конкретного ребёнка прогноз зависит в первую очередь от того, каким вариантом нефробластомы он заболел и насколько болезнь успела распространиться к моменту диагноза (стадия заболевания). У детей с опухолью высокой степени злокачественности прогноз менее благоприятный. Однако, даже у детей на поздних стадиях нефробластомы при определённых условиях могут быть хорошие шансы на выздоровление. Необходимо понимать, что каждый ребенок индивидуален, и статистика не сможет предсказать выздоровеет он или нет, однако относительно прогноза при том или ином варианте заболевания, необходимо спросить лечащего врача.
Приложение Г.
Название на русском языке: шкала токсичности по критериям СТС АЕ
Оригинальное название (если есть): Common Terminology Criteria for Adverse Events
Источник (официальный сайт разработчиков, публикация с валидацией): Common Terminology Criteria for Adverse Events (CTCAE) v5.0 Publish Date: November 27, 2017 (http ://ctep .cancer.gov).
Тип: шкала оценки
Назначение: стандартизация оценки нежелательных явлений
Содержание, ключ:
Приложение ГЗ. Шкала ECOG
Оригинальное название: The ECOG Scale of Performance StatusИсточник: Oken M.M. et al. Toxicity and response criteria of the Eastern Cooperative Oncology Group. Am. J. Clin. Oncol. 1982;5(6):649-65 [68]
Тип: шкала оценки
Назначение: клиническая оценка общего состояния пациента Содержание и интерпретация
Приложение Г4. Шкала Karnofsky, модификация Lansky
Оригинальное название: Lansky Perfonnance Scale
Источник: Lansky SB, List MA, Lansky LL, Ritter-Sterr C, Miller DR (1987). "The measurement of performance in childhood cancer patients". Cancer. 60 (7): 1651-6 [69]
Тип: шкала оценки
Назначение: клиническая оценка общего состояния пациента в зависимости от возраста (шкала Karnovsky - для пациентов 16 лет и старше, шкала Lansky - для пациентов моложе 16 лет)
Содержание и интерпретация:
Теги: новообразования почек
234567 Начало активности (дата): 08.01.2023 22:23:00
234567 Кем создан (ID): 989
234567 Ключевые слова: ангиография, новообразования почек, почечные лоханок, мочеточник, лучевая терапия
12354567899
Похожие статьи
Злокачественные новообразования губыРентген на дому 8 495 22 555 6 8
Дифференцированный рак щитовидной железы
Грибовидный микоз
Рак печени (гепатоцеллюлярный)



