 06.01.2023
06.01.2023
Забрюшинные неорганные саркомы
Клинические рекомендации по забрюшинной неорганной саркомы
Разработчик клинической рекомендации
• Ассоциация онкологов России
• Общероссийская общественная организация «Российское общество клинической онкологии»
Одобрено Научно-практическим Советом Минздрава РФ
Список сокращений
ВБП - выживаемость без прогрессирования ДИ - доверительный интервал в/в - внутривенноЗНС - забрюшинная неорганная саркома
КТ - компьютерная томография
ЛФК - лечебная физкультура
ЛТ - лучевая терапия
ОВ - общая выживаемость
ОШ - отношение шансов
РОД - разовая очаговая доза
СМТ - саркома мягких тканей
СОД - суммарная очаговая доза
CTV - clinical tumor volume, область клинического распространения опухоли
ECOG - Eastern Cooperative Oncology Group, Восточная объединенная онкологическая группа
GTV - gross tumor volume, определяемый объем опухоли
RECIST - Response evaluation criteria in solid tumours, Критерии оценки ответа солидных опухолей на терапию
Другие обозначения
** - жизненно необходимый и важнейший лекарственный препарат
# - препарат, применяющийся не в соответствии с показаниями к применению и противопоказаниями, способами применения и дозами, описанными в инструкции по его применению (офф-лейбл)
Термины и определения
Безрецидивная выживаемость (relapse free survival) - интервал времени от начала лечения до прогрессирования болезни, развития второй опухоли или смерти пациента по любой причине. Применяется в случае радикального лечения при локализованном процессе.
Время до прогрессирования (time to progression) - интервал времени от начала лечения (или даты рандомизации в клинических исследованиях) до даты прогрессирования болезни без учета смерти пациентов по причинам, не связанным с прогрессированием процесса.
Второй этап реабилитации - реабилитация в стационарных условиях медицинских организаций (реабилитационных центров, отделений реабилитации), в ранний восстановительный период, поздний реабилитационный период, период остаточных явлений заболевания.
Выживаемость без прогрессирования (ВБП) (progression free survival) - интервал времени от начала лечения (или даты рандомизации в клинических исследованиях) до даты прогрессирования болезни или смерти пациента по любой причине.
Курс химиотерапии - период с первого до последнего дня введения цитостатиков.
Общая выживаемость (OB) (overall survival) - интервал времени от начала лечения до смерти пациента по любой причине.
Первый этап реабилитации - реабилитация в период специализированного лечения основного заболевания (включая хирургическое лечение, и/или химиотерапию, и/или лучевую терапию (ЛТ)) в отделениях медицинских организаций по профилю основного заболевания.
Полный эффект (complete response), или полный регресс опухоли - исчезновение всех очагов поражения на срок не менее 4 нед.
Предреабилитация (prehabilitation) - реабилитация с момента постановки диагноза до начала лечения (хирургического, и/или химиотерапии, и/или ЛТ).
Прогрессирование болезни (progression disease) - увеличение суммы измеряемых очагов на 20 % и более по сравнению с наименьшей суммой, зарегистрированной в процессе лечения и/или наблюдения, или появление хотя бы одного нового очага.
Радикальная операция (R0) - удаление пораженного органа в пределах здоровых тканей вместе с зонами регионарного метастазирования без остаточных проявлений опухолевого процесса.
Симптоматическое лечение - комплекс лечебных мероприятий, направленных на устранение наиболее тягостных проявлений опухолевого процесса, либо на лечение осложнений, либо на коррекцию последствий противоопухолевого лечения.
Стабилизация болезни - уменьшение суммы измеряемых очагов менее чем на 30 % или увеличение суммы измеряемых очагов менее чем на 20 % при отсутствии новых очагов или явного прогрессирования со стороны неизмеряемых очагов.
Третий этап реабилитации - реабилитация в ранний и поздний реабилитационный периоды, период остаточных явлений заболевания, проводимая в отделениях (кабинетах) реабилитации, физиотерапии, лечебной физкультуры (ЛФК), рефлексотерапии, мануальной терапии, психотерапии, медицинской психологии, кабинетах логопеда (учителя-дефектолога), оказывающих медицинскую помощь в амбулаторных условиях, дневных стационарах, а также выездными бригадами на дому (в том числе в условиях санаторно-курортных организаций).
1. Краткая информация по заболеванию или состоянию (группы заболеваний или состояний)
1.1 Определение заболевания или состояния (группы заболеваний или состояний)
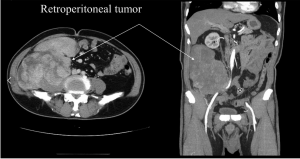
Забрюшинные неорганные саркомы (ЗНС) - редкие виды злокачественных опухолей, развивающиеся из разных типов соединительной ткани и располагающиеся забрюшинно. Наиболее частыми формами являются липосаркомы, лейомиосаркомы, шванномы.
1.2 Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
На сегодняшний день не установлены этиологические факторы развития забрюшинных сарком. Липосаркомы представляют собой злокачественные мезенхимальные опухоли из опухолевых липоцитов/липобластов разной степени дифференцировки. Гистогенетическим источником их развития чаще всего является жировая ткань паранефральной клетчатки, брыжейки ободочной или тонкой кишки. Лейомиосаркомы - вторая по частоте после липосарком группа забрюшинных опухолей [1]. Это злокачественные мезенхимальные опухоли из гладкомышечных клеток. Они имеют два гистогенетических источника развития забрюшинной локализации - миоциты брыжейки тонкой кишки и мышечные клетки стенки нижней полой вены и ее висцеральных ветвей. В соответствии с этим выделены забрюшинные неорганные лейомиосаркомы и лейомиосаркомы нижней полой вены и почечных вен. Злокачественные опухоли из клеток оболочек периферических нервов (злокачественные шванномы) - третья по распространенности группа забрюшинных неорганных опухолей. Это опухоли нейроэктодермального происхождения, формирующиеся из шванновских клеток и периневральных фибробластов (нейрофибросаркомы). Другие гистологические типы встречаются значительно реже.
1.3 Эпидемиология заболевания или состояния (группы заболеваний или состояний)
Эпидемиологические данные о заболеваемости ЗНС в России отсутствуют.
1.4 Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статической класификации болезней и проблем, связанных со здоровьем
Особенность кодирования ЗНС заключается в том, что данные опухоли относятся к мягкотканным саркомам. Многие гистологические типы мягкотканных сарком крайне редко имеют забрюшинную локализацию у взрослых пациентов. В Международной статистической классификации болезней и проблем, связанных со здоровьем, 10-го пересмотра (МКБ-10) ЗНС обозначены кодом С48.0.
1.5 Классификация заболевания или состояния (группы заболеваний или состояний)
1.5.1. Международная гистологическая классификация
Международная гистологическая классификация забрюшинных сарком соответствует международной гистологической классификации мягкотканных сарком, разработанной экспертами Всемирной организации здравоохранения (4-го пересмотра, 2013 г.) [2] (табл. 1).
Таблица 1. Международная гистологическая классификация мягкотканных сарком
Комментарии: гистологическая степень злокачественности опухоли (Grade) - параметр, который определяется при рутинном гистологическом исследовании препарата по системе French Federation of Cancer Centers (FNCLCC) [3]. Система предполагает количественную оценку (в баллах) следующих параметров: степень дифференцировки клеток опухоли, количество митозов в ядрах клеток опухоли, площадь некроза опухоли. Гистологическая степень злокачественности (G) не зависит от гистологического типа саркомы, а определяется индивидуальными особенностями ее морфологии. Система разделяет опухоли на высокодифференцированные (Grade 1) и низкодифференцированные (Grade 2 и 3). Определение гистологической степени злокачественности саркомы возможно только после установления ее гистологического типа (нозологической формы). В случае опухолей с пограничным (неопределенным) потенциалом злокачественности (интраабдоминальный десмоидный фиброматоз, солитарная фиброзная опухоль/гемангиоперицитома, некоторые гастроинтестинальные стромальные опухоли, воспалительная миофибробластическая опухоль) гистологическая степень злокачественности не указывается.
Нет единого мнения о способах определения степени лечебного патоморфоза сарком забрюшинного пространства [4]. В национальных центрах степень лечебного патоморфоза сарком определяют с помощью четырехуровневой системы Лавниковой. Эта система основана на учете площади, которую занимают пригодные к идентификации («живые») опухолевые клетки. К материалу биопсий ЗНС не предъявляется особых требований по сравнению со стандартными операционными процедурами подготовки тканей для гистологического исследования.
Обязательное морфологическое исследование после плановой операции позволяет не только установить гистологический тип опухоли, но и определить степень лечебного патоморфоза в тех случаях, когда проводилась неоадъювантная химиотерапия, что необходимо для выбора дальнейшей тактики лечения и оценки прогноза. Определить края резекции ЗНС, особенно больших размеров, очень трудно [5]. Такая попытка возможна при совместном исследовании препарата оперирующим хирургом и морфологом. В случае сомнений в радикальности вмешательства хирургу следует указать данный факт
в протоколе операции, а также отметить края резекции в ложе удаленной опухоли и в дальнейшем обсудить тактику ведения пациента на междисциплинарном консилиуме.
1.5.2. Стадирование
В настоящее время стадию ЗНС определяют по системе стадирования сарком мягких тканей TNM (7-е издание, 2011) (табл. 2).
Определение стадии основано на таких показателях, как размер опухоли, степень злокачественности и наличие отдаленных метастазов.
По системе TNM 7-го издания (2011) (табл. 2):
размер опухоли:
Т1 - опухоль размером < 5 см;
Т2 - опухоль размером >5 см;
глубина расположения:
а - опухоль расположена над поверхностной фасцией; b - опухоль расположена под поверхностной фасцией; степень злокачественности (G):
G1 - низкая;
G2, G3 - высокая.
1.6 Клиническая картина заболевания или состояния (группы заболеваний или состояний)
Забрюшинные неорганные саркомы представляют собой гетерогенную группу заболеваний. Одной из особенностей ЗНС является их медленный экспансивный рост с минимальными клиническими проявлениями. Отсутствие болевого синдрома позволяет опухолям достичь больших размеров (более 20-30 см в диаметре). В зависимости от типа и темпа роста, гистологической структуры такие опухоли могут либо прорастать в соседние органы, либо, наоборот, смещать их в сторону, что дает возможность в ряде случаев выполнить органосохраняющие операции. Липосаркомы чаще развиваются без болевого синдрома, их труднее диагностировать путем ультразвукового исследования. Лейомиосаркомы могут возникать из мелких либо крупных вен (нижней полой вены), обладают большим потенциалом злокачественности и склонностью к гематогенному метастазированию. Шванномы чаще всего локализуются паравертебрально либо располагаются вдоль крупных нервных стволов, их рост в случае вовлечения нервов может сопровождаться болевым синдромом. При тазовой локализации необходимо провести диагностический поиск с целью исключения органной принадлежности опухоли (образования матки, яичников, прямой кишки, предстательной железы, мочевого пузыря).
Таким образом, получение до операции максимально полной информации не только о размерах опухоли, но и о ее биологической природе является приоритетом в лечении ЗНС.
2. Диагностика заболевания или состояния (группы заболеваний или состояний) медицинские показания и противопоказания к применению методов диагностики
Критерии установления диагноза/состояния:
1. анамнез;
2. результаты физикального обследования;
3. данные инструментальных исследований (компьютерной (КТ) и магнитно-резонансной томографии);
4. данные прижизненного патолого-анатомического исследования биопсийного/операционного материала и/или иммуногистохимического исследования.
2.1 Жалобы и анамнез
• Рекомендуется сбор жалоб и анамнеза у пациента с подозрением на ЗНС с целью выявления симптомов заболевания [6-13].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
2.2 Физикальное обследование
• Рекомендуется тщательный осмотр пациента с симптомами заболевания при первом его обращении. В большинстве случаев ЗНС на ранних стадиях не имеют специфических симптомов и достигают больших размеров, что позволяет в некоторых случаях пальпировать образование. При подозрении на тазовую локализацию рекомендовано выполнить вагинальное и ректальное исследование [6-13].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
2.3 Лабораторные диагностические исследования
• Не существует патогномоничных лабораторных признаков ЗНС. Рекомендуется стандартное обследование, которое включает общий анализ мочи, общий анализ крови, биохимический анализ крови (с определением содержания белка, билирубина, мочевины, креатинина, аспартатаминотрансферазы, аланинаминотрансферазы, щелочной фосфатазы, Na+, К+, Са+, СГ), а также исследование коагуляционного гемостаза. В случае проведения дифференциальной диагностики и необходимости исключения метастазов герминогенных опухолей или лимфомы с поражением забрюшинных лимфатических узлов рекомендуется дополнительно определить уровень лактатдегидрогеназы, альфа-фетопротеина и хорионического гонадотропина. Значительное повышение уровня лактатдегидрогеназы позволяет заподозрить лимфопролиферативное заболевание (в случае подозрения на увеличенные забрюшинные лимфатические узлы), а повышение уровня альфа-фетопротеина и хорионического гонадотропина - герминогенные опухоли с поражением забрюшинных лимфатических узлов, особенно у пациентов молодого возраста. Повышение уровня катехоламинов крови или мочи может указывать на опухоли из хромаффинной ткани (вненадпочечниковую феохромоцитому) [7, 9,12,14-18].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
2.4 Инструментальные диагностические исследования
• Рекомендуется всем пациентам при подозрении на ЗНС выполнять КТ органов брюшной полости и малого таза с внутривенным контрастированием для первичной диагностики [9,18-21].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 4).
• Рекомендуется всем пациентам при подозрении на ЗНС проводить ультразвуковое исследование органов брюшной полости и малого таза, а также органов забрюшинной локализации в случае отсутствия возможности выполнения КТ органов брюшной полости в качестве первичного диагностического исследования (либо скрининга) [9,18-21].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 4).
• Рекомендуется всем пациентам проводить сцинтиграфию почек при высоком риске развития почечной недостаточности, особенно в тех случаях, когда планируется нефрэктомия на стороне поражения (с целью оценки функции контралатеральной почки) [19, 22, 23].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Комментарии: следует заранее обсудить с профильными специалистами возможность проведения сеансов экстракорпоральной детоксикации (либо в учреждении, где проводится оперативное вмешательство, либо по месту жительства пациента).
• Рекомендуется магнитно-резонансная томография органов малого таза или брюшной полости в сложных случаях (при подозрении на вовлечение в опухолевый процесс паренхиматозных органов, мягких тканей, проникновения опухоли в спинномозговой канал) [19,20,21].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Комментарии: магнитно-резонансная томография позволяет оценить мягкотканный компонент опухоли, поражение мышц, вовлечение сосудов и нервов в опухолевый процесс, распространенность опухолевого процесса.
• Рекомендуется КТ органов грудной клетки с целью исключения метастазов в легких, особенно в случаях сарком с высокой степенью злокачественности [83,103].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• Рентгенография органов грудной клетки рекомендуется при ранних стадиях ЗНС [19].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Комментарии: липосаркомы крайне редко метастазируют в легкие (исключение составляют миксоидные липосаркомы). В то же время у лейомиосарком высокий потенциал гематогенного метастазирования, что следует учитывать при исключении отдаленных метастазов.
• Рекомендуется на 1-м этапе диагностики и лечения пациента с подозрением на ЗНС выполнить пункционную чрескожную биопсию (соге-биопсию) опухоли; на основании морфологического заключения определяют дальнейшую тактику лечения [6-13].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Комментарии: биопсия показана, когда планируется предоперационная химиотерапия либо ЛТ, если эта предоперационная терапия может изменить объем операции (в случае уменьшения размеров опухоли возможно сохранение сосудов, паренхиматозных органов), а также в случае метастатического процесса. Биопсия может выполняться под ультразвуковым контролем либо под контролем КТ. При сложной локализации следует использовать видеоэндоскопию либо прибегнуть к открытой биопсии. Забрюшинные липосаркомы в большинстве случаев имеют характерные рентгенографические признаки, что нужно учитывать при диагностическом поиске.
• Рекомендуется пациентам, у которых планируется хирургическое вмешательство при первичных опухолях нижней полой вены, провести флебографию для определения интенсивности коллатерального кровотока с целью оценки необходимости сосудистой реконструкции [9].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Комментарии: пациенты с лейомиосаркомой нижней полой вены должны быть направлены на лечение в онкологические стационары, сотрудники которых имеют опыт вмешательств на крупных сосудах органов брюшной и грудной полостей.
2.5 Иные диагностические исследования
• Рекомендуется выполнение прямой ангиографии при сдавлении крупных сосудов и подозрении на инвазию в них опухолей нижней полой вены, опухолей брюшного отдела аорты и ее ветвей, внутрисосудистого опухолевого или кровяного тромба [8,9,18,24-26].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 4).
Комментарии: ангиография может выполняться в специализированных онкологических учреждениях.
• Рекомендуется гистологическое исследование удаленного препарата с указанием степени злокачественности, степени патоморфоза (если проводилась предоперационная ЛТ или химиотерапия) с целью определения дальнейшей тактики лечения [103].
Уровень убедительности рекомендаций - В (уровень достоверности доказательств - 3).
• Рекомендуется включать в дифференциальный диагноз органные опухоли забрюшинной и тазовой локализации (опухоли почки, надпочечников, поджелудочной железы, неэпителиальные опухоли желудка, прямой кишки, опухоли матки, яичников) [6-13, 25-28].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 4).
Комментарии: наиболее важно исключить лимфопролиферативное поражение забрюшинных лимфатических узлов либо метастазы герминогенных опухолей в забрюшинных лимфатических узлах у пациентов молодого возраста, а также метастазы иных эпителиальных опухолей в забрюшинных лимфатических узлах.
3. Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
Назначение лекарственных препаратов, указанных в клинических рекомендациях, направлено на обеспечение пациента клинически эффективной и безопасной медицинской помощью, в связи с чем их применение в конкретной клинической ситуации определяется соответствующей инструкцией и требует соблюдения описанных в инструкции мер предосторожности; также возможна коррекция доз в зависимости от состояния пациента.
• Пациентам с ЗНС рекомендуется в качестве основного метода лечения выполнение хирургического вмешательства с целью радикального удаления опухоли [1, 6, 7, 9, 14, 16-18,29-31].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 4).
• Пациентам с ЗНС рекомендуется проведение мультидисциплинарного консилиума в составе врача-хирурга, врача-онколога, врача-радиотерапевта для выработки плана лечения [19].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
3.1. Хирургическое лечение
Особенностью клинического течения ЗНС является частое местное рецидивирование и редкое отдаленное метастазирование. Цель хирургического лечения - полное (en Ыос) удаление опухоли с резекцией (удалением) органов, явно вовлеченных в опухолевый процесс [29]. Необходимо стремиться к удалению опухоли в капсуле. Наиболее часто удаляются ободочная кишка и почка [6]. С помощью визуализационных методов диагностики не всегда возможно достоверно оценить степень вовлеченности прилежащих органов в опухолевый процесс, поэтому необходимо тщательно взвешивать потенциальный риск и пользу от комбинированных операций [7]. Резекция смежных органов «заранее» (upfront) теоретически повышает радикализм, однако усложняет оперативное вмешательство и ведет к большему количеству осложнений. Особенно важно оценить целесообразность резекции крупных сосудов и нервов, головки поджелудочной железы, почки и мочеточников, прямой кишки. Признаком нерезектабельности ЗНС является, как правило, муфтообразное вовлечение брыжеечных сосудов (артерии и/или вены). В то же время тесное прилежание к сосуду не всегда свидетельствует об опухолевой инвазии. Удаление тазовых опухолей является непростой задачей и требует участия хирургов смежных специальностей.
Хирургическое лечение рецидива ЗНС - сложная проблема онкохирургии. Спаечный процесс затрудняет оценку истинной распространенности процесса. Локорегионарный рецидив следует оперировать по принципам удаления первичной опухоли. Мультифокальный рецидив (особенно с распространением в другие анатомические зоны) свидетельствует, как правило, о быстром прогрессировании процесса, при котором мультивисцеральные резекции не повышают радикализм операции [1,6, 7,9,14,16-18, 29-31].
• Рекомендуется пациентам с лейомиосаркомой нижней полой вены проводить операцию в объеме удаления опухоли в пределах здоровых тканей и обеспечения адекватного кровотока по нижней полой вене и ее висцеральным притокам (почечным и печеночным венам). При необходимости рекомендуется применять элементы сосудистой пластики, включая протезирование сосуда [15].
3.2. Лучевая терапия
Высокая частота рецидивов опухоли, относительно низкая частота отдаленных метастазов оправдывают применение ЛТ в комбинированном лечении ЗНС. Роль ЛТ в лечении забрюшинных сарком по-прежнему четко не определена. ЛТ в комбинации с хирургическим удалением опухоли применяется в пред- и послеоперационном периодах [63-65].
• Предоперационная ЛТ может быть рекомендована пациентам с операбельными и условно-операбельными ЗНС с целью:
• снижения злокачественного потенциала опухоли за счет гибели анаплазированных, хорошо оксигенированных, наиболее радиочувствительных клеток и изменения биологических свойств клеток, сохранивших жизнеспособность после потенциально летальных повреждений;
• тотального повреждения субклинических очагов опухоли;
• уменьшения объема, отграничения, купирования воспаления и отека вокруг опухоли;
• снижения биологической активности опухоли, уменьшения риска развития локальных рецидивов, имплантационных и отдаленных метастазов;
• создания более благоприятных условий для оперативного вмешательства, а именно уменьшения общего объема опухоли, что позволяет в ряде случаев перевести ее из неоперабельного состояния в операбельное, а также выполнить органосохраняющую операцию [63, 64,66];
• уменьшения перифокального отека;
• формирования вокруг опухоли «ложной капсулы»; более четкого отграничения опухоли от окружающих здоровых тканей.
Уровень убедительности рекомендаций - А (уровень достоверности доказательств - 3).
Комментарии: преимущество предоперационной ЛТ заключается в том, что она может привести к сокращению размеров новообразования, а также повысить резектабельность опухоли и радикализм оперативного вмешательства; возможно точное определение GTV благодаря визуализации опухолевого узла [65]. Уменьшение опухоли в результате проведения ЛТ потенциально может облегчить проведение хирургического лечения; сам массив опухолевой ткани оттесняет здоровые ткани от области, получающей максимальную очаговую дозу, и тем самым снижает токсичность [63-65]; на момент проведения неоадъювантной ЛТ опухоль лучше оксигенирована, что увеличивает эффективность лечения, может снизить риск отсева опухолевых клеток по брюшине или соседним анатомическим областям во время хирургического этапа, исключается длительный перерыв в лечении из-за послеоперационных осложнений.
• При подготовке лечебного плана рекомендуется определять следующие облучаемые объемы:
GTV (gross tumor volume) - определяемый объем опухоли: собственно опухоль;
CTV (clinical tumor volume) - область клинического распространения опухоли: GTV + отступ шириной 2-3 см за исключением фасций, костей, воздуха;
PTV (planned treatment volume) - облучаемый объем с учетом погрешностей укладки: CTV + отступ шириной 0,5-1,0 см [67, 69].
При облучении по методике 3D CRT используются переднезадние и косые поля.
• Рекомендовано проведение конформной ЛТ по методике IMRT всем пациентам при условии соответствующей технической оснащенности отделения [66]. Орган риска -тонкий кишечник. Разовая очаговая доза (РОД) составляет 1,8-2,0 Гр, суммарная очаговая доза (СОД) - 45,0-50,4 Гр.
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 4).
• При локализации опухоли в верхних отделах брюшной полости рекомендуется лечение под контролем дыхательных движений [63].
• Послеоперационная ЛТ рекомендуется для снижения количества жизнеспособных опухолевых клеток и, как следствие, уменьшения вероятности возникновения рецидивов. Облучаемый объем обычно больше, нежели при предоперационной ЛТ.
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 4).
• Рекомендовано клипирование области высокого риска локального рецидива или R1-, 112-краев резекции [103].
Уровень убедительности рекомендаций - А (уровень достоверности доказательств - 2).
• Рекомендовано определять CTV с помощью предоперационных диагностических изображений путем совмещения в программе планирования изодозного распределения.
• Целесообразно дополнительное подведение «буста» при остаточной опухоли или R1-, R2-резекциях: СОД 16-18 Гр на зоны микроскопического распространения заболевания, СОД 20-26 Гр при наличии остаточной опухоли [31,67, 68].
• Рекомендовано проведение ЛТ до СОД 45,0-50,4 Гр с применением интегрированного «буста» до СОД 57,5 Гр за 25 фракций на область высокого риска рецидива по методике IMRT [31,67,68,103].
Уровень убедительности рекомендаций - В (уровень достоверности доказательств - 2).
• Рекомендуется при лечении ЗНС ранних стадий с низким потенциалом злокачественности проведение послеоперационной дистанционной ЛТ по методике 3D CRT или IMRT на ложе удаленной опухоли. Отступ от краев 2-3 см, РОД 1,8-2,0 Гр, СОД 45,0-50,4 Гр. При наличии признаков опухоли в крае резекции СОД 65-70 Гр [67,103].
Уровень убедительности рекомендаций - А (уровень достоверности доказательств - 2).
• Рекомендуется при лечении ЗНС ранних стадий с высоким потенциалом злокачественности проведение послеоперационной дистанционной ЛТ по методике 3D CRT или IMRT на ложе удаленной опухоли. Отступ от краев опухоли 5 см, РОД 1,8-2,0 Гр, СОД 45,0-50,4 Гр, далее локальное облучение ложа опухоли до СОД 60 Гр. При положительном крае резекции СОД 70 Гр [70,106].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 4).
3.3. Лекарственное лечение
3.3.1. Лекарственное лечение резектабельных забрюшинных неорганных сарком
Отдельных проспективных рандомизированных исследований, касающихся оценки роли химиотерапии у пациентов с резектабельными ЗНС, не проводилось. Представлены данные работ, оценивающих эффективность режимов лечения при саркомах мягких тканей (СМТ), и их подгрупповых анализов. •
• При резектабельных ЗНС является предпочтительным обсуждение тактики лечения в ходе мультидисциплинарного консилиума с участием врача-хирурга, врача-радиотерапевта и врача-онколога[92-94].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• После решения консилиума рекомендуется проведение неоадъювантной химиотерапии при резектабельных ЗНС высокой степени злокачественности, потенциально чувствительных к химиотерапии (миксоидная липосаркома, плеоморфная липосаркома, синовиальная саркома) [36,92].
Уровень убедительности рекомендаций - А (уровень достоверности доказательств - 2).
• После решения консилиума рекомендуется проведение адъювантной химиотерапии при хирургическом лечении в объеме R0-R1 ЗНС высокой степени злокачественности, потенциально чувствительных к химиотерапии (миксоидная липосаркома, плеоморфная липосаркома, синовиальная саркома) [104-106,113].
Уровень убедительности рекомендаций - А (уровень достоверности доказательств - 1).
• Рекомендуется начать адъювантную XT в течение 4-6 нед при отсутствии тяжелых осложнений и после нормализации клинико-лабораторных показателей. Продолжительность адъювантной XT составляет 6 курсов [96].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 2).
• Рекомендуется использовать для неоадъювантной и адъювантной химиотерапии комбинацию доксорубицин• ** + ифосфамид** в разных дозоинтервальных вариантах. Монотерапия доксорубицином** является менее предпочтительной [36,37, 96,114].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 2).
3.5.2. Лекарственное лечение нерезектабельных и диссеминированных забрюшинных неорганных сарком
• Рекомендуется проведение системной химиотерапии при нерезектабельных и диссеминированных ЗНС, потенциально чувствительных к лекарственному лечению [19].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
3.5.2.1. Лекарственная терапия 1-й линии
Забрюишнные саркомы - гетерогенная группа новообразований, характеризующаяся как специфическими молекулярно-генетическими особенностями, так и различной чувствительностью к химиотерапии. Единичные работы оценивают результаты химиотерапии у пациентов с ЗНС. Представленные данные экстраполированы из исследований, оценивающих эффективность химиотерапии при СМТ.
• В 1-й линии лечения пациентов с ЗНС G2-G3 рекомендуется назначение режимов на основе доксорубицина** [38,39].
Уровень убедительности рекомендаций - В (уровень достоверности доказательств - 2).
• При выборе режима химиотерапии необходимо учитывать общее состояние пациента, токсический профиль режима и количество и тяжесть сопутствующих заболеваний.
• Пациентам с оценкой по шкале ECOG 0-1 балл и с чувствительными к химиотерапии подтипами ЗНС рекомендуется назначение доксорубицина** в комбинации с ифосфамидом** (схемы AI или HD AI, см. табл. 4) [43,44].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• Режим HD AI (см. табл. 4) рекомендуется пациентам в общем удовлетворительном состоянии (0 баллов по шкале ECOG), без клинически значимых сопутствующих заболеваний, без нарушения функции внутренних органов. Обязательным условием является возможность еженедельного мониторинга побочных эффектов и своевременное назначение сопроводительной терапии [43].
Уровень убедительности рекомендаций - А (уровень достоверности доказательств - 2).
Комментарии: в исследование III фазы по сравнению доксорубицина** в дозе 75 мг/м2 и комбинации доксорубицина** в дозе 75 мг/м2 с ифосфамидом** в дозе 10 г/м2 было включено 228 пациентов с местно-распространенными и диссеминированными СМТ. Медиана ВВП была выше в группе пациентов, получавших комбинацию препаратов (7,4 мес), чем в группе пациентов, получавших только доксорубицин (4,6 мес) (отношение шансов (ОШ) 0,74; 95 % доверительный интервал (ДИ) 0,60-0,90, р = 0,003). Непосредственная эффективность также была выше при использовании комбинации препаратов, чем при монорежиме (60 и 31 %), ОВ была выше в группе HD AI, но различия не достигали порога статистической значимости (14,3 и 12,8 мес) (ОШ 0,83; 95 % ДИ 0,67-1,03, р = 0,076) [7,43,44].
• Рекомендуется назначение режима GemTax (см. табл. 4) при лейомиосаркомах G2-G3 в 1-й линии терапии [42,46].
• Рекомендуется рассмотреть возможность назначения комбинации доксорубицина** с дакарбазином** (схема ADIC, см. табл. 4) в 1 -й линии лечения при лейомиосаркомах G2-G3 при наличии противопоказаний к применению режима GemTax [41].
Уровень убедительности рекомендаций - В (уровень достоверности доказательств - 3).
• Рекомендуется проводить монохимиотерапию доксорубицином** при наличии противопоказаний к применению комбинированного режима [59,60].
Уровень убедительности рекомендаций - В (уровень достоверности доказательств - 3).
• Применение пазопаниба** в 1-й линии лечения рекомендуется при химиорезистентных гистологических типах (альвеолярной и светлоклеточной СМТ, солитарной фиброзной опухоли/гемангиоэндотелиоме) (см. табл. 4) [47].
Уровень убедительности рекомендаций - А (уровень достоверности доказательств - 2).
• При общем состоянии, оцениваемом в 3 балла по шкале ECOG, наличии тяжелых сопутствующих заболеваний рекомендуется симптоматическая терапия [19,97].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
3.3.2.2. Лекарственная терапия 2-й и последующих линий
• Рекомендуется проведение химиотерапии 2-й линии пациентам с оценкой по шкале ECOG 0-2 балла. При отсутствии противопоказаний возможно применение комбинированных режимов [115-117].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 4).
Комментарии: выбор режима при метастатической ЗНС зависит в первую очередь от состояния пациента и гистологического подтипа опухоли [97].
• Ифосфамид** в монорежиме рекомендуется при дедифференцированной липосаркоме, синовиальной саркоме и злокачественной опухоли из оболочек периферических нервов (см. табл. 4) [36, 39, 88, 89, 97].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 4).
• У пациентов с синовиальной саркомой, состояние которых оценено по шкале ECOG в 0 баллов, рекомендуется рассмотреть возможность назначения ифосфамида в режиме HD I. Обязательным условием является проведение еженедельного мониторинга побочных эффектов и своевременное назначение сопроводительной терапии [39,89,117].
Уровень убедительности рекомендаций - В (уровень достоверности доказательств - 3).
• Трабектедин** во 2-й и последующих линиях терапии может быть рекомендован для лечения лейомиосарком, липосарком и синовиальной саркомы (см. табл. 4) [50,51,111].
Уровень убедительности рекомендаций - А (уровень достоверности доказательств - 2).
Комментарии: в исследовании II фазы изучалась эффективность трабектедина в дозе 1,5 мг/м2 в качестве 24-часовой инфузии у пациентов с нерезектабельной диссеминированной СМТ после прогрессирования на фоне применения ифосфамида** и доксорубицина**. При медиане наблюдения 34 мес частота объективного ответа достигла 8,1 % (частичный ответ был зарегистрирован у пациентов с лейомиосаркомой (56 %), синовиальной саркомой (61 %), липосаркомой (40 %) и злокачественной фиброзной гистиоцитомой (83 %)).
В исследование II фазы были включены только пациенты с липо- и лейомиосаркомами. Они были рандомизированы на 2 группы с разными режимами введения трабектедина: в 1-й группе проводилась 24-часовая непрерывная инфузия в дозе 1,5 мг/м2 раз в 3 нед, во 2-й группе еженедельно проводилась 3-часовая инфузия в дозе 0,58 мг/м2 на протяжении 3 нед подряд с 2-недельным интервалом. Медиана ВВП была статистически значимо выше в группе 24-часовой инфузии (3,7 мес), чем в группе еженедельных 3-часовых инфузий (2,3 мес) (р = 0,0302, ОШ 0,0734; 95 % ДИ 0,554-0,970, р = 0,0028). Однолетняя выживаемость достигла 60 % при 24-часовом введении и 50 % при 3-часовом введении (р = 0,09), но значимых различий в медианах ОВ достигнуто не было (13,9 и 11,8 мес, ОШ 0,843; 95 % ДИ 0,635-1,090, р = 0,192) [50,51].
• Эрибулин** рекомендован пациентам с липосаркомами, если ранее они получали терапию дакарбазином** (см. табл. 4) [61,98,99].
Уровень убедительности рекомендаций - А (уровень достоверности доказательств - 2).
Комментарии: в рандомизированное исследование III фазы были включены пациенты с нерезектабельной или метастатической липосаркомой или лейомиосаркомой, получившие как минимум 2 линии терапии, одна из которых была на основе антрациклинов. Пациентам 1-й группы вводили эрибулин** (1,4 мг/м2 в 1-й и 8-й дни) каждые 3 нед, пациентам 2-й группы - дакарбазин** (850 мг/м2,1200 мг/м2 в 1-й день) каждые 3 нед. Медиана ОВ в группе эрибулина** достигла 13,5 мес, в группе дакарбазина** - 11,3 мес (ОШ 0,75; 95 % ДИ 0,61-0,94, р = 0,011). При анализе установлено, что у пациентов с липосаркомой терапия эрибулином** позволяет достигнуть медианы ОВ в 15,6 мес, при назначении дакарбазина** - 8,4 мес (ОШ 0,51; 95 % ДИ 0,35-0,75). Аналогичное преимущество выявлено в отношении медианы ВВП (2,9 и 1,7 мес) (ОШ 0,52; 95 % ДИ 0,35-0,78). При подгрупповом анализе у пациентов с лейомиосаркомой различий в медианах ОВ и ВВП выявлено не было [61].
• Пазопаниб**[1] рекомендован паттиентам с ЗНС. за исключением липосарком. при условии контроля эффективности через 2 мес приема (см. табл. 41 [47]t
Уровень убедительности рекомендаций - В (уровень достоверности доказательств - 21.
Комментарии: в рандомизированном исследовании III фазы PALETTE пациентам с диссеминированной СМТ после прогрессирования на фоне стандартного лечения был назначен пазопаниб**в дозе 800 мг/сут ежедневно либо плацебо. Выявлено статистически значимое увеличение медианы ВВП в группе пазопаниба** по сравнению с группой плацебо (4,6 и 1,6 мес соответственно, ОШ 0,31; 95 % ДИ 0,24-0,40, р < 0,0001). Тем не менее статистически значимого преимущества в медиане ОВ получено не было - 12,5 и 10,7 мес соответственно (ОШ 0,86; 95 % ДИ 0,67-1,11, р = 0,25). Факторами неблагоприятного прогноза в отношении ВВП оказались оценка по шкале ECOG 1 балл (р = 0,03), проведение 2 и более предшествующих линий полихимиотерапии (р = 0,04), Grade 3 (р = 0,004).
• Рекомендуется пациентам с лейомиосаркомой, дедифференцированной плеоморфной саркомой и оценкой по шкале ECOG 0 баллов назначать #гемцитабин** в комбинации с доцетакселом** или дакарбазином* *(см. табл. 4) [52,53].
Уровень убедительности рекомендаций - А (уровень достоверности доказательств - 2).
• Пациентам с оценкой по шкале ECOG 2 балла рекомендуется монохимиотерапия дакарбазином** (см. табл. 4) [52,53].
Уровень убедительности рекомендаций - В (уровень достоверности доказательств - 2).
Комментарии: в рандомизированном исследовании II фазы по сравнению режима GemTax и монотерапии гемцитабином** у пациентов с диссеминированной" СМТ (п = 122) было продемонстрировано преимущество комбинированного режима: медианы ВВП и ОВ составили 3,0 и 11,5 мес в группе монотерапии и 6,2 и 17,9 мес в группе GemTax. Необходимо обратить внимание на высокую гематологическую токсичность: анемия III степени наблюдалась у 13 % пациентов в группе гемцитабина и у 7 % пациентов в группе GemTax, тромбоцитопения III—IV степени - у 35 и 40 %, фебрильная нейтропения - у 7 и 5 % (несмотря на профилактическое введение гранулоцитарного колониестимулирующего фактора). При подгрупповом анализе выявлена максимальную активность комбинации при лейомиосаркоме, дедифференцированной плеоморфной саркоме [52,53].
• Палбониклиб**[2] рекомендуется пациентам с высокодифференцированными и лелифференпированными липосаркомами в 3-й и послелуюших линиях терапии 1см. табл. 4) [54].
Уровень убедительности рекомендаций - В (Уровень достоверности доказательств - 31.
Комментарии: -палбониклиб** является обратимым пероральным ингибитором никлинзависимых киназ 4 и 6 1CDK4/6). В исследовании II фазы было показано, что назначение -палбониклиба** пациентам с высокодифференцированными и недифференцированными липосаркомами позволяет достигнуть 12-недельной ВБП в 66 % случаев при медиане ВБП 18 нед [54].
• #Паклитаксел** рекомендован пациентам с ангиосаркомой, ранее получавшим терапию на основе антрациклинов (см. табл. 4) [55].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 4).
• #Гемцитабин** рекомендован в 3-й и последующих линиях лечения ангиосарком (см. табл. 4) [56].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 4).
Таблица 4. Рекомендуемые режимы химиотерапии при лечении пациентов с саркомами мягких тканей
• Рекомендуется использование #эверолимуса** в дозе 10 мг в лечении неоперабельных злокачественных периваскулярных эпителиоидно-клеточных опухолей.
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 4).
Комментарии: исследования показали, что ингибиторы mTOR нормализуют клеточную пролиферацию и ангиогенез. В ретроспективных исследованиях ингибиторов mTOR выявлен эффект в виде стабилизации. У ряда пациентов достигнут частичный ответ (режим см. в табл. 4) [57,62].
• Рекомендуется использовать #сунитиниб** в дозе 37,5 мг ежедневно или #сорафениб** в дозе 400 мг 2 раза в день в лечении диссеминированной или неоперабельной светлоклеточной СМТ [109,110].
3.4 Сопроводительная терапия
3.4.1 Обезболивающая терапия
Принципы обезболивания и оптимального выбора противоболевой терапии у пациентов с ЗНС с хроническим болевым синдромом соответствуют принципам обезболивания, изложенным в клинических рекомендациях «Хронический болевой синдром у взрослых пациентов, нуждающихся в паллиативной медицинской помощи».
3.4.2. Лечение осложнений и симптоматическая терапия
Принципы лечения и профилактики тошноты и рвоты у пациентов с ЗНС соответствуют принципам, изложенным в методических рекомендациях «Профилактика и лечение тошноты и рвоты» (Владимирова Л.Ю., Гладков О.А., Когония Л.М., Королева И.А., Семиглазова Т.Ю.
Принципы профилактики и лечения инфекционных осложнений и фебрильной нейтропении у пациентов с ЗНС соответствуют принципам, изложенным в методических рекомендациях «Лечение инфекционных осложнений фебрильной нейтропении и назначение колониестимулирующих факторов» (Сакаева Д.Д., Орлова Р.В., Шабаева М.М. DOI: 10.18027/2224-5057-2018-8-3s2-521-530,
3.5. Диетотерапия
К настоящему моменту не получены сколько-нибудь надежные сведения о влиянии пищевого поведения на риск развития ЗНС, а также на риск рецидива или прогрессирования этого заболевания у лиц с уже установленным диагнозом. В связи с этим не рекомендованы какие-либо изменения привычного рациона пациентов, если только они не продиктованы необходимостью коррекции коморбидных состояний, купирования или профилактики осложнений лечения (хирургического, лекарственного или лучевого).
Возможно назначение пациентам с G1 при химиорезистентных гистотипах (альвеолярная и светлоклеточная СМТ, солитарная фиброзная опухоль/гемангиоэнд отели ома).
Возможно назначение пациентам с липосаркомами G1.
4. Медицинская реабилитация, медицинские показания и противопоказания к применению методов реабилитации
В настоящее время эффективность большинства методов медицинской реабилитации пациентов с ЗНС не изучена в клинических исследованиях. Нижеследующие рекомендации даны на основании того, что во многих исследованиях, а также в метаанализах (Steffens D. et al., 2018 и др.) и систематических обзорах (Stout N.L. et al., 2017; Segal R. et al., 2017 и др.) продемонстрировано, что различные виды медицинской реабилитации значительно ускоряют функциональное восстановление, сокращают сроки пребывания в стационаре после операции и снижают частоту развития осложнений и летальных исходов у пациентов с другими злокачественными новообразованиями.
4.1. Предреабилитация
• Рекомендуется всем пациентам с ЗНС проведение предреабилитации в целях ускорения функционального восстановления, сокращения сроков пребывания в стационаре после операции, снижения частоты развития осложнений и летальных исходов на фоне лечения ЗНС. Предреабилитация включает ЛФК, психологическую и нутритивную поддержку, информирование пациентов [70].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• Рекомендуется советовать пациенту увеличить физическую активность за 2 нед до операции для сокращения длительности пребывания в стационаре и снижения риска развития послеоперационных осложнений, а также повышения качества жизни в послеоперационном периоде [71].
4.2. Реабилитация при хирургическом лечении
4.2.1. Первый этап реабилитации
• Рекомендуется мультидисциплинарный подход при проведении реабилитации пациентов с ЗНС, который предполагает включение двигательной реабилитации, психологической поддержки, занятий со специалистами (инструкторами) по трудовой терапии [72].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
4.2.2. Второй этап реабилитации
• Рекомендуется при возникновении лимфедемы проводить полную противоотечную терапию, включающую мануальный лимфодренаж (медицинский массаж нижней или верхней конечности), ношение компрессионного трикотажа, выполнение комплекса ЛФК, уход за кожей [73].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
4.2.5. Третий этап реабилитации
• Рекомендуется выполнение и постепенное расширение комплекса ЛФК с включением аэробной нагрузки, что улучшает результаты комбинированного лечения злокачественных новообразований и качество жизни, особенно в случаях нарушения функции конечностей [74].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 3).
• Рекомендован медицинский массаж для улучшения качества жизни, уменьшения болевого синдрома, слабости, тревоги [75].
4.3. Реабилитация при химиотерапии
• Рекомендуется раннее начало физических нагрузок на фоне химиотерапии, что способствует профилактике мышечной слабости, гипотрофии, снижения толерантности к физической нагрузке [76].
Уровень убедительности рекомендаций - В (уровень достоверности доказательств - 2).
• Рекомендуется аэробная нагрузка на фоне химиотерапии, поскольку она повышает уровень гемоглобина, эритроцитов и снижает длительность лейко- и тромбоцитопении, а также повышает вероятность завершить запланированный курс химиотерапии [77, 78].
Уровень убедительности рекомендаций - В (уровень достоверности доказательств - 2).
Комментарий: рекомендация дана на основании результатов систематических обзоров
Stout N.L. et al. (2017) и Segal R. et al. (2017), в которых изучено влияние физических упражнений на пациентов с другими злокачественными новообразованиями.
• Рекомендуются занятия ЛФК на фоне химиотерапии, которые позволяют уменьшить выраженность слабости и депрессии. Сочетание ЛФК с психологической поддержкой в коррекции слабости и депрессии на фоне химиотерапии более эффективно, чем только медикаментозная коррекция [79].
Уровень убедительности рекомендаций - А (уровень достоверности доказательств - 1).
4.4. Реабилитация при лучевой терапии
• Рекомендуются комплексные занятия ЛФК (сочетание аэробных и силовых нагрузок) на фоне ЛТ, что позволяет снизить выраженность мышечной слабости и улучшить качество жизни у на фоне ЛТ [80].
Уровень убедительности рекомендаций - А (уровень достоверности доказательств - 1).
4.5. Принципы психологической реабилитации
• Рекомендуется добиваться комбинированного эффекта совладающего поведения и принимаемой социальной поддержки, что приводит к меньшему количеству навязчивых и избегающих мыслей до лечения и обеспечивает лучшую психологическую адаптацию пациента через 1 мес после лечения [81].
Уровень убедительности рекомендаций - В (уровень достоверности доказательств - 3).
• Рекомендуются пациентам психообразовательные мероприятия (информирование о способах самодиагностики патологических психических реакций, способах совладания со стрессом, необходимости отслеживания взаимовлияния психических реакций и физического состояния) и психологическая поддержка, которые могут рассматриваться как основной механизм трансформации стрессовых событий в личный опыт, способствующий социальной и психической адаптации в условиях заболевания и лечения [82].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
5. Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
На сегодняшний день нет единого мнения относительно частоты и длительности наблюдения за пациентами с ЗНС. Целями наблюдения следует считать раннее выявление рецидива заболевания, а также психосоциальную поддержку пациентов.
• Рекомендуется для обследования пациентов с ЗНС проводить КТ органов брюшной полости и малого таза каждые 3-6 мес в течение 2-3 лет, затем каждые 6 мес до 5 лет. Дальнейшая частота обследования определяется индивидуально [19].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Организация оказания медицинской помощи
Медицинская помощь, за исключением медицинской помощи в рамках клинической апробации, в соответствии с федеральным законом от 21.11.2011 № 323-ФЗ (ред. от 25.05.2019) «Об основах охраны здоровья граждан в Российской Федерации» организуется и оказывается:
1. в соответствии с положением об организации оказания медицинской помощи по видам медицинской помощи, которое утверждается уполномоченным федеральным органом исполнительной власти;
2. в соответствии с порядком оказания помощи по профилю «онкология», обязательным для исполнения на территории Российской Федерации всеми медицинскими организациями;
3. на основе настоящих клинических рекомендаций;
4. с учетом стандартов медицинской помощи, утвержденных уполномоченным федеральным органом исполнительной власти.
Первичная специализированная медико-санитарная помощь оказывается врачом-онкологом и иными врачами-специалистами в центре амбулаторной онкологической помощи либо в первичном онкологическом кабинете, первичном онкологическом отделении, поликлиническом отделении онкологического диспансера.
При подозрении на ЗНС или ее выявлении врачи-терапевты, врачи-терапевты участковые, врачи общей практики (семейные врачи), врачи-специалисты, средние медицинские работники в установленном порядке направляют пациента на консультацию в центр амбулаторной онкологической помощи либо в первичный онкологический кабинет, первичное онкологическое отделение медицинской организации для оказания ему первичной специализированной медико-санитарной помощи.
Консультация в центре амбулаторной онкологической помощи либо в первичном онкологическом кабинете, первичном онкологическом отделении медицинской организации должна быть проведена не позднее 5 рабочих дней с даты выдачи направления на консультацию. Врач-онколог центра амбулаторной онкологической помощи (в случае отсутствия центра амбулаторной онкологической помощи врач-онколог первичного онкологического кабинета или первичного онкологического отделения) организует взятие биопсийного (операционного) материала, а также выполнение иных диагностических исследований, необходимых для установления диагноза, включая распространенность онкологического процесса и стадию заболевания.
В случае невозможности взятия в медицинской организации, в составе которой организован центр амбулаторной онкологической помощи (первичный онкологический кабинет, первичное онкологическое отделение), биопсийного (операционного) материала, проведения иных диагностических исследований пациент направляется лечащим врачом в онкологический диспансер или в медицинскую организацию, оказывающую медицинскую помощь пациентам с онкологическими заболеваниями.
Срок выполнения патологоанатомических исследований, необходимых для гистологической верификации злокачественного новообразования, не должен превышать 15 рабочих дней с даты поступления биопсийного (операционного) материала в патологоанатомическое бюро (отделение).
При подозрении на ЗНС или ее выявлении в ходе оказания скорой медицинской помощи пациентов переводят или направляют в медицинские организации, оказывающие медицинскую помощь пациентам с онкологическими заболеваниями, для определения тактики ведения и необходимости применения дополнительно других методов специализированного противоопухолевого лечения.
Врач-онколог центра амбулаторной онкологической помощи (первичного онкологического кабинета, первичного онкологического отделения) направляет пациента в онкологический диспансер или в медицинские организации, оказывающие медицинскую помощь пациентам с онкологическими заболеваниями, для уточнения диагноза (в случае невозможности установления диагноза, включая распространенность онкологического процесса и стадию заболевания, врачом-онкологом центра амбулаторной онкологической помощи, первичного онкологического кабинета или первичного онкологического отделения) и оказания специализированной, в том числе высокотехнологичной, медицинской помощи.
Срок начала оказания специализированной, за исключением высокотехнологичной, медицинской помощи пациентам с онкологическими заболеваниями в медицинской организации, оказывающей медицинскую помощь пациентам с онкологическими заболеваниями, не должен превышать 14 календарных дней с даты гистологической верификации злокачественного новообразования или 14 календарных дней с даты установления предварительного диагноза злокачественного новообразования (в случае отсутствия медицинских показаний к проведению патолого-анатомических исследований в амбулаторных условиях).
Специализированная, в том числе высокотехнологичная, медицинская помощь оказывается врачами-онкологами, врачами-радиотерапевтами в онкологическом диспансере или в медицинских организациях, оказывающих медицинскую помощь пациентам с онкологическими заболеваниями, имеющих лицензию, необходимую материально-техническую базу, сертифицированных специалистов, в стационарных условиях и условиях дневного стационара и включает профилактику, диагностику, лечение онкологических заболеваний, требующих использования специальных методов и сложных уникальных медицинских технологий, а также медицинскую реабилитацию.
В медицинской организации, оказывающей медицинскую помощь пациентам с онкологическими заболеваниями, тактика медицинского обследования и лечения устанавливается консилиумом в составе врачей-онкологов и врачей-радиотерапевтов с привлечением при необходимости других врачей-специалистов. Решение консилиума оформляется в виде протокола, подписывается членами консилиума и вносится в медицинскую документацию пациента.
Показания к госпитализации в круглосуточный или дневной стационар медицинской организации, оказывающей специализированную, в том числе высокотехнологичную, медицинскую помощь по профилю «онкология», определяются консилиумом в составе врачей-онкологов и врачей-радиотерапевтов с привлечением при необходимости других врачей-специалистов.
Показаниями к госпитализации в медицинскую организацию в плановой форме являются:
1. необходимость выполнения сложных интервенционных диагностических медицинских вмешательств, требующих последующего наблюдения в условиях круглосуточного или дневного стационара;
2. наличие показаний к специализированному противоопухолевому лечению (хирургическому вмешательству, ЛТ, в том числе контактной, дистанционной и другим видам ЛТ, лекарственной терапии и др.), требующему наблюдения в условиях круглосуточного или дневного стационара.
Показаниями к выписке пациента из медицинской организации являются:
1. завершение курса лечения или одного из этапов оказания специализированной, в том числе высокотехнологичной, медицинской помощи в условиях круглосуточного или дневного стационара при условии отсутствия осложнений лечения, требующих медикаментозной коррекции и/или медицинских вмешательств в стационарных условиях;
2. отказ пациента или его законного представителя от специализированной, в том числе высокотехнологичной, медицинской помощи в условиях круглосуточного или дневного стационара, установленной консилиумом медицинской организации, оказывающей онкологическую помощь, при условии отсутствия осложнений основного заболевания и/ или лечения, требующих медикаментозной коррекции и/или медицинских вмешательств в стационарных условиях;
3. необходимость перевода пациента в другую медицинскую организацию по соответствующему профилю оказания медицинской помощи. Заключение о целесообразности перевода пациента в профильную медицинскую организацию выносится после предварительной консультации по представленным медицинским документам и/или данным предварительного осмотра пациента врачами-специалистами медицинской организации, в которую планируется перевод.
Показания к направлению пациента в другую медицинскую организацию:
1. исполнение клинических рекомендаций призвано максимально повысить качество оказываемой пациентам медицинской помощи в различных клинических ситуациях. Если в медицинской организации отсутствует возможность оказания медицинской помощи в рекомендуемом объеме (например, отсутствует возможность проведения биопсии сторожевого лимфатического узла), рекомендуется задействовать систему маршрутизации пациента в другие медицинские организации, в том числе за пределы субъекта федерации, в том числе в федеральные центры, имеющие соответствующее оснащение и кадры;
2. клинические рекомендации не позволяют описать все многообразие реальной клинической практики и охватывают лишь наиболее частые и типовые клинические ситуации. Если практикующий врач или медицинская организация сталкивается с клинической ситуацией, не описанной в настоящих клинических рекомендациях (нетипичное течение болезни, необходимость начала противоопухолевой терапии при выявлении противопоказаний к ней, прогрессирование на фоне рекомендуемых видов лечения и т. д.), рекомендуется воспользоваться системой телемедицинских консультаций или системой маршрутизации в национальные медицинские исследовательские центры для уточнения тактики лечения;
3. выявление или обострение сопутствующей патологии, не относящейся к профилю онкологического учреждения, которая препятствует проведению того или иного этапа лечения (например, острый инфаркт миокарда, острое нарушение мозгового кровообращения и др.) требует маршрутизации в профильные медицинские организации.
6. Организация оказания медицинской помощи
Факторами прогноза при ЗНС являются гистологический тип опухоли, степень злокачественности, стадия, радикализм операции.Критерии оценки качества специализированной медицинской помощи взрослым пациентам при раке почки указаны в табл. 6.
7. Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния)
Критерии оценки качества медицинской помощи
Таблица 6. Критерии оценки качества медицинской помощи при раке почки
Список литературы
1. Bautista N., Su W., 0"Connell T.X. Retroperitoneal soft-tissue sarcomas: prognosis and treatment of primary and recurrent disease. Am Surg 2000;66:832-6.
2. WHO Classification of Tumours of Soft Tissue and Bone 4th edition. Lyon: IARS, 2013.
3. Trojani M., Contesso G., Coindre J.M. et al. Soft-tissue sarcomas of adults; study of pathological prognostic variables and definition of a pathological grading system. Int J Cancer 1984;33:37-42.
4. Душников Е.Ф. Лечебный патоморфоз злокачественных новообразований человека. Обнинск, 2016.
5. Макроскопическое исследование биопсийного и операционного материала: руководство для патологоанатомов. Под ред. Ю.А. Криволапова. М.: Практическая медицина, 2019.
6. Стилиди И.С., Неред С.Н., Болотский В.И., Огородникова Е.В. Результаты радикальных и паллиативных хирургических вмешательств при забрюшинных неорганных липосаркомах. Паллиативная медицина и реабилитация 2011 ;(2):9—12.
7. Стилиди И.С., Никулин М.П., Давыдов М.М. и др. «Нефросохранные» операции в лечении больных неорганными забрюшинными опухолям. Анналы хирургии 2014;(3):47—52.
8. Стилиди И.С., Цвелодуб С.Б., Матвеев В.Б. и др. Хирургическое лечение больных с лейомиосаркомой нижней полой вены. Анналы хирургии 2013;(5):41—8.
9. Клименков А.А., Рубина Е.И. Неорганные забрюшинные опухоли: основные принципы диагностики и хирургической тактики. Практическая онкология 2004;5(4):285-90.
10. An J.Y., Нео J.S., Noh J.H. et al. Primary malignant retroperitoneal tumors: analysis of a single institutional experience. Eur J Surg Oncol 2007;33(3):376-82.
11. Неред C.H., Стилиди И.С., Клименков А.А. и др. Клинико-морфологические особенности и результаты хирургического лечения забрюшинных неорганных липосарком. Вопросы онкологии 2012;58(1):94—100.
12. Меликов С.А. Современные методы диагностики и лечения нейрогенных опухолей забрюшинного пространства. Русский медицинский журнал 2012;(2, прил.):47-56.
13. Бугаев В.Е., Никулин М.П., Меликов С.А. Особенности диагностики и хирургического лечения больных забрюшиными шванномами. Современная онкология 2017;19(4):28—35.
14. Trans-Atlantic RPS Working Group. Management of primary retroperitoneal sarcoma (RPS) in the adult: a consensus approach from the Trans-Atlantic RPS Working Group. Ann Surg Oncol 2015;22:256-63.
15. Цвелодуб C.B., Стилиди И.С. Лейомиосаркома нижней полой вены: обзор литературы. Часть I. Анналы хирургии 2013;1:5-9.
16. Gronchi A., Strauss D.C., Miceli R. et al. Variability in patterns of recur- rence after resection of primary retroperitoneal sarcoma (RPS): a report on 1007 patients from the multi-institutional collaborative RPS Working Group. Ann Surg 2016;263:1002-9.
17. Lewis J.J., Leung D., Woodruff J.M., Brennan M.F. Retroperitoneal soft-tissue sarcoma: analysis of 500 patients treated and followed at a single institution. Ann Surg 1998;228:355-65.
18. Стилиди И.С., Никулин М.П., Рубина Е.И. и др. Опыт хирургического лечения больных с неорганными забрюшинными саркомами с инвазией подвздошных артерий. Анналы хирургии 2012;(6):31—7.
19. Casali Р. G., Abecassis N., Bauer S. et al. Soft tissue and visceral sarcomas: ESMO-EURACAN Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2018;29(Suppl 4):iv51-67.
20. Вашакмадзе Л.А., Черемисов В.В., Хомяков В.М. Современные аспекты клиники, диагностики и лечения неорганных опухолей забрюшинного пространства. Онкохирургия 2011;3(1):44-54.
21. Какиашвили Н.Н. Методы лучевой диагностики в оптимизации диагностической и хирургической тактики при неорганных забрюшинных опухолях. Автореф. дис. ... канд. мед. наук. М., 2008.
22. Hull М.А., Niemierko A., Haynes А.В. et al. Post-operative renal function following nephrectomy as part of enbloc resection of retroperitoneal sarcoma (RPS). J Surg Oncol 2015;112:98-102.
23. Кит О.И., Максимова Н.А., Агаркова Е.И., Ильченко M.F.. Применение комплексной ультразвуковой диагностики и динамической реносцинтиграфии у пациентов с опухолевым поражением почки в предоперационном периоде при планировании хирургического лечения. Современные проблемы науки и образования 2015;(6):200.
24. Стилиди И.С., Абгарян М.Г., Калинин А.Е., Бердников С.Н. Хирургическое лечение больных лейомиосаркомой нижней полой вены. Хирургия. Журнал им. Н.И. Пирогова
25. Стилиди И.С., Абгарян М.Г., Никулин М.П. и др. Ангиопластика в хирургическом лечении больных забрюшинными неорганными саркомами. Хирургия 2017;(5):14—8.
26. Стилиди И.С., Абгарян М.П., Бохян В.Ю. и др. Резекция и протезирование бифуркации аорты по поводу забрюшинной гломусной опухоли. Онкология. Журнал им. П.А.Герцена 2017 ;(1):53—6.
27. Давыдов М.М. Стратегия хирургии внеорганных сарком торакоабдоминальной локализации. Автореф. дис.... д-ра мед. наук. М., 2015.48 с.
28. Бугаев В.Е., Никулин М.П., Петросян А.П. и др. Хирургическое лечение пациентов с забрюшинными шванномами. Вестник РОНЦ 2018;29:9-14.
29. Gronchi A., Miceli R., Colombo С. et al. Frontline extended surgery is associated with improved survival in retroperitoneal low-tointermediate-grade soft tissue sarcomas. Ann Oncol 2012;23:1067-73.
30. Bonvalot S., Rivoire M., Castaing M. et al. Primary retroperitoneal sarcomas: a multivariate analysis of surgical factors associated with local control. J Clin Oncol 2009;27:31-7.
31. Trans-Atlantic RPS Working Group. Management of primary retroperitoneal sarcoma in the adult: a consensus approach from the Trans-Atlantic RPS Working Group. Ann Surg Oncol 2015;22:255-61.
32. Von Mehren M., Randall R.L., Benjamin R.S. et al. Soft tissue sarcoma, Version 2.2018, NCCN clinical practice guidelines in oncology. J Natl Cornpr Cane Netw 2018;16(5):536-63.
33. Каприн А.Д., Рябов А.Б., Хомяков B.M. и др. Резекция нижней полой вены при местнораспространенных неорганных забрюшинных опухолях. Онкология. Журнал им. П.А. Еерцена 2017;6(1):28-38.
34. MacNeill A.J., Miceli R., Strauss D.C. et al. Post-relapse outcomes after primary extended resection of retroperitoneal sarcoma: a report from the Trans-Atlantic RPS Working Group. Cancer 2017;123:1971-78.
35. Palassini E., Ferrari S., Verderio P. et al. Feasibility of preoperative chemotherapy with or without radiation therapy in localized soft tissue sarcomas of limbs and superficial trunk in the Italian Sarcoma Group/Grupo Espanol de Investigacion en Sarcomas randomized clinical trial: three versus five cycles of full-dose epirubicin plus ifosfamide. J Clin Oncol 2015;33:3628-34.
36. Gronchi A., Ferrari S., Ouagliuolo V. et al. Histotype-tailored neoadjuvant chemotherapy versus standard chemotherapy in patients with high-risk soft-tissue sarcomas (ISG-STS 1001): an international, open-label, andomized, controlled, phase 3, andomized trial. Lancet Oncol 2017;18:812-22.
37. Frustaci S., Gherlinzoni F., De Paoli A. et al. Adjuvant chemotherapy for adult soft tissue sarcomas of the extremities and girdles: results of the Italian randomized cooperative trial. J Clin Oncol 2001;19:1238-47.
38. Lorigan P., Verweij J., Papai Z. et al. Phase III trial of two investigational schedules of ifosfamide compared with standard-dose doxorubicin in advanced or metastatic soft tissue sarcoma: a European Organisation for Research and Treatment of Cancer Soft Tissue and Bone Sarcoma Group Study. J Clin Oncol 2007;25(21):3144-50.
39. Patel S.R., Vadhan-Raj S., Papadopolous N. et al. High-dose ifosfamide in bone and soft tissue sarcomas: results of phase II and pilot studies - dose-response and schedule dependence. J Clin Oncol 1997;15(6):2378-84.
40. Nielsen O.S., Dombernowsky P., Mouridsen H. et al. Epirubicin is not superior to doxorubicin in the treatment of advanced soft tissue sarcomas. The experience of the EORTC Soft Tissue and Bone Sarcoma Group. Sarcoma 2000;4(l-2):31-5.
41. Zalupski M., Metch B., Balcerzak S. et al. Phase III comparison of doxorubicin and dacarbazine given by bolus versus infusionin patients with soft-tissue sarcomas: a Southwest Oncology Group Study. J Natl Cancer Inst 1991 ;83(13):926—32.
42. Hensley M.L., Maki R., Venkatraman E. et al. Gemcitabine and docetaxel in patients with unresectable leiomyosarcoma: resultsof a phase II trial. J Clin Oncol 2002;20(12):2824-31.
43. Judson I., Verweij J., Gelderblom H. et al. Doxorubicin alone versus intensified doxorubicin plus ifosfamide for first-line treatment of advanced or metastatic soft-tissue sarcoma: a randomised controlled phase 3 trial. Lancet Oncol 2014;15(4):415-23.
44. Worden F.P., Taylor J.M.G., Biermann J.S. et al. Randomized phase II evaluation of 6 g/m2 of ifosfamide plus doxorubicin and granulocyte colony-stimulating factor (G-CSF) compared with 12 g/m2 of ifosfamide plus doxorubicin and G-CSF in the treatment of poor-prognosis soft tissue sarcoma. J Clin Oncol 2005;23(1):105-12.
45. Noujaim J., Constantinidou A., Messiou C. et al. Successful ifosfamide rechallenge in soft-tissue sarcoma. Am J Clin Oncol 2015;41(2);147-51.
46. Seddon B.M., Whelan J., Strauss S.J. et al. GeDDiS: a prospective random controlled phase III trial of gemcitabine and docetaxel compared with doxorubicin as first-line treatment in previously untreated advanced unresectable or metastatic soft tissue sarcomas (EudraCT 2009-014907-29). J Clin Oncol 2015;33(Suppl 15):10500.
47. Van der Graaf W.T., Blay J.Y., Chawla S.P. et al. Pazopanib for metastatic soft-tissue sarcoma (PALETTE): a randomized, double-blind, placebo- controlled phase 3 trial. Lancet 2012;379:1879-86.
48. Le Cesne A., Antoine E., Spielnrann M. et al. High-dose ifosfamide: circumvention of resistance to standard-dose ifosfamide in advanced soft tissue sarcomas. J Clin Oncol 1995;13:1600-8.
49. Martin-Liberal J., Alarn S., Constantinidou A. et al. Clinical activity and tolerability of a 14-day infusional ifosfamide schedule in soft-tissue sarcoma. Sarcoma 2013;2013:868973.
50. Denretri G.D., Chawla S.P., von Mehren M. et al. Efficacy and safety of trabectedin in patients with advanced or metastatic liposarconra or leiomyosarcoma after failure of prior anthracyclines and ifosfamide: results of a randomized phase II study of two different schedules. J Clin Oncol 2009;27:4188-96.
51. Denretri G.D., von Mehren M., Jones R.L. et al. Efficacy and safety of trabectedin or dacarbazine for metastatic liposarconra or leiomyosarcoma after failure of conventional chemotherapy: results of a phase III randomized multicenter clinical trial. J Clin Oncol 2016;34:786-93.
52. Maki R.G., Wathen J.K., Patel S.R. et al. Randomized phase II study of gemcitabine and docetaxel compared with gemcitabine alone in patients with metastatic soft tissue sarcomas: results of sarcoma alliance for research through collaboration study 002. J Clin Oncol 2007;25:2755-63.
53. Garcia-Del-Muro X., Lopez-Pousa A., Maurel J. et al.; Spanish Group for Research on Sarcomas. Randomized phase II study comparing gemcitabine plus dacarbazine versus dacarbazine alone in patients with previously treated soft tissue sarcoma: a Spanish Group for Research on Sarcomas study. J Clin Oncol 2011;29(18):2528-33.
54. Dickson M.A., Schwartz G.K., Keohan M.L. et al. Progression-free survival among patients with well-differentiated or dedifferentiated liposarconra treated with CDK4 inhibitor palbociclib: a phase 2 clinical trial. JAMA Oncol 2016;2(7):937-40.
55. Penel N., Bui B.N., Bay J.-O. et al. Phase II trial of weekly paclitaxel for unresectable angiosarcoma: the ANGIOTAX Study. J Clin Oncol 2008;26(32):5269-74.
56. Stacchiotti S., Palassini E., Sanfilippo R. et al. Gemcitabine in advanced angiosarcoma: a retrospective case series analysis from the Italian Rare Cancer Network. Ann Oncol 2012;23(2):501-8.
57. Wagner A.J., Malinowska-Kolodziej I., Morgan J.A. et al. Clinical activity of nrTOR inhibition with sirolinrus in malignant perivascular epithelioid cell tumors: targeting the pathogenic activation of nrTORCl in tumors. J Clin Oncol 2010;28(5):835-40.
58. Переводчикова Н.И. Руководство по химиотерапии опухолевых заболеваний. 2-е изд., доп. и перераб. М., 2005.
59. Benjamin R.S., Wiernik Р.Н., Bachur N.R. Adrianrycin: a new effective agent in the therapy of disseminated sarcomas. Med Pediatr Oncol 1975;1(1):63—76.
60. Borden E.C., Amato D.A., Rosenbaum C. et al. Randomized comparison of three adrianrycin regimens for metastatic soft tissue sarcomas. J Clin Oncol 1987;5(6):840-50.
61. Schoffski P., Chawla S., Maki R.G. et al. Eribulin versus dacarbazine in previously treated patients with advanced liposarconra or leiomyosarcoma: a randomised, open-label, multicentre, phase 3 trial. Lancet 2016;387:1629-37.
62. Gennatas C., Michalaki V., Kairi P.V. et al. Successful treatment with the nrTOR inhibitor everolinrus in a patient with perivascular epithelioid cell tumor. World J Surg Oncol 2012;10:181.
63. Treatment guidelines for preoperative radiation therapy for retroperitoneal sarcoma: preliminary consensus of an international expert panel. Int J Radiation Oncol Biol Phys 2015;92(3):602-12.
64. Baldini E.H., Bosch W., Kane J.M. 3rd et al. Retroperitoneal sarcoma (RPS) high risk gross tumor volume boost (HR GTV boost) contour delineation agreement among NRG sarcoma radiation and surgical oncologists. Ann Surg Oncol 2015;22:2846-52.
65. Tuan J., Vitolo V., Vischioni B. et al. Radiation therapy for retroperitoneal sarcoma. Radiol Med 2014;119(10):790-802.
66. Cosper P., Olsen J., De Wees T. et al. Intensity-modulated radiation therapy and surgery for Management of Retroperitoneal Sarcomas: a single-institute experience. Radial Oncol 2017;12:198.
67. Tzeng C.W., Fiveash J.B., Popple R.A. et al. Preoperative radiation therapy with selective dose escalation to the margin at risk for retroperitoneal sarcoma. Cancer 2006;107:371-9.
68. Musat E., Kantor G., Caron J. et al. Comparison of intensity-modulated postoperative radiotherapy with conventional postoperative radiotherapy for retroperitoneal sarcoma. Cancer Radiother 2004;8:255-61.
69. Swanson E.L., Indelicato D.J., Louis D. et al. Comparison of three-dimensional (3D) conformal proton radiotherapy (RT), 3D conformal photon RT, and intensity-modulated RT for retroperitoneal and intra-abdominal sarcomas. Int J Radiat Oncol Biol Phys 2012;83(5):1549-57.
70. Silver J.K., Bairna J. Cancer prehabilitation: an opportunity to decrease treatment-related morbidity, increase cancer treatment options, and improve physical and psychological health outcomes. Am J Phys Med Rehabil 2013;92(8):715-27.
71. Nilsson H., Angeras U., Bock D. et al. Is preoperative physical activity related to post-surgery recovery? A cohort study of patients with breast cancer. BMJ Open 2016;6(l):e007997.
72. Siegel G.W., Biernrann J.S., Chugh R. et al. The multidisciplinary management of bone and soft tissue sarcoma: an essential organizational framework. J Multidiscip Healthc 2015;8:109-15.
73. The diagnosis and treatment of lymphedema. Position Statement of the National Lymphedema Network Committee. NMA 2011:1-19.
74. Segal R., Zwaal C., Green E. et al. Exercise for people with cancer: a systematic review. Curr Oncol 2017;24(4):e290-315.
75. Boyd C., Crawford C., Paat C.F. et al. the impact of massage therapy on function in pain populations-a systematic review and nreta-analysis of randomized controlled trials: Part II, cancer pain populations. Pain Med 2016;17(8):1553-68.
76. Stout N.L., Bairna J., Swisher A.K. et al. A systematic review of exercise systematic reviews in the cancer literature (2005-2017). PM R 2017;9(9S2):S347-84.
77. Hu M., Lin W. Effects of exercise training on red blood cell production: implications for anemia. Acta Haematol 2012;127(3):156-64.
78. Bland K.A., Zadravec K., Landry T. et al. Impact of exercise on chemotherapy completion rate: A systematic review of the evidence and recommendations for future exercise oncology research. Crit Rev Oncol Henratol 2019;136:79-85.
79. Mustian K.M., Alfano C.M., Heckler C. et al. Comparison of pharmaceutical, psychological, and exercise treatments for cancer-related fatigue: a nreta-analysis. JAMA Oncol 2017;3(7):961-8.
80. Kessels E., Husson O., van der Feltz-Cornelis C.M. The effect of exercise on cancer-related fatigue in cancer survivors: a systematic review and nreta-analysis. Neuropsychiatr Dis Treat 2018;14:479-94.
81. Devine D., Parker P.A., Fouladi R.T., Cohen L. The association between social support, intrusive thoughts, avoidance, and adjustment following an experimental cancer treatment. Psychooncology 2003;12(5):453-62.
82. Беляев A.M., Чулкова B.A., Семиглазова Т.Ю., Рогачев М.В. Онкопсихология для врачей-онкологов и медицинских психологов. Руководство. СПб.: Любавич, 2017.
83. Gamboa А.С., Ethun C.G, Switchenko J. M et al. Lung surveillance strategy for high-grade soft tissue sarcomas: chest X-rayor CT scan? J Am Coll Surg 2019;229(5):449-57.
84. Edmonson J.H., Ryan L.M., Blum R.H. et al. Randomized comparison of doxorubicin alone versus ifosfamide plus doxorubicin or mitomycin, doxorubicin, and cisplatin against advanced soft tissue sarcomas. J Clin Oncol 1993;11:1269-75.
85. Adjuvant chemotherapy for localized resectable soft-tissue sarcoma of adults: nreta-analysis of individual data. Sarcoma Meta-analysis Collaboration. Lancet 1997;350:1647-54.
86. Pervaiz N., Colterjohn N., Farrokhyar F. et al. A systematic nreta-analysis of randomized controlled trials of adjuvant chemotherapy for localized resectable soft-tissue sarcoma. Cancer 2008;113:573-81.
87. Edmonson J., Ryan L., Blum R. et al. Randomized comparison of doxorubicin alone versus ifosfamide plus doxorubicin or mitomycin, doxorubicin, and cisplatin against advanced soft tissue sarcomas. J Clin Oncol 1993;11:1269-75.
88. Benjamin R.S., Legha S.S., Patel S.R., Nicaise C. Single-agent ifosfamide studies in sarcomas of soft tissue and bone: the M.D. Anderson experience. Cancer Chenrother Pharmacol 1993;31(Suppl 2):S174-9.
89. Le Cesne A., Antoine E., Spielnrann M. et al. High-dose ifosfamide: circumvention of resistance to standard-dose ifosfamide in advanced soft tissue sarcomas. J Clin Oncol 1995;13:1600-8.
90. Еорбунова B.A., Феденко A.A., Истомин И.А. и др. Высокодозный ифосфамид в комбинации с доксорубицином в лечении сарком мягких тканей. Саркомы костей, мягких тканей и опухоли кожи 2010;(1):26—31.
91. Ravi V., Patel S., Benjamin R.S. Chemotherapy for soft-tissue sarcomas. Oncology (Williston Park) 2015;29(l):43-50.
92. Trans-Atlantic RPS Working Group. Management of primary retroperitoneal sarcoma (RPS) in the adult: a consensus approach from the Trans-Atlantic RPS Working Group. Ann Surg Oncol 2015;22(l):256e63.
93. Grobmyer S.R., Wilson J.P., Apel B. et al. Recurrent retroperitoneal sarcoma: impact of biology and therapy on outcomes. J Am Coll Surg 2010;210:602-8.
94. Gronchi A., Miceli R., Allard M.A. et al. Personalizing the approach to retroperitoneal soft tissue sarcoma: histology-specific patterns of failure and post-relapse outcome after primary extended resection. Ann Surg Oncol 2015;22(5):1447-54.
95. Pervaiz N., Colterjohn N., Farrokhyar F. et al. A systematic nreta-analysis of randomized controlled trials of adjuvant chemotherapy for localized resectable soft-tissue sarcoma. Cancer 2008;113:573-81.
96. Woll P.J., Reichardt P., Le Cesne A. et al. Adjuvant chemotherapy with doxorubicin, ifosfamide, and lenograstim for resected soft- tissue sarcoma (EORTC 62931): a multicentre randomised controlled trial. Lancet Oncol 2012;13:1045-54.
97. Ahlen J., Ahuja N., Albertsnreier M. Management of metastatic retroperitoneal sarcoma: a consensus approach from the Trans-Atlantic Retroperitoneal Sarcoma Working Group (TARPSWG). Ann Oncol 2018;29:857-71.
98. Schoffski P., Ray-Coquard I.L., Cioffi A. et al. Activity of eribulin mesylate in patients with soft-tissue sarcoma: a phase 2 study in four independent histological subtypes. Lancet Oncology 2011;12(11): 1045-52.
99. Chawla S. Subtype specific activity in liposarcoma (LPS) patients (pts) from a phase 3, open label, randomised study of eribulin (ER1) versus dacarbazine (DT1C) in patients with advanced LPS and leiomyosarcoma (LMS). In: American Society for Clinical Oncology Annual Meeting 2016; Abstract 11037.
100. Gennatas C., Michalaki V., Kairi P.V. et al. Successful treatment with the nrTOR inhibitor everolinrus in a patient with Perivascular epithelioid cell tumor World J Surg Oncol 2012;10:181.
101. Karnofsky D.A., Burchenal J.H. The clinical evaluation of chemotherapeutic agents in cancer. In: Evaluation of chemotherapeutic agents. Ed. by C. MacLeod New York: Columbia University Press, 1949. Pp. 191-205.
102. Oken M.M., Creech R.H., Tornrey D.C. et al. Toxicity and response criteria of the Eastern Cooperative Oncology Group. Am J Clin Oncol 1982;5(6):649—55.
103. NCCN Guidelines Version 2.2020. Soft Tissue Sarcoma.
104. Datta J., Ecker B.L., Neuwirth M.G. et al. Contemporary reappraisal of the efficacy of adjuvant chemotherapy in resected retroperitoneal sarcoma: evidence from a nationwide clinical oncology database and review of the literature. Surg Oncol 2017;26(2): 117—24.
105. Miura J.T., Charlson J., Gamblin T.C. et al. Impact of chemotherapy on survival in surgically resected retroperitoneal sarcoma. Eur J Surg Oncol 2015;41(10):1386-92.
106. Pervaiz N., Colterjohn N., Farrokhyar F. et al. A systematic nretaanalysis of randomized controlled trials of adjuvant chemotherapy for localized resectable soft-tissue sarcoma. Cancer 2008;113:573-81.
107. Brenrjit P.J., Jones R.L., Chai X. et al. A contemporary large single-institution evaluation of resected retroperitoneal sarcoma. Ann Surg Oncol 2013;21:2150-8.
108. Davis E.J., Chugh R., Zhao L. et al. A randomised, open-label, phase 11 study of neo/adjuvant doxorubicin and ifosfamide versus gemcitabine and docetaxel in patients with localised, high-risk, soft tissue sarcoma. Eur J Cancer 2015;51(13):1794—802.
109. Stacchiotti S., Grosso F., Negri T. et al. Tumor response to sunitinib nralate observed in clear-cell sarcoma. Ann Oncol 2010;21:1130-1.
110. Mir O., Boudou-Rouquette P., Larousserie F. et al. Objective response to sorafenib in advanced clear-cell sarcoma. Ann Oncol 2012;23:807-9.
111. Martin-Broto J., Pousa A.L., de Las Penas R. et al. Randomized phase ii study of trabectedin and doxorubicin compared with doxorubicin alone as first-line treatment in patients with advanced soft tissue sarcomas: a Spanish Group for Research on Sarcoma Study. J Clin Oncol 2016;34:2294-302.
112. D'Anrbrosio L., Touati N., Blay J.Y. Doxorubicin plus dacarbazine, doxorubicin plus ifosfamide, or doxorubicin alone as a first-line treatment for advanced leiomyosarcoma: a propensity score matching analysis from the European Organization for Research and Treatment of Cancer Soft Tissue and Bone Sarcoma Group. Cancer 2020;126(ll):2637-47.
113. Soft tissue and visceral sarcomas: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. ESMO/European Sarcoma Network Working Group. Ann Oncol 2014;25 Suppl
3:Ш102-12.
114. Pervaiz N., Colterjohn N., Farrokhyar F. et al. A systematic meta-analysis of randomized controlled trials of adjuvant chemotherapy for localized resectable soft-tissue sarcoma. Cancer 2008;113(3):573-81.
115. Van Winkle P., Angiolillo A., Krailo M. et al. Ifosfamide, carboplatin, and etoposide (ICE) reinduction chemotherapy in a large cohort of children and adolescents with recurrent/refractory sarcoma: the Children"s Cancer Group (CCG) experience. Pediatr Blood Cancer 2005;44(4):338-47.
116. Minchom A., Jones R.L., Fisher S. et al. Clinical benefit of second-line palliative chemotherapy in advanced soft-tissue sarcoma. Sarcoma 2010;2010:264360.
117. Lee S.H., Chang M.H., Baek K.K. et al. High-dose ifosfamide as second- or third-line chemotherapy in refractory bone and soft tissue sarcoma patients. Oncology 2011 ;80(3—4):257— 61.
118. Руководство по химиотерапии опухолевых заболеваний. Под ред. Н.И. Переводчиковой. 2-е изд., доп. М.: Практическая медицина, 2005. 661 с.
119. Гележе П.В., Морозов С.П., Мандельблат Ю.Э., Либсон Е.И. Современные критерии лучевой диагностики в оценке эффективности специального противоопухолевого лечения. Российский онкологический журнал 2014;(3):39—45.
Приложение А1. Состав рабочей группы по разработке и пересмотру клинических рекомендаций
1. Стилиди И.С., д.м.н., чл.-корр. РАН, профессор, директор ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Министерства здравоохранения России, заведующий отделением абдоминальной онкологии НИИ КО им. Н.Н. Трапезникова ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
2. Неред С.Н., д.м.н., ведущий научный сотрудник хирургического отделения № 6 абдоминальной онкологии торакоабдоминального отдела НИИ клинической онкологии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
3. Никулин М.П., к.м.н., старший научный сотрудник хирургического отделения № 6 абдоминальной онкологии торакоабдоминального отдела НИИ клинической онкологии им. Н.Н. Трапезникова ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
4. Абгарян М.Г., к.м.н., старший научный сотрудник хирургического отделения № 6 абдоминальной онкологии торакоабдоминального отдела НИИ клинической онкологии им. Н.Н. Трапезникова ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
5. Архири П.П., врач-хирург хирургического отделения № 6 абдоминальной онкологии торакоабдоминального отдела НИИ клинической онкологии им. Н.Н. Трапезникова ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
6. Шаленков В.А., к.м.н., научный сотрудник хирургического отделения № 6 абдоминальной онкологии торакоабдоминального отдела НИИ клинической онкологии им. Н.Н. Трапезникова ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
7. Калинин А.Е., к.м.н., старший научный сотрудник хирургического отделения № 6 абдоминальной онкологии торакоабдоминального отдела НИИ клинической онкологии им. Н.Н. Трапезникова ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
8. Меликов С.А., к.м.н., старший научный сотрудник хирургического отделения № 6 абдоминальной онкологии торакоабдоминального отдела НИИ клинической онкологии им. Н.Н. Трапезникова ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
9. Близнюков О.П., д.м.н., заведующий патологоанатомическим отделением отдела морфологической и молекулярно-генетической диагностики НИИ клинической онкологии им. Н.Н. Трапезникова ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
10. Козлов Н.А., врач-патологоанатом патологоанатомического отделения отдела морфологической и молекулярно-генетической диагностики НИИ клинической онкологии им. Н.Н. Трапезникова ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
11. Мочальникова В.В., врач-патологоанатом патологоанатомического отделения отдела морфологической и молекулярно-генетической диагностики НИИ клинической онкологии им. Н.Н. Трапезникова ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
12. Артамонова Е.В., д.м.н., заведующий онкологическим отделением лекарственных методов лечения (химиотерапевтического) № 1 НИИ клинической онкологии им. Н.Н. Трапезникова ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
13. Титова Т.А., врач-онколог онкологического отделения лекарственных методов лечения (химиотерапевтического) № 1 НИИ клинической онкологии им. Н.Н. Трапезникова ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
14. Любченко Л.Н., д.м.н., доцент кафедры онкологии института клинической медицины ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России, заведующая лабораторией клинической онкогенетики отдела морфологической и молекулярно-генетической диагностики опухолей НИИ клинической онкологии им. Н.Н. Трапезникова ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
15. Иванов С.М., к.м.н., старший ннаучный сотрудник отделения радиотерапии НИИ клинической и экспериментальной радиологии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
16. Романов Д.С., к.м.н., врач-радиотерапевт отделения радиотерапии НИИ клинической и экспериментальной радиологии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
17. Медведева Б.М., д.м.н., ведущий научный сотрудник отделения рентгенодиагностического НИИ клинической и экспериментальной радиологии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
18. Дробот Н.Ц-Д., к.м.н., врач-рентгенолог рентгенодиагностического отделения НИИ клинической и экспериментальной радиологии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
Блок по медицинской реабилитации:
1. Кончугова Т.В., д.м.н., профессор, врач-физиотерапевт, заведующая отделом преформированных физических факторов ФГБУ «НМИЦ реабилитации и курортологии» Минздрава России.
2. Еремушкин М.А., д.м.н., профессор, заведующий отделением ЛФК и клинической биомеханики ФГБУ «НМИЦ реабилитации и курортологии» Минздрава России.
3. Гильмутдинова И.Р., к.м.н., заведующая отделом биомедицинских технологий и лабораторией клеточных технологий, врач-трансфузиолог, дерматовенеролог, специалист в области клеточных технологий ФГБУ «НМИЦ реабилитации и курортологии» Минздрава России.
4. Буланов А.А., д.м.н., старший научный сотрудник отделения клинической фармакологии и химиотерапии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
5. Бутенко А.В., д.м.н., профессор, главный врач НИИ клинической онкологии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, председатель НС «Ассоциация специалистов по онкологической реабилитации».
6. Назаренко А.В., к.м.н., врач высшей квалификационной категории, заведующий отделением радиологии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, член Российской ассоциации терапевтических радиационных онкологов (РАТРО), European Society for Radiotherapy & Oncology (ESTRO), Российско-Американского альянса по изучению рака (ARCA), представитель РФ в МАГАТЭ.
7. Обухова О.А., к.м.н., врач-физиотерапевт, заведующий отделением реабилитации ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, член Европейской ассоциации парентерального и энтерального питания (ESPEN), Российской ассоциации парентерального и энтерального питания (RESPEN).
8. Хуламханова М.М., врач-физиотерапевт, врач-онколог отделения реабилитации ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
9. Ткаченко Г.А., психолог отделения реабилитации ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
10. Петрова Т.А., логопед-педагог отделения реабилитации ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
11. Семиглазова Т.Ю., д.м.н., ведущий научный сотрудник научного отдела инновационных методов терапевтической онкологии и реабилитации ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России, доцент кафедры онкологии ФГБОУ ВО «СЗГМУ им. И.И. Мечникова» Минздрава России.
12. Пономаренко Г.Н., д.м.н., профессор, заслуженный деятель науки РФ, генеральный директор ФГБУ «ФНЦРИ им. Г.А. Альбрехта» Минтруда России, заведующий кафедрой курортологии и физиотерапии ФГБВОУ ВО «Военно-медицинская академия им. С.М. Кирова» Минобороны России.
13. Ковлен Д.В., д.м.н., доцент кафедры курортологии и физиотерапии ФГБВОУ ВО «Военномедицинская академия им. С.М. Кирова» Минобороны России.
14. Каспаров Б.С., к.м.н., заместитель главного врача по амбулаторной помощи заведующий клинико-диагностическим отделением ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России.
15. Крутов А.А., врач-онколог клинико-диагностического отделения ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России.
16. Зернова М.А., инструктор-методист по ЛФК ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России.
17. Кондратьева К.О., медицинский психолог ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России.
18. Иванова Г.Е., д.м.н., главный специалист по медицинской реабилитации Минздрава России, заведующая отделом медико-социальной реабилитации инсульта НИИ ЦВПиИ ФГБОУ ВО «РНИМУ им. Н.И. Пирогова» Минздрава России.
19. Романов А.И., д.м.н., профессор, академик РАН, главный врач ФГБУ «Центр реабилитации» Управления делами Президента РФ.
20. Филоненко Е.В., д.м.н., профессор, заведующая центром лазерной и фотодинамической диагностики и терапии опухолей МНИОИ им. П.А. Герцена - филиала ФГБУ «НМИЦ радиологии» Минздрава России, врач-онколог.
21. Степанова А.М., заместитель директора по науке, заведующая отделением реабилитации частного многопрофильного диагностического и реабилитационного центра «Восстановление».
Блок по организации медицинской помощи
1. Невольских А.А., д.м.н., профессор, заместитель директора по лечебной работе МРНЦ им. А.Ф. Цыба - филиала ФГБУ «НМИЦ радиологии» Минздрава России.
2. Хайлова Ж.В., к.м.н., главный врач клиники МРНЦ им. А.Ф. Цыба - филиала ФГБУ «НМИЦ радиологии» Минздрава России.
3. Иванов С.А., профессор РАН, д.м.н., директор МРНЦ им. А.Ф. Цыба - филиала ФГБУ «НМИЦ радиологии» Минздрава России.
4. Геворкян Т.Г., заместитель директора НИИ КЭР ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
Приложение А2. Методология разработки клинических рекомендации
Целевая аудитория данных клинических рекомендаций:
• врачи-онкологи;
• врачи-хирурги;
• врачи-радиологи;
• врачи-патологоанатомы;
• студенты медицинских вузов, ординаторы и аспиранты.
Порядок обновления клинических рекомендаций
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию - не реже чем 1 раз в 3 года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, при наличии обоснованных дополнений/замечаний к ранее утвержденным клиническим рекомендациям, но не чаще 1 раза в 6 мес.
Шкала оценки уровней достоверности доказательств для методов диагностики (диагностических вмешательств)
Приложение Б. Алгоритмы действий врача
Приложение В. Информация для пациента
Рекомендации при осложнениях химиотерапии
При осложнениях химиотерапии необходимо связаться с врачом-онкологом (врачом-химиотерапевтом).
1. При повышении температуры тела до 38 °С и выше начать прием антибиотиков в соответствии с назначением врача- онколога.
2. При стоматите:
• диета - механически, термически щадящая;
• часто (каждый час) полоскать рот отварами ромашки, коры дуба, шалфея, смазывать десны облепиховым (персиковым) маслом;
• обрабатывать полость рта по рекоменлаттии врача-онколога.
3. При диарее:
• диета: исключить жирное, острое, копченое, сладкое, молочное, клетчатку. Можно употреблять нежирное мясо, мучное, кисломолочное, рисовый отвар. Обильное питье;
• принимать лекарственные препараты в соответствии с назначением врача-онколога.
4. При тошноте принимать лекарственные препараты в соответствии с назначением врача-онколога.
Приложение П-Ш. Шкалы оценки, вопросники и другие оценочные инструменты состояния пациента, приведенные в клинических рекомендациях
Приложение Г1. Шкала оценки тяжести состояния пациента по версии B03/EC0G (Всемирной организации здравоохранения и Восточной объединенной онкологической группы)
Название на русском языке: Шкала оценки тяжести состояния пациента по версии B03/EC0G
Оригинальное название: The Eastern Cooperative Oncology Group/World Health Organization Performance Status (ECOG/WHO PS)
Источник (официальный сайт разработчиков, публикация с валидацией): [102,118] Тип: шкала оценки
Назначение: описать уровень функционирования пациента с точки зрения его способности заботиться о себе, повседневной активности и физических способностях (ходьба, работа и т. Д-)-
Содержание:
Приложение Г2. Шкала Карновского
Название на русском языке: Шкала Карновского Оригинальное название (если есть): Karnofsky Performance Status
Источник (официальный сайт разработчиков, публикация с валидацией): [101,118] Тип: шкала оценки
Назначение: описать уровень функционирования пациента с точки зрения его способности заботиться о себе, повседневной активности и физических способностях (ходьба, работа и т. Д-)-
Содержание (шаблон):
Шкала Карновского
100 - Состояние нормальное, жалоб нет
90 - Способен к нормальной деятельности, незначительные симптомы или признаки заболевания
80 - Нормальная активность с усилием, незначительные симптомы или признаки заболевания 70 - Обслуживает себя самостоятельно, не способен к нормальной деятельности или активной работе
60 - Нуждается порой в помощи, но способен сам удовлетворять большую часть своих потребностей
50 - Нуждается в значительной помощи и медицинском обслуживании
Ключ (интерпретация): приведен в самой шкале
Приложение ГЗ. Критерии оценки ответа опухоли на лечение (RECIST 1.1)
Название на русском языке: Критерии оценки ответа опухоли на химиотерапевтическое лечение (RECIST 1.1)
Оригинальное название (если есть): Response evaluation criteria in solid tumors 1.1
Источник (официальный сайт разработчиков, публикация с валидацией): [119]
Оригинальная публикация: Eisenhauer Е.А., Therasse R, Bogaerts J. et al. New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1). Eur J Cancer 2009;45(2):228-47.
Тип: шкала оценки
Назначение: оценка ответа на химиотерапевтическое лечение
Содержание, ключ и шаблон на русском языке представлены в методических рекомендациях № 46 ГБУЗ «Научно-практический центр медицинской радиологии»
40 - Инвалид, нуждается в специальной помощи, в том числе медицинской
30 - Тяжелая инвалидность, показана госпитализация, хотя смерть непосредственно не угрожает
20 - Тяжелый больной. Необходимы госпитализация и активное лечение 10 - Умирающий
0 - Смерть
Теги: саркома
234567 Начало активности (дата): 06.01.2023 23:44:00
234567 Кем создан (ID): 989
234567 Ключевые слова: саркома, клинические рекомендации,саркома мягких тканей, очаговая доза
12354567899
Похожие статьи
Герминогенные опухоли у мужчинРентген на дому 8 495 22 555 6 8
Рак печени (гепатоцеллюлярный)
Гастроинтестинальные стромальные опухоли
Вторичное злокачественное новообразование головного мозга и мозговых оболочек



