 02.06.2022
02.06.2022
Результаты применения интрамедуллярного трансфизарного эластичного армирования у пациентов с тяжелыми формами несовершенного остеогенеза
Коррекция деформаций нижних конечностей и увеличение прочностных свойств костей
Несовершенный остеогенез (НО) представляет группу генетических заболеваний, характеризуемых хрупкостью костной ткани, частыми переломами и деформациям скелета и остеопенией [1-4]. В большинстве случаев НО вызван доминантной мутацией генов, ответственных за синтез коллагена первого типа [2, 3]. Частота встречаемости заболевания колеблется от 1/10000 [4] до 1/20000 новорожденных [5]. Клинико-рентгенологическая классификация Sillence [1] является наиболее используемой в случаях, если не проведено генетическое типирование аномалии. В последующие годы классификация была расширена и добавлены V-VIII типы несовершенного остеогенеза, характеризующиеся тем, что у больных имеется клинико-рентгенологическая картина НО, но тип наследования заболевания - рецессивный [3, 4, 6].Основной задачей ортопедического хирургического лечения деформаций и переломов конечностей у пациентов с НО является поддержание их двигательной активности, автономности, способности к приобретению и развитию моторики, а применяемые методы лечения должны исключать длительные периоды иммобилизации, сопровождающиеся вторичным понижением минеральной плотности костной ткани на фоне уже существующей остеопении [7-18].
Показаниями к оперативным вмешательствам служат угловые деформации нижних конечностей, превышающие 10°-15°, и торсионные деформации в сочетании функциональными ограничениями, ложные суставы, дефекты костей, варусная деформация проксимального отдела бедра (шеечно-диафизарный угол 95° и менее), отсутствие навыков самостоятельной или пассивной вертикализации и ходьбы ввиду частых переломов [4, 6, 19-23].
Использование интрамедуллярных телескопических конструкций является основным способом остеосинтеза при коррекции ортопедической патологии конечностей у детей [20, 24-27]. Одним из видов применяемого телескопического остеосинтеза остается трансфизарный интрамедуллярный остеосинтез эластичными стержнями (sliding Flexible Intramedullary Nailing) [25, 28-30]. Он находит свое применение при остеосинтезе костей с небольшим внешним диаметром, когда костномозговой канал либо частично об-литерирован, либо его рассверливание не позволит достичь достаточного диаметра для введения телескопических стержней [21, 25, 28-30]. К его недостаткам, как и прочих телескопических систем, можно отнести миграцию эластичных стержней, вторичные торсионные смещения костных фрагментов, отсутствие возможности ранней нагрузки на оперированную конечность, что ведет к вторичному остеопорозу и созданию предпосылок к миграции стержней, переломов кости [25, 29, 30].
В данной работе мы представляем результаты собственных исследований по использованию эластичного встречного армирования при лечении ортопедических осложнений у пациентов с тяжелыми формами НО, а также рассматриваем способы и их эффективность в преодолении недостатков этой методики.
МАТЕРИАЛЫ И МЕТОДЫ
В период 2012-2015 годы под нашим наблюдением находилось 29 пациентов с НО, которые проходили оперативное лечение. Для оценки результатов лечения мы отобрали случаи, которые соответствовали критериям включения: производилась коррекция деформаций, укорочений, ложных суставов и дефектов бедренных и/или берцовых костей, использовался метод интрамедуллярного встречного армирования изогнутыми на протяжении эластичными стержнями изолированно или в сочетании с другими способами остеосинтеза, пациенты соответствовали тяжелым формам НО (III, IV, VIII), период наблюдения после завершения лечения составлял не менее 6 месяцев. Мы отобрали 24 пациента, соответствующих вышеуказанным критериям.
Возраст пациентов составил 14,4 ± 2,8 года (от 2 до 46 лет). Пациентов младше 18 лет среди них было 16. В данной группе плановое лечение препаратами бифосфонатов получали лишь 11 человек. Среди них НО III типа имели четверо, IV типа - 16 больных и VIII типа - 1 больной. Только у 7 пациентов тип НО был подтвержден лабораторно, в остальных случаях диагноз был клинико-рентгенологическим. Ранее оперативное лечение получали 7 человек, им выполнялась коррекция деформаций и остеосинтез пластинами с угловой стабильностью (5 человек), либо остеосинтез диафиксирующими спицами или интрамедуллярным ригидным стержнем (2 пациента).
Во всех случаях наблюдались деформации сегментов нижних конечностей более 30 градусов, с отклонением прохождения биомеханической оси нижней конечности более 20 мм от центра коленного сустава. Все пациенты имели многочисленные переломы в анамнезе. В шести случаях на уровне бедренной кости и одном -на уровне большеберцовой кости имелось несращение после корригирующей остеотомии (ложный сустав), и присутствовал материал остеосинтеза (накостная пластина - 5 случаев, интрамедуллярный гвоздь или стержень - 2 случая).
В 14 случаях двигательная активность соответствовала второму уровню (пациент может сделать несколько шагов с посторонней помощью, но не может удерживать собственный вес при опоре на конечности) по опроснику Gillette (Gillette Functional Assessment Questionnaire [31]), в пяти случаях - первому уровню (пациент не может сделать ни одного шага ни при каких условиях), в пяти случаях - третьему уровню (ходит во время сеансов реабилитации, но не при перемещении в помещении, для перемещения требуется посторонняя помощь).
То есть ни в одном случае данной серии до операции пациенты не использовали ходьбу, пусть и со вспомогательными средствами опоры, как основной способ передвижения в повседневной жизни.
Деформации нижних конечностей обусловливали некомфортную позу сидя у всех пациентов. В 22 из 24 случаев присутствовали боли и/или страх переломов и болей при пассивных и активных движениях конечностями.
В общей сложности данным пациентам выполнено 52 оперативных реконструктивных вмешательства, эластичное интрамедуллярное армирование выполнено на 83 сегментах.
Детализация вариантов реконструктивных операций с использованием интрамедуллярных эластичных стержней приведена в таблице 1.
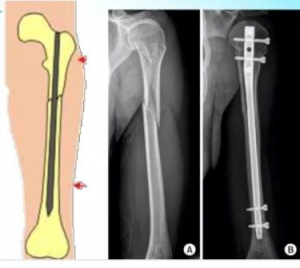
В большинстве случаев (40 операций) были использованы титановые эластичные стержни диаметром от 1,5 до 4 мм в зависимости от диаметра костномозгового канала, в остальных (12 операций) были использованы титановые стержни с биоактивным покрытием диаметром 1,8 и 2 мм. У детей при открытых зонах роста интрамедуллярные стержни вводили трансфизарно навстречу друг другу, чтобы достичь телескопического их расхождения по мере роста сегментов. Для поднадкостничного армирования, которое доказало свою эффективность с точки зрения увеличения толщины кортикальных пластинок [32], применяли сетку из никелида титана марки TN-10 (толщина нити 150 мкм, диаметр ячеек 2-2,5 мм) размером 60 на 80 мм. Сеткой циркулярно оборачивали кость на уровне остеотомии и прилежащих участках на протяжении 6-8 см, предварительно отодвинув надкостницу, края которой потом ушивались или подшивались к сетке в положении максимального перекрытия окружности кости.
Примеры оперативных вмешательств приведены на рисунке 1.
Полученные количественные данные подвергали статистической обработке с использованием программы Microsoft Excel 2016. Статистическое исследование включало описательную статистику: средние значения (М) и стандартное отклонение (5).
РЕЗУЛЬТАТЫ
Во всех случаях требуемая коррекция деформации была достигнута. Консолидация на уровне остеотомии наступала, в среднем, через 26,2 ± 7,8 дня (от 3 до 12 недель) после операции: наблюдалась отчетливая выраженная непрерывная периостальная реакция на уровне остеотомии. С точки зрения появления рентгеновских признаков костного сращения различий при применении изолированного интрамедуллярного армирования либо в сочетании с поднадкостничным армированием и/или остеосинтезом аппаратом Илизарова не наблюдалось.
При коррекции деформаций в сочетании только с интрамедуллярным трансфизарным армированием уверенная вертикализация с полной нагрузкой на оперированную конечность с возможностью передвижения пациента с использованием вспомогательных средств опоры становилась возможной через 5-6 недель после операции, то есть к концу периода иммобилизации гипсовой повязкой или в момент перехода к использованию съемных ортезных изделий (рис. 2).
При использовании изолированного интрамедуллярного армирования после корригирующих остеотомий мы наблюдали развитие вторичных торсионных деформаций в ранний период на 8 сегментах, что потребовало в последующем дополнительной коррекции (рис. 3).
При коррекции деформаций с использованием интрамедуллярного трансфизарного армирования вертикализация с полной нагрузкой на оперированную конечность и началом самостоятельного передвижения пациента при условии использования дополнительных средств опоры (костыли или ходунки) производилась уже с 3-7 дня после операции еще во время госпитализации в ортопедическом отделении (рис. 4). Использование внешней фиксации в минимизированном варианте позволяло предотвратить вторичное торсионное смещение костных фрагментов во всех случаях. Длительность внешнего остеосинтеза при коррекции деформаций была 3-4 недели - до образования первичной костной мозоли, достаточной в условиях интрамедуллярного остеосинтеза для предотвращения ротационных смещений костных фрагментов в дальнейшем.
Использование аппарата внешней фиксации в тех случаях, когда коррекция деформации сочеталась с резекцией зоны ложного сустава, длилось от 3 до 12 недель (31,1 ± 12,7 дня).
В этот период между опорами аппарата Илизарова создавались и поддерживались легкие компрессионные усилия, а вертикализация с полной опорой на оперированную конечность была обязательным условием (рис. 5). Критерием завершения остеосинтеза аппаратом Илизарова являлись признаки появления костной мозоли.
Период наблюдения за пациентами после реконструктивного лечения был от 6 месяцев до 4 лет. Двадцать четыре осложнения отмечены у 8 больных (в 33,3 % случаев). За это время наблюдался рецидив угловых деформаций оперированных сегментов (угол деформации более 10°) у 4 пациентов, вторичные торсионные смещения на 6 сегментах у 4 больных (изолированное использование интрамедуллярного армирования), миграция интрамедуллярных стержней - 5 наблюдений, нерасхождение интрамедуллярных стержней с биоактивным покрытием по мере продольного роста сегмента, обусловленное, вероятно, явлениями остеоинтеграции - 4 наблюдения у 4 детей (во всех случаях это были дети младше 10 лет), переломы армированных сегментов без смещения - 3 случая, замедленная консолидация - 2 случая у пациентов 39 и 46 лет. Коррекция возникших проблем потребовала выполнения 17 незапланированных вмешательств, кроме того, вследствие блокирования интрамедуллярных стержней даже при отсутствии возникновения новых деформаций превентивное введение дополнительных интрамедуллярных элементов потребовалось в трех случаях, еще в трех случаях стержни были заменены по мере роста ребенка.
Таким образом, 23 дополнительных вмешательства были выполнено 20 пациентам, то есть, в среднем, в 83,3 % случаев потребовались незапланированные операции. В данной публикации мы лишь перечисляем встретившиеся проблемы без их детального анализа, чему будет посвящена отдельная работа. Отметим также, что с учетом всех выполненных операций в нашей серии на одного пациента пришлось 3,13 операции на протяжении периода наблюдения.
С точки зрения приобретенных функциональных возможностей вертикализация с опорой на нижние конечности с использованием вспомогательных средств или без них была достигнута в 22 из 24 случаев (91,7 %). Способности пациентов к передвижению, оцененные по шкале Gillette, были представлены первым уровнем в 1 случае (не может сделать шага ни при каких условиях), третьим уровнем (ходит во время сеансов реабилитации, но не при перемещении в помещении, для перемещения требуется посторонняя помощь) - в 3 случаях, четвертным уровнем (способен ходить в домашних условиях, но медленно, не использует ходьбу как предпочтительный способ перемещения в домашних условиях) - в 5 случаях, пятым уровнем (способен пройти более 4,5-15 м дома или в школе, ходьба - основной способ передвижения в домашних условиях) -в 10 случаях, седьмым и восьмым уровнем (перемещается вне дома самостоятельно по ровной поверхности и преодолевает ступеньки и неровности, но требуется минимальная помощь или лишь наблюдение третьих лиц) - в 5 случаях. В целом, двигательная активность пациентов улучшилась в 21 из 24 случаев (87,5 %).
Улучшение условий ухода за пациентом, повышение способностей к самообслуживанию, увеличение социальной активности отмечено во всех случаях. Комфортная поза сидя достигнута у 22 пациентов. Снижение или исчезновение болевого синдрома при движениях нижними конечностями, в том числе во время сеансов ЛФК и при проведении гигиенических процедур, отмечено в 100 % случаев.
ДИСКУССИЯ
Глобальной задачей ортопедического хирургического лечения деформаций и переломов конечностей у пациентов с тяжелыми формами НО является поддержание их двигательной активности, автономности, способности к приобретению и развитию моторики - к сохранению максимально возможного качества жизни при их типе НО. Данная задача - часть мультидисциплинарного лечения, преследующего те же цели [14-18].
Основными средствами остеосинтеза у детей с несовершенным остеогенезом являются интрамедуллярные телескопические конструкции: трансфизарное интрамедуллярное армирование [25, 28-30], телескопический стержень Bailey-Dubow [24] и телескопический стержень Fassier-Duval [28, 33, 34].
Трансфизарный остеосинтез эластичными стержнями имеет ряд положительных свойств: возможность применения при малых диаметрах костномозгового канала или после рассверливания кости при его облитерации, при необходимости - поднадкостничное расположение тонких стержней на уровне диафизар-ного отдела и чрескостное трансфизарное - на уровне метаэпифизов, что позволяет использовать данный остеосинтез у детей в возрасте до года [21, 25, 28-30]. Boutard et Laville сообщают об успешном применении данной методики у 14 пациентов (средний возраст - 4 года, минимальный - 15 дней) с тяжелыми формами НО, где частота выполнения операций составила 2,5 на пациента (варьирование - от 1 до 5) [25]. В работе не указывается на проблемы с расхождением стержней, но их замена на большую длину и диаметр потребовалась в 75 % случаев по мере роста ребенка.
Частота серьезных осложнений для всей серии составляла 25 %: переломы (преимущественно с косой или винтообразной линией перелома диафиза, проходящей между стержнями), миграция имплантов, несращение, укорочение кости вследствие импакции [25, 29, 30]. Телескопический стержень Fassier-Duval считается общепризнанной неригидной телескопической конструкцией, применяемой как при коррекции деформаций длинных трубчатых костей у детей, так и при профилактическом остеосинтезе [21, 33, 34]. Тем не менее, частота осложнений при его использовании составляет 35 % [33]. Существуют общие проблемы применения интрамедуллярных телескопических систем [25, 35, 36]: необходимость замены систем по мере роста ребенка и расхождения частей телескопической системы, наблюдаемая в 10,5-23,7 % случаев миграция стержней или частей конструкции, деформации стержней телескопических систем (до 18,8 % случаев), несращения и расхождение костных отломков (в 7,2 % случаев), нерасхождение частей стержней (в 2,1 % случаев), перелом стержней (6,9 % случаев), переломы на уровне ранее выполненной остеотомии в условиях интрамедуллярного телескопического остеосинтеза стержнем Fassier-Duval (20-25 % случаев). Важно отметить, что изолированное применение интрамедуллярных конструкций предполагает период строгой дополнительной иммобилизации в течение 4-6 недель, когда необходимо избегать нагрузок на конечность с целью предотвращения вторичных деформаций. Данный подход способствует развитию вторичного послеоперационного остеопороза [25, 28, 37-39]. Кроме того, прямые телескопические стержни и эластичное интрамедуллярное армирование совершенно не предотвращают возникновения вторичных торсионных смещений костных фрагментов в раннем послеоперационном периоде. Так, типично развитие ретроверсии шейки бедра, что клинически сопровождается выраженной наружно-ротационной установкой всей конечности [7, 21, 22, 24].
В целом, частота осложнений 33,3 % аналогична частоте осложнений при применении телескопического стержня Fassier-Duval [33], а среднее количество операций на пациента сопоставимо с данными при применении эластичного трансфизарного армирования [25].
Отметим, что использование минимального по объему остеосинтеза аппаратом Илизарова в дополнении к армированию в течение первых 3-4 недель после операции показало преимущества такой методики над стандартным использованием интрамедуллярных конструкций и гипсовой иммобилизации. Такой подход позволил вертикализировать пациента практически с первых же дней после операции с полной опорой на оперированную конечность, что полностью исключило риски вторичного остеопороза, расхождения костных фрагментов и несращения. А также мы не наблюдали ни одного случая вторичных торсионных смещений костных отломков при использовании комбинированной методики. Мы также не наблюдали косых и винтообразных переломов на уровне диафизарной части кости в случаях использования никелид-титановой сетки для поднадкостничного армирования.
Использование эластичных интрамедуллярных стержней с биоактивным покрытием [40, 41] оправдало себя с точки зрения предотвращения миграции имплантов в отдаленном послеоперационном периоде. Однако все случаи нерасхождения интрамедуллярных имплантов мы отмечали при использовании стержней с биоактивным покрытием у детей в возрасте до 10 лет. Очевидным объяснением является остеоинтеграция стержней в костномозговом канале. Собственные и литературные данные [25] указывают, что при правильной фиксации обычных титановых стержней к эпифизам не наблюдается проблем с их расхождением по мере роста ребенка. Поэтому мы полагаем, что при несовершенном остеогенезе использование интрамедуллярных стержней оправдано, но только при условии применения их в виде телескопических у детей старше 10 лет, когда период интенсивного роста завершается.
ЗАКЛЮЧЕНИЕ
Методика эластичного трансфизарного армирования титановыми стержнями показана при коррекции деформаций у детей с тяжелыми формами НО. Коррекция деформаций нижних конечностей и увеличение прочностных свойств костей способствуют увеличению двигательной активности пациентов и повышению качества их жизни. Ортопедические осложнения не являются редкими после оперативного лечения у данной группы пациентов, но своевременная их коррекция позволяет сохранить достигнутый анатомофункциональный результат. Применение в течение 3-4 недель минимального фиксационного варианта остеосинтеза аппаратом Илизарова после корригирующих остеотомий и интрамедуллярного армирования позволяет достичь ранней вертикализации пациента с полной нагрузкой на оперированную конечность, а также исключить ряд осложнений: вторичный остеопороз, вторичные ротационные смещения костных фрагментов. Использование интрамедуллярных имплантов с биоактивным покрытием предотвращает их миграцию в отдаленном периоде, но такие стержни не следует применять в телескопических конструкциях у детей в возрасте до 10 лет, чтобы избежать их блокирования в костномозговом канале вследствие остеоинтеграции.
ЛИТЕРАТУРА
1. Sillence D., Senn A., Danks D.M. Genetic heterogeneity in osteogenesis imperfect // J. Med. Genet. 1979. Vol. 16, N 2. P. 101-116.
2. Cheung M.S., Glorieux F.H. Osteogenesis imperfecta: update on presentation and management // Rev. Endocr. Metab. Disord. 2008. Vol. 9, N 2. P 153-160.
3. Classification of Osteogenesis Imperfecta revisited / F.S. van Dijk, G. Pals, R.R. van Rijn, P.G. Nikkels, J.M. Cobben // Eur. J. Med. Genet. 2010. Vol. 53, N 1. P. 1-5.
4. Glorieux F.H. Osteogenesis imperfecta. Best Pract. Res. Clin. Rheumatol. 2008. Vol. 22, N 1. P. 85-100.
5. Osteogenesis imperfecta / C. Michelle, V. Patel, R. Amirfeyz et al. // Curr. Orthop. 2007. Vol. 21. P 236-241.
6. Rauch F., Glorieux F.H. Osteogenesis imperfecta // Lancet. 2004. N 363 (9418). P 1377-1385.
7. Osteogenesis imperfecta in childhood: prognosis for walking / R.H. Engelbert, C.S. Uiterwaal, V A. Gulmans, H. Pruijs, P J. Helders // J. Pediatr. 2000. Vol. 137, N 3. P. 397-402.
8. Binder H. Rehabilitation of infants with osteogenesis imperfect // Connect. Tissue Res. 1995. Vol. 31, N 4. P. S37-S39.
9. Effect of intravenous pamidronate therapy on functional abilities and level of ambulation in children with osteogenesis imperfect / C. Land. F. Rauch, K. Montpetit, J. Ruck-Gibis, F.H. Glorieux // J. Pediatr. 2006. Vol. 148, N 4. P 456-460.
10. Bone mineral density in children with mild osteogenesis imperfecta / L.E. Zionts, J.P Nash, R. Rude, T. Ross, N.S. Stott // J. Bone Joint Surg. Br. 1995. Vol. 77, N 1. P 143-147.
11. Reliability of the gross motor function measure for children with osteogenesis imperfect / J. Ruck-Gibis, H. Plotkin, J. Hanley, S. Wood-Dauphinee // Pediatr. Phys. Ther. 2001. Vol. 13, N 1. P 10-17.
12. The gross motor function measure: a means to evaluate the effects of physical therapy / D.J. Russell, P.L. Rosenbaum, D.T. Cadman, C. Gowland, S. Hardy, S. Jarvis // Dev. Med. Child. Neurol. 1989. Vol. 31, N 3. P 341-352.
13. Pediatric Evaluation of Disability Inventory (PEDI): Development, Standardization and Administration Manual / S. Haley, W. Coster, L. Ludlow, J. Haltiwanger, P. Andrellos. Boston, MA: New England Medical Center Hospitals, Inc. and PEDI Research Group. 1992.
14. Functional results of operation in osteogenesis imperfecta: elongating rods and nonelongating rods / S. Porat, E. Heller, D.S. Seidman, S. Meyer // J. Pediatr. Orthop. 1991. Vol. 11, N 2. P 200-203.
15. Intramedullary rodding in type III osteogenesis imperfecta. Effects on neuromotor development in 10 children / R.H. Engelbert, PJ. Helders, W. Keessen, H.E. Pruijs, R.H. Gooskens // Acta Orthop. Scand. 1995. Vol. 66, N 4. P 361-364.
16. From pediatric to adult care: strategic evaluation of a transition program for patients with osteogenesis imperfect / M.J. Dogba, F. Rauch, T. Wong, J. Ruck, F.H. Glorieux, C. Bedos // BMC Health Serv. Res. 2014. Vol. 14. P 489. doi: 10.1186/s12913-014-0489-1.
17. Activities and participation in young adults with osteogenesis imperfect / K. Montpetit, N. Dahan-Oliel, J. Ruck-Gibis, F. Fassier, F. Rauch, F. Glorieux // J. Pediatr. Rehabil. Med. 2011. Vol. 4, N 1. P 13-22.
18. Multidisciplinary Treatment of Severe Osteogenesis Imperfecta: Functional Outcomes at Skeletal Maturity / K. Montpetit, T. Palomo, F.H. Glorieux, F. Fassier, F. Rauch // Arch. Phys. Med. Rehabil. 2015. Vol. 96, N 10. P 1834-1839.
19. Волков М.В. Врожденные заболевания костной ткани у детей. М.: Медицина, 1985, 487 с.
20. Cole W.G. Early surgical management of severe forms of osteogenesis imperfect // Am. J. Med. Genet. 1993. Vol. 45, N 2. P. 270-274.
21. Zeitlin L., Fassier F., Glorieux F.H. Modern approach to children with osteogenesis imperfect // J. Pediatr. Orthop. 2003. Vol. 12, N 2. P. 77-87.
22. Results and complications of a surgical technique for correction of coxa vara in children with osteopenic bones / F. Fassier, Z. Sardar, M. Aarabi,
T. Odent, T. Haque, R. Hamdy // J. Pediatr. Orthop. 2008. Vol. 28, N 8. P. 799-805.
23. High prevalence of coxa vara in patients with severe osteogenesis imperfect / M. Aarabi, F. Rauch, R.C. Hamdy, F. Fassier // J. Pediatr. Orthop. 2006. Vol. 26, N 1. P. 24-28.
24. Bailey R.W., Dubow H.I. Evolution of the concept of an extensible nail accomodating to normal longitudinal bone growth: clinical considerations and implications // Clin. Orthop. Relat. Res. 1981. N 159. P. 157-170.
25. Boutaud B., Laville J.M. Elastic sliding central medullary nailing with osteogenesis imperfecta. Fourteen cases at eight years follow-up // Rev. Chir. Orthop. Reparatrice Appar. Mot. 2004. Vol. 90, N 4. P. 304-311.
26. Percutaneous intramedullary fixation of long bone deformity in sever osteogenesis imperfect / K.A. McHale, J.J. Tenuta, L.L. Tosi, D.W. McKay // Clin. Orthop. Relat. Res. 1994. N 305. P. 242-248.
27. Stockley I., Bell M.J., Sharrard W.J. The role of expanding intramedullary rods in osteogenesis imperfecta // J. Bone Joint Surg. Br. 1989. Vol. 71, N 3. P. 422-427.
28. Esposito P, Plotkin H. Surgical treatment of osteogenesis imperfecta: current concepts // Curr Opin. Pediatr. 2008. Vol. 20, N 1. P 52-57.
29. Lascombes P. Flexible intramedullary nailing in children. The Nancy University Manual. Berlin, Heidelberg: Springer-Verlag, 2010.
30. Metaizeau J.P. Sliding centro-medullary nailing. Application to the treatment of severe forms of osteogenesis imperfect // Chir. Pediatr. 1987. Vol. 28, N 4-5. P. 240-243.
31. Novacheck T.F., Stout J.L., Tervo R. Reliability and validity of the Gillette Functional Assessment Questionnaire as an outcome measure in children with walking disabilities // J. Pediatr. Orthop. 2000. Vol. 20, N 1. P 75-81.
32. Intramedullary Elastic Transphyseal Tibial Osteosynthesis and Its Effect on Segmental Growth / D.A. Popkov, N.A. Kononovich, E.R. Mingazov, R.B. Shutov, D. Barbier // Vestn. Ross. Akad. Med. Nauk. 2015. N 4. P P 441-449.
33. Fassier-Duval femoral rodding in children with osteogenesis imperfecta receiving bisphosphonates: functional outcomes at one year / J. Ruck, N. Dahan-Oliel, K. Montpetit, F. Rauch, F. Fassier // J. Child. Orthop. 2011. Vol. 5, N 3. P 217-224.
34. Fassier F., Glorieux F. Osteogeneis imperfecta in the child. In: Cahiers d’enseignement de la SOFCOT. Paris:Expansion Scientifique Fran9aise, 1999. P. 235-252.
35. Zionts L.E., Ebramzadeh E., Stott N.S. Complications in the use of the Bailey-Dubow extensible wire // Clin. Orthop. Relat. Res. 1998. N 348. P 186-195.
36. High reoperation rate and failed expansion in lower extremity expandable rods in osteogenesis imperfecta / T. Larson, B. Brighton, P Esposito et al. In: Proceedings of the Annual Meeting of the Pediatric Orthopaedic Society of North America (POSNA). Waikoloa, Hawaii, 2010.
37. Bilsel N., Beyzadeoglu T., Kafadar A. Application of Bailey-Dubow rods in the treatment of Osteogenesis Imperfecta // Eur. J. Orthop. Surg. Traumatol. 2000. Vol. 10, N 3. P 183-187.
38. Sufko J., Radio W. Operative management of long-bone of the upper limb in children with osteogenesis imperfect // Chir. Narzadow Ruchu Ortop. Pol. 2005. Vol. 70, N 3. P. 195-199.
39. Zeitlin L., Fassier F., Glorieux F.H. Modern approach to children with osteogeneis imperfecta // J. Pediatr. Orthop. 2003. Vol. 12, N 2. P 77-87.
40. Popkov A. Bioactive implants in reconstructive othopedics. In: Combined stimulating methods in reconstructive surgery in pediatric orthopedics / Ed. D. Popkov. New York: Nova Science Publishers Inc., 2015. P. 81-108.
41. Popkov A., Aranovich A., Popkov D. Results of deformity correction in children with X-linked hereditary hypophosphatemic rickets by external fixation or combined technique // Int. Orthop. 2015. Vol. 39, N 12. P 2423-2431.
Сведения об авторах:
1. Мингазов Эдуард Рифович - ФГБУ «РНЦ «ВТО» им. акад. Г. А. Илизарова» Минздрава России, клиническая лаборатория коррекции деформаций и удлинения конечностей, аспирант
2. Попков Арнольд Васильевич - ФГБУ «РНЦ «ВТО» им. акад. ГА. Илизарова» Минздрава России, гл. н. с. лаборатории коррекции деформации и удлинения конечностей, д. м. н., профессор
3. Кононович Наталья Андреевна - ФГБУ «РНЦ «ВТО» им. акад. Г.А. Илизарова» Минздрава России, ведущий научный сотрудник лаборатории коррекции деформаций и удлинения конечностей, к. в. н.
4. Аранович Анна Майоровна - ФГБУ «РНЦ «ВТО» им. акад. Г.А. Илизарова» Минздрава России, гл. н. с. лаборатории коррекции деформации и удлинения конечностей, д. м. н., профессор
5. Попков Дмитрий Арнольдович - ФГБУ «РНЦ «ВТО» им. акад. Г. А. Илизарова» Минздрава России, руководитель киники нейроортопедии, д. м. н.
Теги: остеогенез
234567 Начало активности (дата): 02.06.2022 17:34:00
234567 Кем создан (ID): 989
234567 Ключевые слова: несовершенный остеогенез, хирургическая коррекция деформаций, интрамедуллярное эластичное трансфизарное армирование, остеоинтеграция
12354567899
Похожие статьи
Современные аспекты патоморфологии тканей стопы при синдроме диабетической нейроостеоартропатии, в том числе осложненной остеомиелитом (обзор литературы и результаты собственных исследований)Рентген на дому 8 495 22 555 6 8
Философия Илизарова как основа новой субспециальности в ортопедии-травматологии
Новый вариант пластики тибиального плато большеберцовой кости при эндопротезировании коленного сустава
Ударные волны высокой энергии при лечении медленно срастающихся или несрастающихся переломов



