 13.05.2022
13.05.2022
Современные аспекты патоморфологии тканей стопы при синдроме диабетической нейроостеоартропатии, в том числе осложненной остеомиелитом (обзор литературы и результаты собственных исследований)
Диабетическая нейроостеоартропатия (ДНОАП) является серьезной медико-социальной проблемой, представляет потенциально опасное для конечностей состояние, связанное с повышенной смертностью.
В связи с ранней инвалидизацией и высокой смертностью от поздних осложнений сахарный диабет во всем мире относится к числу серьезных медико-социальных и экономических проблем. Так, одним из наиболее тяжелых, неизбежно приводящих к инвалидизации осложнений сахарного диабета является диабетическая нейроостеоартропатия. Диагностика и лечение диабетической нейроостеоартропатии и ее осложнений является одним из наиболее актуальных направлений современной медицины [1–4].
Цель– анализ литературных данных по диабетической нейроостеоартропатии, осложненной остеомиелитом, с точки зрения патогенеза и гистологических методов диагностики.
МАТЕРИАЛЫ И МЕТОДЫ
В обзоре рассмотрены публикации, полученные в различных информационных системах (eLibrary.ru, PubMed и др.), глубина поиска литературных источников с 2001 по 2021 год.
Результаты
Диабетическая нейроостеоартропатия (остеоартро-патия Шарко, стопа Шарко, сустав Шарко) - неинфекционная хроническая деструкция костей и суставов стопы у больных сахарным диабетом с неврологическим дефицитом, при неадекватном лечении приводящая к необратимой инвалидизации [5, 6].
Заболевание получило название «стопа Шарко» в честь французского невролога J.M. Charcot, который впервые установил и подробно описал патогенетическую связь между периферической нейропатией и поражением голеностопного сустава у пациентов с поздними стадиями сифилиса [7].
Остеоартропатия Шарко была описана у пациентов с алкоголизмом, проказой, повреждением спинного мозга, полиомиелитом, а также в других случаях, когда наблюдали явления периферической нейропатии [8, 9].
В настоящее время наиболее частой причиной осте-оартропатии Шарко является сахарный диабет (диабетическая нейропатия). По последним данным, за последние 10 лет в мире численность больных сахарным диабетом увеличилась более чем в 2 раза и превысила 425 млн. человек к концу 2017 года. Согласно прогнозам Международной диабетической федерации, к 2045 году сахарным диабетом будет страдать около 629 млн. человек. В России также отмечается существенный рост распространенности этого заболевания. По данным федерального регистра сахарного диабета, в Российской Федерации к концу 2018 года состояло на диспансерном учете 3,1 % населения. По результатам российского эпидемиологического исследования (NATION) диагностируется лишь 54 % случаев сахарного диабета 2 типа. Таким образом, реальная численность пациентов с сахарным диабетом не менее 9 млн. человек (около 6 % населения). При этом у значительной части пациентов патология остается не диагностированной, они не получают лечения и имеют высокий риск развития осложнений [10].
В зависимости от преобладания или сочетания основных патогенетических феноменов (нейропатия, ангиопатия, остеоартропатия) в развитии синдрома диабетической стопы выделяют его основные формы: нейропатическая форма (трофическая язва стопы, диабетическая остеоартропатия или стопа Шарко); ишемическая форма; нейроишемическая форма. Известные нейротравматическая и нейротрофическая теории долгое время использовались для выяснения патогенеза стопы Шарко. Причиной изменения структуры костной ткани может быть локальное усиление кровотока в сосудах стопы вследствие нейропатии волокон симпатического отдела нервной системы и/или систематическая травматизация на фоне потери сенсорной чувствительности. Однако ни одна из этих теорий не даёт исчерпывающего представления о том, вследствие чего происходит деформация скелета [11-13]. Это обусловлено малым количеством исследований, направленных на изучение структурных изменений тканей у пациентов с синдромом диабетической стопы.
На современном этапе ДНОАП является серьезной медико-социальной проблемой, так как представляет потенциально опасное для конечностей состояние, которое, помимо эмоционального и социального бремени физической дисфункции, связано с повышенной смертностью [14]. В течение жизни у 8-15 % больных сахарным диабетом образуются трофические язвы стоп, дальнейшее развитие заболевания может осложниться гангреной конечности. Смертность от «высоких» ампутаций колеблется от 28 до 50 %, причем каждый второй пациент после «высокой» ампутации погибает в течение 5 лет [15, 16].
Наиболее частым проявлением позднего осложнения синдрома диабетической стопы являются трофические язвы, которые приводят к тяжелым гнойно-некротическим осложнениям. До 60 % таких осложнений сопровождаются развитием гнойного поражения костей и суставов. Остеомиелит возникает при контактном распространении инфекции со стороны мягких тканей и является главной причиной нетравматических ампутаций нижних конечностей [17, 18].
Диагностика остеоартропатии Шарко и хронического остеомиелита. Несмотря на современные достижения медицины диагностика остеомиелита при ДНОАП является достаточной сложной задачей. Дифференциальная диагностика остеоартропатии Шарко и хронического остеомиелита на фоне гнойно-некротических осложнений синдрома диабетической стопы является малоизученным аспектом [2, 3, 17, 19].
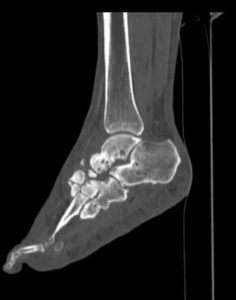
Инструментальные методы диагностики хронического остеомиелита и диабетической нейро-остеоартропатии (стопы Шарко). При ДНОАП рентгенологические признаки в англоязычной литературе описаны как симптомы пяти «Д»: joint distension (растяжение сустава), dislocation (вывих), debris (отломки), disorganization (разрушение с потерей функции), increased density (увеличение плотности) [20, 21]. Рентгенологический метод дает положительные результаты на более поздних стадиях заболевания, при потере костного вещества более 20-40 % и является малоэффективным на ранних стадиях развития ДНОАП [22, 23].
Наиболее информативным методом исследования для диагностики ДНОАП, а также для оценки степени поражения как костей, так и мягких тканей, диф-ференцировки остеомиелита от диабетической нейро-остеоартропатии и для планирования хирургического вмешательства является магнитно-резонансная томография [24, 25]. Разработаны и предложены новые методы анализа данных магнитно-резонансной томографии для оценки стопы Шарко [26, 27].
Местное и системное снижение костной массы достоверно определяет денситометрия. Наиболее эффективный, но малодоступный в настоящее время является метод - сцинтиграфия скелета с введением Tc99m [28, 29].
«Золотым стандартом» в определении природы деструкции костной ткани является гистологический метод - биопсия кости [30, 31].
Гистологический метод в диагностике диабетической нейроостеоартропатии и остеомиелита. Анализ литературы свидетельствует о разнообразных по степени выраженности изменениях структуры кости при хроническом остеомиелите [17, 23, 32].
Патоморфологические изменения при остеомиелите в настоящее время описаны достаточно хорошо, показаны отличия острого и хронического типа воспалительного процесса. Такие патоморфологические признаки как очаги остеонекроза с образованием секвестров, замещение структур костного мозга грануляционной тканью и фиброзом, наличие воспалительной инфильтрации, позволяют сформулировать диагноз хронического остеомиелита [17, 33].
При остеомиелите выделяют следующие морфологические признаки рарефикации кости - в компактной костной ткани расширение гаверсовых каналов, в губчатой костной ткани остеокластическое рассасывание (более характерное для хронического остеомиелита). Усиление перестройки костной ткани проявляется изменением строения костных структур. В остеонах определяются остаточные структуры - «обломки» прежних остеонов, их увеличение свидетельствует о повторной перестройке. В трабекулах губчатой кости усиление перестройки проявляется в увеличении количества линий склеивания - слой костного вещества, образовавшийся в течение одного временного периода, отделяется от слоя, образовавшегося в более поздний период [34].
Характерными признаками секвестра являются пустые остецитарные лакуны, пустые или заполненные гноем гаверсовы каналы и костномозговые пространства, зазубренность краев по линии отделения от основной массы кости. Костные микросеквестры иногда окружены гигантскими многоядерными клетками. Наблюдаются поражения сосудов и нервов, склероз стенок сосудов микроциркуляторного русла, периневральный склероз, продуктивный васкулит. Костномозговые пространства заполнены волокнистой соединительной тканью. В мягких тканях отмечают разрастание соединительной ткани с воспалительными инфильтратами, состоящими из лимфоцитов и плазматических клеток [34].
При хроническом остеомиелите стопы поражение тканей обширное, инфекционный процесс распространяется и на суставы [18]. Сообщения о гистологических изменениях хрящевой ткани суставов при остеомиелите представлены отдельными описаниями клинических случаев с развитием остеоартрита и синовита крупных суставов [35, 36].
На границе субхондральной костной пластинки усиленно функционирующие гипертрофированные хондроциты суставного хряща формируют хондрогема-тический барьер, препятствующий распространению остеомиелитического процесса. При патологических состояниях этот «барьер» нарушается, и отмечается проникновение сосудов в хрящ [37].
Результаты проведенного нами исследования показали, что структурные изменения суставного хряща
при хроническом остеомиелите зависели от расположения остеомиелитического очага. В пяточной и таранной кости, когда остеомиелитический фокус удален от суставной поверхности, структура субхондральной костной пластинки и базофильной линии не нарушены, сосуды в хрящевую ткань не проникали. При наличии остеомиелитического очага в субхондральной зоне выявлены нарушения структуры базофильной линии и субхондральной кости, инвазия сосудами хрящевой ткани. Со стороны суставной поверхности синовиальный паннус, инвазирующий матрикс хряща. При хроническом остеомиелите фаланг и плюсневых костей во всех наблюдениях отмечено нарушение структуры суставного хряща и субхондральной кости, инвазия сосудов в хрящ, что обусловлено малыми размерами этих костей и контактом остеомиелитического очага с суставным хрящом [38].
Для хронического остеомиелита характерна этап-ность течения, чередование ремиссий и обострений. В литературе практически не отражены особенности клеточного и тканевого состава замещенных структур костного мозга при хроническом остеомиелите в разные фазы воспаления (обострения, ремиссии).
Г.В. Дьячкова с соавт. (2017) при анализе операционного материала от 58 пациентов с хроническим остеомиелитом проксимального отдела бедра отмечают следующие характерные для активной и подострой воспалительной фазы особенности: перестройка губчатой кости головки бедра с почти полным разрушением суставного хряща, некроз трабекул, истончение субхондральной кости, замещение межтрабекулярного пространства некротизированным детритом, скопления гнойного экссудата, не зрелая и зрелая (поля фи-брозирования) грануляционная ткань. При активной форме - в межтрабекулярных пространствах большое количество сегментоядерных лейкоцитов. В период ремиссии в некоторых случаях определялись мелкие рыхлые безказеозные гранулемы лимфоцитарного и макрофагального состава, признаки репаративного костеобразования - слои новообразованного остеоида и слои остеобластов на эндостальной поверхности костного трабекулярного комплекса [39].
Важным аспектом является разработка алгоритма диагностики остеомиелита при синдроме диабетической стопы, позволяющая определить тактику лечения данной патологии. Одним из примеров такого алгоритма могут послужить предложенные в 2008 г. международной группой экспертов по проблеме диабетической стопы (DFSG) европейской организации по изучению сахарного диабета (EADS) критерии диагностики и рекомендации по лечению остеомиелита у пациентов с синдромом диабетической стопы. Авторы отмечают, что разработанная схема диагностики остеомиелита диабетической стопы упрощает процесс за счет использования комбинации различных диагностических критериев, в том числе и гистологических [40].
J.L. Lazaro-Martmez с соавт. (2017) после обзора и критического анализа 60 публикаций сделали вывод, что диагноз остеомиелита при диабетической стопе не является однозначным из-за его неоднородности. Сбор клинических признаков воспаления вместе с биопсией кости и рентгенографией постулируются как основные клинические диагностические тесты при подозрении на остеомиелит [41].
A. Tiemann с соавт. (2014) для определения фазы воспалительного процесса разработали шкалу полуколичественной гистопатологической оценки острого и хронического остеомиелита, которая включала градацию изменений костной, мягких тканей и воспалительного инфильтрата от 0 до 3 баллов [42].
Патогистологические исследования диабетической нейроостеоартропатии. Несмотря на современные достижения медицины, проблема дифференциальной диагностики ДНОАП и остеомиелита остается малоизученным аспектом в хирургии [43, 44, 45].
Деев Р.В. с соавт. (2016) выделяют следующие наиболее значимые патоморфологические изменения костной ткани у пациентов с терминальными формами диабетической ангио- и нейропатии: фокальный некроз, проявляющийся запустевшими остеоцитарны-ми лакунами, эндостальной резорбцией, истончением субхондрального слоя, феноменом свободных трабекул; в межтрабекулярном пространстве волокнистый и хлопьевидный тканевой дебрис без воспалительного инфильтрата, признаки реактивного остеогенеза слабо выражены и недостаточны для полного восстановления органа [44].
А.А. Дмитриенко с соавт. (2014) отмечают, что при диабетической нейроостеоартропатии воспалительный инфильтрат костной ткани слабо или умеренно выражен и представлен преимущественно лимфоцитами, плазматическими клетками и макрофагами, редко нейтрофилами и фибробластами. Отличительной особенностью остеомиелита от ДНОАП является наличие грануляционного вала на границе некротизированного и неизмененного участка кости [43].
В проведенном нами ранее исследовании при диабетической нейроостеоартропатии, осложненной остеомиелитом, отмечено нарушение структуры и / или полное отсутствие субхондральной кости вследствие высокой активности остеокластов в субходральной зоне, при этом признаки репаративного костеобразования слабо выражены, суставная поверхность покрыта паннусом, отмечена инвазия сосудов в хрящ со стороны паннуса и субхондральной зоны [45].
Описанные патогистологические изменения костной ткани и суставного хряща соответствуют патогенетическим механизмам заболевания, нарушение структуры сустава сопровождается гиперваскуляризацией и резорбцией костной ткани [46]. Остеокласты играют ключевую роль в течении артропатии Шарко в качестве экзогенных клеток, ответственных за дисбаланс костного обмена и, в конечном итоге, за остеолиз. У пациентов с артропатией Шарко повышенная активность остеокластов приводит к дисбалансу постоянных процессов ремоделирования [11, 47].
Причина повышенной резорбирующей активности при диабетической нейроостеоартропатии неизвестна, предполагают, что она может быть вызвана неконтролируемым воспалением из-за повышенной регуляции провоспалительных цитокинов и, в частности, фактора некроза опухоли a (TNF-a). Дальнейшее изучение роли провоспалительных цитокинов перспективно в плане разработки новых методов лечения синдрома диабетической стопы [47, 48].
Количественные экспериментальные исследования костной ткани при сахарном диабете показали снижение объема костной ткани, количества остеобластов, снижение скорости формирования остеоида [49].
Гистоморфометрические исследования костной ткани у пациентов с диабетической нейроостеоартропатией показали увеличение количества пустых остеоцитарных лакун и лакун Хаушипа, что свидетельствовало об усилении остеокластической активности, количество осте-оцитов достоверно снижено относительно контрольной группы [50]. У пациентов с хронической артропатией Шарко отмечают значительное истончение костных трабекул, уменьшение их площади, на поверхности отдельных трабекул выявлены активные остеобласты [51]. Отмечают, что низкая минеральная плотность костной ткани определяется у пациентов с переломами стопы и голеностопного сустава, связанными с нейропатической артропатией [52, 53].
Одним из ведущих факторов в инициации патологических изменений тканей стопы при ДНОАП является выраженное нарушение структуры стенки сосудов микроциркуляторного русла: гиперплазия интимы, утолщение субэндотелиального слоя, гиалиноз, кальцификация гладкомышечных клеток [44, 54-56].
Патогенез кальцификации сосудов при диабете до конца не изучен, высокий уровень глюкозы и другие факторы могут играть важную роль в остеогенной трансдифференцировке гладкомышечных клеток. Дальнейшее детальное изучение механизма кальцификации сосудов при диабете необходимо для разработки эффективных терапевтических стратегий вмешательства в этот процесс [57, 58].
При диабетической нейропатии ряд метаболических и сосудистых изменений взаимосвязаны, основным фактором является гипергликемия. Изменения включают усиление окислительного стресса, накопление конечных продуктов гликирования, активацию провоспалительных механизмов и ишемию. Эти процессы оказывают прямое и косвенное неблагоприятное воздействие не только на нейроны и шванновские клетки, но и на кровеносные сосуды, снабжающие нервы. Сосудистые поражения в тканях стопы при диабетической нейроостеоартропатии, возникающие на уровне микроциркуляторного русла, сопровождаются структурными изменениями периферических нервов, их дегенерацией и уменьшением количества шваннов-ских клеток [59].
О.В. Белов с соавт. (2017) изучали две клинические группы по шесть пациентов в каждой. В первой группе у пациентов преобладали ишемические изменения, во второй группе преобладали нейропатические изменения. Авторами выявлена неоднородность морфологических данных. В первой группе зарегистрированы тяжелые циркуляторные расстройства, утолщение стенок микрососудов с сужением их просвета. Изменения периферических нервных стволиков характеризовались слабо выраженной демиелинизацией.
Во второй группе изменения сосудов аналогичны первой группе, в периферических нервных стволиках выявлено повреждение шванновских оболочек, разрушение миелина вплоть до тотальной демиелинизации и полной дегенерации осевых цилиндров. Зарегистрированы изменения эндо- и периневральных сосудов - утолщение базальной мембраны, запустевающие капилляры. Гистоморфометрически обнаружено статистически значимое утолщение стенок прекапиллярных артериол, уменьшение их внутреннего диаметра с уменьшением внутреннего диаметра капилляров, более выраженные в первой группе. Выявленные морфологические особенности проявлений нейроишемической формы синдрома диабетической стопы обосновывают необходимость индивидуального похода к лечению пациентов с учетом преобладания тех или иных морфологических изменений [54].
U. Illgner с соавт. (2019) выделили основные полуколичественные гистопатологические критерии стопы Шарко - шкала Шарко (предложенная шкала Шарко основана на принципе шкалы HOES A. Tiemann с соавт., 2014 [42]). Авторы оценивали в баллах (от 0 до 4 баллов) выраженность некроза тканей, признаки ремоделирования кости (обнаружение остеобластов, остеокластов, воспалительный инфильтрат), состояние суставного хряща (выраженность признаков деструкции и регенерации), в синовиальной оболочке выраженность воспалительного инфильтрата. Полуколичественная гистопатологическая оценка в 11 или более баллов (максимальное количество баллов - 21) может быть оценена как стопа Шарко. Ограничением представленного исследования явилась малая выборка из 20 пациентов [60].
ОБСУЖДЕНИЕ
Диабетическая нейроостеоартропатия (стопа Шар-ко) - потенциально опасное осложнение для пациентов с сахарным диабетом, приводящее к значительному разрушению костей, суставов, деформации стопы и образованию трофических язв [5, 6]. С учётом высокого процента ампутаций нижних конечностей и постампутационной летальности больных сахарным диабетом (28-50 %) ранняя диагностика ДНОАП имеет важное значение [15-18]. Основным методом оценки состояния костей и суставов остается рентгенография, позволяющая с высокой достоверностью определять очаги остеолиза, но малоэффективная на ранних стадиях развития ДНОАП [22, 23]. Совершенствуются денситометрические методики исследования. Наиболее информативными методами для оценки локализации и размера очага поражения, как костей, так и мягких тканей, являются магнитно-резонансная томография [24, 25] и гистологический метод [30, 31].
Анализ данных литературы показал, что проблема дифференциальной диагностики ДНОАП и остеомиелита остается малоизученным аспектом [2, 3, 17, 19].
Количественные гистопатологические диагностические критерии хронического остеомиелита к настоящему времени не определены. В ряде случаев, при отсутствии очевидных клинических и рентгенологических признаков остеомиелита, например, при дифференциальной диагностике между диабетической осте-оартропатией и остеомиелитом, когда в обоих случаях выражена деструкция костной ткани, или при выявлении остеомиелита, возникшего как осложнение диабетической остеоартропатии, существует необходимость в достоверном установлении диагноза.
Выделяют три основные формы в развитии синдрома диабетической стопы: нейропатическая, ишемическая и нейроишемическая, но ни одна из этих теорий не даёт исчерпывающего представления о том, вследствие чего происходит деформация скелета из-за недостаточного количества исследований структурных изменений тканей у пациентов с синдромом диабетической стопы [11, 12, 13].
Механизмы патогенеза стопы Шарко и патоморфологических изменений тканей в зависимости от этиологических факторов и коморбидности являются недостаточно изученными. К настоящему времени разработаны полуколичественные гистопатологические критерии остеомиелита и стопы Шарко [42, 60]. Ограничением представленных исследований явились малые выборки из 52 и 20 пациентов [42, 60]. В настоящее время отсутствует стандартизированная воспроизводимая гистологическая оценка операционного материала, результаты часто представлены описательно, что затрудняет работу врача с гистопатологическими результатами.
ЗАКЛЮЧЕНИЕ
Представления о патогенезе стопы Шарко и патоморфологических изменениях тканей в зависимости от этиопатогенетических факторов и коморбидности неоднозначны и требуют проведения дальнейших исследований. Гистологические исследования тканей стопы при данной патологии перспективны для дифференциальной и ранней диагностики стопы Шарко, обоснования необходимости индивидуального похода к лечению с учетом преобладания тех или иных морфологических изменений.
СПИСОК ИСТОЧНИКОВ
1. Гальчина Ю.С., Кармазановский Г.Г., Пасхалова Ю.С. Основные методы диагностики синдрома диабетической стопы // Медицинская визуализация. 2016. № 6. С. 100-117.
2. Минаков О.Е., Андреев А.А., Остроушко А.П. Синдром диабетической стопы // Вестник экспериментальной и клинической хирургии. 2017. Т. 10, № 2. С. 165-172. DOI: 10.18499/2070-478X-2017-10-2-165-172.
3. Особенности специализированной помощи пациентам с диабетической остеоартропатией / Ю.В. Бабушкина, Е.П. Бурлева, Ф.В. Галимзя-нов, Е.Ю. Левчик // Раны и раневые инфекции. Журнал имени проф. Б.М. Костючёнка. 2019. Т. 6, № 2. С. 6-16. DOI: 10.25199/2408-9613-2019-6-2-6-16.
4. Charcot Foot: Clinical Clues, Diagnostic Strategies, and Treatment Principles / V.S. Marmolejo, J.F. Arnold, M. Ponticello, C.A. Anderson // Am. Fam. Physician. 2018. Vol. 97, No 9. P. 594-599.
5. Диабетическая остеоартропатия: современные методы терапии / И.Н. Ульянова, А.Ю. Токмакова, М.В. Ярославцева, А.В. Ильин, Г.Р. Гал-стян // Сахарный диабет. 2010. Т. 13, №. 4. С. 70-73. DOI: 10.14341/2072-0351-6061.
6. Галстян Г.Р., Каминарская Ю.А. Патогенез остеоартропатии Шарко: роль периферической нервной системы // Эндокринная хирургия. 2014. № 4. С. 5-14. DOI: 10.14341/serg20144514.
7. Trepman E., Nihal A., Pinzur M.S. Current topics review: Charcot neuroarthropathy of the foot and ankle // Foot Ankle Int. 2005. Vol. 26, No 1. P. 46-63. DOI: 10.1177/107110070502600109.
8. Бобров Д.С. Диабетическая остеоартропатия (стопа Шарко): патогенез, диагностика и лечение редкого осложнения сахарного диабета // Кафедра травматологии и ортопедии. 2012. № 2. С. 6-12.
9. Mabilleau G., Edmonds M.E. Role of neuropathy on fracture healing in Charcot neuro-osteoarthropathy // J. Musculoskelet. Neuronal Interact. 2010. Vol. 10, No 1. P. 84-91.
10. Алгоритмы специализированной медицинской помощи больным сахарным диабетом : клинические рекомендации / под ред.: И.И. Дедова, М.В. Шестаковой, А.Ю. Майорова. Вып. 9 (дополненный) // Сахарный диабет. 2019. Т. 22(S1). С. 1-212. DOI: 10.14341/DM221S1.
11. An overview of the Charcot foot pathophysiology / G. Kaynak, O. Birsel, M.F. Guven, T. Ogut // Diabet. Foot Ankle. 2013. No 4. DOI: 10.3402/ dfa.v4i0.21117.
12. Pinzur M.S. An Evidence-Based Introduction to Charcot Foot Arthropathy // Foot & Ankle Orthopaedics. 2018. Vol. 3, No 3. 247301141877426. DOI: 10.1177/2473011418774269.
13. Current concepts underlying the pathophysiology of acute Charcot neuroarthropathy in the diabetic foot and ankle / T.H. Yates, S.R. Cooperman, D. Shofler, D.K. Agrawal // Expert. Rev. Clin. Immunol. 2020. Vol. 16, No 8. P. 839-845. DOI: 10.1080/1744666X.2020.1804869.
14. Charcot stage 0: A review and considerations for making the correct diagnosis early / C. Holmes, B. Schmidt, M. Munson, J.S. Wrobel // Clin. Diabetes Endocrinol. 2015. Vol. 1. P. 18. DOI: 10.1186/s40842-015-0018-0.
15. Рундо А.И. Современные аспекты этиологии и патогенеза синдрома диабетической стопы // Новости хирургии. 2015. Т. 23, № 1. С. 97-104.
16. Gouveri E., Papanas N. Charcot osteoarthropathy in diabetes: A brief review with an emphasis on clinical practice // World J. Diabetes. 2011. Vol. 2, No 5. P. 59-65. DOI: 10.4239/wjd.v2.i5.59.
17. Диагностика остеомиелита при синдроме диабетической стопы (обзор литературы) / А.А. Дмитриенко, В.В. Аничкин, М.Ф. Курек, А. Ва-кар // Проблемы здоровья и экологии. 2014. № 3(41). С.62-67.
18. Клинико-морфологическая характеристика остеомиелита при синдроме диабетической стопы / Э.Д. Байрамкулов, А.А. Воротников, С.А. Мозеров, О.В. Красовитова // Фундаментальные исследования. 2015. № 1-1. С. 23-27.
19. Ergen F.B., Sanverdi S.E., Oznur A. Charcot foot in diabetes and an update on imaging // Diabet. Foot Ankle. 2013. Vol. 4. DOI: 10.3402/dfa. v4i0.21884.
20. Storey A.M., Perry C.J., Petrie J.R. Endothelial dysfunction in type 2 diabetes // Br. J Diabetes & Vascular Dis. 2001. Vol. 1, No 1. P. 22-27. DOI: 10.1177/14746514010010010401.
21. Guidelines for the ultrasound assessment of endothelial-dependent flow-mediated vasodilation of the brachial artery: a report of the International Brachial Artery Reactivity Task Force / M.C. Corretti, T.J. Anderson, E.J. Benjamin, D. Celermajer, F. Charbonneau, M.A. Creager, J. Deanfield, H. Drexler, M. Gerhard-Herman, D. Herrington, P. Vallance, J. Vita, R. Vogel; International Brachial Artery Reactivity Task Force // J. Am. Coll. Cardiol. 2002. Vol. 39, No 2. P. 257-265. DOI: 10.1016/s0735-1097(01)01746-6.
22. Современные методы диагностики синдрома диабетической стопы / П.С. Маркевич, С.Ю. Даниленко, А.В. Янкин, А.Н. Плеханов // Бюллетень ВСНЦ СО РАМН. 2012. № 6(88). С. 151-155.
23. «Многоликий» хронический остеомиелит: лучевая диагностика / Г.В. Дьячкова, К.А. Дьячков, Н.М. Клюшин, Т.А. Ларионова, А.Л. Ша-стов // Гений ортопедии. 2020. Т. 26, № 3. С. 385-391. DOI 10.18019/1028-4427-2020-26-3-385-391.
24. Ledermann H.P., Morrison W.B. Differential diagnosis of pedal osteomyelitis and diabetic neuroarthropathy: MR Imaging // Semin. Musculoskelet. Radiol. 2005. Vol. 9, No 3. P. 272-283. DOI: 10.1055/s-2005-921945.
25. Tan P.L., Teh J. MRI of the diabetic foot: differentiation of infection from neuropathic change // Br. J. Radiol. 2007. Vol. 80, No 959. P. 939-948. DOI: 10.1259/bjr/30036666.
26. Novel Semiquantitative Bone Marrow Oedema Score and Fracture Score for the Magnetic Resonance Imaging Assessment of the Active Charcot Foot in Diabetes / L. Meacock, N.L. Petrova, A Donaldson, A. Isaac, A. Briody, R. Ramnarine, M.E. Edmonds, D.A. Elias // J. Diabetes Res. 2017. Vol. 2017. 8504137. DOI: 10.1155/2017/8504137.
27. The "Balgrist Score” for evaluation of Charcot foot: a predictive value for duration of off-loading treatment / M.C. Berli, K. Higashigaito, T. Gotschi, C.W.A. Pfirrmann, R. Sutter, A.B. Rosskopf // Skeletal Radiol. 2021. Vol. 50, No 2. P. 311-320. DOI: 10.1007/s00256-020-03541-6.
28. Capriotti G., Chianelli M., Signore A. Nuclear medicine imaging of diabetic foot infection: results of metaDanalysis // Nucl. Med. Commun. 2006. Vol. 27, No 10. P. 757-764. DOI: 10.1097/01.mnm.0000230065.85705.b3.
29. Diabetic Foot Infections: an Update in Diagnosis and Management / P. Grigoropoulou, I. Eleftheriadou, E.B. Jude, N. Tentolouris // Curr. Diab. Rep. 2017. Vol. 17, No 1. P. 3. DOI: 10.1007/s11892-017-0831-1.
30. Современные методы диагностики и лечения синдрома диабетической стопы / М.Г. Павлова, М.Ф. Калашникова, Т.В. Гусов, Н.В. Лаврищева // Клиницист. 2007. № 3. С. 21-29.
31. Statistical reliability of bone biopsy for the diagnosis of diabetic foot osteomyelitis / A.J. Meyr, S. Singh, X. Zhang, N. Khilko, A. Mukherjee, M.J. Sheridan, J.S. Khurana // J. Foot Ankle Surg. 2011. Vol. 50, No 6. P. 663-667. DOI: 10.1053/j.jfas.2011.08.005.
32. Expert opinion on the management of infections in the diabetic foot / B.A. Lipsky, E.J. Peters, E. Senneville, A.R. Berendt, J.M. Embil, L.A. Lavery, V. Urbancic-Rovan, W.J. Jeffcoate // Diabetes Metab. Res. Rev. 2012. Vol. 28, No Suppl. 1. P. 163-178. DOI: 10.1002/dmrr.2248.
33. Detecting Chronic Post-Traumatic Osteomyelitis of Mouse Tibia via an IL-13RD2 Targeted Metallofullerene Magnetic Resonance Imaging Probe / L. Xiao, T. Li, M. Ding, J. Yang, J. Rodrfguez-Corrales, S.M. LaConte, N. Nacey, D.B. Weiss, L. Jin, H.C. Dorn, X. Li // Bioconjug. Chem. 2017. Vol. 28, No 2. P. 649-658. DOI: 10.1021/acs.bioconjchem.6b00708.
34. Бодаченко К.А., Рушай А.К., Поляков К.В. Патоморфологическое обоснование комплексной консервативной терапии посттравматического остеомиелита костей конечностей // Украшський журнал екстремально'1 медицини iменi Г.О. Можаева. 2011. Т. 12, № 4. С. 11-15.
35. Silent chronic osteomyelitis lasting for 30 years before outburst of symptoms / S.S. Ahmad, S. Kohl, D.S. Evangelopoulos, A. Kruger // BMJ. Case Rep. 2013. Vol. 2013. bcr2013009428. DOI: 0.1136/bcr-2013-009428.
36. Ellerbrook L., Laks S. Coccidioidomycosis osteomyelitis of the knee in a 23-year-old diabetic patient // Radiol. Case. Rep. 2015. Vol. 10, No 1. P. 1034. DOI: 10.2484/rcr.v10i1.1034.
37. Зайдман А.М., Корель А.В. Структурно-функциональные особенности пластинки роста тел позвонка человека в критические периоды роста // Хирургия позвоночника. 2004. № 1. С. 113-120.
38. Ступина Т.А., Мигалкин Н.С., Судницын А.С. Структурная реорганизация хрящевой ткани при хроническом остеомиелите костей стопы // Гений ортопедии. 2019. Т. 25, № 4. С. 523-527. DOI 10.18019/1028-4427-2019-25-4-523-527.
39. Рентгено-гистологические параллели стадий хронического остеомиелита / Г.В. Дьячкова, Н.М. Клюшин, Н.С. Мигалкин, Т.А. Ларионова, Д.С. Леончук, К.А. Дьячков, Н.Б. Бегимбетова // Вестник Российской Военно-медицинской академии. 2017. № 4 (60). С. 17-22.
40. Diabetic foot osteomyelitis: a progress report on diagnosis and a systematic review of treatment / A.R. Berendt, E.J. Peters, K. Bakker, J.M. Embil, M. Eneroth, R.J. Hinchliffe, W.J. Jeffcoate, B.A. Lipsky, E. Senneville, J. Teh, G.D. Valk // Diabetes Metab. Res. Rev. 2008. Vol. 24, No Suppl. 1. P. S145-S161. DOI: 10.1002/dmrr.836.
41. Lazaro-Martinez J.L., Tardaguila-Garcia A., Garcia-Klepzig J.L. Diagnostic and therapeutic update on diabetic foot osteomyelitis // Endocrinol. Diabetes Nutr. 2017. Vol. 64, No 2. P. 100-108. DOI: 10.1016/j.endinu.2016.10.008.
42. Histopathological Osteomyelitis Evaluation Score (HOES) - an innovative approach to histopathological diagnostics and scoring of osteomyelitis / A. Tiemann, G.O. Hofmann, M.G. Krukemeyer, V. Krenn, S. Langwald // GMS. Interdiscip. Plast. Reconstr. Surg. DGPW. 2014. Vol. 3. Doc08. DOI: 10.3205/iprs000049.
43. Морфологические критерии дифференциальной диагностики остеоартропатии и остеомиелита у больных с синдромом диабетической стопы / А.А. Дмитриенко, В.В. Аничкин, М.Ф Курек, А.В. Мишин // Хирургия. Восточная Европа. 2014. № 4. С. 16-23.
44. Патогистологические изменения тканей стопы у пациентов с терминальными формами диабетической ангио- и нейропатии / Р.В. Деев, И.Л. Плакса, И.А. Чекмарева, Г.Р. Галстян, И.А. Сучков, С.А. Матвеев // Вестник Национального медико-хирургического Центра им. Н.И. Пирогова. 2016. Т. 11, № 2. С. 69-75.
45. Микроскопическое исследование компонентов суставов стопы при артропатии Шарко, осложненной остеомиелитом / Т.А. Ступина, Н.С. Мигалкин, М.М. Щудло, А.С. Судницын, И.Н. Мезенцев // Травматология и ортопедия России. 2020. Т. 26, № 4. С. 112-120. DOI: 10.21823/2311-2905-2020-26-4-112-120.
46. Boulton A.J. The diabetic foot: from art to science. The 18th Camillo Golgi lecture // Diabetologia. 2004. Vol. 47, No 8. P. 1343-1353. DOI: 10.1007/ s00125-004-1463-y.
47. Inhibition of TNF-a Reverses the Pathological Resorption Pit Profile of Osteoclasts from Patients with Acute Charcot Osteoarthropathy / N.L. Petrova, P.K. Petrov, M.E. Edmonds, C.M. Shanahan // J. Diabetes Res. 2015. Vol. 2015. P. 917945. DOI: 10.1155/2015/917945.
48. Jeffcoate W.J., Game F., Cavanagh P.R. The role of proinflammatory cytokines in the cause of neuropathic osteoarthropathy (acute Charcot foot) in diabetes // Lancet. 2005. Vol. 366, No 9502. P. 2058-2061. DOI: 10.1016/S0140-6736(05)67029-8.
49. Low bone toughness in the TallyHO model of juvenile type 2 diabetes does not worsen with age / A. Creecy, S. Uppuganti, M. Unal, R. Clay Bunn., P. Voziyan, J.S. Nyman // Bone. 2018. Vol. 110. P. 204-214. DOI: 10.1016/j.bone.2018.02.005.
50. Trabecular quality and cellular characteristics of normal, diabetic, and Charcot bone / J. La Fontaine, N. Shibuya, H.W. Sampson, P. Valderrama // J. Foot Ankle Surg. 2011. Vol. 50, No 6. Р. 648-653. DOI: 10.1053/j.jfas.2011.05.005.
51. Microscopic study of chronic Charcot arthropathy foot bones contributes to understanding pathogenesis - A preliminary report / S. Dharmadas, H. Kumar, M. Pillay, A. Jojo, T. Pj, T.S. Mangalanandan, L. Vivek, V.P. Praveen, A. Bal // Histol. Histopathol. 2020. Vol. 35, No 5. P. 443-448. DOI: 10.14670/HH-18-162.
52. Progression of foot deformity in Charcot neuropathic osteoarthropathy / M.K. Hastings, J.E. Johnson, M.J. Strube, C.F. Hildebolt, K.L. Bohnert, F.W. Prior, D.R. Sinacore // J. Bone Joint Surg. Am. 2013. Vol. 95, No 13. Р. 1206-1213. DOI: 10.2106/JBJS.L.00250.
53. Bone Mineral Density in Diabetes Mellitus Foot Patients for Prediction of Diabetic Neuropathic Osteoarthropathic Fracture / J.H. Cho, T.H. Min, D.I. Chun, S.H. Won, S.Y. Park, K. Kim, Y. Yi // J. Bone Metab. 2020. Vol. 27, No 3. P. 207-215. DOI: 10.11005/jbm.2020.27.3.207.
54. Морфофункциональные особенности мягких тканей при нейроишемической форме синдрома диабетической стопы / С.Г. Белов, О.В. Данилова, И.А. Тарабан, Д.И. Галата, Н.И. Горголь, С.Н. Потапов // Новости хирургии. 2017. Т. 25, № 2. С. 140-147.
55. Jeffcoate W. Vascular calcification and osteolysis in diabetic neuropathy - is RANK-L the missing link? // Diabetologia. 2004. Vol. 47, No 9. P. 14881492. DOI: 10.1007/s00125-004-1477-5.
Теги: стопа
234567 Начало активности (дата): 13.05.2022 21:18:00
234567 Кем создан (ID): 989
234567 Ключевые слова: стопа, ткани, диабетическая стопа, остемиелит
12354567899
Похожие статьи
Новые лабораторные тесты для оценки эффективности лечения больных с хроническим остеомиелитом костей стопы в условиях использования метода чрескостного остеосинтезаРентген на дому 8 495 22 555 6 8
Особенности опорной функции стоп у детей с тяжелыми формами идиопатического сколиоза до и после хирургического лечения
Эндопротезирование голеностопного сустава
Магнитно-резонансная томография в диагностике новообразований опорно-двигательного аппарата



