 04.12.2020
04.12.2020
Комплексное лечение пациента с осложненной травмой грудного отдела позвоночника с использованием методики чрескожной электрической стимуляции спинного мозга
Актуальность лечения детей с позвоночно-спинномозговой травмой обусловлена ростом числа пациентов с данным типом переломов, тяжестью и сложностью самого повреждения, а также возможностью возникновения и развития необратимых осложнений. Выживаемость лиц младше 29 лет, получивших позвоночно-спинномозговую травму грудного, грудопоясничного или поясничного уровня, довольно высока и может составлять до 86 % от всех пострадавших данной возрастной категории.
ВВЕДЕНИЕ
В последние годы прослеживается неуклонный рост количества детей с травматическими повреждениями позвоночника и спинного мозга. В общей структуре травм позвоночного столба у пациентов детского возраста на долю нестабильных и осложненных повреждений приходится не более 2 %. Одновременно с этим в последние годы тяжесть этих переломов становится все более значительной. Согласно анализу статистических данных пациентов детского возраста с позвоночно-спинномозговой травмой в городе Санкт-Петербурге и Ленинградской области, в 2010 году количество пострадавших с нестабильными переломами позвоночника составляло 85,7 %, оставшаяся часть - 14,3 % - приходилась на осложненные повреждения. При этом в 2017 году доля детей с нестабильными переломами составила 67,7 %, а количество пострадавших с повреждениями позвоночника и спинного мозга достигло уже 32,4 %.
Актуальность лечения детей с позвоночно-спинномозговой травмой обусловлена ростом числа пациентов с данным типом переломов, тяжестью и сложностью самого повреждения, а также возможностью возникновения и развития необратимых осложнений. Выживаемость лиц младше 29 лет, получивших позвоночно-спинномозговую травму грудного, грудопоясничного или поясничного уровня, довольно высока и может составлять до 86 % от всех пострадавших данной возрастной категории [1].
Хирургическому лечению пациентов с ПСМТ посвящены многочисленные исследования. В этих исследованиях подтверждается, что проведение вмешательств при повреждениях, сопровождающихся дислокацией позвонков, формированием стеноза позвоночного канала и неврологическим дефицитом, показано в раннем периоде с момента получения травмы [2, 3]. Большинство авторов склонны считать, что на восстановление локомоторной функции у пациентов с позвоночно-спинномозговой травмой влияют сроки выполненной операции, ее объем, исходная тяжесть неврологического дефицита, полноценность и комплексность реабилитационного лечения [4].
Основными задачами хирургического лечения являются коррекция посттравматической деформации позвоночника во всех плоскостях с обязательной ликвидацией спинального стеноза и сдавления спинного мозга, стабилизация поврежденного позвоночно-двигательного сегмента с минимально допустимой протяженностью металлоконструкции, ранняя активизация пациента, индуцирование восстановления неврологических сегментарных расстройств [5, 6]. В литературе имеются немногочисленные исследования, направленные на изучение восстановления чувствительных и двигательных функций у пациентов детского возраста [7-9].
Несмотря на соблюдение общепринятых принципов и ранних сроков оперативного лечения больных с осложненными повреждениями позвоночника только единичные пациенты с исходно тяжелым неврологическим дефицитом (тип А и В по шкале ASIA) способны восстановить свою функциональную и двигательную активность [7, 8].
Целью работы явилась демонстрация результата комплексного лечения подростка с переломо-вывихом в грудном отделе позвоночника, осложненным глубокой нижней параплегией и нарушением функции тазовых органов с применением в программе реабилитации неинвазивной чрескожной стимуляции спинного мозга и механической стимуляции опорной поверхности стопы.
КЛИНИЧЕСКОЕ НАБЛЮДЕНИЕ
Пациент Г., 17 лет. Получил сочетанную травму во время спортивной тренировки на лыжных роллерах. После падения отмечалась кратковременная потеря сознания, непроизвольный акт мочеиспускания и дефекации. Сразу после травмы, придя в сознание, предъявлял активные жалобы на боли в спине и невозможность активных движений в нижних конечностях, затрудненное дыхание. Отмечал утрату* чувствительности нижней части туловища, промежности, нижних конечностей. Бригадой скорой помощи доставлен в одну из центральных районных больниц Ленинградской области, где в течение 3 часов ему* оказывали помощь, направленную на компенсацию витальных функций: дренирование правой плевральной полости по Редону, противоотечнуто, церебропротекторную (цитофлавин, цераксон), гемостатическую (дицинон, викасол, гордокс), антибактериальную (цефтриаксон 2,0 г х 2 р/с, метрогил 500 мг х 2 р/с), инфузионную, гормональную терапию, обезболивание (НПВС, промедол). Через 3 часа от момента травмы в связи с выявлением тяжелого повреждения позвоночника и неврологических нарушений пациент доставлен в ФГБУ “НИДОИ им. Г.И. Турнера” Минздрава России для проведения хирургического лечения.
При поступлении: состояние тяжелое, обусловлено характером и совокупностью полученных повреждений. По правой ключичной линии в проекции 2-го межреберья и по правой средней подмышечной линии в проекции 6-го межреберья установлены плевральные дренажи, центральное венозное русло катетеризировано через правую подключичную вену, отток по катетеру сохранен. Множественные ссадины, гематомы туловища, верхних и нижних конечностей. Пульс симметрииный, 96 ударов в мин., ритмичный, удовлетворительного наполнения и напряжения. АД 110/70 мм рт. ст. Тоны сердца звучные, ясные. Экскурсия грудной клетки асимметричная (Sin > Dex), пониженной амплитуды.
Аускультативно - дыхание везикулярное, проводится во все отделы легких, ослаблено по всем полям справа. Хрипов нет. Живот незначительно вздут, симметричный, участвует в акте дыхания, мягкий, безболезненно доступен глубокой пальпации во всех отделах. Перистальтика вялая. Диурез по мочевому катетеру', моча светлая, прозрачная, макроскопически - без патологических примесей.
Неврологически: сознание ясное. Ориентирован во времени и пространстве. Глазные щели - D = S. Зрачки - OD = OS = 2,0 мм с живой и симметричной фотореакцией на свет.
Горизонтальный мелкоразмашистый нистагм в крайних отведениях. Лицо симметричное, язык по средней линии. Глотание и фонация не нарушены. Активные движения в верхних конечностях в полном объеме, мышечная сила достаточная. Сухожильные рефлексы живые, равные. В нижних конечностях произвольные движения отсутствуют, сухожильные рефлексы не вызываются. Мышечный тонус верхних конечностей удовлетворительный, симметричный, в нижних - снижен до атонии. Отмечается нарушение глубокой и поверхностной чувствительности с уровня сегментов Th4-5. Брюшные рефлексы не вызываются. Перианальные рефлексы сохранены. Sph. ani не зияет. Менингеальных знаков нет. Функция тазовых органов нарушена. По шкале ASIA - тип В (оценка двигательных нарушений составляет 50 баллов, чувствительных - 88 баллов суммарно) (рис. 1)
Лабораторно - компенсирован. ЭКГ без патологии. УЗИ органов брюшной полости, почек - арефлекторный мочевой пузырь.
Заключение рентгенографии и МСКТ позвоночника от 21.07.2017 г.: картина переломо-вывиха ТИ5-6 позвонков (тип С по АО) со стенозом позвоночного канала, ушиба легких, с признаками разрыва в проекции нижней доли справа, двустороннего «малого» гемоторакса, перелома правой ключицы, правой лопатки, поперечных отростков Th3-Th8 позвонков слева (рис. 2).
Проведено MPT-исследование головного мозга, шейного, грудного и пояснично-крестцового отделов позвоночника и спинного мозга. МР-признаков ушиба, отека вещества мозга не выявлено.
После клинико-неврологического, лабораторного, функционального и лучевого обследования установлен окончательный диагноз: тяжелая сочетанная позвоночно-спинномозговая травма. ЗЧМТ. Сотрясение головного мозга. Закрытый переломо-вывих на уровне Th5-Th6 позвонков (тип С по АО). Перелом поперечных отростков позвонков Th2-Th8 слева. Стеноз позвоночного канала на уровне Th5-Th6. Ушиб спинного мозга. Нижняя параплегия с нарушением функции тазовых органов, арефлекторный мочевой пузырь.
Правосторонний гемопневмоторакс, состояние после дренирования. Ушиб правого легкого. Закрытый перелом правой ключицы без смещения.
21-22.07.2017 г. в срочном порядке выполнено хирургическое вмешательство: ликвидация стеноза позвоночного канала с циркулярной декомпрессией спинного мозга на уровне Th5-Th6 позвонков. Коррекция и стабилизация травматической деформации позвоночника многоопорной транспедикулярной металлоконструкцией. Задний локальный спондилодез аутокостью, корпородез. ПХО ушибленных ран тела, верхних и нижних конечностей.
Особенности проведения хирургического вмешательства: разрез кожи по линии остистых отростков от Th2 до ТЫ 0, определятся выраженная субапоневротическая гематома на уровне грудного отдела позвоночника на всем протяжении доступа. Выявлено повреждение дорсальных костных структур позвонков Th5-Th6 со смещением дуги позвонка Th5 в просвет позвоночного канала. Дуральный мешок компремирован дутой позвонка Th5, пульсацию не передает. Определяются переломы левых поперечных отростков Th2-Th8 позвонков, повреждение реберно-позвоночного сочленения позвонка Th6 слева. Выполнена реконструкция позвоночного канала на уровне позвонков Th5-Th6 и циркулярная декомпрессия спинного мозга. Удален поврежденный диск на этом уровне и частично резецированы тела позвонков, вызывающие стеноз канала и компремируклцие дуральный мешок. Восстановлено физиологическое положение дурального мешка, последний не поврежден, появилась его отчетливая пульсация. В тела позвонков ТЪЗ, ТЪ4, ТЪ7, Th8, Th9 с обеих сторон и в тело позвонка Th6 справа установлены транспедикулярные винты. Устранена постравматическая деформация позвоночника и все виды дислокационных смещений позвонков посредством сегментарной коррекции. Посте проведенной коррекции между сохранившимися частями тел Th5-Th6 позвонков посте их частичной резекции сформировали корпородез. Выполнен задний локальный спондилодез аутокостью (рис. 4). Установлена дренажная система “Uno-Vac”
После операции глубина неврологического дефицита сохранялась на уровне типа В по ASIA.
В послеоперационном периоде пациенту проводили ИВЛ в течение первых 12 часов после вмешатель-ства, инфузионно-трансфузионную терапию в режиме нормогидратации коллоидно-кристаллоидными растворами, препаратами альбумина, плазмы, крови, по протоколу NASCIS-3 [12], стабилизацию и поддержание перфузионного давления спинного мозга (дофамин 5 мкг/кг в минуту 3 дня), а также профилактику тромбоэмболических осложнений. Также был назначен метилпреднизолон 5 мг/кг в течение 3 дней.
Со 2 суток после хирургического вмешательства ребенкуг начат курс стимуляции опорной поверхности стоп с использованием имитатора опорной подошвенной нагрузки «Корвит».
Всего на протяжении острого послеоперационного периода проведено 10 процедур.
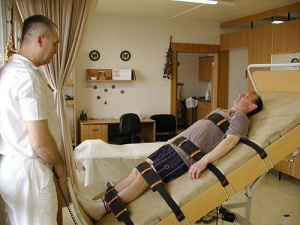
С 4-х суток на фоне восстановленной опороспо-собности позвоночника в комплекс лечения включена активная двигательная реабилитация с проведением дыхательной гимнастики (до 8-ми раз в день), массажа воротниковой области, верхних и нижних конечностей, ягодичной области, ЛФК с адаптацией к вертикальной нагрузке на наклонной плоскости, укладкой нижних конечностей, Экзарта-терапия (рис. 5).
С 8-х суток после хирургического вмешательства начат курс неинвазивной стимуляции спинного мозга. Два стимулирующих электрода (катоды) фиксировали между остистыми отростками позвонков ТЫ 1-ТЫ 2 и L1-L2 (круглые электроды с адгезивным слоем, диаметром около 3 см, BF-4, LEAD-LOC Inc., США). Индифферентные электроды (аноды) располагали симметрично над гребнями подвздошных костей (овальные электроды с адгезивным слоем, протяженностью около 10 см по длинной оси). Частота стимуляции составила от 5 до 30 Гц, интенсивность тока подбирали в процессе каждой процедуры в зависимости от ощущений пациента либо появления двигательной активности в нижних конечностях. Интенсивность тока варьировала в пределах от 20 до 90 мА, амплитуду тока увеличивали постепенно, в процессе каждой процедуры. Длительность процедуры составляла 30 минут 1 раз в день, курс стимуляции осуществляли на протяжении 10 суток.
На фоне проводимого комплексного восстановительного лечения на 14 сутки после операции была отмечена положительная неврологическая динамика в виде улучшения чувствительности и появления ее с уровня ТЬб-7 сегментов, отмечались видимые сокращения мышц бедер.
На 20 сутки отмечена положительная динамика в виде появления чувствительности в нижних конечностях (по мозаичному типу, с зонами гиперестезий). Первоначально начали восстанавливаться поверхностные виды чувствительности (болевая, температурная, тактильная), затем отмечали восстановление проприоцептивной чувствительности. С каждым последующим днем зона восстановления чувствительности расширялась.
На 21 сутки после операции на фоне комплексного реабилитационного лечения появились движения в каленном, тазобедренном и голеностопном суставах, а также в дистальных сегментах стоп (тыльная флексия, движения пальцев). Начала прослеживаться возможность сгибания и разгибания в шлейных суставах, кратковременное удержание на поверхности нижних конечностей в согнутом положении в коленном и тазобедренном суставах.
Через 30 дней после оперативного лечения пациент имел уровень неврологического дефицита типа С по шкале ASIA (двигательная функция 70 баллов, чувствительность - 130 баллов). В этот же период отмечалась положительная динамика в виде увеличения мышечной силы в проксимальных отделах нижних конечностей до 2 баллов, появилось чувство наполнения мочевого пузыря, частичный контроль мочеиспускания и дефекации.
На протяжении последующих 4 месяцев пациент постоянно ежедневно занимался самостоятельно, выполняя индивидуальные комплексы лечебной физкультуры по 1,5-2 часа в день, адаптировался к положению сидя, постепенно увеличивая время нахождения в этом положении на 5-10 минут ежедневно, получал курсы массажа конечностей и спины, проводилась вертикализация в ортезе, фиксирующем коленные и тазобедренные суставы.
Через 6 месяцев после операции пациент начал ходить самостоятельно с помощью дополнительных приспособлений.
Амбулаторное наблюдение проводили 1 раз в 3 месяца. Через 1 год неврологический статус по шкале ASIA соответствовал уровню D (двигательная функция 85 баллов, чувствительность - 175 баллов (91 + 84)) (рис. 6).
На рисунке 7 представлены фотоматериалы, показывающие этапы восстановления двигательной активноста данного пациента. Через 30 дней посте выполнения операции, проведения курса электрической стимуляции спинного мозга (10 процедур) и механической ритмической стимуляции опорной поверхности стопы (14 процедур), имитирующей условия ходьбы, пациент был способен выполнять произвольные движения в коленном и голеностопном суставах в положении лежа на спине (а). Следующий этап был связан с вертикализацией и восстановлением самостоятельного стояния (б). Затем пациент при стоянии с внешней поддержкой восстановил способность инициировать шагательные движения небольшой амплитуды. При стоянии пациент переносил центр тяжести на одну ногу и посте этого делал короткий шаг другой ногой, потам опять переходил к стоянию.
Движение противоположной ноги осуществлялось аналогичным образом (в). Через 6 месяцев посте операции пациент мог идти по ровной поверхности с тростью, опираясь второй рукой на руку методиста (г). На заключительном этапе (1 год после операции) пациент выполнял хорошо координированные шагательные движения по ровной поверхности с тростью в одной руке (д).
Результаты нейрофизиологического тестирования на заключительном этапе лечения показали, что ходьба на движущемся тредбане с опорой руками на брусья сопровождалась хорошо координированной ритмической ЭМГ-активностью в мышцах нижних конечностей. Электрическая неинвазивная стимуляция с частотой 30 Гц на уровне ТЫ 1-ТЫ 2 улучшала выполнение шагательных движений (рис. 8). Так, в левой ноге траектория движения конечной точки (движение маркера на большом пальце ноги) без стимуляции составляла 0,98 м (амплитуда 47 мм), тогда как при стимуляции спинного мозга эти значения увеличивались соответственно до 1,02 мм и 50 мм. В правой ноге траектория движения конечной точки до стимуляции составляла 1 м (амплитуда 60 мм), а при стимуляции 1,02 и 68 мм соответственно. Гистограммы, представленные на ри-сутше 8 в и г, показывают величины утловых перемещений в тазобедренном, коленном и голеностопном суставах правой и левой конечности при выполнении шагательных движений. Согласно этим данным, при стимуляции спинного мозга наблюдается тенденция к увеличению амплитуды движений в коленном суставе левой ноги и к уменьшению амплитуды движений в коленном сугставе правой ноги (в, г).
Рис. 7. Этапы восстановления двигательной активности у пациента Г., 17 лет. Произвольные движения ног в положении лежа на спине (а), стояние в вертикализаторе (б), инициация первых шагов (в), ходьба с тростью и поддержкой методиста (г), хорошо координированная ходьба с тростью (д)
При выполнении шагательных движений по ровной поверхности эффект стимуляции спинного мозга был выражен достаточно четко. Стимуляция спинного мозга укорачивала шагательный цикл и увеличивала частоту шагания (рис. 9). Если траектория движений конечной точки в правой ноге без стимуляции составляла 0,94 м, то при стимуляции спинного мозга - 0,79 м. В левой ноге эти значения были соответственно 0,87 м (без стимуляции) и 0,69 м (при сти-муляции). Согласно данным угловых перемещений в отдельных суставах, укорочение шагательного цикла при стимуляции спинного мозга связано, главным образом, с уменьшением амплитуда движений в голеностопном суставе (рис. 9, в, г).
ОБСУЖДЕНИЕ
Проблеме лечения детей с позвоночно-спинномозговой травмой посвящены немногочисленные исследования. В большинстве из них разбираются основные подходы и принципы хирургического лечения данной категории пациентов [13, 14]. В этих работах результат восстановления чувствительной и двигательной функции конечностей в основном рассматривается с точки зрения сроков проведенного вмешательства, прошедшего от момента травмы, а также варианта хирургического подхода и полноценности объема самой операции [15-17]. В настоящее время не вызывает сомнения, что хирургическое лечение пациенту с позвоночно-спинномозговой травмой должно быть выполнено в первые часы с момента повреждения.
Однако на восстановление активной локомоторной функции пострадавших влияние оказывает не только ликвидированный вертебро-медуллярный конфликт, но и исходная степень и уровень повреждения спинного мозга [18]. Реабилитационное лечение у соматически стабильных больных начинается сразу после операции и направлено на терапию тяжести повреждения спинного мозга, при этом модулируют физиологическое состояние позвоночника, основываясь на трех основных принципах: 1) модулируют нейронные цепи, придавая туловищу и конечностям физиологическое положение, дополняя пассивной реабилитацией на сегментах конечностей; 2) осуществляют фармакологическую модуляцию нейронных цепей; 3) модулируют физиологические функции спинного мозга методом электрической стимуляции (функциональной, чрескожной, эпидуральной) [19].
Роль неинвазивной электростимуляции спинного мозга в доступной нам литературе рассматривают лишь как меру обеспечения локомоторной функции сегментов конечностей у пациентов, перенесших спинномозговое повреждение, в отдаленном восстановительном периоде лечения [20-24]. Результаты данных работ достоверно подтверждают положительное влияние электрического воздействия на исследуемые параметры (транзиторное и стойкое улучшение локомоции и чувствительных сфер, мышечной силы и т.д.) [25-27].
В доступной литературе мы не встретили исследований, посвященных вопросам реабилитационного лечения в раннем послеоперационном периоде, и оценки динамики восстановления функций движения и опоры у пациентов детского возраста [15, 22, 28-30].
В ходе проведенного исследования выполненное в первые часы от момента повреждения оперативное вмешательство явилось основой успеха в последующем восстановительном лечении ребенка. Применение и использование методов реабилитационной терапии (чрескожная электрическая стимуляция спинного мозга и механическая стимуляция опорной поверхности стопы) способствовали более интенсивному' и полноценному этапному' восстановлению чувствительной и двигательной активности.
Согласно нашим данным, у большинства детей с осложненной травмой позвоночника, особенно грудного отдела, сопровождающейся клиническим проявлениями неврологических нарушений типа А и В по шкале ASIA, как правило, после проведенного хирургического лечения и реабилитации восстановление двигательной активности не происходит. В лучшем случае у этой категории пациентов все успехи на фоне терапии сводятся к улучшению чувствительности и контролю функции тазовых органов. Кроме того, следует подчеркнуть, что даже на такую незначительную положительную динамику' в клинической картине у данной категории больных требуются годы. В представленном клиническом наблюдении у ребенка с позвоночно-спинномозговой травмой грудного отдела после своевременного хирургического лечения и комплексной полноценной терапии с использованием неинвазивных методов восстановления функции спинного мозга удалось добиться значительной положительной динамики. Ребенок встал на ноги через 6 месяцев посте получения травмы, а восстановление неврологических нарушений типа В по шкале ASIA через 1 год достигло уровня типа D.
ЗАКЛЮЧЕНИЕ
Таким образом, проведенное в первые часы от момента повреждения хирургическое лечение пациента с позвоночно-спинномозговой травмой при комплексной ранней реабилитации с использованием нового метода неинвазивной чрескожной электрической стимуляции спинного мозга и механической стимуляции опорной поверхности стопы, имитирующей условия нагрузки на опорно-двигательный аппарат при ходьбе, позволило обеспечить регресс неврологических нарушений, способствовало более интенсивному восстановлению двигательных функций, раннему восстановлению навыков опоры и ходьбы. Пациент в течение 1 года от момента травмы восстановил регуляцию произвольного контроля мышечной активности, самостоятельного стояния и ходьбы с опорой на трость.ЛИТЕРАТУРА
1. Повреждения позвоночника и спинного мозга у детского населения / А.В. Залетина, С.В. Виссарионов, А.Г. Баиндурашвили, Д.Н. Коку-шин, К.С. Соловьева Ц Международный журнал прикладных и фундаментальных исследований. 2017. № 12-1. С. 69-73.
2. Совершенствование организации оказания неотложной специализированной хирургической помощи пациентам с травматическими и нетравматическими поражениями позвоночника в у'словиях мегаполиса / А.К. Дудаев, В.А. Мануковский, Д.И. Кутянов, Ю.Ю. Булахтин, С Л. Брижань, П.В. Желнов/У Вестник хирургии им. И.И. Грекова. 2017. Т. 176, № 4. С. 39-43.
3. The value of СТ and MRI in the classification and surgical decision-making among spine surgeons in thoracolumbar spinal injuries / S. Rajasekaran, A.R. Vaccaro. R.M. Kanna, G.D. Schroeder, F.C. Oner, L. Vialle, I. Chapman, M. Dvorak, M. Fehlings, A.P. Shettv, K. Schnake, A. Maheshwaran,
F. Kandziora // Eur. Spine J. 2017. Vol. 26, No 5. P. 1463-1469. DOI: 10.1007/s00586-016-4623-0.
4. Роботизированные технологии в реабилитации больных после хирургической реваскуляризации мозга / В.Д. Даминов, С.С. Кучеренко, Ю.Ю. Сагильдина, А.Н. Кузнецов/У Вестник восстановительной медицины. 2012. № 2 (48). С. 29-31.
5. Thoracolumbar burst fractures: a systematic review of management / K. Alpantaki, A. Bano, D. Pasku, A.F. Mavrogenis. P.J. Papagelopoulos,
G. S. Sapkas, D.S. Korres, P. Katonis//Orthopedics. 2010. Vol. 33, No 6. P. 422-429. DOI: 10.3928/01477447-20100429-24.
6. Single-stage posterior vertebral column resection and internal fixation for old fracture-dislocations of thoracolumbar spine: a case series and systematic review/H.Z. Tang, H. Xu, X.D. Yao, S.Q. Lin //Eur. Spine I. 2016. Vol. 25, No 8. P. 2497-2513. DOI: 10.1007/s00586-015-3955-5.
7. Позвоночно-спинномозговая травма у детей / А.Г. Баинду'рашвили, С.В. Виссарионов, Ю.С. Александрович, К.В. Пшениснов. СПб. : Онли-Пресс, 2016. 88 с.
8. Неврологические нарушения у детей с осложненными повреждениями позвоночника в грудном и поясничном отделах до и после хирургического лечения / С.В. Виссарионов, С.М. Белянчиков, И.Ю. Солохина, ПА. Икоева. Д.Н. Кокушин // Хирургия позвоночника. 2014. № 3. С. 8-21. DOI:10.i4531/ss2014.3.8-21.
9. Анализ влияния различных факторов на динамику неврологических нарушений у детей с позвоночно-спинномозговой травмой / А. Г. Баинду'рашвили, И.Ю. Солохина, Д.Н. Кокушин, С.М. Белянчиков // Ортопедия, Травматология и Восстановительная Хирургия Детского Возраста. 2015. Том 3, № 4. С. 12-21.
10. Page B.J. Thoracic Spine Fractures and Dislocations / Poduval M., Chief Ed. Medscape. 2018. URL: https:/emedicine.medscape.com article 1267029-overview.
11. Smith W.D., Ghazarian N., Christian G. Acute and Hyper-acute Thoracolumbar Corpectomy for Traumatic Burst Fractures Using a Mini-open Lateral Approach //Spine. 2018. Vol. 43, No 2. P. E118-E124. DOI: 10.1097, BRS.0000000000002244.
12. Administration of methylprednisolone for 24 or 48 hours or tirilazad mesylate for 48 horns in the treatment of acute spinal cord injury. Results of the Third National Acute Spinal Cord Injury Randomized Controlled Trial. National Acute Spinal Cord Injury' Study//M.B. Bracken, M.J. Shepard, T.R. Holford, L. Leo-Summers, E.F. Aldrich, M. Fazl, M. Fehlings, D.L. Herr, P.W. Hitchon, L.F. Marshall, R.P. Nockels, V. Pascale. P.L. Perot Jr., J. Piepmeier, V.K. Sonntag, F. Wagner, J.E. Wilberger, H.R. Winn, W. Young// JAMA. 1997. Vol. 277, No 20. P. 1597-1604. DOI: 10.1001/ jama.277.20.1597.
13. Epidemiology and Management of Spinal Trauma in Children and Adolescents <18 Years Old/A. Falavigna, O. Righesso, P. Guarise da Silva, F.A. Sanchez Chavez, E. Sfreddo, L. Pelegrini de Almeida, M.J. Valencia Carrasco. A.F. Joaquim //World Neurosurg. 2018. \bl. 110. P. e479-e483. DOI: 10.1016/j.wneu.2017.11.021.
14. Donenberg J.G., Fetters L., Johnson R. The effects of locomotor training in children with spinal cord injury: a systematic review//Dev Neurorehabil. 2019. Vol. 22, No 4. P. 272-287. DOI: 10.1080,17518423.2018.1487474.
15. Incidence of traumatic spinal cord injur/ worldwide: a systematic review/ S.B. Jazayeri, S. Beygi, F. Shokraneh, E.M. Hagen, V. Rahimi-Movaghar // Eur. Spine J. 2015. Vol. 24, No 5. P. 905-918. DOI: 10.1007/s00586-014-3424-6.
16. The Importance of Early Surgical Decompression for Acute Traumatic Spinal Cord Injury' / D.Y. Lee, Y.J. Park, S.Y. Song, S.C. Hwang, K.T. Kim, D.H. Kim//Clin. Orthop. Surg. 2018. \Ы 10, No 4. P. 448-454. DOI: 10.4055/cios.2018.10.4.448.
17. Anatomic conditions for bypass surgery between rostral (T7-T9) and caudal (L2, L4, SI) ventral roots to treat paralysis after spinal cord injury' / H. Bendella, S. Rink, A. Wohler, J. Feiser, A. Wilden, M. Grosheva, H.J. Stoffels, C. Meyer, M. Manthou, M. Nakamura, D.N. Angelov //Ann. AnaL 2019. Vol. 222. P. 139-145. DOI: 10.1016 j.aanat.2018.12.008.
18. Recovery' from a spinal cord injury': significance of compensation, neural plasticity, and repairЦA. Curt, H.J. Van Hedel, D. Klaus, V. Dietz; EM-SCI Study GroupЦ J. Neurotrauma. 2008. Vol. 25, No 6. P. 677-685. DOI: 10.1089/neu.2007.0468.
19. Bedi P.K., Arumugam N., Chhabra H.S. Effectiveness of activity-based therapy in comparison with surface spinal stimulation in people with traumatic incomplete spinal cord injury' for activation of central pattern generator for locomotion: Study Protocol for a 24-week Randomized Controlled Trial //Asian Spine J. 2018. Vol. 12, No 3. P. 503-510. DOI: 10.4184 asj.2018.12.3.503.
20. Targeted neurotechnology restores walking in humans with spinal cord injury' / F.B. Wagner, J.B. Mignardot, C.G. Le Goff-Mignardot, R. Demesmaeker, S. Komi, M. Capogrosso, A. Rowald, I. Seanez, M. Caban, E. Pirondini, M. Vat, L.A. McCracken, R. Heimgartner, I. Fodor, A. Watrin, P. Seguin, E. Paoles, K. Van Den Keybus, G. Eberle, B. Schurch, E. Pralong, F. Becce, N. Buse, R. Buschman, E. Neufeld, N. Kuster,
S. Carda, J. von Zitzewitz, V. Delattre, J. Prior, T. Denison, H. Lambert, K. Minassian. J. Bloch, G. Courtine Ц Nature. 2018. Vol. 563, No 7729. P. 65-71. DOI: 10.1038/s41586-018-0649-2.
21. Spinal rhythm generation by step-induced feedback and transcutaneous posterior root stimulation in complete spinal cord-injured individuals / K. Minassian, U.S. Hofstoetter, S.M. Danner, W. Mavr, I .A. Bruce, W.B. McKay, K.E. Tansev/7 Neurorehabil. Neural Repair. 2016. Vol. 30, No 3. P. 233-243. DOI: 10.1177/1545968315591706.
22. Noninvasive Spinal Cord Stimulation: Technical Aspects and Therapeutic Applications / R. Nardone, Y. Holler, A. Taylor, A. Thomschew'ski, A. Orioli, V. Frey, E. Trinlca, F. Brigo// Neuromodulation. 2015. Vol. 18, No 7. P. 580-591. DOI: 10.1111/ner.l2332.
23. Augmentation of Vbluntary' Locomotor Activity by Transcutaneous Spinal Cord Stimulation in Motor-Incomplete Spinal Cord-Injured Individuals / U.S. Hofstoetter, M. Krenn, S.M. Danner, C. Hofer, H. Kern, W.B. McKav, W. Mayr, K. Minassian // Artif. Organs. 2015. Vol. 39, No 10. P. E176-E186. DOI: 10.1111/aor.l2615.
24. Hardin E.C., Kobetic R., Triolo R.J. Ambulation and spinal cord injury // Phvs. Med. Rehabil. Clin. N. Am. 2013. Vol. 24, No 2. P. 355-370. DOI: 10.1016/j.pmr.2012.11.002.
25. Spinal cord stimulation facilitates functional walking in a chronic, incomplete spinal cord injured / R. Herman, J. He, S. D’Luzanskv, W. Willis, S. Dilli // Spinal Cord. 2002. Vol. 40, No 2. P. 65-68. DOI: 10.1038/sj.sc.3101263
26. Epidural spinal-cord stimulation facilitates recover,' of functional w'alking following incomplete spinal-cord injury / M.R. Carhart, I. He, R. Herman. S. D’Luzanskv', W.T. Willis//IEEE Trans. Neural Syst. Rehabil. Eng. 2004. Vol. 12, No 1. P. 52-42. DOI: 10.1109TNSRE.2003.S22763.
27. Behrman A.L., Harkema S.J. Physical rehabilitation as an agent for recovery' after spinal cord injury' //Pity's. Med. Rehabil. Clin. N. Am. 2007. Vol. 18, No 2. P. 183-202. DOI: 10.1016 j.pmr.2007.02.002.
28. A systematic review of clinical studies on electrical stimulation therapy for patients with neurogenic bowel dysfunction after spinal cord injury / Y. Deng. Y. Dong. Y. Liu, Q. Zhang, X. Guan, X. Chen. M. Li, L. Xu, C. Yang // Medicine. 2018. Vol. 97, No 41. P. el2778. DOI: 10.1097/ MD.0000000000012778.
29. Badhiwala I.H., Ahuja C.S., Fehlings MG. Time is spine: a review of translational advances in spinal cord injury // J. Neurosurg. Spine. 2018. Vol. 30, No 1. P. 1-18. DOI: 10.3171/2018.9.SPINE18682.
30. Late recover.- following spinal cord injur.-. Case report and review of the literature / J.W. McDonald, D. Becker, C.L. Sadowsky, J.A. Jane Sr., T.E. Conturo, L.M. Schultz//J. Neurosurg. 2002. Vol. 97, No2 Suppl. P. 252-265. DOI: 10.3171/spi.2002.97.3.0405.
АВТОРЫ:
1. Баиндурашвили Алексей Георгиевич, д. м. н., профессор, академик РАН, ФГБУ «НИДОИ им. Г.И. Тонера» Минздрава России, г. Санкт-Петербург, Россия
2. Виссарионов Сергей Валентинович, д. м. н., профессор, ФГБУ «НИДОИ им. Г.И. ТХ'рнера» Минздрава России, г. Санкт-Петербург, Россия
3. Белянчиков Сергей Михайлович, к. м. н., ФГБУ «НИДОИ им. Г.И. 1\грнера» Минздрава России, г. Санкт-Петербург, Россия
4. Каргавенко Кирилл Александрович, к. м. н., ФГБУ «НИДОИ им. Г.И. Тонера* Минздрава России, г. Санкт-Петербург, Россия
5. Солохина Ирина Юрьевна, ФГБУ «НИДОИ им. Г.И. Турнера» Минздрава России, г. Санкт-Петербург, Россия
6. Козырев Александр Сергеевич, к. м. н., ФГБУ «НИДОИ им. Г.И. Тонера» Минздрава России, г. Санкт-Петербург, Россия
7. Пухов Александр Михайлович, к. б. н., ФГБОУ ВО «Великолукская государственная академия физической культуры и спорта», г. Великие Луки, Россия
8. Мошонкина Татьяна Ромульевна, д. б. н., ФГБУН «Институт физиологии им. И.П. Павлова» Российской академии наук, г. Санкт-Петербург, Россия
9. Герасименко Юрий Петрович, д. б. н., профессор, член-корреспондент РАН, ФГБУН «Институт физиологии им. И.П. Павлова» Российской академии наук, г. Санкт-Петербург, Россия
Теги: позвоночно-спинномозговая травма
234567 Начало активности (дата): 04.12.2020 13:08:00
234567 Кем создан (ID): 989
234567 Ключевые слова: позвоночно-спинномозговая травма, спинальный стеноз, неинвазивная чрескожная электрическая стимуляция спинного мозга
12354567899
Похожие статьи
Возможности ультразвукового исследования коленного сустава в диагностике болезни ГоффаРентген на дому 8 495 22 555 6 8
Особенности реакции организма на первичную артропластику при травме проксимального отдела бедра у пострадавших с повышенным индексом массы тела (предварительное сообщение)
Новая технология реконструкции плеча свободным аутотрансплантатом из малоберцовой кости при гипотрофическом псевдоартрозе
«Многоликий» хронический остеомиелит: лучевая диагностика



