 30.11.2020
30.11.2020
Новая технология реконструкции плеча свободным аутотрансплантатом из малоберцовой кости при гипотрофическом псевдоартрозе
Применение современных технологий лечения пациентов с переломами плечевой кости с использованием металлоконструкций(различных вариантов свободной и несвободной костной аутопластики, динамических пластин DCP, LCP, интрамедуллярного блокируемого остеосинтеза, аппаратов внешней фиксации) не всегда гарантирует восстановление целостности поврежденного сегмента.
ВВЕДЕНИЕ
Актуальность проблемы лечения пациентов с переломами плечевой кости связана с высоким риском развития несращений [1]. При консервативном лечении ложные суставы формируются у 2–10 % пострадавших, псевдо-артрозы выявляют у 30 % оперированных больных [2]. Неоднократные и безуспешные оперативные вмешательства приводят к созданию сложного для дальнейшего восстановительного лечения патологического симптома комплекса поврежденной верхней конечности, включающего собственно несращение, межотломковый диастаз, изменение формы и архитектоники костной ткани отломков, их эбурнеацию, атрофию, сочетание склероза и остеопороза, рубцовые изменения мягких тканей, неврологические нарушения, контрактуры смежных суставов.
Особую группу составляют асептические псевдоартрозы с атрофическими отломками. По предлагаемым хирургическим протоколам обязательным условием для восстановления целостности плечевой кости является тщательная обработка концов отломков с созданием между ними адекватного контакта, вскрытие костномозговых каналов с резекцией
эбурнеированных концов и использование свободных алло- и аутотрансплантатов [1,3]. Для костной пластики предпочтение отдают трансплантатам из крыла подвздошной кости, в качестве металлоконструкции используют пластины LCP [3]. Дополнительно протоколы лечения пациентов с ложными суставами плечевой кости включают проведение клеточной терапии с применением остеопотентных клеток, факторов роста и скаффолдов. Признавая эффективность применения BMP- и PRP-терапии, авторы, однако, не рассматривают ее как самостоятельный вариант или протокол лечения [1,4]. В этих условиях для восстановления анатомо-функциональной целостности плечевой кости необходимо выполнить качественный, стабильный и управляемый остеосинтез с адекватной адаптацией концов отломков. Применение современных технологий лечения и металлоконструкций для различных вариантов свободной и несвободной костной аутопластики, динамических пластин DCP, LCP, интремедуллярного блокируемого остеосинтеза, аппаратов внешней фиксации не всегда гарантирует восстановление целостности поврежденного сегмента.
эбурнеированных концов и использование свободных алло- и аутотрансплантатов [1,3]. Для костной пластики предпочтение отдают трансплантатам из крыла подвздошной кости, в качестве металлоконструкции используют пластины LCP [3]. Дополнительно протоколы лечения пациентов с ложными суставами плечевой кости включают проведение клеточной терапии с применением остеопотентных клеток, факторов роста и скаффолдов. Признавая эффективность применения BMP- и PRP-терапии, авторы, однако, не рассматривают ее как самостоятельный вариант или протокол лечения [1,4]. В этих условиях для восстановления анатомо-функциональной целостности плечевой кости необходимо выполнить качественный, стабильный и управляемый остеосинтез с адекватной адаптацией концов отломков. Применение современных технологий лечения и металлоконструкций для различных вариантов свободной и несвободной костной аутопластики, динамических пластин DCP, LCP, интремедуллярного блокируемого остеосинтеза, аппаратов внешней фиксации не всегда гарантирует восстановление целостности поврежденного сегмента.
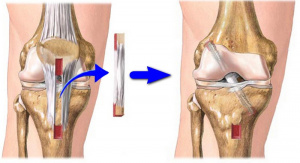
Достичь адекватного контакта сращиваемых концов отломков, предотвратить вторичное смешение, создать условия для костеобразования с помощью аутологичного костно-пластического материала возможно с использованием малоберцовой кости пациента. Идея использования малоберцовой кости для реконструкции плечевой кости не нова, она была описана Wright et al. в клиническом и биомеханическом исследовании [5]. Ранее мы имели скромный опыт успешного использования свободного массивного трансплантата малоберцовой кости в условиях чрескостного остеосинтеза для возмещения пострезекционных дефектов плечевой кости, сформированных у пациентов с саркомой Юинга и поражением плечевой кости в результате охинококкоза [6, 7]. В литературе имеются данные о достаточно широком клиническом применении свободных трансплантатов малоберцовой кости у пациентов с ложными суставами плечевой кости. Для остеосинтеза отломков плечевой кости коллеги использовали пластины DCP, LCP [2.3,8].
Цель работы - представить новую технологию использования свободного трансплантата малоберцовой кости в условиях чрескостного остеосинтеза для восстановления целостности плечевой кости у пациентов с гипотрофическими ложными суставами при отсутствии активной гнойной инфекции.
МАТЕРИАЛЫ И МЕТОДЫ
Ретроспективно мы оценили результаты восстановительного лечения четырех пациентов, у которых для реконструкции плеча использовали свободный аутотрансалантат малоберцовой кости.
Все пациенты были пролечены в одном отделении РНЦ "ВТО" им. ахад. Г.А. Илизарова в период с 2016 по 201S год. Все пациенты были женского пола в возрасте от 23 до 67 лет, имели посттравматическую этиологию псевдоартрозов, травму в результате ДТП получили две пострадавшие, бытовой характер травмы также был у двух пациенток. Все пациентки были ранее безуспешно оперированы один-два раза.
Все пациенты были пролечены в одном отделении РНЦ "ВТО" им. ахад. Г.А. Илизарова в период с 2016 по 201S год. Все пациенты были женского пола в возрасте от 23 до 67 лет, имели посттравматическую этиологию псевдоартрозов, травму в результате ДТП получили две пострадавшие, бытовой характер травмы также был у двух пациенток. Все пациентки были ранее безуспешно оперированы один-два раза.
Пациентки поступили на .лечение с имплантированными интрамедуллярными блокируемыми стержнями, у одной больной был динамизирован дистальный павильон стержня.
Металлоконструкции были нестабильны. У двух пациенток кресле БИОС был безуспешно применен накостный остеосинтез. По данным анамнеза продолжительность несрашения составила от года до семи лет.
Сформированные несрашения были классифицированы как атрофические (нежизнеспособные) по классификации Weber T.W., Cech O. [9]. По классификации В.И. Шевцова с авт. [10] выявленные несрашения плечевой кости были характерными для дефектпсендсартрозсв с анатомически укорочением (у двух пациенток) и без анатомическссо укорочения сегмента (также у двух бальных). Анатомические укорочения плечевой кости величиной соответственно 2 и 5 см были выявлены у двух пациенток. Две пациентки имели стойкие комбинированные контрактуры плечевых и локтевых суставов с резкими ограничением объема движений и функции верхней конечности.
Для реконструкции плеча использовали свободный аутотрансплантат малоберцовой кости величиной от 8 (п = 3) до 10 см (n = 1). Для рассверливания костномозгового канала и зоны псевдоартроза использовали римеры диаметром 10 и 11 мм.
Сформированные несрашения были классифицированы как атрофические (нежизнеспособные) по классификации Weber T.W., Cech O. [9]. По классификации В.И. Шевцова с авт. [10] выявленные несрашения плечевой кости были характерными для дефектпсендсартрозсв с анатомически укорочением (у двух пациенток) и без анатомическссо укорочения сегмента (также у двух бальных). Анатомические укорочения плечевой кости величиной соответственно 2 и 5 см были выявлены у двух пациенток. Две пациентки имели стойкие комбинированные контрактуры плечевых и локтевых суставов с резкими ограничением объема движений и функции верхней конечности.
Для реконструкции плеча использовали свободный аутотрансплантат малоберцовой кости величиной от 8 (п = 3) до 10 см (n = 1). Для рассверливания костномозгового канала и зоны псевдоартроза использовали римеры диаметром 10 и 11 мм.
Техническое исполнение (Патент РФ «Способ реконструкции плечевой кости при гипотрофическом псевдоартроз [11D). Интрамедуллярный гвоздь удаляли по стандартному протоколу, после чего с использованием разверток (римеров) формировали канал, диаметр которого превышал диаметр трансплантата на 1,0 мм. Засор аутотрансплантата осуществляли из диафиза малоберцовой кости проксимальнее уровня голеностопного сустава на 9 см. Аутотрансплантат формировали длиной 3-10 см. При наличии накостной металтсконструкши ее удаляли. После гемостаза ран; послойно ушивали. Пальпировали большой бугорок, определяли ш. supraapinatus и разделяли среднюю порцию сухожилия вдаль его волокон. Шилом с Т-образной рукояткой вскрывали костномозговой канал плечевой кости. Измеряли наибольший поперечный размер аутотрансплантата. Разверткой, равной по диаметру наибольшему поперечному размеру аутотрансплантата, проходили в костномозговой канал и расширяли его.
Клиническим пример. Пациентка Т., 53-х лет, поступила с жалобами на боли в левом плече, патологическую микроподвижность отломков. Диагноз: гипотрофический псевдоартроз правой плечевой кости, состояние после блокируемого интрамедуллярного остеосинтеза. Хронический аутоиммунный тиреоидит. Из анамнеза известно, что переломы правой ключицы и левой плечевой кости были получены в результате ДТП год назад. Было проведено оперативное лечение по месту жительства, выполнен БИОС левой плечевой кости, накостный остеосинтез правой ключицы. Сращения левого плеча достигнуто не было. Левая верхняя конечность была фиксирована на косыночной повязке. При клиническом осмотре у больной были выявлены линейные нормотрофичные рубцы на протяжении левого плеча, не спаянные с подлежащими тканями и костными отломками. Укорочения и атрофии мягких тканей левого плеча выявлено не было. Движения плечевого сустава: отведение - 70°, сгибание - 80°, разгибание - 25°, с мышечной силой 3 балла. Движения локтевого сустава: сгибание - 40°, разгибание - 180°, безболезненные, с мышечной силой 4-5 баллов. Выявлена патологическая подвижность отломков плечевой кости в средней трети диафиза, манипуляция была болезненной. Ангионевротических расстройств выявлено не было (рис. 1, а).
В Центре Илизарова выполнено удаление интрамедуллярного фиксатора, закрытое рассверливание зоны псевдоартроза, антеградная имплантация свободного аутотрансплантата из цилиндр-фрагмента малоберцовой кости. Для этого выделили фрагмент диафиза малоберцовой кости, сформировали из него аутотрансплантат в форме костного штифта цилиндрической формы. С проксимального конца плечевой кости, со стороны головки, сформировали место ввода аутотрансплантата. В плечевой кости сформировали канал, который соответствовал по размеру и геометрически являлся продолжением костномозгового канала плечевой кости. Вскрыли костномозговой канал разверткой (диаметр 10 мм), равной по диаметру наибольшему поперечному размеру аутотрансплантата, прошли в костномозговой канал. Расширили костномозговой канал, достигли зоны псевдоартроза. Закрыто вскрыли зону псевдоартроза, разрушили сформированные замы нательные пластинки на концах отломков плечевой кости, адаптировали концы отломков с формированием костно-пластического материала, локализованного по периферии зоны адаптации отломков. Используя аппарат Илизарова, сопоставили проксимальный и дистальный отломки плечевой кости до анатомически правильного положения, костномозговой канал проксимального отломка был продолжением костномозгового канала дистального отломка. Удерживая отломки в достигнутом положении, разверткой прошли вдоль костномозгового канала дистального отломка на глубину 10 мм. Ввели аутотрансплантат закрыто и антеградно в сформированный костномозговой канал плечевой кости, перекрывая ин-трамедуллярно зону псевдоартроза. Сегмент фиксировали аппаратом Илизарова. В послеоперационном периоде производили дозированную компрессию зоны псевдоартроза по 0,75-1 мм раз в 10-14 дней (рис. 1, б). Через три месяца визуализировали костное сращение в зоне псевдоартроза, аппарат Илизарова демонтировали (рис. 1, в)
ОБСУЖДЕНИЕ
По мнению ряда авторов, отсутствие жесткой и стабильной фиксации отломков плечевой кости является одной из ключевых причин несращения после реконструктивных вмешательств [12-15]. Обязательным условием для достижения консолидации является создание адекватного контакта между концами отломков с компрессией по всей зоне несращения [16]. По нашему мнению, возможности любой динамической погружной системы (интрамедуллярной и накостной) ограничены по времени и силе воздействия.
Преимущества внешней фиксации по данным позициям очевидны и неоспоримы. Аппарат внешней фиксации позволяет создать управляемую фиксацию отломков плечевой кости и поддерживать ее в необходимом режиме до достижения консолидации отломков. Вместе с тем, имеются и определенные недостатки чрескостного остеосинтеза, связанные, в первою очередь, со снижением качества жизни пациентов, риском воспаления мягких тканей в области чрескостных элементов фиксации, развитием контрактур смежных суставов и т.д. [17,18]. Но данные недостатки при сокращении продолжительности лечения, соблюдении эпидемиологического режима и наличии полноценной реабилитации пациентов являются оправданными и преодолимыми. Существует идея стабилизации отломков, в том числе при удлинении, при комбинации внешней фиксации и интрамедуллярного армирования спицами (тенами) [19].
Вместе с тем, общепризнано, что наиболее оптимальным костно-пластическим материалом является аутогенная кость. Малоберцовая кость, имплантируемая в костномозговую полость отломков, в зоне их стыка и адаптации выполняет рать шины и дополнительно армирует плечевую кость, предотвращая риск вторичного смещения при создании компрессионных усилий аппаратам. В результате закрытого дополнительного рассверливания костномозгового канала на уровне псевдоартроза в межотлом-ковом диастазе и по периферии зоны стыка формируется аутогенный костнопластический материал, являющийся субстратом локального костнопластического вмешательства, стимулирующего остеогенез.
Рассверливание костномозгового канала и зоны псевдоартроза при ревизионных вмешательствах некоторые авторы рассматривают как механизм, запускающий каскад процессов ангиогенеза, ремоделирования сосудистой сети восстановленного сегмента и обеспечивающий достижение костного сращения [20].
Продукты римирования обладают остеогенной потенцией [21,22], заполняют межфрагментарный диастаз, что в совокупности с восстановлением ангиогенеза, усилением периостального кровоснабжения и ремоделированием сосудистой сети [20, 23] исключает необходимость проведения открытой ревизии зоны несращения [24, 25], снижена травматичность оперативного пособия.
ЗАКЛЮЧЕНИЕ
Суть новой технологии заключается в следующем. Свободный костный аутотрансплантат в виде цилиндр-фрагмента малоберцовой кости имплантируют в зону активного ангио- и остеогенеза. Зону адаптации отломков плечевой кости внутрикостно на протяжении армируют имплантом, исключающим риск вторичного смещения отломков при создании компрессии аппаратом внешней фиксации. Использование аппарата внешней фиксации позволяет создать адекватный контакт в области костной раны и поддерживать компрессию между концами отломков плечевой кости до формирования костного блока.ЛИТЕРАТУРА
1. Humeral shaft non-union after intramedullar,' nailing / G. Campochiaro, P. Baudi, M. Gialdini, A. Corradini, V. Duca, M. Rebuzzi, F. Catani // Musculoskelet Surg. 2017. Vol. 101, No 2. P. 189-193. DOI 10.1007/sl2306-017-0468-x.
2. Role of autologous non-vascularised intramedullary fibular strut graft in humeral shaft nonunions following failed plating / S. Kashayi-Chowdojirao, A. Vallurupalli, V.K. Chilakamarri, C. Patnala, L.M. Chodavarapu, N.R. Kancherla, A.H.K. Syed//J. Clin. Orthop. Trauma. 2017. Vol. 8, No Suppl. 2. P. S21-S30. DOI: 10.1016tf.jcot.2016.12.006.
3. Babhulkara S., Babhulkara S., Vasudev A. Recalcitrant aseptic atrophic non-union of the shaft of the humerus after failure of surgical treatment: management by excision of non-union, bone grafting and stabilization by LCP in different modes // Injur,'. 2017. Vol. 48, No Suppl. 2. P. S33-S43. DOI: 10.1016/S0020-1383(17)30492-8.
4. From plate to nail: a case-report of proximal humerus non-union / A. Pantalone, D. Vanni, M. Guelfi, M. Abate, A. Belluati, V. Salini // Injury. 2015. Ш. 46, No Suppl. 7. P. S48-S50. DOI: 10.1016/80020-1383(15)30046-2.
5. Reconstruction of humerus with an intramedullar,' fibular graft A clinical and biomechanical study / T.W. Wright, G.J. Miller, RA. Vander Griend, D. Wheeler, P.C. Dell // J. Bone Joint Surg. Br. 1993. Vol. 75, No 5. P. 804-807.
6. Применение чрескостного остеосинтеза при лечении больного с саркомой Юинга алечевой кости / И.И. Балаев, Л.М. Куфтырев, Д.Ю. Борзунов, А.В. Злобин,,/Гений ортопедии. 2004. № 2. С. 63-65.
7. Редкое клиническое наблюдение эхинококкового поражения диафиза атечевой кости/ Д.Ю. Борзунов, А.И. Митрофанов, Д.С. Моховиков, Д.В. Сорокин // Гений ортопедии. 2014. № 2. С. 64-68.
8. Humeral shaft nonunions treated with fibular allograft and compression plating / L.A. Crosby, B.L. Norris, K.D. Dao, M.H. McGuire // Am. J. Orthop. (Belle Mead NJ). 2000. Vol. 29, No 1. P. 45-47.
9. Weber B.G., Cech O. Pseudarthrosis: Pathophysiology, biomechanics, therapy, results. New York, NY: Grune and Strattoa 1976.
10. Псевдоартрозы, дефекты костей верхней конечности и контрактуры локтевого сустава (базовые технологии лечения аппаратом Илизарова) / В.И. Шевцов, ВД. Макушин, Л.М. Куфтырев, Ю.П. Солдатов. Курган : Зауралье, 2001.407 с.
11. Способ реконструкции плечевой кости при гипотрофичексом псевдоартрозе : пат. 2695268 Рос. Федерация, МПК А61В 17/62 /Д.С. Моховиков, С.Н. Колчин, Д.Ю. Бору,нов; патентообладатель: ФГБУ «РНЦ «ВТО» им. акад. Г.А. Илизарова Минздрава России. - № 2018139093; заявл. 06.11. 2018; опубл. 22.07.2019.
12. Nonunion of the humeral shaft / W.L. Healy, G.M. White, C.A. Mick, A.F. Brooker Jr., A.J. Weiland // Clin. Orthop. RelaL Res. 1987. No 219. P. 206-213.
13. Atrophic ununited diaphyseal fractures of the humerus with a bony defect: treatment by wave-plate osteosynthesis / D. Ring, J.B. Jupiter, J. Quintero, R.A. Sanders, R.K. Marti// J. Bone Joint Surg. Br. 2000. Vol. 82, No 6. P. 867-871. DOI: 10.1302,0301-620x.82b6.10124.
14. Open reduction and internal fixation of humeral nonunions: a biomechanical and clinical study / I.F. Rubel, P. Kloen, D. Campbell, M. Schwartz, A. Liew, E. Myers, D.L. Helfet// J. Bone Joint Surg. Am. 2002. Vol. 84, No 8. P. 1315-1322. DOI: 10.2106/00004623-200208000-00004.
15. Marti R.K., Verheyen C.C., Besselaar P.P. Humeral shaft nonunion: evaluation of uniform surgical repair in fiftv-one patients // J. Oithop. Trauma. 2002. Ш. 16, No 2. P. 108-115.
16. Sitati F.C., Kingori J. Outcome of management of humerus diaphvsis non-union// East and Central African Journal of Surgery. 2009. Vol. 14, No 2. P. 15-17.
17. Gubin A.V., Borzunov D.Y., Maikova T.A. The Dizarov paradigm: thirty years with the Ilizarov method, current concerns and future research // Int Orthop. 2013. Vol. 37, No 8. P. 1533-1539. DOI: 10.1007/s00264-013-1935-0.
18. Gubin A.V., Borzunov D.Y., Maikova T.A. Ilizarov method for bone lengthening and defect management: Review of contemporary literature // Bulletin of the Hospital for Joint Diseases. 2016. Vol. 74, No 2. P. 145-154.
19. The use of flexible intramedullar.- nails in limb lengthening/A. Popkov, P. Foster, A. Gubin, D. Borzunov, D. Popkov //Expert Rev. Med. Devices. 2017. Vol. 14, No 9. P. 741-753.
20. Pape H.C., Giannoudis P. The biological and physiological effects of intramedullary reaming// J. Bone Joint Surg. Br. 2007. Vbl. 89, No 11. P. 1421-1426.
21. Reaming in treatment of non-unions in long bones: cytokine expression course as a tool for evaluation of non-union therapy / F. Westhauser, G. Zimmermann, S. Moghaddam, T. Bruckner, G. Schmidmaier, B. Biglari, A. Moghaddam //Arch Orthop. Trauma Surg. 2015. Vol. 135, No 8. P. 1107-1116. DOI: 10.1007/s00402-015-2253-3.
22. RIA fractions contain mesenchymal stroma cells with high osteogenic potency / P. Kuehlfluck, A. Moghaddam, L. Helbig, C. Child, B. Wildemann,
G. Schmidmaier; HTRG-Heideiberg Trauma Research Group //Injury. 2015. Vol. 46, No Suppl. 8. P. S23-S32. DOI: 10.1016.50020-1383(15)30051-6.
23. Pfeifer R., Sellei R., Pape H.C. The biology of intramedullar/ reaming,// Injury. 2010. Vbl. 41, No Suppl. 2. P. S4-S8. DOI: 10.1016/S0020-1383(10)70002-4.
24. Marti R.K., Kloen P. Concepts and Cases in Nonunion Treatment. 1st Ed. Davos: AO Publishing. 2011.960 p.
25. Practice of Intramedullary Locked Nails. New Developments in Techniques and Applications / K.-S. Leung, G. Taglang, R. Schnettler, V. Alt, H. J.T.M. Haarman, H. Seidel, eds. Berlin, Heidelberg: Springer. 2006. 308 p.
АВТОРЫ:
1. Борзунов Дмитрий Юрьевич, д. м. н., ФГБОУ ВО «Уральский государственный медицинский университет» Минздрава России, г. Екатеринбург, Россия, МАУ "ЦГКБ № 23", г. Екатеринбург, Россия
2. Моховиков Денис Сергеевич, к. м. н., ФГБУ «НМИЦ ТО имени академика Г.А. Илизарова» Минздрава России, г. Курган, Россия
3. Колчин Сергей Николаевич, к. м. н., ФГБУ «НМИЦ ТО имени академика Г.А. Илизарова» Минздрава России, г. Курган, Россия
Теги: плечевая кость
234567 Начало активности (дата): 30.11.2020 15:36:00
234567 Кем создан (ID): 989
234567 Ключевые слова: плечевая кость, гипотрофический псевдоартроз, свободная костная пластика, аутотрансплантат, аппарат Илизарова
12354567899
Похожие статьи
Магнитно-резонансная томография с аксиальной нагрузкой в диагностике нарушений статики поясничного отдела позвоночникаРентген на дому 8 495 22 555 6 8
Болезнь Легга-Кальве-Пертеса и асептический некроз головки бедренной кости: МРТ–семиотика терминальных стадий заболевания с исходом в деформирующий артроз
Наблюдение за больными после тотального эндопротезирования тазобедренного и ревизионные повторные операции при асептической нестабильности компонентов тотальных эндопротезов тазобедренного сустава
Исходы лечения больных с открытыми переломами длинных костей



