 27.11.2025
27.11.2025
Возможности бронхоальвеолярного лаважа в диагностике прогрессирующего легочного фиброза
Прогрессирующий легочный фиброз (ПЛФ) представляет плохой прогноз у пациентов с интерстициальными заболеваниями легких, в том числе у пациентов с гиперчувствительным пневмонитом (ГП).
ВВЕДЕНИЕ
Интерстициальные заболевания легких (ИЗЛ) представляют собой группу заболеваний, поражающих паренхиму легочной ткани. Несмотря на различную этиологию и патогенез при хроническом течении, ряд ИЗЛ характеризуется повышенным фиброобразованием, что приводит к развитию хронической дыхательной недостаточности, ухудшению качества жизни и ухудшению прогноза [1]. Такое течение различных ИЗЛ в настоящее время обозначается термином прогрессирующий легочный фиброз (ПЛФ) [2, 3]. Основными ИЗЛ, для которых характерно развитие ПЛФ, являются идиопатический легочный фиброз (ИЛФ), гиперчувствительный пневмонит (ГП), неклассифицируемые ИЗЛ, а также ИЗЛ, ассоциированное с системной склеродермией (ССД) [4, 5]. По данным зарубежных ретроспективных исследований, частота ПЛФ при ИЗЛ составляет от 13 до 40% пациентов с ИЗЛ в Европе и США [6].Несмотря на разнородные данные о частоте и распространенности ПЛФ, большинство авторов выделяют хронический ГП как наиболее распространенный вариант ПЛФ. По данным Американского торакального общества и результатам исследования INBUILD, ГП является самым распространенным ИЗЛ, для которого характерно развитие ПЛФ (38-40% от всех ПЛФ) [6, 7]. Частота ПЛФ при ГП составляет от 25,1 (исследование INBUILD) до 58% (канадский регистр легочного фиброза) [7, 8]. Диагноз ГП устанавливается на основании анамнестических данных, функциональных и рентгенологических методов исследования, а также данных клеточного состава бронхоальвеолярного лаважа (БАЛ). Лимфоцитарный состав БАЛ характерен для ГП, в то время как для ИЛФ, являющимся вторым по распространенности ПЛФ, клеточный состав представлен преимущественно нейтрофилами [9, 10].
Несмотря на то что для постановки диагноза ПЛФ большинство авторов используют показатели, представленные в клинических рекомендациях Американского торакального общества от 2022 г., общепризнанные критерии ПЛФ отсутствуют. Американское торакальное общество предлагает клинические, функциональные и рентгенологические критерии, динамика которых оценивается в срок 12 мес., что является недостатком в отношении ранней диагностики ПЛФ при первичной постановке диагноза [10]. В связи с этим, в настоящее время продолжается поиск лабораторных биологических маркеров для диагностики ПЛФ.
Одними из наиболее изученных биологических маркеров при ИЗЛ являются матриксные металлопротеиназы (MMP), хемокины, такие как моноцитарный хемоаттрактантный белок-1 (MCP-1), а также маркеры иммунной дисрегуляции, к которым относятся фактор роста эндотелия сосудов (VEGF), фактор некроза опухоли a (TNFa), профибротические цитокины - трансформирующий фактор роста р1 (TGF-p1) и тромбоцитарный фактор роста BB (PDGF-BB) [11, 12]. Большинство биомаркеров наиболее изучено при ИЛФ и представляют собой перспективу для изучения данных показателей у других ПЛФ, т. к. имеют общие патогенетические характеристики [13].
Целью исследования явилось изучение динамики уровней MCP-1, VEGF, ММР-1, ММР-7, ММР-9 в жидкости БАЛ и их взаимосвязи с критериями прогрессирующего легочного фиброза у пациентов с идиопатическим легочным фиброзом и гиперчувствительным пневмонитом.
Этическая экспертиза. Протокол исследования одобрен Независимым этическим комитетом Федерального государственного бюджетного образовательного учреждения высшего образования «Кубанский государственный медицинский университет» Министерства здравоохранения Российской Федерации (протокол №11 от 14.09.2022).
МАТЕРИАЛЫ И МЕТОДЫ
В исследование были включены 62 пациента с ИЗЛ, в том числе 39 мужчин (средний возраст 61,1 ± 10,1 года) и 23 женщины (средний возраст 63,8 ± 7,8 года), находящихся на лечении и обследовании в пульмонологическом отделении и консультативно-диагностической поликлинике ГБУЗ «НИИ-ККБ №1 имени профессора С.В. Очапо- вского». Разделение по группам основано по нозологиям и признаками ПЛФ: 1-я группа представлена пациентами с ИЛФ (n = 12; средний возраст 67,5 ± 7,3 года), во 2-ю группу вошли пациенты с ГП и признаками ПЛФ (n = 18; средний возраст 67,1 ± 6,5 года); в 3-ю группу - с ГП без признаков ПЛФ (n = 32; средний возраст 57,5 ± 11,1 года). Средний стаж болезни у пациентов с ИЛФ составил 2,3 ± 1,8 года, у пациентов с ГП с признаками ПЛФ 1,8 ± 1,5 года, у пациентов с ГП без признаковИнтерстициальные заболевания легких
ПЛФ 2,8 ± 2,1 года (р = 0,02). Срок динамического наблюдения составил 1,1 ± 0,8 года.
Всем пациентам выполнена спирометрия и измерение диффузионной способности легких для монооксида углерода (DLCO). Измерение уровня одышки проводилось по шкале Modified Medical Research Council (mMRC). Компьютерная томография высокого разрешения (КТВР) выполнена всем пациентам, у 31 пациента проведена морфологическая верификация диагноза. По данным КТВР определены критерии фиброза легких: ретикулярные изменения с преобладанием в субплевральных и базальных отделах легких, наличие тракционных бронхо/брон- хиолоэктазов и/или «сотовое легкое» [1]. Для определения ПЛФ использованы критерии диагностики Американского торакального общества от 2022 г., которые соответствуют возникшим в течение 12 мес. 2 из 3 критериев: усиление респираторных симптомов; абсолютное снижение ФЖЕЛ £5% от должных в течение 1 года; увеличение распространенности фиброзных изменений по данным КТВР [10].
Посредством фибробронхоскопии, проведенной под местной анестезией, выполнялся забор БАЛ. В сегментарной части средней доли расклинивали бронхоскоп и вводили 4 фракции 50 мл теплого физиологического раствора, после инстилляции жидкость отсасывалась и помещалась в стерильные контейнеры. После центрифугирования на- досадочную жидкость хранили в замороженном виде для последующего определения значений цитокинов и хемо- кинов. Показатели уровней биомаркеров в жидкости БАЛ исследованы на иммуноферментном анализаторе «Hydro Flex» (TECAN, Австрия) с помощью наборов Вектор-Бест (Россия) для количественного определения уровня MCP-1 и VEGF и наборов RayBiotech (США) для количественного определения уровня MMP-1, MMP-7, MMP-9.
Протокол исследования одобрен Независимым этическим комитетом Федерального государственного бюджетного образовательного учреждения высшего образования «Кубанский государственный медицинский университет» Министерства здравоохранения Российской Федерации (протокол №11 от 14.09.22).
Статистическая обработка данных проводилась с помощью программы Statistica 10,0. Показатели представлены в виде M (SD), где M - среднее значение, SD - стандартное отклонение при параметрическом распределении и в виде медианы (Ме) 25 и 75 перцентиля при непараметрическом. При сравнении групп применены критерии Краске- ла - Уоллиса и %2. Для оценки различий между 2 группами в зависимости от нормальности распределения и типа данных использован коэффициент корреляции r-Пирсона. Связи и различия сравниваемых показателей считали статистически значимыми при р < 0,05.
РЕЗУЛЬТАТЫ
Признаки ПЛФ, согласно критериям диагностики Американского торакального общества, выявлены у 30 обследованных, в том числе у 12 пациентов с ИЛФ и у 18 - с ГП. Возраст пациентов с признаками ПЛФ был статистически выше пациентов с ИЗЛ без признаков ПЛФ (67,3 ± 6,9 vs 57,5 ± 11,1 года; р < 0,001). Средний возраст пациентов с ГП и признаками ПЛФ был сопоставим со средним возрастом пациентов с ИЛФ (67,1 ± 6,5 vs 67,5 ± 7,3 года соответственно; р = 0,4).Данные о степени выраженности одышки по шкале mMRC и динамики функциональных методов исследования представлены в табл. 1.
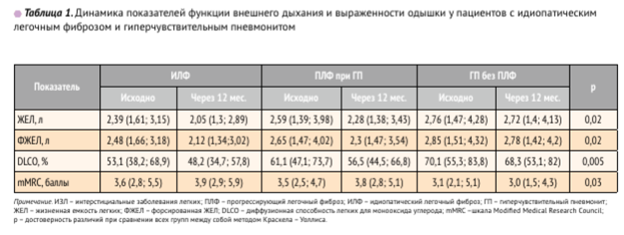
Показатели вентиляционной функции легких исходно статистически значимо отличались в 1-й и 3-й группах: ФЖЕЛ у пациентов с ИЛФ составила 2,48 ± 0,72 л, а у больных с ГП без признаков ПЛФ - 2,82 ± 0,83 л (р = 0,01). Исходные показатели ФЖЕЛ при ГП с признаками фиброза составили 2,65 ± 0,78 л и были сопоставимы с показателями 1-й и 3-й групп (р = 0,2 и р = 0,3 соответственно). Показатели DLCO были статистически значимо ниже у пациентов 1-й и 2-й группы в сравнении с группой ГП без признаков ПЛФ и составили при ИЛФ 53,1 ± 13,3%, при ГП с признаками ПЛФ 61,1 ± 16,9% в сравнении с 70,1± 18,8% у пациентов с ГП без ПЛФ (р = 0,01 и р = 0,01 соответственно).
Исследования уровней MCP-1, VEGF, ММР-1, ММР-7, ММР-9 в жидкости БАЛ показали, что исходно эти показатели были выше у пациентов 1-й и 2-й групп с ПЛФ в сравнении с данными пациентов с ГП без ПЛФ (табл. 2). Исходные уровни металлопротеиназ ММР-1, ММР-7, ММР-9 при ИЛФ были сопоставимы с аналогичными показателями при ГП с признаками ПЛФ. Уровни ММР-1,
ММР-7, ММР-9 были статистически значимо выше у пациентов с ГП и ПЛФ при сравнении ГП без признаков фиброза (p = 0,03 для ММР-1; p = 0,05 для ММР-7 и p = 0,05 для ММР-9 соответственно). Вместе с тем, при изучении динамики исследуемых показателей через 12 мес. только у показателя MMP-7 выявлена отрицательная корреляция между повышением уровня данного показателя в БАЛ в течение 12 мес. со снижением ФЖЕЛ £5% и DLCO £10% от должных в течение 1 года (г = - 0,65; p = 0,004 и г = - 0,78; p = 0,002 соответственно).
Динамика показателей уровней металлопротеиназ (MMP-1, MMP-7, MMP-9), MCP-1 и VEGF в жидкости БАЛ у пациентов с ИЛФ и ГП представлена в табл. 2.
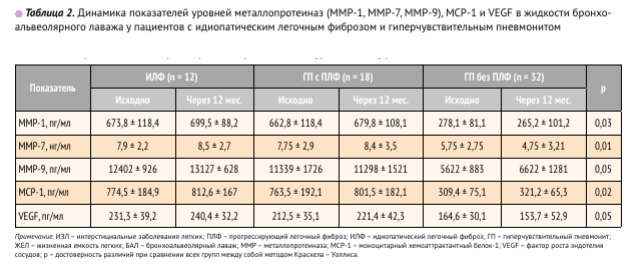
Концентрации MCP-1 и VEGF в БАЛ также были статистически значимо выше в группах пациентов с ИЛФ и ГП с ПЛФ в сравнении с 3-й группой. Показатели VEGF в жидкости БАЛ при ГП без признаков ПЛФ (164,6 ± 30,1 пг/мл) исходно были статистически значимо ниже, чем у пациентов с ИЛФ (231,3 ± 39,2 пг/мл, p = 0,004) и у пациентов с ПЛФ при ГП (212,5 ± 35,1 пг/мл, p = 0,006). Статистически значимых различий между исходными показателями VEGF и уровнями VEGF через 12 мес. в 1-й и 2-й группах не выявлено (p = 0,8 при ИЛФ, p = 0,7 при ГП с ПЛФ).
Уровень MCP-1 у пациентов с ИЛФ (774,5 ± 184,9 пг/мл) и пациентов с ГП и ПЛФ (763,5 ± 192,1 пг/мл) был статистически значимо выше, чем у пациентов с ГП без признаков ПЛФ (309,4 ± 75,1 пг/мл, p < 0,001 для ИЛФ; p < 0,001 для ГП с ПЛФ). Через 12 мес. выявлена отрицательная корреляция между уровнем MCP-1 в БАЛ больных ИЛФ и пациентов с ГП с ПЛФ с показателями ФЖЕЛ £ 5% (г = - 0,69; p = 0,007) и DLCO £ 10% (г = - 0,81; p = 0,003 соответственно).
Уровень MCP-1 у пациентов с ИЛФ (774,5 ± 184,9 пг/мл) и пациентов с ГП и ПЛФ (763,5 ± 192,1 пг/мл) был статистически значимо выше, чем у пациентов с ГП без признаков ПЛФ (309,4 ± 75,1 пг/мл, p < 0,001 для ИЛФ; p < 0,001 для ГП с ПЛФ). Через 12 мес. выявлена отрицательная корреляция между уровнем MCP-1 в БАЛ больных ИЛФ и пациентов с ГП с ПЛФ с показателями ФЖЕЛ £ 5% (г = - 0,69; p = 0,007) и DLCO £ 10% (г = - 0,81; p = 0,003 соответственно).
ОБСУЖДЕНИЕ
В настоящее время проведены единичные исследования для поиска лабораторных биомаркеров ПЛФ. Концентрации металлопротеиназ ММР-1, ММР-7, ММР-9 изучены в сыворотке крови пациентов с ИЛФ и ГП, установлено, что наиболее значимой для диагностики ПЛФ является уровень ММР-7 [14, 15]. По данным J. Guiot et aL., значение MMP-7 в сыворотке крови при ИЛФ на уровне 12,1 нг/мл было значимо связано со смертностью от всех причин, в то время как в исследовании Y. Ваиег et aL., среднее значение уровня MMP-7 в сыворотке крови при ИЛФ составило 4,94 нг-мл-1 в сравнении 2,25 нг-мл-1 у независимой контрольной группой [16, 17].Представленные данные зарубежных исследований весьма разнородны, однако не противоречат данным, полученным в ходе нашего исследования, в котором среднее значение MMP-7 в жидкости БАЛ при ИЛФ составило 7,9 ± 2,2 нг/мл, что может отражать сходные уровни MMP- 7 в сыворотке крови и жидкости БАЛ у пациентов с ПЛФ.
Выявленная в нашем исследовании связь повышения уровня ММР-7 в БАЛ при ИЛФ и ГП со снижением ФЖЕЛ и DLCO сопоставима с данными Y. Ваиег et aL., которые показали отрицательную корреляцию уровня ММР-7 в сыворотке со снижением ФЖЕЛ и DLCO при ИЛФ, а также данными W.S. Bowman et aL., согласно которым уровни ММР-7 в сыворотке крови у пациентов с ГП коррелировали с нарушением функции легких [13, 17]. В исследовании M. Brnzova et aL. уровни MMP-7 в БАЛ существенно не различались среди пациентов с ИЛФ и ГП с ПЛФ, что сопоставимо с полученными нами данными [18].
По данным S. WiLLems et aL., уровни MCP-1 в БАЛ при ИЛФ были выше, чем при ИЗЛ без ПФЛ, что согласуется с полученными нами данными. Вместе с тем, в этом исследовании средняя концентрация MCP-1 в БАЛ при ИЛФ была выше аналогичного показателя, полученного в нашем исследовании (774,5 ± 184,9 пг/мл), что может быть обусловлено высокой вариабельностью данного показателя (в исследовании S. WiLLems et aL. медиана Me составила 294,1 (106,9; 1307,0) пг/мл) [19].
Интерстициальные заболевания легких
В настоящее время показатели MCP-1 используются в экспериментальных исследованиях для оценки эффективности терапии антифибротическими препаратами в мышиной модели фиброза легких, индуцированного блеомици- ном, что представляет особый интерес для изучения [20, 21]. Согласно данным ретроспективного исследования, проведенного недавно в Японии и опубликованного в сентябре 2024 г., повышение MCP-1 в жидкости БАЛ определяло худший прогноз выживаемости для пациентов с ПЛФ [22]. Данные о динамике показателей MCP-1 в БАЛ при ИЛФ и ГП в доступной литературе нами не обнаружены.
Таким образом, исследование уровней биомаркеров в бронхоальвеолярной жидкости при ПЛФ представляет собой перспективное направление для раннего выявления пациентов с прогрессированием легочного фиброза; несмотря на разнородные литературные данные, повышенные концентрации ММР-1, ММР-7, ММР-9, MCP-1 и VEGF в жидкости БАЛ у пациентов с ГП могут свидетельствовать о развитии ПЛФ на ранних этапах заболевания.
ВЫВОДЫ
Прогрессирующие легочные фиброзы, представленные ИЛФ и ГП, имеют схожий профиль биомаркеров бронхоальвеолярной жидкости.
Выявлено статистически значимое повышение исходных показателей уровней MCP-1, VEGF, ММР-1, ММР-7, ММР-9 в жидкости БАЛ у пациентов с ИЛФ и ГП с ПЛФ по сравнению с больными ГП без ПЛФ.
Повышение уровней MMP-7 и MCP-1 в жидкости
БАЛ имеет обратную корреляционную связь с динамикой показателей ФЖЕЛ и DLCO в течение года, соответствующей критериям ПЛФ, что позволяет использовать данные показатели в качестве биомаркеров прогрессирующего легочного фиброза.
Кузубова НА, Титова ОН, Склярова ДБ. Интерстициальные заболевания легких с прогрессирующим легочным фиброзом: патогенетические особенности и подходы к терапии. Медицинский совет. 2020;(17):99-106. https//doi.org/10.21518/2079-701X-2020-17-99-106.
Kuzubova NA, Titova ON, Skliarova DV. InterstitaL Lung diseases with progressive pulmonary fibrosis: phatogenetic features and approaches to therapy. Meditsinskiy Sovet. 2020;(17):99-106. (In Russ.) https//doi.org/ 10.21518/2079-701X-2020-17-99-106.
George PM, Spagnolo P, Kreuter M, Altinisik G, Bonifazi M, Martinez FJ et al. Progressive fibrosing interstitiaL Lung disease: cLinicaL uncertainties, consensus recommendations, and research priorities. Lancet Respir Med. 2020;8(9):925-934. https//doi.org/10.1016/S2213-2600(20)30355-6.
Rajan SK, Cottin V, Dhar R, Danoff S, Flaherty KR, Brown KK et al. Progressive pulmonary fibrosis: an expert group consensus statement. Eur Respir J. 2023;61(3):2103187. https//doi.org/10.1183/13993003.03187-2021.
Olson AL, Patnaik P, Hartmann N, Bohn RL, Garry EM, Wallace L. Prevalence and Incidence of Chronic Fibrosing Interstitial Lung Diseases witha Progressive Phenotype in the United States Estimated in a Large Claims
Database Analysis. AdvTher. 2021;38(7):4100-4114. https//doi.org/ 10.1007/s12325-021-01786-8.
Olson AL, Gifford AH, Inase N, Fernandez Perez ER, Suda T. The epidemiology of idiopathic pulmonary fibrosis and interstitial lung diseases at risk of a progressive-fibrosing phenotype. Eur Respir Rev. 2018;27(150):180077. =
Olson A, Hartmann N, Patnaik P, Wallace L, Schlenker-Herceg R, Nasser M, Richeldi L, Hoffmann-Vold AM, Cottin V. Estimation of the Prevalence of Progressive Fibrosing Interstitial Lung Diseases: Systematic Literature Review and Data from a Physician Survey. Adv Ther. 2021;38(2):854-867.
Flaherty KR, Wells AU, Cottin V, Devaraj A, Walsh SLF, Inoue Y et al. Nintedanib in Progressive Fibrosing Interstitial Lung Diseases. N Engl J Med. 2019;381(18):1718-1727. https//doi.org/10.1056/NEJMoa1908681.
Hambly N, Farooqi MM, Dvorkin-Gheva A, Donohoe K, Garlick K, Scallan C et al. Prevalence and characteristics of progressive fibrosing interstitial lung disease in a prospective registry. Eur Respir J. 2022;60(4):2102571.
Bronchoalveolar lavage: role in the evaluation of pulmonary interstitial disease. Expert Rev Respir Med. 2020;14(11):1117-1130. https//doi.org/10.1080/17476348.2020.1806063.
Bronchoalveolar lavage: role in the evaluation of pulmonary interstitial disease. Expert Rev Respir Med. 2020;14(11):1117-1130. https//doi.org/10.1080/17476348.2020.1806063.
Raghu G, Remy-Jardin M, Richeldi L, Thomson CC, Inoue Y, Johkoh T et al. Idiopathic Pulmonary Fibrosis (an Update) and Progressive Pulmonary Fibrosis in Adults: An Official ATS/ERS/JRS/ALAT Clinical Practice Guideline. Am J Respir Crit Care Med. 2022;205(9):e18-e47. https//doi.org/ 10.1164/rccm.202202-0399ST.
Bowman WS, Echt GA, Oldham JM. Biomarkers in Progressive Fibrosing Interstitial Lung Disease: Optimizing Diagnosis, Prognosis, and Treatment Response. Front Med. 2021;8:680997
Singh S, Anshita D, Ravichandiran V. MCP-1: Function, regulation, and involvement in disease. Int Immunopharmacol. 2021;101(Pt B):107598. https//doi.org/10.1016/j.intimp.2021.107598.
Bowman WS, Newton CA, Linderholm AL, Neely ML, Pugashetti JV, Kaul B et al. Proteomic biomarkers of progressive fibrosing interstitial lung disease: a multicentre cohort analysis. Lancet Respir Med. 2022;10(6):593-602.
Khan FA, Stewart I, Saini G, Robinson KA, Jenkins RG. A systematic review of blood biomarkers with individual participant data meta-analysis of matrix metalloproteinase-7 in idiopathic pulmonary fibrosis. Eur Respir J. 2021;59(4):2101612
Majewski S, Szewczyk K, Zal A, Biatas AJ, Mitkowska-Dymanowska J, Piotrowski WJ. Serial Measurements of Circulating KL-6, SP-D, MMP-7, CA19-9, CA-125, CCL18, and Periostin in Patients with Idiopathic Pulmonary Fibrosis Receiving Antifibrotic Therapy: An Exploratory Study. J Clin Med. 2021;10(17):3864.
Guiot J, Moermans C, Henket M, Corhay JL, Louis R. Blood Biomarkers in Idiopathic Pulmonary Fibrosis. Lung. 2017;195(3):273-280.
Bauer Y, White ES, de Bernard S, Cornelisse P, Leconte I, Morganti A, Roux S, Nayler O. MMP-7 is a predictive biomarker of disease progression in patients with idiopathic pulmonary fibrosis. ERJ Open Res. 2017;3(1):00074-2016
Bruzova M, Pavlova M, Matej R, Sterclova M, Vasakova M. Interstitial Score and Concentrations of IL-4Ra, PAR-2, and MMP-7 in Bronchoalveolar Lavage Fluid Could Be Useful Markers for Distinguishing Idiopathic Interstitial Pneumonias. Diagnostics. 2021;11(4):693.
Abdelhady R, Cavalu S, Saber S, Elmowafy R, Morsy NE, Ibrahim S et al. Mirtazapine, an atypical antidepressant, mitigates lung fibrosis by suppressing NLPR3 inflammasome and fibrosis-related mediators in endotracheal bleomycin rat model. Biomed Pharmacother. 2023;161:114553. https//doi.org/10.1016/j.biopha.2023.114553.
Guilherme RF, Silva JBNF, Waclawiack I, Fraga-Junior VS, Nogueira TO, Pecli C et al. Pleiotropic antifibrotic actions of aspirin-triggered resolvin D1 in the lungs. Front Immunol. 2023;14:886601. https//doi.org/10.3389/ fimmu.2023.886601.
Furuta K, Fujimoto D, Matsunashi A, Shibaki R, Taniya S, Tanaka M et al. Prognostic impact of cytokines and chemokines in bronchoalveolar lavage fluid on acute exacerbation of fibrosing interstitial lung disease. Respir Med. 2024;231:107721. https//doi.org/10.1016/j.rmed.2024.107721.
Информация об авторах:
Болотова Елена Валентиновна, д.м.н., профессор кафедры терапии №1 факультета повышения квалификации и последипломной подготовки специалистов, Кубанский государственный медицинский университет; 350063, Россия, Краснодар, ул. Митрофана Седина, д. 4
Юркова Юлия Геннадьевна, аспирант кафедры пульмонологии факультета повышения квалификации и последипломной подготовки специалистов, Кубанский государственный медицинский университет; 350063, Россия, Краснодар, ул. Митрофана Седина, д. 4; врач-пульмонолог консультативно-диагностического центра, Научно-исследовательский институт «Краевая клиническая больница №1 имени С.В. Очаповского»; 360086, Краснодар, ул. 1 Мая, д. 167
Гилевич Ирина Валерьевна, к.м.н., заведующая лабораторией разработки и изучения новых технологий лечения заболеваний, Научноисследовательский институт «Краевая клиническая больница №1 имени С.В. Очаповского»; 360086, Краснодар, ул. 1 Мая, д. 167; ассистент кафедры онкологии с курсом торакальной хирургии факультета повышения квалификации и последипломной подготовки специалистов, Кубанский государственный медицинский университет; 350063, Россия, Краснодар, ул. Митрофана Седина, д. 4;
Шульженко Лариса Владимировна, д.м.н., заведующая кафедрой пульмонологии факультета повышения квалификации и последипломной подготовки специалистов, Кубанский государственный медицинский университет; 350063, Россия, Краснодар, ул. Митрофана Седина, д. 4; заведующая пульмонологическим отделением, Научно-исследовательский институт «Краевая клиническая больница №1 имени С.В. Очаповского»; 360086, Краснодар, ул. 1 Мая, д. 167
Теги: интерстициальные заболевания легких
234567 Начало активности (дата): 27.11.2025 09:00:00
234567 Кем создан (ID): 989
234567 Ключевые слова: интерстициальные заболевания легких, прогрессирующий фиброз легких, гиперчувствительный пнев- монит, биомаркеры, бронхоальвеолярный лаваж
12354567899
Похожие статьи
Антифибротическая терапия прогрессирующего фиброза легкихРентген на дому 8 495 22 555 6 8
Реактивный артрит
Влияние коморбидного статуса на лечение пациента с поздней стадией ревматоидного артрита (клиническое наблюдение)
Клинико-рентгено-морфологическая диагностика гиперчувствительного пневмонита



