 12.11.2025
12.11.2025
Антифибротическая терапия прогрессирующего фиброза легких
Идиопатический легочный фиброз - хроническое интерстициальное заболевание легких (ИЗЛ) неизвестного происхождения, характеризующееся фибропролиферативной природой и ограниченной эффективностью лечения
Введение
Интерстициальные заболевания легких (ИЗЛ) представляют собой гетерогенную группу, включающую более 200 заболеваний легочной паренхимы с различной степенью воспаления и фиброза.
Интерстициальные заболевания легких подразделяются на болезни с известными (воздействие аллергенов, токсинов или лекарственных препаратов, аутоиммунные заболевания) и неизвестными (идиопатические интерстициальные пневмонии, ИИП) причинами [1, 2]. Считается, что легочный фиброз (ЛФ) возникает в результате повторяющихся субклинических повреждений альвеолярного эпителия и эндотелия, что приводит к активации фибробластов, их пролиферации и избыточному образованию мио- фибробластов и аномальному восстановлению тканей с избыточным отложением внеклеточного матрикса. В итоге это приводит к разрушению нормальной структуры легких, что сопровождается нарушением функции легких, респираторными симптомами и снижением продолжительности жизни [3]. Идиопатический ЛФ (ИЛФ) является наиболее распространенной и тяжелой формой ИИП и характеризуется необратимым прогрессирующим фиброзом легких (ПФЛ) с неблагоприятным исходом [4].
Распространенность ИЛФ возрастает во всем мире и составляет от 20 до 80 случаев на 100 000 человек
Ежегодная заболеваемость ИЛФ варьирует от 0,33 до 2,51 случая в Европе и от 2,4 до 2,98 случая на 10 000 человек в Северной Америке [6]. Идиопатический ЛФ чаще встречается у мужчин с курением в анамнезе и редко у лиц моложе 50 лет, средний возраст при постановке диагноза составляет около 65 лет [7]. Течение заболевания непредсказуемое, прогноз неблагоприятный, средняя продолжительность жизни после установления диагноза без лечения составляет 3-5 лет, но недавно опубликованные наблюдения свидетельствуют об улучшении выживаемости в последние 20 лет, что может быть связано с более ранней диагностикой и проводимой антифибротической терапией [8, 9].
Современные методы лечения ЛФ сосредоточены на использовании противовоспалительных и антифиброзных средств. Хотя эти препараты могут замедлять прогрессирование заболевания, они не устраняют развившийся фиброз и часто связаны с нежелательными явлениями. Поэтому необходимы инновационные методы лечения, нацеленные на основные механизмы ЛФ и обеспечивающие лучшие эффективность и безопасность.
Пирфенидон и нинтеданиб были одобрены во всем мире для лечения ИЛФ более 10 лет назад. Хотя они имеют разные механизм действия и профиль безопасности, эффективность препаратов в замедлении скорости снижения форсированной жизненной емкости легких (ФЖЕЛ) и увеличении продолжительности жизни пациентов с ИЛФ и другими фиброзирующими заболеваниями легких со временем схожа. На поздних стадиях ИЛФ необходима трансплантация легких у отдельных пациентов и паллиативная помощь.
Сопутствующие заболевания и осложнения (легочная гипертензия, рак легких и прежде всего обострения болезни) могут возникать у 10% пациентов в год и связаны с высокой смертностью [10].
Несмотря на имеющиеся достижения в понимании патогенеза ЛФ, точные механизмы влияния генетической предрасположенности и факторов окружающей среды на инициирование и распространение фиброзного процесса еще выяснены не полностью. Известно, что значительный вклад в развитие фиброза вносят профессиональные и экологические воздействия, включая вдыхание органических антигенов. Эти агенты напрямую повреждают легочную ткань, вызывая хроническое воспаление и фиброз. Кроме того, курение и употребление алкоголя тесно связаны с повышенным риском ЛФ.
Курение вызывает окислительный стресс и воспаление в легких, которые способствуют фиброзным изменениям. Употребление алкоголя нарушает естественные механизмы восстановления легких, предрасполагая к развитию фиброза. Сопутствующие заболевания, такие как гастроэзофагеальная рефлюксная болезнь и хронические вирусные инфекции, также играют важную роль в патогенезе ЛФ, поддерживая хроническое воспаление и повреждение легочной ткани [11, 12].
Патогенез ЛФ включает сложное взаимодействие различных клеточных и молекулярных механизмов. Для запуска фиброзного процесса решающее значение имеет взаимодействие между фибробластами, эпителиальными, иммунными и эндотелиальными клетками. Эпителиальные клетки, особенно альвеолоциты II типа, играют важную роль в восстановлении и регенерации легких. Однако повторное повреждение этих клеток может приводить к аберрантным механизмам восстановления, что способствует дифференциации фибробластов в миофибробласты, которые играют центральную роль в фиброзном ответе. Миофибробласты продуцируют избыточные компоненты внеклеточного матрикса, что приводит к уплотнению и фиброзированию легочной ткани. Молекулярные механизмы, вовлеченные в патогенез ЛФ, включают сигнальные пути TGF-b (transforming growth factor b - трансформирующий фактор роста b)/Smad (Sma and Mad related proteins - Sma- и Mad-родственные белки), Wnt/b-катенин и PI3K (фосфати- дилинозитол-3-киназа)/АМ (серин/треониновая протеинкиназа, или протеинкиназа B)/mTOR (mamalian target of rapamycin - мишень рапами- цина млекопитающих), которые регулируют различные процессы пролиферации, дифферен- цировки и апоптоза клеток и способствуют прогрессированию фиброза [12, 13].
Диагностика
В соответствии с современными клиническими рекомендациями, диагностика ИЗЛ требует проведения мультидисциплинарного консилиума с участием врачей пульмонолога, рентгенолога, ревматолога и патологоанатома. Компьютерная томография высокого разрешения (КТВР) легких является “золотым стандартом” для получения подробных изображений легочной паренхимы и выявления паттерна, характерного для ИЗЛ [14]. Компьютерная томография высокого разрешения легких имеет важное значение для диагностики ИЛФ, выявляя специфические закономерности, такие как обычная интерстициальная пневмония [15].
Исследование легочной функции необходимо для диагностики и мониторинга ЛФ. Показатели функции легких позволяют оценить тяжесть заболевания и скорость его прогрессирования. В частности, ФЖЕЛ является ключевым параметром легочной функции, используемым для оценки нарушений легочной вентиляции по рестриктивному типу. Снижение ФЖЕЛ в динамике является основным показателем прогрессирования ЛФ. Мониторинг ФЖЕЛ позволяет оценивать эффективность проводимой терапии и принимать обоснованные решения относительно дальнейшего ведения пациентов [14].
Кроме того, снижение диффузионной способности легких по оксиду углерода (DLco) отражает нарушение газообмена вследствие ЛФ [16]. Измерение DL предоставляет важную информацию о прогрессировании заболевания и эффективности лечения. Тест с 6-минутной ходьбой (6-МТ) позволяет оценить толерантность к физической нагрузке и функциональную способность у пациентов с ЛФ.
Уменьшение расстояния, пройденного в 6-МТ, связано с худшими результатами и служит прогностическим маркером [17].
Биопсия легких проводится в тех случаях, когда результаты КТВР легких неубедительны [3].
В рекомендациях ATS/ERS/JRS/ALAT (American Thoracic Society/European Respiratory Society/Japanese Respiratory Society/Latin American Thoracic Association - Американское торакальное общество/Европейское респираторное общество/Японское респираторное общест- во/Латиноамериканское торакальное общество) 2022 г. по ИЛФ принято, что у пациента с ИЗЛ известной или неизвестной природы, кроме ИЛФ, имеется ПФЛ при наличии рентгенологических признаков ЛФ и клинико-функциональных данных о прогрессировании в предыдущие 12 мес при наличии как минимум 2 из 3 критериев [18]:
ухудшение респираторных симптомов, которое нельзя объяснить другой причиной;
физиологические признаки прогрессирования заболевания (любой из следующих):
а) абсолютное снижение ФЖЕЛ >5% в течение 12 мес;
б) абсолютное снижение DLco (с поправкой на гемоглобин) >10% в течение 12 мес;
рентгенологические признаки прогрессирования заболевания (1 или несколько из следующих):
а) увеличение степени или тяжести тракционных бронхоэктазов и бронхиолоэктазов;
б) новые участки “матового стекла” с тракционными бронхоэктазами;
в) появление новых мелких ретикулярных изменений;
г) увеличение степени или появление грубых ретикулярных изменений;
д) появление или увеличение участков “сотового легкого”;
е) уменьшение объема доли легкого.
Таким образом, прогрессирование ЛФ можно определить по клиническим симптомам, показателям легочной функции и рентгенологическим данным.
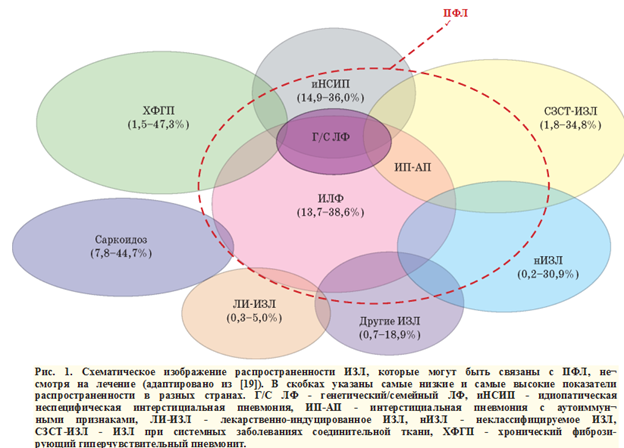
Распространенность ПФЛ при ИЗЛ представлена на рис. 1.
Биомаркеры играют ключевую роль в дифференциации ЛФ от других ИЗЛ и оценке активности заболевания. Они включают маркеры фиброгенеза и ремоделирования внеклеточного матрикса (матриксные металлопротеиназы 1, 7 и 8, периостин, остеопонтин), маркеры повреждения альвеолярных эпителиальных клеток (высокомолекулярный гликопротеин KL-6 (Krebs von den Lungen-6), поверхностно-активные сурфактантные белки A и D) и маркеры воспаления и иммунной дисфункции (YKL-40 (хрящевой гликопротеин человека), S100A8/A9/А12 и CCL18 (chemokine (C-C motif) ligand 18 - хемокиновый (C-C-мотив) лиганд 18)) [12]. Уровень различных биомаркеров в сыворотке крови у пациентов с ИЛФ значимо повышен и коррелирует с тяжестью заболевания, степенью фиброза и прогнозом, он используется при дифференциальной диагностике ИЛФ и других заболеваний легких, а также при оценке прогрессирования заболевания.
Еще предстоит определить, что инициирует ПФЛ у пациентов с ИЗЛ и можно ли идентифицировать биомаркеры, которые могут предсказать развитие ЛФ до начала снижения показателей легочной функции. Причем раннее распознавание ПФЛ имеет важное значение, поскольку своевременно начатая антифиброзная терапия может приостановить развитие необратимых изменений.
Лечение
Традиционные методы лечения ИЛФ включают назначение иммунодепрессантов и глюкокортикостероидов (ГКС). Эти методы лечения направлены на уменьшение воспаления и снижение активности иммунной системы, что, как предполагается, замедляет прогрессирование фиброза. Однако в крупных клинических исследованиях были отмечены ограниченная эффективность и потенциальные побочные эффекты указанных препаратов, что привело к снижению их использования [4, 11]. Иммунодепрессанты, такие как азатиоприн и циклофосфамид, изначально применялись на основании данных о том, что ИЛФ имеет аутоиммунный компонент. Аналогичным образом, ГКС, такие как преднизолон, использовались для подавления воспаления [11]. Однако текущие руководства не рекомендуют использовать их при ИЛФ, за исключением лечения обострений.
Появление препаратов антифибротической терапии (нинтеданиба и пирфенидона), изучавшихся в крупных международных многоцентровых рандомизированных клинических исследованиях, стало прорывом в лечении ИЛФ.
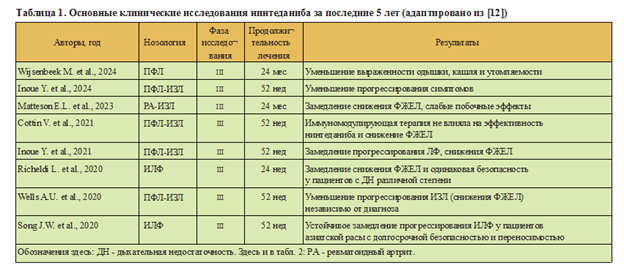
Нинтеданиб - это внутриклеточный ингибитор тирозинкиназы, который воздействует на несколько мишеней, вовлеченных в фиброз: связывает и блокирует PDGFR (platelet-derived growth factor receptor - рецептор фактора роста тромбоцитов), FGFR1 (fibroblast growth factor receptor 1 - рецептор фактора роста фибробластов 1) и VEGFR2 (vascular endothelial growth factor receptor 2 - рецептор фактора роста эндотелия сосудов 2). Он значительно замедляет снижение ФЖЕЛ, ингибируя пролиферацию фибробластов, миграцию и трансформацию в миофибро- бласты (табл. 1) [20]. Побочные эффекты нинте- даниба включают желудочно-кишечные симптомы, в частности, диарею (около 60% пациентов), тошноту, рвоту, снижение аппетита и повышение уровня печеночных ферментов, требующие корректировки дозы и мониторинга [21]. Снижение дозы нинтеданиба до 100 мг 2 раза в день, коррекция диеты, прерывание приема препарата и возобновление лечения более низкой дозой позволяют справляться с побочными эффектами. Нинтеданиб следует назначать с осторожностью пациентам, недавно перенесшим острые сердечно-сосудистые заболевания или получающим антикоагулянты, из-за их взаимодействия [22]. На основании данных исследования INPULSIS нинтеданиб был одобрен для лечения ИЛФ во многих странах и включен в текущие клинические рекомендации по лечению ИЛФ легкой и средней степени тяжести [23].
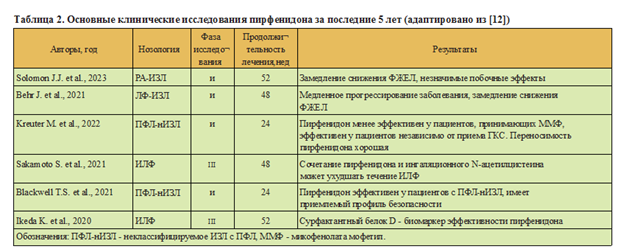
Пирфенидон - пероральный антифибротиче- ский препарат, который подавляет синтез TGF-0 и других цитокинов, ингибирует пролиферацию фибробластов и синтез коллагена [24]. Клинические исследования показали, что пирфенидон уменьшает снижение функции легких и улучшает выживаемость без прогрессирования ЛФ (табл. 2). Пирфенидон также обладает противовоспалительными и антиоксидантными свойствами, которые способствуют его терапевтическому эффекту [25]. К наиболее распространенным побочным эффектам препарата относятся желудочно-кишечные симптомы, в первую очередь тошнота, повышение уровня печеночных трансаминаз, кожная сыпь, фотосенсибилизация и усталость, что требует регулярного мониторинга [26].
Пирфенидон одобрен во многих странах и рекомендуется для лечения ИЛФ легкой и средней степени тяжести. Последующие исследования показали сопоставимую его эффективность при ПФЛ и ряде других ИЗЛ [27, 28].
Прогрессирующий фиброз легких недавно было предложено рассматривать как клинический фенотип пациентов с ИЗЛ, отличным от ИЛФ, у которых наблюдается снижение показателей функции легких (ФЖЕЛ или DL ), ухудшение фиброза по данным КТВР легких или появление симптомов в течение 1 года [18].
В исследовании INBUILD продемонстрирована эффективность и безопасность нинтеданиба у пациентов с ПФЛ [21]. Это исследование и дополнительные ретроспективные анализы послужили основой для рекомендации использования нинтеданиба у пациентов с ПФЛ, за исключением ИЛФ [18]. Алгоритм лечения ИЛФ и ПФЛ представлен на рис. 2.
Пирфенидон продемонстрировал схожие эффекты с нинтеданибом по влиянию на снижение ФЖЕЛ в течение 1 года в 2 исследованиях, включавших пациентов с прогрессирующим не-ИЛФ ИЗЛ [27, 29].
В преждевременно остановленное международное исследование RELIEF было набрано всего 127 пациентов, и на основании полученных результатов пирфенидон не был рекомендован для лечения ПФЛ [18]. Однако после публикации данных метаанализов, показавших влияние пирфенидона на уменьшение снижения ФЖЕЛ, национальные руководства рекомендовали его использование при этом клиническом фенотипе [30-32].
Существует неопределенность в отношении потенциала комбинации нинтеданиба и пирфе- нидона, учитывая их различные механизмы действия и отсутствие четких фармакокинетических взаимодействий [33]. Эта возможность изучалась в 2 клинических исследованиях: в одном исследовании нинтеданиб был добавлен к пирфенидону, в другом - пирфенидон к нинтеда- нибу [34, 35]. По результатам этих исследований была предположена потенциальная роль указанной комбинации. Однако из-за недостаточных данных по безопасности и эффективности такой комбинации международные и национальные руководства по лечению ИЛФ рекомендовали использовать комбинацию антифибротических средств только в клинических исследованиях [18, 31].
В последующих исследованиях, посвященных оценке эффективности и безопасности комбинированной терапии нинтеданибом и пирфе- нидоном, были продемонстрированы положительные результаты [36]. В исследовании in vitro комбинация пирфенидона и нинтеданиба приводила к большему ингибированию роста клеток по сравнению с их использованием по отдельности [37].
Частота возникновения нежелательных явлений, наблюдавшихся при комбинированной терапии пирфенидоном и нинтеданибом в течение 24 нед, была сравнима с частотой побочных эффектов при монотерапии. При этом преобладали диарея, тошнота и рвота [34]. Аналогичные результаты были получены в 12-недельном исследовании INJOURNEY.
Интересно, что в группе комбинированного лечения наблюдалась более высокая частота полного прекращения приема пирфенидона по сравнению с прекращением приема нинтеданиба [35]. Хороший профиль безопасности и переносимости у пациентов с ИЛФ, получавших комбинированную терапию пирфе- нидоном и нинтеданибом, был отмечен в многоцентровом ретроспективном наблюдательном исследовании, проведенном в Японии [38].
В исследовании INSTAGE оценивалась эффективность монотерапии нинтеданиба в сравнении с различными комбинациями, в том числе с силденафилом [39]. Результаты исследования не показали преимуществ данной комбинации.
Другие новые методы лечения, такие как внутривенное введение стволовых клеток легких, использование пентраксина-2, памревлума- ба, ингибиторов фибулина-1с, аутотоксина (GLPG1690) и галектина-3, человеческого антигена R, могут оказаться перспективными при лечении ПФЛ в будущем [36, 40].
Заключение
Механизмы, лежащие в основе патогенеза ЛФ, включают различные клеточные взаимодействия. Будущие исследования должны быть направлены на выявление новых звеньев патогенеза. Для эффективного лечения ПФЛ решающее значение имеет ранняя и точная диагностика. Большие надежды связаны с открытием и применением новых биомаркеров для выявления заболевания на ранних стадиях, для оценки замедления прогрессирования заболевания. Компьютерная томография высокого разрешения остается одним из основных методов оценки ответа на лечение и мониторинга прогрессирования заболевания. Антифиброзная терапия ЛФ (нинтеда- ниб и пирфенидон) является общепризнанной и общепринятой. Следует рассмотреть комбинацию методов лечения, нацеленных на клеточные взаимодействия, в частности с использованием антифиброзных препаратов клеточной и генной терапии. Использование современных методов диагностики и комплексного терапевтического подхода позволит добиться существенного прогресса в понимании и лечении ПФЛ.
Список литературы
Fiddler C, Parfrey H. Diffuse parenchymal lung disease. Medicine 2023 Dec;51(12):829-37.
Travis WD, Costabel U, Hansell DM, King TE Jr, Lynch DA, Nicholson AG, Ryerson CJ, Ryu JH, Selman M, Wells AU, Behr J, Bouros D, Brown KK, Colby TV, Collard HR, Cordei- ro CR, Cottin V, Crestani B, Drent M, Dudden RF, Egan J, Flaherty K, Hogaboam C, Inoue Y, Johkoh T, Kim DS, Kitaichi M, Loyd J, Martinez FJ, Myers J, Protzko S, Raghu G, Richeldi L, Sverzellati N, Swigris J, Valeyre D; ATS/ERS Committee on Idiopathic Interstitial Pneumonias. An official American Thoracic Society/European Respiratory Society statement: update of the international multidisciplinary classification of the idiopathic interstitial pneumonias. American Journal of Respiratory and Critical Care Medicine 2013 Sep;188(6):733-48.
Wuyts WA, Agostini C, Antoniou KM, Bouros D, Chambers RC, Cottin V, Egan JJ, Lambrecht BN, Lories R, Par- frey H, Prasse A, Robalo-Cordeiro C, Verbeken E, Ver- schakelen JA, Wells AU, Verleden GM. The pathogenesis of pulmonary fibrosis: a moving target. The European Respiratory Journal 2013 May;41(5):1207-18.
Lederer DJ, Martinez FJ. Idiopathic pulmonary fibrosis. The New England Journal of Medicine 2018 May;378(19):1811-23.
Hilberg O, Hoffmann-Vold AM, Smith V, Bouros D, Kil- pelainen M, Guiot J, Morais A, Clemente S, Daniil Z, Pa- pakosta D, Fretheim H, Neves S, Alfaro TM, Antoniou KM, Valveny N, Asijee G, Soulard S, Wuyts W. Epidemiology of interstitial lung diseases and their progressive-fibrosing behaviour in six European countries. ERJ Open Research 2022 Jan;8(1):00597-2021.
Maher TM, Bendstrup E, Dron L, Langley J, Smith G, Khalid JM, Patel H, Kreuter M. Global incidence and prevalence of idiopathic pulmonary fibrosis. Respiratory Research 2021 Jul;22(1):197.
Podolanczuk AJ, Thomson CC, Remy-Jardin M, Richeldi L, Martinez FJ, Kolb M, Raghu G. Idiopathic pulmonary fibrosis: state of the art for 2023. The European Respiratory Journal 2023 Apr;61(4):2200957.
Guenther A, Krauss E, Tello S, Wagner J, Paul B, Kuhn S, Maurer O, Heinemann S, Costabel U, Barbero MAN, Muller V, Bonniaud P, Vancheri C, Wells A, Vasakova M, Pe- sci A, Sofia M, Klepetko W, Seeger W, Drakopanagiotakis F, Crestani B. The European IPF registry (eurIPFreg): baseline characteristics and survival of patients with idiopathic pulmonary fibrosis. Respiratory Research 2018 Jul;19(1):141.
Jegal Y, Park JS, Kim SY, Yoo H, Jeong SH, Song JW, Lee JH, Lee HL, Choi SM, Kim YW, Kim YH, Choi HS, Lee J, Uh ST, Kim TH, Kim SH, Lee WY, Kim YH, Lee HK, Lee EJ, Heo EY, Yang SH, Kang HK, Chung MP; Korea ILD Study Group. Clinical features, diagnosis, management, and outcomes of idiopathic pulmonary fibrosis in Korea: analysis of the Korea IPF Cohort (KICO) registry. Tuberculosis and Respiratory Diseases 2022 Apr;85(2):185-94.
Homma S, Suda T, Hongo Y, Yoshida M, Hiroi S, Iwasaki K, Takeshima T, Kondoh Y. Incidence and changes in treatment of acute exacerbation of idiopathic pulmonary fibrosis in Japan: a claims-based retrospective study. Respiratory Investigation 2022 Nov;60(6):798-805.
Guo H, Sun J, Zhang S, Nie Y, Zhou S, Zeng Y. Progress in understanding and treating idiopathic pulmonary fibrosis: recent insights and emerging therapies. Frontiers in Pharmacology 2023 Aug;14:1205948.
Wang J, Li K, Hao D, Li X, Zhu Y, Yu H, Chen H. Pulmonary fibrosis: pathogenesis and therapeutic strategies. MedComm (2020) 2024 Sep;5(10):e744.
Koudstaal T, Funke-Chambour M, Kreuter M, Molyneaux PL, Wijsenbeek MS. Pulmonary fibrosis: from pathogenesis to clinical decision-making. Trends in Molecular Medicine 2023 Dec;29(12):1076-87.
Wijsenbeek M, Swigris JJ, Inoue Y, Kreuter M, Maher TM, Suda T, Baldwin M, Mueller H, Rohr KB, Flaherty KR; INBUILD Trial Investigators. Effects of nintedanib on symptoms in patients with progressive pulmonary fibrosis. The European Respiratory Journal 2024 Feb;63(2):2300752.
Rea G, Sverzellati N, Bocchino M, Lieto R, Milanese G, D’Al- to M, Bocchini G, Maniscalco M, Valente T, Sica G. Beyond visual interpretation: quantitative analysis and artificial intelligence in interstitial lung disease diagnosis “expanding horizons in radiology”. Diagnostics (Basel, Switzerland) 2023 Jul;13(14):2333.
Capaccione KM, Wang A, Lee SM, Patel N, Austin JHM, Mai- no P, Padilla M, Salvatore MM. Quantifying normal lung in pulmonary fibrosis: CT analysis and correlation with °/oDLoo. Clinical Imaging 2021 Sep;77:287-90.
Khor YH, Farooqi M, Hambly N, Johannson KA, Marcoux V, Fisher JH, Assayag D, Manganas H, Khalil N, Kolb M, Ry- erson CJ; Austin ILD Registry and CARE-PF Investigators. Trajectories and prognostic significance of 6-minute walk test parameters in fibrotic interstitial lung disease: a multicenter study. Chest 2023 Feb;163(2):345-57.
Raghu G, Remy-Jardin M, Richeldi L, Thomson CC, Inoue Y, Johkoh T, Kreuter M, Lynch DA, Maher TM, Martinez FJ, Molina-Molina M, Myers JL, Nicholson AG, Ryerson CJ, Strek ME, Troy LK, Wijsenbeek M, Mammen MJ, Hossain T, Bissell BD, Herman DD, Hon SM, Kheir F, Khor YH, Mac- rea M, Antoniou KM, Bouros D, Buendia-Roldan I, Caro F, Crestani B, Ho L, Morisset J, Olson AL, Podolanczuk A, Poletti V, Selman M, Ewing T, Jones S, Knight SL, Ghazi- pura M, Wilson KC. Idiopathic pulmonary fibrosis (an update) and progressive pulmonary fibrosis in adults: an official ATS/ERS/JRS/ALAT clinical practice guideline. American Journal of Respiratory and Critical Care Medicine 2022 May;205(9):e18-47.
Rajan SK, Cottin V, Dhar R, Danoff S, Flaherty KR, Brown KK, Mohan A, Renzoni E, Mohan M, Udwadia Z, She- noy P, Currow D, Devraj A, Jankharia B, Kulshrestha R, Jones S, Ravaglia C, Quadrelli S, Iyer R, Dhooria S, Kolb M, Wells AU. Progressive pulmonary fibrosis: an expert group consensus statement. The European Respiratory Journal 2023 Mar;61(3):2103187.
Lamb YN. Nintedanib: a review in fibrotic interstitial lung diseases. Drugs 2021 Apr;81(5):575-86.
Flaherty KR, Wells AU, Cottin V, Devaraj A, Walsh SLF, Inoue Y, Richeldi L, Kolb M, Tetzlaff K, Stowasser S, Coeck C, Clerisme-Beaty E, Rosenstock B, Quaresma M, Haeufel T, Goeldner RG, Schlenker-Herceg R, Brown KK; INBUILD Trial Investigators. Nintedanib in progressive fibrosing interstitial lung diseases. The New England Journal of Medicine 2019 Oct;381(18):1718-27.
Corte T, Bonella F, Crestani B, Demedts MG, Richeldi L, Coeck C, Pelling K, Quaresma M, Lasky JA. Safety, tolerability and appropriate use of nintedanib in idiopathic pulmonary fibrosis. Respiratory Research 2015 Sep;16:116.
Raghu G, Rochwerg B, Zhang Y, Garcia CA, Azuma A, Behr J, Brozek JL, Collard HR, Cunningham W, Homma S, Johkoh T, Martinez FJ, Myers J, Protzko SL, Richeldi L, Rind D, Selman M, Theodore A, Wells AU, Hoogsteden H, Schune- mann HJ; American Thoracic Society; European Respiratory Society; Japanese Respiratory Society; Latin American Thoracic Association. An official ATS/ERS/JRS/ALAT clinical practice guideline: treatment of idiopathic pulmonary fibrosis an update of the 2011 clinical practice guideline. American Journal of Respiratory and Critical Care Medicine 2015 Jul;192(2):e3-19.
Lv Q, Wang J, Xu C, Huang X, Ruan Z, Dai Y. Pirfenidone alleviates pulmonary fibrosis in vitro and in vivo through regulating Wnt/GSK-3b/b-catenin and TGF-|31/Smad2/3 signaling pathways. Molecular Medicine 2020 May;26(1):49.
Ruwanpura SM, Thomas BJ, Bardin PG. Pirfenidone: molecular mechanisms and potential clinical applications in lung disease. American Journal of Respiratory Cell and Molecular Biology 2020 Apr;62(4):413-22.
Molina-Molina M, Shull JG, Vicens-Zygmunt V, Rivera-Or- tega P, Antoniou K, Bonella F, Renzoni E, Russell AM, Maher TM, Vancheri A, Bachs A, Aviles V, Palma J, Bermudo G, Suarez-Cuartin G, Tebe C, Rigo-Bonnin R, Montes-Worboys A, Wijsenbeek M, Vancheri C. Gastrointestinal pirfenidone adverse events in idiopathic pulmonary fibrosis depending on diet: the MADIET clinical trial. The European Respiratory Journal 2023 Oct;62(4):2300262.
Behr J, Prasse A, Kreuter M, Johow J, Rabe KF, Bonel- la F, Bonnet R, Grohe C, Held M, Wilkens H, Hammerl P, Koschel D, Blaas S, Wirtz H, Ficker JH, Neumeister W, Schonfeld N, Claussen M, Kneidinger N, Frankenberger M, Hummler S, Kahn N, Tello S, Freise J, Welte T, Neuser P, Gunther A; RELIEF investigators. Pirfenidone in patients with progressive fibrotic interstitial lung diseases other than idiopathic pulmonary fibrosis (RELIEF): a double-blind, randomised, placebo-controlled, phase 2b trial. The Lancet. Respiratory Medicine 2021 May;9(5):476-86.
Bonella F, Spagnolo P, Ryerson C. Current and future treatment landscape for idiopathic pulmonary fibrosis. Drugs 2023 Nov;83(17):1581-93.
Maher TM, Corte TJ, Fischer A, Kreuter M, Lederer DJ, Mo- lina-Molina M, Axmann J, Kirchgaessler KU, Samara K, Gil- berg F, Cottin V. Pirfenidone in patients with unclassifiable progressive fibrosing interstitial lung disease: a double-blind, randomised, placebo-controlled, phase 2 trial. The Lancet. Respiratory Medicine 2020 Feb;8(2):147-57.
Ghazipura M, Mammen MJ, Bissell BD, Macrea M, Herman DD, Hon SM, Kheir F, Khor YH, Knight SL, Raghu G, Wilson KC, Hossain T. Pirfenidone in progressive pulmonary fibrosis: a systematic review and meta-analysis. Annals of the American Thoracic Society 2022 Jun;19(6):1030-9.
Behr J, Bonella F, Frye BC, Gunther A, Hagmeyer L, Henes J, Klemm P, Koschel D, Kreuter M, Leuschner G, Nowak D, Prasse A, Quadder B, Sitter H, Costabel U. [Pharmacological treatment of idiopathic pulmonary fibrosis (update) and progressive pulmonary fibrosis - S2k Guideline of the German Respiratory Society.] Pneumologie (Stuttgart, Germany) 2023 Feb;77(2):94-119.
Cottin V, Bonniaud P, Cadranel J, Crestani B, Jouneau S, Marchand-Adam S, Nunes H, Wemeau-Stervinou L, Bergot E, Blanchard E, Borie R, Bourdin A, Chenivesse C, Clement A, Gomez E, Gondouin A, Hirschi S, Lebargy F, Marquette CH, Montani D, Prevot G, Quetant S, Reynaud-Gaubert M, Sa- laun M, Sanchez O, Trumbic B, Berkani K, Brillet PY, Cam- pana M, Chalabreysse L, Chatte G, Debieuvre D, Ferretti G, Fourrier JM, Just N, Kambouchner M, Legrand B, Le Guil- lou F, Lhuillier JP, Mehdaoui A, Naccache JM, Paganon C, Remy-Jardin M, Si-Mohamed S, Terrioux P; OrphaLung network. French practical guidelines for the diagnosis and management of idiopathic pulmonary fibrosis - 2021 update.
Full-length version. Respiratory Medicine and Research 2023 Jun;83:100948.
Richeldi L, Fletcher S, Adamali H, Chaudhuri N, Wiebe S, Wind S, Hohl K, Baker A, Schlenker-Herceg R, Stowasser S, Maher TM. No relevant pharmacokinetic drug-drug interaction between nintedanib and pirfenidone. The European Respiratory Journal 2019 Jan;53(1):1801060.
Flaherty KR, Fell CD, Huggins JT, Nunes H, Sussman R, Valenzuela C, Petzinger U, Stauffer JL, Gilberg F, Bengus M, Wijsenbeek M. Safety of nintedanib added to pirfenidone treatment for idiopathic pulmonary fibrosis. The European Respiratory Journal 2018 Aug;52(2):1800230.
Vancheri C, Kreuter M, Richeldi L, Ryerson CJ, Valeyre D, Grutters JC, Wiebe S, Stansen W, Quaresma M, Stowasser S, Wuyts WA; INJOURNEY Trial Investigators. Nintedanib with add-on pirfenidone in idiopathic pulmonary fibrosis. Results of the INJOURNEY trial. American Journal of Respiratory and Critical Care Medicine 2018 Feb;197(3):356-63.
Saito S, Alkhatib A, Kolls JK, Kondoh Y, Lasky JA. Pharmacotherapy and adjunctive treatment for idiopathic pulmonary fibrosis (IPF). Journal of Thoracic Disease 2019 Sep;11(Suppl 14):S1740-54.
Lehtonen ST, Veijola A, Karvonen H, Lappi-Blanco E, Sormu- nen R, Korpela S, Zagai U, Skold MC, Kaarteenaho R. Pirfeni- done and nintedanib modulate properties of fibroblasts and myofibroblasts in idiopathic pulmonary fibrosis. Respiratory Research 2016 Feb;17:14.
Hisata S, Bando M, Homma S, Kataoka K, Ogura T, Izumi S, Sakamoto S, Watanabe K, Saito Y, Shimizu Y, Kato M, Nish- ioka Y, Hara H, Waseda Y, Tanino Y, Yatera K, Hashimoto S, Mukae H, Inase N; Diffuse Lung Diseases Research Group of the Ministry of Health, Labour and Welfare, Japa. Safety and tolerability of combination therapy with pirfenidone and nintedanib for idiopathic pulmonary fibrosis: a multicenter retrospective observational study in Japan. Respiratory Investigation 2021 Nov;59(6):819-26.
Kang J, Song JW. Effect of sildenafil added to antifibrotic treatment in idiopathic pulmonary fibrosis. Scientific Reports 2021 Sep;11(1):17824.
Glass DS, Grossfeld D, Renna HA, Agarwala P, Spiegler P, DeLeon J, Reiss AB. Idiopathic pulmonary fibrosis: current and future treatment. The Clinical Respiratory Journal 2022 Feb;16(2):84-96.
Antifibrotic Therapy in Progressive Pulmonary Fibrosis
E.Kh. Anaev and A.S. Belevskiy Idiopathic pulmonary fibrosis is a chronic interstitial lung disease of unknown etiology characterized by fibroprolif- erative nature and limited treatment efficacy. Progressive pulmonary fibrosis (PPF) is characterized by the presence of 2 criteria for the previous 12 months: worsening of respiratory symptoms, absolute decline of forced vital capacity of more than 5% and/or diffusing capacity of lungs for carbon monoxide of more than 10% and/or progression of pulmonary fibrosis referring to X-ray/computed tomography. The diagnosis of PPF requires the participation of multidisciplinary team. The treatment methods of pulmonary fibrosis include immunomodulation of inflammatory interstitial lung diseases and antifibrotic therapy of PPF. Deep understanding of mechanisms that cause the development and progression of pulmonary fibrosis is crucial for the elaboration of new drugs.
Авторы:
Э.Х. Анаев, А.С. Белевский
Теги: легочный фиброз
234567 Начало активности (дата): 12.11.2025
234567 Кем создан (ID): 989
234567 Ключевые слова: идиопатический легочный фиброз, интерстициальное заболевание легких, прогрессирующий фиброз легких, лечение, нинтеданиб, пирфенидон
12354567899
Похожие статьи
Морфологические особенности бронха легкого у юношеского и подросткового возрастаРентген на дому 8 495 22 555 6 8
Обьемы хирургического вмешательства среди употребляющих табак пациентов с туберкулезом легких
Влияние коморбидного статуса на лечение пациента с поздней стадией ревматоидного артрита (клиническое наблюдение)
Клинико-рентгено-морфологическая диагностика гиперчувствительного пневмонита



