 17.11.2025
17.11.2025
Нервно-мышечный сколиоз
Мышечные дистрофии представляют собой клинически неоднородную группу расстройств, которые все имеют общие клинические характеристики прогрессирующей мышечной слабости.
Список сокращений
АЛТ – аланинаминотрансфераза
АСТ – аспартатаминотрансфераза
БИПАП – от англ. Biphasic Positive Airway Pressure, BPAP, BiPAP
СИПАП – от англ. Constant Positive Airway Pressure, CPAP
ВАШ – визуально-аналоговая шкала Борга
ДАГ – дистрофин-ассоциированный гликопротеиновый комплекс
ДН – дыхательная недостаточность
ДНК – дезоксирибонуклеиновая кислота
ДЦП – детский церебральный паралич
ЖЕЛ – жизненная емкость легких
ИАПФ – ингибитор ангиотензин-превращающего фермента (АТХ C09AA Ингибиторы АПФ)
ИВЛ – инвазивная вентиляция легких
кДа – килодальтон
КТ – компьютерная томография
КФК – креатинфосфокиназа (синоним – креатинкиназа)
КЩС – кислотно-щелочной состав крови
ЛДГ – лактатдегидрогеназа
МНО – международное нормализованное отношение
МРТ – магнитно-резонансная томография
НИВЛ – неинвазивная вентиляция легки
НМБ – нервно-мышечные болезни
ОФВ1 – объем форсированного выдоха за первую секунду маневра форсированного выдоха
ПДЕ – потенциалы двигательных единиц
ПМДБ – прогрессирующая мышечная дистрофия Беккера
ПМДД – прогрессирующая мышечная дистрофия Дюшенна
ПСВ – пиковая скорость выдоха
ПСК – пиковая скорость кашля
РНК – рибонуклеиновая кислота
СМА – спинальная мышечная атрофия
СМА I – спинальная мышечная атрофия, тип I
ТСР – технические средства реабилитации
ФГБНУ МГНЦ – Федеральное государственное бюджетное научное учреждение «Медико-генетический научный центр имени академика Н.П. Бочкова» Министерства науки и высшего образования Российской Федерации
ФЖЕЛ – функциональная жизненная емкость легких
ЦП – церебральный паралич
ЭКГ – электрокардиография
ЭМГ – электромиография
ЭНМГ – электронейромиография
ЭХО-КГ – эхокардиография
GMFSC – «Gross Motor Function Classification System» (англ.), Шкала глобальных моторных нарушений
CFCS – «Communication Function Classification System» (англ.), Шкала коммуникативных возможностей.
MACS – Manual Ability Classification System (англ.), классификация нарушений функции руки.
MFM – «Motor Function measure» (англ.), шкала для оценки двигательной функции у больных с нервно-мышечными заболеваниями.
HFMSE – «Hammersmith Function Motor Scale Expanded» (англ.), шкала функциональной двигательной активности Хаммерсмита для больных СМА.
RULM – «Revised Upper Limb Module» (англ.), пересмотренный модуль оценки моторной функции верхних конечностей при СМА.
Термины и определения
Амиотрофия (болезнь Фридрейха, болезнь Шарко-Мари-Тута, болезнь Руси-Леви): эквинусная деформация стоп («конская» стопа»), кифосколиоз; нарушение походки, почерка, дизартрия, слабость в ногах; нарушение и потеря слуха, нарушение глубокой чувствительности, мышечная атрофия постепенно нарастает, атрофия зрительного нерва, катаракта, нарушение функций тазовых органов, деменция, сахарный диабет, гипогонадизм, нарушения ритма, изменения предсердно-желудочковой и внутри желудочковой проводимости.
Популяционная частота: 2,7:100000. Соотношение полов: не известно. Тип наследования: аутосомно-рецессивный [113].
Врожденные структурные миопатии – гетерогенная группа генетически детерминированных заболеваний с разными типами наследования и многообразием вариантов течения.
Происходит нарушение функции мышц. Общими признаками врожденных структурных миопатий являются ранний дебют (с рождения или с первых месяцев жизни), генерализованная мышечная гипотония, снижение или отсутствие сухожильных рефлексов, атрофии мышц и структурные аномалии скелета. Как правило, не прогрессирующее течение.
Гиперкифоз – превышение границы нормальных параметров грудного отдела позвоночника в сагиттальной плоскости (>40°).
Гипокифоз – уплощение грудного кифоза за пределы нижней границы его нормальных параметров (<20°), но без формирования грудного лордоза.
Горб (gibbus) – островершинный угловой кифоз.
Кифоз – изменение формы сегмента позвоночника в сагиттальной плоскости с формированием деформации, выпуклостью, обращенной дорсально; аномальный кифоз.
Кифосколиоз – сочетание сколиотической деформации с истинным гиперкифозом. Ротационная деформация в сочетании с кажущимся кифозом не должна обозначаться этим термином.
Коррекция и инструментальная фиксация позвоночника – хирургическое вмешательство, в ходе которого выполняется коррекция и стабилизация сегментов позвоночника фиксирующими устройствами.
Мышечная дистрофия – мышечная дистрофия Дюшенна и мышечная дистрофия Беккера являются Х-сцепленными рецессивными расстройствами, характеризующимися прогрессирующей слабостью проксимальных мышц, вызванной дегенерацией мышечных волокон. Дистрофия Беккера имеет позднее начало и вызывает более легкие симптомы.
Мышечные дистрофии представляют собой клинически неоднородную группу расстройств, которые все имеют общие клинические характеристики прогрессирующей мышечной слабости. Термин “дистрофия”, используемый в его самом строгом патологическом смысле, относится к хроническим и тяжелым миопатическим изменениям в мышцах. Большинство мышечных дистрофий имеют общие патологические признаки фиброза и замещения жировой ткани, особенно на поздних стадиях заболевания. Клинически и генетически разнообразная группа наследственных нарушений структуры поперечнополосатой мускулатуры, в том числе и сердечной, характеризующихся прогрессирующей мышечной слабостью и истощением. Прогрессирующим двигательным дефицитом.
Нервно-мышечные болезни (НМБ) – обширная группа генетических гетерогенных заболеваний, основными клиническими проявлениями которых являются слабость и атрофии различных групп мышц.
Проксимальная спинальная мышечная атрофия 5q (СМА) – это тяжелое аутосомно-рецессивное нервно-мышечное заболевание, характеризующееся прогрессирующими симптомами вялого паралича и мышечной атрофии вследствие дегенерации α-мотонейронов передних рогов спинного мозга [1].
Спинальные мышечные атрофии (СМА) – группа наследственных заболеваний детского возраста, впервые описанных Werdnig в 1891 г. Заболевание проявляется симметричной атрофией нижних моторных нейронов передних рогов и корешков спинного мозга, что вызывает прогрессирующий паралич на фоне нарушения нервно-мышечной передачи.
GMFCS – международная система классификации моторных функций пациентов с ДЦП старше двух лет, которая оценивает общую функциональную активность пациента в привычной для него среде и степень ее ограничения. Принципиально важно, что оценивается именно повседневный уровень активности, а не максимально возможный, демонстрируемый только во время исследования.
Risser тест – количественный тест, определяющий стадию оссификации эпифизов гребней подвздошных костей, который начинается в области передней верхней ости и продолжается в дорсальном направлении до задней верхней ости. Течение процесса определяет стадии костного созревания и продолжается в среднем в течение двух лет. По Risser гребень подвздошной кости делится на 4 части, и стадийность процесса выгладит следующим образом: Risser-0 (отсутствие тени эпифиза), Risser-1 (оссификация в пределах 25% гребня), Risser-2 (оссификация в пределах 50% гребня), Risser-3 (оссификация в пределах 75% гребня), Risser-4 (полная оссификация гребня), Risser-5 (слияние эпифиза и тела подвздошной кости). Risser-4 соответствует завершению роста позвоночного столба.
Spina bifida – незаращение позвоночного канала за счет нарушения слияния дуг (spina bifida posterior) или тел (spina bifida anterior) позвонков.
Spina bifida aperta (открытое расщепление остистого отростка) – один из синонимов общего обозначения врожденных дефектов невральной трубки – комбинированных пороков развития позвоночного канала, спинного мозга и его оболочек: спинномозговых грыж, липоменингоцеле, и рахишизиса.
Spina bifida occulta (закрытое расщепление остистого отростка) – нарушение слияния дуг позвонков, не сопровождающееся формированием спинномозговой грыжи.
1. Краткая информация по заболеванию или состоянию (группы заболеваний или состояний)
1.1 Определение заболевания или состояния (группы заболеваний или состояний)
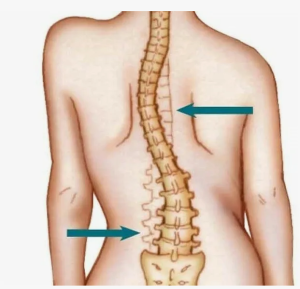
Нейромышечный сколиоз – трехплоскостная деформация позвоночника, является ортопедическим осложнением группы нервно-мышечных заболеваний «с нарушением проведения нервного импульса по нервному волокну, либо связанных с нарушением нейромышечной передачи» [2].
1.2 Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
В зависимости от уровня поражения различают нейропатические и миопатические деформации позвоночника [3].
Первые, в свою очередь, подразделяются на заболевания с поражением первого мотонейрона и второго мотонейрона (рис. 1). К нейропатическим деформациям с поражением первого мотонейрона относят сколиозы у пациентов, страдающих детским церебральным параличом (ДЦП), сирингомиелией, опухолями центральной нервной системы. Деформации позвоночника с поражениями нижнего мотонейрона могут вызывать полиомиелит и другие миелиты вирусной этиологии, спинальные мышечные атрофиии другие заболевания. Как правило, деформация позвоночника при данной патологии носит прогрессирующий характер [4, 5].
Миопатические деформации позвоночника могут наблюдаться при мышечных дистрофиях (миодистрофии Дюшенна, мерозин-негативная мышечная дистрофия), миастении.
Также нейромышечный сколиоз (кифосколиоз) может развиться как на фоне опухоли спинного мозга, так и после удаления последней без адекватной стабилизации позвоночника [6].
При таких состояниях целесообразно говорить о денервационном или паралитическом (кифосколиозе). После хирургического лечения опухолей позвоночника возможно развитие деформации, сходной по характеру с постламинэктомической или посттравматической [7, 8].
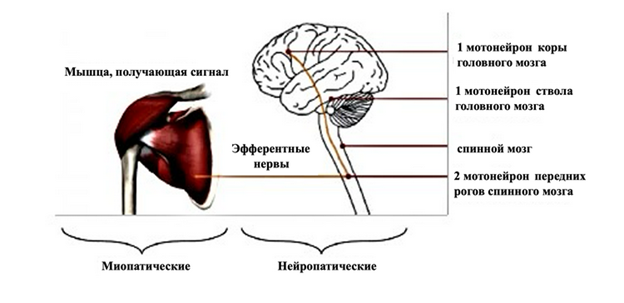
Рис. 1. Схема уровней поражения нервной системы на этапах проведения нервного импульса при различных видах нейромышечных сколиозов (из атласа Spine Surgery Information Portal, Prof .Dr. med. J. Harms).
1.3 Эпидемиология заболевания или состояния (группы заболеваний или состояний)Частота возникновения деформации позвоночника зависит от основного нейромышечного заболевания и серьезности его проявления [9].
Таблица 1. Распространенность деформаций позвоночника при НМБ

Суммарная распространенность НМБ составляет примерно 1 на 3-3,5 тыс. населения в различных популяциях мира [10, 11, 12]. Сейчас в федеральном регистре РФ более 1300 пациентов, однако, если пересчитать данную статистику на численность населения РФ, то можно предположить, что в стране насчитывается около 48 тысяч больных с НМБ.
Прогрессирующие мышечные дистрофии и спинальные амиотрофии являются наиболее распространенными заболеваниями из этой группы (13-33 больных на 100 тыс. населения и 10 больных на 100 тыс. населения соответственно [12]).
Распространенность проксимальной спинальной мышечной атрофии составляет 1 на 6000-10 000 новорожденных [13]. Данные по распространенности заболевания в РФ отсутствуют. Частота носительства заболевания – 1/40-1/50 в популяции в целом [14, 15]. По данным ФГБНУ МГНЦ Минобрнауки России частота носительства СМА в России – 1/36 человек и расчетная частота встречаемости 1 на 5184 новорожденных [16].
Сколиоз широко распространен у детей с CMA 1 и 2 типа, частота заболеваемости составляет 60-90% с началом в раннем детстве [17, 18].
Общая заболеваемость сколиозом в популяции ЦП варьируется от 21% до 76% в зависимости от серии и тяжести ЦП [11, 12, 19, 20, 21, 22]. Кривые обычно меньше 40°, но величина сколиоза, зависит от тяжести ЦП [11]. Заболеваемость сколиозом увеличивается с возрастом и уменьшается передвижение. Persson-Bunke M. с соавт. обнаружили, что риск развития сколиоза возрастает с увеличением возраста пациентов с ЦП и уровня GMFCS (у пациентов с ЦП с GMFCS IV-V имеется риск 50% клинически умеренного или тяжелого сколиоза в 18 лет) [20]. Hagglund G. с соавт. показали, что 8% пациентов с GMFCS V имели клинические признаки сколиоза в возрасте до 5 лет, а 75% пациентов с GMFCS V и мели деформацию позвоночника с углом Кобба ≥40° к 20 годам [23].
Гиперлордоз поясничного отдела позвоночника или кифосколиоз грудного отдела позвоночника также часто встречаются при ЦП [22]. Естественная история прогрессирования сколиоза у пациентов с ЦП показала, что начало гибкой деформации позвоночника происходит в возрасте от 3 до 10 лет с быстрым прогрессированием до жесткого сколиоза [19]. Gu Y. с соавт. определили, что у пациентов с квадриплегией ЦП с деформацией >40° к 12-летнему возрасту вероятность прогрессирования была выше, чем у пациентов с кривой ≤40° к тому же возрасту [24].
Распространенность атаксии Фридрейха у представителей белой европеоидной расы оценивается от 1/20,000 до 1/50,000, сколиотическая деформация развивается у 60-79% пациентов [25].
У пациентов с МДД, которые не получают глюкокортикоиды, вероятность развития выраженного прогрессирующего сколиоза составляет приблизительно 90% [26, 27], а вероятность компрессионного перелома позвонков, вызванного остеопорозом, мала. Показано, что ежедневная терапия глюкокортикоидами снижает риск развития сколиоза [28, 29], однако риск перелома позвонков возрастает [30, 31].
1.4 Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
M41.4 – Нервно-мышечный сколиоз. Сколиоз вследствие церебрального паралича, атаксии Фридрейха, полиомиелита и других нервно-мышечных нарушений.
В настоящих клинических рекомендациях аспекты течения различных нервно-мышечных болезней рассматриваются только в рамках оценки рисков, аспектов предоперационного обследования, интра- и послеоперационного ведения пациентов.
1.5 Классификация заболевания или состояния (группы заболеваний или состояний)
Наиболее полная этиологическая классификация сколиозов, кифозов и лордозов представлена Lonstein E.J. с соавт. (1995) [32]:
I. Идиопатические
A. Инфантильные (от 0 до 3 лет):
1. саморазрешающиеся;
2. прогрессирующие.
В. Ювенильные (от 3 до 10 лет).
С. Подростковые (старше 10 лет).
II. Нейромышечные
A. Нейропатические:
1. На почве поражения верхнего мотонейрона:
a. церебральный паралич;
b. позвоночно-мозжечковая дегенерация:
1) болезнь Friedreich;
2) болезнь Charcot-Marie-Tooth;
3) болезнь Roussy-Levy;
с. Сирингомиелия;
d. опухоль спинного мозга;
e. травма спинного мозга;
f. другие причины.
2. На почве поражение нижнего мотонейрона:
а. полиомиелит;
b. другие вирусные миелиты;
c. травма;
d. позвоночно-мышечные атрофии:
1) болезнь Werdnig-Hoffmann;
2) болезнь Kugelberg-Welander;
3) миеломенингоцеле (паралитическое).
3. Дизаутономия (синдром Riley-Day).
4. Другие.
В. Миопатические.
1. Артрогрипоз.
2. Мышечная дистрофия.
3. Врожденная гипотония.
4. Дистрофическая миотония.
5. Другие.
III. Врожденные
А. Нарушения формирования.
1. Клиновидный позвонок.
2. Полупозвонок.
В. Нарушения сегментации.
1. Односторонние.
2. Двусторонние.
С. Смешанные аномалии.
IV. Нейрофиброматоз
V. Мезенхимальная патология
А. Синдром Marfan.
В. Синдром Ehlers-Danlos.
С. Другие.
VI. Ревматоидные заболевания
А. Ювенильный ревматоидный артрит.
В. Другие.
VII. Травматические деформации
А. После перелома.
В. После хирургического вмешательства.
1. Постламинэктомические.
2. Постторакопластические.
VIII. На почве контрактур вне позвоночной локализации
А. После эмпиемы.
В. После ожогов.
IX. Остео хондродистрофические
А. Дистрофический дварфизм.
В. Мукополисахаридоз (например, болезнь Morquio).
С. Спондилоэпифизарная дисплазия.
D. Множественная эпифизарная дисплазия.
Е. Ахондроплазия.
F. Другие.
X. На почве остеомиелита.
XI. Метаболические нарушения.
А. Рахит.
В. Несовершенный остеогенез.
С. Гомоцистинурия.
D. Другие.
XII. На почве патологии пояснично-крестцового сочленения.
А. Спондилолиз и спондилолистез.
В. Врожденные аномалии пояснично-крестцового сочленения.
XIII. На почве опухоли.
А. Позвоночного столба.
1. Остеоид-остеома.
2. Гистиоцитоз Х.
3. Другие.
В. Спинного мозга (см. нейромышечные сколиозы).
1.6 Клиническая картина заболевания или состояния (группы заболеваний или состояний)
Клинические проявления деформации позвоночника при НМБ характеризуются формированием:
1) сколиоза;
2) кифоза;
3) кифосколиоза;
4) поясничного гиперлордоза;
5) перекоса таза;
6) торсионной деформации грудной клетки.
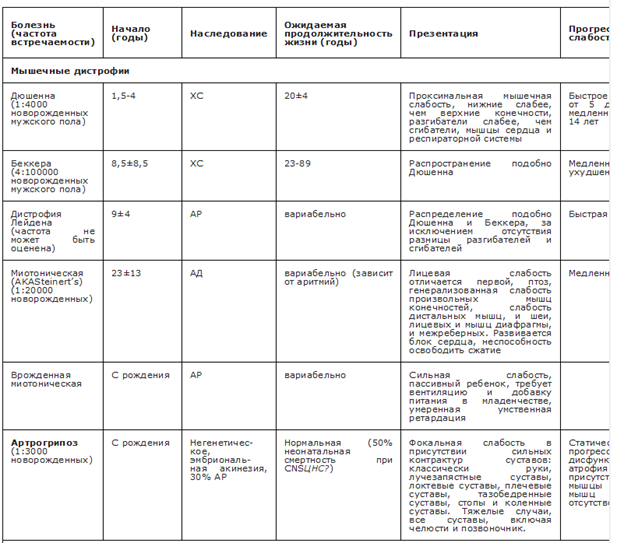
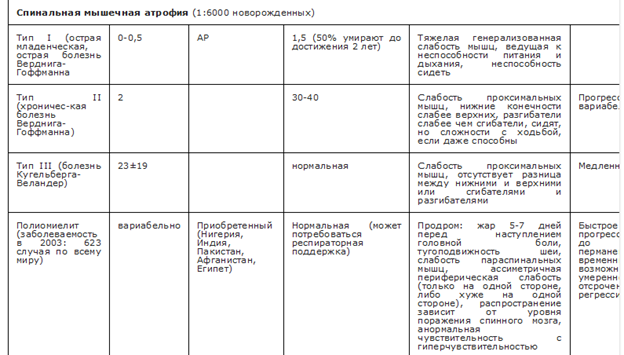
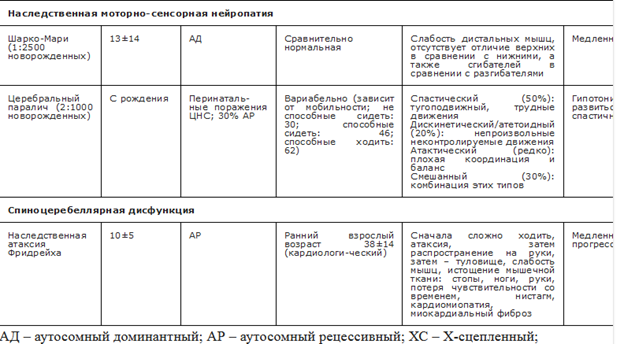
Основные особенности течения НМБ представлены в таблице 2 [33, 34].
Таблица 2. Основные особенности нейромышечных болезней [116]
2. Диагностика заболевания или состояния (группы заболеваний или состояний) медицинские показания и противопоказания к применению методов диагностики
Критерии установления диагноза/состояния на основании:
- Анамнестических данных – установленное нервно-мышечное заболевание или подозрение на его наличие;
- Данных физикального обследования – выявлены признаки деформации позвоночника во фронтальной или сагиттальной плоскостях;
- Лабораторных исследований – подтвержденное нервно-мышечное заболевание на основании данных генетической экспертизы;
- Инструментального обследования – подтвержденная инструментальными методами исследования деформация позвоночника.
2.1 Жалобы и анамнез
У пациентов с нервно-мышечными болезнями для комплексной диагностики статуса пациента и его динамики рекомендуется оценивать:
– степень выраженности жалоб самого пациента и его родителей (для детей);
– время появления деформации позвоночника и динамику ее нарастания;
– темп появления и нарастания жалоб;
– историю предшествовавшего лечения;
– уровень двигательной активности, ее условия и ограничения;
– наличие сопутствующей патологии;
– получаемую лекарственную терапию или аппаратную зависимость и их сроки;
– наличие аллергии, лекарственной непереносимости [32].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5).
Комментарии: первый этап диагностики – сбор анамнеза. Необходимо выяснить, в каком возрасте и кем впервые была замечена деформация позвоночника, обращались ли родители больного к врачу, проводилось ли лечение, какое именно и в чем выражался эффект. Производится оценка активности ребенка и соответствия развития возрасту.
Оценивается имеющаяся медицинская документация, ранее проведенное лечение и заключения специалистов. Уже на этом этапе есть возможность заподозрить наличие наследственно-генетического синдрома или заболевания. При выявлении стигм дизэмбриогенеза, различных внешних признаков отклонения от нормального развития, таких как нарушение формирование органов, нарушение роста, изменение роста волос, цвета и влажности кожных покровов, аномалии развития и грубые отклонения от нормы по результатам общеклинических и параклинических методов обследования, пациент в первую очередь направляется на консультацию к генетику. При выявлении определенного наследственно-генетического синдрома и заболевания, назначаются дополнительные методы диагностики для определения состояния и функции различных органов и систем, которые могут быть вовлечены в патологический процесс при данном заболевании. При наличии уже известной генетической патологии – акцент в предоперационном обследовании делается на таргетные органы и системы, которые могут быть вовлечены в основное заболевание. В остальном, тактика ведения пациентов при синдромальных сколиозах, при отсутствии грубых отклонений от нормы, не отличается от таковой при врожденных идиопатических сколиозах.
Следующий этап – выяснение жалоб пациента. В хирургии деформаций позвоночника этот элемент обследования приобретает особое звучание. Основных жалоб обычно две – косметический дефект, связанный с деформацией позвоночника и грудной клетки, и болевой синдром, причем вовсе необязательно, чтобы больной предъявлял обе жалобы. Их при первом разговоре с пациентом может вообще не быть. Следует учитывать, что самооценка больным своего внешнего вида чрезвычайно вариабельна. Также оцениваются жалобы, не относящиеся на первый взгляд к деформации позвоночника, такие как сон, аппетит, питание, утомляемость, активность, одышка, мобильность и объем движения в суставах, частота простудных заболеваний, что может также натолкнуть на необходимость дообследования.
Необходимо выяснить, беспокоит ли пациента одышка, когда она отмечена впервые, при каких нагрузках отмечается и усиливается ли с годами.
2.2 Физикальное обследование
- Для оценки ортопедического статуса всем пациентам с нейрогенными деформациями позвоночного столба рекомендуется оценка:
– фронтального и сагиттального баланса позвоночника;
– мобильности позвоночника с помощью тракционного теста;
– компенсации перекоса таза;
– постурального контроля самостоятельно или при помощи технических средств реабилитации (ТСР);
– наличие и степени выраженности контрактур конечностей;
– мышечной силы по бальной оценка силы мышц (Приложение Г1);
– боли по визуальной аналоговой шкале (ВАШ) (при ее наличии) (Приложение Г2);
– ИМТ [3, 12, 13, 22, 33, 58].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: Функциональные шкалы универсальные: функциональная шкала оценки глобальных моторных нарушений – GMFSC (Приложение Г3), а также CFCS (Приложение Г4), MACS (Приложение Г5), MFM (Приложение Г6) и нозологически-направленные: модуль оценки моторной функции верхних конечностей – RULM (Приложение Г7), функциональная шкала оценки моторных функций – HFMSE (Приложение Г8), могут применяться опционно специалистами врачами-неврологами и врачами физический и реабилитационной медицины в зависимости от основного заболевания.
- Всем пациентам с подозрением на нервно-мышечное заболевание или с подтвержденным диагнозом рекомендован прием (осмотр, консультация) врача-невролога первичный с целью оценки и протоколирования неврологического статуса [3, 12, 13, 22, 23].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
- Всем пациентам с подозрением на нервно-мышечное заболевание или с подтвержденным диагнозом рекомендован прием (осмотр, консультация) врача-травматолога-ортопеда первичный с целью оценки и описания ортопедического статуса [3, 12, 13, 22, 23].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
Комментарий: Всем пациентам с подозрением на нервно-мышечное заболевание или с подтвержденным диагнозом целесообразно проводить совместный осмотр врача-невролога и врача-травматолога-ортопеда с целью диагностики и согласования тактики лечения.
- Всем пациентам с подозрением на нервно-мышечное заболевание или наследственно-генетическую патологию рекомендован прием (осмотр, консультация) врача-генетика первичный с целью проведения генетического исследования, верификации или исключения генетической патологии [3, 12, 13, 22, 23].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
- Пациентам с нервно-мышечными болезнями с наличием сопутствующей патологии органов дыхания, сердечно-сосудистой системы, нарушений обмена и др. рекомендуется консультация врача соответствующего профиля [36, 98, 99, 100, 101].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
Комментарий: Рекомендации консультантов реализуются исключительно по согласованию с лечащим врачом, за исключением ситуаций, требующих оказания экстренной медицинской помощи.
2.3 Лабораторные диагностические исследования
- Пациентам с НМБ рекомендуется проведение клинических, биохимических и иных исследований с целью оценки состояния пациента в соответствии с имеющимися клиническими проявлениями вертебральной и вневертебральной патологии [32].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
- На амбулаторном этапе пациентам с НМБ рекомендуется проведение следующих лабораторных исследований:
– исследование уровня натрия в крови,
– исследование уровня калия в крови,
– исследование уровня хлоридов в крови,
– определение основных групп по системе AB0,
– определение антигена D системы Резус (резус-фактор),
– определение антигена (HbsAg) вируса гепатита B (Hepatitis B virus) в крови,
– определение антител к вирусу гепатита C (Hepatitis C virus) в крови,
– определение антител классов M, G (IgM, IgG) к вирусу иммунодефицита человека ВИЧ-1 (Human immunodeficiency virus HIV 1) в крови,
– определение антител классов M, G (IgM, IgG) к вирусу иммунодефицита человека ВИЧ-2 (Human immunodeficiency virus HIV 2) в крови,
– определение антител к бледной трепонеме (Treponema pallidum) в нетрепонемных тестах (RPR, РМП) (качественное и полуколичественное исследование) в сыворотке крови,
– коагулограмма (ориентировочное исследование системы гемостаза),
– общий (клинический) анализ крови,
– анализ крови биохимический общетерапевтический,
– общий (клинический) анализ мочи [32].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5).
- На амбулаторном этапе пациентам с НМБ для прогноза течения заболевания рекомендуются консультации специалистов:
– пациентам детского возраста требуется прием (осмотр, консультация) врача-педиатра первичный, а пациентам взрослого возраста – прием (осмотр, консультация) врача-терапевта первичный.
– прием (осмотр, консультация) врача-невролога первичный;
– прием (осмотр, консультация) врача-генетика первичный (при отсутствии верификации диагноза) [205, 206];
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5).
- На стационарном этапе пациентам с НМБ рекомендуется проведение лабораторных исследований:
– коагулограмма (ориентировочное исследование системы гемостаза),
– общий (клинический) анализ крови,
– анализ крови биохимический общетерапевтический,
– общий (клинический) анализ мочи [32, 202].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5).
Комментарии: иные лабораторные исследования назначаются лечащим врачом на основании рекомендаций других врачей-специалистов.
- На стационарном этапе пациентам с НМБ для оценки соматического статуса и оценки риска проведения вмешательств рекомендуются консультации специалистов:
– пациентам детского возраста требуется прием (осмотр, консультация) врача-педиатра первичный, а пациентам взрослого возраста – прием (осмотр, консультация) врача-терапевта первичный.
– осмотр (консультация) врачом-анестезиологом-реаниматологом первичный,
– прием (осмотр, консультация) врача-невролога первичный;
– других врачей-специалистов по назначению лечащего врача [32].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
2.4 Инструментальные диагностические исследования
- С целью определения тактики консервативного и оперативного лечения всем пациентам с наличием деформации позвоночника рекомендуется проведение:
– рентгенографии шейного отдела позвоночника,
– рентгенографии грудного и поясничного отделов позвоночника в прямой и боковой проекциях стоя (при возможности вертикализации у пациентов амбулаторной стадии), сидя (при возможности вертикализации у пациентов ранней неамбулаторной стадии) или лежа (у пациентов поздней неамбулаторной стадии),
– рентгенографии таза в прямой проекции лежа [3].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5).
Комментарии: снимки в прямой проекции рекомендуется выполнять ежегодно при искривлении позвоночника менее 15-20°, и каждые 6 месяцев при искривлении более 20° до созревания скелета. Промежуток между проведением рентгенографии более 1 года увеличивает вероятность того, что прогрессирование сколиоза останется незамеченным. После созревания скелета решение о необходимости проведения рентгенографии принимается снова, на основании клинической оценки.
- С целью определения тактики оперативного лечения всем пациентам с наличием деформации позвоночника рекомендуется проведение компьютерной томографии позвоночника (перед проведением оперативного вмешательства) [3]
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5).
Комментарии: компьютерная томография дает сведения о повреждениях костной структуры позвонков, дает возможность оценить форму, размер структур позвонков и позвоночного канала, что особенно важно при планировании оперативных вмешательств. Большое внимание уделяют изучению структурных особенностей и торсии позвонков на вершине деформации, остеопении каудальных отделов пояснично-крестцового отдела и таза, которые определяют объем и планирование хирургического вмешательства.
- С целью определения тактики оперативного лечения всем пациентам с наличием деформации позвоночника рекомендуется проведение магнитно-резонансной томографии позвоночника (при необходимости перед проведением оперативного вмешательства) [3].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5).
Комментарии: МРТ дает точные сведения о состоянии спинного мозга. Достаточно четко определяется морфология вертебрального синдрома, наличие миелопатии и вертебро-медулларного конфликта.
- Для оценки респираторной функции легких на этапе подготовки к оперативному лечению рекомендуется исследование неспровоцированных дыхательных объемов и потоков с использованием пикфлоуметра, дистанционное наблюдение за функциональными показателями внешнего дыхания, а также спиральная КТ легких [35, 36].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5).
- Рекомендуется регистрация электрокардиограммы, эхокардиография, холтеровское мониторирование сердечного ритма и МРТ сердца и магистральных сосудов (при необходимости) перед операцией для оценки рисков анестезиологического пособия или седации, контроля сердечной дисфункции (гипертрофия миокарда, аритмии, различные блокады проводимости) и оптимизации кардиотропной терапии [35-37, 118].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5).
- Рекомендуется проведение рентгеноденситометрия по протоколу «все тело» и «поясничный отдел позвоночника» для исключения остеопороза при подготовке к хирургическому вмешательству [35, 118].
- с частотой 1 раз в год
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5).
Комментарии: учитывая крайне ограниченную двигательную активность пациентов с НМБ важно акцентировать внимание на «костную плотность». Выраженный остеопороз (Z-критерий <-2.5 SD) является ограничением к хирургической коррекции сколиоза в связи с высоким риском развития импланто-зависимых осложнений [122, 123].
Для пациентов со СМА характерна высокая частота переломов и остеопении. Данные риски обусловлены не только мышечной слабостью и низкой подвижностью пациентов, но и тем, что ген SMN играет определенную роль в метаболизме костной ткани [38].
- Пациентам со СМА 5q I типа, а также у пациентов со СМА II типа рекомендуется Определение парциального давления кислорода в мягких тканях (оксиметрия) во время ночного сна при минимальных подозрениях для выявления ночной гиповентиляции и обструктивного апноэ сна [39].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 4).
Комментарии: использование пульсоксиметрии в качестве единственного способа мониторинга ночной гиповентиляции считается допустимым, когда нет возможности выполнять капнографию. В норме показатели сатурации находятся в пределах 95-100%. При SpO2 ниже 90% необходимо принять неотложные меры. Сатурация между 94-90% считается пограничной. Пациентам с гиповентиляцией рекомендовано иметь дома пульсоксиметр.
- Пациентам с проксимальной мышечной гипотонией и мышечной слабостью, не имеющим генетического подтверждения диагноза, рекомендуется магнитно-резонансная томография мышечной системы, с целью дифференциальной диагностики СМА 5q и других нервно-мышечных заболеваний [40].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4).
Комментарии: МРТ мышц выявляет жировое замещение мышечной ткани. Визуализируется характерный паттерн поражения – гипертрофия и относительная сохранность m. Adductor longus (длинной головки аддуктора), который является довольно специфичным для спинальной мышечной атрофии. Однако специфический паттерн поражения проявляется на поздней стадии заболевания, в самом начале заболевания и у маленьких детей выявить его довольно трудно.
- Всем пациентам со СМА I и СМА II старше 5 лет со снижением форсированного выдоха на 45% и более рекомендуется кардиореспираторный мониторинг 1 раз в 6 месяцев для контроля над прогрессированием дыхательных нарушений [114].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
- Пациентам детского возраста со СМА 5q рекомендуется проведение полисомнографии, если есть подозрение на наличие гиповентиляции для уточнения ее характера и исключения сонных апноэ [41].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2).
Комментарии: пациенты со СМА подвержены нарушению дыхания во сне, наиболее часто – гиповентиляции из-за уменьшения дыхательного объема, нарушения работы диафрагмы, снижения функции межреберных и вспомогательных мышц. Также отмечается обструктивный синдром из-за слабости мышц гортани и глотки, обусловливающий предрасположенность к коллапсу дыхательных путей [114].
Пациентам с НМБ рекомендуется предоперационная оценка дыхательной функции для определения риска возникновения респираторных осложнений (риски снижения силы респираторной мускулатуры, усугубление гиповентиляции, отхаркивания секрета дыхательных путей, аспирации, обструктивных и центральных апноэ. Эти состояния могут приводить к нозокомиальным инфекциям, длительной искусственной вентиляции легких (ИВЛ), трахеотомии и в ряде случаев – смерти.) [35].
Оценка дыхательной функции должна включать подробный анамнез и физикальный осмотр, прицельную рентгенографию органов грудной клетки, оценку респираторной функции и эффективности кашля, а также на предмет расстройств дыхания, ассоциированных со сном [35, 36]. Оценка дыхательной функции включает измерение ЖЕЛ (исследование неспровоцированных дыхательных объёмов и потоков (спирометрия)), дневную пульсоксиметрию (SpO2). SpO2 менее 95% на атмосферном воздухе определяется как клинически значимое патологическое значение, требующее дополнительно оценки парциального напряжения углекислого газа.
Оценка выраженности гиповентиляции для уточнения ее характера и исключения сонных апноэ у взрослых не описана, однако мы считаем целесообразным расширить рекомендацию «проведение полисомнографии, если есть подозрение на наличие гиповентиляции для уточнения ее характера и исключения сонных апноэ» на взрослых пациентов со СМА 5q.
Дыхательная недостаточность является частой причиной смерти, особенно при МДД [45].
- Всем пациентам с НМБ c целью предупреждения и динамического наблюдения кардиальной недостаточности рекомендуется проведение инвазивного мониторинга артериального давления [113, 114, 119].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5).
2.5 Иные диагностические исследования
- Рекомендуется: пациентам детского возраста с атипичным вариантом СМА, если диагноз CМА 5q не подтвержден генетически, с целью дифференциального диагноза СМА 5q и других нервно-мышечных заболеваний:
– биопсия мышц [46];
– патолого-анатомическое (морфологическое) исследование биопсийного (операционного) материала мышечной ткани с применением иммуногистохимических методов с целью дифференциального диагноза [46].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4).
Комментарии: при морфологическом исследовании биоптата мышц у больных со спинальной мышечной атрофией выявляются неспецифические признаки пучковой атрофии и группировки мышечных волокон. Большинство увеличенных мышечных волокон относятся к I типу. Все иммуногистохимические маркеры будут нормальными.
Ультраструктурные изменения также будут неспецифическими.
Данные по необходимости оценке и результатам биопсийного (операционного) материала мышечной ткани у взрослых пациентов с атипичными формами СМА 5q отсутствуют. Целесообразно рассматривать этот вопрос в рамках мультидисциплинарного консилиума [Консенсус авторов клинической рекомендации].
3. Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
3.1. Консервативное лечение
- Рекомендуется корсетное лечение у пациентов с НМБ для поддержки ослабленного мышечного тонуса позвоночника и лечения сколиоза >20°, особенно у ребенка с быстрым ростом [47, 48].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 4).
Комментарии: нет межэкспертного согласия по типу корсетов, который нужно использовать у таких больных. Большинство экспертов рекомендуют жесткие спинальные грудопоясничные ортезы (функционально-корригирующие корсеты) с опорой на таз, нижнюю апертуру грудной клетки и с «абдоминальным окном».
- Пациентам с НМБ рекомендуются любые варианты индивидуальных жестких корсетов на грудной и поясничный отдел позвоночника, позволяющие поддерживать положение тела сидя, если они не нарушают легочную функцию [49].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5).
- Консервативные методы лечения рекомендуются в качестве ведущего компонента в следующих ситуациях:
– при отсутствии показаний к хирургическому лечению;
– При наличии ограничений к хирургической коррекции сколиоза: низкий ИМТ <12; выраженный остеопороз (Z-критерий < -2.5 SD) [50, 118, 119].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5).
Комментарии: ортезирование является паллиативным методом, который, в качестве самостоятельного метода, способен повлиять на прогрессирование деформации позвоночника [48, 51].
Корсеты, которые обычно используются при лечении идиопатического сколиоза, часто неэффективны у пациентов с ЦП [52, 53, 54, 118, 119].
Кроме того, пациенты не всегда соблюдают правила использования корсетов. Синдром судорог при эпилептических формах, ограничение движений грудной стенки, связанных с ношением корсетов, может усугубить существующие проблемы с легкими и может привести к пролежням. Olafsson Y. и соавт. показали некоторые ограничения на прогрессирование кривой у амбулаторных пациентов с небольшими поясничными кривыми [55]. Nakamura N. и соавт. продемонстрировали улучшения при сколиозе, стабильность сидения и удовлетворенность попечителя в группе пациентов, использовавших функционально-корригирующие корсеты типа TSLO [56]. Pettersson K. и Rodby-Bousquet E. изучив 251 пациента с 2800 ЦП, использовали корсет, и они пришли к выводу, что большинство детей делают это для улучшения функции (стабильность, контроль головы и функции руки/кисти), а не предотвращения деформации [57].
У пациентов с ЦП рекомендуется использовать кресла-коляски с боковой поддержкой туловища или индивидуальные ложементы как средство для контроля деформации позвоночника [57].
- Рекомендуется применение ботулинического анатоксина типа А** при терапии спастичности при заболеваниях периферической нервной системы, в том числе, при наличии деформации позвоночника.
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5).
Комментарии: Nuzzo R.M. и соавт. [155] сообщили, что инъекция ботулинического токсина типа А** в мышцы по вогнутой стороне сколиотической деформации позволила замедлить прогрессирование сколиоза и повысить эффективность корсетного лечения. Однако следует учитывать кратковременную эффективность ботулинического анатоксина типа А** и тот факт, что его нельзя использовать на более поздних стадиях из-за механического коллапса деформации позвоночника.
3.2. Хирургическое лечение
- Хирургическое вмешательство по коррекции и фиксации сегментов позвоночника для пациентов с НМБ рекомендовано в случаях:
– сколиоза более 40° по Cobb (для СМА более 50°),
– гиперкифоза или гиперлордоза более 50° по Cobb,
– глобального дисбаланса туловища во фронтальной и (или) сагиттальной плоскости,
– быстрого прогрессирования сколиотической деформации (более 5° в год, для СМА ≥10° ежегодно),
– потребности в вертикализации и улучшении качества жизни [22, 61-67].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарии: у больных с ММД, которые получают глюкокортикоиды, хирургическая коррекция и фиксация оправдана в случае, если искривление во фронтальной плоскости или ≥30° по Коббу отклонения в сагиттальной плоскости) и скорости прогрессирования (≥10° ежегодно), а также при остеопоротических переломах позвонков и сохраняющейся боли при неэффективности медикаментозной терапии этих синдромов, вне зависимости от зрелости скелета.
- Не рекомендуется хирургическая коррекция и фиксации сегментов позвоночника в следующих случаях:
– низкий ИМТ <12;
– выраженный остеопороз (Z-критерий < -2,5 SD);
– нестабильные витальные параметры [50, 118, 119].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарии: при принятии решения о хирургическом вмешательстве рекомендуется учитывать снижение функции дыхания, деформацию ребер, гиперкифоз, влияние на мобильность и функционирование пациента, наклон таза и дисбаланс туловища. Рекомендуется отложить выполнение хирургического вмешательства у детей до 4-х летнего возраста [65].
У детей в возрасте от 8 до 12 лет хирургический подход зависит от клинических данных, особенно с точки зрения скелетной зрелости и роста позвоночника.
- В случаях, если перекос таза равен 15° и более рекомендуется выполнять коррекцию и заднюю инструментальную фиксацию грудного и поясничного отделов позвоночника с захватом таза [68-71].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4).
- Не рекомендуется: выполнение фиксации таза пациентам с возможностью ходить и при отсутствии перекоса таза у неамбулаторных пациентов. Важно поддерживать пояснично-крестцовую связь при вращательных движениях туловища во время походки [72].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарии: при МДД задняя стабилизация позвоночника оправдана только у больных, неспособных к самостоятельному передвижению, у которых искривление позвоночника более 20°, и тех, кто не получают глюкокортикоиды и уже должны достигнуть состояния зрелости позвоночника [26, 74, 75].
- Рекомендуется: у детей до 12 лет рассмотреть возможность использования «метода двойных растущих стержней» для стабилизации позвоночника с или без фиксации таза в зависимости от вовлечения таза в сколиотическую дугу [12, 22, 61, 62, 76-82, 86].
Для детей Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4, для всех пациентов Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5.
- Не рекомендуется: применение эндопротезов для фиксации и остеосинтеза позвоночника с воздействием на позвоночник или ребра (VEPTR и его аналоги) у пациентов со СМА с целью коррекции деформации ребер по типу «сложенного зонта» ввиду низкой эффективности этих методов использования [12, 22, 61, 62, 84, 86, 181].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
- Рекомендуется оставить свободными один или два уровня в среднепоясничном отделе по средней линии у пациентов со СМА при планировании операции на позвоночнике для выполнения спинномозговых пункций, в том числе для проведения таргетной терапии [49].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
- Рекомендуется: проводить интраоперационный мониторинг состояния проводящих структур спинного мозга (ИОНМ) с контролем нервно-мышечной проводимости пациентам с НМБ вне зависимости от двигательного статуса для снижения риска тракционной радикулопатии и сенсомоторных нарушений (Система для интраоперационного мониторинга) [87-92].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4).
3.3. Иное лечение
3.3.1 Анестезиологическое ведение пациентов с нейромышечными заболеваниями.
3.3.1.1 Предоперационное ведение пациентов с НМБ
- Предоперационная подготовка рекомендуется всем пациентам, даже при «бессимптомном» течении. [202].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4).
Комментарии:
- для оценки респираторного резерва в объеме: рентгенография легких или КТ легких; эргоспирометрия с оценкой пиковой скорости кашля; консультация врача-пульмонолога; ночная пульсоксиметрия или кардиореспираторный мониторинг. При ограниченном респираторном резерве обязательно необходимо проведение периоперационной неинвазивной искусственной вентиляции легких, применения ручных и инструментальных методов стимуляции и облегчения откашливания. Особенно у не ходячих пациентов предоперационная подготовка должна дополняться проведением НИВЛ в течение не менее 1 месяца до операции [91, 92, 93, 94].
- Оценка сердечной деятельности должна быть проведена не менее чем за 2 месяца до оперативного лечения. При снижении функции терапия с контролем до хирургического вмешательства. Рекомендован осмотр врача-кардиолога с возраста 10 лет [36].
- Прием (осмотр, консультация) врача-детского эндокринолога первичный с оптимизацией нутритивного статуса [95,36].
- Прием (осмотр, консультация) врача-детского эндокринолога первичный с выполнением рентгеноденситометрии, при выявлении остеопении ее коррекция [96].
- Избегать препаратов для премедикации, которые могут вызвать депрессию дыхания и гиповентиляцию вплоть до остановки дыхания [97].
- Рассмотреть вопрос о введении стрессовой дозы метилпреднизолона** в процессе оперативного вмешательства у пациентов, длительно получающих стероидную терапию (для профилактики острой надпочечниковой недостаточности) [98, 99, 100].
- Интубация трахеи у пациентов с НМБ должна проводиться по существующим и актуальным для клиники протоколам по трудным дыхательным путям [97].
- Центральный венозный доступ желательно осуществлять под ультразвуковой навигацией [101, 102].
- Поддержание нормальной температуры тела [103].
- Рассмотреть вопрос о приобретении нового кресла-коляски или модификация старого (сидения, спинки, подлокотников, подголовника и т. п) до оперативного лечения.
Общие принципы интраоперационного ведения пациентов с НМБ
- Не рекомендуется:
– премедикация препаратами, угнетающих дыхательный центр (опиоды, производные бензодиазепина);
– Ингибиторы холинэстеразы (АТХ код группы N06DA) из-за непредсказуемого ответа на неостигмина метилсульфат**. По возможности следует избегать ингаляционной анестезии. Пациенты с МДД не должны получать ингаляционные галогенированные углеводороды [176].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарии: важную роль играет минимизация объема кровопотери и времени оперативного лечения, особенно в процессе обширных оперативных вмешательств.
Этот аспект детально представлен в проекте клинических рекомендаций Общероссийской общественной организации «Федерация анестезиологов и реаниматологов» России «Периоперационное ведение пациентов с нервно-мышечными заболеваниями (проект)» [176].
3.3.2 Хирургическая антибиотикопрофилактика
- При хирургическом лечении пациентов с идиопатическим сколиозом рекомендуется проводить хирургическую антибиотикопрофилактику (ХАП) инфекции области хирургического вмешательства однократным предоперационным введением антибактериального препарата с целью снижения риска развития инфекционных осложнений [177]. Применение указанных лекарственных препаратов проводится с учетом возрастных ограничений в инструкции по медицинскому применению.
Уровень убедительности рекомендации C (уровень достоверности доказательств – 5).
Комментарии. Для пациентов с неотягощенным аллергоанамнезом и без значимых факторов риска носительства метициллин-резистентных стафилококков для профилактики ХАП используются цефалоспорины первого и второго (I и II поколения) (цефазолин**, цефуроксим**), которые вводятся внутривенно в интервале от 30 до 60 минут до разреза кожи. При непереносимости бета-лактамных антибактериальных препаратов: пенициллинов следует применять ванкомицин**, который вводится в течение минимум 60 мин с началом внутривенной инфузии за 2 ч до разреза, либо #клиндамицин**. При значимых факторах риска носительства метициллин-резистентных стафилококков (MRS) схема ХАП должна включать антибактериальные препараты системного действия (АТХ: J01) с анти-MRS-активностью (ванкомицин**). В большинстве случаев для эффективной профилактики достаточно одной предоперационной дозы антибактериального препарата системного действия. При длительных вмешательствах (более 3 ч) или массивной кровопотере следует назначать дополнительную интраоперационную дозу антибактериального препарата системного действия (АТХ: J01) (ориентировочный срок интраоперационного введения – через 2 периода полувыведения после предоперационной дозы). Введение антибактериальных препаратов системного действия (АТХ: J01) после закрытия раны в операционной нецелесообразно даже при наличии установленных дренажей.
Разовые дозы основных антибактериальных препаратов для ХАП при оперативных вмешательствах в травматологии и ортопедии у взрослых: #цефазолин** 2 г (при весе пациента ≥120 кг – 3 г), цефуроксим** 1,5 г, #клиндамицин** 900 мг, ванкомицин** по 15 мг/кг в виде медленной в/в инфузии, #ципрофлоксацин** 400 мг (у детей 10 мг/кг), #левофлоксацин** 500 мг (у детей 10 мг/кг) [177].
Разовые дозы для детей следует рассчитывать по фактическому весу: цефазолин** 30 мг/кг, цефуроксим** 50 мг/кг, #клиндамицин** 10 мг/кг, ванкомицин** 15 мг/кг [177, 192, 193].
3.3.3 Послеоперационное обезболивание
- С целью адекватного обезболивания пациентам с НМБ рекомендуется использовать мультимодальную анальгезию для взрослых и детей с учётом возрастных ограничений, которая может включать НПВП (из группы M01A Нестероидные противовоспалительные и противоревматические препараты нестероидные противовоспалительные и противоревматические препараты), парацетамол**, габапентиноиды (АТХ код группы N02BF) и опиоиды (АТХ код группы N02A) немедленного высвобождения с учетом возрастных ограничений в инструкции по медицинскому применению, при невозможности её назначения – мономодальную [180, 181, 182, 194].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарии: Из фармакологических стратегий в настоящее время общепринятым является применение мультимодальной анальгезии (ММА), представляющей собой использование нескольких анальгетиков (опиоидных и неопиоидных) из группы N02 Анальгетики с разным механизмом действия и нефармакологических вмешательств, направленных на воздействие на периферические и/или центральные участки нервной системы [206]. Такое сочетание позволяет более эффективно купировать болевой синдром за счет усиления эффектов различных лекарственных препаратов, что в большинстве случаев ведет к снижению частоты назначении и/или доз опиоидных анальгетиков. Таким образом, MMA снижает профиль риска каждого лекарства, обеспечивая при этом синергетический контроль боли с помощью различных классов лекарств.
Послеоперационная ММА может включать психотерапию, физиотерапию, НПВП, парацетамол**, габапентиноиды (АТХ код группы N02BF), регионарную анестезию (однократное введение или установка катетеров для периферических нервов), местные инъекции и опиоиды [181, 196].
В современной научной литературе авторы акцентируют внимание на использовании самых низких эффективных доз опиоидов в течение, как можно более короткого периода времени, не используют опиоиды с пролонгированным высвобождением. В качестве адъюванта на фоне проведения ММА для взрослых пациентов можно использовать однократное введение #дексаметазона** 1,25-20 мг в/в перед оперативным вмешательством (за 60 мин до разреза), который дает значимое снижение болевого синдрома [180].
Необходимо помнить об ограниченной двумя сутками длительности применения парентерального введения большинства НПВП из группы АТХ M01A «нестероидные противовоспалительные и противоревматические препараты» (кеторолак**, кетопрофен**, диклофенак**) в соответствии с инструкциями по медицинскому применению, что требует своевременного перевода пациента на пероральный прием препаратов или смены препарата или согласования дальнейшего применения с врачебной комиссией.
Конкретный выбор способа местной анестезии и лекарственных средств осуществляет лечащий врач индивидуально в соответствии с особенностями пациента, локальными протоколами и оснащением медицинской организации.
При назначении обезболивающей терапии детям следует выбирать разовую дозу с учетом веса и возраста ребенка. Предпочтение следует отдавать анальгетикам с пероральным или ректальным путем введения, избегать внутримышечных инъекций.
- Рекомендуется выполнение местной блокады или регионарной анестезии, как части послеоперационного мультимодального режима [181, 197].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Рекомендуемые анальгетики из группы N02 Анальгетики приведены в Приложениях А3.3 и А3.4.
3.3.4 Послеоперационное ведение пациентов с НМБ
- Рекомендуется:
– Наблюдение в ОРИТ в послеоперационном периоде все пациенты с НМБ независимо от объема хирургического вмешательства и длительности анестезии [104].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарии: перевод в ОРИТ после операции должен рассматриваться у любого пациента с риском респираторных осложнений. Возможности ОРИТ позволяют обеспечить полноценный сердечно-сосудистый и респираторный мониторинг, проводить многокомпонентную терапию, включая НВЛ, применение устройств для облегчения откашливания или аспирации секрета дыхательных путей.
- – Адекватное обезболивание – важнейший компонент лечения пациентов с НМБ в послеоперационном периоде. Глубина обезболивания должна быть подобрана с учетом минимизации торможения дыхательных центров. Опиоидные анальгетики несут дополнительный риск развития угнетения дыхания. Безопасный и эффективный метод обезболивания в таком случае – эпидуральная анестезия в структуре мультимодальной анестезии [105, 178, 179, 202].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарии: своевременное предупреждение и купирование болевого синдрома предупреждает развитие вторичной гиповентиляции вследствие ригидности мышц после торакальных операций, операций на верхнем этаже брюшной полости или позвоночнике. Доза вводимых опиоидов должна обеспечивать адекватную анальгезию, но при этом не угнетать кашлевой рефлекс и самостоятельное дыхание.
- – С целью адекватного обезболивания пациентам со деформациями позвоночника после оперативного лечения рекомендуется использовать мультимодальную анальгезию, которая может включать нестероидные противовоспалительные и противоревматические препараты (АТХ код группы: M01A), парацетамол**, габапентиноиды (АТХ код группы: N02BF) и опиоиды немедленного высвобождения с учетом возрастных ограничений в инструкциях по медицинскому применению, при невозможности её назначения – мономодальную [180, 181, 182].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: необходимо обеспечить полноценное обезболивание пациенту до выполнения любых манипуляций и на весь период лечения, продолжительность которого существенно варьируется в зависимости от выбранной тактики ведения пациента. При проведении обезболивания в стационаре необходимо учесть назначения, выполненные на этапе оказания неотложной медицинской помощи.
– Из фармакологических стратегий в настоящее время общепринятым является применение мультимодальной анальгезии (ММА), представляющей собой использование нескольких анальгетических препаратов (опиоидных и неопиоидных) с разным механизмом действия и нефармакологических вмешательств, направленных на воздействие на периферические и/или центральные участки нервной системы [183]. Такое сочетание позволяет более эффективно купировать болевой синдром за счет усиления эффектов различных лекарственных препаратов, что в большинстве случаев ведет к снижению частоты назначении и/или доз опиоидных анальгетиков. Таким образом, MMA снижает профиль риска каждого лекарства, обеспечивая при этом синергетический контроль боли с помощью различных классов лекарств. Послеоперационная ММА может включать психотерапию, физиотерапию, НПВП, парацетамол**, габапентиноиды, регионарную анестезию (однократное введение или установка катетеров для периферических нервов), местные инъекции и опиоиды [184].
– При назначении обезболивающей терапии детям следует выбирать разовую дозу с учетом веса и возраста ребенка. Предпочтение следует отдавать анальгетикам с пероральным или ректальным путем введения, избегать внутримышечных инъекций. При выборе анальгетиков для ММА следует учитывать, что периоперационное применение #прегабалина 2 мг\кг дважды в сутки** у детей при заднем инструментальном спондилодезе не снижает потребление опиодов в послеоперационном периоде [185].
3.3.5 Профилактика венозных тромбоэмболических осложнений
- Рекомендовано всем взрослым пациентам рассмотреть возможность назначения фармакологической профилактики ВТЭО низкомолекулярными гепаринами из группы гепарина (АТХ код B01AB) при плановых операциях на позвоночнике в случаях, когда риск ВТЭО превышает риск кровотечения, с учетом индивидуальных особенностей пациента и хирургических факторов (большая длительная операция, операция с комбинированным переднезадним доступом), а также в соответствии с клинической оценкой, проводимой лечащим врачом [186, 187, 196].
Уровень убедительности рекомендации В (уровень достоверности доказательств – 2)
Комментарии: для оценки индивидуального риска развития ВТЭО целесообразно использовать шкалу Каприни (Приложение Г9).
- Взрослым пациентам с высоким риском кровотечения рекомендуется до операции применять механическую тромбопрофилактику, а первое введение низкомолекулярного гепарина из группы гепарина (АТХ код B01AB) отложить до достижения гемостаза (12–24 ч. после операции [194, 195, 188].
Уровень убедительности рекомендации С (уровень достоверности доказательств – 5).
- В случае поступления пациента с ограничением двигательной активности, в том числе по поводу геми- и тетрапареза/-паралича рекомендовано начать фармакологическую профилактику ВТЭО в дооперационном периоде [189].
Уровень убедительности рекомендации С (уровень достоверности доказательств – 5)
- При проведении фармакопрофилактики ВТЭО у детей рекомендуется рассмотреть возможность применения #эноксапарина натрия** (при возрасте менее 2 мес: 0,75 мг/кг каждые 12 ч, старше 2 мес: 0,5 мг/кг каждые 12 ч) или гепарина натрия** [191, 184].
Уровень убедительности рекомендации С (уровень достоверности доказательств – 5)
Комментарии: В педиатрической практике не существует стандартизированного и валидированного инструмента оценки риска тромбопрофилактики [190].
- Детям рекомендуется выполнение механической профилактики тромбоэмболических осложнений [204].
Уровень убедительности рекомендации С (уровень достоверности доказательств – 5)
- Рекомендуется использование протоколов отлучения от респиратора и экстубации трахеи в отделениях реанимации и интенсивной терапии для критических пациентов с обязательным контролем СО2. Возможна необходимость продолжительной ИВЛ после операции, а в некоторых обстоятельствах вероятность наложения трахеостомы. Экстубация и переход к НИВЛ всегда должны планироваться как промежуточный этап для возвращения к дооперационной системе дыхательной поддержки. Ателектаз, гиповентиляция и застой бронхолегочного секрета могут стать причинами гипоксемии. Дополнительную оксигенацию необходимо проводить с осторожностью: следует иметь в виду, что можно пропустить гиперкапнию и, соответственно, позже начать лечение ее причин. Кислород не использовать без НИВЛ и только под контролем КЩС. [36, 39, 106, 107, 108].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4).
Комментарии: экстубацию трахеи у пациентов с НМБ рекомендуется выполнять при полном контроле над бронхиальной секрецией и достижением нормальных или пограничных значений SpO2 на атмосферном воздухе или на фоне НИВЛ. При высоком риске респираторных осложнений применение протокола, основанного на комбинации неинвазивной легочной вентиляции с методами активного стимуляции кашля.
- Рекомендуется: пациентам после оперативной коррекции деформации позвоночника в ранний период (1 и 2 этапы) реабилитации рассмотреть возможность ранней экстубации и дыхательной поддержки аппаратом неинвазивной искусственной вентиляции легких (НИВЛ) или аппаратом ИВЛ в режиме CPAP-терапии (Continuous Positive Airway Pressure – метод коррекции остановок дыхания во сне, заключающийся в создании постоянного положительного давления в дыхательных путях) [93-108, 112-114].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 3).
Комментарии: CPAP-терапия (Continuous Positive Airway Pressure) – метод коррекции остановок дыхания во сне, заключающийся в создании постоянного положительного давления в дыхательных путях).
- Рекомендуется лежачим пациентам со СМА 5q, МДД, миопатиями и миодистрофиями с респираторными нарушениями после оперативной коррекции деформации позвоночника в раннем периоде реабилитации (1 и 2 этапы) использовать механический инсуффлятор-аспиратор для профилактики легочных осложнений и гиповентиляции [39, 111-114].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
- Рекомендуется пациентам после оперативной коррекции деформации позвоночника в ранний период реабилитации (1 и 2 этапы) оценить эффективность обезболивания [110, 112, 113].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарии: рекомендуется у детей старше 1 года использовать эпидуральную анестезию раствором ропивакаина гидрохлорида** Раствор для инъекций 2 мг/1 мл с введением через инфузомат (Насос инфузионный) (консенсус авторов КР). Основные аспекты периоперационного ведения пациентов с нервно-мышечными заболеваниями детально изложены в проекте клинических рекомендаций Общероссийской общественной организации «Федерация анестезиологов и реаниматологов» России «Периоперационное ведение пациентов с нервно-мышечными заболеваниями (проект)» и в Приложении Б2 [176].
- Рекомендуется: пациентам после оперативной коррекции деформации позвоночника в ранний период (1 и 2 этапы) реабилитации выполнять раннюю вертикализацию в положении сидя [95, 96, 113].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
- Рекомендуется: пациентам после оперативной коррекции деформации позвоночника в ранний период (1 и 2 этапы) реабилитации выполнить КТ грудного и поясничного отделов позвоночника и грудной клетки с целью контроль положения имплантов и оценки состояния легких [95, 96].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
- Рекомендуется: пациентам с противопоказаниями к ортезированию и оперативной коррекции деформации позвоночника рассмотреть подбор индивидуальных кресел-колясок модульного типа в концепции постурального менеджмента [95, 96, 111, 118, 119].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарии: в качестве альтернативы индивидуальным креслам-коляскам модульного типа могут применяться индивидуально изготовленные ложементы с возможностью крепления к колесной базе.
4. Медицинская реабилитация и санаторно-курортное лечение, медицинские показания и противопоказания к применению методов медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов
- Пациентам с нервно-мышечным сколиозом рекомендован комплекс методик по медицинской реабилитации пациента с заболеванием опорно-двигательной системы, направленный на улучшение двигательных функций (в особенности поддержания положения туловища и передвижения в инвалидной коляске), улучшение дыхательной функции и толерантности к физической нагрузке, профилактику боли, вызванной спастичностью и/или соприкосновением ребер с гребнем подвздошной кости, улучшение самообслуживания и других повседневных жизненных функций [121, 122].
Уровень убедительности рекомендации С (уровень достоверности доказательств – 5).
- Рекомендовано с целью улучшения жизнедеятельности всем пациентам с нервно-мышечным сколиозом при консервативном и (или) оперативном лечении проведение медицинской реабилитации на всех её этапах, включающей физические упражнения [49, 123-125]
Уровень убедительности рекомендации В (уровень достоверности доказательств – 1),
корсетирование (только при консервативном лечении) [32, 47, 48, 49, 53, 56, 57].
Уровень убедительности рекомендации С (уровень достоверности доказательств – 4)
(см. раздел "Консервативное лечение"), гидрокинезотерапию, массаж, физиотерапию и рефлексотерапию [49, 131].
Уровень убедительности рекомендации С (уровень достоверности доказательств – 5)
Комментарии: Корсетирование рекомендуется только при отсутствии показаний к хирургическому лечению и/или при наличии ограничений к хирургической коррекции сколиоза у детей: ИМТ <12; остеопения (Z-критерий <-3 SD) (см. раздел "Консервативное лечение") [52, 53, 48, 56, 51, 55]. Не рекомендуется корсетирование у пациентов, перенесших хирургическую коррекцию по поводу нервно-мышечного сколиоза. При современных методах лечения применение корсетов является избыточным и может отрицательно дыхательной функции, особенно в раннем послеоперационном периоде [122].
- Рекомендован осмотр врача физической и реабилитационной медицины (ФРМ) всем пациентам с нервно-мышечным сколиозом при консервативном и (или) оперативном лечении проведение медицинской реабилитации на всех её этапах [32, 53, 47, 48, 49, 56, 57].
Уровень убедительности рекомендации С (уровень достоверности доказательств – 5).
- Рекомендовано привлечение cпециалиста по эргореабилитации (эргоспециалист) при проведение медицинской реабилитации на всех её этапах, для согласования комплекса физические упражнения, использования ТСР [32, 53, 47, 48, 49, 56, 57, 171, 172] с целью улучшения жизнедеятельности.
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
- Рекомендовано всем пациентам с нервно-мышечным сколиозом при проведении реабилитационных мероприятий формулировать реабилитационный диагноз на основе Международной классификации функционирования, ограничений жизнедеятельности и здоровья (МКФ) c целью оптимизации программы реабилитации и повышения эффективности медицинской реабилитации [143-147].
Уровень убедительности рекомендации С (уровень достоверности доказательств – 5).
Комментарий: постановка реабилитационного диагноза с помощью МКФ занимает центральное место при планировании реабилитации [135-139].
- Рекомендовано всем пациентам с нервно-мышечным сколиозом проводить мероприятия по медицинской реабилитации с участием специалистов мультидисциплинарной реабилитационной команды специалистов (МДРК) с целью улучшения активности и участия и качества жизни в целом [122, 140-144].
Уровень убедительности рекомендации С (уровень достоверности доказательств – 3).
- Корсетирование рекомендуется только при отсутствии показаний к хирургическому лечению и/или при наличии ограничений к хирургической коррекции сколиоза у детей: ИМТ <12; остеопения (Z-критерий <-3 SD) (см. раздел "Консервативное лечение") [52, 53, 48, 56, 51, 55].
Уровень убедительности рекомендации С (уровень достоверности доказательств – 4).
- Не рекомендуется корсетирование у пациентов, перенесших хирургическую коррекцию по поводу нервно-мышечного сколиоза [122].
Уровень убедительности рекомендации С (уровень достоверности доказательств – 5).
Комментарии: при современных методах лечения применение корсетов является избыточным и может отрицательно дыхательной функции, особенно в раннем послеоперационном периоде [122].
- Рекомендуется всем пациентам с нервно-мышечным сколиозом во время корригирующего лечения корсетами на всех этапах медицинской реабилитации продолжать занятия физическими упражнениями с целью улучшения функционального состояния мышц и психологического состояния [122, 125, 51, 145-147].
Уровень убедительности рекомендации В (уровень достоверности доказательств – 2).
- Рекомендуется всем пациентам с нервно-мышечным сколиозом при консервативном лечении и в послеоперационном периоде на всех этапах медицинской реабилитации проведение физической реабилитации, включающей выполнение регулярных физических упражнений [125, 145, 146, 148, 149], занятия физическими упражнениями по методике К. Шрот [123] в комбинации с упражнениями на стабилизацию позвоночника [123] с целью профилактики прогрессирования сколиоза, улучшения показателей активности и участия и качества жизни [123].
Уровень убедительности рекомендации С (уровень достоверности доказательств – 5).
Комментарии: Физические упражнения полезны для поддержания и улучшения переносимости физической нагрузки у пациентов с нервно-мышечными расстройствами. Физические упражнения включают в себя упражнения для сердечно–сосудистой системы, которые могут повысить выносливость и ограничить вероятность сердечно-легочных осложнений [145]. Упражнения для тренировки и укрепления мышц, участвующих в поддержании равновесия туловища и манипуляциях верхними конечностями, также приводят к заметному улучшению переносимости физической нагрузки и функциональной независимости у некоторых пациентов с нервно-мышечными заболеваниями [147, 150, 151]. Физическая реабилитация не оказывает достоверного влияния на прогрессирование деформации позвоночника у пациентов с нервно-мышечными заболеваниями, однако эффективно в улучшении или поддержании активного функционирования. Поэтому в период нехирургического лечения важно постоянное наблюдение и оценка прогрессирующей деформации позвоночника [125].
- Рекомендуется всем пациентам с нервно-мышечным сколиозом, нуждающихся в инвалидной коляске, использование приспособлений для сидения в инвалидной коляске с целью предупреждения усиления деформации позвоночника, профилактики пролежней, улучшения поддержки туловища и функциональной активности [122, 139, 149, 58].
Уровень убедительности рекомендации С (уровень достоверности доказательств – 5).
Комментарии: использование приспособлений для сидения в инвалидной коляске могут быть эффективны в профилактике прогрессирования сколиоза, предотвращения формирования пролежней и для повышения комфорта пребывания в положении сидя [122, 58]. Приспособления для инвалидного кресла могут включать различные вставки, боковые опоры для грудной клетки, плечевые или поясные ремни безопасности, опоры для ног и шеи, а также подкладки между бедрами [122]. Исследование Holmes K.J. и соавт. [58] показало, что размещение 3-точечной системы боковых поддерживающих подушек обеспечивало более симметричное положение туловища и снижение выраженности деформации позвоночника у пациентов с ЦП.
- Рекомендуется всем пациентам, перенесшим хирургическую коррекцию по поводу нервно-мышечного сколиоза, передвижение в инвалидной коляске со 2-5-го дня после оперативного вмешательства [2, 36, 37].
Уровень убедительности рекомендации С (уровень достоверности доказательств – 5).
Комментарии: из-за изменения положения сидя инвалидная коляска нуждается в адаптации. Следует позаботиться о том, чтобы процедуры по реализации адаптации инвалидной кресла-коляски были начаты своевременно под контролем cпециалиста по эргореабилитации (эргоспециалиста). Кресло-коляска должна быть адаптировано таким образом, чтобы обеспечить максимальный комфорт и равновесие туловища и головы в положении сидя [122].
- Рекомендуется всем пациентам, перенесшим хирургическую коррекцию по поводу нервно-мышечного сколиоза, проводить профилактику инфекций дыхательных путей и пролежней, уход за ранами, нутритивную поддержку и симптоматическую обезболивающую терапию [122, 153, 154].
Уровень убедительности рекомендации С (уровень достоверности доказательств – 5).
- Рекомендуется всем пациентам, перенесшим хирургическую коррекцию по поводу нервно-мышечного сколиоза, избегать в раннем, позднем и отдаленном послеоперационном периодах в срок до 9 месяцев на всех этапах медицинской реабилитации избегать наклоны и скручивание туловища, сгибание бедра более чем на 90° [122].
Уровень убедительности рекомендации С (уровень достоверности доказательств – 5).
Комментарии: в связи с тем, что процесс заживления костного сращения после операции занимает от 3 до 9 месяцев, в этот период не допускаются наклоны и скручивание туловища, сгибание бедра более чем на 90° [122].
- Рекомендуется в раннем послеоперационном периоде всем пациентам, перенесшим хирургическую коррекцию по поводу нервно-мышечного сколиоза, использование вертикализатора наклонного [122].
Уровень убедительности рекомендации С (уровень достоверности доказательств – 5).
- Рекомендуется перед выпиской из хирургического стационара предоставить всем пациентам, перенесшим хирургическую коррекцию по поводу нервно-мышечного сколиоза, инструкции по переходу из положения лежа в положение сидя и по пребыванию в положении сидя [122].
Уровень убедительности рекомендации С (уровень достоверности доказательств – 5).
- Рекомендуется всем пациентам, перенесшим хирургическую коррекцию по поводу нервно-мышечного сколиоза и нуждающихся в медицинской реабилитации в условиях дневного стационара или амбулаторно, при наличии факторов, ограничивающих возможности пациента получить такую медицинскую реабилитацию (включая случаи проживания пациента в отдаленном от медицинской организации населенном пункте, ограничения в передвижении пациента), организация прохождения медицинской реабилитации на дому, в том числе с использованием телемедицинских информационно-коммуникационных систем [122].
Уровень убедительности рекомендации С (уровень достоверности доказательств – 5).
Комментарии: медицинскую реабилитацию на дому организует медицинская организация, к которой прикреплен пациент для получения первичной медико-санитарной помощи.
На период проведения медицинской реабилитации в домашних условиях могут быть предоставлены видеоролики с демонстрацией корректного выполнения физических упражнений дома [122].
- Рекомендуется всем старше 2 лет пациентам с нервно-мышечным сколиозом при наличии спастичности применение ботулинического токсина типа A** [121, 155-157] (см. раздел "Консервативное лечение").
Уровень убедительности рекомендации С (уровень достоверности доказательств – 5).
Комментарии: данные об эффективности ботулинического токсина типа А неоднозначные. Nuzzo RM. и соавт. [155] сообщили, что инъекция ботулинического токсина типа A** у пациентов нервно-мышечным сколиозом при ЦП, которые нуждались в отсрочке операции, повысила эффективность дальнейшего хирургического лечения и остановила прогрессирование сколиоза. Kotwicki T. и соавт. [121] отметили эффективность ботулинического токсина типа А** для снижения выраженности болевого синдрома, развивающегося вследствие спастичности.
Напротив, в проспективном рандомизированном тройном слепом исследовании не было показано эффективности ботулинического токсина типа А** в снижении радиологических и клинических проявлений сколиоза у детей с ЦП, за исключением первоначальной субъективной, но положительной оценки эффекта родителями пациентов [158]. Su YC и соавт. [159] в систематическом обзоре с применением мета-анализа не смогли сделать однозначный вывод касательно эффективности применения ботулинического токсина типа А** у пациентов с нервно-мышечным сколиозом из-за высокой неоднородности результатов между исследованиями и небольшого размера выборки. Для изучения эффективности ботулинического токсина типа А** при лечении сколиоза следует провести больше рандомизированных контролируемых исследований с соответствующим выбором мышц-мишеней и стандартизированной оценкой результатов [159].
- Рекомендуется всем пациентам с нервно-мышечным сколиозом на всех этапах медицинской реабилитации проведение физиотерапии при отсутствии противопоказаний. В некоторых исследованиях отмечена эффективность электростимуляции, магнитотерапии, низкочастотного электростатического поля и диадинамической электронейростимуляции при нервно-мышечном сколиозе [160-163].
Уровень убедительности рекомендации С (уровень достоверности доказательств – 5).
- Рекомендовано всем пациентам с нервно-мышечным сколиозом на втором и третьем этапах медицинской реабилитации проведение гидрокинезотерапии с целью улучшения показателей активности и участия, дыхательной функции и качества жизни [161, 164-169].
Уровень убедительности рекомендации С (уровень достоверности доказательств – 5).
Комментарии: в некоторых исследованиях рекомендуется проводить гидрокинезотетарию, включающую различные виды упражнений, аэробику (растяжку, силовые упражнения и тренировку устойчивости), в теплой (выше 30 °C) мелкой воде (по грудь) [165, 166].
- Рекомендуется всем пациентам с нервно-мышечным сколиозом на втором и третьем этапах медицинской реабилитации использование мануальной терапии с целью снижения выраженности сколиоза и болевого синдрома [161, 168, 169].
Уровень убедительности рекомендации С (уровень достоверности доказательств – 5).
Комментарии: в исследовании Шаймурзина М.Р. и соавт. [168] показана эффективность мануальной терапии (приемы мобилизации и постизометрической релаксации) в замедлении прогрессирования двигательных нарушений и степени тяжести сколиотической деформации позвоночника у детей со СМА.
- Рекомендуется всем пациентам с нервно-мышечным сколиозом на всех этапах медицинской реабилитации проведение массажа при заболеваниях позвоночника, массажа воротниковой области, сегментарного массажа шейно-грудного отдела позвоночника и пояснично-крестцового отдела позвоночника с целью предупреждения прогрессирования деформации позвоночника и улучшения качества жизни [161, 170].
Для детей – Уровень убедительности рекомендации С (уровень достоверности доказательств – 5)
Для взрослых – Уровень убедительности рекомендации В (уровень достоверности доказательств – 3)
- Рекомендуется всем пациентам с нервно-мышечным сколиозом на всех этапах медицинской реабилитации проведение психологического консультирования, психопрофилактики и, при необходимости, психокоррекции [171].
Уровень убедительности рекомендации С (уровень достоверности доказательств – 4).
- Рекомендуется пациентам детского возраста рефлексотерапия при нервно-мышечном сколиозе с целью улучшения функциональной активности и предупреждения прогрессирования сколиоза [173, 174]. У взрослых отсутствует доказательной база по использованию данного метода лечения.
Уровень убедительности рекомендации В (уровень достоверности доказательств – 1).
Комментарии: по данным мета-анализа рандомизированных контролируемых исследований по оценке эффективности иглорефлексотерапии у пациентов с ЦП иглоукалывание в сочетании с физической реабилитацией положительно влияло на крупную моторику, снижала выраженность спастичности и улучшало повседневную активность [174].
- Санаторно-курортное лечение рекомендуется пациентам детского возраста с нервно-мышечным сколиозом и может включать физические упражнения, массаж, бальнеотерапию, различные методы физиотерапии [161, 175].
Уровень убедительности рекомендации С (уровень достоверности доказательств – 4).
5. Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
- Всем пациентам с ортопедической патологией при НМБ рекомендовано диспансерного наблюдение врача-травматолога-ортопеда [32].
Уровень убедительности рекомендации С (уровень достоверности доказательств – 5).
Методами профилактики развития нервно-мышечного сколиоза использование ортезной/корсетной терапии и технических средств реабилитации (ТСР), информация контингентов групп риска (пациенты с НМБ) о мерах профилактики вторичных ортопедических осложнений.
Период диспансерного наблюдения пациентов с ортопедическими осложнениями НМБ является бессрочным. Основные методы контроля – клинический осмотр, лабораторные и лучевые исследования. Критерием эффективного лечения нервно-мышечного сколиоза являются улучшение клинических и лучевых проявлений заболевания. Лучевые проявления контроля деформации при консервативном лечении – отсутствие прогрессирования деформации в пределах 20° по Cobb, отсутствие нарастания перекоса таза, улучшение костной плотности по данным рентгеновской денситометрии, чаще – проявляются через 6-8 месяцев от начала лечения. Для больных, перенесших хирургическое лечение, лучевыми признаками эффективности является сохранение коррекции деформации, отсутствие признаков прогрессирования деформации позвоночника и нестабильности металлоконструкции, отсутствие периимплантной резорбции и наличие признаков формирование блока костных структур – позвонков, в зоне фиксации.
В первые 6 месяцев после операции пациенты осматриваются врачом-травматологом-ортопедом и врачом-неврологом 1 раз в 3 мес. При отсутствии клинических и лучевых признаков прогрессирования или осложнений заболевания рентгенография грудного и поясничного отделов позвоночника проводится через 3 и 6 месяцев, КТ позвоночника – через 12 месяцев.
Контрольные МРТ или дополнительно КТ проводят у больных с признаками неврологических нарушений, при сохранении клинической активности, а также для решения вопроса последующей таргетной терапии с возможностью интратекального доступа.
При наличии осложнений пациент продолжает наблюдение/лечение у профильных специалистов:
– у врача-травматолога-ортопеда, врача-хирурга, врача-нейрохирурга – при наличии свищей, нестабильности и деформации позвоночника. При возможности ликвидации указанных осложнений проводят хирургическое лечение в специализированных отделениях/центрах хирургии позвоночника по согласованию с пациентом и информированием его о соответствующих операционных рисках;
– у врача-невролога, врача-уролога, врача по медицинской реабилитации – при проявлениях миело-/радикулопатии;
– у врача-эндокринолога – при наличии остеопороза;
– у врача-хирурга, врача-пластического хирурга, социальных работников – при необратимых неврологических и нейротрофических нарушениях.
Больные с НМБ находятся на диспансерном учете (ДУ) у врача-невролога и врача-травматолога-ортопеда на протяжении трех лет после операции.
6. Организация оказания медицинской помощи
Хирургическая помощь больным с нервно-мышечным сколиозом оказывается в рамках высокотехнологической медицинской помощи в стационарных условиях. Консервативное лечение, в зависимости от выраженности клинических проявлений и сложности изделий, может проводиться как в амбулаторном режиме, так и в специализированном (неврологический или реабилитационный профиль коек) стационаре.
Показаниями для госпитализации в медицинскую организацию являются:
- наличие показаний для хирургического лечения НМС;
- развитие неврологических осложнений НМС;
- не купируемый консервативными методами вертеброгенный болевой синдром;
- развитие нестабильности металлоконструкции позвоночника с риском повреждения мягких тканей, в т.ч. сопровождающееся болевым синдромом и деформацией позвоночника, ухудшающей качество жизни пациента;
- хронически (более 3 месяцев) функционирующий свищ.
Показаниями к выписке пациента из медицинского стационара является:
- рентгенологическая картина сохранения коррекции НМС;
- отсутствие признаков и нестабильности металлоконструкции;
- нормализация общих лабораторных показателей – Hb, СОЭ, лейкоцитарной формулы;
- отсутствие признаков инфекционно-воспалительных изменений в зоне хирургического вмешательства;
- купирование вертеброгенного болевого синдрома до значений, не требующих назначения инъекционных обезболивающих препаратов или субъективно оцениваемых пациентом не более, чем в 3 балла ВАШ.
Дальнейшее лечение пациента с купированием или улучшением клинических проявлений основного заболевания может быть продолжено, с учетом показаний, в стационарном или амбулаторном режиме, в т.ч. в профильных (неврологическом, реабилитационных) отделениях/центрах, под наблюдением хирурга и/или травматолога-ортопеда.
7. Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния)
Пациент-ориентированные факторы, оказывающие негативное влияние на результаты лечения:
- соматическое состояние больного, в т.ч. наличие острых и хронических заболеваний – ожирение, дыхательная недостаточность; сопутствующие хронические воспалительные заболевания мочевыделительной и дыхательной систем, полости рта, кожи и подкожно-жировой клетчатки; заболевания, сопровождающиеся нейротрофическими нарушениям;
- остеопороз;
- иммунодефицитные состояния, в т.ч. вызванных предшествовавшей терапией (глюкокортикоиды, иммуносупрессия).
Заболевание-ориентированные факторы, оказывающие неблагоприятное влияние на исход заболевания:
- неблагоприятное течение основного заболевания с прогрессированием поражения мышц;
- развитие вторичных деформаций грудной клетки.
Потенциально неблагоприятные факторы, связанные с лечением заболевания.
- при консервативном лечении – развитие тяжелых нейротрофических проявлений мягких тканей;
- при хирургическом лечении – нестабильная инструментальная фиксация и раневая инфекция.
Критерии оценки качества медицинской помощи
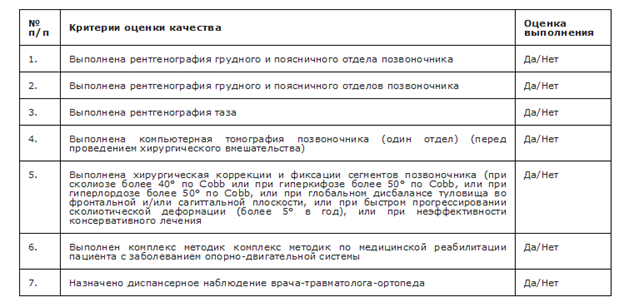
Список литературы
- Brzustowicz L.M., Lehner T., Castilla L.H. et al. Genetic mapping of chronic childhood-onset spinal muscular atrophy to chromosome 5q11.2 – q13.3. Nature. 1990; 344: 540-541.
- Бакланов А.Н., Колесов С.В., Шавырин И.А. Хирургическое лечение тяжелых нейромышечных сколиозов у пациентов, страдающих спинальной мышечной атрофией. Хирургия позвоночника. 2011; (3): 31-37.
- Lonstein J. Neuromuscular spinal deformity // Weinstein S. The Pediatric Spine — Principles and Practice. Philadelphia: Lippincott Williams&Wilkins), 2001: 789-796.
- Brown J., Zeller J., Swank S. Surgical and functional results of spine fusion in spinal muscular atrophy. Spine. 1988; 14: 763-770.
- Granata C., Merlini L., Cervellati S. Long term results of spine surgery in Duchenne muscular dystrophy. Neuromuscul. Disord. 1996; 6: 61-68.
- Кушель Ю.В. Роль ламинотомии и ламинопластики вснижении частоты послеоперационных кифосколиозов у детей, оперированных по поводу интрамедуллярных опухолей. Вопр. нейрохирургии. 2007; (4): 20-34.
- Колесов С.В. Хирургическое лечение тяжелых постламинэктомических деформаций позвоночника. Хирургия позвоночника. 2006; (2): 29-32.
- Мельников И. И. Ортопедическая коррекция вторичных деформаций позвоночника у детей и подростков: Канд. дисс. / Мельников Илья Ильич. — М., 2011. — 124 с.
- Ouellet J. A., Arlet V. Neuromuscular scoliosis. Spinal Disorders. – Springer, Berlin, Heidelberg, 2008: 663-692.
- Madigan R.R., Wallace S.L. Scoliosis in the institutionalized cerebral palsy population. Spine. 1981; 6 (6): 583-590.
- Majd M. E., Muldowny D. S., Holt R. T. Natural history of scoliosis in the institutionalized adult cerebral palsy population. Spine. 1997; 22 (13): 1461-1466.
- McCarthy R. E. Management of neuromuscular scoliosis. Orthop. Clin. North Amer. 1999. 30 (3): 435-449.
- Mercuri E., Finkel R.S., Muntoni F. et al; SMA Care Group. Diagnosis and management of spinal muscular atrophy: Part 1: Recommendations for diagnosis, rehabilitation, orthopedic and nutritional care. Neuromuscul Disord. 2018; 28(2): 103-115.
- Ogino S., Leonard D.G., Rennert H. et al. Genetic risk assessment in carrier testing for spinal muscular atrophy. Am J Med Genet. 2002; 110 P: 301-07.
- Prior T.W., Snyder P.J., Rink B.D. et al.: Newborn and carrier screening for spinal muscular atrophy. Am J Med Genet A. 2010; 152A: 1605-1607.
- Zabnenkova V.V., Dadali E.L., Spiridonova M.G., et al. Spinal muscular atrophy carrier frequency in Russian Federation. ASHG 2016; 2476W.
- Mercuri E, Bertini E, Iannaccone ST. Childhood spinal muscular atrophy: controversies and challenges. Lancet Neurol. 2012; 11(5): 443–52.
- Lunn MR, Wang CH. Spinal muscular atrophy. Lancet 2008; 371(9630): 2120–33.-4C.
- Jones-Quaidoo SM., Yang S, Arlet V. Surgical management of spinal deformities in cerebral palsy: A review. J. Neurosurg. Spine. 2010; 13(6): 672-685.
- Persson-Bunke M, Hägglund G, Lauge-Pedersen H, Wagner P, Westbom L (2012) Scoliosis in a total population of children with cerebral palsy. Spine. 37(12): E708-E713.
- Beckmann K, Lange T, Gosheger G, et al. Surgical correction of scoliosis in patients with severe cerebral palsy. Eur. Spine J. 2016; 25 (2): 506-516.
- Yazici M, Senaran H. Cerebral palsy and spinal deformities. Acta Orthop. Traumatol. Turc. 2009; 43 (2): 149-155.
- Hagglund G., Pettersson K., Czuba T. et al. Incidence of scoliosis in cerebral palsy. Acta Orthop. J. 2018; 89: 443–447.
- Gu Y, Shelton JE, Ketchum JM, et al. Natural history of scoliosis in non-ambulatory spastic tetraplegic cerebral palsy. PM R. 2011; 3(1): 27-32.
- Milbrandt T., Kunes J., Karol L. Friedreich’s ataxia and scoliosis: the experience at two institutions. J. Pediatr. Orthop. 2008; 28(2): 234-238.
- Sussman M. Duchenne muscular dystrophy. J Am Acad. Orthop. Surg. 2002; 10: 138–51.
- Smith AD, Koreska J, Moseley CF. Progression of scoliosis in Duchenne muscular dystrophy. J. Bone Joint Surg. Am. 1989; 71: 1066–74.
- Alman BA, Raza SN, Biggar WD. Steroid treatment and the development of scoliosis in males with Duchenne muscular dystrophy. J. Bone Joint Surg Am. 2004; 86: 519–24.
- Yilmaz O, Karaduman, Topaloglu H. Prednisolone therapy in Duchenne muscular dystrophy prolongs ambulation and prevents scoliosis. Eur J. Neurol. 2004; 11: 541–44.
- Talim B, Malaguti C, Gnudi S, et al. Vertebral compression in Duchenne muscular dystrophy following deflazacort. Neuromuscul. Disord 2002; 12: 294–95.
- Bothwell JE, Gordon KE, Dooley JM, et al. Vertebral fractures in boys with Duchenne muscular dystrophy. Clin. Pediatr 2003; 42: 353–56.
- Михайловский М.В., Фомичев Н.Г. Хирургия деформаций позвоночника. – Новосибирск: Redactio, 2011. 592 с.
- Hart D, McDonald C Spinal deformity in progressive neuromuscular disease. Phys Med Rehab Clin North Am. 1998; 9 (1): :213-32.
- Strauss DJ, Shavelle RMLife expectancy of adults with cerebral palsy. Dev. Med Child Neurol. 1998; 40: 369–375.
- Racca F, Del Sorbo L, Mongini T, et al. Respiratory management of acute respiratory failure in neuromuscular diseases. Minerva Anestesiol 2010; 76: 51-62.
- Racca F, Mongini , Wolfler A, et al. Recommendations for anesthesia and perioperative management of patients with neuromuscular disorders. Minerva Anestesiol. 2013; 79 (4): 419-33.
- Bushby K., Finkel R., Birnkrant D.J. et al. Diagnosis and management of Duchenne muscular dystrophy, part 1: diagnosis, and pharmacological and psychosocial management. Lancet Neurol 2010; 9: 77-93.
- Vai S., Bianchi M.L., Moroni I. et al. Bone and Spinal Muscular Atrophy. Bone. 2015; 79: 116-20.
- Trucco F., Pedemonte M., Fiorillo C. et al. Detection of early nocturnal hypoventilation in neuromuscular disorders. J Int Med Res. 2018; 46(3): 1153-1161.
- Brogna C., Cristiano L., Verdolotti T. et al. MRI patterns of muscle involvement in type 2 and 3 spinal muscular atrophy patients. J Neurol. 2020; 267 (4): 898-912.
- Verrillo E., Pavone M., BruniO. Et al. Sleep architecture in children with spinal muscular atrophy type 2. Sleep Med. 2016; 20: 1-4.
- Racca F., Del Sorbo L., Mongini T. et al. Respiratory management of acute respiratory failure in neuromuscular diseases. Minerva Anestesiol. 2010; 76: 51-62.
- Richa FC. Anaesthetic management of a patient with limb-girdle muscular dystrophy for laparoscopic cholecystectomy. Eur. J.Anaesthesiol 2011; 28:72-3.
- Cardiovascular health supervision for individuals affected by Duchenne or Becker muscular dystrophy. Section on Cardiology and Cardiac Surgery. Pediatrics 2005;116;1569‐1573.
- Graham RJ, Athiraman U, Laubach AE, Sethna NF. Anesthesia and perioperative medical management of children with spinal muscular atrophy. Paediatr. Anaesth 2009;19:1054-63.
- Zalneraitis E.L., Halperin J.J., Grunnet M.L. et al. Muscle biopsy and the clinical course of infantile spinal muscular atrophy. J. Child Neurol. 1991; 6(4): 324-8.
- Fujak A., Kopschina C., Forst R. et al. Use of orthoses and orthopaedic technical devices in proximal spinal muscular atrophy. Results of survey in 194 CMA patients. Disabil. Rehabil. Assist Technol 2011; 6(4): 305–11.
- Catteruccia M., Vuillerot C., Vaugier I. et al. Orthopedic management of scoliosis by Garches Brace and spinal fusion in CMA type 2 children. J. Neuromusc. Dis 2015; 2(4): 453–62.
- Mercuri E. et al. Diagnosis and management of spinal muscular atrophy: Part 1: Recommendations for diagnosis, rehabilitation, orthopedic and nutritional care Neuromusc. Disord. 2018; 28 (2): 103-115.
- Mejabi J.O., Sergeenko O.M., Ryabykh S.O. Correction using Halo Gravity Traction for severe rigid neuromuscular scoliosis: a report of three cases. Malaysian Orthop. J. 2019; 13(1).
- Mesfin A, Sponseller PD, Leet AI. Spinal muscular atrophy: manifestations and management. JAmAcadOrthopSurg 2012;20(6): 393–401.
- Leopando M.T., Moussavi Z., Holbrow J. et al. Effect of a Soft Boston Orthosis on pulmonary mechanics in severe cerebral palsy. Pediatr. Pulmonol. 1999; 28: 53-58.
- Terjesen T., Lange J.E., Steen H. Treatment of scoliosis with spinal bracing in quadriplegic cerebral palsy. Developmental Med. Child Neurol. 2000; 42: 448-454.
- Miller A., Temple T. Miller F. Impact of orthoses on the rate of scoliosis progression in children with cerebral palsy. J. Pediat. Orthop. 1996; 16: 332-335.
- Olafsson Y., Saraste H., Al-Dabbagh Z. Brace treatment in neuromuscular spine deformity. J. Pediatr. Orthop. 1999; 19: 376–379.
- Nakamura N., Uesugi M., Inaba Y. et al. Use of dynamic spinal brace in the management of neuromuscular scoliosis: a preliminary report. J. Pediatr. Orthop. B. 2014; 23(3): 291-298.
- Pettersson K., Rodby-Bousquet E. Prevalence and goal attainment with spinal orthoses for children with cerebral palsy. J. Pediatr. Rehab. Med. 2019; 12(2): 197–203.
- Holmes K.J., Michael S.M., Thorpe S.L., Solomonidis S.E. Management of scoliosis with special seating for the non-ambulant spastic cerebral palsy population. A biomechanical study. Clin. Biomechanics. 2003; 18: 480-487.
- Nuzzo R.M., Walsh S., Boucherit T., Massood S. Counter paralysis for treatment of paralytic scoliosis with botulinum toxin type A. Amer. J. Orthop. 1997; 26:201-207.
- Yazici M., Senaran H. Cerebral palsy and spinal deformities. Acta Orthop. Traumatol. Turc. 2009; 43 (2): 149-155.
- Tsirikos A.I. Development and treatment of spinal deformity in patients with cerebral palsy. Indian J. Orthopaedics. 2010; 44 (2): 148.
- McCarthy J.J., D’Andrea L.P., Betz R.R., Clements D.H. Scoliosis in the child with cerebral palsy. J. Amer. Acad. Orthop. Surg. 2006; 14: 367–375.
- Lipton G.E., Miller F., Dabney K.W. et al. Factors predicting postoperative complications following spinal fusions in children with cerebral palsy. J. Spinal Disord. 1999; 12: 197–205.
- Hasler C.C. Operative treatment for spinal deformities in cerebral palsy. J. Children's orthop. 2013; 7(5): 419-423.
- Phillips D.P., Roye Jr D.P., Farcy J.P. et al. Surgical treatment of scoliosis in a spinal muscular atrophy population. Spine. 1990; 15(9): 942-945.
- Sussman M. Duchenne muscular dystrophy. J. Am. Acad. Orthop, Surg. 2002; 10: 138–51.
- Velasco MV, Colin AA, Zurakowski D, et al. Posterior spinal fusion for scoliosis in Duchenne muscular dystrophy diminishes the rate of respiratory decline. Spine 2007; 32: 459–65.
- Alman B.A., Kim H.K.W. Pelvic obliquity after fusion of the spine in Duchenne muscular dystrophy. J Bone Joint Surg Br. 1999; 81: 821– 24.
- Sengupta DK, Mehdian SH, McConnell JR, et al. Pelvic or lumbar fixation for the surgical management of scoliosis in Duchenne muscular dystrophy. Spine. 2002; 27: 2072–79.
- Bushby K., Finkel R., Birnkrant D. J. et al. Diagnosis and management of Duchenne muscular dystrophy, part 2: implementation of multidisciplinary care. Lancet Neurol. 2010; 9 (2): 177-189.
- Fujak A., Raab W., Schuh A. et al. Operative treatment of scoliosis in proximal spinal muscular atrophy: results of 41 patients. Arch. Orthop. Trauma Surg. 2012; 132 (12): 1697–706.
- Jones-Quaidoo S.M., Yang S., Arlet V. Surgical management of spinal deformities in cerebral palsy: A review. J. Neurosurg.: Spine. (2010) 13 (6): 672-685.
- SussmanM. Duchenne muscular dystrophy. J Am Acad. Orthop Surg. 2002; 10: 138–51
- Shapiro F., Sethna N., Colan S. et al. Spinal fusion in Duchenne muscular dystrophy: a multidisciplinary approach. Muscle Nerve. 1992; 15: 604–14.
- Heller KD, Wirtz DC, Siebert CH, Forst R. Spinal stabilization in Duchenne muscular dystrophy: principles of treatment and record of 31 operative treated cases. J. Pediatr. Orthop. 2001; 10: 18–24.
- Wang C.H., Finkel R.S., Bertini E.S. et al. Consensus statement for standard of care in spinal muscular atrophy. J. Child Neurol 2007;22(8):1027–49.
- Mesfin A., Sponseller P.D., Leet A.I. Spinal muscular atrophy: manifestations and management. J. Am Acad. Orthop. Surg. 2012; 20 (6): 393–401.
- Sponseller PD, Yang JS, Thompson GH. et al. Pelvic fixation of growing rods: comparison of constructs. Spine 2009; 34 (16): 1706–10.
- McElroy MJ, Shaner AC, Crawford TO, Thompson GH, Kadakia RV, Akbarnia BA, et al. Growing rods for scoliosis in spinal muscular atrophy: structural effects, complications, and hospital stays. Spine 2011;36(16):1305–11.
- Chandran S, McCarthy J, Noonan K, et al. Early treatment of scoliosis with growing rods in children with severe spinal muscular atrophy: a preliminary report. J Pediatr Orthop 2011; 31 (4): 450–4.
- Anari J.B., Spiegel D.A., Baldwin K.D. Neuromuscular scoliosis and pelvic fixation in 2015: where do we stand? World J. Orthop 2015; 6(8): 564–6.
- Odent T., Ilharreborde B., Miladi L. et al. Fusionless surgery in early-onset scoliosis. Orthop. Traumatol. Surg. Res. 2015; 101(6 Suppl.): S281–8.
- McElroy MJ. et al. Growing rods for the treatment of scoliosis in children with cerebral palsy: a critical assessment. Spine. 2012; 37(24): E1504-E1510.
- Livingston K., Zurakowski D., Snyder B., Growing Spine Study Group, Children’s Spine Study Group. Parasol rib deformity in hypotonic neuromuscular scoliosis: a new radiographical definition and a comparison of short-term treatment outcomes with VEPTR and growing rods. Spine 2015; 40(13): E780–6.
- Mercuri E. et al. Diagnosis and management of spinal muscular atrophy: Part 1: Recommendations for diagnosis, rehabilitation, orthopedic and nutritional care. Neuromusc. Disord. 2018; 28 (2): 103-115.
- Молотков Ю.В., Рябых С.О., Филатов Е.Ю. и др. Лечение сколиоза c ранним началом развития: систематизированный обзор литературы. Хирургия позвоночника. 2023. 20 (2): 6-20.
- Щурова Е.Н., Сайфутдинов М.С., Рябых С.О. Состояние температурно-болевой чувствительности – маркер уровня риска неврологических осложнений при хирургической коррекции тяжелых деформаций позвоночника. Ортопедия, травматол. Восстановит. хирургия детского возраста. 2017; 5 (4): 5-15.
- Рябых С.О., Савин Д.М., Сайфутдинов М.С. Формализация результатов интраоперационного нейрофизиологического контроля моторных путей спинного мозга при хирургической коррекции. Вестн. хирургии им. И.И. Грекова. 2018; 177 (1): 49-53.
- Сайфутдинов М.С., Рябых С.О. Нейрофизиологический контроль функционального состояния пирамидной системы в процессе лечения больных с деформацией позвоночника. Неврол. Журн. 2018; 23 (5): 248-258.
- Eichhorn J.H., Cooper J.B., Cullen D.J. et al. Standards of patient monitoring during anesthesia at Harvard Medical School. J Am Med Ass. 1986; 256: 1017-1020.
- Арестова Ю.С., Сайфутдинов М.С., Савин Д.М. и др. Значение интраоперационного нейрофизиологического контроля при хирургической коррекции сколиоза для послеоперационного восстановления моторной функции пациента. Соврем. технологии в медицине. 2021; 13 (5): 55-61.
- Filatov E., Sergeenko O., Savin D. et al. The etiological understanding of spine deformities in patients with neuromuscular disorders. J Ortho Sci Res. 2022; 3(2): 1-12.
- Vianello A., Arcaro G., Braccioni F. et al. Prevention of extubation failure in high risk patients with neuromuscular disease. J Crit Care 2011; 26:517-24.
- Birnkrant DJ. The American College of Chest Physicians consensus statement on the respiratory and related management of patients with Duchenne muscular dystrophy undergoing anesthesia or sedation. Pediatrics 2009; 123 (Suppl 4): S242-4.
- Rubino FA. Perioperative management of patients with neurologic disease. Neurol. Clin 2004; 22: 261-76.
- Finkel R.S., Mercuri E., Meyer O.H. et al. SMA Care group. Diagnosis and management of spinal muscul aratrophy: Part 2: Pulmonary and acute care; medications, supplements and immunizations; other organ systems; and ethics. Neuromuscul Disord. 2018; 28(3): 197-207.
- Cardiovascular health supervision for individuals affected by Duchenne or Becker muscular dystrophy. Section on Cardiology and Cardiac Surgery. Pediatrics 2005;116;1569 ‐1573.
- Muenster T, Mueller C, Forst J, Huber H, Schmitt HJ. Anaesthetic management in patients with Duchenne muscular dystrophy undergoing orthopaedic surgery: a review of 232 cases. Eur J Anaesthesiol 2012; 29: 489-94.
- Yong SL, Marik P, Esposito M, Coulthard P. Supplemental perioperative steroids for surgical patients with adrenal insufficiency. Cochrane Database Syst Rev. 2009 (4): CD005367.
- Ames WA, Hayes JA, Crawford MW. The role of corticosteroids in Duchenne muscular dystrophy: a review for the anesthetist. PaediatrAnaesth 2005; 15: 3-8.
- Marik PE, Varon J. Requirement of perioperative stress doses of corticosteroids: a systematic review of the literature. Arch Surg. 2008; 143 (12): 1222-6.
- Troianos CA, Hartman GS, Glas KE, et al. Special articles: guidelines for performing ultrasound guided vascular cannulation: recommendations of the American Society of Echocardiography and the Society of Cardiovascular Anesthesiologists. AnesthAnalg 2012; 114: 46-72.
- Klingler W, Lehmann-Horn F, Jurkat-Rott K. Complications of anaesthesia in neuromuscular disorders. NeuromusculDisord 2005; 15: 195-206.
- Birnkrant DJ, Panitch HB, Benditt JO, et al. American College of Chest Physicians consensus statement on the respiratory and related management of patients with Duchenne muscular dystrophy undergoing anesthesia or sedation. Chest 2007; 132: 1977-86.
- Niranjan V, Bach JR. Noninvasive management of pediatric neuromuscular ventilatory failure. Crit Care Med 1998; 26: 2061-5.
- Ruscic KJ, Grabitz SD, Rudolph MI, Eikermann M. Prevention of respiratory complications of the surgical patient: actionable plan for continued process improvement. Curr. Opin. Anaesthesiol. 2017; 30 (3): 399-408.
- Almenrader N, Patel D. Spinal fusion surgery in children with non-idiopathic scoliosis: is there a need for routine postoperative ventilation? Br J Anaesth 2006; 97: 851-7.
- Marchant WA, Fox R. Postoperative use of a cough-assist device in avoiding prolonged intubation. Br J Anaesth 2002; 89: 644-7.
- Trucco F., Pedemonte M., Fiorillo C., et al. Detection of early nocturnal hypoventilation in neuromuscular disorders. J Int Med Res. 2018; 46(3): 1153-1161.
- Hawker GA, Mian S, Kendzerska T, French M. Measures of adult pain: Visual Analog Scale for Pain (VAS Pain), Numeric Rating Scale for Pain (NRS Pain), McGill Pain Questionnaire (MPQ), Short-Form McGill Pain Questionnaire (SF-MPQ), Chronic Pain Grade Scale (CPGS), Short Form-36 Bodily Pain Scale (SF-36 BPS), and Measure of Intermittent and Constant Osteoarthritis Pain (ICOAP). Arthritis Care Res (Hoboken). 2011; 63 Suppl 11: S 240–252.
- Hart D, McDonald C Spinal deformity in progressive neuromuscular disease. Phys Med Rehab Clin North Am 9 (1), Global Polio Eradication Initiative Strategic Plan (2004) Centers for disease. MMWR MorbMortal Wkly Rep. 1998; 53(5): 107–8.
- Проксимальная спинальная
мышечная атрофия 5q, рубрикатор клинических рекомендаций МЗ РФ, 2023
- Заболотских И.Б., Белкин А.А., Бутров А.В. и др. Периоперационное ведение пациентов с нервно-мышечными заболеваниями. Анестезиология и реаниматология. 2019; (1): 6-26.
- Периоперационное ведение пациентов с нервно-мышечными заболеваниями. Методические рекомендации МЗ РФ, Год утверждения: 2022.
- Revised upper limb module for SMA: RULM SMAReach. 21.01.2019. Режим дост
- Расширенная шкала оценки
моторных функций больницы Хаммерсмит (HFMSE). Оценочные листы. 2019.
- Berarda C., Payan C., Hodgkinsona I., Fermanian J. The MFM Collaborative Study Group A motor function measure scale for neuromuscular diseases. Construction and validation study. Neuromuscular Disord. 2005; 15: 463–470.
- Рябых С.О., Савин Д.М., Филатов Е.Ю. и др. Спинальная мышечная атрофия: особенности клиники и лечения деформаций позвоночника и конечностей. Протокол межгосударственного консенсуса. Хирургия позвоночника. 2020.; 17 (2): 79–94.
- С.И. Куцев, С.С. Никитин, С.О. Рябых, и др. Власов Спинальная мышечная атрофия 5q. Мультидисциплинарный подход к ведению пациентов с подтвержденным диагнозом Спинальная мышечная атрофия 5q. Учебно-методическое пособие. Москва. 2022.]
- Palisano R. et al. Sistema de classificaçào da função motora grossa para paralisia cerebral (GMFCS //Dev Med Child Neurol. – 1997. – Т. 39. – С. 214-223.
- Kotwicki T, Jozwiak M. Conservative management of neuromuscular scoliosis: personal experience and review of literature. Disabil Rehabil. 2008; 30(10):792-8.
- Mullender M, Blom N, De Kleuver M, et al. A Dutch guideline for the treatment of scoliosis in neuromuscular disorders. Scoliosis. 2008; 3:14.
- Weiss HR. The method of Katharina Schroth - history, principles and current development. Scoliosis. 2011; 6: 17.
- Gou Y, Lei H, Zeng Y, et al. The effect of Pilates exercise training for scoliosis on improving spinal deformity and quality of life: Meta-analysis of randomized controlled trials. Medicine (Baltimore). 2021; 100 (39):e27254.
- Berven S, Bradford DS. Neuromuscular scoliosis: causes of deformity and principles for evaluation and management. Semin Neurol. 2002 Jun;22(2):167-78.
- Mercuri E. et al. Diagnosis and management of spinal muscular atrophy: Part 1: Recommendations for diagnosis, rehabilitation, orthopedic and nutritional care. Neuromuscul. Disord. Elsevier, 2018; 28 (2): 103–115.
- Fujak A, Kopschina C, Forst R, et al. Use of orthoses and orthopaedic technical devices in proximal spinal muscular atrophy. Results of survey in 194 CMA patients. Disabil Rehabil Assist Technol 2011;6(4):305-11.
- Catteruccia M, Vuillerot C, Vaugier I, et al. Orthopedic management of scoliosis by GarchesVrace and spinal fusion in CMA type 2 children. J Neuromuscul Dis 2015; 2(4):453-62.
- Nakamura N, Uesugi M, Inaba Y, et al. Use of dynamic spinal brace in the management of neuromuscular scoliosis: a preliminary report. J Pediatr Orthop B. 2014; 23(3):291-8.
- Pettersson K, Rodby-Bousquet E Prevalence and goal attainment with spinal orthoses for children with cerebral palsy. J. Pediatr. Rehabil. Med. 2019; 12(2): 197-203.
- Wang HY, Kong YP. Effect of traditional Chinese medicine massage on the rehabilitation of spinal function in scoliosis patients undergoing 3D printing orthopedic surgery. Zhongguo Gu Shang. 2022; 35(1): 33-7.
- Mesfin A, Sponseller PD, Leet A.I. Spinal muscular atrophy: manifestations and management. J Am Acad Orthop Surg 2012; 20(6): 393-401.
- Miller A, Temple T, Miller F. Impact of orthoses on the rate of scoliosis progression in children with cerebral palsy. J. Pediatric Orthopaedics. 1996; 16: 332-335.
- Olafsson Y, Saraste H, Al-Dabbagh Z: Brace treatment in neuromuscular spine deformity. Journal of Pediatric Orthopaedics. 1999; 19: 376-379.
- Trabacca A, Lucarelli E, Pacifico R, et al. The International Classification of Functioning, Disability and Health-Children and Youth as a framework for the management of spinal muscular atrophy in the era of gene therapy: a proof-of-concept study. Eur J Phys Rehabil Med. 2020; 56(2): 243-251.
- Шейко Г.Е., Белова А.Н., Кузнецов А.Н., и др. Применение Международной классификации функционирования, ограничения жизнедеятельности и здоровья детей и подростков в оценке реабилитационных мероприятий у пациентов с детским церебральным параличом. Вестник восстановительной медицины. 2020; 5 (99): 38-45.
- Kennedy RA, Carroll K, McGinley JL, Paterson KL. Walking and weakness in children: a narrative review of gait and functional ambulation in paediatric neuromuscular disease. J Foot Ankle Res. 2020;13(1):10.
- Hsieh Y.L., Yang C.C., Sun S.H., et al. Effects of hippotherapy on body functions, activities and participation in children with cerebral palsy based on ICF-CY assessments. Disability and Rehabilitation. 2017; 39(17): 1703-1713.
- Angsupaisal M, Maathuis CG, Hadders-Algra M. Adaptive seating systems in children with severe cerebral palsy across International Classification of Functioning, Disability and Health for Children and Youth version domains: a systematic review. Dev Med Child Neurol 2015; 57: 919-30.
- Loughenbury PR, Tsirikos AI. Current concepts in the treatment of neuromuscular scoliosis: clinical assessment, treatment options, and surgical outcomes. Bone Jt Open. 2022; 3(1):85-92.
- Menon D, Gonorazky HD, Dowling JJ, et al. Clinical profile and multidisciplinary needs of patients with neuromuscular disorders transitioning from paediatric to adult care. Neuromuscul Disord. 2022; 32(3):206-212.
- Accogli G, Ferrante C, Fanizza I, et al. Neuromuscular disorders and transition from pediatric to adult care in a multidisciplinary perspective: a narrative review of the scientific evidence and current debate. Acta Myol. 2022; 41(4):188-200.
- Mary P, Servais L, Vialle R. Neuromuscular diseases: Diagnosis and management. Orthop Traumatol Surg Res. 2018;104(1S):S89-S95.
- Wong BL, Rybalsky I, Shellenbarger KC, et al. Long-Term outcome of interdisciplinary management of patients with Duchenne muscular dystrophy receiving daily glucocorticoid treatment. J Pediatr. 2017; 182:296-303.e1.
- Kilmer D.D. The role of exercise in neuromuscular disease. Phys Med Rehabil Clin North Am 1998; 9: 115–125.
- Montes J, Garber CE, Kramer SS, et al. Single-blind, randomized, controlled clinical trial of exercise in ambulatory spinal muscular atrophy: why are the results negative? J. Neuromuscul Dis. 2015; 2(4): 463-470.
- Ansved T. Muscle training in muscular dystrophies. Acta Physiol Scand 2001; 171: 359–366.
- Цыкунов М.Б. Медицинская реабилитация при сколиотических деформациях. Вестник восстановительной медицины. 2018; 86 (4): 75-91.
- Hsu JD, Quinlivan R. Scoliosis in Duchenne muscular dystrophy (DMD). Neuromuscul Disord. 2013; 23(8): 611-7.
- Albany K. Physical and occupational therapy considerations in adult patients receiving botulinum toxin injections for spasticity. Muscle Nerve 1997; 6 (Suppl.): S221–S231
- Agre J.C., Rodriquez A.A, Franke T.M. Strength, endurance, and work capacity after muscle strengthening exercise in post-polio subjects. Arch Phys Med Rehabil. 1997; 78: 681–686
- Holmes K.J., Michael S.M., Thorpe S.L. et al. Management of scoliosis with special seating for the non-ambulant spastic cerebral palsy population--a biomechanical study. Clin. Biomech (Bristol, Avon) 2003;18:480-7.
- Benson ER, Thomson JD, Smith BG, Banta JV. Results and morbidity in a consecutive series of patients undergoing spinal fusion for neuromuscular scoliosis. Spine. 1998; 23: 2308–17.
- Cotton LA. Unit rod segmental spinal instrumentation for the treatment of neuromuscular scoliosis. Orthop Nurs. 1991; 10:17–23.
- Nuzzo R.M., Walsh S., Boucherit T., Massood S. Counterparalysis for treatment of paralytic scoliosis with botulinum toxin type A. Amer. J. Orthop. 1997; 26:201-207.
- Hoare BJ, Wallen MA, Imms C, et al. Botulinum toxin A as an adjunct to treatment in the management of the upper limb in children with spastic cerebral palsy (UPDATE). Cochrane Database Syst Rev 2010;(1):CD003469.
- Molenaers G, Fagard K, Van Campenhout A, et al. Botulinum toxin A treatment of the lower extremities in children with cerebral palsy. J Child Orthop 2013; 7: 383-7.
- Wong C, Pedersen SA, Kristensen BB, et al. The effect of botulinum toxin A injections in the spine muscles for cerebral palsy scoliosis, examined in a prospective, randomized triple-blinded study. Spine (Phila Pa 1976). 2015; 40 (23): E1205-11.
- Su YC, Lin YC, Hsieh PC, et al. Effectiveness of botulinum neurotoxin in treatment of scoliosis among children and adolescents: a systematic review and meta-analysis. Children (Basel). 2022; 9 (10): 1505.
- Хан М.А., Подгорная О.В., Тарасов Н.И., и др. Импульсная магнитная стимуляция в реабилитации детей, оперированных по поводу сколиоза III-IV степени. Вопросы курортологии, физиотерапии и лечебной физической культуры. 2013;90(2):33‑37.
- Хан М.А., Погонченкова И.В., Выборнов Д.Ю. и др. Медицинская реабилитация детей со сколиозом. Вопросы курортологии, физиотерапии и лечебной физической культуры. 2022; 99(4): 57–66.
- Пономаренко Г.Н. Физическая и реабилитационная медицина: национальное руководство. М.: ГЭОТАР-Медиа; 2016.
- Talkovsky E.M., Vybornov D.Yu., Krestyashin V.M., et al. High intensity pulsed magnetic therapy and therapeutic exercises complex application in medical rehabilitation: prospective randomized comparative study of children with grade II scoliosis. Bull. Rehabil. Med. 2022; 21 (4): 88-96.
- Ерохина Н.Н. Плавание — как средство профилактики и лечения сколиоза и других заболеваний позвоночника. Проблемы развития физической культуры и спорта в новом тысячелетии. 2017; 1: 115-116
- Ogonowska-Slodownik A, de Lima AAR, Cordeiro L, et al. Aquatic therapy for persons with neuromuscular diseases - a scoping review. J Neuromuscul Dis. 2022;9(2):237-256.
- Plecash A.R., Leavitt B.R. Aqua-therapy for neurodegenerative disorders. J Huntingtons Dis. 2014; 3(1):5–11.
- Huguet-Rodríguez M., Arias-Buría J.L, Huguet-Rodríguez B. et al. Impact of aquatic exercise on respiratory outcomes and functional activities in children with neuromuscular disorders: findings from an open-label and prospective preliminary pilot study. Brain Sci. 2020; 10(7): 458.
- Шаймурзин М.Р., Луцкий И.С., Евтушенко О.С., Ефименко М.В. Возможности мануальной терапии в коррекции сколиоза у детей со спинальными мышечными атрофиями. Университетская клиника. 2020; 4(37):20-25.
- Wishart B.D., Kivlehan E. Neuromuscular Scoliosis: when, who, why and outcomes. Phys. Med. Rehabil. Clin. N Am. 2021;32(3):547-556.
- Макарова Э.В., Купреенко М.В. Инновационные технологии в комплексной реабилитации лиц со сколиозом. Современные здоровьесберегающие технологии. 2017; 4: 331-338.
- Tones M., Moss N., Polly D.W. A review of quality of life and psychosocial issues in scoliosis. Spine (Phila Pa 1976). 2006; 31 (26): 3027-38.
- Reichel D., Schanz J. Developmental psychological aspects of scoliosis treatment. Pediatr Rehabil. 2003; 6 (3-4): 221-5.
- Li LX, Zhang MM, Zhang Y, He J. Acupuncture for cerebral palsy: A meta-analysis of randomized controlled trials. Neural Regen Res. 2018 Jun;13(6):1107-1117.
- Kang X., Huang Y., Zheng Y. et al. Meta-analysis of the efficacy of Jingjin acupuncture therapy in the treatment of spastic cerebral palsy. Front Neurol. 2024; 15: 1358732.
- Голубова Т.Ф., Любчик В.Н., Курганова А.В. Сравнительная эффективность комплексов санаторно-курортного восстановительного лечения детей со сколиотической болезнью. Вестн. физиотерапии и курортол. 2018; 24(1): 56-63
- Заболотских И. Б. и др. Периоперационное ведение пациентов с нервно-мышечными заболеваниями (проект клинических рекомендаций ФАР России) //Регионарная анестезия и лечение острой боли. – 2014. – Т. 8. – №. 2. – С. 58-75.
- Bratzler D.W., Dellinger E.P., Olsen K.M. et al. Clinical practice guidelines for antimicrobial prophylaxis in surgery. Amer. J. Health-System Pharm. 2013; 70 (3): 195–283
- Анестезиологическое обеспечение оперативного лечения деформаций позвоночника в детском возрасте / К. Ю. Уколов, В. Л. Айзенберг, С. В. Колесов, Н. И. Аржакова // Вестник интенсивной терапии. – 2012. – № 2. – С. 64-69. – EDN QBUAFR.
- Niemi G, Breivik H. Adrenaline markedly improves thoracic epidural analgesia produced by a low-dose infusion of bupivacaine, fentanyl and adrenaline after major surgery. A randomised, double-blind, cross-over study with and without adrenaline. Acta Anaesthesiol Scand. 1998 Sep;42(8):897-909. doi: 10.1111/j.1399-6576.1998.tb05348.x. PMID: 9773133.
- Waldron N.H., Jones C.A., Gan T.J. et al. Impact of perioperative dexamethasone on postoperative analgesia and side-effects: systematic review and meta-analysis. Brit. J. Anaesthesia. 2013; 110 (2): 191–200.
- Wick E.C., Grant M.C., Wu C.L. Postoperative multimodal analgesia pain management with nonopioid analgesics and techniques: a review. JAMA Surg. 2017; 152 (7): 691.
- Doleman B., Mathiesen O., Sutton A.J. et al. Non-opioid analgesics for the prevention of chronic postsurgical pain: a systematic review and network meta-analysis. Br. J. Anaesth. 2023; 130(6):719-728
- Hsu J.R. Mir H., Wally M.K., Seymour R.B.; Orthopaedic Trauma Association Musculoskeletal Pain Task Force. Clinical practice guidelines for pain management in acute musculoskeletal injury. J. Orthopaedic Trauma. 2019; 33 (5): e158–e182
- Lee S.K., Lee J.W., Choy W.S. Is multimodal analgesia as effective as postoperative patient-controlled analgesia following upper extremity surgery? Orthop. Traumatol. Surg. Res. 2013; 99 (8): 895–901
- Helenius L.L., Oksanen H., Lastikka M. et al. Preemptive Pregabalin in children and adolescents undergoing posterior instrumented spinal fusion: a double-blinded, placebo-controlled, randomized clinical trial. J Bone Joint Surg Am. 2020; 102 (3): 205-212
- Mosenthal W.P., Landy D.C., Boyajian H.H., et al. Thromboprophylaxis in Spinal Surgery // Spine. 2018. Vol. 43, № 8. P. E474–E481.
- Shiqing W., Shengzhong M., Cheng Z., et al. Efficacy of low molecular weight heparin in spinal trauma patients after part concentrated screw surgery and its influence on blood parameters and the incidence of deep venous thrombosis. Med. Hypotheses. 2019. 132: 109330.
- Faraoni D., Comes R.F., Geerts W., et al. European guidelines on perioperative venous thromboembolism prophylaxis: Neurosurgery. Eur. J. Anaesthesiol. 2018; 35 (2): 90–95
- Prevention of Venous Thromboembolism in Individuals with Spinal Cord Injury: Clinical Practice Guidelines for Health Care Providers, 3rd ed.: Consortium for Spinal Cord Medicine. Top. Spinal Cord Inj. Rehabil. 2016; 22 (3): 209–240
- UW Health. Venous Thromboembolism Prophylaxis – Pediatric – Inpatient – Consensus Care Guideline [Electronic resource]. 2023.
- Lyle C.A., Sidonio R.F., Goldenberg N.A. New developments in pediatric venous thromboembolism and anticoagulation, including the target-specific oral anticoagulants // Curr. Opin. Pediatr. 2015. Vol. 27, № 1. P. 18–25
- Opri F., Bianchini S., Nicoletti L., et al. Surgical Antimicrobial Prophylaxis in Patients of Neonatal and Pediatric Age Undergoing Orthopedic and Hand Surgery: A RAND/UCLA Appropriateness Method Consensus Study // Antibiotics. 2022. Vol. 11, № 3. P. 289.
- Власова А. В., Смирнова Е. В., Теновская Т. А., et al. Протокол периоперационной и постэкспозиционной антибиотикопрофилактики в ГБУЗ «Морозовская ДГКБ ДЗМ» // Здоровье Мегаполиса. 2021. Vol. 2, № 2. P. 46–64.
- Frizzell K.H., Cavanaugh P.K., Herman M.J. Pediatric Perioperative Pain Management // Orthop. Clin. North Am. 2017. Vol. 48, № 4. P. 467–480.
- Hsu J.R., Mir H., Wally M.K., et al. Clinical Practice Guidelines for Pain Management in Acute Musculoskeletal Injury // J. Orthop. Trauma. 2019. Vol. 33, № 5. P. e158–e182.
- Lee S.K., Lee J.W., Choy W.S. Is multimodal analgesia as effective as postoperative patient-controlled analgesia following upper extremity surgery? // Orthop. Traumatol. Surg. Res. 2013. Vol. 99, № 8. P. 895–901.
- Richman J.M., Liu S.S., Courpas G., et al. Does Continuous Peripheral Nerve Block Provide Superior Pain Control to Opioids? A Meta-Analysis // Anesth. Analg. 2006. Vol. 102, № 1. P. 248–257.
- Hauer J. Pain in children: Approach to pain assessment and overview of management principles // UpToDate. Poplack DG. Wolters Kluwer.
- Orliaguet G., Hamza J., Couloigner V., et al. A Case of Respiratory Depression in a Child With Ultrarapid CYP2D6 Metabolism After Tramadol // Pediatrics. 2015. Vol. 135, № 3. P. e753–e755.
- Schechter W. Pharmacologic management of acute perioperative pain in infants and children // UpToDate. Sun LS. Wolters Kluwer.
- Megarbane A, Bizzari S, Deepthi A, et al. A 20-year Clinical and Genetic Neuromuscular Cohort Analysis in Lebanon: An International Effort. J Neuromuscul Dis. 2022;9(1):193-210. doi:10.3233/JND-210652.
- Ортопедия: национальное руководство / Н. Г. Фомичев, А. А. Луцик, А. Е. Симонович, А. В. Крутько. – 2-е издание, переработанное и дополненное. – Москва : Общество с ограниченной ответственностью Издательская группа "ГЭОТАР-Медиа", 2013. – 944 с. – ISBN 978-5-9704-2448-3. – EDN TFLTNH.
- Monagle P., Chan A.K.C., Goldenberg N.A., et al. Antithrombotic Therapy in Neonates and Children // Chest. Elsevier BV, 2012. Vol. 141, № 2. P. e737S-e801S.
- Erkilinc M, Clarke A, Poe-Kochert C, et al. Is There Value in Venous Thromboembolism Chemoprophylaxis After Pediatric Scoliosis Surgery? A 28-Year Single Center Study. J Pediatr Orthop. 2021;41(3):138-142. doi:10.1097/BPO.0000000000001746.
Приложение А1. Состав рабочей группы по разработке и пересмотру клинических рекомендаций

Приложение А2. Методология разработки клинических рекомендаций
Целевая аудитория данных клинических рекомендаций:
- Врачи-травматологи-ортопеды.
- Врачи-нейрохирурги.
- Врачи-неврологи.
- Врачи-хирурги.
Этапы оценки уровней достоверности доказательств и убедительности рекомендаций:
- Определение критериев поиска и отбора публикаций о клинических исследованиях (КИ) эффективности и/или безопасности медицинского вмешательства, описанного в тезисе-рекомендации.
- Систематический поиск и отбор публикаций о КИ в соответствии с определёнными ранее критериями.
Систематический поиск и отбор публикаций о клинических исследованиях:
Доказательной базой для рекомендаций явились публикации, отобранные с помощью информационного поиска в базах данных ЦНМБ «Российская медицина», MEDLINE (НМБ США) и COCHRANE Library, научных электронных библиотеках eLibrary.ru и «КиберЛенинка», а также в сети Интернет с помощью поисковых систем Яндекс, Google и Google Scholar, путем просмотра ведущих специализированных рецензируемых отечественных медицинских журналов по данной тематике и рекомендаций по лечению переломов международной Ассоциации Остеосинтеза AO/ASIF.
Таблица 1. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
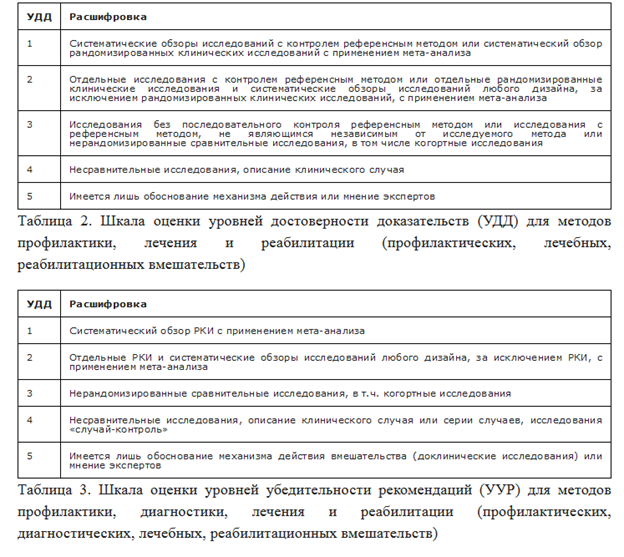

Порядок обновления клинических рекомендаций.
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию – не реже чем один раз в три года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, наличии обоснованных дополнений/замечаний к ранее утверждённым КР, но не чаще 1 раза в 6 месяцев.
Приложение А3. Справочные материалы, включая соответствие показаний к применению и противопоказаний, способов применения и доз лекарственных препаратов, инструкции по применению лекарственного препарата
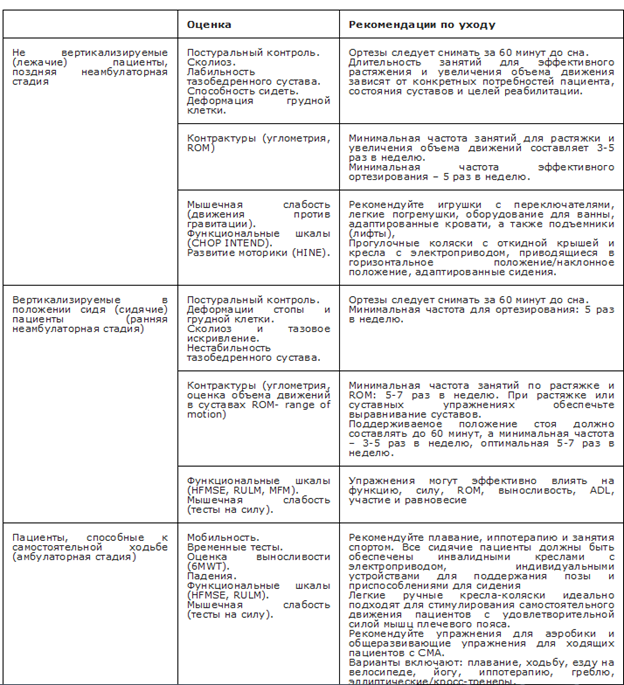
HINE – Hammersmith Infant Neurological Examination, шкала Хаммерсмит неврологической оценки младенцев;
AFOs – Ankle Foot Orthosis, ортез голеностопный;
KAFOs – Knee Ankle Foot Orthosis», ортез колено-голеностопный;
HKAFOs – Hip Knee Ankle Foot Orthosis, ортез бедренно-колено-голеностопный;
TLSOs – Thoracolumbosacral Orthosis, торако-поясничный сакральный ортез;
WHFO – Wrist Hand Finger Orthosis, тутор на кистевой сустав и кисть;
HFMSE – Hammersmith Function Motor Scale Expanded, шкала функциональной двигательной активности Хаммерсмит расширенная для больных СМА;
RULM – Revised Upper Limb Module, пересмотренный модуль оценки моторной функции верхних конечностей при СМА;
MFM – Motor Function measure, шкала для оценки двигательной функции у больных с нервно-мышечными болезнями;
6MWT – 6-Minute Walk Test», тест 6-минутной ходьбы;
ADL – Activities of Daily Living, повседневная бытовая активность.
Приложение А3.3. Рекомендации по обезболиванию при большой мышечно-скелетной травме у взрослых
В таблице представлены обезболивающие лекарственные препараты в режимах дозирования в соответствии с Клиническим руководством по обезболиванию при острой мышечно-скелетной травме [183].
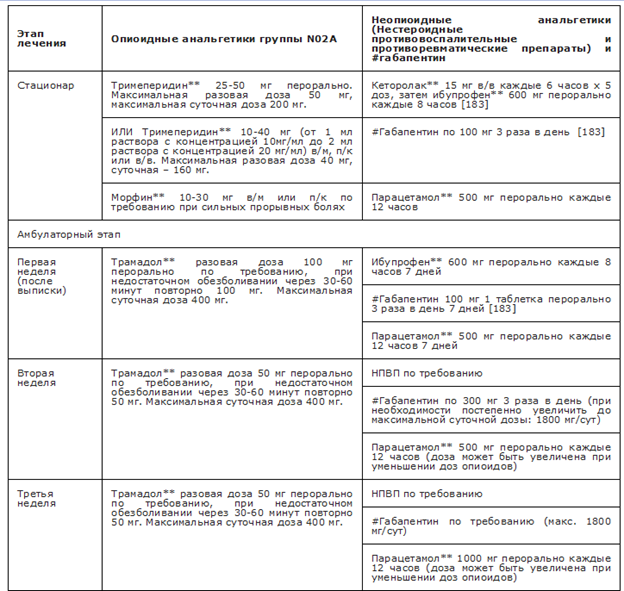
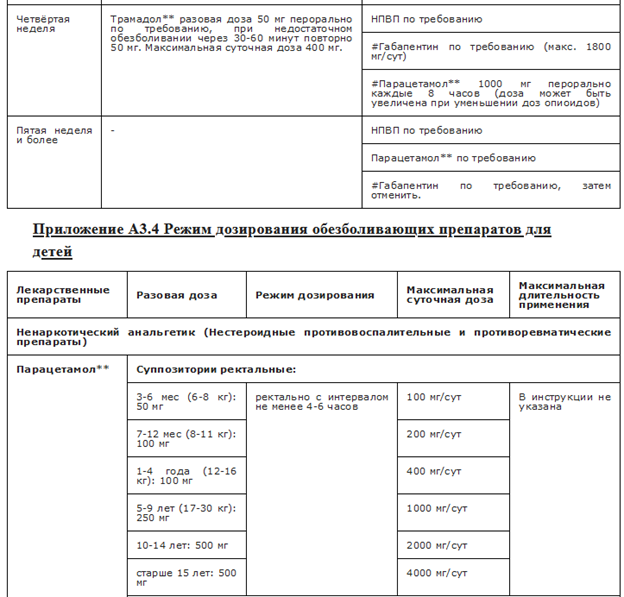
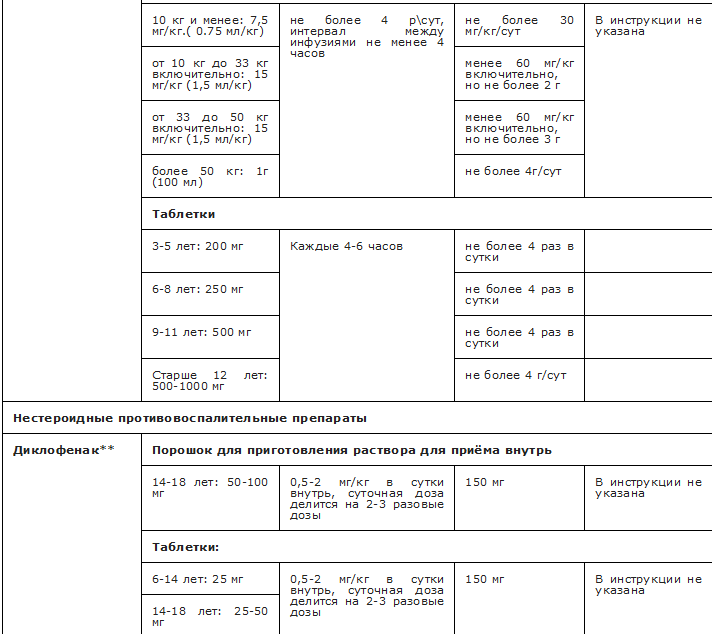


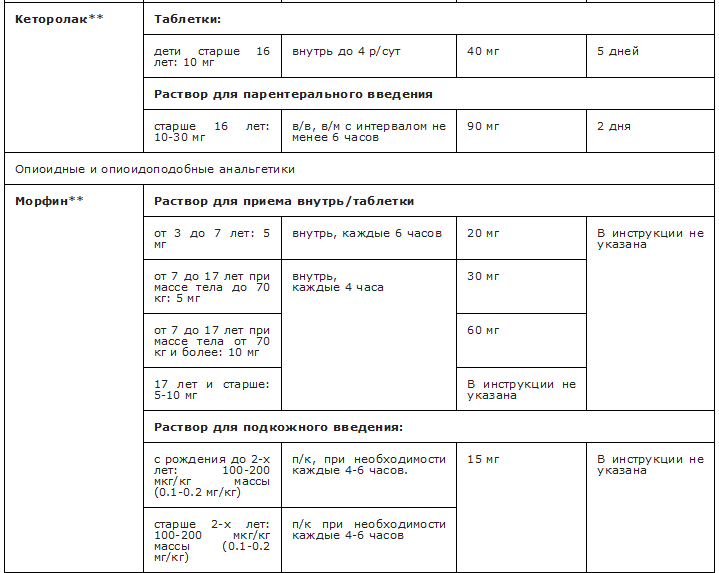
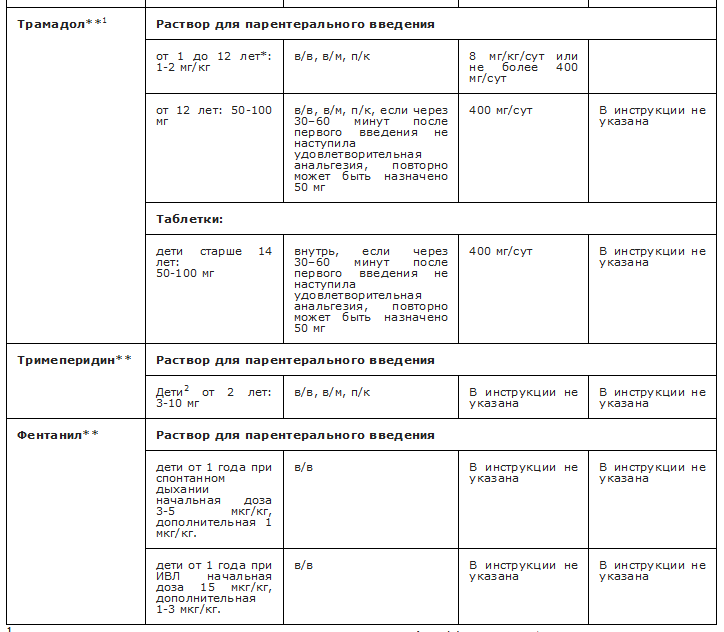
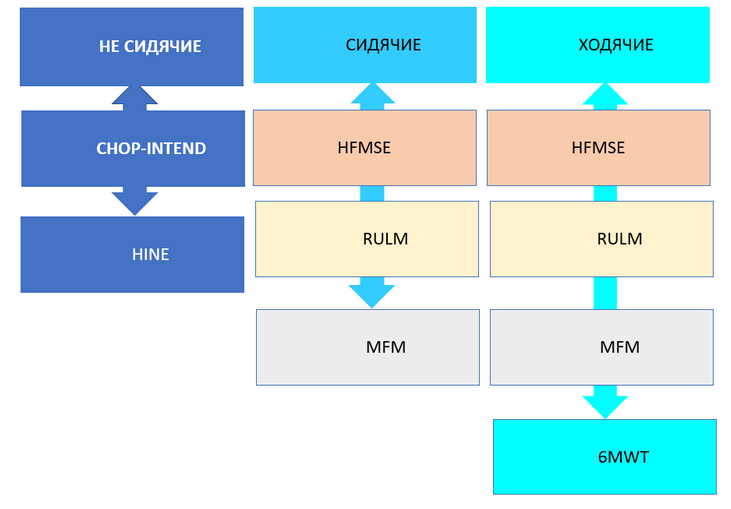
CHOP-INTEND – The Children's Hospital of Philadelphia Infant Test of Neuromuscular Disorders – Тест детской больницы Филадельфии для оценки двигательных функций при нервномышечных болезнях у новорождённых;
HINE – Hammersmith Infant Neurological Examination – Методика Королевской больницы Хаммерсмит для оценки неврологического статуса у детей раннего возраста;
HFMSE – Hammersmith Functional Motor Scale-Expanded – Шкала больницы Хаммерсмит оценки моторных функций при СМА5q;
RULM – Revised Upper Limb Module – Пересмотренный модуль оценки моторной функции верхних конечностей;
MSM – Motor Function Measure – Шкала оценки моторной функции;
6-MWT – The 6 Minute Walk Test – Тест 6 минутной ходьбы
Приложение Б. Алгоритмы действий врача
Приложение Б1. Алгоритм действий врача при подозрении на острое воспалительное заболевание позвоночника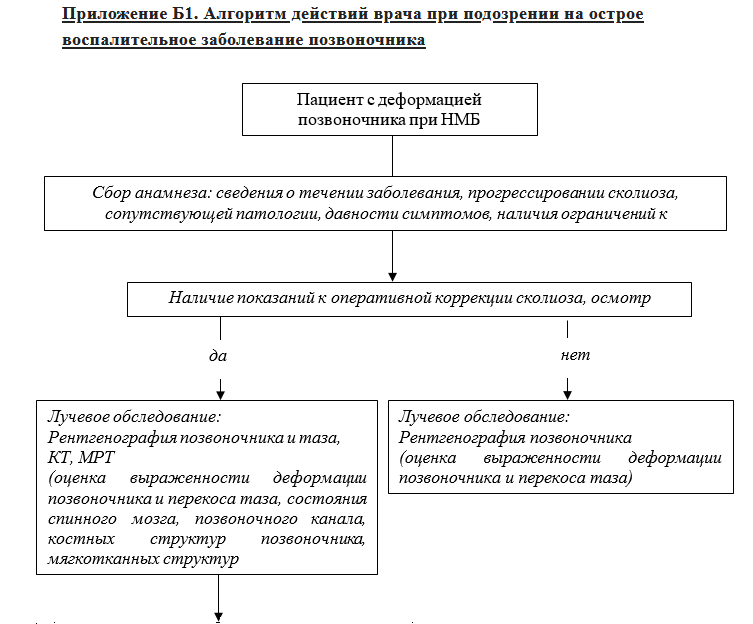
Приложение В. Информация для пациента
- Реабилитация после операции. Ранний реабилитационный период продолжается до момента полного заживления раны и восстановления дооперационного уровня вертикализации. Темп и особенности реабилитационного периода индивидуальны для каждого человека.
- Послеоперационные швы. В большинстве случаев пациент выписывается после заживления швов первичным натяжением. Это значит, что на поверхности шва образуется «корочка», под которой формируется узкий линейный рубец. Ежедневный уходом за швами производится по назначениям лечащего врача. После отрыва «корочки» рубец не обрабатывается. Созревание рубца обычно происходит в течение 1 месяца. Рекомендуется носить хлопчатобумажную или трикотажную одежду, не раздражающую кожу в области послеоперационного шва. Крайне нежелательно прикасаться к шву руками (обработка производится ватными палочками); подвергать шов воздействию воды, влаги. До полного заживления не рекомендуется посещать сауны, бани. Для приема душа можно самостоятельно наклеить на шов герметичную повязку; отрывать «корочки» до образования рубца;
- Изменения со стороны психоэмоциональной сферы. В некоторых случаях после выписки могут наблюдаться следующие явления: эмоциональная неустойчивость, раздражительность, плаксивость; сниженный фон настроения, апатия, быстрая утомляемость; нарушение сна. Данные проявления являются естественной реакцией организма на «операционный стресс», и проходят по мере улучшения общего состояния без какого-либо лечения. В редких случаях (когда состояние вызывает выраженный дискомфорт) рекомендуется обратиться к врачу-психотерапевту, врачу-неврологу или лечащему врачу. С целью стабилизации эмоционального фона полезно соблюдение активного режима и отдыха, прослушивание и просмотр музыкальных релаксационных программ. При нарушении засыпания целесообразно переключиться на какое-либо другое занятие (послушать музыку, почитать, сменить положение тела), проветрить комнату. Организму необходимо какое-то время для восстановления сна. В случае длительного нарушения сна рекомендована консультация врача-невролога.
- Боль. Возможна боль в шейном, грудном или поясничном отделах позвоночника. Эта боль может возникать или усиливаться после физической нагрузки. Это распространенное явление и не должно вызывать тревоги. Возможен прием лекарственных препаратов по назначению лечащего врача, упражнения на расслабления и легкий массаж. Если боль становится выраженной, продолжительной и отдает в руки или ноги рекомендуется обратиться к врачу-неврологу по месту жительства, обязательно проконсультировавшись с лечащим врачом.
- Дорога домой. Домой можно ехать на автомобиле, автобусе, поезде, самолете. Как правило, транспортировка осуществляется в положении лежа на животе или на боку. В автомобиле можно ехать на заднем или разложенном переднем пассажирском сидении. В поезде транспортировка осуществляется на нижней полке купе (необходимую справку можно взять у старшей медсестры отделения). В автобусе или самолете лучше всего расположиться на откинутой спинке кресла или нескольких свободных сиденьях. В аэропорту при себе необходимо иметь выписку и рентгеновский снимок.
- Ортопедический режим. Необходимо избегать длительного пребывания в вертикальном положении. Исключить поднятие и ношение тяжестей (не более 3 кг), сезонные сельскохозяйственные работы, общую физкультуру. Не рекомендуется сидеть до наступления усталости первые 6 месяцев после операции, выполнять различные наклоны туловища, сгибать и поднимать ноги. Для удобного надевания обуви лучше воспользоваться посторонней помощью. Спать рекомендуется на полужесткой кровати с небольшой подушкой. Для отхода ко сну, туалета, необходимо создать условия, аналогичные стационарным (поручни, подставки, опоры).
- Ходьба по лестнице. При возможности ходьбы подъем и спуск по лестнице требует более значительных усилий, чем ходьба по ровной поверхности. Следует подниматься и спускаться по лестнице приставным шагом с остановками для отдыха, держась за перила.
- Учеба. После операции рекомендовано индивидуальное обучение. Необходимо предупредить руководителя учебного учреждения о перенесенной операции. При обучении на дому требуется правильная организация рабочего места: необходимо правильно подобрать высоту стола, источник света должен быть достаточно ярким. Занятия можно проводить в положении лежа, стоя, на коленях. При появлении усталости сделать перерыв. В школе, в ВУЗе необходимо проводить занятия в аналогичном положении. При появлении усталости лучше отпроситься с занятий, отдохнуть в положении лежа.
- Профессия. Нежелательно выбирать профессию, связанную с длительным пребыванием в вертикальном положении.
- Питание. В восстановительном периоде важен правильный режим питания. Желательно избегать употребления жареного, жирного, а также уменьшить употребление соленого, сладкого и субпродуктов. Вес тела должен соответствовать росту. Часы приема пищи должны быть постоянными. Следует избегать избыточного приема пищи. Питание должно быть разнообразным, полноценным и витаминизированным.
- Физическая нагрузка. Любая физическая нагрузка, за исключением ходьбы, может быть разрешена лишь после консультации с лечащим врачом. Следует увеличивать физические нагрузки постепенно, переходя от легких упражнений к более сложным. Не ранее 3 месяцев после операции рекомендуется плавание в бассейне (не менее 2 раз в неделю). Не рекомендуется занятие видами спорта с риском падений, травматизации.
- Дальнейшие наблюдения и контрольное обследование. После выписки следует записаться на прием к врачу-травматологу-ортопеду, врачу-терапевту участковому, врачу-неврологу. Необходимо принести на прием выписной эпикриз.
В первые 6 месяцев после операции не рекомендуется проведение физиопроцедур. Контрольное обследование проводится для оценки эффективности лечения через 6 мес., 1 год, 2 года после операции. Для этого необходимо заранее записаться на прием в регистратуре поликлиники по телефону, указанному в выписке!
- Инвалидность. По вопросам оформления (продления) инвалидности обратитесь к лечащему врачу (металлоконструкция устанавливается пожизненно и удаляется только по показаниям). Если у вас имеются какие-либо вопросы, связанные с перенесенной операцией, не стесняйтесь обращаться прямо к лечащему врачу. Каждый пациент возвращается к объему привычной активности в своем индивидуальном темпе. Не следует сравнивать себя с другими пациентами. Следует чередовать пребывание в вертикальном положении с отдыхом. Не следует ходить до утомления. В течение некоторого времени могут беспокоить боли в области послеоперационных швов. Послушайте радио или музыку, чтобы отвлечься, или встаньте и пройдитесь немного и, потом, попытайтесь снова заснуть. Для периода выздоровления характерны частые смены настроения, что проходит с течением времени. Рекомендуется носить хлопчатобумажную или трикотажную одежду, не раздражающую кожу в области послеоперационного шва. Важно сообщить каждому врачу, к которому вы обращаетесь, что вы перенесли операцию на позвоночнике. С лечащим врачом необходимо согласовывать рекомендации, методы лечения, предлагаемые в амбулаторных условиях.
Приложение Г1-ГN. Шкалы оценки, вопросники и другие оценочные инструменты состояния пациента, приведенные в клинических рекомендациях
Приложение Г1. Балльная оценка силы мышц
Название на русском языке: Балльная оценка силы мышц
Источник (официальный сайт разработчиков, публикация с валидацией) [110]:
Тип (подчеркнуть): шкала оценки
Назначение: оценка силы мышц
Содержание (шаблон):
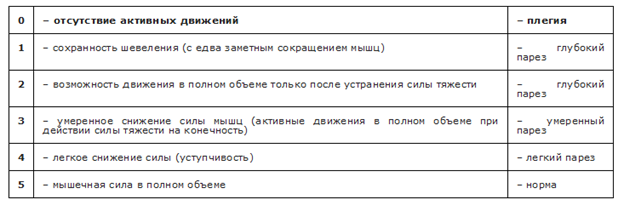
Приложение Г2. Визуальная аналоговая шкала боли
Название на русском языке: Визуальная аналоговая шкала боли (цифровая) (ВАШ)
Оригинальное название (если есть): Visual Analog Scale (VAS)
Источник (официальный сайт разработчиков, публикация с валидацией): [111]
Тип (подчеркнуть): шкала оценки
Назначение: оценка выраженности болевого синдрома
Содержание (шаблон):
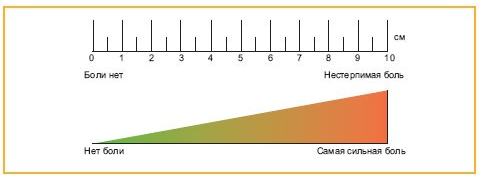
Приложение Г3. Функциональная шкала оценки глобальных моторных нарушений
Название на русском языке: Функциональная шкала оценки глобальных моторных нарушений – GMFSCОригинальное название: Gross Motor Function Classification System (GMFSC)
Источник (официальный сайт разработчиков, публикация с валидацией): [120]
Тип: шкала оценки
Назначение: оценка моторной функции верхней конечности
Содержание (шаблон): Это описательная система, учитывающая степень развития моторики и ограничения движений в повседневной жизни для 5 возрастных групп пациентов с ДЦП: до 2 лет, от 2 до 4 лет, от 4 до 6 лет, от 6 до 12 лет, от 12 до 18 лет. Согласно GMFCS, выделяют 5 уровней развития больших моторных функций:
Уровень I – ходит без ограничений
- До 2-х лет – начало самостоятельной ходьбы
- С 2-х до 4-х лет – самостоятельная ходьба без прыжков и бега
- С 4-х до 6-ти лет – самостоятельная ходьба, подъем по лестнице, бег и прыжки
- С 6-ти до 12 лет, с 12-ти до 18 лет – самостоятельная ходьба через препятствия, бег и прыжки, участие в спортивных мероприятиях
Уровень II – ходит с ограничениями
- До 2-х лет – ползают на животе и четвереньках, ходят вдоль опоры
- С 2-х до 4-х лет – ползают на четвереньках, ходят у опоры, самостоятельная ходьба к 4-м годам
- С 4-х до 6-ти лет – самостоятельная ходьба на короткие расстояния, подъем по лестнице с перилами, не умеют бегать и прыгать
- С 6-ти до 12 лет, с 12-ти до 18 лет – самостоятельная ходьба на большие расстояния, но в привычной обстановке, на улице используют приспособления, бегают и прыгают плохо
Различия между I и II уровнем: дети второго уровня имеют ограничения в свободе движений, при ходьбе на улице, в коллективе, требуются вспомогательные приспособления для освоения ходьбы. Страдает качество движения – ребенок не умеет бегать и прыгать
Уровень III – ходит с применением вспомогательных приспособлений
- До 2-х лет – переворачиваются и ползают на животе
- С 2-х до 4-х лет – ползают по-пластунски или на четвереньках (реципрокно), ходят с ручными приспособлениями на короткие расстояния
- С 4-х до 6-ти лет – могут встать со стула без опоры, но ходят только с приспособлениями
- С 6-ти до 12 лет, с 12-ти до 18 лет – ходят только с приспособлениями, могут спускаться и опускаться по лестнице с перилами, на улице передвижение только на коляске
Разница между II и III уровнями заключается в степени функциональной активности. Детям III уровня требуются вспомогательные устройства и ортезы для ходьбы. Детям во II уровне не требуется вспомогательных средств для ходьбы после 4-х лет.
Уровень IV – передвигается с ограничениями, возможно использование электроприводных вспомогательных устройств
- До 2-х лет – переворачиваются, но не удерживают позу сидя
- С 2-х до 4-х лет – сидят в приспособлениях, но ползают по-пластунски
- С 4-х до 6-ти лет – могут сесть и встать с кресла с помощью взрослого, в лучшем случае могут передвигаться на короткие расстояния с помощью приспособлений
- С 6-ти до 12 лет, с 12-ти до 18 лет – по комнате передвигаются перекатами или ползанием на животе, могут передвигаться в ходунках, поддерживающих тазовый пояс и туловище
Разница между III и IV уровнями проявляется в возможности сидеть, даже с использованием вспомогательных средств. Дети III уровня сидят самостоятельно, передвигаются по полу самостоятельно, ходят с использованием вспомогательных средств. Дети IV уровня могут сидеть, но самостоятельное передвижение очень ограничено. Дети IV уровня чаще транспортируются на инвалидном кресле.
Уровень V – мобильность только в механическом инвалидном кресле
- До 2-х лет – нуждаются в помощи взрослого, чтобы перевернуться
- С 2-х до 4-х лет – некоторые дети достигают самостоятельной мобильности с использованием моторизированной высокотехнологичной коляски
- С 4-х до 6-ти лет, с 6-ти до 12 лет, с 12-ти до 18 лет – некоторые дети достигают самостоятельной мобильности с использованием высокотехнологичного электрического инвалидного кресла. Дети V уровня не могут самостоятельно контролировать движения и поддерживать позу против силы тяжести (не удерживает голову и положение туловища). Самостоятельное передвижение возможно только с использованием усовершенствованных кресел с электроприводом.
Приложение Г4. Классификация коммуникативных функций и навыков
Название на русском языке: Классификация коммуникативных функций и навыков
Оригинальное название (если есть): Communication Function Classification System (СFCS)
Источник (официальный сайт разработчиков, публикация с валидацией)
Тип (подчеркнуть): шкала оценки
Назначение: оценка коммуникативных функций и навыков
Содержание (шаблон):
CFCS включает в себя пять уровней:
1. Успешная коммуникация со знакомыми и незнакомыми людьми.
Ребенок свободно понимает «входящие» сообщения, передает свои сообщения и одновременно выступает в обеих ролях. Общение происходит легко, в комфортном темпе для всех участников процесса (как знакомых, так и незнакомых). Непонимания в общении быстро решаются и не отражаются на продуктивности коммуникации.
2. Успешная, но замедленная коммуникация со знакомыми и незнакомыми людьми.
Ребенок выступает в роли отправителя и получателя сообщений, общаясь как со знакомыми, так и с незнакомыми людьми, однако ему может требоваться дополнительное время, чтобы понять сообщение или сформулировать и высказать свое. Непонимания в общении, как правило, разрешаются без посторонней помощи и не влияют на продуктивность коммуникации. Общий темп общения снижен.
3. Простая коммуникация только со знакомыми людьми.
Ребенок легко понимает и отправляет сообщения, но только в процессе коммуникации со знакомыми людьми. С незнакомыми общение часто неэффективно.
4. Замедленная простая коммуникация только со знакомыми людьми.
Возможные варианты коммуникации: 1) иногда успешный отправитель и получатель; 2) успешно отправляет сообщения, но плохо понимает; 3) хорошо понимает сообщения, но плохо отправляет.
5. Редкая простая коммуникация даже со знакомыми людьми.
Ребенок ограничен как отправитель и получатель. Для большинства людей коммуникация ребенка непонятна. Ребенок плохо понимает обращенную к нему речь. Иногда коммуникация бывает успешной со знакомыми людьми.
Приложение Г5. Классификация мануальных навыков
Название на русском языке: Классификация мануальных навыков
Оригинальное название (если есть): Manual Ability Classification System (MACS)
Источник (официальный сайт разработчиков, публикация с валидацией)
Тип (подчеркнуть): шкала оценки
Назначение: оценка функций рук и мануальных навыков
Содержание (шаблон):
Классификация MACS включает 5 уровней по аналогии с системой Классификации больших моторных функций GMFCS.
Уровень I – ребенок легко и успешно пользуется предметами.
Уровень II – ребенок использует большинство предметов, но с несколько пониженной эффективностью и скоростью.
Уровень III – ребенок манипулирует предметами с трудностями; нуждается в помощи в подготовке и/или модификации действия.
Уровень IV – ребенок ограниченно использует простые в применении предметы в приспособленных условиях.
Уровень V – ребенок не удерживает предметы и ему трудно выполнять даже самые простые действия.
Приложение Г6. Шкала для оценки двигательной функции
Название на русском языке: Шкала для оценки двигательной функции
Оригинальное название (если есть): Motor Function measure (MFM)
Источник (официальный сайт разработчиков, публикация с валидацией): https://mfm-nmd.org
[Berarda C., Payan C., Hodgkinsona I., Fermanian J. The MFM Collaborative Study Group A motor function measure scale for neuromuscular diseases. Construction and validation study. Neuromuscular Disord. 2005; 15: 463–470] [117]
Тип (подчеркнуть): шкала оценки
Назначение: оценка двигательной функции у больных с нервно-мышечными болезнями
Содержание (шаблон):
Список 32 пунктов измерения двигательной функции с исходным положением и необходимыми упражнениями

Приложение Г7. Модуль оценки моторной функции верхних конечностей
Название на русском языке: Модуль оценки моторной функции верхних конечностей
Оригинальное название (если есть): REVISED UPPER LIMB MODULE
Источник (официальный сайт разработчиков, публикация с валидацией): [115]
Тип (подчеркнуть): шкала оценки
Назначение: оценка моторной функции верхней конечности
Содержание (шаблон):
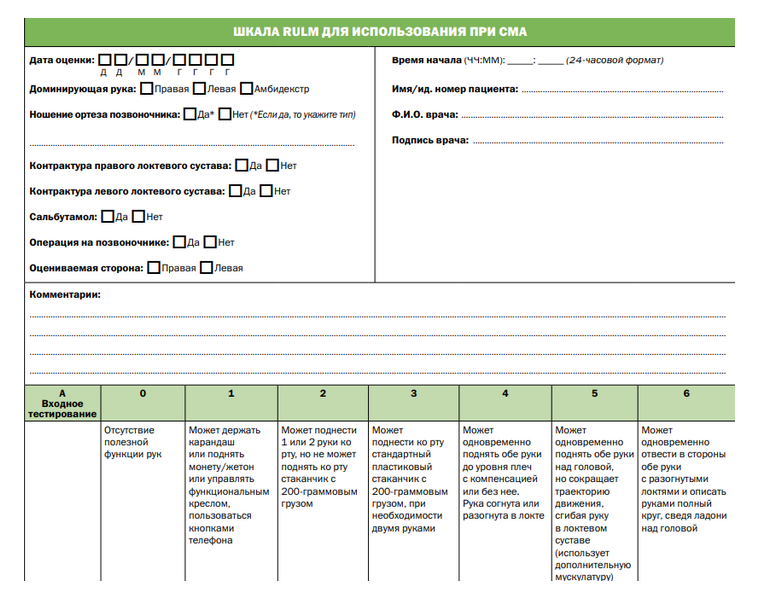
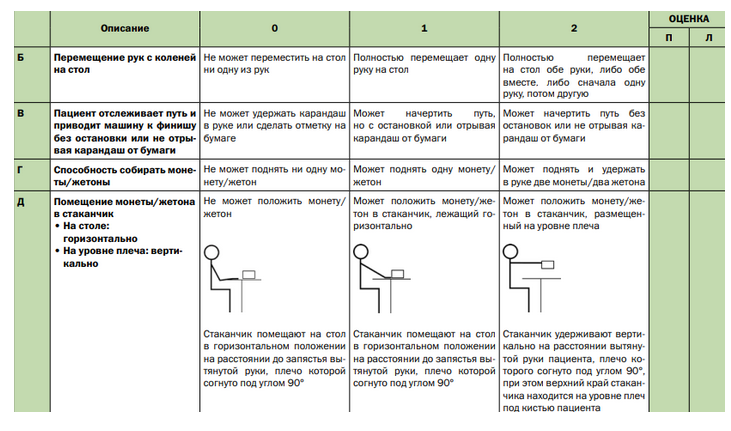
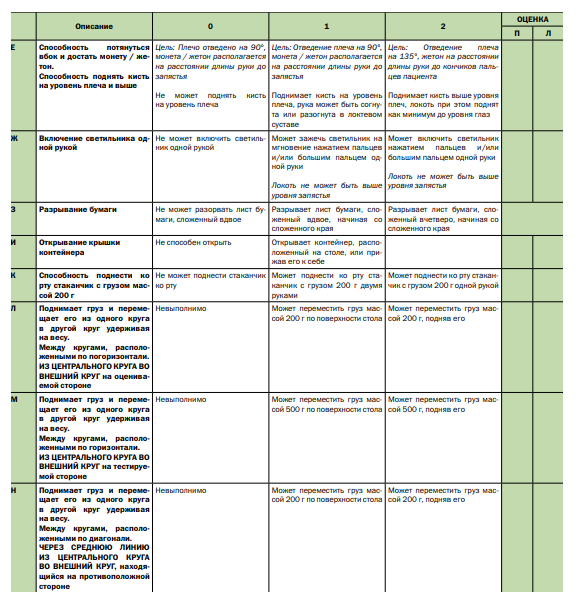
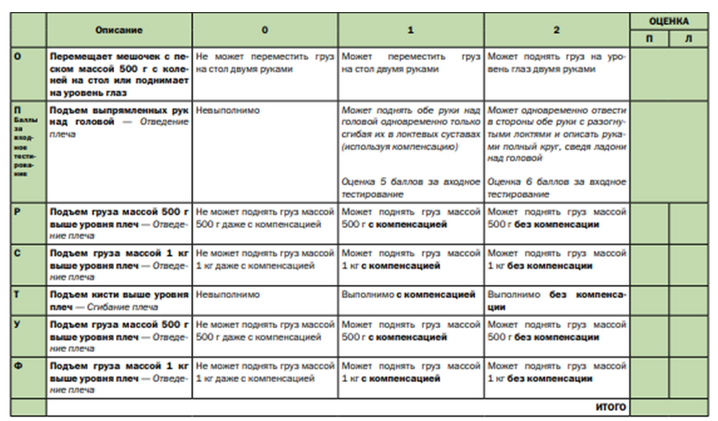
Приложение Г8. Функциональная шкала оценки моторных функций HFMSE
Название на русском языке: Функциональная шкала оценки моторных функций
Оригинальное название (если есть): The Hammersmith Functional Motor Scale Expanded (HFMSE)
Источник (официальный сайт разработчиков, публикация с валидацией): [116]
Тип (подчеркнуть): шкала оценки
Назначение: оценка моторной функции верхней конечности
Содержание (шаблон):
Приложение Г9. Шкала индивидуальной оценки риска развития венозных тромбоэмболических осложнений по Каприни
Название на русском языке: Шкала индивидуальной оценки риска развития венозных тромбоэмболических осложнений по Каприни.
Оригинальное название: Caprini Score for Venous Thromboembolism
Источник: Лобастов К.В., Баринов В.Е., Счастливцев И.В., Лаберко Л.А. Шкала Caprini как инструмент для индивидуальной стратификации риска развития послеоперационных венозных тромбоэмболий в группе высокого риска. Хирургия. Журнал им. Н.И. Пирогова. 2014; (12):16-23.
Тип: шкала
Назначение: оценка степени риска венозных тромбоэмболий
Содержание:
1 балл
Возраст 41-60 лет
Отек нижних конечностей
Варикозные вены
Индекс массы тела более 25 кг/м2
Малое хирургическое вмешательство
Сепсис (давностью до 1 мес.)
Серьезное заболевание легких (в том числе пневмония давностью до 1 мес.)
Прием гормональных контрацептивов системного действияоральных контрацептивов, гормонозаместительная терапия
Беременность и послеродовый период (до 1 мес.)
В анамнезе: необъяснимые мертворождения, выкидыши (≥3),
преждевременные роды с токсикозом или задержка внутриутробного развития
Острый инфаркт миокарда
Хроническая сердечная недостаточность (давностью до 1 мес.)
Постельный режим у нехирургического пациента
Воспалительные заболевания толстой кишки в анамнезе
Большое хирургическое вмешательство давностью до 1 мес. в анамнезе
Хроническая обструктивная болезнь легких
2 балла
Возраст 61-74 года
Артроскопическая хирургия
Злокачественное новообразование105
Лапароскопическое вмешательство (длительностью более 45 мин)
Постельный режим более 72 ч
Иммобилизация конечности (давностью до 1 мес.)
Катетеризация центральных вен
Большое хирургическое вмешательство (длительностью более 45 мин)
3 балла
Возраст старше 75 лет
Личный анамнез ВТЭО
Семейный анамнез ВТЭО
Мутация типа Лейден
Мутация протромбина 20210А
Гипергомоцистеинемия
Гепарининдуцированная тромбоцитопения
Повышенный уровень антител к кардиолипину
Волчаночный антикоагулянт
5 баллов
Инсульт (давностью до 1 мес.)
Множественная травма (давностью до 1 мес.)
Эндопротезирование крупных суставов
Перелом костей бедра и голени (давностью до 1 мес.)
Травма спинного мозга/паралич (давностью до 1 мес.)
Интерпретация: В зависимости от суммы баллов, полученной при сборе анамнеза и обследовании пациента, его относят к той или иной группе риска:
- низкий риск: 0-1 балл;
- умеренный риск: 2 балла;
- высокий риск: 3-4 балла;
- очень высокий риск: 5 баллов и более.
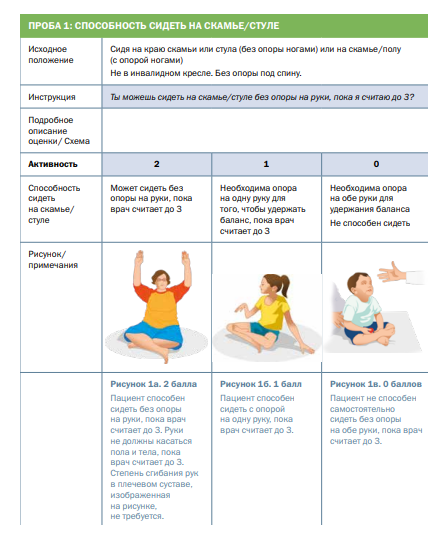
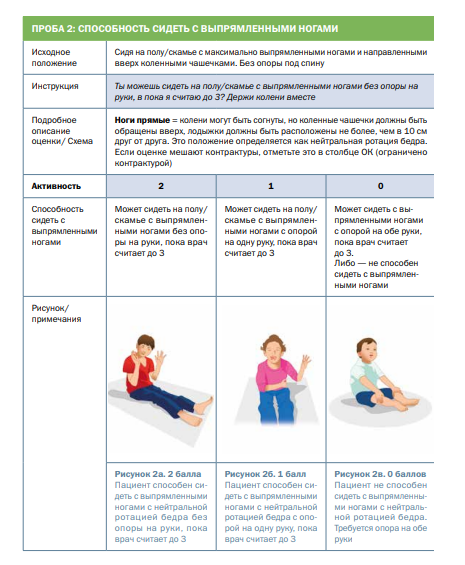
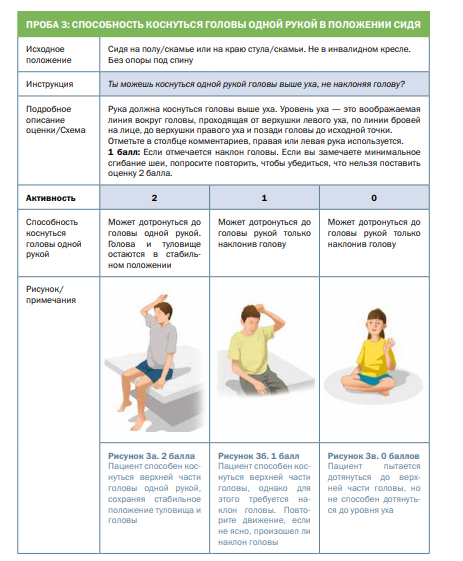
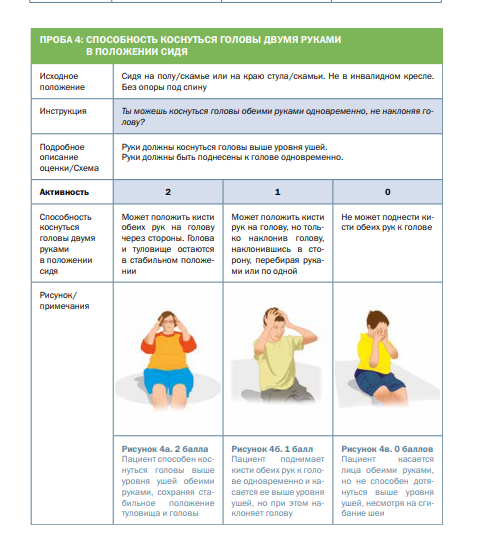
Теги: сколиоз
234567 Начало активности (дата): 17.11.2025
234567 Кем создан (ID): 989
234567 Ключевые слова: сколиоз, эндопротезирование, мануальные навыкы, диагностическое обследование
12354567899
Похожие статьи
Переходные пояснично-крестцовые позвонки: распространенность различных типов и подтипов патологии (обзор литературы)Несоответствие в длине нижних конечностей у пациентов с коковертабельным синдромом
Валидация системы поддержки принятия решений по определению степени тяжести сколиотической деформации позвоночника при анализе рентгенограмм
12.11.2025 12:47:40



