 23.10.2025
23.10.2025
Тактика превентивной коррекции критической респираторной недостаточности у больных резектабельными формами рака легкого в сочетании с хронической обструктивной болезнью легких
По данным литературы, частота встречаемости РЛ и ХОБЛ составляет среди мужского населения 72,8 % и 52,5 % среди женщин
АКТУАЛЬНОСТЬ
Мультимодальная противоопухолевая терапия рака легкого (РЛ) с использованием органосохраняющего хирургического подхода в сочетании с различными лучевыми и лекарственными методиками, несомненно, создает предпосылки для улучшения показателей выживаемости больных фактически на всех стадиях заболевания [1]. Тем не менее РЛ устойчиво лидирует по показателям заболеваемости и смертности среди населения России и мира. Известно, что эффективность противоопухолевой терапии зависит от морфологической характеристики, стадии заболевания, а также от наличия сопутствующей патологии и степени компенсаторных возможностей организма [2]. В данном контексте сочетание РЛ и хронической обструктивной болезни легких (ХОБЛ) нередко является причиной отказа от радикального хирургического лечения, которое сопряжено с высоким риском летального исхода у этих пациентов [3].
В информационном источнике Global strategy for the diagnosis, management and prevention of chronic obstructive pulmonary disease (2023) отмечается, что ХОБЛ диагностируется у 15-25 % взрослого населения и занимает 4-е место среди основных причин смерти в мире [4]. ХОБЛ - прогрессирующее заболевание, которое характеризуется продолжительным воспалительным процессом, стойкой бронхиальной обструкцией с выраженными изменениями респираторной функции и значительными экстрапульмональными осложнениями [5].
По обобщенным данным литературы, частота встречаемости РЛ и ХОБЛ составляет среди мужского населения 72,8 % и 52,5 % среди женщин. Сложная патология представляет собой два комор- бидных заболевания с похожими патогенетическими механизмами формирования патологических процессов в бронхолегочной системе, обусловленных индуцированным ингаляционным воздействием повреждающих факторов [3, 5]. Сочетание РЛ и ХОБЛ является причиной значительного снижения респираторных резервов у онкологического больного, что, несомненно, приводит к увеличению частоты осложнений и повышению риска летального исхода в ходе их лечения [6]. Наличие тяжелых форм ХОБЛ III и IV стадии у этих больных фактически переводит их в категорию инкурабельных. Согласно клиническим рекомендациям лечения РЛ, больные с ограниченными параметрами форсированная жизненная емкость легких менее 50 % и объемом форсированного выдоха за 1 секунду менее 50 % от должной величины относятся к функциональнонеоперабельным. В таких случаях рекомендовано проведение радикального хирургического лечения лишь в небольших объемах - атипичная резекция легкого или сегментэктомия, что, несомненно, не исключает рецидивирование опухоли и не гарантирует полного излечения данных больных [7]. Прослежено, что в раннем послеоперационном периоде прогрессирование ХОБЛ наблюдается в 34 % случаев. Помимо этого, к выраженному респираторному дефициту в 17-39 % случаев приводит послеоперационная пневмония, плеврит и эмпиема плевры - в 5-13 % случаев, острое повреждение легкого/легких - в 3 % случаев. Значительную долю осложнений 38 % случаев представляет кардиальная декомпенсация с клинической манифестацией в виде респираторного компонента [6].
В случаях проведения полноценного хирургического лечения следует учитывать первостепенную причину тяжести течения ХОБЛ и максимально упредить развитие послеоперационных осложнений и летального исхода у этих больных. Особое значение приобретает факт возникновения дыхательной недостаточности (ДН) в первые часы послеоперационного периода, когда организм больного должен в краткосрочный период компенсировать респираторный дефицит [8].
Известно, что ДН у больных РЛ с ХОБЛ в послеоперационном периоде на фоне перечисленных патологических изменений чаще всего развивается стремительно и требует неотложных мероприятий по адекватному замещению респираторной функции. По данным Burton B. N. и соавт. (2018), наличие ХОБЛ у мужчин в возрасте старше 65 лет, курение в анамнезе, состояние физического статуса по шкале Американского общества анестезиологов (American Association of Anaesthetists (ASA)) 4 и более баллов, одышка при незначительной физической нагрузке, а также продолжительность хирургического вмешательства значимо влияют на частоту незапланированных/экстренных интубаций у пациентов после торакотомических операций. При этом есть результаты исследований, утверждающие, что проведение внеплановой интубации способствует увеличению пребывания пациента в отделении интенсивной терапии и стационаре, может быть причиной повторной операции, а также достоверно связано с 30-дневной летальностью [9].
Цель исследования: продемонстрировать эффективность превентивной пункционнодилятационной трахеостомии (ПДТ) и адаптированных-интеллектуальных режимов ИВЛ в предупреждении критических респираторных осложнений у больных РЛ с тяжелыми проявлениями ХОБЛ (III и IV стадии).
В то же время необходимо учитывать, что искусственная вентиляция легких (ИВЛ) с экстренной интубацией трахеи является крайне агрессивной процедурой для любого больного.
Исследования Ramachandran S. K. и соавт. (2011) показали, что реинтубация после операций некардиального характера напрямую связана с 9-кратным увеличением летального исхода у этих пациентов [10]. Высокая вероятность развития декомпенсированной ДН с возможными неблагоприятными последствиями для больных РЛ с тяжелыми формами ХОБЛ побуждают к поиску методов соизмеримого замещения респираторной функции в раннем послеоперационном периоде, предпочтительно с незамедлительной реализацией и высокой эффективностью.
Клинический случай 1
Больной В., 66 лет был направлен в клиникодиагностическое отделение ФГБУ «Национальный медицинский исследовательский центр онкологии» Министерства здравоохранения Российской Федерации для обследования и лечения. Основные жалобы больного: периодический подъем температуры тела, длительный кашель, одышка. Обследование больного: 1. Фибробронхоскопия: опухоль верхней доли левого легкого. 2. Результат гистологического исследования биоптата опухоли: плоскоклеточная карцинома. 3. Позитронноэмиссионная томография органов грудной клетки: опухоль верхней доли левого легкого 6,2 х 6,6 см с распадом и поражением верхнедолевого бронха. 4. Оценка функции внешнего дыхания - жизненная емкость легких 40,69 %, форсированная жизненная емкость легких 40,76 %, объем форсированного воздуха при выдохе за 1 секунду 41,29 %, значительное снижение всех показателей. 5. Эхокардиография: фракция выброса 52 %; гипертрофия миокарда левого желудочка, систолическая функция левого желудочка скомпенсирована, уплотнение стенок аорты, дилатация левого предсердия, аритмогенная недостаточность митрального клапана. Установлен основной клинический диагноз: центральный рак верхней доли левого легкого клиническая группа 2.
Сопутствующий диагноз: ХОБЛ Ill стадия; ИБС: аритмический вариант, постоянный нормосистолический тип фибрилляции предсердий с эпизодами асистолии более 3500 мс (имплантированный электрокардиостимулятор); Хроническая сердечная недостаточность II A, функциональный класс 2; Гипертоническая болезнь 3 стадии, риск 3.
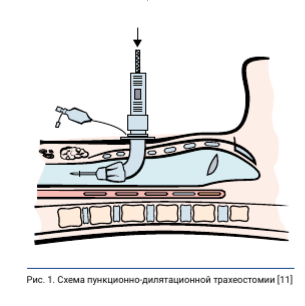
Решением консилиума врачей ФГБУ «Национальный медицинский исследовательский центр онкологии» Министерства здравоохранения Российской Федерации в соответствие с клиническими рекомендациями и стандартами лечения больному В. рекомендовано хирургическое лечение в объеме верхней лобэктомии слева. Учитывая исходный респираторный дефицит, связанный с субкомпен- сированным течением ХОБЛ, с больным согласовано проведение превентивной ПДТ сразу после торакопластической операции. Добровольное информированное согласие на проведение лечения и использование персональных данных в научных целях у больного получено. В условиях мультимодальной комбинированной анестезии больному проведена операция верхняя лобэктомия слева. Предварительно в асептических условиях выполнена катетеризация эпидурального пространства на уровне Th3-Th4 для дозированного введения 0,25 % раствора ропивакаина эластомерной помпой со скоростью 7 мл/час. После того как верхняя доля левого легкого была удалена и проведен адекватный пневмостаз, больной был переведен на двулегочную ИВЛ в режиме управления по давлению с постоянной принудительной вентиляцией. Заданный дыхательный объем составлял 460 мл, частота дыхания (ЧД) 16 в минуту, минутный объем дыхания (МОД) 4,9 л/мин, фракция кислорода во вдыхаемой смеси (Fraction of Inspired Oxygen FiO2) 45 %, насыщение SpO2 97 %. Газовый состав артериальной крови при этом соответствовал нормальным показателям: рСО2 4,2 мм рт. ст., р02135 мм рт. ст., pH 7,332, BE 5,4 ммоль/л, HCO3 29,2 ммоль/л, SpO2 92 %. Контролировали данные показатели в связи с исходным заболеванием ХОБЛ тяжелой степени тяжести, а также из-за значительного снижения площади оксигенирующей поверхности, как следствие полной резекции анатомической доли левого легкого. После завершения операции на легком в условиях продолжающейся анестезии было проведено дополнительное хирургическое вмешательство - превентивная ПДТ. Для этого в анатомической зоне выше или ниже относительно перешейка щитовидной железы производился небольшой разрез с последующей пункцией адаптированной иглой 14 G с канюлей. Затем по тонкому проводнику в трахею вводили винтообразный буж и формировали стому [11] (рис. 1). Следует указать преимущества ПДТ.
Это минимизация травмы трахеи и инфицирования окружающих тканей. Дилятационная трахеостомия значительно снижает развитие легочных инфекций, уменьшает сроки госпитализации пациентов в отделении реанимации и интенсивной терапии [12].
На момент окончания операции, в связи с высокой вероятностью развития критической ДН, респираторное обеспечение больного было продолжено в режиме вспомогательной-принудительной вентиляции по давлению (Pressure support ventilation (PCV)). При этом в режиме ИВЛ на каждое дыхательное усилие больного аппарат инициирует вспомогательный вдох. Под контролем динамики газового состава крови, через 6 часов после операции больной переведен в режим синхронизированная перемежающаяся принудительная вентиляция (Synchronized Intermittent Mandatory Ventilation (SIMV)). В данном режиме при недостаточном самостоятельном дыхании больного запрограммирован внеочередной аппаратный вдох. Отсутствие оро- трахеальной интубационной трубки обеспечивало более комфортную и функционально адекватную вентиляцию без дополнительной седации пациента. Больной находился на ИВЛ в полном сознании, признаки дискомфорта отсутствовали. Однако по показателям газового состава крови у больного был выявлен определенный дефицит газообмена. При индивидуальном подборе параметров вспомогательной ИВЛ пациенту комфортнее всего было в режиме синхронизированной вентиляционной поддержки по давлению с фиксированным объемом (Synchronized Intermittent Mandatory Ventilation- Volume Guarantee (SIMV-VG)). Этот режим вентиляции восприимчив к минимальными дыхательными усилиями больного с возможностью максимальной коррекцией респираторного обеспечения. При этом больной не испытывал лишнего мышечного напряжения и функционального дискомфорта. В течение двух суток признаков нарастания гипоксии и гиперкапнии не зафиксировано. При появлении устойчивой динамики самостоятельных инспираторных усилий без признаков мышечного истощения пациент был переведен в режим спонтанной вентиляции с постоянным положительным давлением в дыхательных путях в конце выдоха. Преимуществом данного режима вентиляции является гарантированное обеспечение газообмена, что обеспечивается инициацией аппаратной дыхательной поддержки в случаях изменения механики дыхания пациента. При проведении теста спонтанного дыхания для больных ХОБЛ (ЧД 24 в минуту, SpO2 > 88 % и PaO2 > 65 мм рт. ст., отсутствие отрицательной динамики показателей гемодинамики и мышечной усталости) пациент В. отлучен от аппаратной вентиляции. Далее, кислородо-воздушная смесь в условиях трахеостомии подавалась высокопоточным генератором AIRVO-2 (поток 5 л/мин, температура 35°, FiO2 45 %) на этом фоне насыщение кислородом крови составило 97 %. В раннем послеоперационном периоде больной получил стандартную медикаментозную терапию, которая включала либеральную инфузионную, антибактериальную и ингаляционную терапию (муколитики и бронходилататоры), профилактику тромбогенных осложнений. За всё время нахождения больного на заместительной респираторной поддержке жизнеугрожающих осложнений зафиксировано не было. Несколько эпизодов нарушения ритма купированы в короткий срок, тромбогенные осложнения отсутствовали. На 8-е сутки больной переведен в хирургическое отделение для продолжения планового лечения.
Клинический случай 2
Больной П., 68 лет обратился в клиникодиагностическое отделение ФГБУ «Национальный медицинский исследовательский центр онкологии»
Министерства здравоохранения Российской Федерации с жалобами на длительный и малопродуктивный кашель, одышку. После комплексного обследования выявлен центральный рак левого легкого, клиническая группа 2. Сопутствующий диагноз: ХОБЛ III стадия; Стенокардия напряжения, функциональный класс 3. Гипертоническая болезнь 3 стадии, риск 3. Больному, согласно стандартам лечения, рекомендовано хирургическое лечение в объеме верхняя лобэктомия слева. Некоторые данные исследований: 1. Гистологический анализ: плоскоклеточная карцинома. 2. Значительные нарушения функции внешнего дыхания. 3. Эхокардиография: мультифокальное атеросклеротическое поражение коронарных артерий, стеноз устья левой коронарной артерии до 50 %. После всестороннего обследования больному выполнена операция: торакотомия, верхняя лобэктомия слева. Этапы операции и анестезиологическое обеспечение соответствовали стандартам лечебной помощи больным РЛ. С учетом исходных кардиальных нарушений и явного дефицита показателей респираторной функции, первые сутки после операции больной находился на продленной ИВЛ. Вентиляционное обеспечение осуществлялось по средствам стандартной интубации трахеобронхиального дерева однопросветной интубационной трубкой. На вторые сутки после операции при полном восстановлении сознания и мышечного тонуса, а также нормальных показателей газового состава артериальной крови больной экстубирован и переведен на неинвазивную вентиляцию легких (НИВЛ). В течение суток клинико-лабораторных нарушений не было. Тем не менее, к концу третьих суток после операции отмечен эпизод синусовой тахиси- столии, который сопровождался критической гипотонией и выраженным респираторным дефицитом. Несмотря на активную оксигенотерапию, насыщение крови кислородом крови стремительно снижалось. Проведена интенсивная терапия, направленная на восстановление нормального сердечного ритма и параметров артериального давления. Для предотвращения критической респираторной недостаточности в экстренном порядке выполнена интубация трахеи эндотрахеальной трубкой. В течение суток состояние больного было крайне тяжелым, без признаков стабилизации. Решением консилиума врачей ФГБУ «Национальный медицинский исследовательский центр онкологии» Министерства здравоохранения Российской Федерации рекомендовано выполнить дополнительное вмешательство в объеме трахеостомии.
Последующие 16 суток больной находился на ИВЛ с различными адаптированными режимами. При самостоятельном респираторном обеспечении без выраженного клинико-лабораторного дефицита больной отлучен от ИВЛ и переведен на НИВЛ высокопоточным генератором AIRVO-2 в условиях трахеостомии. На 20-е сутки больной в стабильном состоянии переведен в хирургическое отделение. Однако на 22-е сутки у него зафиксирован эпизод нарушения сердечного ритма с признаками гемодинамического и респираторного дефицита. Больной в экстренном порядке госпитализирован в отделение реанимации для коррекции критических нарушений. Объективные данные: сознания оглушение I, кожные покровы бледные, цианотичные, гемодинамика с тенденцией к гипотензии, АД 67/52 мм рт. ст., ЧСС 128 в минуту, фибрилляция предсердий, SpO2 76 %. После экстренной инсуффляции увлажненной кислородо-воздушной смесью высокопоточным аппаратом AIRVO-2 c заданными параметрами: поток 38 л/мин, температура 32°, FiO2 75 % отмечено быстрое восстановление SpO2 до уровня 93 %. Последующие сутки параметры Airvo: FiO2—40 %, поток - 26 л/мин, при этом SpO2 98 %. Больной еще 3 суток находился в отделении реанимации и интенсивной терапии, затем при полной стабилизации функционального состояния переведен в профильное отделение для продолжения лечения.
ОБСУЖДЕНИЕ
В приведенных клинических примерах рассматриваются подходы радикального хирургического лечения РЛ у больных с крайне низкими функциональными респираторными резервами, обусловленными суб- и декомпенсированным течением ХОБЛ (III и IV стадии).
При резектабельных формах РЛ стандартное хирургическое лечение предусматривает удаление или резекцию легкого, что снижает общую площадь дыхательной поверхности легочной ткани и оксигенацию.
Данная ситуация наиболее опасна для пациентов с ХОБЛ, у которых в послеоперационном периоде имеет место бронхоконстрикция и усугубление обструктивных проявлений в легких с уже исходно измененным газообменом. Эти изменения сопровождаются критическим нарушением вентиляционно-перфузионного отношения, т. е. альвеолярной вентиляции и сердечного выброса с усугублением гипоксии [3]. Помимо этого, любые факторы, вызывающие усиленные нагрузки на дыхательную мускулатуру (нарушение эвакуации бронхиального секрета, повышение гиперинфляции легких) снижают альвеолярную вентиляцию и приводят к нарастанию гиперкапнии. Повышенная легочная гиперинфляция приводит к увеличению положительного давления в конце выдоха, что также увеличивает нагрузку на респираторный аппарат и повышает респираторное усилие. Возникает замкнутая цепь патологических реакций с отсутствием адекватного газообмена и развитием тканевой гипоксии [8]. Недостаточность активной дренажной функции бронхолегочной системы на фоне затяжного воспалительного процесса в бронхах, изменение архитектоники нормального кровотока и формирование ателектазированных участков в ткани легкого дополнительно осложняет ситуацию. В результате малоэффективное обогащение органов кислородом приводит к каскаду неконтролируемых реакций с фатальными последствиями для больного [3]. По нашему мнению, избежать жизнеугрожающее осложнение респираторного характера на ранних сроках после операции и вместе с тем снизить летальность возможно при рациональном применении искусственной вентиляционной поддержки в условиях упреждающей ПДТ.
Данные клинические примеры демонстрируют очевидное преимущество превентивной ПДТ, которая позволяет своевременно менять тактику респираторного обеспечения в раннем послеоперационном периоде и лечения в целом (клинический случай 1). Плановое проведение ПДТ позволяет избежать экстренных мероприятий по замещению респираторной функции без повторной и агрессивной трансларингеальной интубации трахеи, а применение адаптированных-интеллектуальных режимов ИВЛ исключает дополнительную седацию, миоре- лаксацию и анальгезию у больных РЛ с тяжелыми формами ХОБЛ. Клинический случай 2 показывает, что экстренное замещение дыхательной функции больного имеет значительные сложности в плане лечения и прогноза течения заболевания, а также увеличивает продолжительность его нахождения в отделении интенсивной терапии.
По данным открытых источников РФ мы не обнаружили описание подобной медицинской методики. В этой связи авторами предложен и запатентован «Способ профилактики декомпенсированной дыхательной недостаточности после радикального хирургического лечения рака легкого у пациентов с тяжелыми формами хронической обструктивной болезни легких» (Патент на изобретение № 2829259 от 30.10.2024 г.).
ЗАКЛЮЧЕНИЕ
Клинические случаи продемонстрировали эффективность проведения превентивной пункционно-дилятационной трахеостомии и адапти- рованных-интеллектуальных режимов ИВЛ при возникновении ургентных респираторных состояниях с декомпенсацией дыхания у больных резектабельными формами РЛ в сочетании с ХОБЛ. Применение метода представляется перспективным в полноценном противоопухолевом лечении больных РЛ с крайне низкими функциональными резервами, обусловленными суб- и декомпенсированным течением ХОБЛ.
Список источников
1. Кит О. И., Туркин И. Н., Харагезов Д. А., Лазутин Ю. Н., Лейман И. А., Чубарян А. В. И др. Последовательная бронхопластическая верхняя лобэктомия - хирургический компонент мультимодального лечения синхронного двухстороннего первично-множественного немелкоклеточного рака легкого. Сибирский онкологический журнал. 2022;21(3):143-150\
2. Мерабишвили В. М., Юркова Ю. П., Щербаков А. М., Левченко Е. В., Барчук А. А., Кротов Н. Ф. и др. Рак легкого. Заболеваемость, смертность, достоверность учета, локализационная и гистологическая структура (популяционное исследование). Вопросы онкологии. 2021;67(3):361-367
3. McIntyre A, Ganti AK. Lung cancer-A global perspective. J Surg Oncol. 2017 Apr;115(5):550-554
4. Agusti A, Celli BR, Criner GJ, Halpin D, Anzueto A, Barnes P, et al. Global Initiative for Chronic Obstructive Lung Disease 2023 Report: GOLD Executive Summary. Eur Respir J. 2023 Apr;61(4):2300239.
5. Авдеев С. Н., Лещенко И. В., Айсанов З. Р., Архипов В. В., Белевский А. С., Овчаренко С. И. и др. Новые клинические рекомендации по ХОБЛ - смена парадигмы. Терапевтический архив. 2024;96(3):292-29
6. Добнер C. Ю., Федосенко С. В., Родионов Е. О., Яровой Н. Д., Петров В. А., Тузиков С. А. и др. Рак легкого у больных ХОБЛ и факторы, ассоциированные со снижением их выживаемости. Бюллетень сибирской медицины. 2022;21(3):41-49
7. Batchelor TP, Rasburn NJ, Abdelnour-Berchtold E. Guidelines for enhanced recovery after lung surgery: recommendations of the Enhanced Recovery After Surgery Society and the European Society of Thoracic Surgeons. European Journal of Car- dio-thoracic Surgery. 2019; (55):91-115
8. Авдеев С. Н. Патофизиология обострений хронической обструктивной болезни легких. Вестник анестезиологии и реаниматологии. 2019;16(2):75-82
9. Burton BN, Khoche S, A'Court AM, Schmidt UH, Gabriel RA. Perioperative Risk Factors Associated With Postoperative Unplanned Intubation After Lung Resection. J Cardiothorac Vasc Anesth. 2018 Aug;32(4):1739-1746
10. Ramachandran SK, Nafiu OO, Ghaferi A, Tremper KK, Shanks A, Kheterpal S. Independent predictors and outcomes of unanticipated early postoperative tracheal intubation after nonemergent, noncardiac surgery. Anesthesiology. 2011 Jul;115(1):44-53
11. Старков Ю. Г., Лукич К. В., Джантуханова С. В., Плотников Г. П., Замолодчиков Р. Д., Зверева А. А. Опыт эндоскопически ассистированных дилатационных трахеостомий при лечении больных с COVID-19. Хирургия. Журнал им. Н. И. Пирогова. 2020;(12):16-21
12. Письменный В. И., Серегин А. С., Кривощеков Е. П., Романов В. Е., Штейнер М. Л., Цымбалюк В. В. И др. Осложнения трахеостомии и их профилактика у пациентов хирургического профиля. Врач. 2021;32(10):54-5
Информация об авторах:
Розенко Дмитрий Александрович - к.м.н., заведующий отделением анестезиологии и реанимации, ФГБУ «Национальный медицинский исследовательский центр онкологии» Министерства здравоохранения Российской Федерации, г. Ростов-на-Дону, Российская Федерация
Харагезов Дмитрий Акимович - к.м.н., заведующий отделением торакальной хирургии, ФГБУ «Национальный медицинский исследовательский центр онкологии» Министерства здравоохранения Российской Федерации, г. Ростов-на-Дону, Российская Федерация
Попова Наталья Николаевна н - к.м.н., врач анестезиолог-реаниматолог отделения анестезиологии и реанимации, ФГБУ «Национальный медицинский исследовательский центр онкологии» Министерства здравоохранения Российской Федерации, г. Ростов-на-Дону, Российская Федерация; ассистент кафедры онкологии, ФГБОУ ВО «Ростовский государственный медицинский университет» Министерства здравоохранения Российской Федерации, г. Ростов-на-Дону, Российская Федерация
Тихонова Светлана Николаевна - врач анестезиолог-реаниматолог, ФГБУ «Национальный медицинский исследовательский центр онкологии» Министерства здравоохранения Российской Федерации, г. Ростов-на-Дону, Российская Федерация
Смирнов Алексей Андреевич - врач анестезиолог-реаниматолог, ФГБУ «Национальный медицинский исследовательский центр онкологии» Министерства здравоохранения Российской Федерации, г. Ростов-на-Дону, Российская Федерация
Статешный Олег Николаевич - врач-онколог отделения торакальной онкологии, ФГБУ «Национальный медицинский исследовательский центр онкологии» Министерства здравоохранения Российской Федерации, г. Ростов-на-Дону, Российская Федерация
Сугак Елизавета Юрьевна - врач анестезиолог-реаниматолог, ФГБУ «Национальный медицинский исследовательский центр онкологии» Министерства здравоохранения Российской Федерации, г. Ростов-на-Дону, Российская Федерация
Теги: рак легкого
234567 Начало активности (дата): 23.10.2025
234567 Кем создан (ID): 989
234567 Ключевые слова: рак легкого, хроническая обструктивная болезнь легких, респираторная недостаточность, превентивная пункционная трахеостомия, режимы вспомогательной вентиляции легких
12354567899
Похожие статьи
Обьемы хирургического вмешательства среди употребляющих табак пациентов с туберкулезом легкихРентген на дому 8 495 22 555 6 8
Особенности раннего выявления рака легкого в условиях противотуберкулезного диспансера
ИИ-модели превосходят людей в тестах, но спрос на сертифицированных рентгенологов достиг рекорда
Проведено ретроспективное исследование с изучением медицинских документов пациентов противотуберкулезного диспансера, наблюдавшихся по поводу туберкулеза



