 13.07.2025
13.07.2025
Генотип — фенотипическая ассоциация гетерозиготной делеции гена TBX-6 у пациентов с врожденным сколиозом
Врождённый сколиоз — мультифакториальное заболевание, обусловленное нарушением формирования позвоночника в эмбриогенезе. Ген TBX6, расположенный в локусе 16p11.2, играет ключевую роль в сомитогенезе, а его гетерозиготная делеция связана с развитием специфических фенотипов врожденного сколиоза
ВВЕДЕНИЕ
Врождённые деформации позвоночника, к которым относится врождённый сколиоз (ВС), представляют собой актуальную проблему в области детской ортопедии и связаны с нарушением формирования осевого скелета в процессе эмбриогенеза [1]. Критически значимыми причинами, приводящими к порокам развития позвоночного столба, принято считать тератогенные факторы и связанные с ними мутационные повреждения генома, воздействующие на формирование плода в первые 6-8 недель эмбриогенеза [2]. Частота ВС по данным эпидемиологических исследований составляет 0,5-1 случай на 1 000 новорождённых [3].
Аномалии развития позвонков, такие как полупозвонки, бабочковидные позвонки и дефекты сегментации, могут быть причиной прогрессирующей сколиотической и/или кифотической деформации позвоночника, приводящей к нарушению функциональной активности сердечно-сосудистой и дыхательной систем, и формирования неврологического дефицита [4, 5]. Несмотря на успехи, достигнутые в диагностике этой патологии у детей раннего возраста, прогрессирующие формы врожденных искривлений позвоночного столба требуют высокотехнологичного и своевременного хирургического лечения в возрасте до трех лет у значительной части пациентов [6].
Современные достижения в молекулярной генетике позволили выявить гены, ответственные за формирование врождённых деформаций позвоночника и врожденного сколиоза [7, 8, 9]. В частности, ген TBX6 является одним из ключевых факторов, определяющих развитие позвоночного столба, он участвует в процессах сомитогенеза, регулируя формирование параксиальной мезодермы, из которой развиваются позвонки и рёбра [10, 11]. Современные публикации констатируют, что около 7,9-10,6 % наблюдений врождённого сколиоза связаны с мутациями TBX6 и чаще всего развиваются спорадически, при этом семейные случаи описаны у 1-3,4 % пациентов [12]. Исследования на моделях экспериментальных животных подтвердили, что гипоморфные аллели и делеции TBX6 приводят к формированию бабочковидных позвонков и полупозвонков [13].
Объектом данной работы является гетерозиготная делеция в области 16p11.2 хромосомы, затрагивающая участок короткого плеча (р) 16-й хромосомы, на которой расположен ген TBX6. Делеция представляет собой тип генетической мутации, при которой утрачивается тот или иной участок ДНК [14] . В результате этой потери может изменяться структура гена или генов, что приводит к нарушению их функций. Гомозиготная делеция 16р11.2 является летальной для эмбриона [15]. В случае гена TBX6 гетерозиготная делеция и прочие генотипы могут характеризовать тBX6-ассоциированный сколиоз (англ.: TBX6-associated congenital scoliosis, TACS), описанный J. Liu et al. у 52 пациентов китайской популяции [16]. TACS характеризуется специфическими фенотипами и клиническими проявлениями, такими как полупозвонки и бабочковидные позвонки, преимущественно в нижнегрудном и поясничном отделах [16].
Цель работы — определение и подтверждение TACS фенотипа в связи с наличием делеции области 16р11.2 у пациентов российской когорты.
Анализ когорт пациентов в Китае, Японии и США показал, что мутации TBX6 часто ассоциированы с простыми аномалиями формирования позвоночника и редко сопровождаются тяжёлыми дефектами сегментации или интраспинальными аномалиями [17]. Клиническая значимость подобных исследований заключается в разработке предиктивных моделей, таких как TACScore, которые помогают идентифицировать пациентов с высоким риском наличия TACS [18]. Однако исследования гетерозиготной делеции TBX6 и TACS фенотипа в российской и европейской популяциях до сих пор не проведены.
Анализ полученных данных позволяет выявить характерные фенотипы и определить частоту встречаемости в исследуемой группе пациентов, а также оценить возможную корреляцию с сопутствующими аномалиями развития органов и систем.
МАТЕРИАЛЫ И МЕТОДЫ
Дизайн работы представляет собой моноцентровое когортное ретроспективное исследование. Проанализированы результаты молекулярно-генетического и клинического обследования 187 пациентов, проходивших лечение на базе НМИЦ ДТО им. Г.И. Турнера в период с 2012 по 2021 гг.
Критерии включения: верифицированный диагноз «врожденный сколиоз» по данным комплексного клинического и лучевого обследования, отсутствие отягощенного генетического анамнеза, добровольное информированное согласие пациентов или их законных представителей на участие в исследовании.
Критерии невключения: пациенты, в ходе обследования у которых не был подтвержден диагноз «врожденный сколиоз»; верифицированные генетические синдромы у пациентов и/или их родственников, а также отказ пациента или законного представителя от участия в исследовании.
Исследование выполнено в два этапа. В ходе первого этапа осуществляли молекулярно-генетический анализ геномной ДНК, выделенной из лейкоцитов периферической крови пробандов, направленный на поиск делеций в области 16р11.2 хромосомы. Выделение геномной ДНК проводили с использованием коммерческого набора реагентов («Синтол», Москва). Для выявления гетерозиготной делеции гена TBX-6 применен метод мультиплексной количественной полимеразной цепной реакции (ПЦР) в реальном времени (MORT-PCR) с флуоресцентно-мечеными гибридизационными зондами типа TaqMan. ПЦР проводили в 25 мкл смеси, содержащей 1*ПЦР-буфер, 0,5 единиц активности Taq-ДНК-полимеразы SynTaq («Синтол», Москва), 3,5 ммоль/л MgCl2, 200 мкмоль/л каждого dNTP, 5 % диметилсульфоксид, 0,5 % формамид. Реакционная смесь также содержала по 500 нмоль/л каждого олигонуклеотидного праймера и 200 нмоль/л каждого из флуоресцентно-меченых ПЦР-зондов («Евроген», Москва). Анализ выполнялся c использованием системы Bio-Rad CFX96 (Bio-Rad, США).
На втором этапе исследования проанализированы клинические данные отобранных пациентов с целью определения фенотипических проявлений заболевания. Все пробанды разделены на две группы в зависимости от наличия гетерозиготной делеции. Группа генотипа гетерозиготной делеции 16p11.2 составила 42 пациента, группа нормы — 145 пробандов. В анализ включены данные медицинской документации, исследований методами рентгенографии, мультиспиральной компьютерной томографии (МСКТ) и магнитно-резонансной томографии (МрТ).
Для оценки результатов применены методы описательной статистики. Для оценки значимости корреляции применялся коэффициент взаимной сопряженности Пирсона.
РЕЗУЛЬТАТЫ
По результатам выполненной мультиплексной количественной ПЦР в реальном времени (MORT-PCR) из 187 образцов геномной ДНК у 42 пробандов верифицирована гетерозиготная делеция 16p11.2 гена TBX6 (TBX6/null генотип).
На втором этапе исследования проанализированы данные клинического и инструментального обследования групп с гетерозиготной делецией (п = 42) и без нее (нормы) (п = 145) в объеме панорамной рентгенографии позвоночника в положении лежа, данные МСКТ для верификации локализации и варианта аномалии позвонков, данные МРТ с целью исключения интракраниальной патологии. Средний возраст пациентов на момент обследования составил (6,00 ± 2,73) года, из них 79 (42 %) мужчин, 108 (57 %) — женщин.
Локализация аномалий
Анализ локализаций аномалий позвоночника показал, что наиболее часто в обеих группах поражались поясничный и грудной отделы. С учетом большинства пациентов с множественным характером поражения позвоночного столба, пороками развития позвонков, данные представлены по их абсолютному количеству. В группе нормы (рис. 1, а) аномалию развития имели 394 позвонка, из них локализованы в шейном отделе — 33 (8,5 %), в грудном — 288 (73 %), в поясничном — 73 (18,5 %). В группе гетерозиготной делеции (рис. 1, б) зарегистрировано 104 аномальных позвонка, среди них шейных позвонков — 2 (1,9 %), грудных — 78 (75 %), поясничных — 24 (23 %).
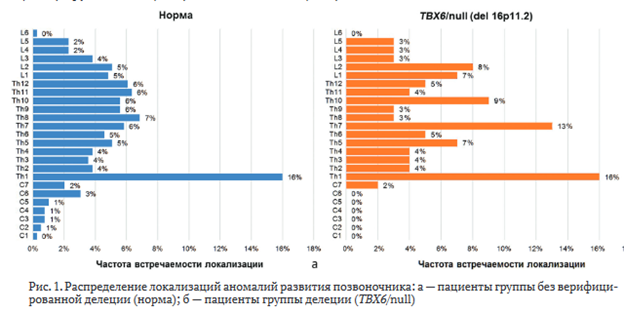
Для определения связи локализации с наличием гетерозиготной делеции применен коэффициент взаимной сопряженности Пирсона. В результате исследования получено положительное значение (0,09), характеризующее тесноту стохастической связи случайных величин, что подтверждает корреляцию между наличием делеции и локализацией аномалий развития.
Типологический анализ
Все пороки развития разделены на типы (варианты) в соответствии с общепринятой классификацией MacEwan, расширенной и дополненной: нарушения формирования позвонков (полупозвонки), нарушения слияния позвонков (бабочковидные позвонки), нарушения сегментации позвонков (несегментированный стержень) и их сочетания. Среди всех обследованных пациентов наиболее часто выявляли единичные изолированные полупозвонки, а именно 63 наблюдения (43,4 %) в группе без верифицированной делеции и 21 наблюдение (50 %) в группе делеции (рис. 2). Разночтения же обнаружены в категориях пациентов с нарушением сегментации (изолированные несегментированные стержни и сочетания несегментированного стержня с полупозвонками и бабочковидными позвонками), суммарно 30,9 % в группе нормы против 21,4 % в группе с наличием делеции.
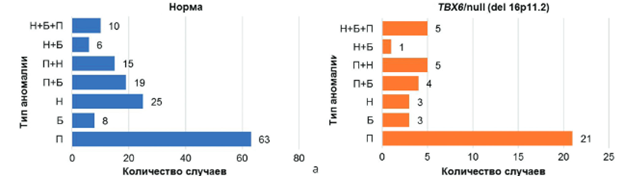
Рис. 2. Распределение типов порока развития позвоночника: а — группа без верифицированной делеции (норма); б — группа гетерозиготной делеции (TBX6/null). Б — бабочковидный позвонок, Н — несегментированный стержень, П — полупозвонок и их сочетания
Множественные пороки развития позвоночника зафиксированы у 51 пациента (35 %) группы нормы, в то время как в группе гетерозиготной делеции зафиксирован 21 случай (50 %). Таким образом, беря во внимание удельный вес множественности поражения позвоночника, можно сделать вывод о более частой встречаемости такого типа аномалий развития у пациентов с гетерозиготной делецией. При уровне значимости p = 0,05 расчётный коэффициент Пирсона получился больше предполагаемого значения (0,109 > 0,090), из чего можно заключить, что существует взаимосвязь между наличием деле- ции и локализацией порока.
Сопутствующие пороки развития
По результатам анализа, предшествующего госпитализации и соматическому обследованию каждого пациента, отдельно определяли сопутствующие врождённой деформации позвоночника, пороки развития других органов и систем (табл. 1): малые аномалии сердца, пороки развития желудочно-кишечного тракта и мочевыделительной системы.
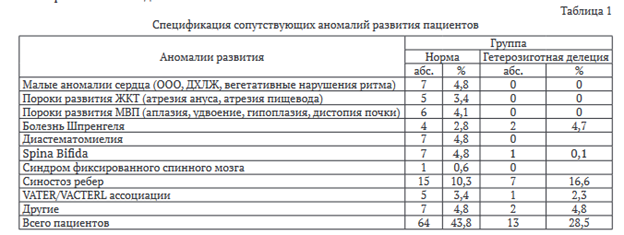
Со стороны ортопедической патологии рассматривали болезнь Шпренгеля, диастематомиелию, Spina Bifida, синдром фиксированного спинного мозга, VATER и VACTERL ассоциации, синостозы ребер и другие пороки развития (единичные случаи наличия изолированных тарзальных коалиций, синдрома каудальной регрессии, брахидактилии, аплазии пальцев кисти, полидактилии, синдрома Чарга - Стросса, гипофизарного нанизма, миопии высокой степени, липомиелиоменингоцеле).
ОБСУЖДЕНИЕ
По результатам исследования, гетерозиготная делеция гена TBX6 в локусе 16p11.2 выявлена у 22,4 % пациентов с верифицированным диагнозом врождённого сколиоза. Этот показатель превышает данные мировой литературы, где частота ТВХ6-ассоциированных мутаций варьирует от 7,9 % до 10,6 % в китайской, японской и североамериканской популяции [17]. Хромосомная локализация делеций и дупликаций, а именно область 16р11.2, как причина развития фенотипа врожденного сколиоза, также подтверждена в исследовании H. Al-Kateb et al. [19]. В своей публикации N. Wu et al. [17] сообщают, что влияние и частота встречаемости мутаций ТВХ6, определяющих развитие врожденного сколиоза, различается в зависимости от популяции, что указывает на возможное взаимодействие с другими генетическими и средовыми факторами. По нашему мнению, более высокая частота мутации в российской когортной выборке может быть обусловлена региональными особенностями популяции. С учетом полученных данных интерес представляет более расширенный генетический профиль пациентов в группе с наличием делеции.
Анализ локализации пороков развития позвоночника выявил преимущественное поражение грудного и поясничного отделов позвоночника как у пациентов с ТВХ6-делецией, так и без неё. Однако в группе с гетерозиготной делецией аномалии в шейном отделе позвоночника не зарегистрированы, в то время как доля аномалий этой локализации в группе нормы составила 8,4 %. Это соответствует результатам исследований J.Liu et al. где также отмечалось выраженное преобладание поражений в нижнегрудном и поясничном отделах при TACS фенотипе [16]. Такой характер локализации может быть связан с функцией гена ТВХ6 в сомитогенезе, который особенно критичен для формирования параксиальной мезодермы на данных уровнях позвоночного столба [20]. Гетерозиготная делеция ТВХ6 приводит к снижению экспрессии гена, что может нарушать процесс сегментации и формирования позвонков[21]. В исследовании P.H. White et al. показано, что снижение уровня ТВХ6 у мышей приводит к дефектам в формировании сомитов, что коррелирует с наблюдаемыми у пациентов с аномалиями позвоночника [22].
Типологический анализ выявил, что полупозвонки являются наиболее частым вариантом скелетных аномалий как у пациентов с ТВХ6-делецией (50 %), так и без неё (43,4 %). Этот результат согласуется с данными исследований J. Liu et al., подчёркивающими важность данной морфологической характеристики для определения тактики лечения пациента с врожденным сколиозом и дальнейшим динамическим наблюдением [23]. В группе с гетерозиготной делецией реже регистрировали изолированные нарушения сегментации (7,2 % против 17,2 % в группе нормы), что также отражает специфику ТВХ6-ассоциированных аномалий, описанную в исследованиях N. Yang et al., где авторы сообщают, что гетерозиготные мутации ТВХ6 приводят к снижению экспрессии гена, но не до критического уровня, необходимого для возникновения сложных дефектов сегментации [24].
Множественные аномалии позвоночника выявлены у 50 % пациентов с ТВХ6-делецией, что значительно превышает аналогичный показатель в группе нормы (35 %). Это согласуется с результатами исследований J. Liu et al. [23], N. Wu et al. [25] и X. Feng et al. [26], где множественные пороки позвоночника также чаще встречались у пациентов с ТВХ6-мутациями. Такая картина подчёркивает более сложный характер поражений у данной группы пациентов, что имеет клиническое значение с точки зрения прогнозирования течения заболевания и планирования хирургического лечения [27].
Сопутствующие пороки развития внутренних органов, включая аномалии сердечно-сосудистой, мочевыделительной и пищеварительной систем, реже встречались у пациентов с ТВХ6-делецией по сравнению с группой нормы. Эти результаты частично противоречат данным J. Liu et al. [16] о высокой частоте сочетанных системных аномалий, что может свидетельствовать о региональных или методологических различиях. Кроме того, полученные результаты не исключают наличие других мутационных повреждений генома в группе нормы, например, микроделеций или полиморфизмов других генов. Необходимо отметить, что в систематическом обзоре J.E. Powel et al. сообщается о более частом обнаружении пороков развития сердца среди пациентов с мутациями TBX-6. [28] Однако такие ортопедические аномалии, как синостозы рёбер (16,6 %) и болезнь Шпренгеля (4,7 %), более характерны для TACS, что подтверждают данные N. Otomo et al. о более часто встречающихся синостозах и гипоплазий или аплазий ребер у пациентов с делециями ТВХ6 [29]. В исследовании I. Panigrahi et al. [30] проанализированы серии клинических наблюдений пациентов с врожденным сколиозом и болезнью Шпренгеля, в которых выявлена положительная корреляция между наличием мутаций ТВХ6 и патологическим положением лопатки. Y. Yang et al. сообщают, что возникновение сложных форм врожденного сколиоза, зачастую ассоциированных с пророками развития других органов и систем, может являться причиной сложного олигогенного влияния [31].
Представленное нами исследование имеет ряд ограничений. Во-первых, выборка пациентов ограничена одной клиникой, что снижает возможность экстраполяции результатов на более обширные выборки пациентов. Кроме того, отсутствие возможностей полногеномного секвенирования ограничивает горизонт поиска этиопатогенетических обоснований наличия прочих сопутствующих аномалий развития в группах исследования.
В ходе дальнейших исследований планируется расширение когорты пациентов с целью изучения региональных и этнических особенностей пациентов с TACS. Дополнительно предполагается проведение исследования для оценки влияния гетерозиготных мутаций TBX6 на возникновение диспластического характера течения врожденного сколиоза. Это позволит уточнить механизмы патогенеза и улучшить подходы к ранней диагностике патологического состояния и лечению пациентов с данной патологией.
ЗАКЛЮЧЕНИЕ
Полученные данные подтверждают, что ТВХ6-ассоциированный сколиоз характеризуется пороками развития позвонков, локализованными преимущественно в грудном и поясничном отделах позвоночника, с преобладанием полупозвонков. Высокая частота синостозов рёбер и множественных аномалий требует дальнейшего изучения с целью уточнения прогностической ценности данных признаков.
СПИСОК ИСТОЧНИКОВ
Tikoo A, Kothari MK, Shah K, Nene A. Current Concepts - Congenital Scoliosis. Open Orthop J. 2017;11:337-345. doi: 10.2174/18743 25001711010337.
Mackel CE, Jada A, Samdani AF, et al. A comprehensive review of the diagnosis and management of congenital scoliosis. Childs Nerv Syst. 2018;34(11):2155-2171. doi: 10.1007/s00381-018-3915-6.
Ульрих Э. В., Мушкин А. Ю., Губин А. В. Врожденные деформации позвоночника у детей: прогноз эпидемиологии и тактика
ведения. . 2009;(2):055-061. doi: 10.14531/ss2009.2.55-61.
Redding G, Song K, Inscore S, et al. Lung function asymmetry in children with congenital and infantile scoliosis. Spine J. 2008;8(4):639-644. doi: 10.1016/j.spinee.2007.04.020.
Rong T, Jiao Y, Huang Y, et al. Morphological analysis of isolated hemivertebra: radiographic manifestations related to the severity of congenital scoliosis. BMCMusculoskeletDisord. 2024;25(1):112. doi: 10.1186/s12891-024-07193-8.
Виссарионов С.В., Кокушин Д.Н., Белянчиков С.М., Ефремов А.М. Хирургическое лечение детей с врожденной деформацией верхнегрудного отдела позвоночника. Хирургия позвоночника. 2011;(2):035-040. doi: 10.14531/ss2011.2.35-40.
Sparrow DB, Chapman G, Smith AJ, et al. A mechanism for gene-environment interaction in the etiology of congenital scoliosis. Cell. 2012;149(2):295-306. doi: 10.1016/j.cell.2012.02.054.
Giampietro PF. Genetic aspects of congenital and idiopathic scoliosis. Scientifica (Cairo). 2012;2012:152365. doi: 10.6064/2012/152365.
Pahys JM, Guille JT. What's New in Congenital Scoliosis? J Pediatr Orthop. 2018;38(3):e172-e179. doi: 10.1097/BPO.0000000000000922.
Naiche LA, Harrelson Z, Kelly RG, Papaioannou VE. T-box genes in vertebrate development. Annu Rev Genet. 2005;39:219-39. doi: 10.1146/annurev.genet.39.073003.105925.
Veenvliet JV, Bolondi A, Kretzmer H, et al, Timmermann B, Meissner A, Herrmann BG. Mouse embryonic stem cells self-organize into trunk-like structures with neural tube and somites. Science. 2020;370(6522):eaba4937. doi: 10.1126/science.aba4937.
Zhang W, Yao Z, Guo R, et al. Molecular identification of T-box transcription factor 6 and prognostic assessment in patients with congenital scoliosis: A single-center study. Front Med (Lausanne). 2022;9:941468. doi: 10.3389/fmed.2022.941468.
Ren X, Yang N, Wu N, et al. Increased TBX6 gene dosages induce congenital cervical vertebral malformations in humans and mice. J Med Genet. 2020;57(6):371-379. doi: 10.1136/jmedgenet-2019-106333.
Wu Y, Zhang L, Lv H, et al. Applying high-throughput sequencing to identify and evaluate foetal chromosomal deletion and duplication. J Cell Mol Med. 2020;24(17):9936-9944. doi: 10.1111/jcmm.15593.
Blaker-Lee A, Gupta S, McCammon J, et al. Zebrafish homologs of genes within 16p11.2, a genomic region associated with brain disorders, are active during brain development, and include two deletion dosage sensor genes. Dis Model Mech. 2012;5(6):834-851. doi: 10.1242/dmm.009944.
Liu J, Wu N, Yang N, et al. TBX6-associated congenital scoliosis (TACS) as a clinically distinguishable subtype of congenital scoliosis: further evidence supporting the compound inheritance and TBX6 gene dosage model. Genet Med. 2019 Jul;21(7):1548-1558. doi: 10.1038/s41436-018-0377-x.
Wu N, Giampietro P, Takeda K. The genetics contributing to disorders involving congenital scoliosis. In: Kusumi K, Dunwoodie S, (eds). The Genetics and Development of Scoliosis. Springer, Cham; 2018. doi: 10.1007/978-3-319-90149-7_4.
Chen Z, Yan Z, Yu C, et al. Cost-effectiveness analysis of using the TBX6-associated congenital scoliosis risk score (TACScore) in genetic diagnosis of congenital scoliosis. Orphanet J Rare Dis. 2020;15(1):250.
Al-Kateb H, Khanna G, Filges I, et al. S Scoliosis and vertebral anomalies: additional abnormal phenotypes associated with chromosome 16p11.2 rearrangement. Am J Med Genet A. 2014;164A(5):1118-1126. doi: 10.1002/ajmg.a.36401.
Errichiello E, Arossa A, Iasci A, et al. An additional piece in the TBX6 gene dosage model: A novel nonsense variant in a fetus with severe spondylocostal dysostosis. Clin Genet. 2020;98(6):628-629. doi: 10.1111/cge.13854.
Lefebvre M, Duffourd Y, Jouan T, et al. Autosomal recessive variations of TBX6, from congenital scoliosis to spondylocostal dysostosis. Clin Genet. 2017;91(6):908-912. doi: 10.11n/cge.12918.
White PH, Farkas DR, McFadden EE, Chapman DL. Defective somite patterning in mouse embryos with reduced levels of Tbx6. Development. 2003;130(8):1681-1690. doi: 10.1242/dev.00367.
Liu J, Chen W, Yuan D, et al. Progress and perspective of TBX6 gene in congenital vertebral malformations. Oncotarget. 2016;7(35):57430-57441. doi: 10.18632/oncotarget.10619.
Yang N, Wu N, Zhang L, et al. TBX6 compound inheritance leads to congenital vertebral malformations in humans and mice. Hum Mol Genet. 2019;28(4):539-547. doi: 10.1093/hmg/ddy358.
Wu N, Ming X, Xiao J, et al. TBX6 null variants and a common hypomorphic allele in congenital scoliosis. N Engl J Med. 2015;372(4):341-50. doi: 10.1056/NEJMoa1406829.
Feng X, Cheung JPY, Je JSH, et al. Genetic variants of TBX6 and TBXT identified in patients with congenital scoliosis in Southern China. JOrthopRes. 2021;39(5):971-988. doi: 10.1002/jor.24805.
Zhao S, Zhang Y, Chen W, et al. Diagnostic yield and clinical impact of exome sequencing in early-onset scoliosis (EOS). J Med Genet. 2021;58(1):41-47. doi: 10.1136/jmedgenet-2019-106823.
Powel JE, Sham CE, Spiliopoulos M, et al. Genetics of non-isolated hemivertebra: A systematic review of fetal, neonatal, and infant cases. Clin Genet. 2022;102(4):262-287. doi: 10.11n/cge.14188.
Otomo N, Takeda K, Kawai S, et al. Bi-allelic loss of function variants of TBX6 causes a spectrum of malformation of spine and rib including congenital scoliosis and spondylocostal dysostosis. J Med Genet. 2019;56(9):622-628. doi: 10.1136/jmedgenet-2018-105920.
Panigrahi I, Angurana SK, Varma H, et al. Phenotypic heterogeneity of kyphoscoliosis with vertebral and rib defects: a case series. Clin Dysmorphol. 2019;28(3):103-113. doi: 10.1097/MCD.0000000000000269.
Yang Y, Zhao S, Zhang Y, et al. Mutational burden and potential oligogenic model of TBX6-mediated genes in congenital scoliosis. Mol Genet Genomic Med. 2020;8(10):e1453. doi: 10.1002/mgg3.1453.
Информация об авторах:
Сергей Егорович Хальчицкий — кандидат биологических наук, заведующий лабораторией
Сергей Валентинович Виссарионов — доктор медицинских наук, профессор, член-корреспондент РАН, директор
Полина Андреевна Першина — аспирант
Константин Григорьевич Буслов — кандидат биологических наук, научный сотрудник
Юрий Алексеевич Новосад — научный сотрудник
Марина Ваниковна Согоян — научный сотрудник,
Марат Сергеевич Асадулаев — кандидат медицинских наук, научный сотрудник
Марина Вячеславовна Герцык — студент
Теги: инфекция
234567 Начало активности (дата): 13.07.2025
234567 Кем создан (ID): 989
234567 Ключевые слова: генотип, ген TBX-6, сколиоз
12354567899
Похожие статьи
Проявление гетерогенности хронической обструктивной болезни легких в фенотипахРентген на дому 8 495 22 555 6 8
Механизм наследования идиопатического сколиоза
Федеральные клинические рекомендации по организации и проведению микробиологической и молекулярно-генетической диагностики туберкулеза
Курс медицинской рентгенологии.Рентгенологическое исследование органов кровообращения(сердца и больших сосудов).Часть 2. Глава 8.2



