 23.06.2025
23.06.2025
Возможности ультразвукового исследования толстой кишки в определении тяжелого течения и прогноза рецидивов энтероколита, вызванного Clostridioides difficile
Установлено, что при антибиотик-ассоциированной диарее распространенное утолщение кишечной стенки величиной более 3,2 мм по данным УЗИ наблюдается при энтероколите, вызванном Cl. difficile
Введение
Прогресс визуализационных методов диагностики с использованием не только описательного, но и аналитического подхода позволяет раскрыть нюансы клинических ситуаций, что в конечном итоге влияет на парадигму ведения пациентов [1-3]. Одной из клинических проблем, связанных с неинвазивной диагностикой заболеваний кишечника, является антибиотик-ассоциированная диарея (ААД). Среди ААД в стационарах наиболее опасным вариантом с возможным летальным исходом является энтероколит, вызываемый микроорганизмом Clostridioides difficile (Cl. difficile) [4, 5]. Эта инфекция, заболеваемость которой неуклонно растет во всем мире, считается наиболее частой из внутрибольничных в Европе [4, 6, 7]. Пандемия COVID-19 существенно увеличила заболеваемость энтероколитом, вызванным Cl. difficile [8, 9].
Цель исследования: определить ультразвуковые признаки тяжелого течения и критерии прогнозирования рецидива энтероколита, вызванного Clostridioides difficile (Cl. difficile), а также возможности разграничения клинически незначимой антибиотик-ассоциированной диареи от ее варианта с клостридиальной инфекцией. Поставленная цель предполагала изучение пациентов с COVID-19 и без такового.
Хотя диагностика клостридиального энтероколита, который иногда называют псевдомембранозным колитом (ПМК), осуществляется клиническими, лабораторными, эндоскопическими и морфологическими методами, при компьютерной томографии (КТ) и ультразвуковом исследовании (УЗИ) изменения кишечной стенки были обнаружены около 40 лет назад [6, 10-12]. В последние годы наблюдается резкий рост интереса к трансабдоминальной ультразвуковой диагностике (УЗД) заболеваний кишечника, или интестинальной эхографии [13, 14]. Российские и зарубежные исследователи достаточно детально описали ультразвуковую симптоматику ПМК, причем отметили большую важность проблемы в хирургической практике [15-18].
Разработанные на сегодняшний день варианты терапии и дозировки лекарственных средств при энтероколите, вызванном Cl. difficile, строго дифференцированы в зависимости от степени тяжести этого заболевания [4, 5].
Тяжесть клостридиальной инфекции (КДИ) определяется преимущественно по клинико-лабораторным критериям, однако нередки случаи ошибочной гиподиагностики тяжелого течения энтероколита, вызванного Cl. difficile, что приводит к недостаточно эффективной терапии и прогрессированию поражения кишечника [19]. В такой ситуации применение доступного объективного неинвазивного метода исследования кишечника, каким является интестинальная эхография, могло бы решить проблему. Однако критерии УЗД тяжелого течения ПМК не разработаны.
Еще одной проблемой лечения пациентов с КДИ является высокий уровень рецидивов заболевания, который составляет 15-30% после проведения стандартного курса этиотропной терапии с достижением клинического излечения первого эпизода инфекции. Увеличение длительности терапии и изменение выбора антибиотика может предотвратить рецидив, однако его прогнозирование пока недоступно в клинической практике [20, 21].
Опыт последних лет показал, что решение перечисленных проблем диагностики энтероколита, вызванного Cl. difficile, должно решаться с учетом возможности развития этого заболевания при COVID-19, так как при сочетании ПМК и COVID-19 наблюдается высокая летальность - 11,36% [19, 22]. Вместе с тем сравнительных исследований особенностей УЗД при ПМК, протекающем при коронавирусной инфекции и без таковой, не проводилось.
Материал и методы
Дизайн и характеристика пациентов
Исследование проводилось на базе УЗ “Витебская областная клиническая больница” и “Витебская областная клиническая инфекционная больница”. Дизайн работы соответствовал поперечному варианту в части разграничения пациентов с ААД (группы 1, 2; 1-COVID, 2-COVID), а также в диагностике тяжелого течения КДИ (группы 2NS, 2S; 2NS-COVID, 2S-COVID). Для разработки ультразвукового критерия прогнозирования рецидива энтероколита, вызванного Cl. difficile, проведено проспективное исследование (группы 2NR, 2R; 2NR-COVID, 2R-COVID). Степень тяжести КДИ определяли согласно рекомендациям Российской гастроэнтерологической ассоциации [5].
Возникновение ПМК после приема антибиотиков у пациента на фоне острой инфекции SARS-CoV-2 расценивали как “сочетание COVID-19 и энтероколита, вызванного Cl. difficile”.
Рецидивом считали повторное возникновение КДИ в течение 8 нед после окончания этиотропного лечения [5, 17]. Исходная сплошная случайная выборка с учетом критериев включения и исключения состояла из 253 больных с ААД (170 женщин, 83 мужчины, возраст 19-100 лет, средний возраст 64,62 ± 16,91 года). Структура выделенных групп отражена на рис. 1.
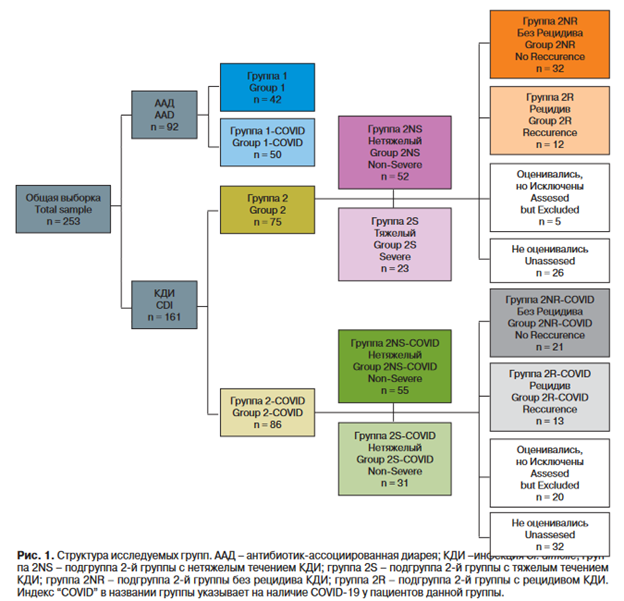
В 1-ю группу вошло 42 пациента с ААД при отрицательных лабораторных тестах на инфекцию Cl. difficile; во 2-ю группу - 75 пациентов с ААД и верифицированной КДИ. Группа 1-COVID состояла из 50 пациентов с ААД на фоне COVID-19; группа 2-COVID - из 86 пациентов с ААД и верифицированным энтероколитом, вызванным Cl. difficile, на фоне COVID-19.
В группу 2NS (NS - non-severe, т.е. нетяжелый) включено 52 пациента с энтероколитом, вызванным Cl. difficile, нетяжелого (легкой и средней тяжести) течения согласно клинико-лабораторным данным; в группу 2S (S - severe, т.е. тяжелый) - 23 пациента с КДИ тяжелой степени; в группу 2NS-COVID - 55 пациентов с энтероколитом, вызванным Cl. difficile, нетяжелого (легкой и средней тяжести) течения на фоне COVID-19; в группу 2S-COVID - 31 пациент с КДИ тяжелой степени на фоне COVID-19.
Группа 2NR (NR - no recurrence, т.е. без рецидива) состояла из 32 пациентов без рецидива кло- стридиального энтероколита; группа 2R (R - recurrence, т.е. c рецидивом) - из 12 больных, у которых развился рецидив энтероколита; группа 2NR-COVID включала 21 человека, у которого при сочетании COVID-19 и текущего эпизода КДИ рецидив энтероколита в катамнезе отсутствовал; группа 2R-COVID - 13 пациентов, у которых при сочетании COVID-19 и текущего эпизода КДИ возник рецидив энтероколита. Выяснить катамнез не удалось у 18 человек ввиду их смерти по различным причинам в исследуемый период, а также у 7 обследуемых, связь с которыми установить не удалось. Эти пациенты были исключены из исследования. Таким образом, катамнез был прослежен у 78 больных, хотя первоначально в описанные группы изучения рецидивов было включено 103 человека. У 58 пациентов с КДИ УЗИ на этапе окончания этиотропной терапии не проводилось.
Все группы, между которыми в дальнейшем проводились парные сравнения по различным исследуемым показателям, статистически значимо не различались по полу и возрасту.
Критерии включения: возраст 18 лет и старше, острая диарея (стул более 3 раз в сутки, тип 6 или 7 по Бристольской шкале формы кала), сохраненная проходимость магистральных мезентериальных сосудов по данным УЗИ, а также для всех групп, кроме 1 и 1-COVID, - наличие КДИ по характерной клинической картине и положительному иммунохроматографическому тесту (ИХТ). Критерии исключения: наличие хронических воспалительных или опухолевых заболеваний кишечника, мезентериального тромбоза и прочих состояний, которые могли бы существенно повлиять на эхографическую картину толстой кишки [13, 14], положительный результат посевов кала или ИХТ на патогенные энтеробактерии, ротавирус, норо- вирус и энтеровирусы.
Лабораторные методы
Верификация диагноза COVID-19 проводилась с использованием наборов “ALSENSE-SARS-CoV- 2-RT-qPCR” производства Альгимед Трейд (Республика Беларусь), “SARS-COV-2 ANTIGEN RAPID TEST” производства ACON Biotech (Hangzhou) Co., Ltd. (КНР), “Panbio COVID-19 Ag Rapid Test Device” производства Abbott Rapid Diagnostics (Германия).
Инфекцию Cl. difficile выявляли с помощью ИХТ с определением в кале больных токсинов А и В наборами производства ООО “МультиЛаб” (Республика Беларусь), а также “BioMaxima S.A.” (Польша).
Ультразвуковое исследование
УЗИ выполняли на аппаратах Logiq Е9 (фирма GE Healthcare, США) и Mindray M7 (фирма Shenzhen Mindray BioMedical Electronics Co., Ltd, КНР) с конвексными 3,5-4,0 МГц и линейным 10,0 МГц датчиками без специальной подготовки пациентов к исследованию.
Анализировались следующие ультразвуковые параметры: толщина толстокишечной стенки; наличие паракольной и/или свободной асцитической жидкости в различных областях брюшной полости; повышение эхогенности прилегающей к воспаленной кишке жировой ткани и “увеличение” ее объема; нарушение стратификации стенки толстой кишки; утолщение стенки тонкой кишки более 3,0 мм; парез толстой кишки; токсический мегаколон.
Измерение толщины кишечной стенки осуществлялось в продольном сечении в соответствии с рекомендациями Европейской федерации обществ ультразвука в медицине и биологии (European Federation of Societies for Ultrasound in Medicine and Biology - EFSUMB) с учетом наличия у органов желудочно-кишечного тракта пятислойного строения стенки, включающего следующие структуры со стороны полости кишки: 1) гиперэхогенный слой, соответствующий границе жидкость-стенка кишки и поверхность слизистой оболочки; 2) гипоэхогенный слой - слизистая оболочка; 3) гиперэхогенный подслизистый слой; 4) гипоэхогенная мышечная оболочка, 5) гиперэхогенная серозная оболочка [13, 14, 18]. Для определения толщины стенки кишки маркеры располагались между поверхностным эхогенным (со стороны просвета кишки) и серозным слоями. В каждом из отделов ободочной кишки (слепой, восходящей, поперечной, нисходящей, сигмовидной) толщина стенки измерялась 2-4 раза. Фиксация эхограммы осуществлялась при наилучшей визуализации стенки кишки и всех ее слоев, включая просвет кишки и часть регионарной пара- кольной клетчатки. Датчик при измерении толщины стенки кишки располагался перпендикулярно ее поверхности. В соответствии с рекомендациями EFSUMB нормальной толщиной кишечной стенки считали ее значение до 2 мм, патологической - 3 мм и более [13, 18].
Потеря стратификации кишечной стенки фиксировалась при отсутствии четкого разделения ее на вышеуказанные слои за счет ухудшения или отсутствия визуализации подслизистого слоя.
Парезом толстой кишки считали отсутствие поступательного движения внутрикишечного содержимого. Показателем токсического мегаколона считали диаметр толстой кишки более 60 мм [14, 18].
В группах 2NR, 2R, 2NR-COVID и 2R-COVID, кроме исходного УЗИ, проводилось измерение параметров стенки толстой кишки на 8-10-й день от начала курса этиотропной терапии энтероколита, вызванного Cl. difficile.
Статистический анализ
В связи с распределением количественных показателей, отличном от нормального, использовались методы непараметрической статистики (U-критерий Манна-Уитни для независимых выборок). Данные представлялись в виде среднего значения и медианы с межквартильным размахом, а также с указанием минимального и максимального значений выборки. Сравнение категориальных параметров проводилось с использованием критерия х2 для бинарных переменных. Граничные значения (cut-off) показателей толщины стенки толстой кишки как критериев тяжелого течения КДИ, ее рецидива определялись с помощью общепринятого receiver operating characteristic- анализа (ROC-анализа) с оценкой чувствительности (Ч), специфичности (С), предсказательной ценности положительного результата (ПЦПР), предсказательной ценности отрицательного результата (ПЦОР). Определение оптимальной комбинации ультразвуковых маркеров, свидетельствующих о наличии тяжелого течения энтероколита, вызванного Cl. difficile, а также изучение прогнозирования рецидива КДИ осуществлялось методом бинарной логистической регрессии [23]. Качество модели оценивалось по площади под ROC-кривой (ППК) и 95% доверительного интервала (ДИ), учитывая малый размер выборок, проводилась внутренняя валидация с использованием методики бутстреп. Статистическая обработка полученных данных выполнялась на персональном компьютере с применением стандартного пакета программ Statistica 10,0 StatSoft Inc., Okla., Microsoft Office Excel 2019, MedCalc Statistical Software 18.9.1 и IBM SPSS Statistics 26.0.0.1. При всех расчетах результаты считались значимыми при р < 0,05.
Результаты исследования
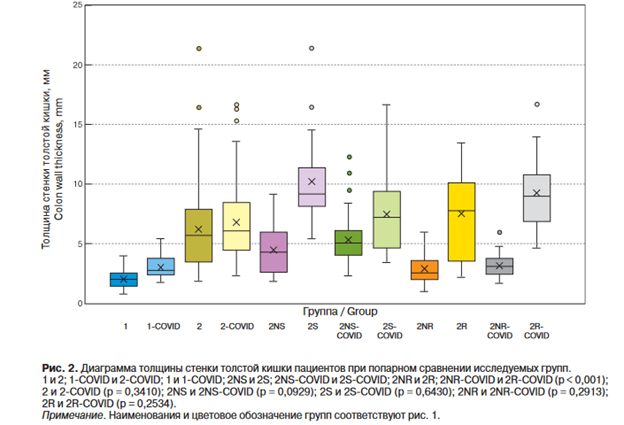
Толщина стенки толстой кишки по ультразвуковым данным достоверно отличалась при парном сравнении в следующих группах пациентов: 1 и 2; 1 ^OVID и 2-OOVID; 1 и 1-OOVID; 2NS и 2S; 2NS-aOVID и 2S^OVID; 2NR и 2R; 2NR-OCVID и 2R-TOVID (р < 0,001); достоверных отличий толщины кишечной стенки не выявлено у пациентов нижеуказанных групп: 2 и 2-TOVID (р = 0,3410); 2NS и 2NS-OCVID (р = 0,0929); 2S и 2S-OCVID (р = 0,6430); 2NR и 2NR^OVID (р = 0,2913); 2R и 2R-TOVID (р = 0,2534) (рис. 2). Поражение толстой кишки при ПМК было распространенным, т.е. захватывало больше двух отделов.
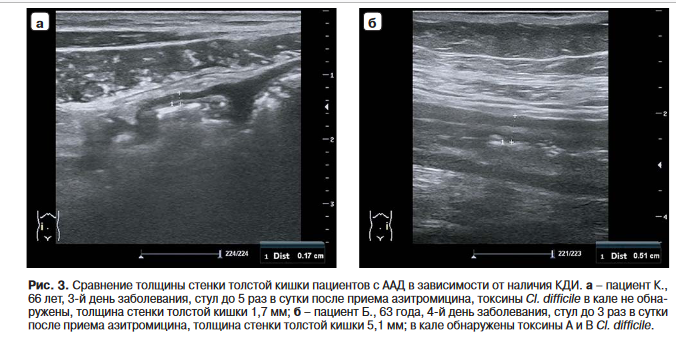
Таким образом, при ААД с КДИ толщина стенки кишки была больше, чем при отсутствии Cl. difficile (рис. 3).
При тяжелом ПМК (рис. 4а) толщина кишечной стенки статистически значимо превышала аналогичные значения у пациентов с легким и среднетяжелым течением заболевания (рис. 4б).
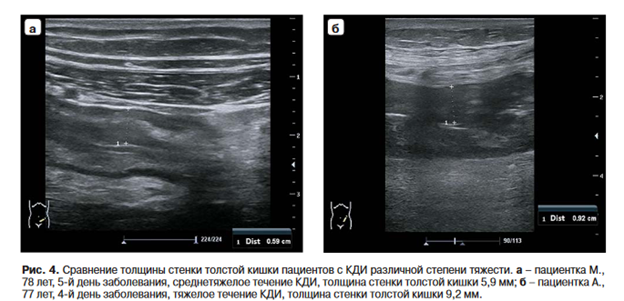
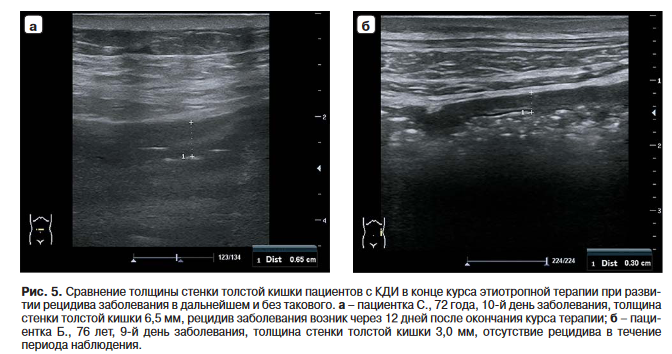
В группе больных рецидивирующим энтероколитом, вызванным Cl. difficile, толщина стенки толстой кишки после окончания стандартного этиотропного лечения была больше, чем в группе пациентов без рецидива этой инфекции (рис. 5).
Все перечисленные закономерности сохранялись при наличии COVID-19 в группах больных энтероколитом, вызванным Cl. difficile. Только среди пациентов с ААД без КДИ стенка кишки при COVID-19 была статистически значимо больше, чем при отсутствии коронавирусной инфекции.
Тенденция к увеличению толщины стенки во всех остальных группах при COVID-19 в сравнении с аналогичными значениями у пациентов без этой инфекции имела место, но различия были статистически незначимыми
Оптимальным пограничным значением (cut-off) толщины стенки ободочной кишки, характеризующим наличие КДИ у пациентов с ААД, явился показатель “более 3,2 мм” (Ч - 79,5%, С - 92,9%, ПЦПР - 95,1%, ПЦОР - 72,2%, ППК = 0,919, ДИ 0,854-0,962, p < 0,0001) в любом из ее отделов при тотальном поражении ободочной кишки; на фоне COVID-19 - значение “более 4,0 мм” (Ч - 84,9%, С - 90,0%, ПЦПР - 93,6%, ПЦОР - 77,6%, ППК = 0,927, ДИ 0,869-0,964, p < 0,0001).
Для разграничения тяжелого и среднетяжело- го/легкого течения энтероколита, вызванного Cl. difficile, оптимальным был показатель “более 7,2 мм” в любом из ее отделов при тотальном поражении ободочной кишки (Ч - 91,3%, С - 98,1%, ПЦПР - 95,5%, ПЦОР - 96,2%, ППК = 0,974, ДИ 0,907- 997, p < 0,0001); на фоне COVID-19 - идентичное значение, т.е. “более 7,2 мм” (Ч - 90,3%, С- 92,8%, ПЦПР - 87,4%, ПЦОР - 94,4%, ППК = 0,944, ДИ 0,872-0,982, p < 0,0001). Показатель толщины кишечной стенки более 7,2 мм был расценен как основной в ультразвуковой дифференциальной диагностике тяжелого и среднетяжелого/легкого течения КДИ. Увеличение граничного значения толщины кишечной стенки до 7,4 мм позволило повысить специфичность диагностики тяжелого течения ПМК с 92,7 до 96,4%, однако при этом чувствительность снижалась с 90,3 до 83,9%.
В ходе исследования также сравнивалась частота выявления ультразвуковых качественных характеристик у пациентов групп 2S (2S^OVID), с одной стороны, и групп 2NS (2NS^OVID) - с другой соответственно. Установлено, что при тяжелом течении ПМК на фоне COVID-19 чаще встречаются следующие качественные признаки, которые расценены как дополнительные: 1) наличие паракольной свободной жидкости и/или асцитической жидкости в различных областях брюшной полости (х2 = 41,35, р < 0,001); 2) повышение эхогенности прилегающей к воспаленной кишке жировой ткани и “увеличение” ее объема (х2 = 43,73, р < 0,001); 3) нарушение стратификации стенки толстой кишки (х2 = 32,19, р < 0,001); 4) утолщение стенки тонкой кишки более 3,0 мм (%2 = 5,45, р = 0,0196); 5) парез толстой кишки (%2 = 43,72, р < 0,001); 6)токсический мегаколон.
Чувствительность диагностики тяжелого течения КДИ при комбинации показателя “толщина кишечной стенки более 7,2 мм” и хотя бы одного из вышеуказанных ультразвуковых качественных признаков достигает 95,7%, специфичность - 98,1% (ППК = 0,973, ДИ 0,906-0,997, p < 0,0001). На фоне COVID-19 чувствительность диагностики тяжелого течения КДИ при сочетании признаков “толщина кишечной стенки более 7,2 мм + дополнительные” составила 92,6% специфичность - 95,2%, (ППК = 0,964, ДИ 0,899-0,987, p < 0,0001).
Пограничным значением толщины стенки ободочной кишки, характеризующим развитие рецидива энтероколита, вызванного Cl. difficile, в дальнейшем явился критерий “более 6,0 мм” (Ч - 75,0%, С - 100,00%, ПЦПР - 100,0%, ПЦОР - 91,4%, ППК = 0,842, ДИ 0,701-0,935, p < 0,0001); на фоне COVID-19 диагностические показатели имели следующий вид - “более 6,0 мм”: Ч - 92,3%, С - 100,00% ПЦПР - 100,0%, ПЦОР - 95,5%, ППК = 0,993, ДИ 0,884-1,000, p < 0,0001. При прогнозировании рецидива клостридиального энтероколита у пациентов с COVID-19 применение в качестве граничного значения величины 6,1 мм при сохранении специфичности диагностики 100,0% приводило к снижению чувствительности с 92,3 до 84,6%. Использование в этой же ситуации в качестве граничного значения прогноза рецидива энтероколита величины 4,8 мм вызывало снижение специфичности диагностики с 100,0 до 95,2%, однако чувствительность сохранялась на уровне 92,3%.
Обсуждение
Полученные результаты свидетельствуют о том, что у пациентов с энтероколитом, вызванным Cl. difficile, основной ультразвуковой характеристикой при оценке толстой кишки является толщина стенки. Если этот показатель при возникновении диареи на фоне или после приема антибиотиков превышает 3,2 мм, причем поражение распространяется на разные отделы ободочной кишки, существует высокая вероятность КДИ. Ситуация с наличием диареи в отсутствие утолщения стенки кишки объяснима, учитывая, что антибиотики значительно изменяют микробиом кишечника, однако необязательно, чтобы при этом в кишечной стенке происходили структурные изменения [24]. Также возможна некровавая инфекционная диарея без утолщения стенки кишки [25]. Кроме того, макро- лидный антибиотик эритромицин сам по себе действует как прокинетик, усиливающий кишечную перистальтику, так как способен связываться с мотилиновыми рецепторами [26].
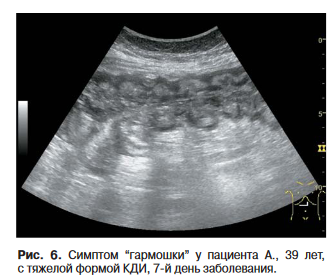
В соответствии с полученными результатами в случае превышения показателем толщины кишечной стенки значения 7,2 мм можно диагностировать тяжелое течение ПМК с достаточно высокой чувствительностью и специфичностью. Вместе с тем следует учитывать, что распространенное утолщение кишечной стенки по данным интестинальной эхографии является неспецифическим симптомом и наблюдается при воспалительных заболеваниях кишечника, мезентериальном тромбозе, ишемическом колите, обтурационной непроходимости, а также амилоидозе и туберкулезе кишечника. Локальное утолщение стенки толстой кишки с поражением ее 1-2 отделов возможно при злокачественных опухолях, болезни Крона, эозинофильном колите, дивертикулите, тяжелых острых кишечных инфекциях, например сальмонеллезе [13, 18, 27, 28]. В случае ПМК при КТ и УЗИ наблюдается симптом “гармошки” (рис. 6), или, как его обычно называют в англоязычной литературе, симптом “аккордеона”, связанный с отеком складок ободочной кишки преимущественно за счет подслизистого слоя [29, 30]. Считалось, что этот симптом специфичен для энтероколита, вызванного Cl. difficile, однако отдельные исследования такое предположение не подтвердили, причем чувствительность признака составила около 13-15% [31, 32]. Хотя высокая специфичность симптома “гармошки” отсутствует, следует учитывать, что складки достигают весьма значительной толщины преимущественно при ПМК [33].
Несмотря на то что основным признаком дифференциальной диагностики тяжелого и нетяжелого течения энтероколита, вызванного Cl. difficile, является толщина кишечной стенки, учет дополнительных признаков улучшает диагностику и позволяет оценивать динамику заболевания. Нередко именно дополнительный признак (особенно асцит) позволяет направить мысль врача на вероятность тяжелого течения ПМК. Дополнительные признаки сами по себе могут нести важную информацию. В практической работе возможна ситуация при тяжелой КДИ, когда объективно состояние больного ухудшается, а частота стула уменьшается. Если при этом наблюдается парез толстой кишки, симптоматика становится объяснимой и подтверждает приближение катастрофы. Констатация токсического мегаколона имеет самостоятельное значение, так как определяет кардинальное изменение дальнейшей тактики ведения пациента.
Выявленное в нашем исследовании утолщение стенки кишки в конце курса этиотропного лечения с последующим развитием рецидива заболевания в дальнейшем может быть связано с сохранением воспалительного процесса в стенке кишки при неполной элиминации Cl. difficile за счет наличия вегетативных спор или высоковирулентного штамма возбудителя [5]. Поэтому в клинической практике особую важность имеет установление граничного значения толщины кишечной стенки (более 6,0 мм в любом из отделов ободочной кишки) для определения риска развития рецидива энтероколита, вызванного Cl. difficile, у пациента после проведенного полного курса этиотропной терапии и при клиническом выздоровлении.
Полученные результаты о толщине стенки кишки как ключевом ультразвуковом показателе прогноза рецидива энтероколита, вызванного Cl. difficile, хорошо согласуются с современной парадигмой ведения язвенного колита с учетом результатов интестинального УЗИ. Исследованиями последних лет установлено, что оценка ультразвуковых характеристик кишечной стенки является надежным показателем активности и распространенности воспаления, причем эта информация может быть ключевой для выбора эскалационного, поддерживающего или деэскалационного варианта лечения язвенного колита[14, 34].
При COVID-19 логично ожидать утолщение стенки кишки даже в случае отсутствия КДИ. Известно, что одной из мишеней вируса SARS- CoV2 является желудочно-кишечный тракт [19]. Действительно, в группе больных COVID-19 без КДИ толщина кишечной стенки была больше (р < 0,0001), чем при ААД с отсутствием как микрорга- низма Cl. difficile, так и вируса SARS-CoV2. При сочетании COVID-19 и энтероколита, вызванного Cl. difficile, вероятно, имеет место суммация эффектов, приводящих к утолщению кишечной стенки. В случае отсутствия COVID-19 граничные диагностические значения толщины кишечной стенки для ААД, вызванной КДИ (3,2 мм), оказались несколько меньше, чем при наличии вируса SARS-CoV2 (4,0 мм).
Можно предполагать, что значительное утолщение кишечной стенки в результате тяжелой КДИ существенно превосходит местный эффект вируса SARS-CoV2, и поэтому граничное значение толщины стенки кишки оказалось сопоставимым при отсутствии и наличии COVID-19. Аналогичная ситуация прослеживается в случае оценки вероятности рецидива клостридиального энтероколита.
Таким образом, использование интестинальной эхографии для оценки кишечной стенки и окружающих структур позволяет детализировать диагностику энтероколита, вызванного Cl. difficile.
Выводы
Если антибиотик-ассоциированная диарея по данным ультразвукового исследования сопровождается распространенным утолщением кишечной стенки величиной более 3,2 мм, высоковероятно наличие энтероколита, вызванного Cl. difficile. В случае диареи у пациентов с COVID-19 обнаружение кишечной стенки толщиной более 4,0 мм указывает на наличие клостридиальной инфекции при исключении патологии кишечника ишемического генеза.
Тяжелое течение клостридиального энтероколита при эхографии характеризуется распространенным увеличением толщины толстокишечной стенки с максимальным значением более 7,2 мм. Кроме того, возможны дополнительные ультразвуковые признаки тяжелого течения энтероколита, вызванного Cl. difficile: наличие пара- кольной свободной жидкости и/или асцитической жидкости в различных областях брюшной полости; повышение эхогенности прилегающей к воспаленной кишке жировой ткани (сальника) и “увеличение” ее объема; нарушение стратификации стенки толстой кишки; утолщение стенки тонкой кишки более 3,0 мм; парез толстой кишки; токсический мегаколон.
Сохранение у пациентов с энтероколитом, вызванным Cl. difficile, утолщения кишечной стенки более 6,0 мм по результатам ультразвукового исследования после проведения стандартного курса лечения с достижением клинического целевого результата (отсутствие диареи, нормализация температуры и лабораторных показателей) является предиктором рецидива заболевания.
В случае сочетания энтероколита, вызванного Cl. difficile, с COVID-19 можно использовать вышеописанные ультразвуковые диагностические критерии псевдомембранозного колита при установлении его тяжелого течения и высокой вероятности рецидива.
Список литературы
Palestro C.J., Brandon D.C., Dibble E.H. et al. FDG PET in Evaluation of Patients With Fever of Unknown Origin: AJR Expert Panel Narrative Review. Am. J. Roentgenol. 2023; 221 (2): 151-162
Тимина И.Е., Бурцева Е.А., Пяткова И.И., Кармаза- новский ГГ. Возможности ультразвуковой диагностики параганглиом шеи. Медицинская визуализация. 2024; 28 (1): 65-75. Timina I.E., Burtseva E.A., Pyatkova I.I., Karmazanovsky G.G. Possibilities of ultrasound diagnostics of paragangliomas of the neck. Medical Visualization. 2024; 28 (1): 65-75.
Мартиросян Э.А., Кармазановский Г.Г., Соколова Е.А., Глотов А.В., Марапов Д.И. Подслизистые образования желудка: новый инструмент для дифференциальной диагностики гастроинтестинальных стромальных опухолей и лейомиом при компьютерной томографии с контрастным усилением. Медицинская визуализация. 2020; 24 (4): 27-41.
Martirosyan E.A., Karmazanovsky G.G., Sokolova E.A. et al. Submucosal gastric lesions: a CECT-based tool for differential diagnosis between gastrointestinal stromal tumor and leiomyoma. Medical Visualization. 2020; 24 (4): 27-41.
Kelly C.R., Fischer M., Allegretti J.R. et al. ACG Clinical Guidelines: Prevention, Diagnosis, and Treatment of Clostridioides difficile Infections. Am. J. Gastroenterol. 2021; 116 (6): 1124-1147.
Ивашкин В.Т., Ляшенко О.С., Драпкина О.М., Алексеева О.П., Алексеенко С.А., Андреев Д.Н., Барановский А.Ю., Голощапов О.В., Железнова Н.В., Зольникова О.Ю., Кляритская И.Л., Корочанская Н.В., Лапина Т.Л., Маев И.В., Масленников Р.В., Мязин Р.Г., Павлов П.В., Перекалина М.В., Писаренко Н.А., Повторейко А.В., Полуэктова Е.А., Секретарева Л.А., Ткачев А.В., Трошкина Ю.М., Трухманов А.С., Ульянин А.И., Филатова С.Г., Цуканов В.В., Шифрин О.С. Практические рекомендации Научного сообщества по содействию клиническому изучению микробиома человека, Российской гастроэнтерологической ассоциации и Российского общества по профилактике неинфекционных заболеваний по диагностике и лечению Clostridioides difficile (C. difficile)- ассоциированной болезни у взрослых. Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2023; 33 (3)
Ivashkin V.T., Lyashenko O.S., Drapkina O.M. et al. Clinical Practice Guidelines of the Scientific Society for the Clinical Study of Human Microbiome, of the Russian Gastroenterological Association and the Russian Society for the Prevention of Noncommunicable Diseases on the Diagnosis and Treatment of Clostridioides difficile (C. difficile)-associated Disease in Adults. Russian Journal of Gastroenterology, Hepatology, Coloproctology. 2023; 33 (3): 85-119
Goodman P.C., Federle M.P. Pseudomembranous colitis. J. Comput. Assist. Tomogr. 1980; 4 (3): 403-404
Okafor C.M., Clogher P., Olson D. et al. Trends in and Risk Factors for Recurrent Clostridioides difficile Infection, New Haven County, Connecticut, USA, 2015-2020. Emerg. Infect. Dis. 2023; 29 (5): 877-887
Granata G., Bartoloni A., Codeluppi M. et al. On Behalf Of The CloVid Study Group. The Burden of Clostridioides Difficile Infection during the COVID-19 Pandemic: A Retrospective Case-Control Study in Italian Hospitals (CloVid). J. Clin. Med. 2020; 9 (12): 3855.
Lewandowski K., Rosotowski M., Kaniewska M. et al. Clostridioides difficile infection in coronavirus disease 2019 (COVID-19): an underestimated problem? Pol. Arch. Intern. Med. 2021; 131 (2): 121-127.
Megibow A.J., Streiler M.L., Balthazar E.J., Bosniak M.A. Pseudomembranous colitis: diagnosis by computed tomography. J. Comput. Assist. Tomogr. 1984; 8: 281-283.
Bolondi L., Ferrentino M., Trevisani F. et al. Sonographic appearance of pseudomembranous colitis. J. Ultrasound. Med. 1985; 4(9): 489-492.
Downey D.B., Wilson S.R. Pseudomembranous colitis: sonographic features. Radiology. 1991; 180 (1): 61-64.
Nylund K., Maconi G., Hollerweger A. et al. EFSUMB Recommendations and Guidelines for Gastrointestinal Ultrasound. Ultraschall Med. 2017; 38 (3): 273-284.
Maconi G., Nylund K., Ripolles T. et al. EFSUMB Recommendations and Clinical Guidelines for Intestinal Ultrasound (GIUS) in Inflammatory Bowel Diseases. Ultraschall Med. 2018; 39 (3): 304-317.
Петрук М.Н., Нешитов С.П. Псевдомембранозный колит. Хирургия. Журнал им. Н.И. Пирогова. 2009; 4: 55-60. Petruk M.N., Neshitov S.P. Pseudomembranous colitis. Khirurgiya. Zurnal im. N.I. Pirogova = Pirogov Russian Journal of Surgery. 2009; 4: 55-60. (In Russian)
Алексеечкина О.А., Дубров Э.Я., Владимирова Е.С. Возможности ультразвукового исследования в диагностике псевдомембранозного колита у хирургических больных. Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2012; 21 (2): 29-35. Alekseechkina O.A., Dubrov E.Ya. Vladimirova E.S. Possibilities of ultrasound examination in the diagnosis of pseudomembranous colitis in surgical patients. Russian Journal of Gastroenterology, Hepatology, Coloproctology. 2012; 21 (2): 29-35. (In Russian)
Sartelli M., Di Bella S., McFarland L.V. et al. 2019 update of the WSES guidelines for management of Clostridioides (Clostridium) difficile infection in surgical patients. Wld J. Emerg. Surg. 2019; 14: 8.
Практическое руководство по ультразвуковой диагностике. Общая ультразвуковая диагностика. Изд. 3-е Под ред. В.В. Митькова. М.: ВИДАР, 2019. 756 с. Practical guide to ultrasound diagnostics. General ultrasound diagnostics. 3rd ed / Ed. V.V. Mitkov. Moscow: VIDAR, 2019. 756 p. (In Russian)
Тимербулатов М.В., Аитова Л.Р, Гришина Е.Е., Сакаев Э.М., Щекин В.С., Щекин С.В., Низамутдинов Т Р. Тяжелый псевдомембранозный колит на фоне перенесенной коронавирусной инфекции. Хирургия. Журнал им. Н.И. Пирогова. 2022; 8: 53-60.
Timerbulatov M.V., Aitova L.R., Grishina E.E. et al. Severe pseudomembranous colitis in patients with previous coronavirus infection. Khirurgiya. Zurnal im. N.I. Pirogova = Pirogov Russian Journal of Surgery. 2022; 8: 53-60
Song J.H., Kim YS. Recurrent Clostridium difficile Infection: Risk Factors, Treatment, and Prevention. Gut Liver. 2019; 13 (1): 16-24.
Filip S.S., Slivka R.M., Bratasiuk A.M., Skrypynets Y.P, Shitev A.I. Pseudomembranous colitis as a complication in Covid-19. Wiad. Lek. 2024; 77 (3): 450-455.
Ma G.K., Brensinger C.M., Wu Q. Increasing incidence of multiply recurrent Clostridium difficile infection in the United States: a cohort study. Ann. Intern. Med. 2017; 167 (3): 152-158.
Van Smeden M., Reitsma J.B., Riley R.D. Clinical prediction models: diagnosis versus prognosis. J. Clin. Epidemiol. 2021; 132: 142-145.
Patangia D.V., Anthony Ryan C., Dempsey E. et al. Impact of antibiotics on the human microbiome and consequences for host health. Microbiologyopen. 2022; 11 (1): e1260.
Chun P, Lim T.J., Hwang E.H. et al. Clinical Characteristics and Ultrasonographic Findings of Acute Bacterial Enterocolitis in Children. Pediatr. Gastroenterol. Hepatol. Nutr. 2017; 20 (2): 107-113.
Takeshita E., Matsuura B., Dong M.J. et al. Molecular characterization and distribution of motilin family receptors in the human gastrointestinal tract. Gastroenterology. 2006; 41 (3): 223-230.
Dietrich C.F., Hollerweger A., Dirks K. et al. EFSUMB Gastrointestinal Ultrasound (GIUS) Task Force Group: Celiac sprue and other rare gastrointestinal diseases ultrasound features. Med. Ultrason. 2019; 21 (3): 299-315
Dirks K., Calabrese E., Dietrich C. et al. EFSUMB Position Paper: Recommendations for Gastrointestinal Ultrasound (GIUS) in Acute Appendicitis and Diverticulitis. Ultraschall Med. 2019; 40 (2): 163-175.
O'Sullivan S.G. The accordion sign. Radiology. 1998; 206 (1): 177-178.
Ramachandran I., Sinha R., Rodgers P Pseudomembranous colitis revisited: spectrum of imaging findings. Clin. Radiol. 2006; 61 (7): 535-544.
Macari M., Balthazar E.J., Megibow A.J. The accordion sign at CT: a nonspecific finding in patients with colonic edema. Radiology. 1999; 211 (3): 743-746.
Duffin C., Mirpour S., Catanzano T., Moore C. Radiologic Imaging of Bowel Infections. Semin. Ultrasound CT MR. 2020; 41 (1): 33-45.
Horton K.M., Corl F.M., Fishman E.K. CT evaluation of the colon: inflammatory disease. Radiographics. 2000; 20 (2): 399-418
Helwig U., Fischer I., Hammer L. et al. Transmural Response and Transmural Healing Defined by Intestinal Ultrasound: New Potential Therapeutic Targets? J. Crohns. Colitis. 2022; 16 (1): 57-67.
Авторы:
Пиманов Сергей Иванович - доктор мед. наук, профессор, заведующий кафедрой внутренних болезней и ультразвуковой диагностики факультета повышения квалификации и переподготовки кадров УО “Витебский государственный ордена Дружбы народов медицинский университет”, Витебск, Беларусь.
Руцкая Ирина Александровна - врач ультразвуковой диагностики, врач-инфекционист УЗ “Витебская областная клиническая инфекционная больница”, Витебск, Беларусь
Теги: ультразвуковая диагностика
234567 Начало активности (дата): 23.06.2025
234567 Кем создан (ID): 989
234567 Ключевые слова: ультразвуковая диагностика; Clostridioides difficile; псевдомембранозный колит; антибиотик-ассоциированная диарея; рецидив; ободочная кишка; COVID-19
12354567899
Похожие статьи
Исторические аспекты становления и развития методов лучевой диагностики в перинатологииРентген на дому 8 495 22 555 6 8
Стенозирующий лигаментит пальцев кисти
Повреждения тазового кольца
Переломы проксимального отдела плечевой кости



