 27.05.2025
27.05.2025
Современные подходы к пренатальной визуальной диагностике пороков развития легких: обзор
Врожденные аномалии легких и бронхов возникают в результате нарушений развития на любом из этапов формирования орган
Введение.
Врожденные аномалии легких и бронхов возникают в результате нарушений развития на любом из этапов формирования органа: между 3-й и 6-й неделями гестации, когда на передней кишке появляется дивертикул трахеи, между 6-й и 16-й неделями развития — в результате деления бронхов, и после 16 нед — вследствие активного формирова¬ния альвеолярного аппарата. Проявления указанных изменений значительно варьируют: от минимальных по размеру, как правило, бессимптомных изменений до крупных объемных образований, занимающих большую часть легкого, которые приводят к гибели плода или выраженным дыхательным нарушениям после рождения. Своевременная и точная пренатальная диагностика аномалий развития легких является одним из основополагающих факторов, определяющих прогноз, тактику ведения беременности и возможное планирование как пренатального, так и постнатального хирургического вмешательства.
Цель. Продемонстрировать наиболее типичные признаки широкого спектра врожденных аномалий легких по данным УЗИ и МРТ, а также алгоритм диагностического поиска.
Ультразвуковое исследование (УЗИ) относится к основным методам визуальной диагностики при оценке пороков развития плода. Большинство структурных изменений легких могут быть обнаружены при рутинной эхографии на сроке 18-20 нед беременности [ 1 ]. При этом в некоторых случаях, даже в руках опытных специалистов, прецизионная эхографическая диагностика может быть затруднительна, в особенности при маловодии, избыточной массе тела беременной или на более поздних сроках гестации. В таких случаях для подтверждения диагноза либо получения дополнительной информации требуется выполнение магнитно-резонансной томографии (МРТ). При значительно менее выраженном влиянии на качество изображений конституции беременной, положения плода или количества околоплодных вод к преимуществам данного метода можно отнести крупное поле обзора и высокий естественный контраст от мягких тканей. Как и при УЗИ, МРТ выполняется без использования седативных препаратов или внутривенного контрастирования.
Материалы и методы.
Поиск литературы осу-ществлялся в открытых информационных базах на русском и английском языках Medline, PubMed, Web of Science, РИНЦ, еLIBRARY по ключевым словам и словосочетаниям: «пренатальная диагно¬стика», «МРТ плода», «УЗИ», «фетальная МРТ», «ВПР», «врожденные пороки развития легких».
Эмбриональное развитие легких.
Легочная система человека начинает развиваться на 26-33-й день беременности из переднего отдела первичной кишки. Дальнейшее развитие включает как несколько периодов (эмбриональный, фетальный, постнатальный), так и фаз (эмбриональная, псевдогландулярная, каналикулярная, саккулярная и альвеолярная) [2]. В эмбриональной фазе (4-7 нед беременности) формируются зачатки легких, основных дыхательных путей и плевры.
Псевдогландулярная фаза (5-17 нед) характеризуется развитием бронхиального дерева, крупных отделов дыхательной паренхимы и ацинусов. При этом ацинарный эпителий еще не дифференцирован. В каналикулярной фазе (16-26 нед) происходит созревание дистальных дыхательных путей, аэрогематического барьера, появление сурфактанта, дальнейшее формирование ацинусов.
Саккулярная (мешотчатая) фаза (24-38 нед) в основном характеризуется увеличением будущих воздушных пространств. В альвеолярной фазе (36 нед — 3-8 лет) происходит формирование вторичных перегородок, образующих альвеолы. Этот процесс может начинаться до рождения и в постнатальном периоде. Позже происходит увеличение количества воздушных пространств, респираторных бронхиол и альвеолярных мешочков. Все фазы развития легкого пересекаются между собой, потому как большинство процессов созревания легких начинаются центрально и продвигаются на периферию. Необходимо отметить, что точное начало и окончание созревания микроваскулярной сети, завершение альвеолярной фазы неизвестно [2].
Визуализация легких в норме.
Неизмененная паренхима легких при УЗИ имеет гомогенную эхо-структуру на протяжении всей беременности. На более ранних сроках легкое гипоэхогенно относительно ткани печени, с прогрессированием беременности эта разница становится менее очевидна. Визуализация гортани, глотки и трахеи на ранних сроках гестации обычно ограничена, а на более поздних сроках отображается в виде тубулярных гипоэхогенных структур, заполненных жидкостью [3].
Кистозно-аденоматозная мальформация легких.
Кистозно-аденоматозная мальформация легких (кистозно-аденоматозный порок развития легких, КАМЛ, КАПРЛ) составляет до половины от всех пороков легкого и встречается с частотой 1 на 25000-35000 беременностей [7].
Указанные образования относятся к гамартомам и характерзуются аномальным ветвлением незрелых бронхиол без нормального развития альвеол. Кровоснабжение осуществляется из системы легочных артерий, а отток по легочным венам. В подавляющем большинстве случаев (80-95%) заболевание возникает в одном из легких, чаще на уровне нижних долей. Данных о предрасположенности локализации справа или слева не установлено.
По классификации Stocker и соавт. (1977) выделяют три типа КАМЛ [8].
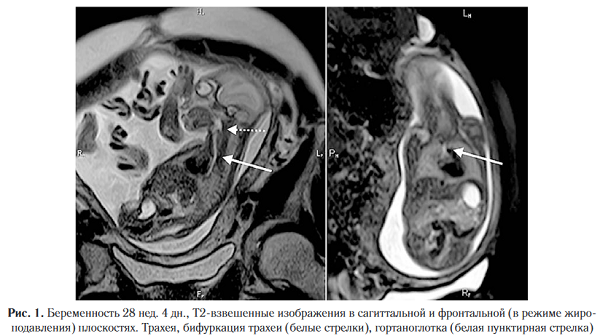
Т2-ВИ являются оптимальными последовательностями для оценки легких плода, трахеи и главных бронхов по данным МРТ. Ввиду значительного количества жидкости, легкие имеют относительно гомогенный гиперинтенсивный сигнал на Т2-ВИ по сравнению с тканью печени, селезенки или стен¬кой грудной клетки. При этом с прогрессированием беременности интенсивность сигнала на Т2-ВИ в норме повышается, что связано с увеличением количества жидкости в формирующихся альвеолах [4-6] и может быть использовано в качестве маркера структурной зрелости легких. В отличие от УЗИ визуализация верхних дыхательных путей на фоне их гиперинтенсивного сигнала на Т2-ВИ, как правило, не вызывает сложностей (в особенности на более поздних сроках гестации) (рис. 1).
I тип — состоит из единичных или множественных кист (3-10 см).
II тип — включает множественные мелкие кисты (0,5-2,0 см).
III тип — микрокистозная масса с размерами кист не более 0,2 см.
Позднее были выделены 0 и IV типы [9]. Тип 0 представляет собой солидное образование (ацинарная дисплазия), а IV — образование с преобладанием многокамерных периферических тонкостенных кист [10].
Согласно классификации Adzick и соавт. выделяют два типа КАМЛ: макрокистозный (множественные крупные кисты более 0,5 см) и микрокистозный (кисты менее 0,5 см) [11]. Последний встречается значительно реже и имеет менее благоприятный прогноз.
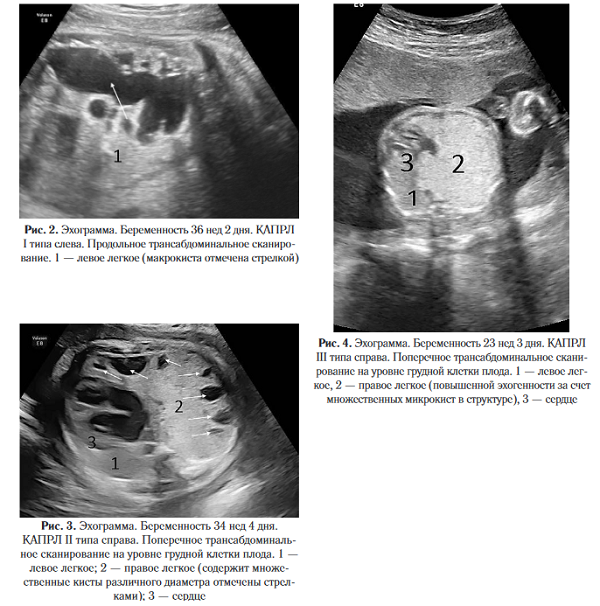
Пренатальная ультразвуковая диагностика аномалий легочной ткани в основном возможна с 20 -21-й недели беременности. Эхографическая картина КАМЛ зависит от типа порока. При I и II типах в легочной ткани определяются анэхогенные кистозные включения округлой формы разного диаметра, при КАПРЛ III типа пораженный участок имеет гиперэхогенную структуру (рис. 2-4).
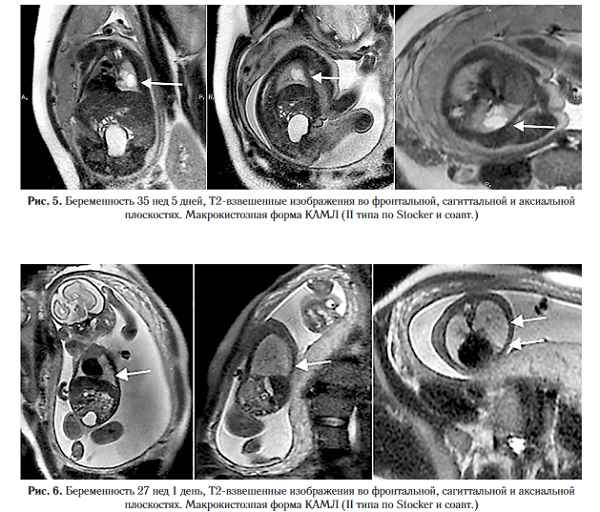
Пренатальная лучевая семиотика в зависимости от типа КАМЛ варьирует, при этом все они, как правило, на МРТ выглядят гиперинтенсивными относительно неизмененной ткани легких (рис. 5, 6). Микрокистозный тип представляется как гомогенное образование повышенного сигнала на Т2-ВИ, а макрокистозный — в виде образования с наличием разнокалиберных кист. С прогрессированием беременности и повышением интенсивности сигнала от легких на Т2-ВИ граница между КАМЛ и неизмененной тканью становится менее очевидной.
В редких случаях кистозный аденоматоз может иметь атипичный вид промежуточной интенсивности сигнала образования с наличием гипоинтенсивных включений. В таких наблюдениях проводится дифференциальная диагностика с врожденной перибронхиальной миофибробластической опухолью [12]. В остальных случаях дифференциальную диагностику макрокистозных КАМЛ проводят с бронхогенными кистами, гибридными формами и опухолями средостения (рис. 7), а микрокистозный тип дифференцируют от легочной секвестрации, врожденной эмфиземы, бронхиальной атрезии и гибридных форм.
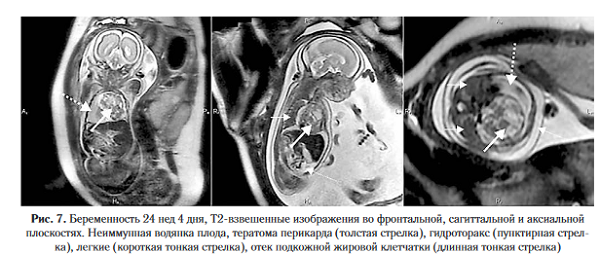
Пиком роста легочной патологии является срок 26-28 недель беременности [13-15]. При этом в ряде случаев, обычно после 32 нед гестации, может происходить обратное развитие КАМЛ [16, 17]. Последнее не исключает проведение постнатального обследования с помощью компьютерной томографии (для определения резидуальных изменений).
В целом, чем больше изначальный объем опухоли по отношению к легкому, тем менее вероятен ее полный регресс [18].
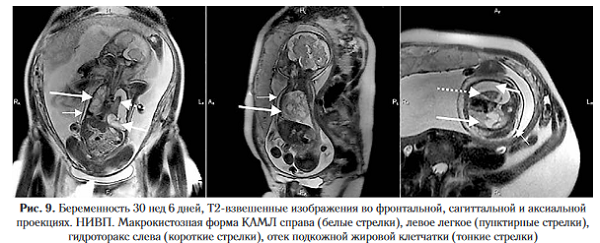
К серьезным осложнениям кистозного аденоматоза относится развитие неиммунной водянки плода (НИВП), возникающей на фоне сдавления сердца, нарушения лимфатического и венозного оттока, что в свою очередь приводит к вторичной сердечно-сосудистой недостаточности [19]. Прогнозирование НИВП основано на вычислении соотношения объема опухоли с окружностью головки плода по данным ультразвукового исследования (CCAM volume to head circumference ratio, CVR): если CVR превышает 1,6, НИВП возникает в 75% случаев, при CVR <1,6 НИВП развивается менее чем в 3% наблюдений [20
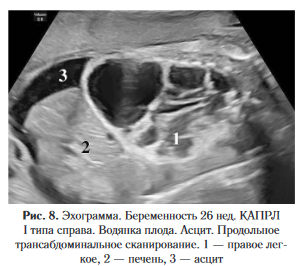
Во внутриутробном периоде появление неиммунной водянки плода при пороках легкого отмечено в 5-9% наблюдений [15], что значительно ниже, чем в популяции. Так, по данным литературы, частота встречаемости указанной патологии составляет 1 на 3000-4000 новорожденных [21] (рис. 8, 9).
Легочная секвестрация.
Легочная секвестрация (ЛС, бронхопульмонарная секвестрация) — это участки аномальной ткани легких, не имеющие нормального соединения с трахеобронхиальным деревом и имеющие аномальное кровоснабжение из системного кровотока (как правило, грудной или брюшной отдел аорты, значительно реже — чревный ствол, селезеночная или подключичная артерии) [22]. Наличие системного аберрантного кровоснабжения позволяет дифференцировать секвестрацию от иных пороков развития легкого [23, 24].
Выделяют внутридолевую и внелегочную (интра- и экстралобарную) секвестрацию. Интралобарный тип окружен неизмененной легочной тканью и покрыт общим листком плевры.
В ситуациях, когда разделение происходит после формирования плевры, формируется экстралобарная секвестрация, покрытая собственным листком плевры (супрадиафрагмальный, субдиафрагмальный, трансдиафрагмальный или интрадиафрагмальный типы) [25, 26]. Вне зависимости от типа секвестры чаще встречаются на уровне базальных отделов легкого слева (рис. 10).

Пренатальная ультразвуковая диагностика ЛС основана на выявлении в грудной клетке или интра-абдоминально образования повышенной эхогенности с четкими контурами.
Структура образования
По данным различных авторов бронхопульмонарная секвестрация составляет от 0,15 до 23% от всех аномалий легких и относится ко второй по частоте среди всех пороков развития данной локализации чаще всего бывает однородной, но при сочетании с КАПРЛ в секвестре могут обнаруживаться небольшие кистозные включения округлой формы. К значимым патогномоничным признакам данной патологии относится определение отдельного питающего сосуда, отходящего от аорты при цветовом допплеровском картировании. Необходимо отметить, что указанный критерий удается выявить не во всех наблюдениях (рис. 11, 12)
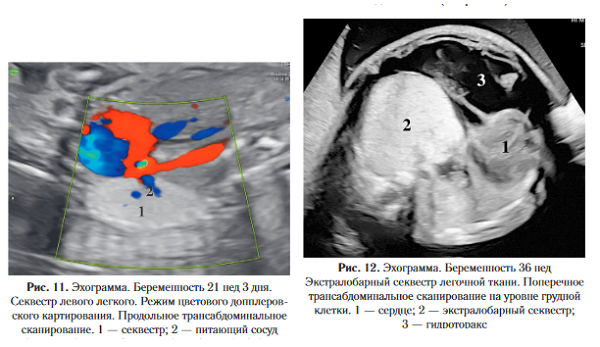
Диагноз устанавливается при наличии гомогенно¬го образования с четкими контурами и гиперинтенсивным сигналом на Т2-ВИ на МРТ. Допплеровское исследование является наиболее точным в определении питающего сосуда, который в виде линейных гипоинтенсивных структур не всегда удается идентифицировать на МРТ [24]. Дифференциальную диагностику интралобарной секвестрации проводят с микрокистозным типом КАМЛ и гибридными формами (при отсутствии визуализации аберрантного кровоснабжения).
Экстралобарные поддиафрагмальные секвестры — с кровоизлиянием и нейробластомой надпочечника (см. рис. 10).
Осложнения в виде формирования гидроторакса и неиммунной водянки плода при легочной секвестрации наблюдается достаточно редко — 6,8% случаев. В ряде случаев с прогрессированием беременности (после 26-28 нед гестации) может происходить уменьшение размеров образования [24]. Тем не менее, как и при КАМЛ, это не исключает необходимость выполнения постнатального обследования для определения резидуальных изменений в легких.
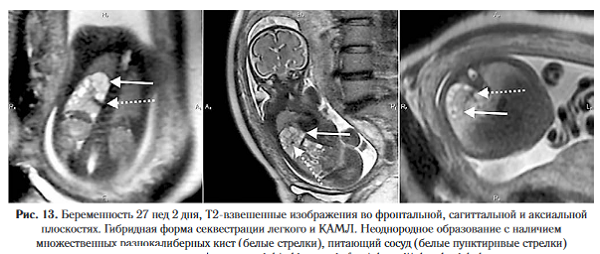
Гибридные формы (сочетание КАМЛ и легочной секвестрации). Различные бронхолегочные мальформации имеют общее эмбриональное происхождение, поэтому критерии, характерные для различных пороков развития, могут наблюдаться на уровне одного образования или встречаться сочетанно [22]. Одним из наиболее частых примеров является гибридная форма легочной секвестрации и КАМЛ II типа, кото¬рая включает поликистозное образование с наличием системного аберрантного кровотока (рис. 10, 13)., на Т2-ВИ является увеличенный гомогенный участок легкого с гиперинтенсивным сигналом, без нарушения сосудистого рисунка.
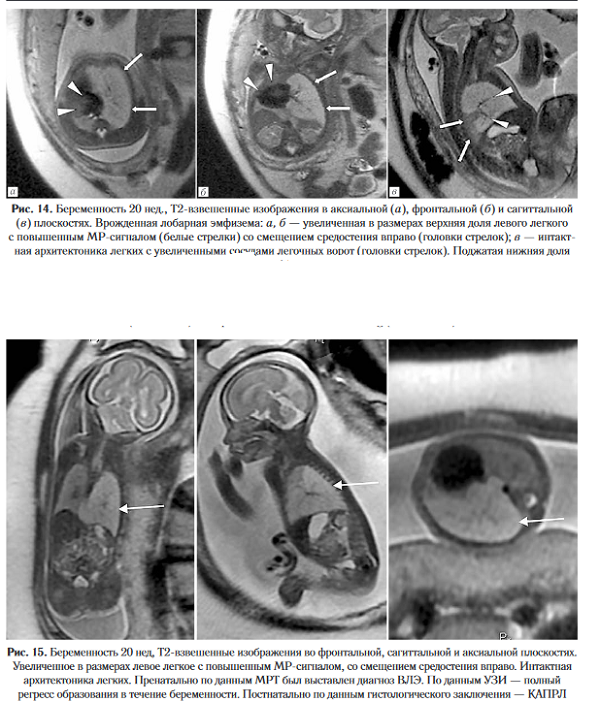
Диагноз устанавливается при наличии расширенных тубулярных структур на уровне легочных ворот, соответствующих увеличенным бронхам. На МРТ данный признак удается визуализировать чаще, чем при УЗИ [32]. Необходимо отметить, что пренатальная дифференциальная диагностика с микрокистозной формой КАМЛ может быть затруднительной (рис. 14, 15), что диктует необходимость проведения тщательного постнатального обследования.
По данным морфологических исследований уста-новлено, что около 50% КАПРЛ и ЛС относятся к «гибридным формами», в которых сочетаются признаки аномального строения ткани легкого, характерные для КАПРЛ и особенности кровоснабжения патологического участка, типичные для секвестрации [14, 27, 28]. В целом происхождение, морфологические особенности и клинические дан¬ные этих заболеваний очень схожи, что позволяет объединить их в одну группу.
Врожденная лобарная эмфизема. Врожденная лобарная эмфизема (ВЛЭ) — это аномалия развития легких, которая возникает на фоне бронхиальной обструкции клапанного типа и приводит к перерастяжению ткани легких без ее деструкции.
К непроходимости могут приводить как дефекты хряща в стенке бронха, так и воздействие на него извне (например, бронхогенной кистой или аномально расположенным сосудом) [29]. Частота встречаемости составляет 1 случай на 20000-30000 живорождений [30]. ВЛЭ редко локализуется более чем в одной доле легкого, чаще — на уровне задневерхушечного сегмента верхней доли слева (S1+S2), далее по частоте встречаемости идут верхняя, средняя и нижняя доли правого легкого [31]. Характерным признаком ВЛЭ
Бронхогенные кисты.
Бронхогенные кисты — это жидкостные образования, выстланные бронхи¬альным эпителием, возникающие на фоне нарушений формирования трахеобронхиального дерева.
Частота встречаемости достигает 20-30% от всех бронхолегочных мальформаций [34]. Большинство кист возникают на уровне средостения, около 15-20% случаев — в паренхиме легкого, чаще на уровне нижних долей [35]. Реже бронхогенные кисты встречаются на уровне шеи или субдиафрагмально. Описана локализация в твердой мозговой оболочке позвоночного канала [35]. Типичным признаком бронхогенной кисты является анэхогенное однока¬мерное образование с гиперинтенсивным сигналом на Т2-ВИ.
Дифференциальный диагноз включает макрокистозную форму КАМЛ. Кровоснабжение бронхогенных кист осуществляется из системы легочной артерии, что отличает их от секвестрации, получающей кровь из магистральных сосудов.
Алгоритм диагностики.
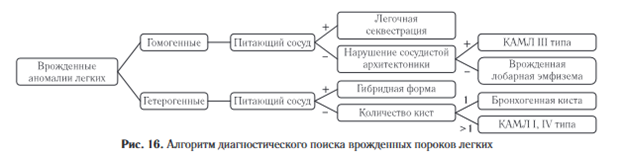
В зависимости от структуры образования все бронхолегочные мальформации могут быть разделены на однородные и гетерогенные. В свою очередь однородные включают образования с наличием питающего сосуда и без него.
Аномалии легочной ткани, имеющие аберрантное системное кровоснабжения относят к легочной секвестрации. Если питающего сосуда не выявлено, порок развития можно далее классифицировать по наличию деформации сосудистого рисунка. Гиперинтенсивный участок легкого, расположенный дистальнее увеличенного бронха с неизмененной сосудистой архитектоникой будет в большей степени соответствовать врожденной лобарной эмфиземе.
Гомогенное образование с деформацией сосудистого рисунка чаще представляет собой КАМЛ III типа [36, 37]. Гетерогенные образования, имеющие питающий сосуд, относят к гибридным формам (КАМЛ и секвестр). При отсутствии аберрантного кровоснабжения дифференциальный поиск включает в себя анализ размеров, количества и локализации кист; в ситуациях однокамерного периферического внутрилегочного образования более вероятен диагноз бронхогенной кисты. Если наблюдается множество кист, в зависимости от их размера предполагается легких. Фетальная МРТ используется для уточнения характера и протяженности изменений, более детальной оценки смежных органов, а также определения сочетанных пороков развития.
Всестороннее понимание особенностей лучевой семиотики пороков развития легочной системы наличие КАМЛ соответствующего типа (I, II или IV) (рис. 16).
Заключение.
УЗИ относится к основным методам диагностики врожденных аномалий развития и основных признаков указанных аномалий является основополагающим критерием пренатального консультирования, а также пери- и постнатального ведения данной категории пациентов.
Сведения об авторах:
Сыркашев Егор Михайлович — кандидат медицинских наук, научный сотрудник отделения лучевой диагностики федерального государственного бюджетного учреждения «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова» Министерства здравоохранения Российской Федерации; 117997, Москва, ул. Академика Опарина, д. 4
Машинец Наталья Валерьевна — кандидат медицинских наук, старший научный сотрудник отделения ультразвуковой и функциональной диагностики федераль-ного государственного бюджетного учреждения «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени акаде¬мика В. И.Кулакова» Министерства здравоохранения Российской Федерации; 117997, Москва, ул. Академика Опарина, д. 4;
Дорофеева Юлия Игоревнa — кандидат медицинских наук, заведующий по клинической работе отделения хирургии новорожденных федерального государствен-ного бюджетного учреждения «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И.Кулакова» Министерства здравоохранения Российской Федерации; 117997, Москва, ул. Академика Опарина, д.
Подуровская Юлия Леонидовна — кандидат медицинских наук, заведующий отделением хирургии новорожденных федерального государственного бюджетного учреждения «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова» Министерства здравоохранения Российской Федерации; 117997, Москва, ул. Академика Опарина, д. 4;
Гус Александр Иосифович — доктор медицинских наук, профессор, заведующий кафедрой ультразвуковой диагностики медицинского института факультета непре-рывного медицинского образования федерального государственного автономного образовательного учреждения высшего образования «Российский университет дружбы народов» (РУДН); 117198, Москва, ул. Миклухо-Маклая, д. 6; главный научный сотрудник отделения ультразвуковой и функциональной диагностики отдела визуальной диагностики федерального государственного бюджетного учреждения «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В. И. Кулакова» Министерства здравоохранения Российской Федерации; 117997, Москва, ул. Академика Опарина, д. 4;
ЛИТЕРАТУРА / REFERENCES
1. Farrugia M.K., Raza S.A., Gould S., Lakhoo K. Congenital lung lesions: classification and concordance of radiological appearance and surgical pathology // Pediatr. Surg. Int. 2008. Vol. 24, No. 9. Р 987-991. doi: 10.1007/s00383-008-2201-1.
2. Schittny J.C. Development of the lung // Cell Tissue Res. 2017. Mar; Vol. 367, No. 3. Р. 427-444. doi: 10.1007/s00441-016-2545-0.
3. Bulas D., Egloff A.M. Fetal chest ultrasound and magnetic resonance imaging: recent advances and current clinical applications // Radiol. Clin. North Am. Vol. 49, No. 5. Р 805-823, Sep. 2011, doi: 10.1016/j.rcl.2011.06.005.
4. Moshiri М., Mannelli L., Richardson M.L., Bhargava P., Dubinsky T.J. Fetal lung maturity assessment with MRI fetal lung-to-liver signal-intensity ratio // AJR.Am.J. Roentgenol. 2013. Vol. 201, No. 6. Р. 1386-1390. doi: 10.2214/AJR.12.9679.
5. Oka Y., Rahman M., Sasakura Ch., Waseda T., Watanabe Y., Fujii R., Makinoda S. Prenatal diagnosis of fetal respiratory function: Evaluation of fetal lung maturity using lung-to-liver signal intensity ratio at magnetic resonance imaging // Prenat. Diagn. 2014. Vol. 34, No. 13. Р 1289-1294,
6. Ogawa R., Kido T., Nakamura M., Kido T., Mochizuki T., Sugiyama T. Magnetic resonance assessment of fetal lung maturity: comparison between signal intensity and volume measurement // Jpn. J. Radiol. 2018. Vol. Jul; Vol. 36, No. 7. Р 444-449. . doi: 10.1007/s11604-018-0745-0.
7. Langston C. New concepts in the pathology of congenital lung malformations // Semin. Pediatr. Surg. 2003. Vol. 12, No. 1. Р 17-37.
8. Stocker J.T., Madewell J.E., Drake R.M. Congenital cystic adenomatoid malformation of the lung. Classification and morphologic spectrum // Hum. Pathol. Vol. 8, No. 2. Р 155-171, Mar. 1977, doi: 10.1016/s0046-8177(77)80078-6.
9. Stocker J.T. Cystic lung disease in infants and children // Fetal Pediatr. Pathol. 2009. Vol. 28, No. 4. Р 155-184. doi: 10.1080/15513810902984095.
10. Annunziata F., Bush A., Borgia F. et al. Congenital lung malformations: Unresolved issues and unanswered questions // Front. Pediatr. 2019. Vol. 7, No. Jun. Р. 1¬10. doi: 10.3389/fped.2019.00239.
11. Аdzick N.S., Harrison M.R., Crombleholme T.M., Flake A.W., Howell L.J. Fetal lung lesions: management and outcome // Am.J. Obstet. Gynecol. 1998. Vol. 179, No. 4. Р 884-889. doi: 10.1016/s0002-9378(98)70183-8.
12. Victoria T., Srinivasan A.S., Pogoriler J.et al. The rare solid fetal lung lesion with T2-hypointense components: prenatal imaging findings with postnatal pathological correlation // Pediatr. Radiol. 2018. Vol. 48, No. 11. Р 1556-1566.
13. Laje Р., Liechty K.W. Postnatal management and outcome of prenatally diagnosed lung lesions // Prenat. Diagn. Vol. 28, No. 7. Р 612-618, Jul. 2008, doi: 10.1002/pd.1966.
14. Gallardo M.A., Alvarez de la Rosa M.R., De Luis J.F.E, Mendoza L.R, Padilla A.I.P., Troyano J.L. Antenatal ultrasound diagnosis and neonatal results of the con¬genital cystic adenomatoid malformation of the lung // Rev. Chil. Pediatr. Vol. 89, No. 2. Р 224-230, Apr. 2018, doi: 10.4067/S0370-41062018000200224.
15. Walker L., Cohen K., Rankin J., Crabbe D. Outcome of prenatally diagnosed congenital lung anomalies in the North of England: a review of 228 cases to aid in prenatal counselling // Prenat. Diagn. 2017. Vol. 37, No. 10. Р 1001-1007.
16. Rodriguez M.R., de Vega V.M., Alonso R.C., Arranz J.C., Ten P.M., Pedregosa J. P., MR imaging of thoracic abnormalities in the fetus // Radiographics. 2012. Vol. 32, No. 7. doi: 10.1148/rg.327125053.
17. Kunisaki S.M., Ehrenberg-Buchner S., Dillman J.R., Smith E.A., Mychaliska G. B., Treadwell M.C. Vanishing fetal lung malformations: Prenatal sonographic char-acteristics and postnatal outcomes // J. Pediatr. Surg. 2015. Vol. 50, No. 6. Р 978-982. doi: 10.1016/j.jpedsurg.2015.03.025.
18. Liu Y.P., Chen C.P., Shih S.L., Chen Y.F., Yang F.S., Chen S.C. Fetal cystic lung lesions: evaluation with magnetic resonance imaging // Pediatr. Pulmonol. 2010. Vol. 45, No. 6. Р 592-600. doi: 10.1002/ppul.21226.
19. Kadyrberdieva K., Shmakov R.G., Bokeria B. Nonimmune hydrops fetalis: modern principles of diagnosis and treatment // Akush. Ginekol. (Sofiia). 2019. Vol. 10. Р. 28-34. doi: 10.18565/aig.2019.10.28-34.
20. Vu L., Tsao K., Lee H. et al. Characteristics of congenital cystic adenomatoid malformations associated with nonimmune hydrops and outcome // J. Pediatr. Surg. 2007. Vol. 42, No. 8. Р 1351-1356. doi: 10.1016/j.jpedsurg.2007.03.039.
21. Kumar M., Jha V., Singh A. Nonimmune Hydrops Fetalis: Factors Which Predict Outcome // J. Obstet. Gynaecol. India. 2018. Vol. 68, No. 3. Р 197-203. doi: 10.1007/s13224-017-1011-6.
22. Newman B. Congenital bronchopulmonary foregut malformations: Concepts and controversies // Pediatr. Radiol. 2006. Vol. 36, No. 8. Р. 773-791. doi: 10.1007/s00247-006-0115-4.
23. Gabelloni M., Faggioni L., Accogli S., Aringhieri G., Neri E. Pulmonary sequestration: What the radiologist should know // Clin. Imaging. 2021. Vol. 73. Р 61-72. doi: 10.1016/j.clinimag.2020.11.040.
24. Oliver E.R., DeBari S.E., Giannone M.M. et al. Going With the Flow: An Aid in Detecting and Differentiating Bronchopulmonary Sequestrations and Hybrid Lesions // J. Ultrasound Med. Off. J.Am.Inst. Ultrasound Med. 2018. Vol. 37, No. 2. Р 371-383. doi: 10.1002/jum.14346.
25. Johnson A.M., Hubbard A.M. Congenital anomalies of the fetal/neonatal chest // Semin. Roentgenol. 2004. Vol. 39, No. 2. Р 197-214. doi: 10.1053/j.ro.2003.12.006.
26. Meier A.H., Eggli K.D., Cilley R.E. Intradiaphragmatic extralobar sequestration-a rare pulmonary anomaly // J. Pediatr. Surg. 2009. Vol. 44, No. 12. Р e27-29. doi: 10.1016/j.jpedsurg.2009.09.026.
27. Di Prima F.A.F., Bellia A., Inclimona G., Grasso F., Teresa M., Cassaro M.N., Antenatally diagnosed congenital cystic adenomatoid malformations (CCAM): Research Review // J. Prenat. Med. 2012. Vol. 6, No. 2. Р 22-30.
28. Cavoretto P., Molina F., Poggi S., Davenport M., Nicolaides K. H. Prenatal diagnosis and outcome of echogenic fetal lung lesions // Ultrasound Obstet. Gynecol. Off. J. Int. Soc. Ultrasound Obstet. Gynecol. 2008. Vol. 32, No. 6. Р 769-783.
29. Langston C. New concepts in the pathology of congenital lung malformations // Semin. Pediatr. Surg. 2003. Vol. 12, No. 1. Р 17-37. doi: 10.1016/S1055- 8586(03)70004-3.
30. Oliver E.R., DeBari S.E., Horii S.C. et al. Congenital Lobar Overinflation: A Rare Enigmatic Lung Lesion on Prenatal Ultrasound and Magnetic Resonance Imaging // J. ultrasound Med. Off. J.Am.Inst. Ultrasound Med. 2019. Vol. 38, No. 5. Р 1229-1239. doi: 10.1002/jum.14801.
31. Mani H., Suarez E., Stocker J.T. The morphologic spectrum of infantile lobar emphysema: a study of 33 case // Paediatr. Respir. Rev. 2004. Vol. 5, Р S313-20. doi: 10.1016/s1526-0542(04)90056-5.
32. Johnston J.H., Kline-Fath B.M., Bitters C., Calvo-Garcia M.A., Lim F.Y.Y. Congenital overinflation: Prenatal MRI and US findings and outcomes // Prenat. Diagn. 2016. Vol. 36, No. 6. Р 568-575. doi: 10.1002/pd.4827.
33. Tsai P.S., Chen C.P., Lin D.C., Liu Y.P. Prenatal diagnosis of congenital lobar fluid overload // Taiwan. J. Obstet. Gynecol. 2017. Vol. 56, No. 4. Р 425-431.
34. Parikh D., Samuel M. Congenital cystic lung lesions: is surgical resection essential? // Pediatr. Pulmonol. 2005. Vol. 40, No. 6. Р 533-537. doi: 10.1002/ppul.20300.
35. Sarper A., Ayten A., Golbasi I., Demircan A., Isin E. Bronchogenic cyst // Texas Hear. Inst. J. 2003. Vol. 30, No. 2. Р 105-108.
36. Levine D., Barnewolt C.E., Mehta T.S., Trop I., Estroff J., Wong G. Fetal thoracic abnormalities: MR imaging // Radiology. 2003. Vol. 228, No. 2. Р 379-388. doi: 10.1148/radiol.2282020604.
37. Pacharn P. et al. Congenital lung lesions: Prenatal MRI and postnatal findings // Pediatr. Radiol. 2013. Vol. 43, No. 9. Р 1136-1143. doi: 10.1007/s00247-013- 2668-3.
Теги: пренатальная диагностика
234567 Начало активности (дата): 27.05.2025
234567 Кем создан (ID): 989
234567 Ключевые слова: пренатальная диагностика, МРТ плода, УЗИ, фетальная МРТ, ВПР, врожденные пороки развития легких
12354567899
Похожие статьи
Исторические аспекты становления и развития методов лучевой диагностики в перинатологииРентген на дому 8 495 22 555 6 8
Деформация Шпренгеля (случай из практики)
Ортопедические осложнения гемипаретических форм церебрального паралича: проблемы нижних конечностей (обзор литературы)
Возможности ультразвукового исследования коленного сустава в диагностике болезни Гоффа



