 24.03.2025
24.03.2025
Оценка эффективности субпараневральной блокады седалищного нерва у пациентов после реконсруктивно-корригирующих операций на стопе
Потребность в реконструктивно-корригирующих операциях на дистальном отделе нижней конечности остается на высоком уровне
Введение
Потребность в реконструктивно-корригирующих операциях на дистальном отделе нижней конечности остается на высоком уровне [1, 2, 3]. На базе ФГБУ «Федеральный центр травматологии, ортопедии и эндопротезирования» Минздрава России (ФГБУ «ФЦТОЭ» г. Барнаула) за последние три года наблюдается следующая статистика: реконструктивнокорригирующие операции на стопе выполнены в 2021 г. - 796, в 2022 г. - 957, в 2023 г. - 1036 людям. Остро стоит проблема послеоперационного обезболивания данной группы пациентов [4, 5, 6]. По данным проспективного когортного исследования, при оценке интенсивности болевого синдрома по визуальной аналоговой шкале (ВАШ) операции на стопе имеют самые высокие показатели интенсивности боли, а также послеоперационной анальгезии [7].
Клиническое значение послеоперационного болевого синдрома (ПБС) состоит в том, что он является фактором, индуцирующим развитие хирургического стресс-ответа, представляющего собой совокупность нейроэндокринных, метаболических и воспалительных процессов, развивающихся в ответ на хирургическую травму и боль и ведущих к изменению нормальной деятельности всех жизненно важных функциональных систем, пусковым фактором для формирования хронических болевых синдромов [8], а также способных привести к кардиальным осложнениям у некардиологических больных [9, 10]. На сегодняшний день повсеместно с целью лечения ПБС активно применяются концепция мультимодальной анальгезии, введение наркотических анальгетиков, нестероидных противовоспалительных средств. Однако методики, основанные на системном введении наркотических анальгетиков, даже контролируемая пациентом, не способны обеспечить достаточного качества анальгезии [11]. Современные исследования демонстрируют, что наряду с системным применением анальгетиков для эффективного снижения болезненных ощущений (минимизации стрессовой реакции организма) в схемы послеоперационного обезболивания также включают различные методы регионарной анестезии: инфильтрационную блокаду, блокаду нервов нижней конечности, эпидуральную анальгезию [12, 13, 14]. Поиск эффективного метода послеоперационной анальгезии на сегодняшний день продолжается, активно проводятся исследования по данной тематике, однако, несмотря на многочисленные попытки изучить данный вопрос, единого ответа нет [3, 12, 15].
Цель исследования - оценить эффективность субпараневральной блокады седалищного нерва в сравнении с мультимодальной анальгезией в послеоперационном периоде у пациентов, перенесших реконструктивно-корригирующие операции на стопе.
На основании вышесказанного авторы посчитали нужным провести сравнительную оценку эффективности проводниковой анестезии как компонента мультимодальной схемы обезболивания и системного введения анальгетиков в послеоперационном периоде у пациентов с реконструктивно-корригирующими операциями на стопе.
Материал и методы исследования
Одноцентровое проспективное рандомизированное исследование выполнено в период с 2023 по 2024 гг. на базе ФГБУ «ФЦТОЭ» г. Барнаула. Проведение исследования одобрено локальным этическим комитетом ФГБУ «ФЦТОЭ» г. Барнаула (протокол № 1 от 25.09.2023 г.). Пациенты, включенные в исследование, подписали информированное добровольное согласие на участие в исследование.
Критерии включения: возраст от 18 лет, отсутствие противопоказаний к регионарным видам анестезии, допустимая соматическая патология: компенсированная гипертоническая болезнь, ожирение 1-3-й степени, хроническая сердечная недостаточность (ХСН) 1-й стадии, согласие пациента на участие в исследовании.
Критерии исключения: абсолютные и относительные противопоказания к регионарным видам анестезии, отказ пациента от участия в исследовании на любом из этапов, наличие в анамнезе аллергических реакций на препараты, используемые для анестезии, физический статус пациентов III класс и выше в соответствии с классификацией Американского общества анестезиологов (ASA).
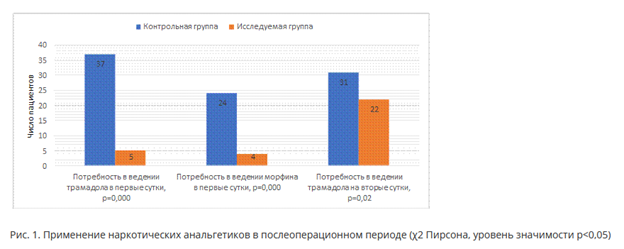
В исследование вошли 74 пациента, которым была выполнена реконструктивнокорригирующая операция на стопе. Пациенты рандомизированы с помощью генератора случайных чисел в соотношении 1:1 в зависимости от метода послеоперационной анальгезии. Контрольная и исследуемая группа сопоставимы по возрасту, полу, индексу массы тела (ИМТ), в соответствии с классификацией ASA (табл. 1).
Пациентам контрольной группы послеоперационная анальгезия проводилась по схеме: кетопрофен 100 мг 2 раза в сутки внутримышечно (в/м), парацетамол 1000 мг 3 раза в сутки внутривенно (в/в), в первые сутки в/м трамадол 100 мг 2 раза в сутки, на 2-е сутки - таблетированная форма трамадола 50 мг 2 раза в сутки per os. Пациентам исследуемой группы после спиномозговой анестезии (СМА) выполняли субпараневральную блокаду седалищного нерва на уровне нижней трети бедра, в послеоперационном периоде применяли кетопрофен 100 мг 2 раза в сутки в/м, парацетамол 1000 мг 3 раза в сутки в/в, наркотические анальгетики назначались при оценке пациентом интенсивности боли в покое в 4 и более баллов по 10балльной ВАШ, где 0 баллов - нет боли, 1-3 балла - легкая боль, 4-6 баллов - умеренная боль,
7-8 баллов - выраженная боль, 9-10 баллов - невыносимая боль. Если введение трамадола было неэффективно, с целью коррекции болевого синдрома вводили раствор морфина 10 мг в/м. В послеоперационном периоде в качестве меры тромбопрофилактики все пациенты получали ривароксабан в дозировке 10 мг 1 раз сутки уже через 6-8 часов после оперативного вмешательства на протяжении всего периода нахождения в стационаре.
Описание медицинского вмешательства
Пациентам были выполнены реконструктивно-корригирующие операции на стопе. Перед разрезом накладывали пневматическую манжету на верхнюю треть бедра, давление внутри манжеты - 300 мм рт. ст. Длительность оперативного вмешательства во всех случаях составила не более 60 минут. Регионарную анестезию выполнял один и тот же анестезиолог. В условии операционной проводили стандартный анестезиологический мониторинг витальных функций организма: измерение артериального давления каждые 5 минут, контроль ЭКГ во 2-м отведении, пульсоксиметрию, термометрию.
Всем пациентам выполняли СМА на уровне Liii - Liv, интратекально вводили изобарический 0,5%-ный раствор бупивакаина от 2 до 3 мл. Пациентам исследуемой группы сразу после СМА выполняли субпараневральную блокаду седалищного нерва на уровне нижней трети бедра с использованием ультразвуковой навигации и под контролем нейростимулятора [16]. Авторы в подколенной области с помощью ультразвукового аппарата и линейного датчика визуализировали анатомические структуры (подколенную артерию, подколенную вену, общий малоберцовый нерв, большеберцовый нерв). Далее находили область расхождения седалищного нерва на общий малоберцовый и большеберцовый нервы. В точке, где два нерва разделены перегородкой, но еще не представляют отдельные анатомические структуры, под ультразвуковым контролем направляли кончик иглы в область перегородки. После введения 20 мл 0,5%-ного раствора ропивакаина в качестве подтверждения правильности выполнения техники визуализируются ультразвуковая картина отслоения параневральной оболочки от эпиневрия, распространение анестетика проксимально и дистально вокруг нервов, как седалищного, так и его ветвей.
Всем пациентам проводили антибактериальную профилактику цефазолином 2 г в/в, внутривенную инфузию стерофундина 500-1000 мл, а также до операции в/в вводили дексаметазон 8 мг. По достижении сенсорно-моторного блока травматологическая бригада приступала к операции. Накануне операции всем пациентам проводили профилактику стрессязв (омепразол 40 мг per os), в интраоперационном периоде все пациенты получали мидазолам 2,5 мг внутривенно.
Оцениваемые параметры
Интенсивность боли определяли по 10-балльной ВАШ в покое каждые 12 часов в течение 3 дней с момента оперативного вмешательства. Учитывали потребность в дополнительном введении наркотических анальгетиков. При выполнении лабораторных методов исследования определяли концентрацию кортизола в сыворотке крови до операции и через 24 после нее, учитывали концентрацию С-реактивного белка (СРБ) - до операции, через 24 и 48 часов после хирургического вмешательства. Проводили учет наличия тромбозов в венах нижних конечностей (0 - нет тромбозов, 1 - есть тромбозы). Для визуализации тромбозов на 2-е сутки после операции применяли дуплексное сканирование вен нижних конечностей. Также принимали во внимание необходимость коррекции артериальной гипертензии дополнительным приемом гипотензивных препаратов, учитывались такие жалобы, как тошнота, рвота, общая слабость после операции, задержка мочи (0 - отсутствие жалобы, 1 - наличие жалобы).
Статистический анализ
Полученные результаты обрабатывали в программе Microsoft Excel 2010 (Microsoft Corporation, США), IBM SPSS Statistics 23 (IBM Corporation, США). В связи с тем, что первичные данные не соответствовали закону о нормальном распределении, все показатели представлены в виде медианы и межквартильного размаха - Ме[01; Q3]. Для выявления статистически значимых различий количественных данных для несвязанных выборок применяли U-критерий Манна-Уитни, дисперсионный анализ Фридмана, для сравнения в параллельных группах - критерий Уилкоксона. Для сравнения качественных данных использовали критерий х2 Пирсона. Статистически значимым был принят уровень p<0,05.
Результаты исследования их обсуждение
При оценке клинической характеристики обследованных пациентов (табл. 1) не было выявлено статистически значимых различий по полу, возрасту, ИМТ, физическому статусу пациентов в соответствии с классификацией ASA между группами сравнения.
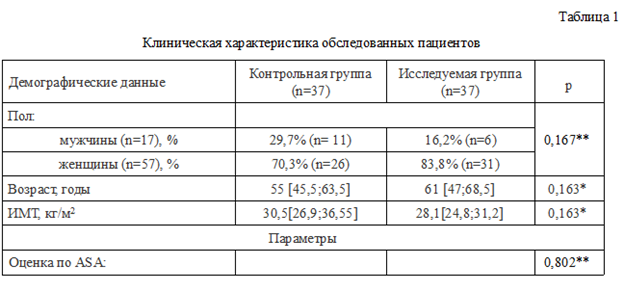

Оценка интенсивности болевого синдрома по ВАШ показала статистически значимое различие между группами в первые 24 часа после операции, в последующие часы различий не обнаружено (табл. 2).
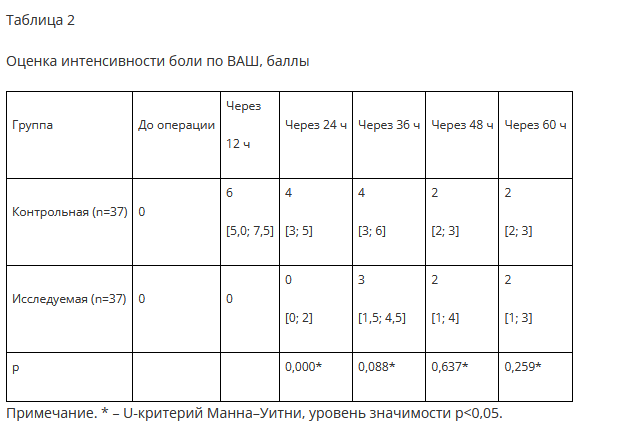
Анализ потребности пациентов в наркотических анальгетиках (рис. 1) показал значимое различие в применении трамадола и морфина.
Оценка концентрации кортизола в крови до операции и через 24 часа после операции при сравнении несвязанных выборок не показала статистически значимого различия (табл. 3),
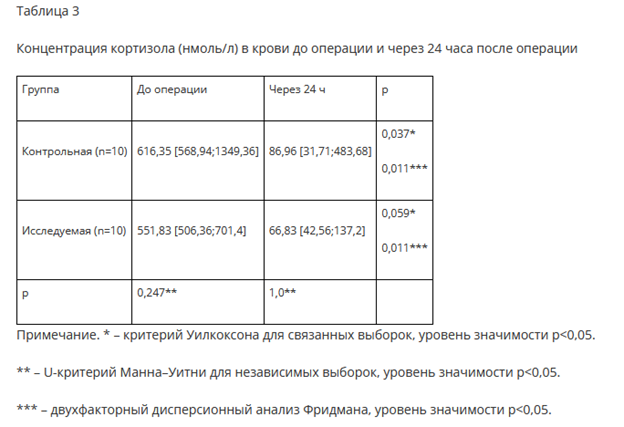
Сравнение уровня СРБ (мг/л) крови до операции, через 24 часа и через 48 часов после операции выявило статистически значимые различия между группами через 24 часа (U- критерий Манна-Уитни для независимых выборок, р=0,02) и через 48 часов после операции (U-критерий Манна-Уитни для независимых выборок, р=0,002), а также во всех контрольных точках в параллельных группах (двухфакторный дисперсионный анализ Фридмана, критерий Уилкоксона для связанных выборок, уровень значимости p<0,05) (рис. 2).
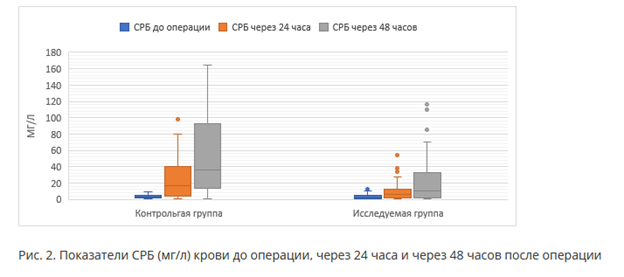
При сравнении жалоб пациентов в первые 24 часа после операции (рис. 3) наблюдается статистически значимое снижение числа пациентов в исследуемой группе с жалобами на чувство тошноты, наличие рвоты, на общую слабостью, а также с потребностью в дополнительном назначении антигипертензивных препаратов и с жалобами на задержку мочи.
Всем пациентам на следующие сутки после оперативного вмешательства было выполнено дуплексное сканирование вен нижних конечностей (рис. 3). В контрольной группе у одного пациента был обнаружен тромбоз берцовых вен оперированной конечности, в исследуемой группе тромбозов не выявили (р=0,315).
Анализ послеоперационного болевого синдрома при оценке по ВАШ позволил выявить существенные статистически значимые различия в группах сравнения в первые сутки, что подтверждает гипотезу авторов о том, что применение субпараневральной блокады седалищного нерва способно оказывать анальгетическое действие в раннем
послеоперационном периоде (табл. 2). При анализе потребности дополнительного обезболивания в 1-е сутки после операции отмечается, что в исследуемой группе введение трамадола потребовалось в 7,4 раза меньше, чем в контрольной группе. В исследуемой группе частота применения раствора морфина была в 6 раз реже в сравнении с частотой применения данного препарата у пациентов контрольной группы. На 2-е сутки тенденция различия в частоте применения трамадола сохранилась, данный препарат в 1,4 раза чаще вводился пациентам контрольной группы, потребности во в/в введении морфина не было в обеих группах. Полученные авторами результаты находят подтверждение и в других исследованиях. В частности, в работе Н.А. Мурашовой с соавторами указывается на преимущество комбинации спинальной анестезии с блокадами нервов нижней конечности, заключающееся в улучшении послеоперационного обезболивания, в сравнении с применением только спинальной анестезии [4]. Подобные же данные представлены в систематических обзорах Arianna L Gianakos с соавторами и Myeongjong Lee с соавторами, в которых было показано, что блокада периферических нервов нижней конечности снижает потребность пациентов во введении наркотических анальгетиков после операции по сравнению со спинальной анестезией при плановой хирургии стопы [17, 18]. В целом указанные выше исследования подтверждают данные авторов о том, что использование блокады периферических нервов позволяет продлить период эффективной анальгезии в послеоперационном периоде, при этом комбинация спинальной и проводниковой анестезий видится самым эффективным сочетанием. Анализируя полученные авторами данные, следует отметить, что у части пациентов исследуемой группы потребовалось назначение наркотических анальгетиков. В первую очередь авторы связывают данное обстоятельство с тем, что при блокаде седалищного нерва остаются незаблокированными участки иннервации подкожного нерва (ветвь бедренного нерва), что также отмечено в одной из работ [3].
Одним из положительных проявлений методов проводниковой анестезии является влияние на регионарный кровоток и микроциркуляцию, что, в свою очередь, может проявиться в меньшей выраженности воспалительной реакции в ответ на операционную травму [3, 19, 20]. Маркером, который авторы использовали для оценки воспалительной реакции организма в ответ на травму, был уровень СРБ, относящийся к белку острой фазы воспаления, изменяющийся в зависимости от выраженности воспаления [21]. Анализ изменения медианы концентрации СРБ показал различия в каждой группе на всех этапах исследования после операции (рис. 2). Однако выраженность воспалительного процесса и динамика роста данного маркера воспаления были более значимы в контрольной группе. Данный факт находит свое подтверждение в исследованиях, которые демонстрируют снижение показателей воспалительных маркеров при эффективном обезболивании [20, 22].
Результаты нейроэндокринных изменений оказались неоднозначными. Афферентные импульсы, исходящие из области операционной травмы и достигающие гипоталамуса, вызывают изменения уровня гормонов стресса [22].
Однако авторы не увидели статистически значимого различия между группами по уровню кортизола через 24 часа после операции. Показатели концентрации кортизола в крови пациентов в период до операции в обеих группах превышали нормальные значения, медианы составили 616 нмоль/л и 551,8 нмоль/л (табл. 3). Через 24 часа наблюдается снижение в 7-8 раз значений концентрации кортизола в обеих группах, до 86,9 и 66,8 нмоль/л соответственно (p<0,05). Эти изменения не имели общей тенденции с показателями оценки интенсивности боли, а наоборот, носили разнонаправленный характер. Такие значения концентрации кортизола могут являться следствием психологического стресса, который авторы не учитывали в своем исследовании, однако он способен оказывать значительное влияние на уровень кортизола в зависимости от выраженности самого стресса и степени тревожности, что описывается в одном из научных исследований [23]. Поскольку полученные данные были противоречивыми и не соответствовали как нулевой, так и альтернативной гипотезе, было принято решение прекратить дальнейшую оценку концентрации кортизола.
У пациентов, которым дополнительно проводили проводниковую анестезию, в 1-е сутки после операции наблюдали существенное уменьшение частоты случаев возникновения нежелательных явлений, таких как тошнота и рвота (1 vs 21, 0 vs 9), в сравнении с пациентами контрольной группы. Данные различия, вероятно, связаны с меньшим использованием наркотических обезболивающих при сравнительно менее интенсивном болевом синдроме (табл. 2, рис. 1, 3). Описанные нежелательные события сочетались с жалобами в послеоперационном периоде на общую слабость, которая отмечалась в 2,4 раза чаще (31 vs 13) у пациентов группы контроля, p<0,001.
Артериальная гипертензия может быть следствием выброса катехоламинов и усиления симпатического тонуса в раннем послеоперационном периоде в ответ на ноцицептивные стимулы. Снижение артериального давления понадобилось в 5 раз реже (р=0,007) пациентам исследуемой группы, что тоже может указывать на эффективность выбранной стратегии обезболивания, что также описывается в работах авторов [9, 11, 22].
Еще одним нежелательным явлением, оцениваемым в данном исследовании, была задержка мочи (рис. 3). У пяти пациентов из контрольной группы была отмечена эта проблема в течение 1-х суток, что, вероятно, связано с более частым использованием наркотических анальгетиков в послеоперационной схеме анальгезии. Известно, что регионарные методы анестезии, улучшая циркуляцию крови, могут способствовать снижению возникновения послеоперационных венозных тромбозов [11, 20]. Однако авторам не удалось выявить статистически значимых различий, р=0,315. Вероятно, применение антикоагулянтов оказывает достаточно эффективное профилактическое действие в предотвращении венозных тромбозов (рис. 3).
Заключение
Применение субпараневральной блокады седалищного нерва на уровне нижней трети бедра позволяет эффективно снижать интенсивность послеоперационной боли, уменьшает потребность в наркотических анальгетиках и риски нежелательных событий, а также способствует снижению воспалительной реакции организма, развивающейся в ответ на травму после реконструктивно-корригирующих оперативных вмешательств на стопе.
Список литературы
Burton A., Aynardi M.C., Aydogan U. Demographic Distribution of Foot and Ankle Surgeries Among Orthopaedic Surgeons and Podiatrists: A 10-Year Database Retrospective Study // Foot & Ankle Specialist. 2021. Vol. 14. Is. 3. P. 206-212. DOI: 10.1177/1938640020910951.
Cai Y., Song Y., He M., He W., Zhong X., Wen H., Wei Q. Global prevalence and incidence of hallux valgus: a systematic review and meta-analysis // Journal of Foot and Ankle Research. 2023.Vol. 16. Is. 1. P. 63.
Корышков Н.А., Ларионов С.В., Мурашова Н.А., Соболев К.А. Обезболивание при операциях на стопе и голеностопном суставе (обзор литературы) // Травматология и ортопедия России. 2012. Т. 18. № 3. С. 118-126.
Мурашова Н.А., Любошевский П.А., Ларионов С.В., Ганерт А.Н. Оценка состояния вегетативной нервной системы у пациентов с травмой дистального отдела нижней конечности в периоперационном периоде в зависимости от вида анестезии // Регионарная анестезия и лечение острой боли. 2015. Т. 9. № 3. С. 14-18.
Small C., Laycock H. Acute postoperative pain management // British Journal of Surgery. 2020. Vol. 107. Is. 2. P. 70-80. DOI: 10.1002/bjs.11477.
Garda L.T.C., Ponce FEE., Esparza ACM. // Postoperative Pain in Orthopedics. Topics in Postoperative Pain. 2023. P. 1-2. DOI: 10.5772/intechopen.111880.
Gerbershagen H.J., Aduckathil S., van Wijck A.J., Peelen L.M., Kalkman C.J., Meissner W. Pain intensity on the first day after surgery: a prospective cohort study comparing 179 surgical procedures // Anesthesiology. 2013. Vol. 118. Is. 4. P. 934-944. DOI: 10.1097/ALN.0b013e31828866b3.
Ямщиков О.Н., Киреев С.И., Марков Д.А. Микроциркуляторные нарушения у больных с патологией опорно-двигательного аппарата (обзор литературы) // Вестник Тамбовского университета. Серия: Естественные и технические науки. 2011. Т. 1. С. 339-342.
Забродин О.Н., Страшнов В.И. Механизмы защитного действия регионарной анестезии в отношении развития кардиальных осложнений при некардиохирургических операциях // Вестник анестезиологии и реаниматологии. 2023. Т. 20. № 3. С. 103-110. DOI: 10.24884/2078- 5658-2023-20-3-103-110.
Jakobsen C.-J. High thoracic epidural in cardiac anesthesia // Seminars in Cardiothoracic and Vascular Anesthesia. 2015. Vol. 19. Is. 1. P. 38-48. DOI: 10.1177/1089253214548764.
Овечкин А.М. Послеоперационная боль: состояние проблемы и современные тенденции послеоперационного обезболивания // Регионарная анестезия и лечение острой боли. 2015. Т. 9. № 2. С. 34.
Комкин В.А., Бабушкин В.Н., Жирова Т.А., Руднов В.А. Местная однократная инфильтрационная анальгезия послеоперационной раны у пациентов после эндопротезирования коленного и тазобедренного суставов // Фундаментальные исследования. 2014. Т. 4. № 3. С. 524-529.
Bringuier S., Xavier С., Dadure C., Bernard N. Effect of patient-controlled perineural analgesia on rehabilitation and pain after ambulatory orthopedic surgery // Anesthesiology. 2006. Vol. 105. Is. 3. P. 566-573. DOI: 10.1097/00000542-200609000-00022.
Boezaart A.P. Perineural Infusion of Local Anesthetics // Anesthesiology. 2006. Vol. 104. Is. 4. P. 872-880. DOI: 10.1097/00000542-200604000-00033.
Андрианова Т.О., Ежевская А.А., Герасимов С.А., Загреков В.И., Военнов О.В. Оптимальный метод послеоперационного обезболивания при эндопротезировании коленного сустава: двойное слепое рандомизированное исследование // Анестезиология и реаниматология. 2023. № 2. С. 34-43. DOI: 10.17116/anaesthesiology202302134.
Karmakar M.K., Reina M.A., Sivakumar R.K., Areeruk P., Pakpirom J., Sala-Blanch X. Ultrasound-guided subparaneural popliteal sciatic nerve block: there is more to it than meets the eyes // Regional anesthesia and pain medicine. 2021. Vol. 46. Is. 3. P. 268-275 DOI: 10.1136/rapm-2020- 101709.
Gianakos A.L., Romanelli F., Rao N., Badri M., Lubberts B., Guss D., DiGiovanni C.W. Combination Lower Extremity Nerve Blocks and Their Effect on Postoperative Pain and Opioid Consumption: A Systematic Review // The journal of Foot and Ankle surgery. 2021. Vol. 60. Is. 1. P. 121-131. DOI: 10.1053/j.jfas.2020.08.026.
Lee M., Lee C., Lim J., Kim H., Choi Y.-S, Kang H. Comparison of a peripheral nerve block versus spinal anesthesia in foot or ankle surgery: A systematic review and meta-analysis with a trial sequential analysis // Journal of Personalized Medicine. 2023. Vol. 13. Is. 7. P. 1096. DOI:10.3390/jpm13071096.
lang R.S., Gorantla V.S., Esper S. Anesthetic management in upper extremity transplantation: the Pittsburgh experience // Anesthesia and analgesia. 2012. Vol. 115. Is. 3. P. 678-688. DOI: 10.1213/ANE.0b013e31825da401.
Заболотский Д.В., Корячкин В.А. Лечебные эффекты регионарных блокад у пациентов с ортопедической патологией // Медицина: теория и практика. 2018. Т. 3. № 4. С. 59-64.
Первушин Ю.В., Вельков В.В., Путренок Л.С. СОЭ и СРБ: что предпочтительней? // Лаборатория. 2007. № 1 С. 14-15.
Китиашвили И.З., Власов А.С., Парфенов Л.Л., Миньковецкий В.Д., Закляков К.К. Влияние различных методов анестезии на эндокринно-метаболическое звено хирургического стресс-ответа при гистерэктомии // Регионарная анестезия и лечение острой боли. 2010. Т. 4. № 3. С. 18-26.
Schlotz W. Investigating associations between momentary stress and cortisol in daily life: What have we learned so far // Psychoneuroendocrinology. 2019. Vol. 105. Is. 7. P. 105-116. DOI: 10.1016/j.psyneuen.2018.11.038.
Штарк А.В. , Бережняк И.В. , Эпп П.Я., Воеводская Л.Ю., Батрак Ю.М., Пелеганчук В.А.
ФГБУ «Федеральный центр травматологии, ортопедии и эндопротезирования» Минздрава России
Теги: седалищный нерв
234567 Начало активности (дата): 24.03.2025 09:00:00
234567 Кем создан (ID): 989
234567 Ключевые слова: субпараневральная блокада, седалищный нерв, мультимодальная анальгезия, С- реактивный белок, кортизол
12354567899
Похожие статьи
Повреждения тазового кольцаРентген на дому 8 495 22 555 6 8
Перелом дна глазницы
Вывих шейного позванка
Редкое осложнение после эндоскопического невролиза седалищного нерва: клинический случай



