 31.01.2025
31.01.2025
Современный взгляд к вопросу взаимосвязи патофизиологии и терапии мультифокального атеросклероза и остеопороза
Сердечно-сосудистые заболевания лидируют среди причин смерти и инвалидности взрослого населения экономически развитых стран мира
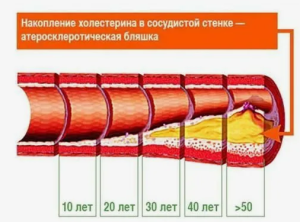
Атеросклероз - хроническое воспалительное заболевание, которое преимущественно поражает крупные и средние эластические и мышечные артерии [41]. Заболевание характеризуется накоплением жировых полос и атеросклеротических бляшек во внутреннем слое стенки артерий, известном как интима [30]. Этот процесс обусловлен сложным взаимодействием клеточных, молекулярных и гемодинамических факторов (Evangeline S.D., Iyer P.R., 2021). Эндотелиальные клетки образуют внутреннюю оболочку кровеносных сосудов и играют ключевую роль в поддержании сосудистого гомеостаза. Они контролируют проницаемость стенки сосуда, регулируют тонус расположенных ниже гладкомышечных клеток сосудов и препятствуют тромбообразованию, вырабатывая антикоагулянтные и фибринолитические молекулы. Начало атеросклероза тесно связано с дисфункцией эндотелия - патологическое состояние, при котором эндотелиальные клетки утрачивают свои защитные и регуляторные функции. Некоторые стимулы, такие как окислительный стресс, воспаление, гиперлипидемия, гипертония, диабет и курение, могут нарушить целостность эндотелия и способствовать развитию провоспалительного, протромботического и вазоконстриктивного фенотипа [4]. Дисфункциональный эндотелий становится проницаемым для липопротеинов плазмы, особенно липопротеинов низкой плотности (ЛПНП). Частицы ЛПНП проникают в интиму, где они подвергаются окислительной модификации с образованием окисленного ЛПНП (oxLDL) [18]. Присутствие oxLDL в артериальной стенке является ключевым триггером для последующей воспалительной реакции [48]. Эндотелиальные клетки в ответ на oxLDL повышают экспрессию молекул адгезии (таких как VCAM-1 и ICAM-1) и выделяют хемотаксические факторы (такие как MCP-1), привлекая циркулирующие моноциты и Т-лимфоциты в интимальный слой. Под воздействием колониестимулирующих факторов (например, M-CSF) моноциты дифференцируются в макрофаги [30]. Эти макрофаги экспрессируют рецепторы сборщика отходов (например, SR-A и CD36), которые интернализируют окси-ЛПНП, что приводит к их превращению в пенистые клетки, содержащие липиды. Пенистые клетки являются отличительной чертой атеросклеротических поражений и способствуют прогрессированию заболевания за счет секреции провоспалительных цитокинов и факторов роста [46].
Со временем продолжающееся накопление пенистых клеток в сочетании с пролиферацией и миграцией сосудистых гладкомышечных клеток (VSMC) из медии в интиму приводит к формированию атеросклеротической бляшки. VSMC, стимулируемые факторами роста (такими как PDGF и TGF-P), выделяемыми активированными эндотелиальными клетками, макрофагами и Т-клетками, производят белки внеклеточного матрикса, способствуя образованию фиброзной пробки, которая заключает в себе липидное ядро бляшки. По мере прогрессирования заболевания сложное взаимодействие провоспалительных и прорезорб- тивных механизмов, а также факторы, влияющие на стабильность бляшки (например, матриксные металлопротеиназы), определяют конечную судьбу атеросклеротического поражения - остается ли оно стабильным, регрессирует или разрывается, приводя к тромбозу и острым клиническим проявлениям.
Мультифокальный атеросклероз означает наличие атеросклеротических поражений в нескольких артериальных руслах, что отражает широко распространенный системный процесс [70]. Такой диффузный характер заболевания подчеркивает важность контроля системных факторов риска и выдвигает на первый план задачу выявления пациентов с высоким риском сердечно-сосудистых событий в будущем (Kozhanova T.V., Neudakhin E.V. et al., 2018).
Остеопороз, если рассматривать его с точки зрения патофизиологии, представляет собой широко распространенное заболевание, поражающее скелетную систему.
Это заболевание характеризуется постоянным уменьшением объема костной массы в сочетании с одновременной деградацией структуры костного аппарата [79].
Вследствие этого ткани становятся все более хрупкими, что повышает вероятность переломов. В условиях демографического роста стареющего населения планеты последствия остеопороза, особенно связанные с ним осложнения, становятся все более серьезной проблемой для общественного здравоохранения [47].
Кость, вопреки распространенному мнению, является высокодинамичной тканью, которая подвергается постоянному ремоделированию - циклическому процессу резорбции и формирования, который поддерживает здоровье костной ткани и регулирует гомеостаз кальция в организме. В процессе ремоделирования кости остеокласты, крупные многоядерные клетки гемопоэтического происхождения, начинают цикл с резорбции минерализованной костной ткани [15]. Затем остеобласты, происходящие из мезенхимальных стволовых клеток, откладывают органические матричные белки, которые подвергаются минерализации для формирования новой кости. Остеоциты, зрелые остеобласты, встроенные в костный матрикс, выступают в качестве организаторов ремоделирования кости, воспринимая механические нагрузки и подавая сигналы остеокластам и остеобластам [75]. Остеопороз возникает, когда этот тщательно регулируемый процесс нарушается, когда резорбция кости начинает опережать ее образование, что приводит к потере костной массы (Lavanya S.A., Rachel J., Jagadeeswari J., 2022). Этот процесс часто протекает незаметно, пока не проявляется клинически в виде случаев хрупких переломов [65]. Клеточные и молекулярные нарушения Патофизиология остеопороза включает в себя сложное взаимодействие генетических, гормональных и экологических факторов [5]. Одним из ключевых молекулярных механизмов, вовлеченных в патогенез остеопороза, является система сигналов из трех систем, включающая рецепторный активатор ядерного фактора (RANK), его лиганд (RANKL) и остеопротегерин (OPG). RANKL является членом суперсемейства фактора некроза опухоли (TNF), экспрессия которого осуществляется преимущественно остеобластами и остеоцитами. Он взаимодействует с RANK, рецептором, находящимся на поверхности предшественников остеокластов.
Взаимодействие RANK- RANKL запускает каскад внутриклеточных сигнальных событий, приводящих к дифференциации предшественников остеокластов в зрелые остеокласты, разрушающие кость [63]. Он также увеличивает продолжительность жизни зрелых остеокластов, подавляя апоптоз. OPG действует как растворимый рецептор-"приманка" для RANKL. Вырабатываемый остеобластами и остеоцитами, он конкурирует с RANK за связывание с RANKL (Kumar D.I. et al., 2022).
Связываясь с RANKL, OPG ингибирует взаимодействие RANK-RANKL, тем самым подавляя образование и активацию остеокластов и способствуя их апоптозу [62]. В здоровом состоянии баланс между RANKL и OPG поддерживает гомеостаз костной ткани. Однако при остеопорозе этот баланс нарушается, и соотношение RANKL/OPG увеличивается. Это изменение меняет баланс в пользу остеокластогенеза, что приводит к увеличению резорбции кости по сравнению с ее формированием [84]. На баланс RANKL/OPG могут влиять многочисленные факторы, включая старение, половые гормоны, цитокины и другие сигнальные молекулы [50]. Например, было обнаружено, что дефицит эстрогена, распространенное состояние у женщин в постменопаузе, повышает экспрессию RANKL и снижает выработку OPG, тем самым способствуя остеокластогенезу и резорбции кости [67]. Понимание молекулярных и клеточных механизмов, лежащих в основе остеопороза, может дать ценную информацию для разработки новых терапевтических стратегий для лечения этого изнурительного заболевания. Будущие исследования должны быть направлены на выявление новых молекулярных мишеней и разработку препаратов, способных эффективно модулировать баланс RANKL/OPG и восстанавливать гомеостаз костной ткани (Hooshiar S.H. et al., 2022).
Появляющиеся научные данные свидетельствуют об интригующей взаимосвязи между остеопорозом и атеросклерозом, которые встречаются чаще, чем обычно, особенно среди пожилых людей. Эти заболевания имеют общий спектр факторов риска, включая пожилой возраст, табак курение, гиподинамию и недостаточность эстрогенов в постменопаузе.
Эпидемиологические исследования позволили установить взаимосвязь между снижением минеральной плотности костной ткани, что является отличительной чертой остеопороза, и частотой развития атеросклеротических заболеваний, предполагая возможную взаимосвязь патофизиологических путей [19]. Было сформулировано несколько гипотез, согласно которым хроническое системное воспаление, чрезмерный окислительный стресс и аберрантный минеральный обмен являются общими механистическими элементами, способствующими развитию остеопороза и атеросклероза [59]. Дальнейшее изучение этих предполагаемых связей является оправданным и потенциально может дать новое понимание патогенетических механизмов, лежащих в основе этих двух распространенных заболеваний. Это исследование также может проложить путь к инновационным терапевтическим стратегиям, направленным одновременно и на остеопороз, и на атеросклероз.
Сложная взаимосвязь между мультифокальным атеросклерозом и остеопорозом является предметом серьезного научного исследования [13]. Эти два патологических состояния часто проявляются в сочетании друг с другом, особенно среди гериатрической популяции, что указывает на возможную взаимосвязь в их патофизиологических механизмах [2].
Существуют определенные факторы риска, которые являются общими для обоих расстройств.
Повышение возраста, например, является основным фактором риска, поскольку и атеросклероз, и остеопороз в значительной степени зависят от процесса старения (Skripnikova I.A. et al., 2021). Старение связано с дисфункцией эндотелия, повышением жесткости артерий и провоспалительным состоянием, которые способствуют развитию атеросклероза [45]. Одновременно со старением возникает дисбаланс в ремоделировании костной ткани, при котором резорбция преобладает над формированием, что приводит к остеопорозу.
Сидячий образ жизни или недостаток физической активности - еще один общий фактор риска. Регулярная физическая активность оказывает комплексное защитное действие против атеросклероза и остеопороза, в первую очередь за счет модуляции физиологических параметров, относящихся к этим заболеваниям [24]. В частности, при атеросклерозе физическая активность благотворно влияет на липидный обмен, снижая уровень холестерина липопротеинов низкой плотности (LDL-C) и повышая уровень холестерина липопротеинов высокой плотности (HDL-C), известного как "хороший" холестерин благодаря его роли в обратном транспорте холестерина [11]. Дополнительно регулярные занятия физической культурой способствуют снижению уровня триглицеридов - еще одного класса липидов, участвующих в атерогенезе. Физические упражнения увеличивают выработку эндотелиальными клетками оксида азота, мощного вазодилататора и ингибитора агрегации тромбоцитов. Это приводит к улучшению вазодилатации и
снижению воспалительной реакции, что является ключевым фактором в предотвращении развития атеросклеротических бляшек (Cantanhede N.A. et al., 2022). Регулярная физическая активность, особенно упражнения с утяжелением и на сопротивление, помогают противостоять потере костной ткани и стимулируют ее формирование, что имеет значение при остеопорозе. Механическая нагрузка, оказываемая на кость во время таких упражнений, приводит к деформации кости, что является мощным стимулом для формирования костной ткани. Это достигается благодаря механотрансдукции - процессу, в ходе которого механические сигналы преобразуются в биохимические реакции, приводящие к повышению активности остеобластов и отложению костного матрикса. Кроме того, физические упражнения повышают уровень кальцитонина, гормона, который непосредственно подавляет функцию остеокластов и способствует их апоптозу [53]. Этот двойной эффект физических упражнений на процесс ремоделирования костной ткани может привести к общему увеличению массы и плотности костной ткани, тем самым снижая риск развития остеопороза [81]. Женщины в постменопаузе подвержены повышенному риску развития атеросклероза и остеопороза, прежде всего, из-за значительного снижения уровня эстрогена, сопровождающего менопаузу. Этот гормональный сдвиг оказывает значительное влияние на многие системы организма, в частности, на сердечно-сосудистую и скелетную системы [16].
В отношении атеросклероза известно, что эстроген оказывает ряд кардиопротекторных эффектов, которые ослабевают по мере снижения его уровня после менопаузы. Одним из таких эффектов является положительная модуляция липидного обмена. Эстроген способствует выработке холестерина липопротеинов высокой плотности (HDL-C), который участвует в обратном транспорте холестерина, тем самым снижая риск образования атеросклеротических бляшек. И наоборот, эстроген способствует снижению уровня холестерина липопротеинов низкой плотности (LDL-C) и триглицеридов, которые способствуют развитию атеросклероза. Дефицит эстрогена у женщин в постменопаузе может привести к менее благоприятному липидному профилю, тем самым повышая риск развития атеросклероза [58]. Кроме того, эстроген играет важнейшую роль в поддержании здоровья эндотелия.
Он стимулирует выработку оксида азота, мощного вазодилататора, и обладает противовоспалительными свойствами, тем самым уменьшая воспаление сосудов, ключевого игрока в патогенезе атеросклероза [66]. При снижении уровня эстрогена эти защитные механизмы ослабевают, тем самым повышая восприимчивость к воспалению сосудов и дисфункции эндотелия, которые являются предшественниками атеросклероза [55]. В аспекте остеопороза эстроген является важнейшим регулятором ремоделирования костной ткани. Он подавляет костную резорбцию, опосредованную остеокластами, и способствует костеобразованию, опосредованному остеобластами [52].
Снижение уровня эстрогена во время менопаузы нарушает этот баланс, благоприятствуя резорбции костной ткани, а не ее формированию [77]. Это ускоряет потерю костной массы, что приводит к снижению минеральной плотности костной ткани - отличительному признаку остеопороза. Более того, дефицит эстрогена увеличивает выработку провоспалительных цитокинов, таких как интерлейкин-1 (IL-1), интерлейкин-6 (IL-6) и фактор некроза опухоли-альфа (TNF-a). Эти цитокины могут стимулировать остеокластогенез, что способствует усилению резорбции костной ткани, наблюдаемой при остеопорозе [60]. Этот общий профиль факторов риска предполагает потенциально общие патофизиологические пути, лежащие в основе мультифокального атеросклероза и остеопороза, что требует дальнейшего изучения. Эпидемиологическое пересечение остеопороза и атеросклероза выявило заметную корреляцию между снижением минеральной плотности костной ткани и увеличением распространенности атеросклеротических заболеваний [54]. Такое совпадение указывает на наличие общих патофизиологических путей, которые играют важную роль в совместной манифестации этих двух заболеваний [29]. Хроническое системное воспаление, характеризующееся длительной и нерегулируемой активацией иммунного ответа организма, является связующим звеном многочисленных хронических заболеваний, включая остеопороз и атеросклероз. Постоянная активация воспалительных путей при этих заболеваниях опосредуется различными провоспалительными цитокинами и хемокинами, которые выделяются многочисленными типами клеток, включая иммунные клетки, эндотелиальные клетки и клетки костного микроокружения из-за различных триггеров, включая старение, ожирение, метаболический синдром, курение, аутоиммунные заболевания и др. При атеросклерозе хронический воспалительный ответ оказывает несколько ключевых эффектов на артериальную стенку, которые способствуют образованию бляшек. Во-первых, провоспалительные цитокины, такие как фактор некроза опухоли-альфа (TNF-a), интерлейкин-1 (IL-1) и интерлейкин-6 (IL- 6), могут вызывать дисфункцию эндотелия, нарушая эндотелиальный барьер [83], способствуя экспрессии молекул адгезии и секреции хемотаксиче- ских факторов. Это способствует привлечению и инфильтрации моноцитов и Т-лимфоцитов в сосудистую стенку, где они дифференцируются в макрофаги и еще больше усиливают воспалительную реакцию [76]. Более того, эти цитокины могут стимулировать пролиферацию и миграцию сосудистых гладкомышечных клеток, что приводит к утолщению артериальной стенки и образованию фиброзных пробок, в которых заключены атеросклеротические бляшки [39]. Одновременно хроническое воспаление оказывает глубокое влияние на ремоделирование костей - непрерывный процесс образования и рассасывания костной ткани, поддерживающий целостность скелета. Провоспалительные цитокины, такие как TNF-a, IL 1 и IL-6, могут непосредственно стимулировать дифференцировку и активацию остеокластов - клеток, ответственных за резорбцию кости. Это происходит через регуляцию сигнального пути RANK/RANKL, ключевого медиатора остеокластогенеза. Кроме того, эти цитокины могут подавлять дифференцировку и функцию остеобластов, нарушая формирование костной ткани. В результате возникает дисбаланс в ремоделировании костной ткани, в результате чего резорбция кости преобладает над ее формированием, что способствует развитию остеопороза [3].
Окислительный стресс, определяемый как дисбаланс между производством реактивных форм кислорода (ROS) и способностью организма к детоксикации этих реактивных промежуточных продуктов или восстановлению возникающих повреждений, является еще одним центральным звеном во множестве патологических состояний, включая атеросклероз и остеопороз [56]. Супероксид-анионы (O2-), гидроксильные радикалы (-OH) и перекись водорода (H2O2), могут непосредственно повреждать эндотелий сосудов [23]. Во-первых, ROS могут окислять частицы липопротеинов низкой плотности (ЛПНП), превращая их в окисленный ЛПНП (окс-ЛПНП), высокоатерогенную молекулу. Окси-ЛПНП может поглощаться макрофагами, что приводит к образованию пенистых клеток, являющихся отличительной чертой атеросклеротических бляшек [85]. Во-вторых, ROS может нарушать синтез оксида азота (NO), мощного вазодилататора и ингибитора агрегации тромбоцитов, способствуя дисфункции эндотелия, предшественника образования атеросклеротических бляшек [25]. Кроме того, ROS может стимулировать экспрессию молекул адгезии на эндотелии, способствуя привлечению и инфильтрации воспалительных клеток в артериальную стенку, что еще больше усиливает атерогенный процесс [14]. Окислительный стресс также играет существенную роль в патогенезе остеопороза, нарушая равновесие между формированием и резорбцией костной ткани. Высокий уровень ROS может вызывать апоптоз остеобластов, тем самым снижая образование костной ткани. ROS может вызывать экспрессию RANKL (рецепторный активатор лиганда ядерного фактора каппа В) на поверхности остеобластов и остеоцитов. RANKL взаимодействует со своим рецептором RANK на предшественниках остеокластов, способствуя их дифференцировке в зрелые остеокласты [82]. Это приводит к усилению резорбции костной ткани, способствуя развитию остеопороза. Более того, ROS может подавлять активность остеопротегери- на (OPG), рецептора-приманки, который обычно связывается с RANKL, предотвращая его взаимодействие с RANK, тем самым подавляя остеокластогенез [7]. Минеральный обмен, особенно обмен кальция и фосфатов, является процессом, который строго регулируется и имеет решающее значение для поддержания физиологических функций. Нарушение этого метаболического баланса становится все более важным механизмом, который способствует патогенетическому развитию как атеросклероза, так и остеопороза [43]. В сосудистой системе гиперфосфатемия может вызывать кальцификацию сосудов - процесс, характеризующийся отложением кристаллов фосфата кальция в стенках артерий, что приводит к повышению жесткости артерий, что является серьезной составляющей атеросклероза. Считается, что этот процесс происходит через дифференциацию сосудистых гладкомышечных клеток в остеобластоподобные клетки, которые вырабатывают белки костного матрикса, что еще больше способствует кальцификации. Фосфат, наряду с кальцием, необходим для образования гидроксиапатита, основного минерального компонента кости. Однако избыток фосфата может подавлять процесс минерализации, что приводит к нарушению формирования костей и повышению их хрупкости, тем самым способствуя развитию остеопороза (Mansoori A. et al., 2023).
Другим важнейшим аспектом минерального обмена является его регуляция витамином D и паратиреоидным гормоном (ПТГ). Витамин D усиливает кишечное всасывание кальция и фосфата, в то время как ПТГ в первую очередь повышает уровень кальция, способствуя резорбции костной ткани и снижая почечную экскрецию кальция [6].
Дисрегуляция этих гормонов может привести к нарушению гомеостаза кальция и фосфатов [68]. Например, дефицит витамина D, распространенный во всем мире, может привести к снижению всасывания кальция, вызывая компенсаторное увеличение секреции ПТГ, что известно, как вторичный гиперпаратиреоз. Хроническое повышение уровня ПТГ может увеличить резорбцию костной ткани, что приводит к снижению минеральной плотности костной ткани, характерному признаку остеопороза. В то же время вторичный гиперпаратиреоз может повышать уровень кальция в сыворотке крови, а в сочетании с фосфатным дисбалансом может способствовать кальцификации сосудов, способствуя развитию атеросклероза [64].
Глубокое понимание клеточных и молекулярных связей между остеопорозом и атеросклерозом выявляет сложные взаимодействия с участием ключевых регуляторных путей, которые контролируют как ремоделирование костей, так и кальцификацию сосудов [37]. Кальцификация сосудов - активный, опосредованный клетками процесс, который имеет много общего с формированием костей, и последние исследования подчеркивают решающую роль сосудистых гладкомышечных клеток (VSMCs) в этом процессе. В физиологических условиях VSMC демонстрируют фенотип сокращения, характеризующийся экспрессией специфических маркеров, таких как гладкомышечный а-актин и тяжелая цепь миозина. Однако в присутствии определенных стимулов, включая окислительный стресс и воспаление, VSMC могут претерпевать фенотипическое переключение и дифференцироваться в остеобластоподобные клетки [42]. Этот фенотипический переход сосудистых гладкомышечных клеток (VSMC) в остеобластоподобные клетки является тщательно регулируемым процессом, который осуществляется сетью сигнальных молекул и транскрипционных факторов, в частности, костными морфогенетическими белками (BMPs) и связанным с runt транскрипционным фактором 2 (Runx2) [34]. BMPs, принадлежащие к суперсемейству трансформирующего фактора роста-бета (TGF-P), признаны эффективными индукторами костеобразования, играющими фундаментальную роль в развитии скелета и минерализации костной ткани. Они стимулируют дифференцировку мезенхимальных клеток в остеобласты и усиливают выработку белков костного матрикса. Некоторые BMP, в частности BMP 2 и BMP-4, участвуют в фенотипическом переключении VSMC, способствуя их переходу в остеобластоподобные клетки, что является важнейшим шагом в процессе кальцификации сосудов [61]. Runx2, также известный как core-binding factor subunit alpha-1 (CBFA1), является главным транскрипционным фактором, регулирующим дифференциацию и функцию остеобластов [80]. Он необходим для экспрессии нескольких белков костного матрикса, включая остеокальцин, белок, синтезируемый исключительно остеобластами, и коллаген I типа, основной структурный белок кости. сосудистой кальцификации сверхэкспрессия Runx2 в VSMCs была связана с повышением уровня этих белков костного матрикса, способствуя отложению гидроксиапатита, формы фосфата кальция, в артериальной стенке [28].
Таким образом, взаимодействие между BMPs и Runx2 играет важную роль в процессе кальцификации сосудов. Под их воздействием VSMC пере- программируются в остеобластоподобные клетки, способные производить белки костного матрикса и инициировать отложение минералов - отличительные признаки сосудистой кальцификации [69].
Понимание этих сложных механизмов может открыть новые перспективы для разработки терапевтических стратегий по предотвращению или замедлению прогрессирования сосудистой кальцификации, основного компонента атеросклеротического заболевания. Это также усиливает взаимосвязь здоровья сосудов и костей, обеспечивая дальнейшее понимание общей патофизиологии атеросклероза и остеопороза.
Напротив, остеопороз характеризуется нарушением ремоделирования костной ткани, при котором костная резорбция преобладает над костеобразованием.
Остеокласты происходят из кроветворных предшественников и дифференцируются в зрелые под воздействием макрофагального колониестимулирующего фактора (M CSF) и рецепторного активатора лиганда ядерного фактора каппа-B (RANKL), вырабатываемых остеобластами и остеоцитами [11].
Активность остеокластов тщательно регулируется, и нарушение этой регуляции может привести к усилению резорбции кости, что является ключевым признаком остеопороза.
Например, воспалительные цитокины, такие как TNF-a и IL-6, могут усиливать остеокластогенез путем повышения экспрессии RANKL. Кроме того, окислительный стресс может стимулировать активность остеокластов, что еще больше способствует потере костной ткани. В совокупности эти общие клеточные и молекулярные пути подчеркивают сложное взаимодействие между костным ремоделированием и сосудистой кальцификацией, связывая остеопороз и атеросклероз [74].
Терапевтические аспекты и перспективы. Признание взаимосвязанной природы мультифокального атеросклероза и остеопороза несёт в себе глубокие потенциальные последствия для их терапевтического лечения. Выявление общих патофизиологических процессов может стать предвестником появления инновационных терапевтических стратегий, направленных одновременно на оба заболевания, повышая эффективность лечения и улучшая прогноз пациентов. Сочетание терапии мультифокального атеросклероза и остеопороза представляет собой весьма привлекательную исследовательскую перспективу для разработки более комплексных и эффективных стратегий лечения [40]. Некоторые современные терапевтические средства, направленные в первую очередь на лечение одного заболевания, показали дополнительные преимущества при лечении другого, что подчеркивает потенциал комбинированных терапевтических подходов (Бар- бараш О., Кашталап В., 2020). Статины, химически известные как ингибиторы HMG-CoA редуктазы, являются одним из основных компонентов лечения гиперхолестеринемии.
Они действуют путем ингибирования ключевого фермента в пути синтеза холестерина в печени. Это приводит к снижению уровня внутриклеточного холестерина, стимулирует повышение уровня рецепторов липопротеинов низкой плотности (ЛПНП) на гепатоцитах и последующее увеличение поглощения ЛПНП из кровотока, тем самым снижая уровень циркулирующих ЛПНП и уменьшая риск развития атеросклероза. Помимо способности снижать уровень холестерина, статины обладают целым спектром плейотроп- ных эффектов, которые способствуют их общей пользе для сердечно-сосудистой системы. К ним относятся противовоспалительные эффекты, о которых свидетельствует снижение уровня маркеров воспаления, таких как С реактивный белок (CRP), и антиоксидантные эффекты, проявляющиеся в снижении маркеров окислительного стресса и улучшении функции эндотелия [8].
Недавние исследования позволили выявить одну достаточно важную сторону биологии статинов - их потенциальное влияние на метаболизм костной ткани. Было доказано, что статины стимулируют выработку костного морфогенетического протеина-2 (BMP-2), члена суперсемейства трансформирующего фактора роста-бета (TGF-P) [93]. BMP-2 является ключевым индуктором дифференцировки остеобластов и формирования костной ткани, стимулируя экспрессию различных белков костного матрикса и усиливая минерализацию. Поэтому повышение уровня BMP- 2 под действием статинов может способствовать формированию и плотности костной ткани [24]. Кроме того, статины препятствуют мевалонатному пути, который, помимо синтеза холестерина, имеет решающее значение для пренилирования белков малых ГТФаз. Эти белки необходимы для образования "границы шероховатости" и резорбции костной ткани остеокластами. Ингибируя процесс пренили- рования белков, статины могут нарушать функцию и выживаемость остеокластов, тем самым снижая резорбцию кости [32].
Бисфосфонаты, химически характеризующиеся наличием двух фосфонатных (PO3) групп на атоме углерода, представляют собой первую линию обороны в лечении остеопороза.
Эти препараты, благодаря своему структурному сходству с пирофосфатом, обладают высоким средством к костному минералу, в частности к гидроксиапатиту, основному компоненту костного минерального матрикса. При введении бисфосфонаты прилипают к активным участкам резорбции кости, где они подвергаются интернализации остеокластами - клетками, ответственными за резорбцию кости [36]. Попадая внутрь остеокластов, бисфосфонаты нарушают ме- валонатный путь, подобно статинам, что приводит к ингибированию преенилирования белков - посттрансляционной модификации, необходимой для функционирования многочисленных белков, участвующих в активности и выживании остеокластов. В результате нарушается функция остеокластов и стимулируется апоптоз остеокластов, тем самым ослабляя резорбцию костной ткани и предотвращая дальнейшую потерю костной ткани при остеопорозе [21]. Помимо хорошо известной роли бисфосфонатов в лечении остеопороза, появляющиеся данные свидетельствуют о потенциальной роли бисфосфонатов в смягчении атеросклероза [12,]. Способность бисфосфонатов связываться с отложениями кальция не ограничивается костями, но может распространяться и на места сосудистой кальцификации. Так, бисфосфонаты могут ингибировать фенотипический переход сосудистых гладкомышечных клеток (VSMCs) в остеобластоподобные клетки - критический процесс в патогенезе сосудистой кальцификации [20]. Более того, было продемонстрировано, что бисфосфонаты уменьшают накопление липидов в макрофагах. Подавляя образование пенистых клеток, бисфос- фонаты потенциально могут замедлить прогрессирование атеросклероза [10]. В совокупности эти данные позволяют предположить, что бисфосфо- наты, как и статины, могут оказывать двойное терапевтическое действие при лечении остеопороза и атеросклероза.
Однако эти наблюдения, хотя и многообещающие, все еще находятся на предварительной стадии. Необходимы более тщательные доклинические и клинические исследования, чтобы подтвердить эти эффекты, выяснить лежащие в их основе механизмы и усовершенствовать эти терапевтические стратегии для достижения максимальной клинической эффективности и пользы для пациентов. Ось RANK/RANKL/OPG, ключевая регуляторная система в ремоделировании костной ткани, представляет собой перспективную терапевтическую мишень для лечения остеопороза и атеросклероза. RANKL (Receptor activator of nuclear factor kappa-B ligand) - цитокин, необходимый для дифференциации и активации остеокластов, клеток, ответственных за резорбцию кости. Остеопротегерин (OPG) - рецептор обманка для RANKL, способный связываться с RANKL и предотвращать его взаимодействие с RANK, его рецептором на предшественниках остеокластов.
Ингибирование взаимодействия RANKL-RANK с помощью OPG приводит к подавлению остеокластогенеза и, следовательно, резорбции кости. Несколько доказательств свидетельствуют о роли системы RANKL/OPG не только в костной ткани, но и в сосудистой системе. RANKL и его рецепторы были идентифицированы в различных типах сосудистых клеток, включая эндотелиальные клетки и сосудистые гладкомышечные клетки [78]. Атеросклероз RANKL был вовлечен в развитие сосудистого воспаления. Более того, в клинических исследованиях сообщалось о повышенном уровне RANKL в сыворотке крови и соотношении RANKL/OPG у пациентов с атеросклеротическими сердечно-сосудистыми заболеваниями, что указывает на потенциальную роль системы RANKL/OPG в атеросклерозе. Одной из потенциальных терапевтических стратегий, вытекающих из этого понимания, является использование препаратов, направленных на систему RANKL/ OPG. Ярким примером является деносумаб, моноклональное антитело, которое специфически связывается с RANKL, тем самым ингибируя его взаимодействие с RANK и подавляя активность остеокластов. В настоящее время деносумаб одобрен для лечения остеопороза, учитывая его доказанную эффективность в снижении резорбции кости и риска переломов [31].
Учитывая потенциальное участие системы RANKL/OPG в развитии атеросклероза, очень убедительно предположение о потенциальной двойной пользе деносумаба как при остеопорозе, так и при атеросклерозе. Однако сердечно-сосудистые эффекты деносумаба до конца не изучены, и для изучения этой возможности необходимы дополнительные исследования. Если будущие исследования подтвердят благоприятную роль ингибирования RANKL при атеросклерозе, это может открыть новый путь для одновременного лечения остеопороза и атеросклероза, потенциально улучшая терапевтические результаты у пациентов, страдающих этими сосуществующими заболеваниями.
Концепция персонализированной медицины, характеризующаяся индивидуализированными стратегиями профилактики, прогнозирования и лечения, становится все более заметной в современном здравоохранении. По мере углубления понимания молекулярных основ мультифокального атеросклероза и остеопороза открываются многообещающие возможности для применения персонализированной медицины к этим заболеваниям [49].
Генетическое профилирование представляет собой ключевой аспект этого подхода. И атеросклероз, и остеопороз - сложные заболевания, на которые влияют многочисленные генетические факторы. Благодаря достижениям в области геномики и биоинформатики теперь можно определить генетические варианты, связанные с повышенным риском развития этих заболеваний [22]. Например, однонуклеотидные полиморфизмы (SNPs) в генах, связанных с липидным обменом, воспалением и ремоделированием костей, были связаны с предрасположенностью к атеросклерозу и остеопорозу. Благодаря скринингу на эти варианты риска генетическое профилирование может обеспечить раннее выявление людей с высоким риском, способствуя своевременному вмешательству и потенциально задерживая или даже предотвращая начало заболевания [44]. Кроме того, персонализированная медицина может быть основана на выявлении биомаркеров [9].
Биомаркеры - измеримые показатели биологических процессов или реакции на вмешательство. Атеросклероз и остеопороз исследуются различные молекулярные и клеточные биомаркеры, отражающие патофизиологические процессы заболевания [27]. Например, циркулирующие уровни воспалительных цитокинов, маркеры окислительного стресса или маркеры оборота костной ткани могут дать представление об активности и прогрессировании заболевания. Примечательно, что некоторые биомаркеры могут также указывать на ответ на терапию, помогая адаптировать стратегии лечения к индивидуальным потребностям пациента и оптимизировать терапевтические результаты. Наконец, персонализированная медицина - не только генетика и биомаркеры. Она также должна учитывать образ жизни и факторы окружающей среды, которые существенно влияют на развитие и прогрессирование атеросклероза и остеопороза. Персонализированные рекомендации по диете, физической активности и другим изменениям образа жизни могут сыграть решающую роль в лечении этих заболеваний [38,]. В заключение следует отметить, что применение персонализированной медицины для лечения атеросклероза и остеопороза имеет большие перспективы. По мере того, как исследования продолжают выяснять генетические и молекулярные тонкости этих заболеваний, мы приближаемся к эре медицины, в которой стратегии профилактики, прогнозирования и лечения будут точно соответствовать индивидуальным особенностям пациента, улучшая уход за больными и улучшая результаты лечения. Однако, несмотря на значительный потенциал персонализированной медицины в лечении атеросклероза и остеопороза, важно отметить, что мы все еще находимся на ранних стадиях этой революции.
Остаются значительные проблемы, связанные с подтверждением прогностической силы генетических показателей риска и биомаркеров, стандартизацией их измерения и внедрением этих инструментов в рутинную клиническую практику. Более того, этические, правовые и социальные последствия, такие как проблемы конфиденциальности и неравенства в здравоохранении, должны быть тщательно рассмотрены по мере продвижения к более персонализированной парадигме здравоохранения. Важность модификации образа жизни в профилактике и лечении остеопороза и атеросклероза невозможно переоценить. Эти меры, включающие в себя диетические привычки, физическую активность, отказ от курения и умеренное употребление алкоголя, оказывают значительное влияние на различные уровни патофизиологии заболевания, представляя, таким образом, целостный подход к борьбе с этими заболеваниями. Рацион питания играет важную роль в здоровье костной и сердечно-сосудистой систем. Сбалансированная диета, богатая фруктами, овощами, нежирными белками и цельным зерном, обеспечивает необходимые для ремоделирования костей питательные вещества, включая кальций, витамин D и белок. Одновременно такая диета полезна для здоровья сердца, поскольку содержит мало насыщенных жиров и холестерина, много клетчатки и разнообразных антиоксидантов, способных уменьшить окислительный стресс - общий патофизиологический фактор остеопороза и атеросклероза [72]. Более того, определенные питательные вещества, такие как омега 3 жирные кислоты и полифенолы, были связаны как с противовоспалительным, так и с костнопротекторным действием, что подчеркивает потенциал диетического модулирования в качестве профилактической стратегии.
Физическая активность - еще одна важная профилактическая мера. Регулярные физические упражнения способствуют здоровью костей, стимулируя активность остеобластов и образование костной ткани, тем самым помогая компенсировать потерю костной ткани, присущую старению и остеопорозу. Кроме того, физические упражнения имеют хорошо известные преимущества для сердечно-сосудистой системы, включая улучшение функции эндотелия, липидного профиля и чувствительности к инсулину, а также снижение артериального давления. Важно отметить, что физическая активность также оказывает противовоспалительное действие и повышает антиоксидантную защиту организма, тем самым способствуя профилактике обоих заболеваний. Отказ от курения имеет решающее значение, учитывая пагубное влияние табака на здоровье костей и сердечно-сосудистой системы. Курение связано со снижением минеральной плотности костной ткани и повышением риска переломов, что, вероятно, обусловлено влиянием на функцию костных клеток и усвоение кальция. Кроме того, курение ускоряет прогрессирование атеросклероза, вызывая дисфункцию эндотелия, способствуя развитию воспаления и окислительного стресса, а также негативно влияя на липидный профиль. Потребление алкоголя представляет собой сложную взаимосвязь как с остеопорозом, так и с атеросклерозом, причем его влияние в значительной степени определяется количеством и частотой потребления. Однако важно подчеркнуть, что эти потенциальные преимущества уравновешиваются значительными негативными последствиями, связанными с чрезмерным потреблением алкоголя. Высокий уровень потребления алкоголя вреден для здоровья костей, что приводит к повышенному риску развития остеопороза. Механистически, чрезмерное употребление алкоголя может нарушить баланс ремоделирования костной ткани, подавляя функцию остеобластов и стимулируя активность остеокластов.
Он также может нарушать всасывание и метаболизм важных для здоровья костей питательных веществ, таких как кальций и витамин D, и нарушать гормональную регуляцию [51]. Употребление алкоголя может привести к многочисленным неблагоприятным последствиям, включая гипертонию, кардиомиопатию, аритмию и повышенный уровень триглицеридов, все из которых способствуют повышению риска развития атеросклероза и сердечно сосудистых событий. Более того, чрезмерное употребление алкоголя может вызывать окислительный стресс и воспаление - ключевые факторы патогенеза атеросклероза [73]. Поэтому, хотя умеренное потребление алкоголя может принести определенную пользу, крайне важно соблюдать осторожность, учитывая потенциальные негативные последствия, связанные с более высоким уровнем потребления. Важно отметить, что перед принятием решения об употреблении алкоголя люди должны проконсультироваться с медицинскими работниками, чтобы учесть общее состояние здоровья, потенциальные риски и преимущества.
В заключение следует отметить, что внедрение этих модификаций образа жизни может иметь значительные последствия для профилактики и лечения остеопороза и атеросклероза. Благодаря воздействию на общие факторы риска и патофизиологические механизмы, эти меры предлагают мощный инструмент для снижения бремени заболеваний, связанных с этими распространенными состояниями. Будущие направления исследований Сложная взаимосвязь между остеопорозом и атеросклерозом представляет собой широкую, плодородную почву для будущих исследований, охватывающих как клинические, так и фундаментальные научные аспекты. Потенциал комбинированных методов лечения и исследование новых терапевтических мишеней требуют дальнейшей клинической оценки. Необходимы строгие рандомизированные контролируемые исследования (РКИ) для оценки эффективности и безопасности этих подходов, включая их влияние на результаты, о которых сообщают пациенты, прогрессирование заболевания и долгосрочную выживаемость. Кроме того, наблюдательные исследования могут дать ценную информацию о применении этих стратегий в реальном мире, включая их экономическую эффективность и влияние на неравенство в здравоохранении. Кроме того, потенциальная роль персонализированной медицины при этих заболеваниях, основанная на генетическом профилировании и выявлении биомаркеров, требует изучения в крупномасштабных популяционных когортах и клинических испытаниях [33].
Фундаментальные исследования имеют решающее значение для углубления нашего понимания общих молекулярных и клеточных механизмов, лежащих в основе остеопороза и атеросклероза [49]. Это включает изучение роли хронического воспаления, окислительного стресса и дисрегуляции минерального обмена при обоих заболеваниях, а также их взаимосвязи. Кроме того, необходимо продолжить изучение роли различных сигнальных путей и регуляторных молекул, таких как система RANK/RANKL/OPG и BMPs, в этих процессах. Экспериментальные модели, включая системы клеточных культур in vitro и модели животных in vivo, могут стать ценными платформами для таких исследований (Skripnikova I.A. et al., 2021). Преодолевая разрыв между фундаментальной наукой и клиническими исследованиями, трансляционные исследования могут помочь применить результаты, полученные в лаборатории, на практике. Это может включать разработку и проверку новых диагностических маркеров, терапевтических мишеней или моделей прогнозирования риска на основе открытий фундаментальной науки [57]. В конечном счете, такие комплексные исследования могут привести к значительному прорыву в нашей способности предотвращать, диагностировать и лечить остеопороз и атеросклероз. Учитывая их высокую распространенность и существенное влияние на здоровье населения планеты, успехи в этих областях могут иметь далеко идущие последствия для общественного здравоохранения. В следующих разделах мы более подробно рассмотрим конкретные виды повреждений опорно-двигательного аппарата, которые могут возникать у пациентов с мультифокальным атеросклерозом и остеопорозом, а также методы диагностики и стратегии лечения, используемые при лечении этих состояний.
ЛИТЕРАТУРА
Afshari M.A., Afshari N.A., Fulton A.B. Cortical visual impairment in infants and children. Int Ophthalmol Clin. 2001; 41(1): 159-69.
Ajeganova S., Gustafsson T., Jogestrand T., Frostegard J., Hafstrom I. Bone mineral density and carotid atherosclerosis in systemic lupus erythematosus: a controlled cross-sectional study. Arthritis Res Ther. 2015; 17(1): 84.
Alan D., Webb N.R., Rateri D.L., King V.L. Cardiovascular Research Center, Gill Heart Institute, University of Kentucky, Lexington, KY. J. Lipid Research. 2005; 46: 1812-1822.
Al-Benna S. The effect of harvesting techniques and cardiovascular risk factors on endothelial function of human coronary artery bypass grafts. 2007.
Ali D., Tencerova M., Figeac F., Kassem M., Jafari A. The pathophysiology of osteoporosis in obesity and type 2 diabetes in aging women and men: The mechanisms and roles of increased bone marrow adiposity. Front Endocrinol. (Lausanne). 2022;13: 981487.
Aloia J., Dhaliwal R., Mikhail M., Shieh A., Stolberg A., Ragolia L., Fazzari M., Abrams S.A. Free 25(OH)D and Calcium Absorption, PTH, and Markers of Bone Turnover. J Clin Endocrinol Metab. 2015;100 (11): 4140-5.
Alsterda A., Asha K., Powrozek O., Repak M., Goswami S., Dunn A.M., Memmel H.C., Sharma-Walia N. Salubrinal Exposes Anticancer Properties in Inflammatory Breast Cancer Cells by Manipulating the Endoplasmic Reticulum Stress Pathway. Front Oncol. 2021; 11: 654940.
Amariei D.E., Reed R.M. The role of statins in chronic obstructive pulmonary disease: is cardiovascular disease the common denominator? Curr Opin Pulm Med. 2019; 25 (2): 173-178.
Bernardini R., Gancitano G., Balice A., Mauro R.D., Cantarella G., Dionisi M. Personalized medicine: biomarkers and companion diagnostics. Farmeconomia. Health economics and therapeutic pathways, 19. 2018.
Bevilacqua M., Dominguez L.J., Rosini S., Barbagallo M. Bisphosphonates and atherosclerosis: why? Lupus. 2005; 14 (9): 773-9.
Bonucci E., Ballanti P. Osteoporosis-bone remodeling and animal models. Toxicol Pathol. 2014; 42 (6): 957-69.
Caffarelli C., Montagnani A., Nuti R., Gonnelli S. Bisphosphonates, atherosclerosis and vascular calcification: update and systematic review of clinical studies. Clin. Interv. Aging. 2017;12: 1819-1828.
Carmona-Fernandes D., Barreira S.C., Leonardo N., Casimiro R.I., Castro A.M., et al. Atherosclerosis and Bone Loss in Humans-Results From Deceased Donors and From Patients Submitted to Carotid Endarterectomy. Front Med (Lausanne). 2021; 8: 672496.
Castellano M., Rizzoni D., Beschi M., Muiesan M.L., Porteri E. et al. Relationship between sympathetic nervous system activity, baroreflex and cardiovascular effects after acute nitric oxide synthesis inhibition in humans. J Hypertens. 1995; 13(10): 1153-61.
Cekovska S. IFCC Professional Scientific Exchange Programme Report - Biochemical Markers of Bone Turnover. EJIFCC. 2001; 13 (1): 25-26.
Cervellati C., Bergamini C.M. Oxidative damage and the pathogenesis of menopause related disturbances and diseases. Clin. Chem. Lab. Med. 2016; 54 (5): 739-53.
Chitra S., Arunadevi R., Sudesh G. et al. Role of Hridayarnava Rasa on inflammatory responses in rabbits with high fat diet induced atherosclerosis. AYUHOM. 8: 73-81.
Christa M., Jens B., Natalie K. et al. Plasma Oxidized Low-Density Lipoprotein, a Strong Predictor for Acute Coronary Heart Disease Events in Apparently Healthy, Middle-Aged Men From the General Population. Circulation. 2005.
Cui R., Zhou L., Li Z., Li Q., Qi Z., Zhang J. Assessment risk of osteoporosis in Chinese people: relationship among body mass index, serum lipid profiles, blood glucose, and bone mineral density. Clin. Interv. Aging. 2016; 11: 887-95.
Dayanand P., Sandhyavenu H., Dayanand S., Martinez J., Rangaswami J. Role of Bisphosphonates in Vascular calcification and Bone Metabolism: A Clinical Summary. Curr Cardiol Rev. 2018; 14 (3): 192-199.
Drake M.T., Clarke B.L., Khosla S. Bisphosphonates: mechanism of action and role in clinical practice. Mayo Clin Proc. 2008; 83 (9): 1032-45.
Dahlqwist E., Magnusson P.K.E., Pawitan Y., Sjolander A., Received: 3 January 2019 / Accepted: 22 March 2019 / Published online: 2 April 2019., Springer, Human Genetics. 2019; 138: 425-435.
Ellis A., Triggle C.R. Endothelium-derived reactive oxygen species: their relationship to endothelium-dependent hyperpolarization and vascular tone. Can J Physiol Pharmacol. 2003; 81 (11): 1013-28.
Evangelisti C. Bernasconi P., Cavalcante P., Cappelletti C. et al. Modulation of TGFbeta 2 levels by lamin A in U2-OS osteoblast-like cells: understanding the osteolytic process triggered by altered lamins. Oncotarget. 2015; 6 (10): 7424-37.
Fernanda C., de Araujo B.J., Cordeiro C.S., Arruda V.M., Faria B.Q. et al. Endothelial dysfunction due to the inhibition of the synthesis of nitric oxide: Proposal and characterization of an in vitro cellular model. Front Physiol. 2022; 13: 978378.
Fernanda С., Alonso-Molero J., Ayan C. et al. PGC-1a as a Biomarker of Physical Activity- 97 Protective Effect on Colorectal Cancer. Cancer Prev Res (Phila). 2018; 11 (9): 523-534.
Ferro M., La Civita E., Liotti A. et al. Liquid Biopsy Biomarkers in Urine: A Route towards Molecular Diagnosis and Personalized Medicine of Bladder Cancer. J Pers Med. 2021; 11 (3): 237.
Franceschi R.T., Xiao G., Jiang D., Gopalakrishnan R., Yang S., Reith E. Multiple signaling pathways converge on the Cbfa1/Runx2 transcription factor to regulate osteoblast differentiation. Connect Tissue Res. 2003; 44 (Suppl 1: 109-16.
Fujihara Y., Nawata H., Honda M. et al. Comparative study of the correlation between atherosclerosis and osteoporosis in women in Japan and Mongolia. J Gen Fam Med. 2017; 18 (5): 237-243.
Fujii S. Atherosclerosis, Chronic Inflammation, and Thrombosis: In Search of the Missing Link in Laboratory Medicine. Rinsho Byori. 2015; 63 (5): 605-11.
Hanley D.A., Adachi J.D., Bell A., Brown V. Denosumab: mechanism of action and clinical outcomes. Int. J. Clin. Pract. 2012; 66 (12): 1139-46.
Hasan W.N.W., Chin K.Y., Jolly J.J., Ghafar N.A., Soelaiman I.N. Identifying Potential Therapeutics for Osteoporosis by Exploiting the Relationship between Mevalonate Pathway and Bone Metabolism. Endocr. Metab. Immune Disord. Drug. Targets. 2018; 18 (5): 450-457.
Haselmann V., Hedtke M., Neumaier M. Liquid Profiling for Cancer Patient Stratification in Precision Medicine-Current Status and Challenges for Successful Implementation in Standard Care. Diagnostics (Basel). 2022; 12 (3): 748.
Hayashi K., Nakamura S., Nishida W., Sobue K. Bone morphogenetic protein-induced MSX1 and MSX2 inhibit myocardin- dependent smooth muscle gene transcription. Mol Cell Biol. 2006; 26 (24): 9456-70.
Hughes A., Rogers M.J., Idris A.I., Crockett J.C. A comparison between the effects of hydrophobic and hydrophilic statins on osteoclast function in vitro and ovariectomy-induced bone loss in vivo. Calcif. Tissue Int. 2007; 81 (5): 403-13.
Hughes D.E., Mian M., Guilland-Cumming D.F., Russell R.G. The cellular mechanism of action of bisphosphonates. Drugs. Exp. Clin. Res. 1991; 17 (2): 109-14.
Karakaya C., van Turnhout M.C., Visser V.L., Ristori T., Bouten C.V.C., Sahlgren C.M., Loerakker S. Notch signaling regulates strain-mediated phenotypic switching of vascular smooth muscle cells. Front Cell Dev Biol. 2022; 10: 910503.
Kikuchi T., Hayashi J.I., Mitani A. Next-Generation Examination, Diagnosis, and Personalized Medicine in Periodontal Disease. J. Pers. Med. 2022; 12 (10): 1743.
Kleemann R., Zadelaar S., Kooistra T. Cytokines and atherosclerosis: a comprehensive review of studies in mice. Cardiovasc Res. 2008; 79 (3): 360-76.
Kucherenko S.S., Alekseeva T.M. Sovremennye strategii antitromboticheskoi terapii pri mul'tifokal'nom ateroskleroze [Modern strategies of antithrombotic therapy in patients with multifocal atherosclerosis]. Zh. Nevrol. Psikhiatr. Im. S.S. Korsakova. 2022; 122 (2): 49-55.
Leoni M., Gorini A. Atherosclerosis, chronic inflammation and oxidative stress in CKD. G. Ital. Nefrol. 2017; 34 (Suppl 69): 142-149.
Liang M., Cai Z., Jiang Y., Huo H., Shen L., He B. SENP2 Promotes VSMC Phenotypic Switching via Myocardin De- SUMOylation. Int. J. Mol. Sci. 2022; 23 (20): 12637.
Liu J., Kumar S., Hong J. et al. Combined Single Cell Transcriptome and Surface Epitope Profiling Identifies Potential Biomarkers of Psoriatic Arthritis and Facilitates Diagnosis via Machine Learning. Front Immunol. 2022; 13: 835760.
Malchuk E.I., Майчук Е.Ю., Voevodina I.V. et al. The risk of developing atherosclerosis and osteoporosis in postoophorectomy women during hormone replacement therapy. 2014.
Marchio P., Guerra-Ojeda S., Vila J.M., Aldasoro M., Victor V.M., Mauricio M.D. Targeting Early Atherosclerosis: A Focus on Oxidative Stressand Inflammation. Oxid. Med. Cell. Longev. 2019; 2019: 8563845.
Matsushita M., Tsuboyama T., Kasai R., Okumura H., Yamamuro T., Higuchi K., Higuchi K., Kohno A., Yonezu T., Utani A. et al. Age-related changes in bone mass in the senescence-accelerated mouse (SAM). SAM-R/3 and SAM-P/6 as new murine models for senile osteoporosis. Am. J. Pathol. 1986; 125 (2): 276-283.
Meisinger C., Baumert J., Khuseyinova N., Loewel H., Koenig W. Plasma oxidized low-density lipoprotein, a strong predictor for acute coronary heart disease events in apparently healthy, middle-aged men from the general population. Circulation. 2005; 112 (5): 651-7.
Mo L., Ma C., Wang Z., Li J., He W., Niu W., Chen Z., Zhou C., Liu Y. Integrated Bioinformatic Analysis of the Shared Molecular Mechanisms Between Osteoporosis and Atherosclerosis. Front Endocrinol. (Lausanne). 2022; 13: 950030.
Monteiro A.M., Forte P., Carvalho J., Barbosa T.M., Morais J.E. Relationship between fear of falling and balance factors in healthy elderly women: A confirmatory analysis. J. Women Aging. 2021; 33 (1): 57-69.
Naruo M., Negishi Y., Okuda T., Katsuyama M., Okazaki K., Morita R. Alcohol consumption induces murine osteoporosis by downregulation of natural killer T-like cell activity. Immun. Inflamm. Dis. 2021; 9 (4): 1370-1382.
Ozmen B., Kirmaz C., Aydin K., Kafesciler S.O., Guclu F., Hekimsoy Z. Influence of the selective oestrogen receptor modulator (raloxifene hydrochloride) on IL-6, TNF-alpha, TGF-beta1 and bone turnover markers in the treatment of postmenopausal osteoporosis. Eur. Cytokine Netw. 2007; 18 (3): 148-53.
Paul S., Paul S. Controlling the self-assembly of human calcitonin: a theoretical approach using molecular dynamics simulations. Phys. Chem. Chem. Phys. 2021; 23 (26): 14496-14510.
Peng Z., Tao S., Liu Y., Sun P., Gong L., Bai Y., Tang T. Analysis on the correlation between the occurrence of vertebral artery ostium stenosis and the severity of osteoporosis in elderly patients with atherosclerosis. Acta Orthop. Belg. 2022; 88 (4): 685-690.
Puglisi M.A., Cenciarelli C., Tesori V., Cappellari M., Martini M. et al. High nitric oxide production, secondary to inducible nitric oxide synthase expression, is essential for regulation of the tumour-initiating properties of colon cancer stem cells. J Pathol. 2015; 236 (4): 479-90.
Qi H., Wang Y., Fa S., Yuan C., Yang L. Extracellular Vesicles as Natural Delivery Carriers Regulate Oxidative Stress Under Pathological Conditions. Front Bioeng Biotechnol. 2021; 9: 752019.
Rahim S., Uren A. Emergence of ETS transcription factors as diagnostic tools and therapeutic targets in prostate cancer. Am. J. Transl. Res. 2013; 5 (3): 254-68.
Ribot C., Tremollieres F., Pouilles J.M. Estrogenes et modulateurs specifiques des recepteurs estrogeniques dans le traitement de l'osteoporose [Estrogens and selective estrogen receptor modulators in the treatment of osteoporosis]. Ann. Med. Interne (Paris). 2000; 151 (6): 490-6.
Riggs B.L., Wahner H.W., Dunn W.L., Mazess R.B., Offord K.P., Melton L.J. 3rd. Differential changes in bone mineral density of the appendicular and axial skeleton with aging: relationship to spinal osteoporosis. J. Clin. Invest. 1981; 67 (2): 328-35.
Riggs B.L. The mechanisms of estrogen regulation of bone resorption. J. Clin. Invest. 2000; 106 (10): 1203-4.
Rouhanizadeh M., Lin T.C., Miller J.D., Heistad D.D., Hsiai T.K. Induction of BMP4 in Vascular Smooth Muscle Cells by Shear Stress. The FASEB J. 2006; 20.
Sagalovsky S. Bone remodeling: cellular-molecularbiology and cytokine RANK-RANKL- osteoprotegerin (OPG) system and growth factors. 2014; 108.
Sagalovsky S., Kunze P., Schonert M. The role of cytokine system RANKL-RANK-OPG and cathepsin k in the pathogenesis of osteoporosis: achievements and perspectives in the treatment of disease. Klinicist. 2012; 6: 9-16.
Saito T., Mizobuchi M., Hamada T. et al. Tumoral calcinosis due to severe hyperphosphatemia and secondary hyperparathyroidism without vascular calcification in a hemodialysis patient. Clin. Nephrol. 2021; 95 (3): 166-170.
Sakat B.T., Sakhare R., Suryvanshi U.C., Kore P.S., Mohite S.K., Magdum C.S. Osteoporosis: The Brittle Bone. Asian J.Tof Pharmaceutical Research. 2018; 8: 39-43.
Salvemini D., Manning P.T., Zweifel B.S., Seibert K. et al. Dual inhibition of nitric oxide and prostaglandin production contributes to the antiinflammatory properties of nitric oxide synthase inhibitors. J. Clin. Invest. 1995; 96 (1): 301-8.
Shen G., Ren H., Shang Q., Zhang Z., Zhao W., Yu X., Tang J., Yang Z., Liang D., Jiang X. miR-128 plays a critical role in murine osteoclastogenesisand estrogen deficiency-induced bone loss. Theranostics. 2020; 10 (10): 4334-4348.
Sirichakwal P.P., Kamchansuppasin A., Akoh C.C., Kriengsinyos W., Charoenkiatkul S., O'Brien K.O. Vitamin D Status Is Positively Associated with Calcium Absorption among Postmenopausal Thai Women with Low Calcium Intakes. J. Nutr. 2015; 145 (5): 990-5.
Sulistyowati E., Hsu J.H., Lee S.J., Huang S.E., Sihotang W.Y., Wu B.N., Dai Z.K., Lin M.C., Yeh J.L. Potential Actions of Baicalein for Preventing Vascular Calcification of Smooth Muscle Cells In Vitro and In Vivo. Int J Mol Sci. 2022; 23 (10): 5673.
Sumin A.N., Shcheglova A.V., Ivanov S.V., Barbarash O.L. Long-Term Prognosis after Coronary Artery Bypass Grafting: The Impact of Arterial Stiffness and Multifocal Atherosclerosis. J. Clin. Med. 2022; 11 (15): 4585.
Teng Z., Zhu Y., Hao Q., Yu X., Teng Y., Yue Q., Zhang X., Lu S. Long non-coding RNA taurine upregulated gene 1 is downregulated in osteoporosis and influences the osteogenic differentiation of bone marrow mesenchymal stem cells. Peer. J. 2021; 9: e11251.
Tripodi L., Molinaro D., Farini A., Cadiao G., Villa C., Torrente Y. Flavonoids and Omega3 Prevent Muscle and Cardiac Damage in Duchenne Muscular Dystrophy Animal Model. Cells. 2021; 10 (11): 2917.
Trung Nguyen M.L., Ancion A., Tridetti J., Lancellotti P. Effets cardiovasculaires indesirables de l’alcool [Cardiovascular effects of alcohol consumption]. Rev Med Liege. 2019; 74 (5-6): 321-325.
Tyson J., Bundy K., Roach C., Douglas H., Ventura V., Segars M.F., Schwartz O., Simpson C.L. Mechanisms of the Osteogenic Switch of Smooth Muscle Cells in Vascular Calcification: WNT Signaling, BMPs, Mechanotransduction, and EndMT.
Bioengineering (Basel). 2020; 7 (3): 88.
Uskokovic V., Jankovic-Castvan I., Wu V.M. Bone Mineral Crystallinity Governs the Orchestration of Ossification and Resorption during Bone Remodeling. ACS Biomater. Sci Eng. 2019; 5 (7): 3483-3498.
Valencia-Ortega J., Zarate A., Saucedo R., Hernandez-Valencia M., Cruz J.G., Puello E. Placental Proinflammatory State and Maternal Endothelial Dysfunction in Preeclampsia. Gynecol. Obstet. Invest. 2019; 84 (1): 12-19.
Vural M., Mert M., Erhan B., Gunduz B., Keles B. et al. Bone mineral density and vitamin d in postmenopausal women?. 2017.
Quax W.J., van Assen A.H.G., Wang Y.Z. Published under licence by IOP Publishing Ltd, IOP Conference Series: Earth and Environmental Science. 2018; 185: 1088.
Wang C., Meng H., Wang X., Zhao C., Peng J., Wang Y. Differentiation of Bone Marrow Mesenchymal Stem Cells in Osteoblasts and Adipocytes and its Role in Treatment of Osteoporosis. Med. Sci Monit. 2016; 22: 226-233.
Xu ML, Bi CWC, Liu EYL, Dong TTX, Tsim KWK. Wnt3a induces the expression of acetylcholinesterase during osteoblast differentiation via the Runx2 transcription factor. J Biol Chem. 2017 Jul 28;292(30):12667-12678. doi: 10.1074.
Yamamoto Y., Noguchi T., Takahashi N. Effects of calcitonin on osteoclast. Clin. Calcium. 2005; 15 (3): 147-51.
Yang Y., Su Y., Wang D., Chen Y., Wu T., Li G., Sun X., Cui L. Tanshinol attenuates the deleterious effects of oxidative stress on osteoblastic differentiation via Wnt/FoxO3a signaling. Oxid. Med. Cell Longev. 2013; 2013: 351895.
Yudkin J.S., Stehouwer C.D., Emeis J.J., Coppack S.W. C-reactive protein in healthy subjects: associations with obesity, insulin resistance, andendothelial dysfunction: a potential role for cytokines originating from adipose tissue? Arterioscler
Thromb. Vasc. Biol. 1999; 19 (4): 972-8.
Zhu S., Haussling V., Aspera-Werz R.H., Chen T., Braun B., Weng W., Histing T., Nussler A.K. Bisphosphonates Reduce Smoking-Induced Osteoporotic-Like Alterations by Regulating RANKL/OPG in an Osteoblast and Osteoclast Co-Culture Model. Int J Mol Sci. 2020; 22 (1): 53.
Zou Y., Ito S., Yoshino F., Suzuki Y., Zhao L., Komatsu N. Polyglycerol Grafting Shields Nanoparticles from Protein Corona Formation to Avoid Macrophage Uptake. ACS Nano. 2020; 14 (6): 7216-7226.
Авторы:
Э.Ю.Валиев, Х.М.Асадуллаев, Н.М.Вахабова, О.Э.Валиев
1. Республиканский научный центр экстренной медицинской помощи,
2.Ташкентская медицинская академия,
3. Специализированный научно-практический медицинский центр травматологии и ортопедии г. Ташкент, Узбекистан
2.Ташкентская медицинская академия,
3. Специализированный научно-практический медицинский центр травматологии и ортопедии г. Ташкент, Узбекистан
Теги: атеросклероз
234567 Начало активности (дата): 31.01.2025
234567 Кем создан (ID): 989
234567 Ключевые слова: атеросклероз, атерокальциноз, апаптоз, остеопороз, остеокласт, ремоделирование, костная ткань, кальцификация сосудов
12354567899
Похожие статьи
Особенности хирургического лечения переломов лодыжек у пациентов с высокими рисками осложненийСистемная красная волчанка
Рентген на дому 8 495 22 555 6 8
Рентген-хирурги областной больницы применили алмазный бур для освобождения сердечной артерии и восстановления кровотока у пенсионера
Отдалённые результаты профилактики лечения перипротезной инфекции в онкоортопедии



