 03.10.2024
03.10.2024
Биомеханически обоснованный чрекскостной остеосинтез в лечении переломов плечевой кости, осложненных хроническим остеомиелитом, и их последствий
Лечение переломов плечевой кости различной локализации, осложненных хроническим остеомиелитом, продолжает оставаться актуальной проблемой и достаточно сложной задачей в современной травматологии и ортопедии, ввиду ее анатомо-топографических, биомеханических особенностей и существующего высокого риска повреждения сосудисто-нервного пучка на всех уровнях сегмента как во время травмы, так и в процессе хирургического вмешательства.
Среди всех повреждений опорно-двигательной системы на долю травматизма плечевой кости приходится 3—13,5 % [1, 5, 9], из них 14,4—72 % случаев составляют диафизарные переломы [5, 9]. Повреждения проксимального отдела встречаются в 5—15 % [2], а по некоторым данным в 32—65 % наблюдений [13]. При этом 58,3 % травм данной локализации сочетаются с вывихами головки плечевой кости [2] и 30 % — c повреждениями магистральных сосудов и крупных нервов [3]. В меньшей степени наблюдаются переломы дистальной трети сегмента — 6,5-15 % [21].
Закрытый вид переломов плечевой кости по частоте превалирует над открытым, 94,4 против 5,6 % [20]. При этом лица молодого возраста травмируют конечность вследствие высокоэнергетической травмы (дорожно-транспортное происшествие, ка- татравма, занятия спортом), а старшего возраста (более 60 лет) в основном имеют бытовой характер повреждения с преимущественной локализацией перелома в 87-90 % случаев в области хирургической шейки [3, 13, 14].
Несмотря на постоянное совершенствование металлофиксаторов для остеосинтеза и оперативной техники [11, 13], процент неудовлетворительных результатов не снижается и составляет 57,1 % случаев [20]. Последнее обусловлено развитием в послеоперационном и отдаленном периодах разного рода осложнений, но наиболее тяжелое и распространенное среди них — формирование ложного сустава. Удельный вес псевдоартрозов плечевой кости, по данным разных авторов, варьирует в пределах от 15 до 33 % наблюдений [23, 28, 31].
Лечение данного последствия длительное, многоэтапное и сопровождается образованием пострезекционных костных дефектов (0,5-27 %) [18], а присоединившаяся инфекция не только усугубляет сложность лечения и пролонгирует пребывание пациента в стационаре, но и в разы увеличивает его стоимость [29, 31]. При этом неудовлетворительный исход наблюдается в 21-71 % случаев [1, 22] и в 32,6 % клинических ситуациях приводит к инва- лидизации пациента [20]. Согласно литературным
источникам, доля чрескостного остеосинтеза при лечении несращений переломов и ложных суставов составляет 50 %, и достигает 90 % при их сочетании с инфекцией костной ткани [36].Цель исследования: изучить результаты лечения пациентов с переломами плечевой кости и их последствий, в том числе осложненных хроническим остеомиелитом, методом биомеханически обоснованного чрескостного остеосинтеза.
МАТЕРИАЛЫ И МЕТОДЫ
Проведен ретроспективный анализ результатов лечения 74 пациентов с переломами всех уровней плечевой кости и их последствиями методом биомеханически обоснованного чрескостного остеосинтеза, находившихся на лечении в отделении последствий травм опорно-двигательной системы и гнойных осложнений ФГБУ «НМИЦ ТО им. Н.Н. Приорова» за период с 2011 по 2019 г. Среди них женщин 34 (45,9 %), мужчин — 40 (54,1 %). Средний возраст составил 46 лет (от 18 до 83 лет). Женщин трудоспособного возраста (до 55 лет) было 18 (24,3 %), мужчин (до 60 лет) — 37 (50 %).
Критерии включения в исследование: 1. Изолированный перелом плечевой кости. 2. Чрескостный остеосинтез аппаратом внешней фиксации. 3. Демонтаж аппарата внешней фиксации в условиях нашего отделения. 4. Сроки амбулаторного наблюдения — 1 год и более с момента демонтажа аппарата.
Критерии исключения из исследования: 1. Множественные и комбинированные травмы. 2. Многооскольчатые и внутрисуставные переломы проксимального или дистального отделов плечевой кости. 3. Демонтаж аппарата внешней фиксации в других лечебных учреждениях. 4. Срок амбулаторного наблюдения после снятия аппарата — менее 1 года.
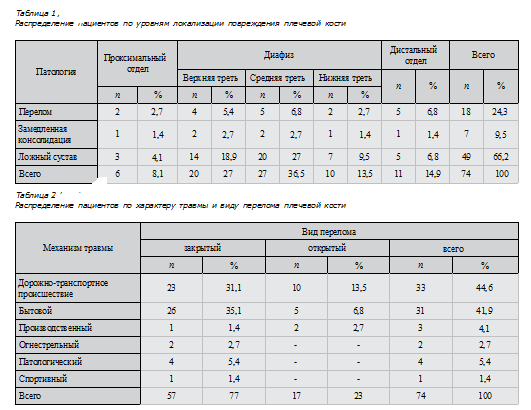
Из общего числа (74) пациентов с острыми переломами плечевой кости в среднем в течение 8 дней с момента получения травмы поступило 18 (24,3 %) человек, с замедленной консолидацией — 7 (9,5 %), с ложными суставами — 49 (66,2 %). 68 (92%) пациентов были с инфекционными осложнениями. Локализации уровней повреждения представлены в табл. 1.
Распределение пациентов по механизму травмы и виду перелома представлено в табл. 2.
Согласно биомеханической классификации переломов длинных костей, отломки делятся на рычагообладающие и не обладающие свойствами рычага [33-35]. Из 74 пациентов однорычаговые повреждения диагностированы у 24 (32,4 %) человек, двухры- чаговые — у 50 (67,6 %).
Сроки обращения в нашу клинику с момента получения травмы широко варьировали от 7 дней до 8 лет, в среднем — 3,5 года. Из них на догоспитальном этапе 45 (60,8 %) человек многократно (3 раза и более) подвергались оперативным вмешательствам.
Первичный остеосинтез пластиной и винтами проведен у 46 (62,2 %) больных: при закрытых переломах — 40 (54 %), открытых — 6 (8 %); интрамедуллярным штифтом с блокированием были прооперированы 8 (10,8 %) человек: 6 (8 %) — с закрытым и 2 (2,7 %) — с открытым повреждениями. Аппарат внешней фиксации, как первичный метод, применен в 10 (13,5 %) клинических случаях: по 5 (6,8 %) больных с закрытой и открытой травмой соответственно.
У 2 (2,7 %) пациентов был произведен комбинированный остеосинтез: «накостный — интрамедуллярный», «накостный — аппарат внешней фиксации».
Кроме того, реостеосинтез одним и тем же видом металлофиксатора, в частности пластиной или штифтом, при отсутствии признаков консолидации произведен в 4 и 1 наблюдении соответственно. Очередность методов остеосинтеза при неудовлетворительных исходах лечения применена у 20 (27 %) пациентов, из них 4 (5,4 %) — в сочетании с костной пластикой области несращения. Последовательность методик продемонстрирована в табл. 3.
Консервативное лечение до поступления проведено 8 (10,8 %) пациентам.
Необходимо отметить, что 25,7 % очередности методик произведены у пациентов с закрытыми переломами.
Длительность течения заболевания колебалась в широких пределах от 7 дней до 14 лет: до 1 месяца — 6 (8,8 %) человек, от 1 месяца до 1 года — 28 (41,2 %), от 1 года до 3 лет — 25 (36,8 %), от 3 до 6 лет — 7 (10,3 %), более 6 лет — 2 (2,9 %) пациента.
Нейропатии поврежденной верхней конечности зафиксированы у 18 (24,3 %) пациентов, среди которых с повреждением плечевого сплетения — 4 (5,4 %) случая, локтевого нерва — 2 (2,7 %), подмышечного — 1 (1,4 %), изолированно лучевого — 7 (9,5 %), в сочетании с поражением последнего со срединным и локтевым нервами — 3 (4,1 %) и 1 (1,4 %) соответственно. Причем 13 (17,6 %) пациентов имели посттравматическую этиологию нейропатии, 5 (6,8 %) — ятрогенную (после оперативного вмешательства).
Все пациенты в предоперационном периоде проходили полное клинико-рентгенологическое, лабораторное обследование. Так, изучение локального статуса пациентов во всех случаях выявило патологическую подвижность в зоне повреждения, гиперемию и гипертермию — у 32 (43,2 %), деформацию в области перелома/ложного сустава плечевой кости — у 17 (23 %), наличие свищей с гнойным отделяемым — в 26 (35,1 %) случаях, рана и инфильтрат в области послеоперационного рубца отмечена у 4 (5,4 %) и 1 (1,4 %) больного соответственно. При поступлении 63 (81,1 %) пациента жаловались на болевой синдром и во всех исследуемых случаях на нарушение функции пораженной конечности.
Следует отметить, что ввиду давности первичной травмы и неоднократных оперативных вмешательств удельный вес пациентов с контрактурами смежных суставов различной степени при госпитализации в нашу клинику составил 55 (74,3 %) человек: изолированно плечевого сустава — 18 (24,3 %), локтевого — 14 (18,9 %), обоих суставов — 20 (27 %), всех трех суставов, включая лучезапястный, — 3 (4,1 %), с укорочением исследуемого сегмента от 2 до 3 см — 4 (5,4 %) наблюдения.
С сопутствующей патологией, такой как сахарный диабет 2-го типа, ожирение, вирусные гепатиты В и С, эндокринные нарушения, остеопороз, усугубляющей течение хронического остеомиелита и влияющей на исход лечения, было 18 (24,3 %) пациентов.
Рентгенологический анализ выявил наличие металлоконструкций у 25 (33,8 %) пациентов. Де- фект-ложные суставы имели 15 (20,3 %) человек из общего числа больных, при этом у 5 из них размер дефекта костной ткани составил от 3 до 5 см.
На догоспитальном этапе помимо стандартных методов исследования для определения обширности границ поражения костной ткани, точной локализации секвестров также выполняли компьютерную томографию (КТ). Для выявления гнойных затеков, определения границ пораженных мягкотканных структур — магнитно-резонансную томографию (МРТ). При наличии свища проводили фистулографию. Микробиологический забор материала с последующей идентификацией возбудителя и тестированием чувствительности к исследуемым антибиотикам осуществляли: до операции (в случаях свища или раны), при хирургическом вмешательстве (минимум из 3 точек) и в послеоперационном периоде, не менее трех раз. Гистологическое исследование интраоперационного биоптата производили с целью уточнения наличия хронического воспалительного процесса поврежденного сегмента.
Методом выбора оперативного лечения для всех пациентов был чрескостный остеосинтез, осуществляемый аппаратами стержневой или гибридной компоновок с учетом основных критериев биомеханической концепции фиксации костных отломков. Компоновка аппарата внешней фиксации зависела от локализации повреждения сегмента. Кроме того, при необходимости, в предоперационном планировании обязательно учитывали место компактотомии в целях замещения костного дефекта или удлинения сегмента при значительном его укорочении.
Анализ результатов лечения методом биомеханически обоснованного чрескостного остеосинтеза проводили по следующим показателям:
• восстановлению анатомической оси плечевой кости;
• функциональности конечности;
• рентгенологическим признакам полной консолидации области перелома;
• клинико-лабораторным данным купирования воспалительного процесса.
Также мы ориентировались на субъективную оценку самочувствия пациентов, используя шкалу DASH (Disabilities of Arm, Shoulder and Hand). Среднее значение по шкале DASH у пациентов до операции составило 29,4 балла.
Динамику анатомо-функционального состояния конечности осуществляли амбулаторно в условиях поликлинического приема на основании результатов локального статуса и рентгенограмм плеча в двух проекциях (прямой и боковой) ежемесячно с момента выписки до демонтажа аппарата. После демонтажа аппарата контроль проводили в сроки
1 раз в 3 мес., а затем 1 раз в 6 мес. Статистическая обработка данных проведена с помощью программы IBM SPSS Statistics 22. Для представления данных использованы методы описательной статистики.В качестве дополнительной задачи исследования выдвинуто предположение о возможной связи механизма травмы (высоко/низкоэнергетическая) и количестве отломков кости, обладающих свойствами рычага (один либо два). При расчетах использовался критерий х2 Пирсона.
Алгоритм хирургического лечения
При проведении оперативного вмешательства мы придерживались критериев, выработанных многолетним клиническим опытом нашей клиники: а) экономная резекция костных концов в пределах жизнеспособной ткани; б) реканализация костномозгового канала в случаях его облитерации как проксимального, так и дистального фрагментов; в) их адаптация; г) стабильная и жесткая фиксация костных отломков, с учетом их рычаговых свойств, аппаратом внешней фиксации в трех плоскостях и шести степенях свободы.
Операцию завершали адекватным дренированием и ушиванием раны. В редких случаях во время операции для лучшей визуализации и выделения лучевого нерва мы использовали гемостатический жгут.
При наличии свищевого хода после забора материала для микробиологического исследования через катетер вводили 1 % раствор бриллиантовой зелени. Как правило, разрез осуществляли по ходу имеющегося рубца от предыдущих операций с иссечением свища при его наличии. В отдельных ситуациях использовали передний доступ в проксимальном отделе, латеральный с выделением лучевого нерва — при переломах в средней трети диафиза плечевой кости и задний срединный — в дистальном отделе, чтобы исключить контакт с лучевым нервом.
Далее обнажали зону повреждения. При наличии металлических фиксаторов их удаляли. Осуществляли санацию ложа фиксатора (пластины) для лучшей визуализации патологического участка, оценки жизнеспособности и определения размера дефекта костной ткани. Иссекали рубцовую, грануляционную ткани. В случаях интрамедуллярного штифта после его извлечения выполняли тщательную санацию костномозгового канала на всем протяжении. Обязательным условием являлась реканализация облитерирующего костномозгового канала для вовлечения эндоста в последующий процесс остеорегенерации. Резекцию выполняли в пределах здоровой костной ткани до появления «кровяной росы». Добивались конгруэнтности резецированных концов с целью оптимальной их адаптации.
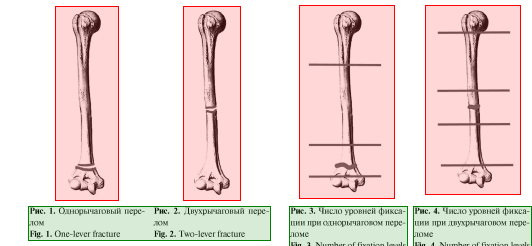
Следующим этапом приступали к чрескостно- му остеосинтезу аппаратом стержневой или спицестержневой компоновок. Определяли число уровней фиксации плечевого сегмента, используя биомеханические критерии костных отломков. Согласно биомеханической концепции костные отломки и осколки длинных костей подразделяются на обладающие и не обладающие рычаговыми свойствами. Дифференциация костных отломков по рычаговым свойствам основывается на следующем принципе: если длина отломка не превышает величину равной двум диаметрам кости на уровне линии излома, то такой отломок не обладает свойствами рычага. Если же максимальная длина отломка превышает данную величину, то он обладает рычаговыми свойствами, нейтрализация которых — обязательное условие для достижения стабильной фиксации [33—35, 37, 38]. Таким образом, переломы классифицируются на однорычаговые и двухрычаговые (рис. 1, 2).
К однорычаговым относятся переломы с полным нарушением поперечника кости, распространяющимся на 5 см от метафизарной зоны, то есть наиболее широкой части в поперечнике. Рычаговыми свойствами обладает только один отломок, а отломки суставного конца ими практически не обладают. Такие переломы фиксируются на 3 уровнях: отломок, не обладающий свойствами рычага, — на одном уровне фиксации, а обладающий рычаговыми свойствами — на двух уровнях с разносом элементов фиксации на расстояние не менее 50 % длины отломка (рис. 3). Двухрычаговыми являются метадиафизарные и диафизарные переломы с распространением линии излома дальше диаметра вращения суставных концов кости. В данной группе повреждений оба отломка обладают свойствами рычага, поэтому они фиксируются на 4 уровнях, то есть по 2 уровня на каждом отломке (рис. 4) [35].
Руководствуясь принципами компактности и комфортности аппарата, не препятствующего движениям в плечевом и локтевом суставах, мы в основном использовали аппараты формы открытого контура (полукольца, секторы).
Причем в проксимальной части полукольцо и сектор фиксировали на стержнях диаметром 5 или 6 мм в зависимости от параметров и конституции оперируемого сегмента.
Фиксирующие элементы (стержни) проводили максимально близко к перпендикулярному углу относительно продольной оси отломков и в анатомически безопасных зонах: для проксимального отдела — по переднелатеральной поверхности через дельтовидную мышцу под углом 45° к фронтальной плоскости, учитывая топографию сухожилия длинной головки двуглавой мышцы плеча (caput longum m. bicipitis brachii) и подмышечного нерва (n. axillaris), огибающего метафиз дорсолатерально на расстоянии 5—7 см книзу от акромиона (acromion). Минимальный угол фиксирующих элементов на проксимальном уровне составлял не менее 60°. Необходимо отметить, что чрезмерное глубокое введение фиксирующего элемента после прохождения второго кортикального слоя может повредить медиальный сосудисто-нервный пучок.
Для среднего отдела относительно безопасного места нет, поскольку лучевой нерв (n. radialis), идущий в плече-мышечном канале (canalis hu- meromuscularis) и спиралевидно огибающий кость в данной области в направлении снаружи кпереди, плотно прилегает к кости. Надо отметить, что независимо от опыта оперирующего хирурга риск повреждения лучевого нерва всегда присутствует. Поэтому, чтобы избежать данного осложнения, мы проводим стержни в направлении на 25—30° кзади от фронтальной оси плеча в положении конечности максимально согнутой в локтевом суставе. Введение элементов фиксации в таком положении верхней конечности предотвращает формирование разгибательной контрактуры в локтевом суставе в послеоперационном периоде, что представляется очень важным моментом для последующей полноценной реабилитации.
В дистальном отделе таковой зоной является задняя/заднелатеральная поверхность через трехглавую мышцу под углом 15—20° относительно фронтальной плоскости. При этом угол перекреста введенных нами элементов составлял не менее 30—40°. В случае, как и с верхней третью, глубокая перфорация фиксирующего элемента при прохождении второго кортикального слоя может привести к повреждению плечевой артерии (a. brachialis) и срединного нерва (n. medianus).
После стабилизации аппарата внешней фиксации осуществляли интраоперационный рентгенологический контроль восстановления правильной анатомической оси сегмента во всех плоскостях и области контакта отломков плечевой кости. Далее переходили к заключительным этапам операции — дренированию, ушиванию раны и наложению асептических повязок. Кровопотеря независимо от степени сложности и объема оперативного вмешательства была минимальной.
РЕЗУЛЬТАТЫ
Метод монолокального чрескостного остеосинтеза применен у 69 (93 %), билокального — у 5 (7 %) пациентов с пострезекционным дефектом 3 см и более либо с укорочением конечности на 4 см и более. Из них остеосинтез аппаратом стержневой компоновки выполнен 36 (48,6 %), спице-стержневой — 38 (51,4 %) пациентам. Одному пациенту со стойкой контрактурой локтевого сустава применена компоновка аппарата «плечо — предплечье», поскольку дистальный отломок плечевой кости вместе с предплечьем при анкилозе локтевого сустава — это единый рычаг, нейтрализация которого, создает необходимые условия для стабильной и жесткой фиксации костных отломков. Пациентам, которым требовалось замещение дефекта или удлинение конечности, вторым этапом осуществляли компактотомию.
Результаты лечения 48 (66 %) пациентов прослежены в сроки от 1 года до 3 лет, 22 (30 %) — до 6 лет, 3 (4 %) — до 10 лет. Из исследования выбыл 1 пациент по причине смерти от онкологии в течение 1 года после выписки. Во всех случаях достигнуто полное купирование воспалительного процесса и консолидация костных отломков плечевой кости.
Средний срок фиксации в аппарате составил 187 дней, пребывание в стационаре (сред. койкодень) — 16 дней. Длительность ступенчатой антибактериальной терапии (с последующим переходом на таблетированные формы) продолжалась в течение 2 нед. Подбор препаратов производили в соответствии с данными антибиотикограмм.
Повторное оперативное вмешательство за весь период фиксации аппаратом внешней фиксации потребовалось 6 (8,1 %) пациентам из-за развившихся осложнений: по поводу воспаления вокруг фиксирующих элементов — 3 (4 %) случая, формирование абсцесса — 1 (1,3 %), вторичное смещение — 2 (2,7 %) человека, которые произошли в результате падения пациентов на плечо, фиксированное аппаратом.
У 5 (7 %) пациентов произведена плановая адаптирующая резекция (до 0,5 см) костных концов после постепенной их компрессии.
Как уже было ранее отмечено, подавляющее большинство пациентов поступило в клинику в достаточно поздние сроки с момента получения первичной травмы. За этот период у многих успела развиться стойкая контрактура смежных суставов. Как правило, это многократно оперированные либо с тотальным повреждением плечевого сплетения больные, поэтому функциональное восстановление конечности у данной категории была второстепенной.
Перед нами стояла первостепенная задача восстановления анатомической целостности плечевой кости и купирования инфекционного процесса.
Отличным считали результат с полной консолидацией области перелома, стойкой ремиссией инфекционного процесса, правильной анатомической осью плечевой кости, с полной амплитудой движений или незначительным ее ограничением в смежных суставах и укорочением плеча до 1 см. Хорошим — с укорочением до 2 см, незначительной остаточной деформацией оси сегмента, ограничением движений в смежных суставах до 30°.
Удовлетворительным — сохранение болевого синдрома, укорочение более 2 см, с деформацией оси сегмента до 5°, ограничение объема движений в смежном суставе до 60°. Неудовлетворительный — отсутствие консолидации костных концов плечевой кости и не достигнутая ремиссия / частые рецидивы хронического остеомиелита.
Субъективная оценка состояния поврежденной конечности проведена по шкале DASH, согласно которой функциональность считали отличной в диапазоне от 0 до 8 баллов, хорошей — 9—20, удовлетворительной — 21—35 и неудовлетворительной — более 35 баллов.
Отличных результатов лечения удалось добиться в 25 (34 %) случаях, хорошие получены у 44 (60 %) пациентов, удовлетворительные констатированы у 4 (6 %). Неудовлетворительных исходов не зарегистрировано, так как во всех случаях было достигнуто сращение кости и купирован воспалительный процесс. Среднее значение итогов лечения по шкале DASH составило 10,3 балла, что входит в интервал хороших результатов.
При проверке гипотезы о возможной связи механизма травмы (высоко/низкоэнергетическая) и количестве отломков, которые обладают свойствами рычага, образующихся при переломе, при помощи критерия х2 Пирсона, статистическая достоверность связи не подтверждена (р = 0,862). Таким образом, на характер возникающего перелома плечевой кости влияет не степень энергетичности травмы сама по себе, а иные факторы, требующие дальнейших исследований.
КЛИНИЧЕСКИЙ ПРИМЕР
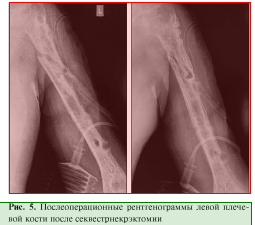
Пациент, 49 лет, получил производственную травму в результате падения с высоты около 2 м. Диагноз: «Закрытый перелом на границе верхней и средней трети левой плечевой кости». Через 5 дней после травмы выполнен остеосинтез пластиной и винтами. Спустя месяц открылся свищ, в связи с чем произведено удаление металлоконструкции, секвестрнекрэктомия и реостеосинтез левой плечевой кости аппаратом внешней фиксации. Аппарат демонтирован через 6 мес. В последующем выполнялись неоднократные санационные операции левой плечевой кости по поводу рецидива в разных лечебных учреждениях (рис. 5).
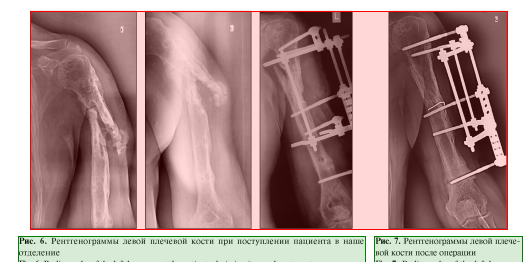
Через 5 мес. при повторном падении пациент получил патологический перелом на границе проксимального и среднего отдела диафиза левой плечевой кости (рис. 6). Госпитализирован в нашу клинику.
При осмотре локально: патологическая подвижность на границе верхней и средней трети левого плеча. Движения в левом плечевом суставе: от- ведение/приведение — 30/180°, сгибание/разгиба- ние — 40/180°, ротация — 10°.
Движения в локтевом, лучезапястном суставах, суставах пальцев кисти — в полном объеме, безболезненные. Сосудисто-неврологических расстройств не выявлено.
В условиях нашей клиники выполнена операция:
1. Экономная резекционная секвестрнекрэктомия левой плечевой кости.
2. Реостеосинтез левой плечевой кости аппаратом внешней фиксации стержневой компоновки (рис. 7).
Резекция костной ткани осуществлена в пределах жизнеспособной ткани. Согласно критериям биомеханической концепции, двухрычаговый перелом зафиксирован на 4 уровнях фиксации, по 2 уровня на каждом отломке. Рана была дренирована. В послеоперационном периоде проведена антибактериальная терапия [с учетом данных микробиологического исследования — метицил- линрезистентный золотистый стафилококк (MRSA)]: Ванкомицин по 1 г 2 раза в день в/в капельно 12 дней.
Параллельно проводили противовоспалительную, инфузионную терапию. Послеоперационная рана зажила первичным натяжением. Дренажная трубка удалена на третьи сутки.
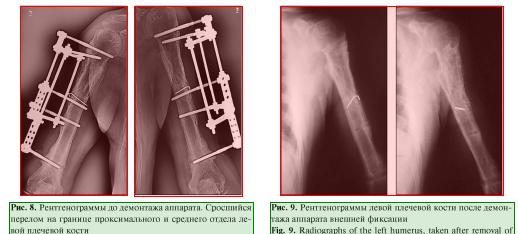
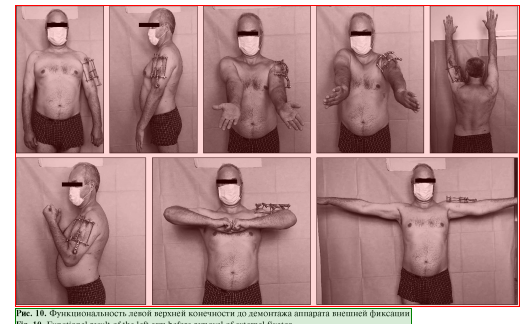
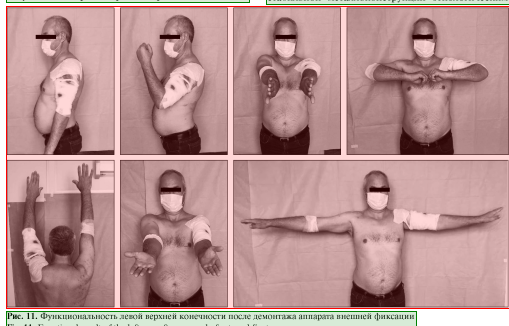
Пациент наблюдался амбулаторно 1 раз в месяц, разрабатывал движения в плечевом и в локтевом суставах. Через 7 мес. диагностирована консолидация области перелома левой плечевой кости, поле 34 чего аппарат был демонтирован (рис. 8, 9), рецидивов за весь период наблюдения не зафиксировано. Функциональность конечности полностью восстановлена (рис. 10, 11).
ОБСУЖДЕНИЕ
Согласно проведенному нами анализу, частота травматизма плечевой кости в результате воздействия высококинетических сил (при дорожно-транспортном происшествии) и в быту практически одинакова — 44,6 и 42 % соответственно, что несколько расходится с данными зарубежных источников (63,2 против 15,1 %) [24]. По нашим наблюдениям патологические переломы в основном встречаются у женщин старшего возраста, старше 70 лет, с сопутствующим менопаузальным остеопорозом или у многократно оперированных пациентов по поводу часто рецидивирующего остеомиелита плечевой кости.
Переломы диафиза (77 %) превалируют по сравнению с проксимальным и дистальным отделами сегмента. Причем в подавляющем большинстве случаев они локализуются в средней трети диафиза (36,5 %).
Исследование 17 пациентов из 25 с металлоконструкциями плечевой кости выявило их несоответствие основным критериям биомеханической концепции фиксации — первичный остеосинтез был нестабильным. Во всех клинических ситуациях несущая часть фиксаторов не превышала должные2/3 длины каждого отломка, а фиксирующие элементы не были разнесены на расстояние не менее половины длины фрагмента [35]. В 32 % случаев стабильной металлоконструкции этиологическим фактором замедленной консолидации или несращения перелома послужило развитие хронического остеомиелита, что не противоречит данным, приведенными M. Leiblein и соавт. [23], согласно которым частота развития псевдоартроза плечевой кости, как следствие инфекционного осложнения, составила 38 % наблюдений [23, 27].
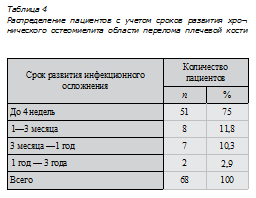
В настоящее время доказано влияние хронического остеомиелита на процесс консолидации перелома за счет непосредственного воздействия вирулентных микроорганизмов, вызвавших данную инфекцию, или их продуктов обмена на костную мозоль, что сопровождается активацией каскада реакций хемотаксиса макрофагов, гранулоцитов, провоспалительных цитокинов в патологический очаг, исходом которого является остеолиз костной ткани и как следствие нарушение стабильности фиксации [26].Как видно из табл. 4 у 75 % пациентов инфекционное осложнение развилось в раннем послеоперационном периоде, и только лишь у 2,9 % — через 1 год и более после оперативного вмешательства.
Ретроспективное изучение выписной документации, предоставленной пациентами, свидетельствует о значительном числе случаев несоблюдения тактики лечения открытых повреждений плечевой кости и их последствий, в том числе основ антибактериальной терапии.
Порой клиника воспаления латентна и только проведение микробиологического и гистологического исследований нескольких интраоперационных биоптатов позволяет ее обнаружить [26]. Так, скрытое течение хронического остеомиелита диагностировано нами у 1 (1,4 %) пациента, что значительно ниже в сравнении с результатом, полученным в исследовании L. Mills и соавт. (5 % случаев) [27, 36].
Очередность методов остеосинтеза, в частно - сти замена пластины на штифт или наоборот, при отсутствии признаков образования костной мозоли в зоне перелома приводит к дополнительной травматизации мягких тканей, нарушению эндостального и периостального кровоснабжения, и как следствие к еще большему усугублению процессов остеорепарации и неудовлетворительным исходам. Таким образом, причинами неудачных результатов лечения являются прежде всего ятрогенные:
1. Несоответствующий с биомеханической точки зрения проведенный остеосинтез, некорректный выбор первичной металлоконструкции, не способной обеспечить необходимую стабильную и жесткую фиксацию костных отломков в течение всего периода лечения.
2. Недостаточно правильная адаптация концов костных отломков.
3. Игнорирование противопоказаний к применению погружных металлоконструкций при высокой контаминации очага при открытых переломах (11 % случаев), что впоследствии приводит к развитию инфекционного процесса и хронического остеомиелита.
Кроме того, усугубляющими факторами, оказывающими косвенное негативное влияние на результат лечения, считаются: ожирение (индекс массы тела >30) в 35-37 %, курение (38-53 %), сердечно-сосудистые заболевания (37 %), метаболические нарушения костной ткани (32 %), а также политравма со множественными переломами длинных костей [28].
Биомеханически необоснованная замена одного погружного металлофиксатора на другой с применением костной пластики при дефектах, обширная отслойка надкостницы, вследствие несоблюдения оперативной техники, приводит к нарушению локального кровоснабжения сегмента. Как известно, любое вмешательство с имплантацией фиксатора, независимо от его вида, всегда сопряжено с риском инфекционного осложнения, а поочередное применение различных методов остеосинтеза при неудовлетворительном исходе в разы увеличивает вероятность развития данной компликации.
Анализ данных также показал, что наиболее распространенный и часто применяемый первичный метод остеосинтеза плечевой кости — это накостная фиксация пластиной и винтами (62,2 %). При этом существенной разницы в частоте развития послеоперационных осложнений при использовании в качестве первичного метода пластины или интрамедуллярного штифта не выявлено [23] и составляет 30-35 % [4].
Доля нейропатий лучевого нерва при переломах всех уровней плечевой кости по старым источникам отечественной литературы составляет 1,3-20 % [17], по современным данным 11-12% (15,2 % всех диафизарных переломов) случаев [28], из них 3/4 повреждений происходит непосредственно во время получения травмы, а остальные — вследствие оперативного вмешательства [24].
В нашем исследовании нейропатия лучевого нерва отмечена в 14,9 % наблюдений (в основном, за счет переломов диафиза плечевой кости). При этом 10,8 % удельного веса повреждения нерва происходят у пациентов с переломом средней трети диафиза сегмента, среди которых 9,5 % развились после травмы, 5,4 % — вследствие оперативного вмешательства. Данные нашего исследования не противоречат описанным в литературе. В своей работе S. Yigit [24] приводит цифры 17,3 % нейропатий лучевого нерва из 52 пролеченных пациентов, что несколько больше в сравнении с нашими показателями. Возможно, такая высокая частота связана с включением в исследование пациентов исключительно с переломами диафиза плечевой кости.
Как показал анализ литературы, чрескостный остеосинтез как метод лечения переломов плечевой кости, их последствий и осложнений не столь предпочтителен и распространен среди оперирующих травматологов-ортопедов, о чем свидетельствует небольшое количество существующих публикаций в основных отечественных журналах за последние 10 лет. Так, с 2010 по 2020 г. всего выпущено 10 научных статей, посвященных данной тематике.
Проведенный нами анализ первичного остео - синтеза как метода выбора при открытых и закрытых переломах сегмента демонстрирует низкую приверженность к данной методике (13,5 %). Нерезультативность других способов лечения в 20 % случаев способствует вынужденному применению чрескостного остеосинтеза. Можно предположить, 37 что столь нераспространенное применение аппаратов внешней фиксации при повреждениях плеча обусловлено небольшим количеством специалистов, владеющих данным методом остеосинтеза, а также лечебных учреждений, занимающихся их подготовкой. Как показывает практика, для подготовки высококвалифицированного специалиста, владеющего техникой чрескостного остеосинтеза и знающего основы лечения последствий травм с костной инфекцией, требуется 7—10 лет.
Успешность остеосинтеза плечевой кости аппаратом внешней фиксации, согласно литературным источникам, составляет от 80 до 97 % [25, 28, 30, 32]. В нашем исследовании применение метода биомеханически обоснованного чрескостного остеосинтеза у данной категории больных обеспечило 100 % положительных исходов, 94 % из которых — с отличным и хорошим функциональным состоянием конечности.
Преимущество метода биомеханически обоснованного чрескостного остеосинтеза заключается в возможности репозиции отломков закрытым способом, малой травматичности оперативного вмешательства, одновременном создании условий для стабильной фиксации фрагментов плечевой кости в трех плоскостях и шести степенях свободы, билокальном замещении обширных дефектов, динамическом управлении отломками на протяжении всего периода фиксации, купировании инфекционного процесса и ранней функциональной активности пациента [30], а также в индивидуальности каждой компоновки аппарата. Кроме того, процент осложнений (до 8 %) и вероятность травмирования лучевого нерва минимальны.
Зарубежные коллеги в лечении инфицированных ложных суставов плечевой кости придерживаются поэтапного подхода, где первым этапом выполняют радикальную санацию гнойно-воспалительного очага с последующей гипсовой иммобилизацией и ступенчатой антибактериальной терапией в течение 6 нед. После клинико-лабораторной ремиссии инфекционного процесса приступают ко второму этапу (в общей сложности через 8—12 нед. после первого этапа) — чрескостному остеосинтезу [25]. Подобная тактика обоснована сокращением срока фиксации сегмента в аппарате внешней фиксации с целью снижения риска развития специфических осложнений.
Наш клинический опыт показывает отсутствие необходимости в двухэтапности методики лечения, поскольку в условиях чрескостного остеосинтеза возможно одновременно решить несколько задач: купирование гнойно-воспалительного процесса, обеспечение стабильной фиксации костных фрагментов на всем протяжении лечения, восстановление амплитуды движений в смежных суставах пораженного сегмента. Важно отметить, что частота осложнений составила 8,1 %, среди них доля специфических — 4 %, что в целом не отличается от показателей при двухэтапной методике лечения, про- погандируемой нашими зарубежными коллегами.
Несмотря на отсутствие консенсуса в тактике лечения данной категории пациентов, успешность результатов первичного остеосинтеза, независимо от вида выбранной металлоконструкции, зависит от правильного определения рычаговых свойств отломков плечевой кости и их нейтрализацией необходимой длины фиксатором, а также требует учи- тывания минеральной плотности костной ткани, остеорепаративных возможностей и состояния иммунного статуса организма, факторов риска разного рода осложнений, в том числе инфекционных, помимо всего немаловажное значение имеет опыт хирурга.
ЗАКЛЮЧЕНИЕ
Биомеханически обоснованный метод чрескостного остеосинтеза позволяет свести многоэтапное лечение переломов плечевой кости, их последствий и осложнений в один этап, что существенно сокращает сроки реабилитации пациента и обеспечивает до 94 % отличных и хороших функциональных результатов.
ЛИТЕРАТУРА
2. Коган П.Г., Воронцова Т.Н., Шубняков И.И., и др. Эволюция лечения переломов проксимального отдела плечевой кости (обзор литературы). Травматология и ортопедия России. 2013;(3):154-161. [Kogan PG, Vorontsova TN, Shubnya- kov II, et al. Evolyutsiya lecheniya perelomov proksimal’nogo otdela plechevoi kosti (obzor literatury). Travmatologiya i orto- pediya Rossii. 2013;(3):154—161. (In Russ).]
3. Файн А.М., Ваза А.Ю., Сластинин В.В., Титов Р.С. Диагностика и лечение переломов проксимального отдела плечевой кости. Журнал им. Н.В. Склифосовского «Неотложная медицинская помощь». 2018;7(2): 144—151. [Fain AM, Vaza AY, Slastinin VV, Titov RS. Diagnosis and treatment of proximal humerus fractures. Russian Sklifosovsky Journal “Emergency Medical Care”. 2018;7(2): 144—151. (In Russ).] doi: 10.23934/2223-9022-2018-7-2-144-151.
4. Попов В.П. Лечение переломов плечевой кости с применением биоактивных и биоинертных имплантатов. Бюллетень сибирской медицины. 2012;(6): 160—166. [Popov VP. Lechenie perelomov plechevoi kosti s primeneniem bioaktivnykh i bioinertnykh implantatov. Byulleten’ sibirskoi meditsiny. 2012;(6):160—166. (In Russ).]
5. Барабаш А.П., Гражданов К.А., Барабаш Ю.А., Балаян В.Д. Лечение последствий переломов диафиза плечевой кости с использованием различных методов стимуляции костеобразования в условиях стабильной фиксации отломков. Гений ортопедии. 2012;(2):77—81. [Barabash AP, Grazhdanov KA, Barabash YuA, Balayan VD. Lechenie posledstvii perelomov diafiza plechevoi kosti s ispol’zovaniem razlichnykh metodov stimulyatsii kosteobra- zovaniya v usloviyakh stabil’noi fiksatsii otlomkov. Genii orto- pedii. 2012;(2):77—81. (In Russ).]
6. Васюк В.Л., Брагарь А.А. Накостный остеосинтез переломов плечевой кости (обзор литературы). Бюллетень ВСНЦ СО РАМН. 2011;(4):344—347. [Vasyuk VL, Bragar’ AA. Nakostnyi osteosintez perelomov plechevoi kosti (obzor literatury). Byulleten’ VSNTsSORAMN. 2011;(4):344— 347. (In Russ).]
7. Кочиш А.Ю., Майоров Б.А., Беленький И.Г. Оригинальный способ малоинвазивного накостного остеосинтеза спирально изогнутыми пластинами при переломах диафиза плечевой кости. Травматология и ортопедия России. 2016;22(3):99—109. [Kochish AYu, Maiorov BA, Belen’kii IG. The new method of minimally invasive osteo- sythesis of humeral shaft fractures with helical plates. Trav- matologiya i ortopediya Rossii. 2016;22(3):99—109. (In Russ).]
8. Толстых А.Л. Особенности восстановления архитектоники кости при многооскольчатых переломах проксимального отдела плеча. Вестник новых медицинских технологий. 2014;21(1):73—75. [Tolstykh AL. Open reposition of fresh shoulder dislocations fractures. Journal of New Medical Technologies. eJournal. 2014;21(1):73—75. (In Russ).] doi: 10.12737/4788.
9. Апагуни А.Э., Арзуманов С.В., Эсеналиев А.А. Пути улучшения качества жизни больных с переломами проксимального отдела и диафиза плечевой кости. Кубанский научный медицинский вестник. 2009;(2):17—19. [Apa- guni AE, Arzumanov SV, Esenaliev AA. Puti uluchsheniya kachestva zhizni bol’nykh s perelomami proksimal’nogo ot- dela i diafiza plechevoi kosti. Kubanskii nauchnyi meditsinskii vestnik. 2009;(2):17—19. (In Russ).]
10. Майоров Б.А., Беленький И.Г., Кочиш А.Ю. Сравнительный анализ результатов использования трех способов остеосинтеза при переломах диафиза плечевой кости. Гений ортопедии. 2017;23(3):284—291. [Maiorov BA, Belen’kii IG, Kochish AYu. Comparison analysis of using three methods for humeral shaft fracture osteosynthesis. Genii ortopedii. 2017;23(3):284—291. (In Russ).]
11. Набиев Е.Н. Стабильность остеосинтеза при переломах проксимального конца плечевой кости в эксперименте. Гений ортопедии. 2012;(1):15—18. [Nabiev EN. Stabil’nost’ osteosinteza pri perelomakh proksimal’nogo kontsa plechevoi kosti v eksperimente. Genii ortopedii. 2012;(1):15—18. (In Russ).]
12. Николенко В.Н., Бейдик О.В., Мидаев Ю.М., и др. Анатомо-клиническое обоснование вариантов внешней фиксации при переломах плечевой кости с учетом особенностей ее васкуляризации. Гений ортопедии. 2006;(2):45—50. [Nikolenko VN, Beidik OV, Midaev YuM, et al. Anatomo-klinicheskoe obosnovanie variantov vneshnei fiksatsii pri perelomakh plechevoi kosti s uchetom osoben- nostei ee vaskulyarizatsii. Genii ortopedii. 2006;(2):45—50
13. Егиазарян К.А., Ратьев А.П., Гордиенко Д.И., и др. Среднесрочные результаты лечения переломов проксимального отдела плечевой кости методом внутрикостного остеосинтеза. Травматология и ортопедия России. 2018;24(4):81—88. [Egiazaryan KA, Rat’ev AP, Gordien- ko DI, et al. Midterm treatment outcomes of proximal humerus fractures by intramedullary fixation. Travmatologi- ya i ortopediya Rossii. 2018;24(4):81—88. (In Russ).]
15. Bari MM, Shahidul Islam, Shetu NH, et al. Treatment ofhumer- us nonunion using G.A. Ilizarov technique. MOJ Orthop Rheumatol. 2015;(2):88—89. doi: 10.15406/mojor.2015.02.00046.
16. Гражданов К.А., Барабаш А.П., Барабаш Ю.А., Кауц О.А. Интрамедуллярный остеосинтез в лечении последствий переломов плечевой кости. Саратовский научно-медицинский журнал. 2018;14(3):523—529. [Grazhdanov KA, Barabash AP, Barabash YuA, Kauts OA. Intramedullary osteosynthesis in the treatment of humerus fracture consequences. Saratovskii nauchno-meditsinskii zhurnal. 2018;14(3):523—529. (In Russ).]
17. Швед С.И., Сысенко Ю.М. Способ остеосинтеза переломов плечевой кости, сопровождающихся невритами лучевого нерва. Гений ортопедии. 2000;(2):74—77. [Shved SI, Sysenko YuM. Sposob osteosinteza perelomov plechevoi kosti, soprovozhdayushchikhsya nevritami luchevogo nerva. Genii ortopedii. 2000;(2):74—77. (In Russ).]
18. Шаповалов В.М., Губочкин Н.Г., Микитюк С.И. Формирование кровоснабжаемых костных трансплантатов и их использование для лечения ложных суставов и дефектов костей. Вестник хирургии имени И.И. Грекова. 2013; 172(4):63—67. [Shapovalov VM, Gubochkin NG, Mikityuk SI. Formation of vascularized bone grafts and their use for treatment of pseudoarthroses and bone defects. Grekov’s Bulletin of Surgery. 2013; 172(4):63—67. (In Russ).]
19. Сермяжко Г.К. Опыт стимуляции остеогенеза методом пьезоэлектрической экстракорпоральной ударно-волновой терапии при диафизарных переломах плечевой кости (описание клинического случая). Вестник новых медицинских технологий. 2013;(1):108. [Sermyazhko GK. The experiment are stimulation of osteogenesis the method piezoelectric extracorporeal shockwave therapy for the diaphyseal fractures of the humerus (a clinical case report). Vestnik novykh meditsinskikh tekhnologii. 2013;(1):108. (In Russ).]
20. Батпенов Н.Д., Оспанов К.Т., Цай Д.А., Акишев К.Ш. Экспериментальная оценка стабильности накостного остеосинтеза при переломе диафиза плечевой кости. Медицина и экология. 2010;(3):104—108. [Batpenov ND, Ospanov KT, Tsai DA, Akishev KSh. Eksperimental’naya otsenka stabil’nosti nakostnogo osteosinteza pri perelome di- afiza plechevoi kosti. Meditsina i ekologiya. 2010;(3):104—108. (In Russ).]
21. Кривенко С.Н., Медведев Д.И. Остеосинтез мелких фрагментов при многооскольчатых переломах дистального метаэпифиза плечевой кости. Гений ортопедии. 2018;24(4):436—443. [Krivenko SN, Medvedev DI. Osteosynthesis of small fragments in multicomminuted fractures of the distal humerus metaepiphysis. Genii ortopedii. 2018;24(4):436—443. (In Russ).] doi: 10.18019/1028-4427- 2018-24-4-436-443.
22. Клюшин Н.М., Шляхов В.И., Злобин А.В., и др. Чре- скостный остеосинтез при лечении остеомиелита длинных костей верхней конечности. Гений ортопедии. 2010;(4):45—50. [Klyushin NM, Shlyakhov VI, Zlobin AV, et al. Transosseous osteosynthesis in treatment of osteomyelitis of upper limb long bones. Genii ortopedii. 2010;(4):45—50. (In Russ).]
23. Leiblein M, Verboket R, Marzi I, et al. Nonunions of the humerus — treatment concepts and results of the last five years. Chin J Traumatol. 2019;22(4): 187—195. doi: 10.1016/j.cjtee.2019.04.002.
24. Yigit S. What should be the timing of surgical treatment of humeral shaft fractures? Medicine (Baltimore). 2020;99(17):e19858. doi: 10.1097/MD.0000000000019858.
25. Ferreira N, Marais LC, Serfontein C. Two stage reconstruction of septic non-union of the humerus with the use of circular external fixation. Injury. 2016;47(8):1713—1718. doi: 10.1016/j.injury.2016.06.014.
26. Kanakaris NK, Tosounidis TH, Giannoudis PV. Surgical management of infected non-unions: an update. Injury. 2015;46 Suppl 5:S25-32. doi: 10.1016/j.injury.2015.08.009.
27. Mills L, Tsang J, Hopper G, et al. The multifactorial aetiology of fracture nonunion and the importance of searching for latent infection. Bone Joint Res. 2016;5(10):e512—e519. doi: 10.1302/2046-3758.510.BJR-2016-0138.
28. Scaglione M, Fabbri L, Dell’ Omo D, et al. The role of external fixation in the treatment of humeral shaft fractures: a retrospective case study review on 85 humeral fractures. Injury. 2014;46(2):265—269. doi: 10.1016/j.injury.2014.08.045.
29. Леончук Д.С., Сазонова Н.В., Ширяева Е.В., Клю- шин Н.М. Хронический посттравматический остеомиелит плеча: экономические аспекты лечения методом чрескостного остеосинтеза аппаратом Илизарова. Гений ортопедии. 2017;23(1):74—79.
30. de Azevedo MC, de Azevedo GM, Hayashi AY, Dourado Nascimento PE. Treatment of post-traumatic humeral fractures and complications using the Osteoline® external fixator: a treatment option. Rev Bras Ortop. 2011;46(4):390—397.
32. Donders JC, Lorich DG, Helfet DL, Kloen P. Surgical technique: treatment of distal humerus nonunions. HSS J. 2017;13(3):282—291. doi: 10.1007/s11420-017-9551-y.
33. Pichkhadze IM. Atlas of long bones and pelvis fractures. London: Blue Chip Publishing; 2002.
34. Цискарашвили А.В. Лечение больных с переломами длинных костей, осложненных гнойной инфекцией, с учетом биомеханической концепции фиксации отломков: Дис. ... канд. мед. наук. М.; 2009. [Tsiskarashvili AV. Lechenie bol’nykh s perelomami dlinnykh kostei, oslozhnennykh gnoinoi infektsiei, s uchetom biomekhanicheskoi kontseptsii fiksatsii otlomkov. [dissertation] Moscow; 2009. (In Russ).]
35. Цискарашвили А.В., Жадин А.В., Кузьменков К.А., и др. Биомеханически обоснованный чрескостный остеосинтез у пациентов с ложными суставами бедренной кости, осложненные хроническим остеомиелитом. Вестник травматологии и ортопедии им. Н.Н. Приорова. 2018;25(3—4):71—78.
36. Simpson AH, Robiati L, Jalal MM, Tsang ST. Non-union: indications for external fixation. Injury. 2019;50S:73-S78. doi: 10.1016/j.injury.2019.03.053.
37. Чернышов А.А. Лечение переломов дистального отдела плечевой кости методом чрескостного остеосинтеза на основе биомеханической концепции фиксации отломков: Дис. ... канд. мед. наук. М.; 2003. [Chernyshov AA. Lech- enie perelomov distal’nogo otdela plechevoi kosti metodom chreskostnogo osteosinteza na osnove biomekhanicheskoi kontseptsii fiksatsii otlomkov. [dissertation] Moscow; 2003. (In Russ).]
38. Натуветти Р.Р. Экспериментальное обоснование и клиническое применение биомеханической концепции фиксации отломков при переломах проксимального и среднего отделов плечевой кости методом чрескостного остеосинтеза: Дис. ... канд. мед. наук. М.; 2001.
Сведение об авторах:
Арчил Важаевич Цискарашвили — канд. мед. наук, врач — травматолог-ортопед высшей квалификационной категории, заведующий отделением последствий травм опорно-двигательной системы и гнойных осложнений. ФГБУ «НМИЦ ТО им. Н.Н. Приорова» Минздрава России, Москва.
Регина Энверпашаевна Меликова — аспирант отделения последствий травм опорно-двигательной системы и гнойных осложнений. ФГБУ «НМИЦ ТО им. Н.Н. Приорова» Минздрава России, Москва.
Константин Александрович Кузьменков — врач — травматолог-ортопед отделения последствий травм опорно-двигательной системы и гнойных осложнений. ФГБУ «НМИЦ ТО им. Н.Н. Приорова» Минздрава России, Москва.
Теги: плечевая кость
234567 Начало активности (дата): 03.10.2024 17:46:00
234567 Кем создан (ID): 989
234567 Ключевые слова: плечевая кость; ложный сустав; последствия травм; хронический остеомиелит; дефект костной ткани; биомеханическая концепция; чрескостный остеосинтез
12354567899
Похожие статьи
Клиническое наблюдение хирургического лечения рецидивирующего вывиха костей предплечьяРентген на дому 8 495 22 555 6 8
Динамика метаболического состояния костной ткани при комплексном лечении хронического посттравматического остеомиелита длинных костей
Фиксация сухожилий вращательной манжеты при полном лизисе большого бугорка плечевой кости
Повреждения нервов при хирургии плечевого сустава



