 16.08.2024
16.08.2024
Связь белков экзосом с эффективностью терморадиохимиотерапии у больных c избыточной массой тела и раком прямой кишки: пилотное проспективное когортное исследование
Избыточная масса тела и особенно ожирение ассоциированы с риском развития и прогрессией колоректального рака. Можно предположить наличие многоплановых взаимодействий между опухолью и жировой тканью в процессе противоопухолевой терапии.
клеток секретируют малые везикулы (экзосомы) [1, 2]. Присутствие факторов транскрипции, трансляции, фолдинга (например, белков теплового шока (HSPs) и убиквитин-зависимой деградации белков, матриксных металлопротеиназ (MMPs) и их тканевого ингибитора 1-го типа (TIMP1) в составе экзосом, секретируемых как облученными клетками, так и подвергшимися гипертермии, отражает адаптацию клеток к условиям теплового и радиационного стресса [3, 4]. Важность идентификации таких маркеров обусловлена данными о том, что экзосомы вовлечены в реализацию так называемого эффекта свидетеля, когда радиационные повреждения находят в клетках, которые не подвергались облучению [5]. На примерах многих опухолевых клеточных культур показано, что некоторые экзосомальные некодирующие РНК (miR-95-5p, circ-METRN, miR-199-5p, miR-124, miR-506) и белки (Beclin-1, LC3B, HSP70) вовлечены в различные механизмы радиорезистентности и терморадиорезистентности [4, 5]. Однако список экзосомальных и сывороточных маркеров, использующихся в клинической практике или имеющих перспективы клинического применения для оценки радиорезистентности опухоли, весьма ограничен (исследование экспрессии матричной РНК и протеина LRP-1, копийности генов H2AX и RBBp8, циркулирующей ДНК), а предлагаемые методы сложны и маловоспроизводимы [6, 7].
Избыточная масса тела и особенно ожирение - доказанные факторы риска развития колоректального рака. Наличие ожирения, часто в сочетании с другими метаболическими нарушениями (ги- перинсулинемия, гипертриглицеридемия, сахарный диабет 2-го типа), ассоциировано не только с риском, но и с прогрессией опухолей данной локализации [8, 9]. Так как жировая ткань человека состоит из адипоцитов и стромы сложного клеточного состава, эти клетки могут секретировать в межклеточное пространство, а затем и в кровь везикулы различного происхождения. К маркерным мембранным белкам экзосом относят тетраспанины CD63, CD9, CD81 и CD82.
Их экспрессируют мажорные фракции циркулирующих экзосом тромбоцитарного, эритроцитарного, лейкоцитарного и эндотелиального происхождения. Методы проточной цитометрии высокого разрешения, иммунопреципитации в сочетании с вестерн-блоттингом позволяют охарактеризовать не только общую фракцию циркулирующих везикул, но и минорные субпопуляции, включая популяцию везикул адипоцитарного происхождения [10]. В качестве маркеров таких везикул ряд авторов предлагает PPAR-гамма, FABP4 (белок, связывающий жирные кислоты 4), PLIN1 (пери- липин-1), PREF-1 (преадипоцитарный фактор-1) [10-12]. Эти белки не являются строго специфичными для клеток жировой ткани, поскольку их могут синтезировать также некоторые иммунные клетки (в частности, макрофаги). Однако протеин FABP4 - популярный и часто используемый маркер адипоцитарных везикул [10-12].
Цель исследования - проанализировать уровень MMPs, TIMP1 и HSPs на СБ9-позитивных (CD9+) экзосомах и экзосомах адипоцитарного происхождения (FABP4+) у больных с избыточной массой тела / ожирением и раком прямой кишки (РПК) на фоне терморадиохимиотерапии (ТРХТ) во взаимосвязи с ее непосредственной эффективностью.
Материал и методы
На базе Научно-исследовательского института онкологии (НИИ онкологии) - филиала ФГБНУ «Томский национальный исследовательский медицинский центр Российской академии наук» (ТНИМЦ) и ФГБОУ ВО «Сибирский государственный медицинский университет» Минздрава России (СибГМУ) в период с 2021 года по настоящее время проводится пилотное проспективное когортное исследование для изучения возможности использования экспрессии ММPs и HSPs на экзосомах плазмы крови в качестве перспективных предикторов эффективности ТРХТ у больных РПК с избыточной массой тела и ожирением. В исследование включены 20 больных (медиана возраста - 59,0 [52,0; 63,0] лет; 8 мужчин и 12 женщин) с морфологически верифицированным раком средне- и нижнеампулярного отдела прямой кишки, которые до начала лечения имели избыточную массу тела / ожирение (медиана индекса массы тела составила 29,6 [28,5; 33,1]; расчет по формуле Кетле). Диагноз заболевания устанавливали по данным эндоскопического исследования (фиброколоноскопия) с биопсией и последующим морфологическим исследованием материала, магнитно-резонансной томографии (МРТ) таза. Четыре пациента имели стадию заболевания T3-4N0M0, 16 - T3-4N1M0; по степени дифференцировки опухоли было следующее распределение: G1 - 4 пациента, G2 - 9, G3 - 7.
Все пациенты получали дистанционную гамма-терапию на аппарате Theratron Equinox (Best Theratronics Ltd., Канада) с энергией падающего фотона 1,25 МэВ, в стандартном режиме фракционирования (разовая очаговая доза - 2 Гр, 1 фракция/сут, 5 раз/нед, суммарная очаговая доза - 54 Гр). Курс дистанционной лучевой терапии проводили на фоне повышения чувствительности опухолевых тканей к ионизирующему излучению (радиомодификация) капецитабином (825 мг/м2, 2 раза/сут с 12-часовым интервалом) в сочетании с локальной гипертермией (3 раза/нед, за 30 мин. до сеанса лучевой терапии, в диапазоне 42-44 °С в течение 60 мин., всего 10 сеансов) с использованием аппарата Celsius TCS (Celsius42 GmbH, Германия). Эффективность лечения оценивали через 6-10 нед. после завершения ТРХТ с использованием критериев RECIST 1.1 (англ. Response Evaluation Criteria in Solid Tumors - критерии оценки ответа солидных опухолей) и ESGAR (англ. European Society of Gastrointestinal and Abdominal Radiology - Европейское общество желудочно-кишечной и абдоминальной радиологии). В интервале между завершением курса ТРХТ и контрольным обследованием больные получали 3 курса консолидирующей химиотерапии по схеме XELOX (оксалиплатин и капецитабин).
Для оценки объективного ответа на ТРХТ проводили комплексное инструментальное обследование. При эндоскопическом исследовании прямой кишки определяли изменение расстояния дистального полюса опухоли от Z-линии, протяженности опухолевого процесса, объема экзофитного компонента опухоли, степени выраженности лучевой ректопатии. С помощью МРТ оценивали динамику линейных размеров опухоли, объема экзофитного компонента, степени инвазии опухоли в стенку кишки (компонент рТ), вовлеченности в опухолевый процесс смежных с прямой кишкой органов и тканей, размеров и количества измененных лимфатических узлов. Как полный ответ на лечение по данным МРТ трактовали отсутствие измеримых опухолей, наличие фиброза в ложе опухоли без зон средней интенсивности МР-сиг- нала на T2-взвешенных изображениях (mrTRG), без повышения сигнала на диффузионно-взвешенных изображениях (DWI) и без патологического ограничения диффузии на картах измеряемого коэффициента диффузии (ADC). У пациентов с частичным ответом или стабилизацией определялась остаточная опухолевая ткань, участки фиброза и участки с высоким сигналом на DWI, соответствующие зоне низкого сигнала на картах ADC. При полной клинико-морфологической регрессии первичной опухоли пациентам не проводили хирургического лечения и они находились под динамическим наблюдением. При частичной регрессии или стабилизации первичной опухоли операцию выполняли через 6-10 нед. после окончания химиолучевой терапии.
Забор крови для получения экзосом у больных РПК выполняли в четырех точках: точка 1 - до начала лечения, 2 - в середине курса ТРХТ, 3 - через 6-10 нед. после окончания ТРХТ, 4 - через 6 мес. после точки 1. Введение контрольной точки 3 представляется целесообразным, поскольку в этот срок полностью реализуется эффект от проведенного курса ТРХТ и достигаются максимальные показатели непосредственной эффективности лечения. Кроме того, согласно действующим клиническим рекомендациям Минздрава России по РПК, с целью своевременной диагностики прогрессирования заболевания в первые 1-2 года после лечения контрольное обследование следует проводить каждые 3-6 мес1. В нашем исследовании точка 4 укладывалась в рекомендованные сроки обследования, при этом нами было получено подтверждение полной клинико-морфологической регрессии РПК.
Малые ВВ из плазмы крови больных выделяли методом ультрафильтрации с двойным ультрацентрифугированием на ультрацентрифуге Optima MAX-XP (Beckman Coulter, США) [13]. В соответствии с рекомендациями ISEV (англ. International Society for Extracellular Vesicles - Международное общество по изучению внеклеточных везикул) от 2018 г. для подтверждения везикулярной морфологии выполняли трансмиссионную электронную микроскопию на электронном микроскопе JEM-1400 (JEOL Ltd., Япония) [14]. Размер и концентрацию экзосом в препаратах оценивали с использованием трекового анализа (англ. nanoparticle tracking analysis, NTA) на приборе NanoSight 393 NS300 (Malvern, США), а уровень мажорных те- траспанинов CD63, CD81 и CD9 - методом проточной цитометрии. Анализ сочетания экспрессии HSP60, HSP27, HSP90 и MMPs на поверхности экзосом CD9+ и FABP4+ осуществляли на проточном цитофлуориметре высокого разрешения CytoFLEX (Beckman Coulter, США). Аликвоты экзосом (около 30 мкг белка) инкубировали с 3 х 105 анти-СD9 или анти-FABP4 латексными частицами в 150 мкл фосфатно-буферного солевого раствора (PBS) при 4 °C в течение ночи при осторожном перемешивании (400 об/мин) и затем блокировали в 0,2 М глицине в течение 30 мин. После отмывки комплексов PBS для блокирования неспецифического связывания использовали human BD Fc Block (564219, BD, США). Далее в течение 20 мин. при комнатной температуре комплексы окрашивали антителами анти-HSP60-PE (2 мкл на тест, FAA822Hu41, Cloud-Clone Corp., Китай), анти-HSP27-FITC (2 мкл на тест, FAA693Hu81, Cloud-Clone Corp., Китай) и анти-HSP90-APCФ (2 мкл на тест, FAA863Hu51, Cloud-Clone Corp.). Анализ субпопуляций ММР9/ ММР2/TIMP1 на везикулах выполняли аналогично.
Использовали антитела анти-TIMPFAPC (2 мкл на тест, FAA522Hu51, Cloud-Clone Corp., Китай), анти-MMP2-PE (2 мкл на тест, FAA100Hu41, Cloud-Clone Corp., Китай) и анти-MMP9-FITC (2 мкл на тест, FAA553Hu81, Cloud-Clone Corp., Китай). Полученные данные проанализировали с помощью программы CytExpert 2.0 Software. Уровень белка в выделенных везикулах оценивали флуориметрическим методом [15] в собственной модификации. Для определения белка смешивали 10 мкл препаратов везикул с 3 мкл лизис-буфера (0,25 М Tris-HCl, 8% SDS, 0,2 M DTT, pH 6,8) на льду (10 мин.), кипятили при 95 °C в течение 10 мин. После краткого центрифугирования при 12 000 g в течение 10 мин. весь надосадок смешивали с 3 мкл раствора флуорескамина (3 мг/мл, CAS 38183, BLD Pharm, Китай) в диметилсульфоксиде. Измерение проводили на ридере для визуализации клеток Agilent BioTek Cytation 1 Cell Imaging Multimode Reader (Biotek, ОША), длина волны возбуждения 365 нм, длина волны испускания 470 нм. Предварительно строили калибровку с использованием водных стандартов трипсина (кристаллический порошок лиофилизированный, 10 мг фл).
Исследование одобрено этическим комитетом НИИ онкологии Томского НИМЦ (протокол № 5 от 10.02.2019). Информированное согласие получено от всех пациентов, участвовавших в исследовании. В работе соблюдались положения Хельсинкской декларации.
Статистический анализ проводили с использованием программного обеспечения Statistica 10.0 (TIBCO Software Inc., США). Для всех видов анализа статистически значимыми приняли различия при уровне р < 0,05. Для проверки нормальности распределения исследуемых выборок применяли критерий Шапиро - Уилка. Данные представляли в виде медианы и интерквартильного размаха
Результаты
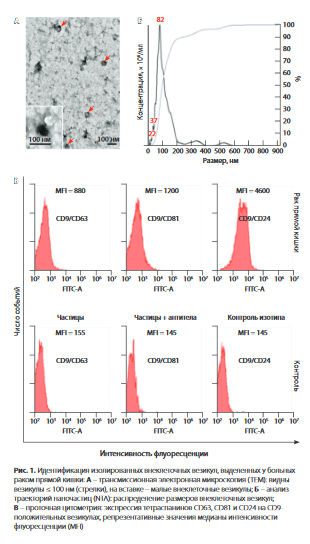
Для характеристики изолированных экзосом использовали трансмиссионную электронную микроскопию, анализ траектории наночастиц (NTA) и проточную цитометрию (рис. 1).
Электронная микроскопия в препаратах везикул, приготовленных из тканей исследуемых больных РПК, позволила выявить четко структурированные чашеобразные объекты с низкой электронной плотностью и сохраненными мембранами (см. рис. 1А), при этом их морфология не отличалась от таковой у экзосом в препаратах от больных другими видами рака [13]. В препаратах практически не было ВВ крупнее 100 нм (см. рис. 1 Б); везикулы экспрессировали мажорные тетраспанины и CD24 (см. рис. 1 В).
Уровни субпопуляций экзосом CD9+ и FABP4+ у пациентов с РПК с избыточной массой тела и ожирением в динамике проведения ТРХТ отражены в таблице. В основном изменения субпопуляций везикул имели волнообразный характер, однако для части популяций (CD9+MMP9+ и HSP60+27+90-) выявлено четкое снижение показателей при проведении ТРХТ. У 13 из 20 больных зарегистрирована полная регрессия, у 7 - частичная регрессия или стабилизация процесса.
При проведении дискриминантного анализа выявлены 4 популяции экзосом (как CD9+, так и FABP4+), ассоциированные с непосредственной эффективностью ТРХТ у больных РПК (рис. 2). Интересно отметить, что экспрессия HSPs на эк- зосомах не ассоциировалась с непосредственной эффективностью ТРХТ.
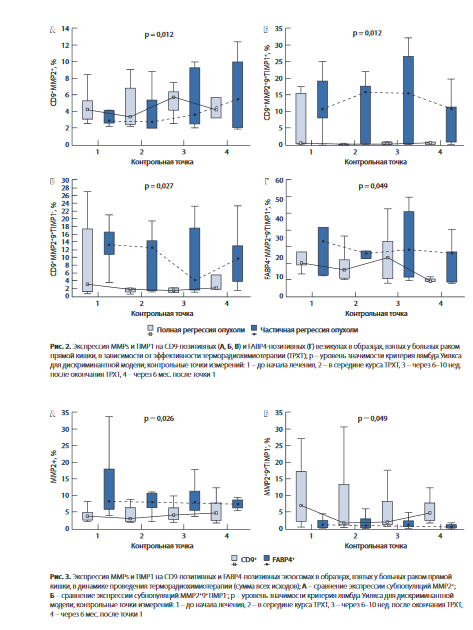
Далее мы провели сравнение экспрессии MMPs, TIMP1 и HSPs на ВВ на этапах ТРХТ отдельно на CD9+ и FABP4+ везикулах без разделения на группы больных с различным непосредственным эффектом терапии (рис. 3). Адипоцитарные везикулы (FABP4+), детектируемые с помощью проточной цитометрии с использованием метода непрямой детекции с сорбцией на латексных частицах, у больных РПК на этапах ТРХТ экспрессируют статистически значимо больше MMP2 по сравнению с CD9+ везикулами (см. рис. 3А), однако среди адипоцитарных везикул практически не было частиц с сочетанной экспрессией желатиназ MMP2 и MMP9 (см. рис. 3Б).
Обсуждение
И радиация, и гипертермия, будучи методами локального воздействия на опухоль, приводят к гиперпродукции экзосом с измененным составом. Определенная противоопухолевая активность малых ВВ (экзосом), происходящих от опухолевых и неопухолевых клеток, подвергшихся гипертермии или гипертермии в сочетании с химиотерапией, показана во многих исследованиях [16-18].
Механизмы такой активности изучены достаточно плохо, однако есть данные, что они ассоциированы с проявляющимся в этих условиях свойством экзосом накапливать и транспортировать до опухолевых клеток комплекс хемокинов, HSPs, ми- кроРНК, которые в свою очередь способствуют апоптозу, индуцируют перераспределение фракций лимфоцитов и пр. [16-18]. Мембрана ВВ наряду с тетраспанинами и интегринами содержит комплекс протеаз: ADAM-протеазы, MMPs. Гиперэкспрессия желатиназ MMP2/MMP9 после инкубации опухолевых клеток-реципиентов с везикулами / экзосомами от облученных кле- ток-доноров рассматривается в качестве одного из основных механизмов эффекта свидетеля [3, 19]. Проангиогенные белки семейства MMPs, которые экспрессируются на адипоцитарных везикулах, с одной стороны, могут отражать активацию ангиогенеза в опухоли, а с другой - участвуют в ремоделировании стромы опухоли и способствуют опухолевой прогрессии. Гиперэкспрессия TIMP1, ингибитора MMPs, характерна для адипоцитов. Как растворимый белок, секретируемый во внеклеточную среду, TIMP1 обнаруживается в большинстве тканей и жидкостей организма. CD63 также был идентифицирован как рецептор TIMP1 вместе с fH-интегрином, который формирует супрамолекулярный комплекс, расположенный на поверхности эпителиальных клеток молочной железы человека [20].
Источником везикул CD9+, как полагает большинство исследователей, являются практически все клетки организма, поскольку CD9 - универсальный маркер ВВ (наряду с CD63, CD81), тогда как адипоцитарные везикулы представлены преимущественно FABP4+. Везикулы, продуцируемые облученными клетками опухоли и параректальной клетчаткой, поглощаются опухолью непосредственно или поступают в кровь и поглощаются адипоцитами и адипоцитарными макрофагами дистанционно. Это, в свою очередь, может вести к измененной секреции FABP4+ (адипоцитарных) везикул, которые также могут интернализироваться опухолью и приводить к ее регрессии [21] (рис. 4).

Доказательства этой гипотезы представлены на уровне in vitro и in vivo моделей и их сочетания [22-24], однако на клиническом материале эти механизмы не изучены, что послужило одной из задач настоящего исследования.
Несмотря на данные литературы о вовлеченности гормонов жировой ткани, адипоцитарных везикул, микроРНК ади- поцитарного происхождения в прогрессию опухолей у человека при ожирении [25], невозможно предсказать, какие именно популяции циркулирующих экзосом будут ассоциированы с непосредственной эффективностью ТРХТ у больных РПК. Полученные нами результаты свидетельствуют о четкой взаимосвязи динамики отдельных субпопуляций экзосом, как CD9+, так и FABP4+, с непосредственной эффективностью ТРХТ у больных РПК с избыточной массой тела и ожирением. В перспективе необходимо построение прогностических моделей для этой группы больных с учетом данных по везикулярным маркерам. Возможно, везикулярные предикторы были бы полезны для выявления группы больных РПК с неблагоприятным общим прогнозом. В целом это позволило бы персонализировать подходы к лечению и динамическому наблюдению больных с местнораспространенным средне- и нижнеампулярным РПК.
Ограничения исследования
К ограничениям данного исследования следует отнести небольшой объем выборки, что обусловлено тщательным подбором больных и изучением показателей на экзосомах в динамике ТРХТ. Еще одно ограничение исследования: при построении дискриминантных моделей количественные переменные, характеризующие популяции везикул в разных контрольных точках, включались как независимые переменные. Таким образом, в настоящее время проведенный анализ не учитывает возможное влияние индивидуальной динамики экспрессии белков у пациентов.
Заключение
Одним из подходов к решению проблемы повышения эффективности терморадиотерапии / ТРХТ в комплексной терапии злокачественных новообразований может быть поиск молекулярных маркеров, ассоциированных с ее непосредственной эффективностью. В отобранной группе больных РПК с избыточной массой тела и ожирением нами выявлены 4 субпопуляции CD9+ и FABP4+ экзосом, ассоциированных с эффективностью ТРХТ.
Адипоцитарные везикулы на фоне ТРХТ экспрессируют статистически значимо больше MMP2 по сравнению с везикулами CD9+. При этом среди адипоцитарных везикул практически нет экзосом с сочетанной экспрессией желатиназ MMP2 и MMP9. Экспрессия HSPs на циркулирующих экзосомах на этапах ТРХТ не ассоциировалась с непосредственной эффективностью лечения и с типом везикул. В перспективе необходимо построение прогностических моделей для группы больных РПК с ожирением с учетом данных по везикулярным маркерам. Ф
Jabbari N, Nawaz M, Rezaie J. Ionizing radiation increases the activity of exosomal secretory pathway in MCF-7 human breast cancer cells: A possible way to communicate resistance against radiotherapy. Int J Mol Sci. 2019;20(15):3649.
Mutschelknaus L, Azimzadeh O, Heider T, Winkler K, Vetter M, Kell R, Tapio S, Merl-Pham J, Huber SM, Edalat L, Radulovic V, Anastasov N, Atkinson MJ, Moertl S. Radiation alters the cargo of exosomes released from squamous head and neck cancer cells to promote migration of recipient cells. Sci Rep. 2017;7(1):12423. doi: 10.1038/ s41598-017-12403-6.
Назарова ИВ, Забегина ЛМ, Никифорова НС, Слюсаренко МА, Сидина ЕИ, Жахов АВ, Ищенко АМ, Маргулис БА, Гужова ИВ, Малек АВ. Тепловой стресс стимулирует секрецию клетками колоректальной карциномы специфической популяции нановезикул с повышенным содержанием БТШ70 и измененным составом микроРНК. Сибирский онкологический журнал. 2022;21(1):57-71. doi: 10.21294/1814-4861-2022-21-1-57-71. Nazarova IV, Zabegina LM, Nikiforova
NS, Slusa- renko MA, Sidina EI, Zhakhov AV, Ishchenko AM, Margulis BA, Guzhova IV, Malek AV. [Heat stress stimulates colon cancer cells to secret specific population of extracellular nanovesicles
enriched by HSP70 and microRNAs]. Siberian Journal of Oncology. 2022;21(1):57-71. Russian. doi: 10.21294/1814-4861-2022-21-1-57-71.
Yang Z, Zhong W, Yang L, Wen P, Luo Y, Wu C. The emerging role of exosomes in radiotherapy. Cell Commun Signal. 2022;20(1):171.
Кутилин ДС, Гусарева МА, Кошелева НГ. Уровень копийности генетических локусов и малоинвазивная оценка эффективности лучевой терапии у больных раком прямой кишки. Российский биотерапевтический журнал. 2022;21(4):41-49. doi: 10.17650/1726- 9784-2022-21-4-41-49.
Kutilin DS, Gusareva MA, Kosheleva NG. [Genetic locus copy number variation level and minimally invasive assessment of radiation therapy efficiency in rectal cancer patients]. Rossijskij Bioterapevticeskij Zurnal. 2022;21(4):41-49. Russian. doi: 10.17650/1726-9784-2022-21-4- 41-49.
Chaudhuri AA, Binkley MS, Osmundson EC, Alizadeh AA, Diehn M. Predicting radiotherapy responses and treatment outcomes through analysis of circulating tumor DNA. Semin Radiat Oncol. 2015;(4):305-12.
Yunusova NV, Kondakova IV, Kolomiets LA, Afanas'ev SG, Kishkina AYu, Spirina LV. The role of metabolic syndrome variant in the malignant tumors progression. Diabetes Me- tab Syndr. 2018;12(5):807-812. doi: 10.1016/j. dsx.2018.04.028.
Choi Y, Lee YH, Park SK, Cho H, Ahn KJ. Association between obesity and local control of advanced rectal cancer after combined
surgery and radiotherapy. Radiat Oncol J. 2016;34(2):113-20. doi: 10.3857/roj.2016.01725.
Connolly KD, Wadey RM, Mathew D, Johnson E, Rees DA, James PE. Evidence for adipocyte-derived extracellular vesicles in the human circulation. Endocrinology. 2018;159(9):3259-3267. doi: 10.1210/en.2018-00266.
Kralisch S, Ebert T, Lossner U, Jessnitzer B, Stumvoll M, Fasshauer M. Adipocyte fatty acid-binding protein is released from adipocytes by a non-conventional mechanism. Int J Obes (Lond). 2014;38(9):1251-4. doi: 10.1038/ ijo.2013.232.
Hubal MJ, Nadler EP, Ferrante SC, Barberio MD, Suh JH, Wang J, Dohm GL, Pories WJ, Mi- etus-Snyder M, Freishtat RJ. Circulating adipocyte-derived exosomal MicroRNAs associated with decreased insulin resistance after gastric bypass.
Obesity (Silver Spring). 2017;25(1):102- 110. doi: 10.1002/oby.21709.
Тамкович СН, Юнусова НВ, Стахеева МН, Сомов АК, Фролова АЕ, Кирюшина НА, Афанасьев СГ, Григорьева АE, Лактионов ПП, Кондакова ИВ. Выделение и характеризация экзосом плазмы крови больных раком молочной железы и колоректальным раком. Биомедицинская химия. 2017;63(2):165-169. doi: 10.18097/PBMC20176302165.
Tamkovich SN, Yunusova NV, Stakheeva MN, Somov AK, Frolova AE, Kiryushina NA, Afanasyev SG, Grigor'eva AE, Laktionov PP, Kondakova IV. Isolation and characterization of exosomes from blood plasma of breast cancer and colorectal cancer patients. Biochem Mosc Suppl B Biomed Chem. 2017;11:291-295. doi: 10.1134/ S1990750817030106.
Thery C, Witwer KW, Aikawa E, Alcaraz MJ, Anderson JD, Andriantsitohaina R, Antoniou A, Arab T, Archer F, Atkin-Smith GK, Ayre DC, Bach JM, Bachurski D, Baharvand H, Balaj L, Baldacchino S, Bauer NN, Baxter AA, Bebawy M, Beckham C,
Bedina Zavec A, Benmoussa A, Berardi AC, Bergese P, Bielska E, Blenkiron C, Bobis-Wozowicz S, Boilard E, Boireau W, Bon- giovanni A, Borras FE, Bosch S, Boulanger CM, Breakefield X, Breglio AM, Brennan MA, Brig- stock DR, Brisson A, Broekman ML, Bromberg JF, Bryl-Gorecka P, Buch S, Buck AH, Burger D, Bu- satto S, Buschmann D, Bussolati B, Buzas EI, Byrd JB, Camussi G, Carter DR, Caruso S, Cham- ley LW, Chang YT, Chen C, Chen S, Cheng L, Chin AR, Clayton A, Clerici SP, Cocks A, Cocuc- ci E, Coffey RJ, Cordeiro-da-Silva A, Couch Y, Coumans FA, Coyle B, Crescitelli R, Criado MF, D'Souza-Schorey C, Das S, Datta Chaudhu- ri A, de Candia P, De Santana EF, De Wever O, Del Portillo HA, Demaret T, Deville S, Devitt A, Dhondt B, Di Vizio D, Dieterich LC, Dolo V, Dominguez Rubio AP, Dominici M, Doura- do MR, Driedonks TA, Duarte FV, Duncan HM, Eichenberger RM, Ekstrom K, El Andaloussi S, Elie-Caille C, Erdbrugger U, Falcon-Perez JM, Fatima F, Fish JE, Flores-Bellver M, Forsonits A, Frelet-Barrand A, Fricke F, Fuhrmann G, Gabri- elsson S, Gamez-Valero A, Gardiner C, Gartner K, Gaudin R, Gho YS, Giebel B, Gilbert C, GimonaM, Giusti I, Goberdhan DC, Gorgens A, Gorski SM, Greening DW, Gross JC, Gualer- zi A, Gupta GN, Gustafson D, Handberg A, Haraszti RA, Harrison P, Hegyesi H, Hendrix A, Hill AF, Hochberg FH, Hoffmann KF, Holder B, HolthoferH, Hosseinkhani B, Hu G, Huang Y, Huber V, Hunt S, Ibrahim AG, Ikezu T, Inal JM, Isin M, Ivanova A, Jackson HK, Jacobsen S, Jay SM, Jay- achandran M, Jenster G, Jiang L, Johnson SM, Jones JC, Jong A, Jovanovic-Talisman T, Jung S, Kalluri R, Kano SI, Kaur S, Kawamura Y, Keller ET, Khamari D, Khomyakova E, Khvorova A, Kierulf P, Kim KP, Kislinger T, Klingeborn M, Klinke DJ 2nd, Kornek M, Kosanovic MM, Kovacs AF, Kramer-Al- bers EM, Krasemann S, Krause M, Kurochkin IV, Kusuma GD, Kuypers S, Laitinen S, Langevin SM, Languino LR, Lannigan J, Lasser C, Laurent LC, Lavieu G, Lazaro-Ibanez E, Le Lay S, Lee MS, Lee YXF, Lemos DS, Lenassi M, Leszczynska A, Li IT, Liao K, Libregts SF, Ligeti E, Lim R, Lim SK, Line A, Linnemannstons K, Llorente A, Lombard CA, Lorenowicz MJ, Lorincz AM, Lotvall J, Lovett J, Lowry MC, Loyer X, Lu Q, Lukoms- ka B, Lunavat TR, Maas SL, Malhi H, Marcilla A, Mariani J, Mariscal J, Martens-Uzunova ES, Martin-Jaular L, Martinez MC, Martins VR, Mathieu M, Mathivanan S, Maugeri M, McGinnis LK, McVey MJ, Meckes DG Jr, Meehan KL, Mertens I, Minciacchi VR, Moller A, Moller Jorgensen M, Morales-Kastresana A, Morhayim J, Mullier F, Muraca M, Musante L, Mussack V, Muth DC, Myburgh KH, Najrana T, Nawaz M, Nazarenko I, Nejsum P, Neri C, Neri T, Nieuw- land R, Nimrichter L, Nolan JP, Nolte-'t Hoen EN, Noren Hooten N, O'Driscoll L, O'Grady T, O'Logh- len A, Ochiya T, Olivier M, Ortiz A, Ortiz LA, Os- teikoetxea X, 0stergaard O, Ostrowski M, Park J, Pegtel DM, Peinado H, Perut F, Pfaffl MW, Phin- ney DG, Pieters BC, Pink RC, Pisetsky DS, Pogge von Strandmann E, Polakovicova I, Poon IK, Powell BH, Prada I, Pulliam L, Quesenberry P, Radeghieri A, Raffai RL, Raimondo S, Rak J, Ramirez MI, Raposo G, Rayyan MS, Regev-Rudz- ki N, Ricklefs FL, Robbins PD, Roberts DD, Rodrigues SC, Rohde E, Rome S, Rouschop KM, Rughetti A, Russell AE, Saa P, Sahoo S, Salas- Huenuleo E, Sanchez C, Saugstad JA, Saul MJ, Schiffelers RM, Schneider R, Schoyen TH, Scott A, Shahaj E, Sharma S, Shatnyeva O, Shekari F, Shelke GV, Shetty AK, Shiba K, Sil- jander PR, Silva AM, Skowronek A, Snyder OL 2nd, Soares RP, Sodar BW, Soekmadji C, Sotillo J, Stahl PD, Stoorvogel W, Stott SL, Strasser EF, Swift S, Tahara H, Tewari M, Timms K, Tiwari S, Tixeira R, Tkach M, Toh WS, Tomasini R, Torrecil- has AC, Tosar JP, Toxavidis V, Urbanelli L, Vader P, van Balkom BW, van der Grein SG, Van Deun J, van Herwijnen MJ, Van Keuren-Jensen K, van Niel G, van Royen ME, van Wijnen AJ, Vascon- celos MH, Vechetti IJ Jr, Veit TD, Vella LJ, Velot Ё, Verweij FJ, Vestad B, Vinas JL, Visnovitz T, Vuk- man KV, WahlgrenJ, Watson DC, Wauben MH, Weaver A, Webber JP, Weber V, Wehman AM, Weiss DJ, Welsh JA, Wendt S, Wheelock AM, Wiener Z, Witte L, Wolfram J, Xagorari A, Xander P, Xu J, Yan X, Yanez-Mo M, Yin H, Yuana Y, Zap- pulli V, Zarubova J, Zekas V, Zhang JY, Zhao Z, Zheng L, Zheutlin AR, Zickler AM, Zimmer- mann P, Zivkovic AM, Zocco D, Zuba-Surma EK. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. J Extracell Vesicles. 2018;7(1):1535750. doi: 10.1080/20013078.2018.1535750.
Jones LJ, Haugland RP, Singer VL. Development and characterization of the NanoOrange protein quantitation assay: A fluorescence-based assay of proteins in solution. Biotechniques. 2003;34(4):850-4, 856, 858 passim. doi: 10.2144/03344pt03.
Yang Y, Chen Y, Zhang F, Zhao Q, Zhong H. Increased anti-tumour activity by exosomes derived from doxorubicin-treated tumour cells via heat stress. Int J Hyperthermia. 2015;31(5):498- 506. doi: 10.3109/02656736.2015.1036384.
Chen T, Guo J, Yang M, Zhu X, Cao X. Chemo- kine-containing exosomes are released from heat-stressed tumor cells via lipid raft-dependent pathway and act as efficient tumor vaccine. J Immunol. 2011;186(4):2219-28. doi: 10.4049/jimmunol.1002991.
Altanerova U, Babincova M, Babinec P, Benejo- va K, Jakubechova J, Altanerova V, Zduriencikova M, Repiska V, Altaner C. Human mesenchymal stem cell-derived iron oxide exosomes allow targeted ablation of tumor cells via magnetic hyperthermia. Int J Nanomedicine. 2017;12:7923- 7936. doi: 10.2147/IJN.S145096.
Buzas EI, Toth EA, Sodar BW, Szabo-Taylor №. Molecular interactions at the surface of extracellular vesicles. Semin Immunopathol. 2018;40(5):453-464. doi: 10.1007/s00281-018- 0682-0.
Justo BL, Jasiulionis MG. Characteristics of TIMP1, CD63, and p1-integrin and the functional impact of their interaction in cancer. Int J Mol Sci. 2021;22(17):9319. doi: 10.3390/ ijms22179319.
Юнусова НВ, Дандарова ЕЭ, Сваровский ДА, Денисов НС, Костромицкий ДН, Патышева МР, Черемисина ОВ, Спирина ЛВ. Продукция и интернализация внеклеточных везикул в норме и в условиях гипергликемии и инсулинорезистентности. Биомедицинская химия. 2021;67(6):465-474. doi: 10.18097/ PBMC20216706465.
Yunusova NV, Dandarova EE, Svarovsky DA, Denisov NS, Kostromitsky DN, Patysheva MR, Cheremisina OV, Spirina LV. Production and internalization of extracellular vesicles in norm and under conditions of hyperglycemia and insulin resistance. Biochem Mosc Suppl B Biomed Chem. 2022;16:104-112. doi: 10.1134/ S199075082202010X.
Lou G, Song X, Yang F, Wu S, Wang J, Chen Z, Liu Y. Exosomes derived from miR-122-modified adipose tissue-derived MSCs increase chemo- sensitivity of hepatocellular carcinoma. J Hema- tol Oncol. 2015;8:122. doi: 10.1186/s13045-015- 0220-7.
Yin H, Qiu X, Shan Y, You B, Xie L, Zhang P, Zhao J, You Y. HIF-1a downregulation of miR-433-3p in adipocyte-derived exosomes contributes to NPC progression via targeting SCD1. Cancer Sci. 2021;112(4):1457-1470. doi: 10.1111/cas.14829.
Fan X, Wang J, Qin T, Zhang Y, Liu W, Jiang K, Huang D. Exosome miR-27a-3p secreted from adipocytes targets ICOS to promote antitumor immunity in lung adenocarcinoma. Thorac Cancer. 2020;11(6):1453-1464. doi: 10.1111/1759- 7714.13411.
Юнусова НВ, Сваровский ДА, Коновалов АИ, Сиденко ЕА, Старцева ЖА. Молекулярные механизмы противоопухолевого эффею^ терморадиотерапии у больных злокачественными новообразованиями с метаболическими нарушениями. Вопросы онкологии. 2023;69(3):373-382. doi: 10.37469/0507-3758- 2023-69-3-373-382.
Авторы:
Юнусова Наталья Валерьевна - д-р мед. наук, профессор кафедры биохимии и молекулярной биологии с курсом клинической лабораторной диагностики, ФГБОУ ВО «Сибирский государственный медицинский университет» Минздрава России; 634050, г. Томск, Московский тракт, 2, Российская Федерация
Коновалов Артем Игоревич - канд. мед. наук, ассистент кафедры хирургии с курсом мобилизационной подготовки и медицины катастроф, ФГБОУ ВО «Сибирский государственный медицинский университет» Минздрава России; 634050, г. Томск, Московский тракт, 2, Российская Федерация
Кондакова Ирина Викторовна - д-р мед. наук, профессор, зав. лабораторией биохимии опухолей, Научно-исследовательский институт онкологии - филиал ФГБНУ «Томский национальный исследовательский медицинский центр Российской академии наук»; 634009, г. Томск, Кооперативный пер., 5, Российская Федерация
Усова Анна Владимировна - канд. мед. наук, ст. науч. сотр. отделения лучевой диагностик, Научно-исследовательский институт онкологии - филиал ФГБНУ «Томский национальный исследовательский медицинский центр Российской академии наук»; 634009, г. Томск, Кооперативный пер., 5, Российская Федерация
Фролова Ирина Георгиевна - д-р мед. наук, профессор, зав. отделением лучевой диагностики, Научно-исследовательский институт онкологии - филиал ФГБНУ «Томский национальный исследовательский медицинский центр Российской академии наук»; 634009, г. Томск, Кооперативный пер., 5, Российская Федерация
Сиденко Евгения Александровна - канд. мед. наук, мл. науч. сотр. лаборатории биохимии опухоле, Научно-исследовательский институт онкологии - филиал ФГБНУ «Томский национальный исследовательский медицинский центр Российской академии наук»; 634009, г. Томск, Кооперативный пер., 5, Российская Федерация
Какурина Гелена Валерьевна - канд. мед. наук, ст. науч. сотр. лаборатории биохимии опухолей, Научно-исследовательский институт онкологии - филиал ФГБНУ «Томский национальный исследовательский медицинский центр Российской академии наук»; 634009, г. Томск, Кооперативный пер., 5, Российская Федерация
Гердт Любовь Викторовна - канд. мед. наук, врач клинической лабораторной диагностики лаборатории молекулярной онкологии и иммунологии, Научно-исследовательский институт онкологии - филиал ФГБНУ «Томский национальный исследовательский медицинский центр Российской академии наук»; 634009, г. Томск, Кооперативный пер., 5, Российская Федерация
Старцева Жанна Александровна - д-р мед. наук, зав. отделением радиотерапии, Научно-исследовательский институт онкологии - филиал ФГБНУ «Томский национальный исследовательский медицинский центр Российской академии наук»; 634009, г. Томск, Кооперативный пер., 5, Российская Федерация
Теги: рак прямой кишки
234567 Начало активности (дата): 16.08.2024 18:51:00
234567 Кем создан (ID): 989
234567 Ключевые слова: экзосомы опухолевых клеток, адипоцитарные внеклеточные везикулы, ожирение и избыточная масса тела, рак прямой кишки (РПК), терморадиохимиотерапия, ответ опухоли, предикторы эффективности терапии
12354567899
Похожие статьи
Клинический случай хордомы крестца и копчика, имеющей массивный внутритазовый компонент (хирургическое лечение с кратким обзором литературы)Факторы, приводящие к повторному хирургическому вмешательству при метастатическом поражении длинных костей
Рентген на дому 8 495 22 555 6 8
Радиационная гигиена. Л. А. Ильин, В. Ф. Кириллов, И. П. Коренков. Глава 3
Опухоли невыявленной первичной локализации



