 30.03.2023
30.03.2023
Радиационная гигиена. Л. А. Ильин, В. Ф. Кириллов, И. П. Коренков. Глава 3
Процессы взаимодействия ионизирующих излучений с веществом клетки, в результате чего образуются ионизированные и возбужденные атомы и молекулы, являются первым этапом развития лучевого поражения.
ГЛАВА 3 ОСНОВЫ БИОЛОГИЧЕСКОГО ДЕЙСТВИЯ ИОНИЗИРУЮЩИХ ИЗЛУЧЕНИЙ
Ионизирующее излучение - одно из уникальных явлений окружающей среды, последствия от воздействия которого на организм, на первый взгляд, совершенно неэквивалентны величине поглощаемой энергии. Действительно, летальная доза для млекопитающих составляет 10 Гр (1000 рад), поглощаемая же при этом тканями и органами животных энергия могла бы повысить их температуру всего на тысячные доли градуса. Ясно, что само по себе такое повышение температуры не могло бы вызвать столь выраженного эффекта поражения; в то же время непосредственные прямые нарушения в химических связях биомолекул в клетках и тканях, возникающие вслед за облучением, ничтожны.
Вместе с тем известно, что ни один из субстратов клетки in vitro не является столь радиочувствительным, как вся клетка in vivo. В связи с указанными обстоятельствами в настоящее время выдвигается гипотеза о возможности существования цепных автокаталитических реакций, усиливающих первичное действие, или о наличии в клетках систем положительных обратных связей, которые после возникновения поддерживаются независимо от существования породившей их причины.
Процессы взаимодействия ионизирующих излучений с веществом клетки, в результате чего образуются ионизированные и возбужденные атомы и молекулы, являются первым этапом развития лучевого поражения. Ионизированные и возбужденные атомы и молекулы в течение 10-6 с взаимодействуют между собой и с различными молекулярными системами, давая начало химически активным центрам (свободные радикалы, ионы, ион-радикалы и др.). В этот же период возможно образование разрывов связей в молекулах за счет как непосредственного взаимодействия с ионизирующим агентом, так и внутри- и межмолекулярной передачи энергии возбуждения.
В дальнейшем развиваются реакции химически активных веществ с различными биологическими структурами, при которых отмечаются как деструкция, так и образование новых, несвойственных облучаемому организму соединений.
Последующие этапы развития лучевого поражения проявляются в нарушении обмена веществ в биологических системах с изменением соответствующих функций. У высших организмов это протекает на фоне нейрогуморальной реакции на развитие нарушения.
Явления, происходящие на начальных, физико-химических этапах лучевого воздействия, принято называть первичными, или пусковыми, поскольку именно они определяют весь дальнейший ход развития лучевых поражений.
3.1. Первичные процессы при действии ионизирующих излучений
При облучении биологических объектов, содержащих воду, находящуюся частично в свободном состоянии, а частично входящую в состав органелл соответствующих биосистем, принято считать, что 50% поглощенной дозы в «средней» клетке приходится на воду, другие 50% - на ее органеллы и растворенные вещества. В соответствии с локализацией поглощенной энергии (в воде или в основном веществе) можно говорить о непрямом и прямом действии ионизирующего излучения.
При взаимодействии ионизирующего излучения с водой происходит выбивание электронов из молекул воды с образованием так называемых молекулярных ионов, несущих положительный и отрицательный заряды.
Схематически этот процесс можно представить следующим образом:
Н2О - Н2О+ + е1, Н2О + е-1 - Н2О- .
Возникающие ионы воды, в свою очередь, распадаются с образованием ряда радикалов, которые взаимодействуют между собой:
Н2О+ - Н+ + ОН,
Н2О- - Н + ОН-,
Н + ОН - Н2О,
ОН + ОН - Н2О2, Н2О2 + ОН - Н2О + НО2.
Считается, что основной эффект лучевого воздействия обусловлен такими радикалами, как Н, ОН и особенно НО2 (гидропероксид). Последний радикал, обладающий высокой окислительной способностью, образуется при облучении воды в присутствии кислорода: Н + О2 = НО2. Выход этого радикала уменьшается пропорционально падению парциального давления кислорода. Этим объясняется кислородный эффект при облучении, проявляющийся в том, что при снижении концентрации кислорода в период облучения уменьшается эффект лучевого воздействия. Кислородный эффект отсутствует при облучении биообъектов излучением с высоким значением ЛПЭ (например, нейтронами). Это явление объясняется тем обстоятельством, что при взаимодействии частиц с веществом создается высокая удельная концентрация радикалов ОН, при которой протекают следующие реакции:
ОН + ОН - Н2О2, Н2О2 + ОН - Н2О + НО2, Н2О2 + О2Н - Н2О + ОН + О2, Н + О2 - НО2, НО2 + ОН - Н2О + О2.
Таким образом, в этом случае кислород, необходимый для возникновения радикала НО2, продуцируется непосредственно в зоне поглощения энергии, поэтому количество возникающих в данном случае окислительных радикалов не зависит от степени насыщенности растворов кислородом.
Возникшие в результате взаимодействия излучений с водой радикалы взаимодействуют с растворенными молекулами различных соединений, давая начало вторично-радикальным продуктам. Время жизни этих продуктов значительно больше по сравнению со сроком жизни первичных радикалов, поэтому для них возможно проявление большей избирательности действия.
Пути размена энергии при действии ионизирующих излучений могут быть представлены на первом этапе возникновением ионизированных и возбужденных молекул:
А - А+ + е-1; А - А*.
Важнейшими процессами, ведущими к химическим преобразованиям (а следовательно, к поражению) биомолекул, являются диссоциации А* на соответствующие молекулярные продукты, взаимодействующие с сенсибилизатором (например, О2).
Кроме указанных механизмов размена энергии, возможны процесс переноса энергии возбуждения путем реабсорбции (пере- поглощения активатором света люминесценции растворителя), образование комплексов молекул растворителя и активатора с передачей энергии внутри этого комплекса, передачей энергии при столкновении (диффузионный механизм) и др. Конкурировать с перечисленными процессами поражения могут эффекты восста- новления, к которым относятся люминесценция и преобразование энергии возбуждения в тепло.
Следует подчеркнуть, что в результате прямого и непрямого действия ионизирующих излучений на биосубстрат возникают идентичные вторичные радикалы, которые могут служить объяснением определенной специфичности радиационно-химических превращений.
Дальнейшие этапы развития радиационного поражения молекулярных структур и наиболее радиочувствительных надмолекулярных образований сводятся к изменениям белков, липидов и углеводов. Так, например, облучение белковых растворов приводит к конфигурационным изменениям белковой структуры, агрегации молекул за счет образования дисульфидных связей, деструкции, связанной с разрывом пептидных или углеводных связей. Все эти процессы наблюдаются при поглощении достаточно высоких доз - порядка сотен тысяч рад и более. При облучении целостного организма в первую очередь изменяется содержание свободных аминокислот в тканях.
При общем облучении экспериментальных животных дозой 5 Гр понижается уровень метионина (важнейшего донора метальных групп) на 75%, триптофана на 26%, что оказывает большое влияние на белковый обмен, поскольку недостаток хотя бы одной аминокислоты приводит к резкому замедлению биосинтеза белков. Отмечаемое уменьшение содержания сульфгидрильных групп в тканях облученных животных относится к наиболее ранним радиационным изменениям. В дальнейшем оно прогрессирует и достигает более 50% исходного уровня на 5-е сутки при облучении дозой 6 Гр. Считается, что начальная инактивация сульфгидрильных групп вызывается короткоживущими радикалами, а в дальнейшем она происходит за счет действия стойких перекисей.
Различные ферментные системы реагируют на облучение неодинаково. Активность одних ферментов после облучения возрастает, других понижается, третьих остается неизменной. Важно отметить, что при облучении организма происходят повреждение систем синтеза нуклеиновых кислот и стимуляция ферментных систем, деполяризующих эти макромолекулы.
К числу наиболее радиочувствительных процессов в клетке относится окислительное фосфорилирование. Нарушение этого процесса отмечается уже через несколько десятков минут после облучения дозой 1 Гр. Оно проявляется в повреждении системы генерирования аденозинтрифосфата, без которого не обходится ни один процесс жизнедеятельности.
Высокой чувствительностью обладают дезоксирибонуклеиновые комплексы (ДНК клеточного ядра в комплексе с щелочными белками, РНК и ферментами). Уже через несколько минут после облучения происходят высвобождение нуклеиновой кислоты из дезоксинуклеопротеида и одновременное накопление нуклеиновых кислот в цитоплазме облученных клеток. Предполагается, что в этом случае в первую очередь поражаются связи белок-белок и белок-ДНК.
Облучение простых сахаров значительными дозами приводит к их окислению и распаду, в результате чего образуются органические кислоты и формальдегид. Облучение растворов полисахаридов (на- пример, крахмала) сопровождается значительным понижением их вязкости, появлением простых сахаров (глюкозы, мальтозы) и др.
При дозах 5-10 Гр выявлены изменения в мукополисахаридах. Так, понижается вязкость гиалуроновой кислоты, теряется ее способность к соединению с белком. Облучение другого мукополисахарида - гепарина - приводит к его деполяризации, сопровождающейся потерей антикоагулянтных свойств. При облучении целостного организма содержание гликогена снижается в скелетных мышцах, печени и ряде других тканей, как предполагают, в результате нейрогуморальной реакции на облучение. Кроме того, нарушаются процессы распада глюкозы и в первую очередь анаэробного гликолиза. Отмечаются изменения и в обмене высокополимерных полисахаридов - гиалуроновой кислоты и гепарина.
При действии ионизирующих излучений на липиды образуются перекиси, которым придают особо важное значение в развитии лучевого поражения. Схема реакций в этом случае может быть представлена так:
При облучении организма снижаются содержание липидов и их перераспределение в различных тканях с повышением их уровня в печени и крови, что, по-видимому, связано с изменениями углеводного обмена. Наряду с некоторой стимуляцией синтеза липидов происходит также повышенная их окисляемость, в результате которой возникают перекиси.
При этом образование перекисей обусловлено не столько прямым действием радиации, сколько результатом угнетения ряда антиоксидантов. Необходимо также отметить, что в результате действия радиации обнаруживаются изменения в липопротеинах во внутриклеточных структурах, в частности в митохондриях и микросомах.
Перечисленные выше некоторые поражения молекулярных структур, возникающие в результате облучения, далеко не исчер- пывают все сведения, которые накоплены к настоящему времени в этой области. Вместе с тем эта информация до настоящего времени пока еще носит описательный качественный характер.
3.2. Действие ионизирующих излучений на клетку
Повреждением биологически важных макромолекул далеко не полностью объясняется ионизирующее поражение клетки. Клетка - слаженная динамическая система биологически важных макромолекул, которые скомпонованы в субклеточных образованиях, выполняющих определенные физиологические функции. Поэтому эффект действия источников ионизирующих излучений можно понять, лишь приняв во внимание изменения, происходящие как в самих клеточных органеллах, так и во взаимоотношениях между ними.
Наиболее чувствительными к облучению органеллами клеток организма млекопитающих являются ядро и митохондрии. Повреждения этих структур наступают при малых дозах и проявляются в самые ранние сроки. Так, при облучении митохондрий лимфатиче- ских клеток дозой 0,5 Гр и более процессы окислительного фосфорилирования угнетаются в ближайшие часы облучения. При этом обнаруживаются изменения физико-химических свойств нуклеопротеидных комплексов, в результате чего происходят количественные и качественные изменения ДНК и разобщается процесс синтеза ДНК- РНК-белок. В ядрах радиочувствительных клеток почти тотчас же после облучения угнетаются энергетические процессы, ионы натрия и калия выбрасываются в цитоплазму, нарушается нормальная функция мембран. Одновременно возможны разрывы хромосом, выявляемые в период клеточного деления, хромосомные аберрации и точковые мутации, в результате которых образуются белки, утратившие свою нормальную биологическую активность. Более выраженной радиочувствительностью, чем ядра, обладают митохондрии. Так, зна- чительные изменения в структуре митохондрий лимфатических клеток селезенки обнаруживаются уже через 1 ч после облучения дозой 1 Гр. Эти изменения проявляются набуханием митохондрий, деструкцией крист и просветлением матрикса. В ряде случаев отмечаются повреждения мембраны митохондрий, проявляющиеся прежде всего в резком угнетении процессов окислительного фосфорилирования. В чувствительных к излучению тканях это нарушение обнаруживается уже при дозах фотонного излучения 0,5-1 Гр.
Эффект воздействия ионизирующего излучения на клетку - результат комплексных взаимосвязанных и взаимообусловленных преобразований. По А.М. Кузину, радиационное поражение клетки осуществляется в три этапа.
На первом этапе излучение воздействует на сложные макромолекулярные образования, ионизируя и возбуждая их. При поглощенной дозе фотонного излучения 10 Гр в клетке образуется до 3?106 ионизированных и возбужденных молекул. При этом в ядре должно возникнуть около 9?105 активных центров, в каждой митохондрии - 900 центров, в эндоплазматическом ретикулуме - 4,5?105 и в каждой лизосоме - около 200 активных центров.
На эти процессы прямого воздействия расходуется до 80% поглощенной энергии. Кроме того, от 25 до 50% образовавшихся в результате радиолиза воды радикалов реагируют с макромолекулами клетки.
Поглощенная энергия может мигрировать по макромолекулам, реализуясь в слабых местах. В белках, вероятно, это SН-группы, в
ДНК - хромофорные группы тимина, в липидах - ненасыщенные связи. Указанный этап повреждения может быть назван физической стадией лучевого воздействия на клетку.
Второй этап - химические преобразования, соответствующие процессам взаимодействия радикалов белков, нуклеиновых кислот и липидов с водой, кислородом, радикалами воды и биомолекулами, а также возникновению органических перекисей, вызывающих быстро протекающие реакции окисления, которые приводят к появлению множества измененных молекул. В результате этого начальный эффект многократно усиливается. Радикалы, появляющиеся в слоях упорядоченно расположенных белковых молекул, взаимодействуют с образованием сшивок, в результате чего нарушается структура биологических мембран. Повреждение мембран приводит к высвобождению ряда ферментов. Вследствие повреж- дения лизосомных мембран увеличивается активность ДНКазы, РНКазы, катепсинов, фосфатазы и ряда других ферментов.
Нарушения, наступающие в результате высвобождения ферментов из клеточных органелл и изменения их активности, соответствуют третьему этапу лучевого поражения клетки - биохими- ческому.
Высвободившиеся ферменты путем диффузии достигают любой органеллы клетки и легко проникают в нее благодаря увеличению проницаемости мембран. Под воздействием этих ферментов происходит распад высокомолекулярных компонентов клетки, в том числе нуклеиновых кислот и белков. Было бы неправильным особо выделять какое-то одно биохимическое нарушение, возникающее при этом, так как радиационный эффект отмечается в результате многих самых разнообразных повреждений тонко сбалансированного механизма биохимических реакций. Вместе с тем, рассматривая действие радиации на клетки, можно говорить о ведущих повреждениях, приводящих к нарушению той или иной функции. Так, нарушения процессов окислительного фосфорилирования связаны с повреждением структуры митохондрий. В то же время указанные нарушения могут возникать в результате повреждения лизосом и высвобождения из них гидролитических ферментов. Изменения в клеточном ядре способны приводить к синтезу ферментов с измененной или утраченной активностью и т.д.
Действие ничтожно малых количеств поглощенной энергии оказывается для клетки губительным вследствие физического, химического и биохимического усиления радиационного эффекта, и основную роль в развитии этого эффекта играет повреждение надмолекулярных структур, обладающих высокой радиочувствительностью.
В зависимости от количества этих структур в клетках в определенной степени изменяется и их радиочувствительность. Так, при удвоенном количестве ДНК в клетке при облучении повышается содержание части ДНК в неповрежденном виде. Поэтому диплоидные клетки более устойчивы, чем гаплоидные. Уменьшение числа митохондрий повышает степень поражения каждой из них, в результате чего радиочувствительность возрастает.
Радиочувствительность клеток в значительной мере зависит от скорости протекающих в них обменных процессов. Клетки, для которых характерны интенсивно протекающие биосинтетические процессы, высокий уровень окислительного фосфорилирования и значительная скорость роста, обладают более высокой радиочувствительностью, чем клетки, пребывающие в стационарной фазе.
Наконец, следует подчеркнуть, что конечный эффект облучения является результатом не только первичного повреждения клеток, но и последующих процессов восстановления.
Предполагается, что значительная часть первичных повреждений в клетке возникает в виде так называемых потенциальных повреждений, которые могут реализоваться в случае отсутствия восстановительных процессов.
Реализации этих процессов способствуют процессы биосинтеза белков и нуклеиновых кислот. Пока реализации потенциальных повреждений не произошло, клетка может в них восстановиться. Такое восстановление, как предполагается, связано с ферментативными реакциями и обусловлено энергетическим обменом. Считается, что в основе этого явления лежит деятельность систем, которые в обычных условиях регулируют интенсивность естественного мутационного процесса.
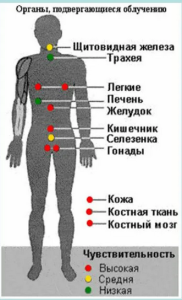
Таковы современные взгляды на механизм развития поражения клетки, возникающего при действии ионизирующих излучений. Если принять в качестве критерия чувствительности к ионизирующему излучению морфологические изменения, то ткани клетки и органы человека по степени снижения чувствительности можно расположить в следующем порядке: гонады и красный костный мозг; толстая кишка, легкие и желудок; мочевой пузырь, молочная железа, печень, пищевод, щитовидная железа; кожа и клетки костных поверхностей; остальные органы и ткани.
Генетическое действие ионизирующих излучений
Мутагенное воздействие ионизирующей радиации впервые установили советские ученые Г.А. Надсон и Г.С. Филатов в 1925 г. в опытах на дрожжах. В 1927 г. это открытие было подтверждено Г. Меллером на классическом генетическом объекте - дрозофиле.
Ионизирующие излучения способны вызывать все виды наследственных перемен или мутаций (мутация - это всякое изменение наследственных структур). К ним относятся геномные мутации (кратные изменения гаплоидного числа хромосом), хромосомные мутации или хромосомные аберрации (структурные и численные изменения хромосом) и точковые или генные мутации (изменения молекулярной структуры генов).
Спектр мутаций, индуцированных ионизирующими излучениями, не отличается от спектра спонтанных мутаций.
Генные мутации. На основании количественного учета генных мутаций была установлена зависимость частоты их возникновения от дозы облучения. Многочисленные опыты с лабораторными животными позволили сделать вывод, что частота летальных мутаций в половых клетках возрастает прямо пропорционально дозе ионизирующего излучения.
Экстраполяция этих данных приводит к выводу о том, что любая сколь угодно малая доза ионизирующего излучения повышает частоту мутаций по сравнению с уровнем спонтанных мутаций.
На ранних этапах оценки эффектов облучения по частоте возникновения мутаций считалось, что фракционирование дозы дает такой же эффект, как и доза однократного облучения.
Исследования последних лет, проведенные с облученными мышами, радикально изменили эту точку зрения. Полученные результаты позволили предположить, что между индукцией первичного повреждения и его конечной реализацией происходит репарация и что удлинение экспозиции или фракционирование дозы менее 8 мГр-мин-1 (до 0,007 мГр-мин-1) при воздействии на сперматогонии мышей вызывает 1/3 мутаций, образующихся при облучении с большей мощностью дозы. Сходным образом фракционирование дозы дает меньше мутаций, чем одномоментное облучение.
Хромосомные мутации. В результате действия ионизирующих излучений на хромосомы возникает большое количество хромосомных перестроек. Различные типы хромосомных перестроек поразному зависят от дозы облучения.
Частота хромосомных перестроек, происходящих в результате одиночного разрыва (например, деления-нехватки), находится в линейной зависимости от дозы. Частота же хромосомных перестроек, возникших в результате двух независимых одновременных разрывов и соответственно основанных на них двуударных перестроек (например, транслокаций), возрастает пропорционально квадрату дозы вследствие того, что вероятность одновременного возникновения двух независимых событий равна произведению вероятностей.
Прямые цитологические исследования - подсчет клеток с нарушенными хромосомами - показали, что возникновение хромосомных аберраций зависит от плотности ионизации. Излучения с меньшей энергией и большей плотностью ионизации более эффективно способствуют хромосомной перестройке. Нейтроны, обладающие, например, энергией 7,5 МэВ, вызывают больше хромосомных перестроек, чем нейтроны с энергией 15 МэВ. В опытах с рентгеновским излучением показано, что его эффективность зависит от длины волны: более эффективно рентгеновское излучение с длиной волны 4,1 А, менее эффективно с длиной волны 0,15 А. Еще менее эффективно излучение. Можно сказать, что корпускулярные излучения - быстрые нейтроны и частицы - вызывают хромосомные перестройки чаще, чем электромагнитные излучения. Эти различия объясняются разницей в плотности ионизации, которую они производят.
Рядом исследователей было показано, что облучение дрозофилы в атмосфере чистого кислорода повышает частоту мутаций, а облучение в атмосфере азота снижает ее.
Бескислородная атмосфера оказывается в некотором смысле защитной при ионизирующем облучении клетки. Повышение концентрации кислорода во время облучения от 0 до 21% линейно увеличивает число хромосомных перестроек; дальнейшее повышение концентрации кислорода оказывается менее эффективным.
Эти явления подтверждают положение о том, что хромосомные перестройки возникают в результате обратимого нарушения в ядре клетки, вызванного облучением.
Во время воздействия ионизирующего излучения на ядро клетки могут возникать истинные и потенциальные разрывы хромосом. Последние, в зависимости от условий, складывающихся в клетке после облучения, могут реализоваться в истинные разрывы или совсем не реализоваться. Количество фиксированных мутаций в клетке определяется двумя факторами: количеством первичных поражений хромосом, возникающих в момент радиационного воздействия, и вероятностью перехода первичного изменения в конечную мутацию.
На основании различных опытов складывается представление, что способность разорванных концов хромосом к соединению в новой комбинации или воссоединению исходной структуры зависит от фазы митотического и мейотического циклов клетки, специфики объекта, характера излучения (величина, мощность дозы, ЛПЭ) и биохимических условий микросреды.
Исходы поражений зародышевых и соматических клеток
Принципиальной разницы в механизме действия источников ионизирующих излучений на соматические и зародышевые клетки нет. Одинаково поражаются и те и другие. Однако исходы поражений разные. Когда повреждаются зародышевые клетки, возникающие мутации (генные и хромосомные) с той или иной скоростью, зависящей от степени доминантности и степени снижения жизнеспособности, элиминируются из популяции. Эта элиминация далеко не всегда бывает быстрой. Многие мутации, в особенности рецессивные, благодаря различным генетическим процессам, таким как, например, дрейф генов или эффект родоначальника, могут заметно размножаться в популяциях. Это может приводить к увеличению числа случаев врожденных уродств, аномалий обмена и т.д.
Мутационные события в соматических клетках могут выражаться в гибели клеток (клеточные летали) или в приобретении клеткой новых наследуемых свойств, выводящих ее из-под контроля организма. Это находит свое выражение в процессах малигнизации.
3.3. Действие ионизирующих излучений на многоклеточный организм
Действие ионизирующих излучений на многоклеточный организм проявляется не только в реакции и последствиях, развивающихся в отдельных клетках и тканях, но и благодаря теснейшим связям и переплетениям их физиологических функций в организме в общих реакциях, присущих организму как единой сложной биологической системе. Как правило, существует определенная
зависимость между степенью, уровнем развития организмов и их чувствительностью к ионизирующей радиации. Так, одноклеточные организмы значительно устойчивее, чем многоклеточные; особо высокой радиочувствительностью обладают млекопитающие. Если, например, в качестве критерия радиочувствительности использовать такой показатель, как гибель 50% взятых в опыт особей на 30-й день наблюдения после общего облучения (ЛД50/30), то он оказывается различным у отдельных классов живых организмов (табл. 2).
Причины различия в чувствительности живых организмов к излучению полностью до сих пор еще не выяснены. Неодинаковую чувствительность холоднокровных и теплокровных организмов пытаются объяснить низкой температурой тела и медленным обменом веществ у холоднокровных; вместе с тем температура тела и обмен веществ у птиц выше, но они и более устойчивы к действию излучения, чем млекопитающие.
Устойчивость к облучению насекомых и ракообразных объясняется присутствием в их организмах повышенных количеств ряда веществ, которые обладают защитным свойством.
Так, у насекомых отмечается высокое содержание каталазы, расщепляющей перекиси. У раков определенным защитным свойством обладают аминокислоты, амины и мелкие полипептиды, участвующие в регуляции осмотического давления (у млекопитающих регуляция осмотического давления осуществляется в первую очередь с помощью ионов Na, К, Mg и др.).
Определенную роль в радиочувствительности играет число хромосомных наборов в клетках организма. Так, диплоидные клетки более устойчивы, чем гаплоидные. Предполагают, что при одной и той же плоидности радиоустойчивость клетки прямо пропорциональна массе ядра, т.е. количеству ДНК.
Чувствительность млекопитающих к ионизирующему излучению зависит от физиологического состояния организма, условий его существования, индивидуальньгх особенностей.
Более чувствительны к облучению новорожденные млекопитающие и старые животные; первые за счет повышенной митотической активности клеток (особенно чувствителен к облучению эмбрион животных и человека), вторые за счет ухудшения способности клеток и тканей организма к восстановлению. Существенно повышает радиочувствительность теплокровных беременность.
Проявления индивидуальной радиочувствительности (явление, которое до сих пор еще не имеет достаточного объяснения) выражается в том, что из многочисленной группы животных одного вида, даже выведенных путем близкородственного скрещивания, часть (хотя и незначительная) может погибнуть от облучения дозой, составляющей менее половины ЛД50/30, а небольшой процент животных переживает облучение дозой, вдвое превышающей ЛД50/30.
3.4. Особенности действия ионизирующих излучений на организм теплокровных животных
Эффект воздействия источников ионизирующих излучений на организм теплокровных животных зависит от ряда причин, главными из которых принято считать уровень поглощенных доз, время облучения и мощность доз, объем облучаемых тканей и органов, вид излучения.
Уровень поглощенных доз - один из главных факторов, определяющих возможность реакции организма на лучевое воздействие.
Так, однократное облучение собаки ?-излучением в дозе 4-5 Гр вызывает у нее острую лучевую болезнь тяжелой степени, однократное же облучение дозой 0,5 Гр приводит лишь к временному снижению числа лимфоцитов и нейтрофилов в крови.
Фактор времени в прогнозе возможных последствий облучения занимает важное место в связи с развивающимися после лучевого повреждения в тканях и органах процессами восстановления. Например, при однократном облучении собаки дозой 7 Гр самый вероятный исход облучения - гибель животного; облучение же дозой 7,2 Гр, но распределенной на год по 0,6 Гр на месяц, гибели животного не вызовет.
По данным большинства радиобиологических исследований, снижение мощности дозы излучения (при одной и той же по- глощенной дозе) уменьшает биологический эффект, причем для каждого из критериев, которые положены в основу оценки этой закономерности (например, эритемная реакция кожи человека, ЛД50/30 животных, нарушения углеводного обмена у крыс и др.), существуют свои строго определенные диапазоны мощности доз, при которых указанная выше закономерность справедлива. Так, усиление действия излучения по такому показателю, как эритемная реакция кожи человека, обнаружено при сравнении мощности доз, равных 0,7 и 3 мГр/с, а при мощности доз 12,5 и 3 мГр/с эффект оказался равнозначным. Некоторые авторы говорят о так называемых оптимальных мощностях дозы. Так, по наблюдениям Г. Лангендорфа, уменьшение количества ретикулоцитов у мышей при облучении их дозой 2 Гр было наибольшим, мощность дозы соответствовала 0,2 мГр/с. При мощности доз 0,1, 1,3, 8,2 мГр/с был отмечен меньший повреждающий эффект.
Различия в биологическом действии ионизирующего излучения при одинаковых поглощенных дозах, но разных мощностях облучения находят свое объяснение в возможности восстановления поврежденного излучением организма. При малой мощности дозы скорость развития повреждений соизмерима со скоростью восстановительных процессов. С увеличением мощности излучения значимость процессов восстановления уменьшается, что, в свою очередь, приводит к возрастанию биологического эффекта. Уменьшение биологического эффекта при больших мощностях дозы объясняется тем, что при кратковременном воздействии ионизирующих излучений в процессе поглощения части дозы используется имеющийся в тканях кислород, а последующее облучение происходит уже в условиях недостатка его.
Степень лучевого поражения, развивающегося после облучения, в значительной мере зависит от того, подвергается ли облучению все тело или только какая-то его часть.
Например, у собаки при облучении ее смертельной дозой достаточно экранировать область живота, чтобы предупредить летальный исход. Другой пример: при терапии злокачественных новообразований у больных в пораженной опухолью ткани создается поглощенная доза, достигающая десятков грей, т.е. доза, во много раз превышающая абсолютно смертельную для человека в случае тотального облучения.
Многочисленными исследованиями было показано, что эффект лучевого воздействия на организм зависит не только от поглощенной дозы и ее фракционирования во времени, но и в значительной степени от пространственного распределения поглощенной энергии, которое характеризуется линейной передачей энергии.
Для сопоставления биологического действия различных видов излучений в радиобиологии было принято понятие относитель- ная биологическая эффективность (ОБЭ). Под ОБЭ излучения понимают его относительную (по сравнению с рентгеновским или ?-излучением) способность при заданной поглощенной дозе вызывать лучевое поражение определенной степени тяжести. ОБЭ рентгеновского и ?-излучений принимают равной 1. Коэффициент ОБЭ (RBETR) определяется как отношение доз данного и стандартного излучений, необходимое для получения одинакового эффекта:
где DTX - доза рентгеновского излучения (200 кэВ), вызывающая какой-то эффект; DTR - поглощенная доза любого вида ионизирующего излучения, вызывающая такой же эффект.
Величина RBETR в определенной степени зависит не только от ЛПЭ, но и от ряда физических и биологических факторов. Так, на величину коэффициентов ОБЭ влияют:
• уровни доз (например, коэффициент ОБЭ для быстрых нейтронов при облучении животных дозами, соответствующими ЛД50/30, составляет 4,5, а при более высоких дозах - 2,9);
• кратность облучения (коэффициент ОБЭ быстрых нейтронов при многократном облучении мышей оказался равным 3,5, а при остром облучении - 3,0);
• распределение дозы во времени и др.
К факторам биологической природы, влияющим на величину коэффициента ОБЭ, относятся:
• вид животного (например, при сравнении смертности мышей и кроликов при облучении рентгеновским излучением с энергией 80 кэВ оказалось, что коэффициент ОБЭ для мышей был равен 0,78, а для кроликов - 0,43);
• критерий, используемый для оценки биологического эффекта, возникающего вслед за облучением (например, коэффициенты ОБЭ по таким критериям, как средняя продолжительность жизни, атрофия яичек, частота «прививок» лейкемии экспериментальным животным и др., неравнозначны) (табл. 3).
В этом случае ОБЭ-взвешенная доза в органе (ADT) предназначена для оценки риска развития детерминированных эффектов излучения с учетом влияния качества излучения и, редко, чувствительности облучаемого органа.
Она равна произведению поглощенной дозы излучения R в органе или ткани T на коэффициент относительной биологической эффективности (RBETR) излучения R для развития определенного детерминированного эффекта в органе T:
Единица измерения ОБЭ-взвешенной дозы - Дж/кг, которая называется грей-эквивалент (Гр-экв).
Для учета качества излучения в условиях хронического облучения людей в малых дозых, когда единственным последствием могут быть сохастические эффекты, МКРЗ рекомендует использовать два показателя качества излучения, значения которых зависят от свойств излучения, но одинаковы для всех стохастических эффектов:
• взвешивающий коэффициент излучения, WR;
• средний коэффициент качества,
Основной областью применения коэффициента качества служит мониторинг полей внешнего излучения, поэтому он определен как функция ЛПЭ:
В табл. 4 представлены установленные МКРЗ значения WR для различных излучений (R).
В табл. 5 приведены сведения о величине и области применения показателей качества излучения.
В случае развития стохастических эффектов относительная биологическая эффективность излучения слабо зависит от свойств облучаемого органа, поэтому вместо RBET R для характеристики этих эффектов применяется соответствующий взвешивающий коэффициент излучения WR.
Произведение поглощенной дозы облучения органа и взвешивающего коэффициента получило название «эквивалентная доза органа или ткани».
Эквивалентная доза предназначена для оценки риска развития стохастических эффектов с учетом влияния качества излучения:
Единица измерения эквивалентной дозы - Дж/кг, которая называется зиверт, Зв [по имени шведского ученого Рольфа Зиверта (1896-1966) - первого председателя МКРЗ].
Основная сфера применения эквивалентной дозы - оценка вероятности развития радиогенных злокачественных новообразований вследствие облучения, хотя в отечественных нормативных актах по охране труда (в отличие, например, от США) отсутствуют требования для определения вероятностной обусловленности профессионального заболевания.
Эффективная доза представляет сумму произведений эквивалентной дозы в органе HT на соответствующий взвешивающий коэффициент для данного органа или ткани:
где HT - эквивалентная доза в ткани T за время ; WT - взвешивающий коэффициент для ткани T - зависит от радиочувствительности органа или ткани.
Единица измерения эффективной дозы - Дж/кг, которая имеет специальное название - зиверт, Зв.
В табл. 6 представлены взвешивающие коэффициенты для определения эффективной дозы.
Для контроля радиационной обстановки по внешнему облучению используется амбиентный эквивалент дозы - H(d). Амбиентная доза - доза в точке, совпадающей с центром шарового фантома Международной комиссии по радиологическим единицам (МКРЕ) - шара диаметром 30 см из тканеэквивалентного материала плотностью 1 г/см3. Результаты контроля используются для расчета дозы внешнего излучения. Единицей амбиентного эквивалента дозы является зиверт, Зв.
При индивидуальном дозиметрическом контроле за значение эффективной дозы внешнего облучения принимают значение опе- рационной величины - индивидуального эквивалента дозы, H (d).
Индивидуальный эквивалент дозы равен эквиваленту дозы в мягких тканях на глубине d, выраженной в миллиметрах, под рассматриваемой точкой на поверхности плоского фантома или на теле взрослого человека. Эквивалент дозы равен поглощенной дозе в точке, умноженной на средний коэффициент качества для излучения, воздействующего на ткань в данной точке:
где -- средний коэффициент качества в рассматриваемой точке; Q(L) - зависимость коэффициента качества излучения от ЛПЭ; D(L) - распределение поглощённой дозы в точке по ЛПЭ; D - величина поглощенной дозы в рассматриваемой точке. Единица эквивалента дозы - Дж/кг, которая называется зиверт, Зв.
Облучение человека может быть представлено любыми дозиметрическими величинами. Вместе с тем МКРЗ рекомендует для объективной оценки аварийного облучения использовать значение ОБЭ-взвешенной дозы облучения органа или ткани, а для оценки доз, например, фотонного излучения менее 0,1 Гр (ожидание стохастических эффектов) - эффективную дозу.
Теги: радиация
234567 Начало активности (дата): 30.03.2023 22:53:00
234567 Кем создан (ID): 989
234567 Ключевые слова: радиация, излучение, клетка, ионизирующие излучения
12354567899
Похожие статьи
Радиационная гигиена. Л. А. Ильин, В. Ф. Кириллов, И. П. Коренков. Глава 1Радиационная гигиена. Л. А. Ильин, В. Ф. Кириллов, И. П. Коренков. Предисловие
Курс медицинской рентгенологии. Специальная рентгенотерапия. Часть 3. Глава 15.2
Рентген на дому 8 495 22 555 6 8
Курс медицинской рентгенологии. Специальная ретгенотерапия. Часть 3. Глава 15



