 04.05.2024
04.05.2024
Клинический случай хордомы крестца и копчика, имеющей массивный внутритазовый компонент (хирургическое лечение с кратким обзором литературы)
Представлен клинический случай радикального хирургического лечения пациента с хордомой S4-5 позвонков и копчика, имеющей массивный внутритазовый компонент
ОБОСНОВАНИЕ
Хордома — это злокачественная нотохордальная опухоль, как правило, возникающая из экстрадурально расположенных рудиментарных остатков нотохорды, впервые описанная Вирховом в 1857 году [1]. Нотохорда представляет собой клеточный тяж или временный осевой скелет зародыша, обеспечивающий развитие невральной трубки, позвоночника и в последующем регрессирующий в первые годы жизни [2]. Вследствие этого опухоль в абсолютном большинстве случаев поражает осевой скелет, сообщения об экстрааксиальных локализациях крайне редки [3].
Хордома — относительно редко встречающаяся опухоль, на её долю приходится от 3 до 4% первичных злокачественных опухолей костей в крупных сериях исследований [4, 5]. По данным базы SEER, охватывающей около трети населения США, заболеваемость составила 0,08 случая на 100 000 человек в год (0,1 случая для мужчин и 0,06 — для женщин).
Соотношение вовлечения основания черепа, подвижной части позвоночника и крестца в целом имело близкие значения, однако основание черепа чаще поражалось у лиц молодого возраста и женщин, крестец — несколько чаще у лиц старших возрастных групп [6, 7]. По сведениям более обширной Национальной базы данных опухолей США NCDB, охватывающей до 70% населения, чаще встречались хордомы основания черепа и крестцово-копчиковой области (38,4 и 37,3%), реже — мобильной части позвоночника (24,4%) [8]. Заболевание редко обнаруживалось у детей и подростков (менее 5%), его распространённость постепенно увеличивалась с возрастом с максимальной выявляемостью 0,3 случая на 100 000 человек для группы лиц 70–79 лет при среднем возрасте 58,5 года [6, 7]. Как правило, опухоль спорадична, однако описаны крайне редкие семейные формы с преимущественным поражением основания черепа, манифестацией в молодом возрасте и иногда множественной локализацией [9].
При крестцово-копчиковой локализации опухоль длительное время развивается бессимптомно, клинические проявления часто бывают стёртыми, что обусловливает запоздалое обращение пациентов к врачу. Иногда первые симптомы обусловлены лишь механическим воздействием опухоли больших размеров на органы малого таза (задержка мочеотделения, запоры). В случае распространения опухоли в позвоночные отверстия и сдавления нервных корешков развиваются болевой синдром, парезы или плегия нижних конечностей, недержание мочи и дисфункция кишечника [1, 10]. Поэтому для врачей первичного звена всегда важно соблюдать онкологическую настороженность.
Радикальное удаление хордомы осложняется трудным доступом к опухоли, частым вовлечением или близостью невральных структур, сосудов и жизненно важных органов, что затрудняет радикальное удаление и объясняет высокий риск рецидивов. По данным ретроспективного анализа 1980–2008 гг., пятилетняя общая выживаемость составила 78%, десятилетняя — 54%, тогда как безрецидивная — 52 и 33% соответственно [11].
Рецидивы значительно сокращали продолжительность жизни больных. После первого рецидива пятилетняя выживаемость уменьшалась до 50%, после второго — до 19%. Несмотря на частоту отдалённых метастазов 14 и 28% в сроки 5 и 10 лет соответственно, смерть пациентов чаще была обусловлена местными осложнениями [11].
Хордомы ввиду их локализации, высокого риска рецидивов и метастазирования требуют мультидисциплинарного подхода в определении объёма и выполнении хирургического вмешательства, комбинированном лечении, купировании осложнений, реабилитации пациентов [1].
Абластичное удаление хордом крестца позволяет существенно уменьшить частоту рецидивов и метастазов, увеличить продолжительность жизни пациентов [12, 13]. Однако хирургическое лечение травматично и часто приводит к развитию послеоперационных осложнений: нарушению функции тазовых органов и репродуктивной функции, чувствительным и двигательным нарушениям нижних конечностей, трофическим и инфекционным осложнениям при заживлении операционной раны. Нередко из-за запущенности заболевания проведение радикального хирургического вмешательства оказывается невозможным. Так, в сообщении P. Ruggieri с соавт. отмечено, что в 46% случаев из-за больших размеров опухоли и высокой коморбидности больным были проведены лишь паллиативные операции [14].
Трудности в лечении хордомы, помимо поздней диагностики и запущенности случаев, анатомической сложности локализации, также связаны с её сравнительно низкой чувствительностью к лучевой и лекарственной терапии [1].
В нашем сообщении представлен опыт хирургического лечения пациента с конвенциональной хордомой крестца, имеющей мягкотканный внутритазовый компонент больших размеров.
ОПИСАНИЕ КЛИНИЧЕСКОГО СЛУЧАЯ
Пациент в возрасте 36 лет обратился в НМИЦ ТО им. Н.Н. Приорова в январе 2023 года с жалобами на дискомфорт в области копчика, нарушение дефекации, проявляющееся либо запорами, либо частыми дефекациями с малым количеством стула без каких-либо примесей, единичным эпизодом острой задержки мочи в декабре 2022 года.
При осмотре пациента отмечаются деформация передней брюшной стенки, симметричное увеличение размера живота; кожные покровы передней брюшной стенки и в области крестца и копчика физиологической окраски, живот равномерно участвует в акте дыхания, при поверхностной пальпации безболезненный, проведение глубокой пальпации значительно затруднено за счёт наличия дополнительного образования таза и брюшной полости, симптомы раздражения брюшины отрицательны. Перианальная область без патологических изменений, при пальцевом исследовании прямой кишки болезненность не определяется; анус тоничен, определяется деформация и смещение прямой кишки каудально за счёт наличия дополнительного образования плотноэластической консистенции. Пальпаторно выявляется наличие плотного болезненного образования в проекции копчика.
По данным магнитно-резонансной томографии (МРТ), имеет место деструкция S4, S5 и копчиковых позвонков с массивным мягкотканным опухолевым компонентом малого таза и брюшной полости размерами 200?110?98 мм, неоднородно гиперинтенсивным в режиме T2 SPAIR (рис. 1) и неоднородно гипоинтенсивным в T1 SPIR (рис. 2); органы таза (прямая и сигмовидная кишка, мочевой пузырь, мочеточники) смещены, деформированы.

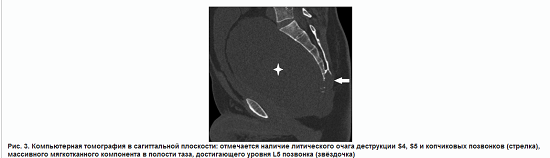
На компьютерной томографии (КТ) таза (рис. 3) определяется очаг литической деструкции S4, S5 и копчиковых позвонков, не имеющий чётких контуров, с разрушением кортикального слоя и выходом в окружающие мягкие ткани, распространением в дистальный отдел крестцового канала до уровня S4 позвонка. По передней поверхности крестца визуализируется массивный мягкотканный компонент опухоли размером по длиннику до 200 мм, достигающий уровня L5 позвонка. Со стороны малого таза и брюшной полости опухоль визуально имеет чёткие контуры, резко сдавливает и оттесняет мочевой пузырь и прямую кишку. По результатам КТ органов грудной клетки, в лёгких очаговых и инфильтративных изменений не выявлено.

Пациенту выполнена трепан-биопсия опухоли под контролем КТ. По результатам гистологического исследования материала сделано следующее заключение: гистологическая картина, с учётом данных цитологии и методов лучевой диагностики, соответствует конвенциональной хордоме крестца с разрушением кортикальной пластинки и инфильтративным ростом в прилежащие мягкие ткани (стадия IIB по Enneking).
Мультидисциплинарной хирургической бригадой проведено хирургическое вмешательство в следующем объёме: удаление опухоли с резекцией крестца на уровне S3 и кокцигэктомией.
Ход операции
В положении пациента на спине под эндотрахеальным наркозом осуществлён передний доступ. Выполнена нижнесрединная лапаротомия. Мобилизованы петли кишечника, опухоль абластично мобилизована от окружающих тканей и передней поверхности проксимального отдела крестца до уровня S3 (рис. 4). Наложены провизорные швы на переднюю брюшную стенку.

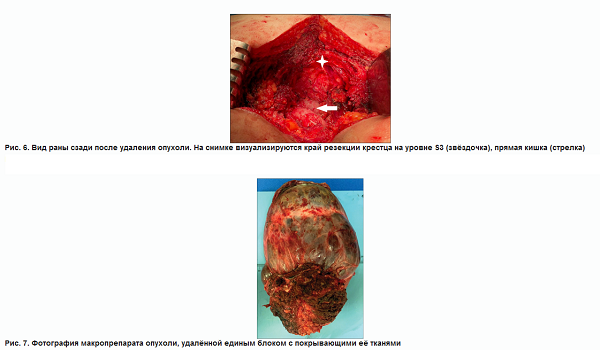
При помощи электролигирующего инструмента пересечены поясничные мышцы, большая и средняя ягодичные мышцы. Произведена ламинэктомия на уровне S3 позвонка, выделен дуральный мешок, ниже отхождения S3 корешков наложены 2 лигатуры, конский хвост перевязан, пересечён между ними. Культя конского хвоста обработана биоклеем для профилактики ликвореи. От копчика абластично отсечены связки и мышцы, осуществлён доступ к малому тазу, тупым и острым путём от опухоли по передней поверхности крестца мобилизована прямая кишка. При помощи высокоскоростного бора произведена резекция задних элементов на уровне S3, долотом выполнена остеотомия его переднего отдела на уровне S3. Препарат удалён единым блоком, отправлен на плановое морфологическое исследование (рис. 6–8)
При ревизии раны произведён дополнительный гемостаз, через контрапертуру установлен силиконовый дренаж. Послойное ушивание раны, швы и скобки на кожу. Далее пациент повёрнут на спину, сняты наложенные ранее на кожу швы, произведена ревизия раны — признаков кровотечения, повреждения органов брюшной полости и таза не выявлено. Рана на передней брюшной стенке послойно ушита с выведением трубчатого дренажа. Оба дренажа оставлены на пассивном дренировании. Продолжительность операции составила 215 минут, кровопотеря — 700 мл, масса удалённой опухоли — 1800 граммов. Осложнений во время операции не отмечено, использовался аппарат Cell Saver.

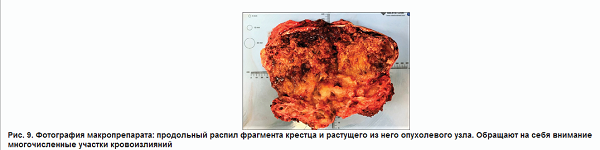
Из операционной в патологоанатомическое отделение материал был доставлен единым блоком в виде опухоли и фрагмента крестца с мягкими тканями размерами 20?11?10 см (рис. 7). Плотноэластичный бугристый узел диаметром около 12,5 см покрыт тонкой полупрозрачной капсулой, через которую просвечивается красно-синюшное содержимое. По краю определяются участки костной плотности с большим количеством красных плотных волокон размером 7,0?9,0 см. На разрезе узла отмечаются множественные разнокалиберные кистозные полости, из которых истекает густая масса дольчато-зернистого вида с желтовато-розовым жидким содержимым (объёмом около 200 мл), и мягкотканные разнокалиберные шероховатые с блестящими участками красно-серого и желтовато-бурого цвета, местами с фокусами грязно-жёлтого цвета и кровоизлияниями, инъецированными сосудами. Прилежащий фокус кости пилится легко, на распиле в его толще отмечаются участки сероватой блестящей дольчатой мягкой ткани, подобные также имеются за пределами кости (рис. 9).
Обращают на себя внимание многочисленные участки кровоизлияний При гистологическом исследовании операционного материала определяется новообразование солидного строения, представленное тяжами или гнёздами клеток эпителиоидного типа, расположенными в мукоидном межклеточном матриксе. Прослойки соединительной ткани разделяют патологическую ткань на дольки различной конфигурации и размера. Клетки опухоли имеют преимущественно крупные округлые ядра c умеренно выраженной атипией и заметными ядрышками, обильную бледную цитоплазму с многочисленными цитоплазматическими вакуолями (так называемые физалиформные клетки) (рис. 10).
Также определяются эпителиоподобные клетки с плотной эозинофильной цитоплазмой и слабо выраженной вакуолизацией (рис. 11). Преобладают мононуклеарные клетки, но также встречаются двуядерные и многоядерные, клетки с вакуолизированной цитоплазмой перстнеобразного вида со смещённым к клеточной мембране ядром.
Митотическая активность низкая, выявляются единичные атипичные митозы. В различных участках опухоли видны как плотно расположенные, образующие синцитий клетки со слабо выраженным межклеточным мукоидным матриксом, так и участки с преобладанием последнего с малочисленными островками опухолевых клеток. В различных участках опухоли обнаруживаются многочисленные некрозы и кровоизлияния.
На основании проведённого исследования операционного материала было сделано заключение, что гистологическая картина соответствует конвенциональной хордоме.
По заключению патоморфолога, край резекции свободен от опухоли (R0), что подтверждает радикальность проведённой операции.
Ранний послеоперационный период
Пациенту проводились антибиотикопрофилактика и пролонгированная антибиотикотерапия, профилактика тромбоэмболических осложнений, обезболивание, противовоспалительная, гастропротективная терапия, терапия энтеросорбентами, стимуляция перистальтики кишечника, инфузионная терапия, выполнение перевязок.
Больной получал инфузию заготовленных на амбулаторном этапе аутокомпонентов крови. На передней брюшной стенке рана зажила первичным натяжением на 12-е сутки после операции, в области крестца рана зажила с участком краевого некроза, швы сняты на 20-е сутки.
Несмотря на выделение и сохранение S3 корешков с обеих сторон, отмечено развитие неврологического осложнения — нарушения функции тазовых органов в виде недержания кала и мочи. Неврологических расстройств нижних конечностей не отмечалось, трофических расстройств в области нижних конечностей и таза не выявлено.
К моменту выписки имел место регресс неврологического расстройства — пациент начал частично удерживать мочу и кал, появилось ощущение наполнения мочевого пузыря.
Пациент активизирован, вертикализирован и начал ходить с дополнительной опорой на костыли в противогрыжевом бандаже на 5-е сутки после операции. На 6-е сутки после операции удалены дренажи из области хирургического вмешательства. На 10-е сутки после операции удалён уретральный катетер, по данным ультразвукового исследования признаков остаточной мочи в мочевом пузыре после его опорожнения не выявлено.
Пациент выписан для продолжения реабилитационно-восстановительного лечения по месту жительства. В дальнейшем планируется постоянное динамическое наблюдение с проведением контрольных обследований согласно онкологическому протоколу по месту жительства и в нашем институте.
ОБСУЖДЕНИЕ
Хордома — наиболее часто встречающаяся первичная опухоль крестца, составляющая около четверти всех поражений и около половины — злокачественных [15], при этом она является четвёртой по частоте первичной злокачественной опухолью кости после остеосаркомы, хондросаркомы и саркомы Юинга [5]. Медленный бессимптомный рост, отсутствие ранней клинической симптоматики затрудняют своевременную диагностику, а запоздалое выявление крупной опухоли может препятствовать оказанию необходимой медицинской помощи в региональных медицинских учреждениях [16, 17].
Так, в нашем наблюдении опухоль развивалась бессимптомно, и лишь после достижения ею значительных размеров появились выраженные жалобы, вынудившие пациента обратиться к врачу.
Лучевая диагностика при подозрении на наличие опухоли в крестцово-копчиковой области требует, помимо рентгенографии, обязательного применения КТ и МРТ.
В нашем случае использование КТ и МРТ позволило чётко установить границы опухоли и соотношение с окружающими анатомическими структурами, определив планируемый ход радикального оперативного вмешательства и обусловив необходимость в мультидисциплинарной бригаде хирургов.
При хордоме на КТ выявляется очаг литической деструкции крестцовых и копчиковых позвонков, распространяющийся в мягкие ткани; в структуре по краям опухоли могут отмечаться мелкие, частично резорбированные костные фрагменты или, чаще в хондроидном варианте, кальцинаты, при миксоматозных изменениях — участки сниженной плотности. На МР-томограммах в Т1-взвешенном изображении опухоль имеет гипоинтенсивный сигнал, иногда с гиперинтенсивными участками. В режимах жироподавления область гиперинтенсивного сигнала имеет гипоинтенсивные перегородки и включения, связанные с геморрагиями, некрозами, костными, частично лизированными, фрагментами и кальцинатами. Как при КТ, так и при МРТ опухоль неоднородно контрастируется [1].
Показано, что более интенсивно контрастируемые хордомы активнее экспрессируют гены, ответственные за рост опухоли, морфологически имеют более богатую строму, а клинически — тенденцию к более раннему рецидивированию [18]. В связи с этим томографическое исследование с контрастированием имеет дополнительную прогностическую ценность и влияние на оценку объёма предстоящего хирургического вмешательства.
Дооперационная морфологическая диагностика выполняется на основании тонкоигольной или трепан-биопсии. Проведение открытой биопсии значительно повышает риск рецидивов [13]. В связи с этим в нашем наблюдении предоперационное обследование включало трепан-биопсию под КТ-навигацией.
Выделяют три морфологических типа хордомы: конвенциональную (наиболее распространённая, с подтипом «хондроидная хордома»), а также дедифференцированную и низкодифференцированную [19].
Конвенциональная хордома диагностируется у больных различного возраста, но чаще встречается на 4–7- м десятилетиях жизни, с превалированием у мужчин. Морфологически конвенциональная хордома имеет лобулярное строение с разделением на дольки соединительнотканными перегородками. Клетки эпителиоидные, округлые, с эозинофильной цитоплазмой, образуют гнёзда, пласты или цепочки. Наряду с ними, как и в рассматриваемом нами случае, определяются характерные для хордомы физалиформные клетки с пузырчатой цитоплазмой [4, 20]. Однако в ряде случаев классические физалиформные клетки относительно редки или могут вообще не присутствовать в конвенциональной хордоме [5]. Матрикс миксоидный, иногда преобладающий над клеточным компонентом. Ядерный атипизм умеренный, митозы единичные. При хондроидной хордоме, чаще локализующейся в основании черепа, в составе опухоли отмечаются участки, имеющие сходство с межклеточным матриксом хрящевой опухоли. Остальные типы хордом встречаются намного реже.
Низкодифференцированная хордома — редкий тип хордомы, чаще встречающийся в детском и молодом возрасте, с преимущественной локализацией в основании черепа, реже — в шейном отделе позвоночника и редко — в крестцово-копчиковой области. Гистологическая картина характеризуется преобладанием эпителиоидных клеток с очагами рабдоидной морфологии, при этом физалиформные клетки, характерные для конвенциональной хордомы, отсутствуют, миксоидная строма, если она и присутствует, обычно не более чем очаговая [21].
Дедифференцированная хордома — самый редкий тип хордомы, чаще локализующийся, как и конвенциональный тип, в крестцово-копчиковой области. Морфологически представляет собой двухфазную хордому, характеризующуюся наличием конвенциональной хордомы и высокозлокачественной веретеновидной и/или плеоморфной саркомы [19, 22].
Дифференциальный диагноз чаще всего проводится с хондросаркомой, метастазом рака, хордоидной менингиомой, миоэпителиальной опухолью кости. Высокозлокачественные варианты опухоли чаще требуют дифференциального диагноза с дедифференцированной хондросаркомой, злокачественной рабдоидной опухолью, рабдоидной менингиомой, эпителиоидной саркомой. Уточнению диагноза может помочь иммуногистохимическое исследование. В частности, в последнее время в обиход вошёл маркер брахиури, характерный для любых нотохордальных образований. Тем не менее следует помнить, что участки дедифференцировки хордомы теряют не только характерную для этой опухоли морфологическую картину, но и положительную реакцию на цитокератины, протеин S-100 и брахиури, что может служить причиной диагностических ошибок по результатам тонкоигольчатой или трепан-биопсии [19, 22].
Морфологические, иммуногистохимические и генетические особенности опухоли могут обладать определённым прогностическим значением. Так, было показано, что наличие в хордоме некротических участков, более высокие показатели митотической активности, Ki-67 и P53, сочетание делеции 22-й хромосомы с альтерациями гена PBRM1 снижают безрецидивную и общую выживаемость [23, 24].
Дедифференцированные хордомы, в отличие от конвенциональных, склонны быстро расти и достигать больших размеров, результаты их лечения хуже, а сроки выживаемости намного ниже, высока частота метастазирования [22, 25]. Низкодифференцированная хордома, обладающая высоким злокачественным потенциалом, также характеризуется худшими клиническими результатами [21, 26].
Хирургическое лечение пациентов с хордомами крестца является основным методом. Выделяют высокие, средние и низкие резекции крестца, определяемые уровнями до S2 позвонка (либо корешков), до S3 и ниже (соответственно, тотальную, латеральные). Ход хирургических вмешательств зависит как от объёма, так и от локализации опухоли [27, 28]. Показано, что распространение мягкотканного компонента опухоли в полость таза сопровождается отдавливанием и подпаиванием органов малого таза, однако прорастания их не происходит. В связи с этим во многих случаях возможно абластичное выделение опухоли в объёме краевого иссечения без вскрытия капсулы. Наоборот, распространение хордомы кзади требует широкого иссечения для достижения радикальности из-за инфильтративного роста в мышечную ткань [27]. При распространении опухоли выше уровня S3 позвонка и наличии опухолевого компонента спереди выполнение операции только из заднего доступа не представляется технически возможным, и для выделения её передней поверхности также применяется лапаротомия [27].
В нашем случае, несмотря на то, что опухоль разрушала крестец ниже уровня S3, большой внутритазовый компонент, распространяющийся проксимально и тесно контактирующий с органами таза, потребовал для выделения и абластичного удаления двух доступов, а также работы мультидисциплинарной хирургической бригады.
Радикальное удаление опухоли является главным фактором снижения риска рецидивов заболевания [14, 29]. Более того, эффективность лечения рецидивных хордом существенно ниже, чем первичных [30].
Дополнительными к нерадикальному вмешательству факторами повышенного риска рецидива являются особенности морфологического строения опухоли (повышенное число митозов, зон некроза, участки дедифференцировки, контрастирования и др.) и её большой размер [11, 13, 18, 22]. Несмотря на медленное развитие хордомы, повторный рост является главной причиной ограничения продолжительности жизни пациентов [11]. Нацеленность на достижение лучших онкологических результатов при этом неизбежно сопряжена с травматичностью, приводящей к возможности послеоперационных осложнений и неврологическим расстройствам.
Тяжесть неврологических расстройств зависит от уровня резекции крестца. Так, показано, что сохранение в ходе операции S3 корешков, в отличие от их двусторонней резекции, позволяет избежать у большинства пациентов резкого нарушения функции тазовых органов после операции [25, 31, 32]. Сохранение S1 корешков при высоком расположении опухоли даёт возможность избежать значительных расстройств ходьбы, улучшая качество жизни больного [31]. В нашем примере в ходе операции удалось сохранить оба S3 корешка, что позволило избежать стойких тяжёлых неврологических расстройств и создать более благоприятные условия для реабилитации больного в послеоперационном периоде.
Обширные резекции, связанные с перевязкой внутритазовых сосудов, иссечением мышц, близость ануса в области заднего доступа создают риски некрозов и нагноений в послеоперационном периоде. У части пациентов отмечается развитие ликвореи. До четверти всех операций, по данным литературы, требует повторных вмешательств, связанных с местными осложнениями, что существенно увеличивает стоимость лечения и время пребывания в стационаре [1].
Проведённые в последние годы работы свидетельствуют о положительном эффекте высокодозной лучевой терапии, позволяющей снизить риск рецидива после нерадикально проведённого хирургического вмешательства.
Ретроспективный анализ лечения 1478 пациентов с хордомами показал, что адъювантная лучевая терапия в суммарной очаговой дозе более 65 Гр снижала повторный рост опухоли и значимо повышала пятилетнюю общую выживаемость в случае неабластичного удаления — с 70,6 до 82,3%. Лучший результат достигался при использовании протонной терапии и стереотаксической радиотерапии. В то же время при радикально выполненной операции авторами не было отмечено дополнительного эффекта от лучевой терапии, и её проведение в таких случаях не рекомендуется [8].
На основании этого опыта в нашем случае в связи с радикальностью проведённого хирургического вмешательства выполнения лучевой терапии в послеоперационном периоде не предполагалось, несмотря на большие размеры опухоли и неблагоприятные морфологические особенности (наличие многочисленных некротических фокусов).
Лучевая терапия как в до-, так и в послеоперационном периоде, а также самостоятельно применяется при паллиативном лечении пациентов с запущенными опухолями или высокой коморбидностью, препятствующей радикальному хирургическому лечению [33, 34].
Изучение этиопатогенеза опухолей, включая хордомы, позволяет выявить потенциальные мишени для фармакологического воздействия на них. Так, таргетная терапия низкомолекулярными ингибиторами тирозиновых киназ в последние годы проходит клинические испытания и в будущем может стать эффективным компонентом комбинированного лечения либо вариантом паллиативной терапии пациентов с хордомами. Перспективными также выглядят исследования, касающиеся иммунотерапии, а единичные сообщения о её клиническом применении обнадёживают [35–37]. Возможность воздействия на различные метаболические пути опухолевых клеток позволяет надеяться на реализацию в недалёком будущем как персонализированного подхода к лекарственной терапии больных с хордомой, так и обоснования комбинированного применения нескольких препаратов с целью достижения синергетического эффекта [37].
ЗАКЛЮЧЕНИЕ
Диагностика и лечение хордом крестца являются одной из самых сложных проблем современной онкоортопедии. Золотым стандартом лечения этой группы больных является радикальное удаление опухоли, однако операции могут сопровождаться высокой интра-операционной кровопотерей, нередки тяжёлые неврологические осложнения в послеоперационном периоде. В значительном числе случаев выполнить радикальное вмешательство затруднительно или даже невозможно из-за сложной локализации и запоздалого выявления, связанного с особенностями клинического течения. Тщательное полноценное обследование, мультидисциплинарный подход, предоперационное планирование позволяют снизить риски осложнений интра- и послеоперационного периода, максимально сохранить качество жизни данной категории пациентов.
Развитие современных технологий в лучевой терапии, разработка новых методов таргетной и иммунной терапии создают благоприятные перспективы для проведения комплексного лечения коморбидных больных, а также в случаях поздней диагностики заболевания.
Описанное нами клиническое наблюдение подтверждает сложность раннего выявления хордомы крестцово-копчиковой локализации и необходимость онкологической настороженности врачей первичной практики.
Комплексная диагностика, включающая КТ, МРТ, проведение трепанационной биопсии и морфологическую верификацию опытным патологоанатомом, позволила разработать и осуществить план радикального хирургического вмешательства усилиями мультидисциплинарной бригады. Удаление опухоли, несмотря на большие размеры, единым блоком сделало благоприятным прогноз для жизни пациента, а максимально возможное сохранение невральных структур минимизировало функциональные нарушения.
Список литературы
1. Barber S.M., Sadrameli S.S., Lee J.J., Fridley J.S., Teh B.S., Oyelese A.A., Telfeian A.E., Gokaslan Z.L. Chordoma — Current Understanding and Modern Treatment Paradigms // J Clin Med. 2021. Vol. 10, № 5. Р. 1054.
3. Evans S., Khan Z., Jeys L., Grimer R. Extra-axial chordomas // Ann R Coll Surg Engl. 2016. Vol. 98, № 5. Р. 324–8. doi: 10.1308/rcsann.2016.0138
4. Dahlin D.C., Unni K.K. Bone Tumors. General aspects and Data on 8,542 Cases. 4th ed. Springfield, Illinois, 1986. P. 379–390.
5. Czerniak B. Dorfman and Czerniak’s Bone Tumors. 2nd ed. Elsevier, 2015. P. 1179–1216.
6. McMaster M.L., Goldstein A.M., Bromley C.M., Ishibe N., Parry D.M. Chordoma: incidence and survival patterns in the United States, 1973–1995 // Cancer Causes Control. 2001. Vol. 12, № 1. Р. 1–11. doi: 10.1023/a:1008947301735
7. Pan Y., Lu L., Chen J., Zhong Y., Dai Z. Analysis of prognostic factors for survival in patients with primary spinal chordoma using the SEER Registry from 1973 to 2014 // J Orthop Surg Res. 2018. Vol. 13, № 1. Р. 76
8. Dial B.L., Kerr D.L., Lazarides A.L., Catanzano A.A., Green C.L., Risoli T. Jr, Blazer D.G., Goodwin R.C., Brigman B.E., Eward W.C., Larrier N.A., Kirsch D.G., Mendoza-Lattes S.A. The Role of Radiotherapy for Chordoma Patients Managed With Surgery: Analysis of the National Cancer Database // Spine (Phila Pa 1976). 2020. Vol. 45, № 12. Р. E742–E751. doi: 10.1097/BRS.0000000000003406
9. Parry D.M., McMaster M.L., Liebsch N.J., Patronas N.J., Quezado M.M., Zametkin D., Yang X.R., Goldstein A.M. Clinical findings in families with chordoma with and without T gene duplications and in patients with sporadic chordoma reported to the Surveillance, Epidemiology, and End Results program // J Neurosurg. 2020. Vol. 134, № 5. Р. 1399–1408. doi: 10.3171/2020.4.JNS193505
10. Бурдыгин В.Н., Морозов А.К., Беляева А.А. Первичные опухоли крестца у взрослых: проблемы диагностики // Вестник травматологии и ортопедии им. Н.Н. Приорова. 1998. Т. 5, № 1. С. 3–12. doi: 10.17816/vto104020
11. Stacchiotti S., Casali P.G., Lo Vullo S., Mariani L., Palassini E., Mercuri M., Alberghini M., Pilotti S., Zanella L., Gronchi A., Picci P. Chordoma of the mobile spine and sacrum: a retrospective analysis of a series of patients surgically treated at two referral centers // Ann Surg Oncol. 2010. Vol. 17, № 1. Р. 211–9. doi: 10.1245/s10434-009-0740-x
12. Varga P.P., Sz?v?rfi Z., Fisher C.G., Boriani S., Gokaslan Z.L., Dekutoski M.B., Chou D., Quraishi N.A., Reynolds J.J., Luzzati A., Williams R., Fehlings M.G., Germscheid N.M., Lazary A., Rhines L.D. Surgical treatment of sacral chordoma: prognostic variables for local recurrence and overall survival // Eur Spine J. 2015. Vol. 24. № 5. Р. 1092–101. doi: 10.1007/s00586-014-3728-6
13. Bergh P., Kindblom L.G., Gunterberg B., Remotti F., Ryd W., Meis-Kindblom J.M. Prognostic factors in chordoma of the sacrum and mobile spine: a study of 39 patients // Cancer. 2000. Vol. 88, № 9. Р. 2122–34.
14. Ruggieri P., Angelini A., Ussia G., Montalti M., Mercuri M. Surgical margins and local control in resection of sacral chordomas // Clin Orthop Relat Res. 2010. Vol. 468, № 11. Р. 2939–47
15. Wang J., Li D., Yang R., Tang X., Yan T., Guo W. Epidemiological characteristics of 1385 primary sacral tumors in one institution in China // World J Surg Oncol. 2020. Vol. 18, № 1. Р. 297. doi: 10.1186/s12957-020-02045-w
16. Keykhosravi E., Rezaee H., Tavallaii A., Tavassoli A., Maftouh M., Aminzadeh B. A Giant Sacrococcygeal Chordoma: A Case Report // Brain Tumor Res Treat. 2022. Vol. 10, № 1. Р. 29–33. doi: 10.14791/btrt.2022.10.e12
17. Phang Z.H., Saw X.Y., Nor N.F.B.M., Ahmad Z.B., Ibrahim S.B. Rare case of neglected large sacral Chordoma in a young female treated by wide En bloc resection and Sacrectomy // BMC Cancer. 2018. Vol. 18, № 1. Р. 1112.
18. Park M., Park I., Hong C.K., Kim S.H., Cha Y.J. Differences in stromal component of chordoma are associated with contrast enhancement in MRI and differential gene expression in RNA sequencing // Sci Rep. 2022. Vol. 12, № 1. Р. 16504. doi: 10.1038/s41598-022-20787-3
19. Soft Tissue and Bone Tumours. WHO Classification of Tumours. 5th ed. Vol. 3. WHO Classification of Tumours Editorial Board. 2020. P. 451–457.
21. Shih A.R., Cote G.M., Chebib I., Choy E., DeLaney T., Deshpande V., Hornicek F.J., Miao R., Schwab J.H., Nielsen G.P., Chen Y.L. Clinicopathologic characteristics of poorly differentiated chordoma // Mod Pathol. 2018. Vol. 31, № 8. Р. 1237–1245. doi: 10.1038/s41379-018-0002-1
22. Hung Y.P., Diaz-Perez J.A., Cote G.M., Wejde J., Schwab J.H., Nardi V., Chebib I.A., Deshpande V., Selig M.K., Bredella M.A., Rosenberg A.E., Nielsen G.P. Dedifferentiated Chordoma: Clinicopathologic and Molecular Characteristics With Integrative Analysis // Am J Surg Pathol. 2020. Vol. 44, № 9. Р. 1213–1223. doi: 10.1097/PAS.0000000000001501
23. Tauzi?de-Espariat A., Bresson D., Polivka M., Bouazza S., Labrousse F., Aronica E., Pretet J.L., Projetti F., Herman P., Salle H., Monnien F., Valmary-Degano S., Laquerri?re A., Pocard M., Chaigneau L., Isambert N., Aubriot-Lorton M.H., Feuvret L., George B., Froelich S., Adle-Biassette H. Prognostic and Therapeutic Markers in Chordomas: A Study of 287 Tumors // J Neuropathol Exp Neurol. 2016. Vol. 75, № 2. Р. 111–20. doi: 10.1093/jnen/nlv010
24. Bai J., Shi J., Li C., Wang S., Zhang T., Hua X., Zhu B., Koka H., Wu H.H., Song L., Wang D., Wang M., Zhou W., Ballew B.J., Zhu B., Hicks B., Mirabello L., Parry D.M., Zhai Y., Li M., Du J., Wang J., Zhang S., Liu Q., Zhao P., Gui S., Goldstein A.M., Zhang Y., Yang X.R. Whole genome sequencing of skull-base chordoma reveals genomic alterations associated with recurrence and chordoma-specific survival // Nat Commun. 2021. Vol. 12, № 1. Р. 757
25. Nachwalter R.N., Rothrock R.J., Katsoulakis E., Gounder M.M., Boland P.J., Bilsky M.H., Laufer I., Schmitt A.M., Yamada Y., Higginson D.S. Treatment of dedifferentiated chordoma: a retrospective study from a large volume cancer center // J Neurooncol. 2019. Vol. 144, № 2. Р. 369–376. doi: 10.1007/s11060-019-03239-3
26. Yeter H.G., Kosemehmetoglu K., Soylemezoglu F. Poorly differentiated chordoma: review of 53 cases // APMIS. 2019. Vol. 127, № 9. Р. 607–615. doi: 10.1111/apm.12978
27. Varga P.P., Sz?v?rfi Z., Lazary A. Surgical treatment of primary malignant tumors of the sacrum // Neurol Res. 2014. Vol. 36, № 6. Р. 577–87. doi: 10.1179/1743132814Y.0000000366
28. Fourney D.R., Rhines L.D., Hentschel S.J., Skibber J.M., Wolinsky J.P., Weber K.L., Suki D., Gallia G.L., Garonzik I., Gokaslan Z.L. En bloc resection of primary sacral tumors: classification of surgical approaches and outcome // J Neurosurg Spine. 2005. Vol. 3, № 2. Р. 111–22. doi: 10.3171/spi.2005.3.2.0111
29. Мусаев Э.Р.о. Современные подходы к хирургическому лечению больных с опухолями костей таза: автореферат дис. … доктора медицинских наук: 14.00.14. Москва, 2008. 46 с.
30. Ailon T., Torabi R., Fisher C.G., Rhines L.D., Clarke M.J., Bettegowda C., Boriani S., Yamada Y.J., Kawahara N., Varga P.P., Shin J.H., Saghal A., Gokaslan Z.L. Management of Locally Recurrent Chordoma of the Mobile Spine and Sacrum: A Systematic Review // Spine (Phila Pa 1976). 2016. Vol. 41 (Suppl 20). Р. S193–S198.
31. Zoccali C., Skoch J., Patel A.S., Walter C.M., Maykowski P., Baaj A.A. Residual neurological function after sacral root resection during en-bloc sacrectomy: a systematic review // Eur Spine J. 2016. Vol. 25, № 12. Р. 3925–3931.
33. Demizu Y., Jin D., Sulaiman N.S., Nagano F., Terashima K., Tokumaru S., Akagi T., Fujii O., Daimon T., Sasaki R., Fuwa N., Okimoto T. Particle Therapy Using Protons or Carbon Ions for Unresectable or Incompletely Resected Bone and Soft Tissue Sarcomas of the Pelvis // Int J Radiat Oncol Biol Phys. 2017. Vol. 98, № 2. Р. 367–374. doi: 10.1016/j.ijrobp.2017.02.030
34. Jin C.J., Berry-Candelario J., Reiner A.S., Laufer I., Higginson D.S., Schmitt A.M., Lis E., Barzilai O., Boland P., Yamada Y., Bilsky M.H. Long-term outcomes of high-dose single-fraction radiosurgery for chordomas of the spine and sacrum // J Neurosurg Spine. 2019. Р. 1–10
35. Ozair M.Z., Shah P.P., Mathios D., Lim M., Moss N.S. New Prospects for Molecular Targets for Chordomas // Neurosurg Clin N Am. 2020. Vol. 31, № 2. Р. 289–300. doi: 10.1016/j.nec.2019.11.004
36. Akinduro O.O., Suarez-Meade P., Garcia D., Brown D.A., Sarabia-Estrada R., Attia S., Gokaslan Z.L., Qui?ones-Hinojosa A. Targeted Therapy for Chordoma: Key Molecular Signaling Pathways and the Role of Multimodal Therapy // Target Oncol. 2021. Vol. 16, № 3. Р. 325–337. doi: 10.1007/s11523-021-00814-5
37. Yang X., Li P., Kang Zh., Li W. Targeted therapy, immunotherapy, and chemotherapy for chordoma // Curr Med. 2023. Vol. 2, №
Об авторах
Антон Герасимович Назаренко - д-р мед. наук, профессор РАН, Национальный медицинский исследовательский центр травматологии и ортопедии им. Н.Н. Приорова Россия, МоскваВадим Юрьевич Карпенко - д-р мед. наук, Национальный медицинский исследовательский центр травматологии и ортопедии им. Н.Н. Приорова Россия, Москва
Александр Федорович Колондаев - канд. мед. наук, Национальный научно-исследовательский институт травматологии и ортопедии им. Н.Н. Приорова Россия, Москва
Никита Анатольевич Любезнов - Национальный медицинский исследовательский центр травматологии и ортопедии им. Н.Н. Приорова Россия, Москва
Геннадий Николаевич Берченко - д-р мед. наук, профессор, Национальный медицинский исследовательский центр травматологии и ортопедии им. Н.Н. Приорова Россия, Москва
Игорь Николаевич Карпов д-р мед. наук, профессор, Национальный медицинский исследовательский центр травматологии и ортопедии им. Н.Н. Приорова Россия, Москва
Михаил Владимирович Алексеев - д-р мед. наук , Национальный медицинский исследовательский центр колопроктологии им. А.Н. Рыжих Россия, Москва
Александр Михайлович Кузьминов - д-р мед. наук, профессор, Национальный медицинский исследовательский центр колопроктологии им. А.Н. Рыжих Россия, Москва
Юлия Васильевна Алимова - Национальный медицинский исследовательский центр колопроктологии им. А.Н. Рыжих Россия, Москва
Анатолий Леонидович Карасев - Национальный медицинский исследовательский центр травматологии и ортопедии им. Н.Н. Приорова Россия, Москва
Кирилл Анатольевич Антонов - Национальный медицинский исследовательский центр травматологии и ортопедии им. Н.Н. Приорова Россия, Москва
Теги: опухоли костей
234567 Начало активности (дата): 04.05.2024 16:00:00
234567 Кем создан (ID): 989
234567 Ключевые слова: хордома, опухоли костей, опухоли крестца, хирургическое лечение
12354567899
Похожие статьи
Новый способ определения диагностических параметров суставного хряща : от теории к практике(клинический пример)В Ломоносовской больнице запущен новый рентгеновский аппарат
Эффективность оперативного лечения псевдоартрозов наружного мыщелка плечевой кости у детей комбинированными методиками костнопластических операций с применением аппарата Илизарова
Профилактика, диагностика и лечение тромбоэмболических осложнений в травматологии и ортопедии: методические рекомендации
Замещение пострезекционных дефектов костей углеродными наноструктурными имплантатами (УНИ) при опухолевых и опухолеподобных заболеваниях скелета



